ОБЛАСТЬ ТЕХНИКИ
Настоящая заявка относится к области генетики, генной терапии и молекулярной биологии. Более конкретно, настоящее изобретение относится к выделенной кодон-оптимизированной нуклеиновой кислоте, которая кодирует белок FIX (фактор свертывания крови IX), экспрессионной кассете и вектору на ее основе, а также к рекомбинантному вирусу на основе AAV5 (аденоассоциированный вирус 5 серотипа) для увеличения экспрессии гена FIX в целевых клетках, и их применению.
УРОВЕНЬ ТЕХНИКИ
Генная терапия является одной из перспективных отраслей современной медицины. Ее основное направление - разработка эффективных решений для лечения наследственных заболеваний, поскольку только генотерапевтические методы позволяют воздействовать собственно на причину этих заболеваний. Из большого количества наследственных заболеваний одной из наиболее распространенных является группа патологий, связанных с нарушением гемостаза.
Гемофилия - это сцепленное с Х-хромосомой заболевание, связанное с отсутствием или выраженным дефицитом плазменных факторов свертывания, характеризующееся нарушением свертывания крови, клинически проявляющимся в виде спонтанных или спровоцированных, часто неконтролируемых, кровотечений в суставы, мышцы и внутренние органы и т.д.
Гемофилия В вызвана отсутствием или дефицитом плазменного фактора свертывания IX. В большинстве случаев заболевание имеет семейный анамнез, но в ряде случаев выявляются спорадические мутации. Подавляющее большинство больных гемофилией лица мужского пола, случаи гемофилии у женщин установлены, но крайне редки. Фактор IX свертывания крови (FIX, фактор Кристмаса) является проферментом сериновой протеазы, которая в присутствии Са2+ и мембранных фосфолипидов гидролизует связь аргинин-изолейцин в молекуле фактора X с образованием активированного фактора X (FXa). Каталитическая эффективность фактора 1Ха возрастает при связывании кофактора - активированного фактора свертывания крови VIII (FVIIIa).
Фактор IX синтезируется в печени в виде неактивного белка-предшественника, который процессируется в эндоплазматическом ретикулуме и аппарате Гольджи, где подвергается множественным посттрансляционным модификациям различных типов и секретируется в кровоток после протеолитического отщепления пропептида. В каскаде свертывания крови фактор IX активируется после протеолитического расщепления активированным фактором XI (внутренний путь) или активированным фактором VII (внешний путь) с образованием двух полипептидных цепей, связанных дисульфидной связью. Активированный фактор IX постепенно инактивируется, в основном путем медленного связывания с антитромбином III, нексином-2, белок Z зависимым ингибитором протеаз и рецепторами эндоцитоза гепатоцитов, а также подвергается расщеплению эластазой нейтрофилов.
На данный момент используется заместительная терапия. После разработки метода криопреципитации в 1966 г. был зарегистрирован первый препарат фактора свертывания, который получали из плазмы крови доноров. В 1980-х годах было установлено, что препараты факторов свертывания крови, получаемые из плазмы, могут быть инфицированы вирусами (ВИЧ, гепатит С), что привело к заражению около 20000 больных. Данное обстоятельство послужило импульсом для разработки методов элиминации и инактивации вирусов при производстве плазменных препаратов и создания новых препаратов, получаемых без использования плазмы. В производственный процесс получения препаратов из плазмы (plasma derived - pdFIX) был включен этап термической обработки, который позволил устранить инфицирование препаратов. Параллельно совершенствованию технологического процесса получения препаратов из плазмы проводили исследования по разработке факторов свертывания с использованием технологии рекомбинантных ДНК. На основе данной технологии получены и зарегистрированы препараты рекомбинантного фактора свертывания крови IX (rFIX) в 1997 г. Технология получения препаратов на основе рекомбинантной ДНК позволяет значительно снизить риск вирусной контаминации препаратов. В настоящее время препаратами заместительной терапии гемофилии являются плазменные и рекомбинантные препараты, однако они имеют ряд недостатков.
Основной проблемой производства плазменных препаратов является потребность в больших объемах плазмы. При этом, несмотря на то, что с конца 1980-х годов не было зарегистрировано случаев инфицирования больных при применении pdFIX, производители данных препаратов теоретически не могут исключить возможность их вирусного заражения.
Среди недостатков, применяемых в настоящее время для лечения гемофилии препаратов FIX, следует выделить следующие:
• теоретическая вероятность вирусного инфицирования больных плазменными препаратами;
• высокая иммуногенность плазменных и рекомбинантных препаратов;
• более низкая (в сравнении с плазменными препаратами) эффективность рекомбинантных препаратов;
• низкий период циркуляции в крови факторов свертывания крови;
• потребность в частых внутривенных инфузиях (2-3 раза в неделю);
• отсутствие широкой доступности пожизненной заместительной терапии.
Применение генотерапевтических лекарственных препаратов для трансдукции гена фактора IX являются принципиально новым и перспективным подходом в сравнении с существующими вариантами терапии: вводимый с помощью внутривенной инфузии генотерапевтический препарат восстанавливает продукцию фактора свертывания в организме пациента.
Один из основных методов генотерапии - это доставка целевого гена в клетки организма с помощью вирусных векторов, например, вектора на основе AAV.
Аденоассоциированный вирус (AAV) представляет собой небольшой (25 нм), неспособный к самостоятельной репликации, безоболочечный вирус.У человека и приматов описано множество различных серотипов AAV. Геном аденоассоциированного вируса содержит (+ или -) одноцепочечную ДНК (ssDNA) длиной около 4,7 тысяч нуклеотидов. На концах молекулы геномной ДНК располагаются инвертированные концевые повторы (англ. inverted terminal repeats, ITRs). Геном содержит две открытые рамки считывания (англ. ORF): Rep и Сар, содержащие в себе несколько альтернативных рамок считывания, кодирующих различные белковые продукты. Продукты Rep имеют важное значение для репликации AAV, при этом ген Сар, помимо других альтернативных продуктов, кодирует 3 капсидных белка (VP1, VP2 и VP3). Белки VP1, VP2 и VP3 находятся в соотношении 1:1:10, образуя икосаэдрический капсид (Xie Q. et al. The atomic structure of adeno-associated virus (AAV-2), a vector for human gene therapy. Proc Natl Acad Sci USA, 2002; 99:10405-10410). При образовании рекомбинантного вектора AAV (rAAV) кассета экспрессии, фланкированная ITR, упаковывается в капсид AAV. Гены, необходимые для репликации AAV, не входят в кассету. Рекомбинантный AAV считается самым безопасным и одним из наиболее широко используемых вирусных векторов для переноса генов in vivo. Векторы могут инфицировать клетки из тканей множества типов, обеспечивая мощную и устойчивую трансгенную экспрессию. Они также являются непатогенными и имеют низкий профиль иммуногенности (High КА et al., «rAAV human trial experience)) Methods Mol Biol. 2011; 807:429-57).
Одной из насущных целей исследований в области разработки эффективной генотерапии является кодон-оптимизация генов интереса в составе векторов для получения максимального уровня экспрессии генов интереса, что, в свою очередь, позволит использовать для достижения значимого эффекта более низкие дозы вектора.
Одним из свойств генетического кода является вырожденность - способность разных кодонов (тринуклеотидов) кодировать одну и ту же аминокислоту. Такие кодоны, которые дают одну и ту же аминокислоту в процессе трансляции, называются синонимичными. В природных последовательностях выбор одного из синонимичных кодонов осуществляется случайным образом в процессе эволюции, однако частоты использования синонимичных кодонов отличаются: для каждой аминокислоты есть более и менее предпочтительные. Кодон-оптимизация - это широко используемая в мире техника, направленная на повышение продуктивности наработки белковых молекул, которая заключается в рациональном сопоставлении каждой аминокислоте в белковой последовательности одного из подходящих синонимичных кодонов. Один из распространенных принципов кодон-оптимизации подразумевает использование наиболее частых кодонов, впоследствии были предложены и другие подходы, такие как гармонизация (воспроизведение распределения частот используемых кодонов), но и они не всегда дают увеличение продуктивности. Помимо частот кодонов на эффективность наработки может влиять GC-состав последовательности (отношение количества гуанинов и цитозинов к суммарной длине последовательности), в частности, было показано, что завышенный GC-состав ассоциирован с повышением количества мРНК в клетках млекопитающих Grzegorz Kudla ET AL., High Guanine and Cytosine Content Increases mRNA Levels in Mammalian Cells, June 2006, Volume 4, Issue 6, el80, pp.933-942). Также стоит отметить, что устойчивые элементы вторичной структуры мРНК, т.е. имеющие низкую свободную энергию фолдинга, могут снижать эффективность.
Различные варианты кодон-оптимизации последовательности гена интереса могут приводить к следующему (в сравнение с геном дикого типа):
а) уровень экспрессии генов интереса будет незначительно увеличен;
б) уровень экспрессии генов интереса будет значительно увеличен;
в) уровень экспрессии генов интереса останется приблизительно на том же уровне;
г) уровень экспрессии генов интереса будет понижен.
Таким образом, есть потребность в получении кодон-оптимизированной последовательности гена FIX для увеличения экспрессии гена FIX в целевых клетках и создании на его основе генотерапевтического препарата.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторами данной группы изобретений было установлено, что кодон-оптимизированная нуклеиновая кислота по изобретению, которая кодируют белок FIX (фактор свертывания крови IX), с нуклеотидной последовательностью SEQ ID NO: 2 (hFIXco-v1) или SEQ ID NO: 4 (hFIXco-v2) неожиданно показывает увеличение уровня экспрессии гена FIX и увеличение уровня продукции белка фактора свертывания крови IX в несколько раз по сравнению с геном дикого типа, кодирующим фактор свертывания крови IX (hFIX-wt). Данные варианты кодон-оптимизированной нуклеиновой кислоты по изобретению с нуклеотидной последовательностью SEQ ID NO: 2 (hFIXco-v1) и SEQ ID NO: 4 (hFIXco-v2) входят в состав экспрессионной кассеты и вектора на ее основе, а также в состав рекомбинантного вируса на основе AAV5 (аденоассоциированный вирус 5 серотипа).
Краткое описание изобретения
В одном из аспектов настоящее изобретение относится к выделенной кодон-оптимизированной нуклеиновой кислоте, которая кодирует белок FIX (фактор свертывания крови IX) с аминокислотной последовательностью SEQ ID NO: 1, и которая включает нуклеотидную последовательность, которую выбирают из группы: SEQ ID NO: 2 или SEQ ID NO: 4.
В одном из аспектов настоящее изобретение относится к экспрессионной кассете, которая включает вышеуказанную кодон-оптимизированную нуклеиновую кислоту.
В некоторых вариантах экспрессионная кассета включает следующие элементы в направлении от 5'-конца к 3'-концу:
левый (первый) ITR (инвертированные концевые повторы);
TTR промотор (промотор транстиретина);
интрон гена hBG1 (фрагмент гена β глобина человека, несущий интрон);
вышеуказанную кодон-оптимизированную нуклеиновую кислоту;
сигнал полиаденилирования hGH1 (сигнал полиаденилирования гена гормона роста человека);
правый (второй) ITR.
В некоторых вариантах экспрессионная кассета включает нуклеотидную последовательность, которую выбирают из группы: SEQ ID NO: 3 или SEQ ID NO: 5.
В одном из аспектов настоящее изобретение относится к экспрессионному вектору, который включает вышеуказанную кодон-оптимизированную нуклеиновую кислоту или любую из вышеуказанных экспрессионных кассет.
В одном из аспектов настоящее изобретение относится к выделенному рекомбинантному вирусу на основе AAV5 (аденоассоциированный вирус 5 серотипа) для увеличения экспрессии гена FIX в целевых клетках, который включает вышеуказанную кодон-оптимизированную нуклеиновую кислоту или любую из вышеуказанных экспрессионных кассет.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 11.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 11 с одной или несколькими точечными мутациями.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 14.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 11 или аминокислотную последовательность SEQ ID NO: 11 с одной или несколькими точечными мутациями, а экспрессионная кассета включает следующие элементы в направлении от 5'-конца к 3'-концу:
левый (первый) ITR (инвертированные концевые повторы); TTR промотор (промотор транстиретина);
интрон гена hBG1 (фрагмент гена β глобина человека, несущий интрон); вышеуказанную кодон-оптимизированную нуклеиновую кислоту;
сигнал полиаденилирования hGH1 (сигнал полиаденилирования гена гормона роста человека);
правый (второй) ITR.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 11 или аминокислотную последовательность SEQ ID NO: 11 с одной или несколькими точечными мутациями, а экспрессионная кассета включает нуклеотидную последовательность, которую выбирают из группы: SEQ ID NO: 3 или SEQ ID NO: 5.
В некоторых вариантах рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 11 с одной или несколькими точечными мутациями, представляет собой аминокислотную последовательностью SEQ IDNO: 14.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции для доставки гена FIX в целевые клетки, которая включает любой из вышеуказанных рекомбинантных вирусов на основе AAV5 в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
В одном из аспектов настоящее изобретение относится к применению любого из вышеуказанных рекомбинантных вирусов на основе AAV5 или вышеуказанной композиции для доставки гена FIX в целевые клетки.
В одном из аспектов настоящее изобретение относится к применению любого из вышеуказанных рекомбинантных вирусов на основе AAV5 или вышеуказанной композиции для обеспечения белком FIX субъекта, который имеет гемофилию В и/или не имеет полнофункциональных копий гена FIX.
В одном из аспектов настоящее изобретение относится к применению любого из вышеуказанных рекомбинантных вирусов на основе AAV5 или вышеуказанной композиции для лечения гемофилии В у субъекта, который имеет гемофилию В.
В одном из аспектов настоящее изобретение относится к способу обеспечения белком FIX субъекта с гемофилией В, включающий введение терапевтически эффективного количества любого из вышеуказанных рекомбинантных вирусов на основе AAV5 или вышеуказанной композиции в клетки субъекта, нуждающегося в этом.
В одном из аспектов настоящее изобретение относится к способу доставки гена FIX в целевые клетки субъекта с гемофилией В, включающий введение любого из вышеуказанных рекомбинантных вирусов на основе AAV5 или вышеуказанной композиции в клетки субъекта.
В одном из аспектов настоящее изобретение относится к способу лечения гемофилии В у субъекта, который включает ведение терапевтически эффективного количества любого из вышеуказанных рекомбинантных вирусов на основе AAV5 или вышеуказанной композиции субъекту, который имеет гемофилию В.
Краткое описание чертежей
Фигура 1 представляет собой схему плазмид pAAV-hFIXco-v1 и pAAV-hFIXco-v2, предназначенных для получения AAV векторов с экспрессионной кассетой, которая содержит кодон-оптимизированные последовательности гена фактора свертывания крови IX (FIX) человека hFIXco-v1 и hFIXco-v2 соответственно, где
hFIXco-v1 - кодон-оптимизированная последовательность гена фактора свертывания крови IX человека (вариант №1);
hFIXco-v2 - кодон-оптимизированная последовательность гена фактора свертывания крови IX человека (вариант №2);
AmpR - ген бета-лактамазы, обеспечивающий устойчивость к ампициллину;
pUC origin- pUC ориджин репликации в бактериях;
ITR - инвертированные терминальные повторы;
TTR Promoter - промотор гена транстиретина (transthyretin promoter);
Poly А - последовательность сигнала полиаденилирования, для повышения стабильности мРНК;
HBG Intron - (human beta globine intron), фрагмент гена β глобина человека, несущий интрон.
Фигура 2 представляет собой график, показывающий уровень экспрессии гена FIX в клетках Huh7 спустя 7 дней после трансдукции клеток вирусными препаратом AAV5-FIX, несущим ген FIX дикого типа (AAV5-hFIX-wt), препаратом AAV5-FIX, несущим кодон-оптимизированный ген hFIXco-v1 (AAV5-hFIXco-v1) и препаратом AAV5-FIX, несущим кодон-оптимизированный ген hFIXco-v2 (AAV5-hFIXco-v2) (все варианты генов FIX в препаратах AAV-FIX содержат природную мутацию Padua, R338L). * - p-value < 0,05. Статистический анализ проведен с помощью two-way ANOVA с критерием Даннетта (Dunnett test).
Фигура 3А представляет собой график, показывающий концентрацию белка FIX в культуральной жидкости спустя 7 дней после трансдукции клеток Huh7 вирусными препаратом AAV5-FIX, несущим ген FIX дикого типа (AAV5-hFIX-wt), препаратом AAV5-FIX, несущим кодон-оптимизированный ген hFIXco-v1 (AAV5-hFIXco-v1) и препаратом AAV5-FIX, несущим кодон-оптимизированный ген hFIXco-v2 (AAV5-hFIXco-v2) (все варианты генов FIX в препаратах AAV-FIX содержат природную мутацию Padua, R338L). Контроль - нетрансдуцированные клетки Huh7. *** - p-value < 0,001. Статистический анализ проведен с помощью two-way ANOVA с критерием Даннетта (Dunnett test).
Фигура 3Б представляет собой график, показывающий активность белка FIX в культуральной жидкости спустя 7 дней после трансдукции клеток Huh7 вирусными препаратом AAV5-FIX, несущим ген FIX дикого типа (AAV5-hFIX-wt), препаратом AAV5-FIX, несущим кодон-оптимизированный ген hFIXco-v1 (AAV5-hFIXco-v1) и препаратом AAV5-FIX, несущим кодон-оптимизированный ген hFIXco-v2 (AAV5-hFIXco-v2) (все варианты генов FIX в препаратах AAV-FIX содержат природную мутацию Padua, R338L). Контроль - нетрансдуцированные клетки Huh7. *** - p-value < 0,001. Статистический анализ проведен с помощью two-way ANOVA с критерием Даннетта (Dunnett test).
Фигура 4А представляет собой график, который показывает содержание белка фактора свертывания крови IX в плазме крови экспериментальных животных после внутривенного введения препарата AAV5-FIX, несущего ген FIX дикого типа (AAV5- hFIX-wt) и препарата AAV5-FIX, несущего кодон-оптимизированный ген hFIXco-v1 (AAV5-hFIXco-v1) (все варианты генов FIX в препаратах AAV-FIX содержат природную мутацию Padua, R338L). Средние значения±стандартное отклонение (n=10). *** - p-value < 0,001; ** - p-value < 0,01; * - p-value < 0,05. Статистический анализ проведен с помощью one-way ANOVA с критерием Даннетта (Dunnett test).
Фигура 4Б представляет собой график, который показывает содержание белка фактора свертывания крови IX в плазме крови экспериментальных животных после внутривенного введения препарата AAV5-FIX, несущего ген FIX дикого типа (AAV5- hFIX-wt) и препарата AAV5-FIX, несущим кодон-оптимизированный ген hFIXco-v2 (AAV5-hFIXco-v2) (все варианты генов FIX в препаратах AAV-FIX содержат природную мутацию Padua, R338L). Средние значения ± стандартное отклонение (n=10). *** - p-value < 0,001; ** - p-value < 0,01; * - p-value < 0,05. Статистический анализ проведен с помощью one-way ANOVA с критерием Даннетта (Dunnett test).
Определения и общие методы
Если иное не определено в настоящем документе, научные и технические термины, используемые в связи с настоящим изобретением, будут иметь значения, которые обычно понятны специалистам в данной области.
Кроме того, если по контексту не требуется иное, термины в единственном числе включают в себя термины во множественном числе, и термины во множественном числе включают в себя термины в единственном числе. Как правило, используемая классификация и методы культивирования клеток, молекулярной биологии, иммунологии, микробиологии, генетики, аналитической химии, химии органического синтеза, медицинской и фармацевтической химии, а также гибридизации и химии белка и нуклеиновых кислот, описанные в настоящем документе, хорошо известны специалистам и широко применяются в данной области. Ферментативные реакции и способы очистки осуществляют в соответствии с инструкциями производителя, как это обычно осуществляется в данной области, или как описано в настоящем документе.
«Выделенный» означает измененный или удаленный из природного состояния. Например, нуклеиновая кислота или пептид, в природе присутствующие в животном, не являются «выделенными», но те же нуклеиновая кислота или пептид, частично или полностью отделенные от материалов, сопутствующих им в их природном состоянии, являются «выделенными». Выделенная нуклеиновая кислота или белок могут существовать, по существу, в очищенной форме или могут существовать в неприродном окружении, таком как, например, генетически модифицированной клетке.
Определения «встречающийся в природе», «нативный» или «дикого типа» используют для описания объекта, который можно обнаружить в природе как отличающийся от получаемого искусственно. Например, белок или нуклеотидная последовательность, присутствующие в организме (включая вирус), которые можно изолировать из источника в природе, и которые не модифицированы умышленно специалистом в лаборатории, являются встречающимися в природе.
Термин «геном» относится к полному генетическому материалу организма.
В настоящем описании и в последующей формуле изобретения, если контекстом не предусмотрено иное, слова «включать» и «содержать» или их вариации, такие как «имеющий», «включает», «включающий», «содержит» или «содержащий», следует понимать как включение указанного целого или группы целых, но не исключение любого другого целого или группы целых.
Белок (Пептид)
В настоящем описании термины «пептид», «полипептид» и «белок» используют взаимозаменяемо, и они относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должен содержать по меньшей мере две аминокислоты, и не существует ограничений по максимальному количеству аминокислот, которые может содержать последовательность белка или пептида. Полипептиды включают любой пептид или белок, содержащий две или более аминокислот, соединенных друг с другом пептидными связями. Как применяют в настоящем описании, термин относится и к коротким цепям, также общепринято обозначаемым в этой области, например, как пептиды, олигопептиды и олигомеры, и к более длинным цепям, как правило, обозначаемым в этой области как белки, множество типов которых существует.«Полипептиды» включают, помимо прочего, например, биологически активные фрагменты, по существу, гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, слитные белки. Полипептиды включают природные пептиды, рекомбинантные пептиды, синтетические пептиды или их комбинацию.
Молекулы нуклеиновых кислот
Термины «нуклеиновая кислота», «нуклеиновая последовательность» или «нуклеиновокислотная последовательность», «полинуклеотид», «олигонуклеотид», «полину клеотидная последовательность» и «нуклеотидная последовательность», которые используются равнозначно в данном описании, обозначают четкую последовательность нуклеотидов, модифицированных или не модифицированных, определяющую фрагмент или участок нуклеиновой кислоты, содержащую или не содержащую неприродные нуклеотиды и являющуюся либо двухцепочечной ДНК или РНК, либо одноцепочечной ДНК или РНК, либо продуктами транскрипции указанных ДНК.
Как применяют в настоящем описании, полинуклеотиды включают, в качестве неограничивающих примеров, все последовательности нуклеиновой кислоты, получаемые любыми способами, доступными в этой области, включая, в качестве неограничивающих примеров, рекомбинантные способы, т.е. клонирование последовательностей нуклеиновой кислоты из рекомбинантной библиотеки или генома клетки, использование обычной технологии клонирования и ПЦР и т.п., и способами синтеза.
Здесь также следует упомянуть, что данное изобретение не относится к нуклеотидным последовательностям в их природной хромосомной среде, т.е. в природном состоянии. Последовательности данного изобретения были выделены и/или очищены, т.е. были взяты прямо или косвенно, например, путем копирования, при этом их среда была по меньшей мере частично модифицирована. Таким образом, также здесь следует подразумевать изолированные нуклеиновые кислоты, полученные путем генетической рекомбинации, например, с помощью принимающих клеток (клеток-хозяев), или полученные путем химического синтеза.
Термин нуклеотидная последовательность охватывает его комплемент, если не указано иное. Таким образом, нуклеиновую кислоту, имеющую определенную последовательность следует понимать как охватывающие ее комплементарную цепь с ее комплементарной последовательностью.
Аденоассоциированный вирус (AAV)
Вирусы семейства Parvoviridae представляют собой небольшие ДНК-содержащие вирусы животных. Семейство Parvoviridae может быть разделено на два подсемейства: Parvovirinae, представители которого инфицируют позвоночных животных, и Densovirinae, представители которого инфицируют насекомых. К 2006 году были описаны 11 серотипов аденоассоциированного вируса (Mori, S. ET AL., 2004, «Two novel adeno-associated viruses from cynomolgus monkey: pseudotyping characterization of capsid protein», Virology, T. 330 (2): 375-83). Все известные серотипы могут инфицировать клетки многих видов тканей. Тканевая специфичность определяется серотипом белков капсида, поэтому векторы на основе аденоассоциированого вируса конструируют, задавая необходимый серотип.Дополнительная информация по парвовирусам и другим представителям Parvoviridae описана в литературе (Kenneth I. Berns, «Parvoviridae: The Viruses and Their Replication)), Chapter 69 in Fields Virology (3d Ed. 1996)).
Геномная организация всех известных серотипов AAV очень сходна. Геном AAV представляет собой линейную одноцепочечную молекулу ДНК, которая содержит менее чем примерно 5000 нуклеотидов (нт) в длину. Инвертированные концевые повторы (1TR) фланкируют уникальные кодирующие нуклеотидные последовательности репликации неструктурных белков (Rep) и структурных белков (Сар). Ген Сар кодирует белки VP (VP1, VP2 и VP3), которые образуют капсид. Концевые 145 нуклеотидов являются самокомплементарными и организованы таким образом, что может быть сформирован энергетически стабильный внутримолекулярный дуплекс, образующий Т-образную шпилечную структуру. Такие шпилечные структуры функционируют как точки начала репликации ДНК вируса, являясь праймерами для клеточного ДНК-полимеразного комплекса. После инфекции клеток млекопитающих AAV дикого типа (wtAAV) гены Rep (например, Rep78 и Rep52) экспрессируются с помощью Р5 промотора и Р19 промотора, соответственно, и оба белка Rep выполняют определенную функцию в репликации генома вируса. Сплайсинг в открытой рамке считывания Rep (Rep ORF) приводит к экспрессии фактически четырех белков Rep (например, Rep78, Rep68, Rep52 и Rep40). Однако было показано, что несплайсированная мРНК, кодирующая белки Rep78 и Rep52, является достаточной для продукции вектора AAV в клетках млекопитающих.
Вектор
Термин «вектор» при использовании в настоящем документе означает молекулу нуклеиновой кислоты, способную транспортировать другую нуклеиновую кислоту, с которой она соединена. Кроме того, термин «вектор» в данном настоящем документе означает вирусную частицу, способную транспортировать нуклеиновую кислоту.
Как применяют в настоящем описании, термин «экспрессия» определяют как транскрипцию и/или трансляцию конкретной нуклеотидной последовательности, запускаемую ее промотором.
Применение
«Генная терапия» представляет собой вставку генов в клетки и/или ткани субъекта для лечения заболевания, обычно, наследственных заболеваний, при этом дефектный мутантный аллель заменяется или дополняется функциональным аллелем.
«Лечить», «лечение» и «терапия» относятся к методу смягчения или устранения биологического расстройства и/или по меньшей мере одного из сопутствующих ему симптомов. Используемый в данном документе, термин «облегчить» болезнь, заболевание или состояние, означает уменьшение тяжести и/или частоты возникновения симптомов заболевания, расстройства или состояния. Кроме того, содержащиеся в данном документе ссылки на «лечение» включает ссылки на лечебную, паллиативную и профилактическую терапию.
В одном аспекте субъект лечения или пациент является млекопитающим, предпочтительно человеческим субъектом. Вышеупомянутый субъект может быть мужского или женского пола любого возраста.
Термин «нарушение» означает любое состояние, которое можно улучшить в результате лечения по настоящему изобретению.
«Заболевание» является состоянием здоровья субъекта, где субъект не может поддерживать гомеостаз, и где, если заболевание не облегчают, то здоровье субъекта продолжает ухудшаться.
Термин «субъект», «пациент», «индивидуум» и т.п. используют в настоящем описании взаимозаменяемо, и они относятся к любому животному, которое поддается воздействию способами, представленными в настоящем описании. В конкретных неограничивающих вариантах осуществления субъект, пациент или индивидуум является человеком. Вышеупомянутый субъект может быть мужского или женского пола любого возраста.
Терапевтически эффективным количеством» или «эффективным количеством» считается количество вводимого терапевтического агента, которое избавит в определенной степени от одного или нескольких симптомов заболевания, по поводу которого проводится лечение.
Подробное описание изобретения
Нуклеиновая кислота
В одном из аспектов настоящее изобретение относится к выделенной кодон-оптимизированной нуклеиновой кислоте, которая кодирует белок FIX (фактор свертывания крови IX) с аминокислотной последовательностью 
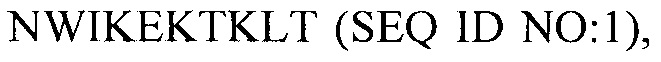
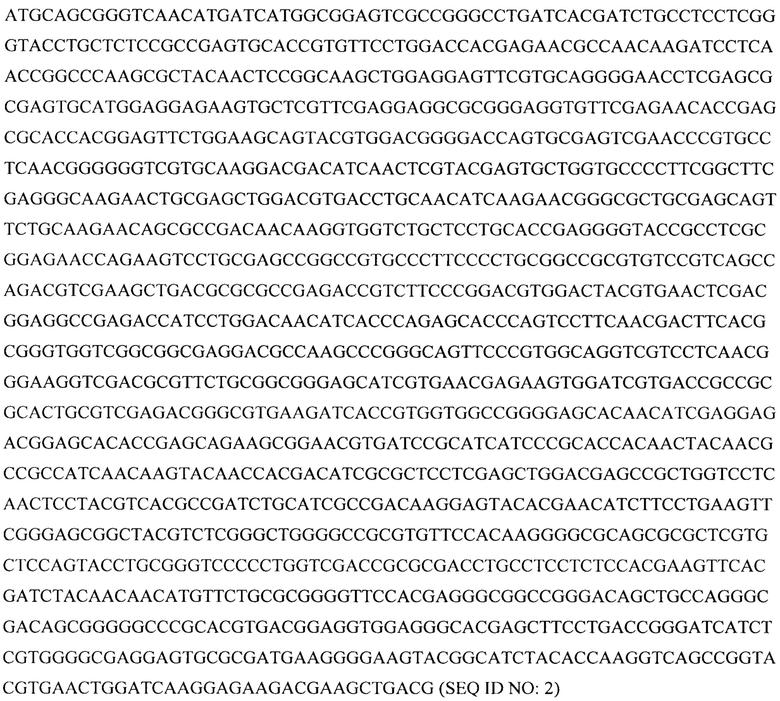
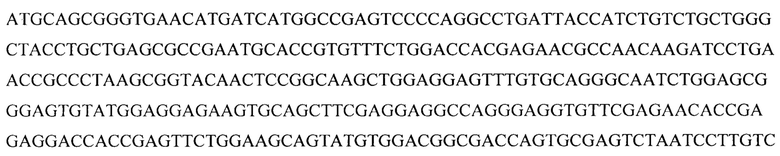

«Выделенная» молекула нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты, которая идентифицирована и отделена от по меньшей мере одной молекулы нуклеиновой кислоты-примеси, с которой она обычно связана в естественном источнике нуклеиновой кислоты нуклеазы. Выделенная молекула нуклеиновой кислоты отличается от той формы или набора, в которых она находится в естественных условиях. Таким образом, выделенная молекула нуклеиновой кислоты отличается от молекулы нуклеиновой кислоты, существующей в клетках в естественных условиях. Однако выделенная молекула нуклеиновой кислоты включает молекулу нуклеиновой кислоты, находящуюся в клетках, в которых в норме происходит экспрессия нуклеазы, например, в случае, если молекула нуклеиновой кислоты имеет локализацию в хромосоме, отличную от ее локализации в клетках в естественных условиях.
Для получения вышеуказанной кодон-оптимизированной нуклеиновой кислоты была проведена кодон-оптимизации нуклеиновой кислоты дикого типа с нуклеотидной последовательностью 

В результате кодон-оптимизации нуклеиновой кислоты дикого типа, которая кодирует белок FIX, с нуклеотидной последовательностью SEQ ID NO: 17 был получен ряд кодон-оптимизированных нуклеиновых кислот, которые были в дальнейшем протестированы на уровень продукции белка по сравнению с контролем (нуклеиновая кислота дикого типа с SEQ ID NO: 17).
Все кодон-оптимизированные нуклеиновые кислоты показали увеличение уровня продукции белка FIX по сравнению с диким типом, при этом кодон-оптимизированная нуклеиновая кислота по изобретению с нуклеотидной последовательностью SEQ ID NO: 2 (hFIXco-v1) и кодон-оптимизированная нуклеиновая кислота по изобретению с нуклеотидной последовательностью SEQ ID NO: 4 (hFIXco-v2) неожиданно показали самый лучший показатель, а именно увеличение уровня экспрессии гена FIX, увеличение уровня продукции белка FIX в несколько раз по сравнению с диким типом (см. примеры 2, 3 и 4).
Экспрессионная кассета. Экспрессионный вектор.
В одном из аспектов настоящее изобретение относится к экспрессионной кассете, которая включает вышеуказанную кодон-оптимизированную нуклеиновую кислоту, которая кодирует белок FIX (фактор свертывания крови IX).
Термин «кассета, которая экспрессирует» или «экспрессионная кассета» при использовании в данном документе, в частности, относится к фрагменту ДНК, который способен в соответствующей обстановке запускать экспрессию полинуклеотида, кодирующего представляющий интерес полипептид, который включен в указанную экспрессионную кассету. При введении в клетку-хозяина экспрессионная кассета помимо прочего способна задействовать клеточные механизмы для транскрипции полинуклеотида, кодирующего представляющий интерес полипептид, в РНК, которая затем обычно дополнительно процессируется и, наконец, транслируется в представляющий интерес полипептид. Экспрессионная кассета может содержаться в экспрессионном векторе.
Экспрессионная кассета по настоящему изобретению содержит в качестве элемента промотор. Термин «промотор», используемый в настоящем документе, в частности, относится к элементу ДНК, который способствует транскрипции полинуклеотида, с которым функционально связан промотор. Промотор может также составлять часть элемента «промотор/энхансер». Хотя физические границы между элементами «промотор» и «энхансер» не всегда ясны, термин «промотор» обычно относится к месту на молекуле нуклеиновой кислоты, с которым связывается РНК-полимераза и/или связанные с ней факторы, и с которого инициируется транскрипция. Энхансеры усиливают активность промотора во времени, а также пространственно. В данной области известно множество промоторов, которые транскрипционно активны в широком диапазоне типов клеток. Промоторы могут быть разделены на два класса: на тех, которые функционируют конститутивно, и тех, которые регулируются индукцией или снятием репрессии. Для экспрессии белка пригодны оба класса. Промоторы, которые используются для продукции высокого уровня полипептидов в эукариотических клетках и, в частности, в клетках млекопитающих, должны быть сильными и, предпочтительно, должны быть активными в широком диапазоне типов клеток. Сильные конститутивные промоторы, которые способны запускать экспрессию во многих типах клеток, хорошо известны в данной области и, поэтому, нет необходимости в их подробном описании в данном документе. В соответствии с идеей настоящего изобретения предпочтительно использовать TTR промотор. Промотор или промотор/энхансер TTR в особенности подходят в качестве промотора в экспрессионной кассете по настоящему изобретению. Согласно одному варианту осуществления изобретения промотор TTR используется в экспрессионной кассете по настоящему изобретению.
В некоторых вариантах осуществления изобретения экспрессионная кассета включает следующие элементы в направлении от 5'-конца к 3'-концу:
левый (первый) 1TR (инвертированные концевые повторы);
TTR промотор (промотор транстиретина);
интрон гена hBG1 (фрагмент гена |3 глобина человека, несущий интрон);
вышеуказанную кодон-оптимизированную нуклеиновую кислоту, которая кодирует белок FIX (фактор свертывания крови IX);
сигнал полиаденилирования hGH1 (сигнал полиаденилирования гена гормона роста человека);
правый (второй) ITR.
В некоторых вариантах осуществления изобретения левый (первый) ITR имеет следующую последовательность нуклеиновой кислоты:
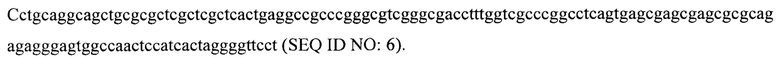
В некоторых вариантах осуществления изобретения TTR промотор имеет следующую последовательность нуклеиновой кислоты:

В некоторых вариантах осуществления изобретения интрон гена hBG1 имеет следующую последовательность нуклеиновой кислоты:

В некоторых вариантах осуществления изобретения сигнал полиаденилирования hGH1 имеет следующую последовательность нуклеиновой кислоты:
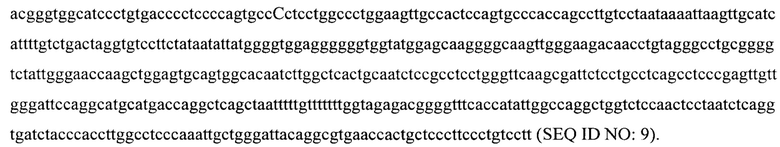
В некоторых вариантах осуществления изобретения правый (второй) ITR имеет следующую последовательность нуклеиновой кислоты:

В некоторых вариантах осуществления изобретения экспрессионная кассета включает нуклеотидную последовательность, которую выбирают из группы:


или


В одном из аспектов настоящее изобретение относится к экспрессионному вектору, который включает вышеуказанную кодон-оптимизированную нуклеиновую кислоту или любую из вышеуказанных экспрессионных кассет.
В некоторых вариантах осуществления изобретения вектор представляет собой плазмиду, т.е. кольцевую двухцепочечную часть ДНК, в которую могут быть лигированы дополнительные сегменты ДНК.
В некоторых вариантах осуществления изобретения вектор представляет собой вирусный вектор, в котором дополнительные сегменты ДНК могут быть лигированы в вирусный геном.
В некоторых вариантах осуществления изобретения векторы способны к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, имеющие бактериальный сайт инициации репликации и эписомные векторы млекопитающих). В других вариантах осуществления изобретения векторы (например, неэписомальные векторы млекопитающих) могут быть интегрированы в геном клетки-хозяина при введении в клетку-хозяина, и таким образом реплицируются вместе с геном хозяина. Более того, некоторые векторы способны направлять экспрессию генов, с которыми они функционально соединены. Такие векторы упоминаются в данном документе как «рекомбинантные экспрессирующие векторы» (или просто «экспрессирующие векторы» («вектор экспрессии» или «экспрессионный вектор»)).
Экспрессионные векторы включают плазмиды, ретровирусы, аденовирусы, аденоассоциированные вирусы (AAV), вирусы растений, такие как вирус мозаики цветной капусты, вирусы табачной мозаики, космиды, YAC, EBV полученные эписомы и тому подобное. Молекулы ДНК могут быть лигированы в вектор таким образом, что последовательности, контролирующие транскрипцию и трансляцию в векторе, выполняют предусмотренную функцию регуляции транскрипции и трансляции ДНК. Экспрессионный вектор и последовательности контроля экспрессии могут быть выбраны таким образом, чтобы быть совместимыми с используемой экспрессирующей клеткой-хозяином. Молекулы ДНК могут быть введены в экспрессионный вектор стандартными способами (например, лигированием комплементарных сайтов рестрикции или лигированием тупых концов, если сайты рестрикции отсутствуют).
Рекомбинантный экспрессионный вектор также может кодировать лидерный пептид (или сигнальный пептид), который облегчает выработку белка-интереса клеткой-хозяином. Ген белка-интереса может быть клонирован в вектор таким образом, что сигнальный пептид соединен с рамкой считывания аминоконца белка-интереса. Лидерным пептидом (или сигнальным пептидом) может быть лидерный пептид иммуноглобулина или иной лидерный пептид (то есть, лидерный пептид белка не иммуноглобулиновой природы).
Помимо гена FIX по данному изобретению, рекомбинантная экспрессия векторов по данному изобретению может нести регулирующие последовательности, которые контролируют экспрессию гена FIX в клетке-хозяине. Специалистам в этой области будет понятно, что дизайн экспрессионного вектора, включая выбор регулирующих последовательностей, может зависеть от таких факторов, как селекция клетки-хозяина для трансформации, уровень экспрессии желаемого белка, и т.д. Предпочтительные регулирующие последовательности для экспрессирующей клетки-хозяина млекопитающих включают вирусные элементы обеспечивающие высокий уровень экспрессии белков в клетках млекопитающих, таких как промоторы и/или энхансеры, полученные из ретровирусной LTR, цитомегаловируса (CMV) (например, CMV промотора/энхансера), обезьяньего вируса 40 (SV40) (например, SV40 промотора/энхансера), аденовируса, (например, большого позднего промотора аденовируса (AdMLP)), вирус полиомы, а также сильных промоторов млекопитающих, таких как TTR промотор, промотор нативных иммуноглобулинов или промотор актина.
Выражение «контролирующие последовательности» относится к последовательностям ДНК, необходимым для экспрессии функционально связанной кодирующей последовательности в определенном организме-хозяине. Пригодные для прокариот контролирующие последовательности представляют собой, например, промотор, необязательно оператор и сайт связывания рибосомы. Как известно, в эукариотических клетках присутствуют промоторы, сигналы полиаденилирования и энхансеры.
В контексте настоящего описания термин «промотор» или «регуляторная последовательность транскрипции» или «регуляторная последовательность» относится к фрагменту нуклеиновой кислоты, который контролирует транскрипцию одной или нескольких кодирующих последовательностей, и который расположен против направления считывания информации относительно направления транскрипции от сайта инициации транскрипции кодирующей последовательности, а также который структурно идентифицируется по наличию сайта связывания для ДНК-зависимой РНК-полимеразы, сайтов инициации транскрипции и других последовательностей ДНК, включающих, без ограничения, сайты связывания фактора транскрипции, сайты связывания репрессора и активатора белка, а также любые другие последовательности нуклеотидов, известные специалистам в данной области, которые непосредственно или опосредованно регулируют уровень транскрипции с данным промотором. «Конститутивный» промотор представляет собой такой промотор, который активен в большинстве тканей в обычных физиологических условиях и условиях развития. «Индуцибельный» промотор представляет собой промотор, который подвергается физиологической регуляции или регуляции в ходе развития, например, при воздействии химического индуктора. «Тканеспецифичный» промотор активен только в конкретных типах тканей или клеток.
Термины «энхансеры» или «энхансер», используемые в изобретении, могут относиться к последовательности ДНК, которая расположена как смежная с последовательностью ДНК, кодирующей рекомбинантный продукт. Энхансерные элементы обычно расположены в 5'-направлении от промоторного элемента или могут быть расположены ниже или в пределах кодирующей последовательности ДНК (например, последовательности ДНК, транскрибированной или транслированной в рекомбинантный продукт или продукты). Таким образом, энхансерный элемент может быть расположен на расстоянии 100 пар оснований, 200 пар оснований или 300 или больше пар оснований перед последовательностью ДНК, которая кодирует рекомбинантный продукт, или после этой последовательности. Энхансерные элементы могут увеличивать количество экспрессируемого рекомбинантного продукта от последовательности ДНК, превышая экспрессию, обусловленную одиночным промоторным элементом. Специалистам в данной области техники доступно множество энхансерных элементов.
В дополнение к вышеуказанным генам и регулирующим последовательностям, рекомбинантные векторы экспрессии изобретения могут нести дополнительные последовательности, такие как последовательности, которые регулируют репликацию вектора в клетках-хозяевах (например, точки начала репликации) и гены селектируемого маркера. Ген селектируемого маркера облегчает селекцию клеток-хозяев, в которые был введен вектор (см., например, патенты США 4,399,216, 4,634,665 и 5,179,017). Например, обычно ген селектируемого маркера придает устойчивость к лекарственным средствам, таким как G418, ампициллин, гигромицин или метотрексат, клетке-хозяину, в которую вектор введен. Например, гены селектируемого маркера включают ген дигидрофолат редуктазы (DHFR) (для использования в dhfr-клетках-хозяевах при селекции/амплификации метотрексата), ген нео (для селекции G418) и ген синтетазы глутамата.
Термин «последовательность контроля экспрессии», используемый в данном описании, означает полинуклеотидные последовательности, которые необходимы для воздействия на экспрессию и процессинг кодирующих последовательностей, к которым они лигированы. Контролирующие экспрессию последовательности включают соответствующие последовательности инициации транскрипции, терминации, промотора и энхансера; эффективные сигналы процессинга РНК, такие как сплайсинг и сигналы полиаденилирования; последовательности, которые стабилизируют цитоплазматическую мРНК; последовательности, которые повышают эффективность трансляции (т.е. консенсусная последовательность Козака); последовательности, которые повышают стабильность белка; и, при желании, последовательности, которые усиливают секрецию белка. Характер таких контролирующих последовательностей различается в зависимости от организма-хозяина; в прокариотах такие контролирующие последовательности, как правило, включают промотор, сайт связывания рибосомы, а также последовательности терминации транскрипции; в эукариотах, как правило, такие контролирующие последовательности включают промоторы и последовательности терминации транскрипции. Термин «контролирующие последовательности» включает, как минимум, все компоненты, наличие которых имеет важное значение для экспрессии и процессинга, и может также включать дополнительные компоненты, чье присутствие является полезным, например, лидирующие последовательности и последовательности слившихся клеток.
В контексте настоящего описания термин «функционально связанный» относится к связи полинуклеотидных (или полипептидных) элементов в функциональную связь. Нуклеиновая кислота является «функционально связанной», если она находится в условиях функциональной связи с другой последовательностью нуклеиновой кислоты. Например, регуляторная последовательность транскрипции функционально связана с кодирующей последовательностью, если она влияет на транскрипцию указанной кодирующей последовательности. Термин «функционально связанный» означает, что связанные последовательности ДНК являются, как правило, непрерывными, и при необходимости соединения двух участков, кодирующих белок, являются также непрерывными и находятся в рамке считывания.
В одном из вариантов настоящего изобретения «экспрессионный вектор» относится к вектору, содержащему одну или несколько интересующих полинуклеотидных последовательностей, интересующих генов или «трансгенов», которые фланкированы парвовирусными или инвертированными концевыми повторяющимися последовательностями (ITR).
Ни кассета, ни вектор по изобретению не содержит нуклеотидные последовательности генов, кодирующих неструктурные белки (Rep) и структурные белки (Сар) аденоассоциированного вируса.
Рекомбинантный вирус на основе AAV5 (аденоассоциированный вирус 5 серотипа)
В одном из аспектов настоящее изобретение относится к выделенному рекомбинантному вирусу на основе AAV5 (аденоассоциированный вирус 5 серотипа) для увеличения экспрессии гена FIX в целевых клетках, который включает вышеуказанную кодон-оптимизированную нуклеиновую кислоту или любую из вышеуказанных экспрессионных кассет.
Термин «рекомбинантный вирус на основе AAV» (или «вирусоподобная частица на основе AAV», или «рекомбинантный вирусный штамм AAV», или «рекомбинантный вектор AAV», или «вектор rAAV») в контексте настоящего описания относится к вышеуказанной экспрессионной кассете (или вышеуказанному экспрессионному вектору), которая заключена внутри капсида AAV.
Ген Сар, помимо других альтернативных продуктов, кодирует 3 капсидных белка (VP1, VP2 и VP3). Белки VP1, VP2 и VP3 находятся в соотношении 1:1:10, образуя икосаэдрический капсид (Xie Q. et al. The atomic structure of adeno-associated virus (AAV-2), a vector for human gene therapy. Proc Natl Acad Sci USA, 2002; 99:10405-10410). Транскрипция этих генов начинается с одного промотора, р40. Молекулярная масса соответствующих белков (VP1, VP2 и VP3) составляет 87, 72 и 62 кДа, соответственно. Все три белка транслируются с одной мРНК. После транскрипции пре-мРНК может подвергаться сплайсингу двумя разными способами, при этом вырезается более длинный или более короткий интрон и образуются мРНК различной нуклеотидной длины.
При образовании рекомбинантного вируса на основе AAV (rAAV) кассета экспрессии, фланкированная ИКП (ITR), упаковывается в капсид AAV. Гены, необходимые для репликации AAV, как было указано выше, не входят в кассету.
ДНК экспрессионной кассеты упакована в вирусный капсид в виде одноцепочечной молекулы ДНК (оцДНК) длиной приблизительно 3000 нуклеотидов. После инфицирования клетки вирусом, одноцепочечную ДНК конвертируют в форму двухцепочечной ДНК (дцДНК). Только дцДНК могут использовать белки клетки, которые транскрибируют содержащийся ген или гены в РНК.
В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5.
В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность
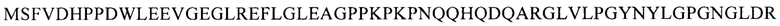

В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP2 AAV5.
В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP2 AAV5, имеющий следующую аминокислотную последовательность:

В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP3 AAV5.
В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP3 AAV5, имеющий следующую аминокислотную последовательность


В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белки VP1, VP2 и VP3 AAV5.
В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белки VP1 с аминокислотной последовательность SEQ ID NO: 11, VP2 с аминокислотной последовательность SEQ ID NO: 12 и VP3 с аминокислотной последовательность SEQ ID NO: 13.
В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 11 с одной или несколькими точечными мутациями.
В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность, которая включает аминокислотные замены в положениях S2A и T711S VP1 AAV5 дикого типа (SEQ ID NO: 11), и имеет аминокислотную последовательность

В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP2 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 12 с одной или несколькими точечными мутациями.
В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP2 AAV5, имеющий аминокислотную последовательность, которая включает аминокислотную замену в положении T575S VP2 AAV5 дикого типа (SEQ ID NO: 12), и имеет аминокислотную последовательность


В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP3 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 13 с одной или несколькими точечными мутациями.
В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP3 AAV5, имеющий аминокислотную последовательность, которая включает аминокислотную замену в положении T519S VP3 AAV5 дикого типа (SEQ ID NO: 13), и имеет аминокислотную последовательность

В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белки VP1 с аминокислотной последовательность SEQ ID NO: 11 с одной или несколькими точечными мутациями, VP2 с аминокислотной последовательность SEQ ID NO: 12 с одной или несколькими точечными мутациями и VP3 с аминокислотной последовательность SEQ ID NO: 13 с одной или несколькими точечными мутациями.
В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белки VP1 с аминокислотной последовательность SEQ ID NO: 14, VP2 с аминокислотной последовательность SEQ ID NO: 15 и VP3 с аминокислотной последовательность SEQ ID NO: 16.
Под «несколькими точечными мутациями» подразумеваются две, три, четыре, пять, шесть, семь, восемь, девять или десять точечных замен.
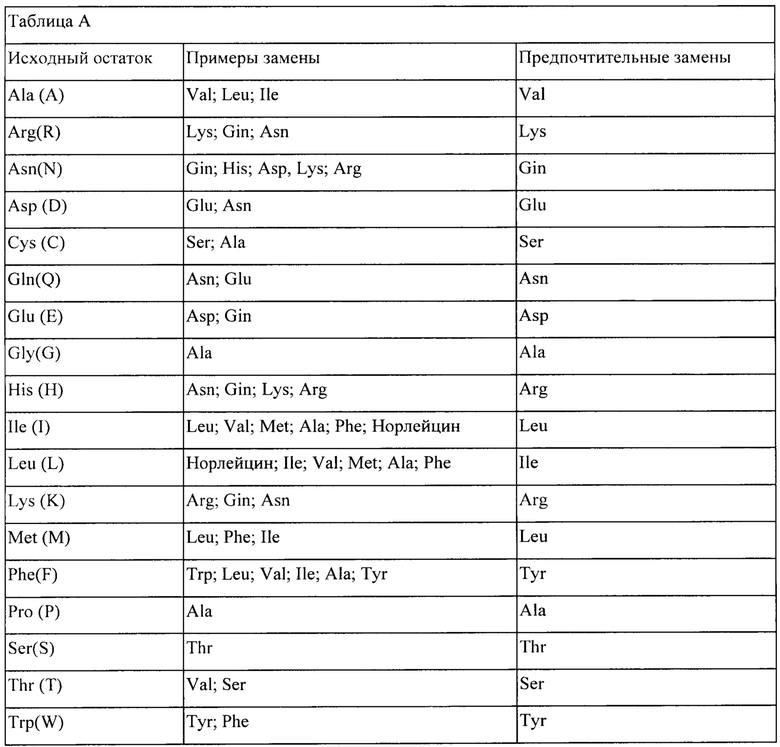
Особенно предпочтительные варианты включают замены (мутации), которые являются консервативными по природе, т.е. те замены, которые имеют место в семействе аминокислот, которые объединены по их боковым цепям. В частности, аминокислоты обычно делят на четыре семейства: (1) кислые - аспартат и глутамат; (2) основные - лизин, аргинин, гистидин; (3) неполярные - аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) незаряженные полярные - глицин, аспарагин, глутамин, цистеин, серии треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют как ароматические аминокислоты. Например, достаточно обосновано предсказание о том, что выделенная замена лейцина на изолейцин или валин, аспартата на глутамат, треонина на серии или схожая консервативная замена аминокислоты на структурно родственную аминокислоту не окажет важного влияния на биологическую активность. Например, полипептид, представляющий интерес, может включать вплоть до приблизительно 5-10 консервативных или неконсервативных аминокислотных замен, при условии, что желаемая функция молекулы остается незатронутой.
Вариант точечных мутаций в последовательностях белков VP1, VP2 или VP3 AAV5 с помощью аминокислотных замен представляет собой замену, по меньшей мере, одного аминокислотного остатка в белке VP1, VP2 или VP3 AAV5 на другой аминокислотный остаток.
Консервативные замены показаны в таблице А под заголовком «предпочтительные замены».

В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 11 или аминокислотную последовательность SEQ ID NO: 11 с одной или несколькими точечными мутациями, а экспрессионная кассета включает следующие элементы в направлении от 5'-конца к 3'-концу:
левый (первый) ITR (инвертированные концевые повторы);
TTR промотор (промотор транстиретина);
интрон гена hBG1 (фрагмент гена β глобина человека, несущий интрон);
вышеуказанную кодон-оптимизированную нуклеиновую кислоту;
сигнал полиаденилирования hGH1 (сигнал полиаденилирования гена гормона роста человека);
правый (второй) ITR.
В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 11, белок VP2 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 12 и белок VP3 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 13, а экспрессионная кассета включает следующие элементы в направлении от 5'-конца к 3'-концу:
левый (первый) ITR (инвертированные концевые повторы);
TTR промотор (промотор транстиретина);
интрон гена hBG1 (фрагмент гена β глобина человека, несущий интрон);
вышеуказанную кодон-оптимизированную нуклеиновую кислоту;
сигнал полиаденилирования hGH1 (сигнал полиаденилирования гена гормона роста человека);
правый (второй) ITR.
В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 11 с одной или несколькими точечными мутациями, белок VP2 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 12 с одной или несколькими точечными мутациями и белок VP3 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 13 с одной или несколькими точечными мутациями, а экспрессионная кассета включает следующие элементы в направлении от 5'-конца к 3'-концу:
левый (первый) ITR (инвертированные концевые повторы);
TTR промотор (промотор транстиретина);
интрон гена hBG1 (фрагмент гена β глобина человека, несущий интрон);
вышеуказанную кодон-оптимизированную нуклеиновую кислоту;
сигнал полиаденилирования hGH1 (сигнал полиаденилирования гена гормона роста человека);
правый (второй) ITR.
В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 14, белок VP2 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 15 и белок VP3 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 16, а экспрессионная кассета включает следующие элементы в направлении от 5'-конца к 3'-концу:
левый (первый) ITR (инвертированные концевые повторы);
TTR промотор (промотор транстиретина);
интрон гена hBG1 (фрагмент гена β глобина человека, несущий интрон);
вышеуказанную кодон-оптимизированную нуклеиновую кислоту;
сигнал полиаденилирования hGH1 (сигнал полиаденилирования гена гормона роста человека);
правый (второй) ITR.
В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белок VP1 AAV5, имеющий аминокислотную последовательность SEQ ID NO: 11 или аминокислотную последовательность SEQ ID NO: 11 с одной или несколькими точечными мутациями, а экспрессионная кассета включает нуклеотидную последовательность, которую выбирают из группы: SEQ ID NO: 3 или SEQ ID NO: 5.
В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белки VP1 с аминокислотной последовательность SEQ ID NO: 11, VP2 с аминокислотной последовательность SEQ ID NO: 12 и VP3 с аминокислотной последовательность SEQ ID NO: 13, а экспрессионная кассета включает нуклеотидную последовательность, которую выбирают из группы: SEQ ID NO: 3 или SEQ ID NO: 5.
В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белки VP1 с аминокислотной последовательность SEQ ID NO: 11 с одной или несколькими точечными мутациями, VP2 с аминокислотной последовательность SEQ ID NO: 12 с одной или несколькими точечными мутациями и VP3 с аминокислотной последовательность SEQ ID NO: 13 с одной или несколькими точечными мутациями, а экспрессионная кассета включает нуклеотидную последовательность, которую выбирают из группы: SEQ ID NO: 3 или SEQ ID NO: 5.
В некоторых вариантах осуществления изобретения рекомбинантный вирус на основе AAV5 имеет капсид, который включает белки VP1 с аминокислотной последовательность SEQ ID NO: 14, VP2 с аминокислотной последовательность SEQ ID NO: 15 и VP3 с аминокислотной последовательность SEQ ID NO: 16, а экспрессионная кассета включает нуклеотидную последовательность, которую выбирают из группы: SEQ ID NO: 3 или SEQ ID NO: 5.
Фармацевтическая композиция
В одном из аспектов настоящее изобретение относится к фармацевтической композиции для доставки гена FIX в целевые клетки, которая включает любой из вышеуказанных рекомбинантных вирусов на основе AAV5 в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
Действующее вещество в вышеуказанной композиции находится в эффективном количестве, например, в биологически эффективном количестве.
В конкретных вариантах осуществления настоящее изобретение относится к фармацевтической композиции, содержащей рекомбинантный вирус на основе AAV5 по изобретению в фармацевтически приемлемом носителе или в других фармацевтических агентах, адъювантах, разбавителях и т.д. Носитель для инъекций обычно является жидким. Носитель для других способов введения может быть или твердым, или жидким, таким как стерильная апирогенная вода или стерильный апирогенный фосфатно-солевой буферный раствор. Для введения путем ингаляции носитель является вдыхаемым и предпочтительно находится в твердой или жидкой дисперсной форме. В качестве инъекционной среды предпочтительно использовать воду, содержащую добавки, общепринятые для инъекционных растворов, такие как стабилизирующие агенты, соли или солевые растворы и/или буферы.
«Фармацевтическая композиция» обозначает композицию, включающую в себя вышеуказанный рекомбинантный вирус на основе AAV5 по изобретению и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых эксипиентов, таких как наполнители, растворители, разбавители, носители, вспомогательные, распределяющие, средства доставки, консерванты, стабилизаторы, эмульгаторы, суспендирующие агенты, загустители, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Фармацевтические композиции по настоящему изобретению и способы их изготовления будут бесспорно очевидными для специалистов в этой области. Производство фармацевтических композиций предпочтительно должно соответствовать требованиям GMP (надлежащей производственной практики). Композиция может включать буферную композицию, тонические агенты, стабилизаторы и солюбилизаторы.
«Фармацевтически приемлемым» считается материал, который не имеет биологических или других противопоказаний, например, материал можно вводить субъекту без каких-либо нежелательных биологических эффектов. Таким образом, такие фармацевтические композиции можно использовать, например, для трансфекции клетки ex vivo или для введения in vivo рекомбинантного вируса на основе AAV5 по изобретению непосредственно субъекту.
Термин «эксципиент» или «вспомогательное вещество» используется в данном документе для описания любого компонента, отличающегося от ранее описанных по данному изобретению. Это вещества неорганического или органического происхождения, используемые в процессе производства, изготовления лекарственных препаратов для придания им необходимых физико-химических свойств.
Под «стабилизатором» понимается вспомогательное вещество или смесь двух и более вспомогательных веществ, которые обеспечивают физическую и/или химическую стабильность активного агента.
Под термином «буфер», «буферная композиция», «буферный агент» понимается раствор, способный сохранять значение рН, благодаря взаимодействию кислотных и щелочных компонентов, входящих в его состав, который дает возможность препарату вектора на основе rAAV5, проявлять устойчивость к изменениям рН. В общем случае, преимущественными являются значения рН фармацевтической композиции от 4,0 до 8,0. В качестве буферных агентов могут быть использованы, например, ацетатный, фосфатный, цитратный, гистидиновый, сукцинатный и т.п. буферные растворы, но, не ограничиваясь ими.
Фармацевтическая композиция является «стабильной», если активный агент сохраняет свою физическую стабильность и/или химическую стабильность и/или биологическую активность в течение заявленного срока годности при температуре хранения, например, при 2-8°С. Предпочтительно, чтобы активный агент сохранял и физическую, и химическую стабильность, а также биологическую активность. Период хранения выбирается на основании результатов исследования стабильности при ускоренном и естественном хранении.
Фармацевтическая композиция по данному изобретению может изготавливаться, упаковываться или широко продаваться в виде единичной стандартной дозы или множества единичных стандартных доз в виде готовой лекарственной формы. Используемый в данном документе термин «единичная стандартная доза» означает дискретное количество фармацевтической композиции, содержащей заранее определенное количество активного ингредиента. Количество активного ингредиента обычно равно дозировке активного ингредиента, который будет вводиться субъекту, или удобной части такой дозировки, например, половине или трети такой дозировки.
Применение
В одном из аспектов настоящее изобретение относится к применению любого из вышеуказанных рекомбинантных вирусов на основе AAV5 или вышеуказанной композиции для доставки гена FIX в целевые клетки.
В одном из аспектов настоящее изобретение относится к применению любого из вышеуказанных рекомбинантных вирусов на основе AAV5 или вышеуказанной композиции для обеспечения белком FIX субъекта, который имеет гемофилию В и/или не имеет полнофункциональных копий гена FIX.
В одном из аспектов настоящее изобретение относится к применению любого из вышеуказанных рекомбинантных вирусов на основе AAV5 или вышеуказанной композиции для лечения гемофилии В у субъекта, который имеет гемофилию В.
В одном из аспектов настоящее изобретение относится к способу обеспечения белком FIX субъекта с гемофилией В, включающий введение терапевтически эффективного количества любого из вышеуказанных рекомбинантных вирусов на основе AAV5 или вышеуказанной композиции в клетки субъекта, нуждающегося в этом.
В одном из аспектов настоящее изобретение относится к способу доставки гена FIX в целевые клетки субъекта с гемофилией В, включающий введение любого из вышеуказанных рекомбинантных вирусов на основе AAV5 или вышеуказанной композиции в клетки субъекта.
В одном из аспектов настоящее изобретение относится к способу лечения гемофилии В у субъекта, который включает ведение терапевтически эффективного количества любого из вышеуказанных рекомбинантных вирусов на основе AAV5 или вышеуказанной композиции субъекту, который имеет гемофилию В.
Под гемофилией В подразумевается наследственное нарушение свертывания крови, вызванное недостаточностью или полным отсутствием фактора свертывания крови IX (FIX). Частота встречаемости гемофилии В составляет около 1 случая на 40000 новорожденных мальчиков. Дефицит фактора свертывания крови сопровождается спонтанными или индуцированными кровоизлияниями в суставы, мышцы и внутренние органы.
Под отсутствием полнофункциональных копий гена FIX подразумеваются инактивирующие мутации или делеции во всех копиях гена FIX в геноме, которые приводят к потере или дефекту функции гена FIX.
Под субъектом подразумевают любое животное, которое поддается воздействию способами, представленными в настоящем описании. В конкретных неограничивающих вариантах осуществления субъект является человеком. Вышеупомянутый субъект может быть мужского или женского пола любого возраста.
Под субъектом, нуждающимся в доставке гена FIX в целевые клетки, или субъектом, нуждающимся в обеспечении белком FIX, подразумевается субъект, который имеет гемофилию В, или субъект, который имеет дефицит фактора свертывания крови IX, или субъект, который имеет инактивирующие мутации или делеции в гене FIX, которые приводят к потере или дефекту функции гена FIX.
Примеры способов введения включают в себя местное применение, интраназальное, ингаляционное, чрезслизистое, трансдермальное, энтеральное (например, пероральное, ректальное), парентеральное (например, внутривенное, подкожное, внутрикожное, внутримышечное) введения, а также инъекции непосредственно в ткань или в орган.
Инъекционные препараты могут быть приготовлены в общепринятых лекарственных формах: в виде жидких растворов или суспензий, твердых форм, подходящих для приготовления растворов или суспензий в жидкости перед инъекцией, или в виде эмульсий. Альтернативно, можно вводить вышеуказанный рекомбинантный вирус на основе AAV5 по данному изобретению локально, а не системно, например, в виде депо или в композиции с замедленным высвобождением.
Рекомбинантный вирус на основе AAV5 вводят в организм в эффективном количестве. Рекомбинантный вирус на основе AAV5 предпочтительно вводят в организм в биологически эффективном количестве. «Биологически эффективное» количество рекомбинантного вируса представляет собой количество, которое достаточно, чтобы вызвать трансдукцию и экспрессию последовательности нуклеиновой кислоты в клетке. Если вирус вводят в клетку in vivo (например, вирус вводят субъекту, как описано ниже), «биологически эффективное» количество вирусного вектора представляет собой количество, которое достаточно, чтобы вызвать трансдукцию и экспрессию последовательности нуклеиновой кислоты в клетке-мишени.
Дозировки вышеуказанного рекомбинантного вируса на основе AAV5 по данному изобретению будут зависеть от способа введения конкретного вирусного вектора, и их можно определять рутинными способами. Примерными дозами для достижения терапевтического эффекта являются вирусные титры, составляющие по меньшей мере примерно 105, 106, 107, 108, 109, 1010, 1011, 1012, 1013, 1014, 1015, 1016 трансдуцирующих единиц или больше, предпочтительно приблизительно от 109 до 1015 трансдуцирующих единиц, еще более предпочтительно 1014 трансдуцирующих единиц на килограмм.
Клетка для введения вышеуказанного рекомбинантного вируса на основе AAV5 по изобретению может быть клеткой любого типа, включая в себя без ограничения, эпителиальные клетки (например, эпителиальные клетки кожи, дыхательных путей и кишечника), печеночные клетки, мышечные клетки, клетки селезенки, фибробласты, эндотелиальные клетки и тому подобное.
Вышеуказанный рекомбинантный вирус на основе AAV5 по изобретению не используется для модификации генетической целостности клеток зародышевой линии человека.
Примеры
Для наилучшего понимания изобретения приводятся следующие примеры. Эти примеры приведены только в иллюстративных целях и не должны толковаться как ограничивающие сферу применения изобретения в любой форме.
Все публикации, патенты и патентные заявки, указанные в этой спецификации включены в данный документ путем отсылки. Хотя вышеупомянутое изобретение было довольно подробно описано путем иллюстрации и примера в целях исключения двусмысленного толкования, специалистам в данной области на основе идей, раскрытых в данном изобретении, будет вполне понятно, что могут быть внесены определенные изменения и модификации без отклонения от сущности и объема прилагаемых вариантов осуществления изобретения.
Материалы и общие методы Методы рекомбинантной ДНК
Для манипуляций с ДНК использовали стандартные методы, описанные у Sambrook J. и др., Molecular cloning: A laboratory manual; Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989. Реагенты для молекулярной биологии использовали согласно инструкциям производителей. Вкратце, плазмидную ДНК нарабатывали для дальнейших манипуляций в клетках Е. coli, выращиваемых под селективным давлением с антибиотиками для того, чтобы плазмиды не терялись в клеточной популяции. Плазмидную ДНК выделяли из клеток коммерческими наборами, измеряли концентрацию и использовали для клонирования с помощью обработки эндонуклеазами рестрикции или методами ПЦР-амплификации. Фрагменты ДНК лигировали между собой с помощью лигаз и трансформировали в бактериальные клетки для отбора клонов и дальнейших наработок. Все полученные генетические конструкции подтверждали по паттернам рестрикции и полным секвенированием по Сэнгеру.
Синтез генов
Требуемые сегменты генов получали из олигонуклеотидов, созданных путем химического синтеза. Генные сегменты длиной от 300 до 1000 п.н., которые фланкированы уникальными сайтами рестрикции, собирали путем ренатурации олигонуклеотидов друг на друге с последующей ПЦР-амплификацией с крайних праймеров. В результате получали смесь фрагментов, включая нужный. Фрагменты клонировали по сайтам рестрикции в промежуточные векторы, после чего последовательности ДНК субклонированных фрагментов подтверждали путем секвенирования ДНК.
Определение последовательностей ДНК
Последовательности ДНК определяли путем секвенирования по Сэнгеру. Анализ последовательностей ДНК и белков и обработку данных о последовательностях осуществляли в программе SnapGene 4.2 и выше для создания, картирования, анализа, аннотирования и иллюстрации последовательностей.
Культивирование клеточных культур
В экспериментах были использованы клеточные линии НЕК293 (Human Embryonic Kidney clone 293) и HUH7 (human hepatocellular carcinoma cell lines). Суспензионные клетки HEK293, используемые для наработки AAV, культивировались в стандартных условиях при 37°С и 5% CO2, на полной питательной среде без FBS и антибиотика. Адгезионные клетки HUH7, используемые для проверки эффективности препаратов AAV, культивировались в стандартных условиях при 37°С и 5% СО2, на полной питательной среде DMEM добавлением 10% FBS, антибиотика/антимикотика. Пересев клеток HUH7 осуществлялся при достижении 80-90% конфлюентности. Для диссоциации клеточного монослоя использовался TrypLE Select enzyme (10х). Жизнеспособность клеток оценивалась с помощью окраски Trypan Blue и одноразовых камер для подсчета клеток с помощью автоматического счетчика Countess П.
Сборка и очистка вирусных частиц рекомбинантных векторов AAV
Для сборки вирусных частиц AAV, содержащих кодон-оптимизированные варианты гена FIX (hFIXco-v1 и hFIXco-v2), использовали клетки-продуценты НЕК293, которые трансфецировали 3-мя плазмидами:
Плазмиды pAAV-hFIXco-v1 и pAAV-hFIXco-v2, содержащие экспрессионную кассету AAV для экспрессии трансгенов hFIXco-v1 и hFIXco-v2 соответственно (Фиг. 1.);
Плазмида для экспрессии гена Сар серотипа AAV5 и гена Rep серотипа AAV2. Каждый ген с помощью альтернативных рамок считывания кодирует несколько белковых продуктов;
Плазмида для экспрессии генов аденовируса Ad5, необходимых для сборки и упаковки капсидов AAV.
Через 72 часа клетки лизировали и проводили очистку и концентрирование вирусных частиц с помощью методов фильтрации, хроматографии и ультрацентифугирования. Титр вирусных частиц определяли с помощью количественной ПЦР с праймерами и пробой, специфичными к участку рекомбинантного вирусного генома и выражали в виде количества копий вирусных геномов на 1 мл.
Трансдукции клеточных культур
Клеточную линию HUH7 заранее засевали в лунки 12-луночных планшетов с плотностью 10000 кл/см2. После прикрепления клеток к адгезивной подложке, вносились препараты AAV при MOI 500000 вг/кл. На 7 день после трансдукции определяли содержание белка FIX и его активность в культуральной жидкости методом ИФА, а также уровень экспрессии гена фактора свертывания крови IX в клетках методом количественной ПЦР с обратной транскрипцией, как описано выше. Работы по оценке уровня белка FIX в культуральной жидкости проводились в 6 независимых экспериментах. Работы по оценке активности секретируемого белка FIX и уровня экспрессии гена фактора свертывания крови IX в клетках проводились в 3 независимых экспериментах. Для негативного контроля были использованы интактные клетки.
Определение уровня экспрессии гена фактора свертывания крови IX
Определение уровня экспрессии гена FIX в клеточных культурах после трансдукции (или трансфекции) проводили методом количественной ПЦР с обратной транскрипцией. Вкратце, выделение РНК из клеточных осадков проводили при помощи набора RNeasy Plus mini kit (Qiagen) согласно протоколу производителя. Обратную транскрипцию проводили при помощи набора реагентов GoScript (Promega) согласно протоколу производителя, а именно на реакцию обратной транскрипции исходно брали 500 нг РНК, кДНК получали при помощи рандомных и олиго-dT праймеров, после проведения обратной транскрипции объем кДНК доводился до 50 мкл стерильной водой. Количественную ПЦР проводили с использованием технологии TaqMan при помощи реакционной смеси qPCRmix-HS HighROX (Евроген), согласно протоколу производителя, на приборе StepOne (Applied Biosystems). Специфичекие праймеры и зонды были подобраны на целевой ген (FIX) и на ген домашнего хозяйства (GAPDH). Для построения стандартных кривых были использованы образцы плазмидных ДНК (плДНК), несущих соответсвующий ген. Для построения каждой стандартной кривой были подготовлены по 7 стандартных образцов. Серия разведений: от 20 млн до 200 копий плДНК на реакцию (шаг разведения - 1:10). Для каждого исследуемого образца анализ проводился в трех технических повторах и сопровождался постановкой «RT-minus» контроля (для контроля отсутствия примеси ДНК в исследуемом образце РНК) и негативного контроля. Результаты определения уровня экспрессии мРНК были представлены в виде: количество копий мРНК целевого гена в образце, нормированное на количество копий мРНК гена GAPDH.
Определение уровня белка фактора свертывания крови IX методом ИФА
Оценка содержания белка фактора свертывания крови IX в культуральной жидкости после трансдукции HUH7 целевыми кандидатами AAV5-FIX, а также в плазме крови животных после введения целевых вирусных препаратов проводилась «сэндвич»-методом неконкурентного твердофазного иммуноферментного анализа (ИФА) коммерческим набором. Вкратце, разведенные в буфере для разведений образцы культуральной жидкости и плазмы крови, вносились в лунки 96-луночного планшета, сенсибилизированные первичными специфическими к фактору свертывания крови IX антителами. В этот же планшет вносились стандарты для построения калибровочной кривой, положительный и отрицательный контроли. Планшет инкубировался 2 часа при комнатной температуре. Производили отмывку лунок планшета отмывочным буфером перед внесением биотинилированных антител, раствора конъюгата стрептавидин-пероксидазы и ТМВ. Вносился раствор со специфическими биотинилированными детектирующими антителами к фактору IX и планшет инкубировался 1 час при комнатной температуре. Далее к образовавшемуся комплексу добавлялся раствор конъюгата стрептавидин-пероксидазы и планшет инкубировался 30 минут при комнатной температуре. Для визуализации ферментативной реакции вносился раствор ТМВ. По достижении нужной степени интенсивности окрашивания во все лунки добавляется стоп-раствор для остановки реакции. Далее измерялась оптическая плотность растворов в лунках планшета. Концентрация фактора свертывания крови IX в исследуемых образцах определялась по калибровочной кривой с учетом предварительного разведения образцов.
Определение активности белка фактора свертывания крови IX
Фактор свертывания крови IX является витамин К-зависимым и для синтеза клеточной культурой активной формы фактора IX необходимо наличие витамина К в ростовой среде. В связи с чем, при трансдукции HUH7 в состав полной ростовой среды добавляли витамин К1 в концентрации 500 нг/мл.
Оценка активности белка фактора свертывания крови IX в культуральной жидкости после трансдукции HUH7 целевыми препаратами проводилась хромогенным методом коммерческим набором.
Вкратце, разведенные в реакционном буфере Трис-БСА образцы культуральной жидкости, стандарты и контрольные растворы вносились в лунки 96-луночного планшета. Далее к ним добавлялся реагент 1 (FX-FVIII). После 2 минутной инкубации при температуре 37°С, вносился реагент 2 (активирующий агент). Планшет инкубировался в течение 3 минут при температуре 37°С. Далее в лунки планшета вносили реагент 3 (хромогенный субстрат) и инкубировали планшет в течение 2 минут. Затем добавляли раствор 20% уксусной кислоты для остановки реакции. Образующийся в результате FXa гидролизует хромогенный субстрат, что приводит к высвобождению паранитроанилина, количество которого (детектируемое по оптической плотности) прямо пропорционально концентрации фактора IX (FIX) в образце.
Проведение in vivo исследования на лабораторных животных
Для экспериментов были использованы мыши линии C57BL/6 (самцы возрастом 6-8 недель). Препараты вводили животным однократно путем внутривенного введения в хвостовую вену. Группе животных отрицательного контроля вводился буферный раствор, не содержащий AAV. Отбор плазмы крови производился в день инъекции до введения препаратов, далее - на 7, 14, 21, 28, 35 и 42 дни после введения препаратов.
Пример 1. Модификация последовательности гена FIX с помощью алгоритма кодон-оптимизации
Разработанный нами препарат представляет собой суспензию модифицированных рекомбинантных капсидов аденоассоциированного вируса 5-го серотипа (AAV5) несущих экспрессионную кассету, кодирующую ген человеческого фактора свертывания крови IX (hFIX) под контролем тканеспецефичного к печени промотора транстиретина (TTR).
В качестве нуклеиновой кислоты дикого типа использовалась нуклеиновая кислота, которая кодирует белок человеческого фактора свертывания крови IX дикого типа с природной мутацией R338L (так называемая мутация Padua), и включает нуклеотидную последовательность SEQ ID NO: 17. Данная нуклеиновая кислота дикого типа используется в качестве контроля.
Дополнительно с целью повышения эффективности экспрессии природная последовательность гена фактора свертывания крови IX была модифицирована с помощью алгоритма кодон-оптимизации.
В результате кодон-оптимизации нуклеиновой кислоты дикого типа фактора свертывания крови IX с нуклеотидной последовательностью SEQ ID NO: 17 был получен ряд кодон-оптимизированных нуклеиновых кислот, которые были в дальнейшем протестированы на уровень экспрессии белка фактора свертывания крови IX и его активности по сравнению с контролем (нуклеиновая кислота дикого типа с SEQ ID NO: 17) в составе препарата на основе AAV5.
Все кодон-оптимизированные нуклеиновые кислоты показали увеличение уровня продукции белка фактора свертывания крови IX по сравнению с диким типом, при этом большинство кодон-оптимизированных нуклеиновых кислот показали незначительное увеличение уровня продукции белка фактора свертывания крови IX по сравнению с диким типом и только два кодон-оптимизированных варианта нуклеиновой кислоты по изобретению с нуклеотидной последовательностью SEQ ID NO: 2 (hFIXco-v1) и SEQ ID NO: 4 (hFIXco-v2) неожиданно показали самый лучший показатель, а именно увеличение уровня экспрессии гена фактора свертывания крови IX и увеличение уровня продукции белка фактора свертывания крови IX в несколько раз, что, в свою очередь, приводило к увеличению активности препарата на основе AAV5, который содержал SEQ ID NO: 2 (hFIXco-v1) или SEQ ID NO: 4 (hFIXco-v2) (см Примеры 2, 3 и 4).
Кодон-оптимизированные нуклеиновые кислоты с нуклеотидными последовательностями SEQ ID NO: 2 и SEQ ID NO: 4 характеризуется повышенным индексом адаптации кодонов (стандартная метрика для оценки последовательности на предмет частот использованных кодонов) для клеток млекопитающих по сравнению с нуклеиновой кислотой дикого типа с нуклеотидой последовательностью SEQIDNO: 17.
Кодон-оптимизированные нуклеиновые кислоты с нуклеотидными последовательностями SEQ ID NO: 2 и SEQ ID NO: 4 обозначаются далее в примерах, соответственно, как hFIXco-v1 и hFIXco-v2.
Пример 2. Сборка генетической конструкции, содержащей экспрессионную кассету AAV с вариантами рекомбинантного кодон-оптимизированого гена фактора свертывания крови IX (hFIXco-v1 и hFIXco-v2).
Целевые плазмиды pAAV-hFIXco-v1 или pAAV-hFIXco-v2 (Фиг. 1.), предназначенные для получения вирусных векторов AAV5 с экспрессионной кассетой, включающей кодон-оптимизированный вариант гена фактора свертывания крови IX (SEQ ID NO: 2 или SEQ ID NO: 4), были получены путем последовательной замены последовательности модифицированного зеленого флуоресцентного белка и промотора CMV в исходной конструкции pAAV-GFP с помощью рестриктазно-лигазного метода клонирования на кодон-оптимизированные последовательности гена фактора свертывания крови IX и промотора TTR соответственно, синтезированные de novo из олигонуклеотидов, созданных путем химического синтеза.
Конечный вектор содержит все необходимые элементы для экспрессии гена и сборки в составе генома рекомбинантного AAV:
1) терминальные повторы ITR на концах последовательности, которая инкапсидируется в вирусный капсид;
2) элементы для экспрессии целевого гена (промотор, энхансер, интрон, последовательность Kozak, трансген, сайт полиаденилирования);
3) ориджин бактериальной репликации и ген устойчивости к антибиотику для наработки плазмидной ДНК в бактериальных клетках.
Пример 3. Создание вирусных препаратов, экспрессирующих фактор свертывания крови IX
Целевые плазмиды pAAV-hFIXco-v1 и pAAV-hFIXco-v2 (Фиг 1.) вместе с остальными плазмидами, необходимыми для получения вирусных частиц рекомбинантного AAV (см. выше), были использованы для наработки препаратов AAV5-hFIXco-v1 и AAV5-hFIXco-v2, несущих, соответственно, кодон-оптимизированные версии гена фактора свертывания крови IX (hFIXco-v1 и hFIXco-v2). В результате биопроцесса были получены рекомбинантные вирусные частицы AAV5-hFIXco-v1 и AAV5-hFIXco-v2, содержащие экспрессионные кассеты с кодон-оптимизированнымм вариантами гена фактора свертывания крови IX (hFIXco-v1 и hFIXco-v2). Очищенные препараты AAV5-hFIXco-v1 и AAV5-hFIXco-v2, используемые для проведения in vitro и in vivo исследований были подготовлены с применением стандартным буферов и эксципиентов, которые являются безопасными и не изменяют свойств AAV. В качестве препарата сравнения с использованием описанной выше технологии был наработан препарат AAV5-hFIX-wt, содержащие экспрессионную кассету с природным геном фактора свертывания крови IX (ген дикого типа, включающий природную мутацию R338L, см. Пример 1).
Пример 4. Проверка работоспособности препаратов AAV5-hFIXco-v1 и AAV5-hFIXco-v2 in vitro
Перед проведением исследований на животных очищенные препараты AAV5-hFIXco-v1 и AAV5-hFIXco-v2 был протестированы in vitro. Данные эксперименты были проведены с использованием адгезионной клеточной линии HUH7 (Фиг 2 и 3). В лунки 12-луночных планшетов были посеяны клетки линии с плотностью 10000 кл/см2. После прикрепления клеток к адгезивной подложке, вносились препараты AAV при MOI 500000 вг/кл. На 7 день после трансдукции определяли содержание белка FIX и его активность в культуральной жидкости методом ИФА, а также уровень экспрессии гена фактора свертывания крови IX в клетках методом количественной ПЦР с обратной транскрипцией, как описано выше. Все образцы были поставлены в трипликатах. Для негативного контроля были использованы интактные клетки.
Было показано, что разработанные нами препараты AAV5-hFIXco-v1 и AAV5-hFIXco-v2, несущие кодон-оптимизированные версии гена фактора свертывания крови IX [hFIXco-v1 и hFIXco-v1), позволяют эффективно доставить трансген фактора свертывания крови IX в клетки и обеспечить продукцию целевого белка, что подтверждается данными количественной ПЦР в реальном времени, ИФА и анализом активности белка фактора свертывания крови IX (Фиг 2 и 3.). Так при использовании препаратов AAV5-hFIXco-v1 и AAV5-hFIXco-v2, содержащих кодон-оптимизированную последовательность гена фактора свертывания крови IX наблюдается уровень экспрессии гена фактора свертывания крови IX в 1.8 раз выше в случае препарата AAV5-hFIXco-v1 и в 2.8 раз выше в случае препарата AAV5-hFIXco-v2 по сравнению с использованием препарата с природной версией гена фактора свертывания крови IX (AAV5-hFIX-wt) (Фиг 2). Кроме того, при использовании препаратов AAV5-hFIXco-v1 и AAV5-hFIXco-v2, содержащих кодон-оптимизированную последовательность гена фактора свертывания крови IX наблюдается уровень продукции белка фактора свертывания крови IX в 1.6 раз выше в случае препарата AAV5-hFLXco-v1 и в 2.1 раза выше в случае препарата AAV5-hFIXco-v2 по сравнению с использованием препарата с природной версией гена фактора свертывания крови IX (AAV5-hFIX-wt) (Фиг. 3А). Также важно отметить, что при использовании препаратов AAV5-hFIXco-v1 и AAV5-hFIXco-v2, содержащих кодон-оптимизированную последовательность гена фактора свертывания крови IX, наблюдается уровень активности белка фактора свертывания крови IX в 2.1 раза выше в случае препарата AAV5-hFIXco-v1 и в 2.9 раза выше в случае препарата AAV5-hFIXco-v2 по сравнению с использованием препарата с природной версией гена фактора свертывания крови IX (AAV5-hFIX-wt) (Фиг. 3Б).
Пример 5. Проверка работоспособности препарата AAV5-hFIXco-v1 и AAV5-hFIXco-v2 in vivo
Для проведения in vivo исследований препаратов AAV5-hFIXco-v1 и AAV5-hFIXco-v2 были использованы лабораторные мыши линии C57BL/6. В исследовании использовали дозу AAV препаратов равную 4×1011 VG/мышь. В качестве негативного контроля был использованы контрольный раствор без AAV. Препараты вводили животным однократно путем внутривенного введения в хвостовую вену. Отбор плазмы крови производился в день инъекции до введения препаратов, далее - на 7, 14, 21, 28, 35 и 42 дни после введения препаратов. В образцах плазмы крови определяли уровень белка фактора свертывания крови IX методом ИФА, как было описано выше.
В результате проведенных in vivo исследований было показано, что в случае использования препарата AAV5-hFIXco-v1, содержащего кодон-оптимизированную последовательность гена фактора свертывания крови IX hFIXco-v1, наблюдается достоверно более высокий уровень белка фактора свертывания крови IX в крови животных (в 2.2-2.3 раза) на 21 и 28 дни после введения препарата, чем в случае использования препарата с природной версией гена фактора свертывания крови IX (AAV5-hFIX-wt) (Фиг 4А). В случае использования препарата AAV5-hFIXco-v2, содержащего кодон-оптимизированную последовательность гена фактора свертывания крови IX hFIXco-v2, наблюдается достоверно более высокий уровень белка фактора свертывания крови IX в крови животных (в 1.8-2.5 раза) на 14, 21, 28, 35 и 42 дни после введения препарата, чем в случае использования препарата с природной версией гена фактора свертывания крови FIX (AAV5-hFIX-vvt) (Фиг 4А).
Таким образом, разработанные рекомбинантный вирусы на основе AAV5, несущие кодон-оптимизированные версии гена фактора свертывания крови IX (AAV5-hFIXco-v1 или AAV5-hFIXco-v2) обладают преимуществом по сравнению с вектором AAV5 с природной версией гена фактора свертывания крови IX и обладают высоким потенциалом для генной терапии Гемофилии В
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ООО "АНАБИОН"
<120> Кодон-оптимизированная нуклеиновая кислота, которая кодирует белок
фактора свёртывания крови IX, и ее применение
<160> 17
<170> BiSSAP 1.3.6
<210> 1
<211> 461
<212> PRT
<213> Природная последовательность
<220>
<223> Аминокислотная последовательность рекомбинантного белка фактора
свёртывания крови IX с мутацией R338L
<400> 1
Met Gln Arg Val Asn Met Ile Met Ala Glu Ser Pro Gly Leu Ile Thr
1 5 10 15
Ile Cys Leu Leu Gly Tyr Leu Leu Ser Ala Glu Cys Thr Val Phe Leu
20 25 30
Asp His Glu Asn Ala Asn Lys Ile Leu Asn Arg Pro Lys Arg Tyr Asn
35 40 45
Ser Gly Lys Leu Glu Glu Phe Val Gln Gly Asn Leu Glu Arg Glu Cys
50 55 60
Met Glu Glu Lys Cys Ser Phe Glu Glu Ala Arg Glu Val Phe Glu Asn
65 70 75 80
Thr Glu Arg Thr Thr Glu Phe Trp Lys Gln Tyr Val Asp Gly Asp Gln
85 90 95
Cys Glu Ser Asn Pro Cys Leu Asn Gly Gly Ser Cys Lys Asp Asp Ile
100 105 110
Asn Ser Tyr Glu Cys Trp Cys Pro Phe Gly Phe Glu Gly Lys Asn Cys
115 120 125
Glu Leu Asp Val Thr Cys Asn Ile Lys Asn Gly Arg Cys Glu Gln Phe
130 135 140
Cys Lys Asn Ser Ala Asp Asn Lys Val Val Cys Ser Cys Thr Glu Gly
145 150 155 160
Tyr Arg Leu Ala Glu Asn Gln Lys Ser Cys Glu Pro Ala Val Pro Phe
165 170 175
Pro Cys Gly Arg Val Ser Val Ser Gln Thr Ser Lys Leu Thr Arg Ala
180 185 190
Glu Thr Val Phe Pro Asp Val Asp Tyr Val Asn Ser Thr Glu Ala Glu
195 200 205
Thr Ile Leu Asp Asn Ile Thr Gln Ser Thr Gln Ser Phe Asn Asp Phe
210 215 220
Thr Arg Val Val Gly Gly Glu Asp Ala Lys Pro Gly Gln Phe Pro Trp
225 230 235 240
Gln Val Val Leu Asn Gly Lys Val Asp Ala Phe Cys Gly Gly Ser Ile
245 250 255
Val Asn Glu Lys Trp Ile Val Thr Ala Ala His Cys Val Glu Thr Gly
260 265 270
Val Lys Ile Thr Val Val Ala Gly Glu His Asn Ile Glu Glu Thr Glu
275 280 285
His Thr Glu Gln Lys Arg Asn Val Ile Arg Ile Ile Pro His His Asn
290 295 300
Tyr Asn Ala Ala Ile Asn Lys Tyr Asn His Asp Ile Ala Leu Leu Glu
305 310 315 320
Leu Asp Glu Pro Leu Val Leu Asn Ser Tyr Val Thr Pro Ile Cys Ile
325 330 335
Ala Asp Lys Glu Tyr Thr Asn Ile Phe Leu Lys Phe Gly Ser Gly Tyr
340 345 350
Val Ser Gly Trp Gly Arg Val Phe His Lys Gly Arg Ser Ala Leu Val
355 360 365
Leu Gln Tyr Leu Arg Val Pro Leu Val Asp Arg Ala Thr Cys Leu Leu
370 375 380
Ser Thr Lys Phe Thr Ile Tyr Asn Asn Met Phe Cys Ala Gly Phe His
385 390 395 400
Glu Gly Gly Arg Asp Ser Cys Gln Gly Asp Ser Gly Gly Pro His Val
405 410 415
Thr Glu Val Glu Gly Thr Ser Phe Leu Thr Gly Ile Ile Ser Trp Gly
420 425 430
Glu Glu Cys Ala Met Lys Gly Lys Tyr Gly Ile Tyr Thr Lys Val Ser
435 440 445
Arg Tyr Val Asn Trp Ile Lys Glu Lys Thr Lys Leu Thr
450 455 460
<210> 2
<211> 1383
<212> DNA
<213> Искусственная последовательность
<220>
<223> Кодон-оптимизированная нуклеиновая кислота, кодирующая
рекомбинантный фактор свёртывания крови IX (вариант hFIXco-v1)
<400> 2
atgcagcggg tcaacatgat catggcggag tcgccgggcc tgatcacgat ctgcctcctc 60
gggtacctgc tctccgccga gtgcaccgtg ttcctggacc acgagaacgc caacaagatc 120
ctcaaccggc ccaagcgcta caactccggc aagctggagg agttcgtgca ggggaacctc 180
gagcgcgagt gcatggagga gaagtgctcg ttcgaggagg cgcgggaggt gttcgagaac 240
accgagcgca ccacggagtt ctggaagcag tacgtggacg gggaccagtg cgagtcgaac 300
ccgtgcctca acggggggtc gtgcaaggac gacatcaact cgtacgagtg ctggtgcccc 360
ttcggcttcg agggcaagaa ctgcgagctg gacgtgacct gcaacatcaa gaacgggcgc 420
tgcgagcagt tctgcaagaa cagcgccgac aacaaggtgg tctgctcctg caccgagggg 480
taccgcctcg cggagaacca gaagtcctgc gagccggccg tgcccttccc ctgcggccgc 540
gtgtccgtca gccagacgtc gaagctgacg cgcgccgaga ccgtcttccc ggacgtggac 600
tacgtgaact cgacggaggc cgagaccatc ctggacaaca tcacccagag cacccagtcc 660
ttcaacgact tcacgcgggt ggtcggcggc gaggacgcca agcccgggca gttcccgtgg 720
caggtcgtcc tcaacgggaa ggtcgacgcg ttctgcggcg ggagcatcgt gaacgagaag 780
tggatcgtga ccgccgcgca ctgcgtcgag acgggcgtga agatcaccgt ggtggccggg 840
gagcacaaca tcgaggagac ggagcacacc gagcagaagc ggaacgtgat ccgcatcatc 900
ccgcaccaca actacaacgc cgccatcaac aagtacaacc acgacatcgc gctcctcgag 960
ctggacgagc cgctggtcct caactcctac gtcacgccga tctgcatcgc cgacaaggag 1020
tacacgaaca tcttcctgaa gttcgggagc ggctacgtct cgggctgggg ccgcgtgttc 1080
cacaaggggc gcagcgcgct cgtgctccag tacctgcggg tccccctggt cgaccgcgcg 1140
acctgcctcc tctccacgaa gttcacgatc tacaacaaca tgttctgcgc ggggttccac 1200
gagggcggcc gggacagctg ccagggcgac agcgggggcc cgcacgtgac ggaggtggag 1260
ggcacgagct tcctgaccgg gatcatctcg tggggcgagg agtgcgcgat gaaggggaag 1320
tacggcatct acaccaaggt cagccggtac gtgaactgga tcaaggagaa gacgaagctg 1380
acg 1383
<210> 3
<211> 3122
<212> DNA
<213> Искусственная последовательность
<220>
<223> экспрессионная кассета с кодон-оптимизированным геном
рекомбинантного фактора свёртывания крови IX (вариант
AAV5-hFIXco-v1)
<400> 3
cctgcaggca gctgcgcgct cgctcgctca ctgaggccgc ccgggcgtcg ggcgaccttt 60
ggtcgcccgg cctcagtgag cgagcgagcg cgcagagagg gagtggccaa ctccatcact 120
aggggttcct gcggccgcac gcgtgccgcc accatggtcg agcttgggct gcaggtcgag 180
ggcactggga ggatgttgag taagatggaa aactactgat gacccttgca gagacagagt 240
attaggacat gtttgaacag gggccggcga tcagcaggta gctctagagg atccccgtct 300
gtctgcacat ttcgtagagc gagtgttccg atactctaat ctccctaggc aaggttcata 360
tttgtgtagg ttacttattc tccttttgtt gactaagtca ataatcagaa tcagcaggtt 420
tggagtcagc ttggcaggga tcagcagcct gggttggaag gagggggtat aaaagcccct 480
tcaccaggag aagccgtcac acagatccac aagctcctga caggaagctc taggtgactc 540
tcttaaggta gcctccgcgg attcgaatcc cggccgggaa cggtgcattg gaacgcggat 600
tccccgtgcc aagagtgacg taagtaccgc ctatagagtc tataggccca caaaaaatgc 660
tttcttcttt taatatactt ttttgtttat cttatttcta atactttccc taatctcttt 720
ctttcagggc aataatgata caatgtatca tgcctctttg caccattcta aagaataaca 780
gtgataattt ctgggttaag gcaatagcaa tatttctgca tataaatatt tctgcatata 840
aattgtaact gatgtaagag gtttcatatt gctaatagca gctacaatcc agctaccatt 900
ctgcttttat tttatggttg ggataaggct ggattattct gagtccaagc taggcccttt 960
tgctaatcat gttcatacct cttatcttcc tcccacagct cctgggcaac gtgctggtct 1020
gtgtgctggc ccatcacttt ggcaaagaat tgggattcga acatcgatat gcagcgggtc 1080
aacatgatca tggcggagtc gccgggcctg atcacgatct gcctcctcgg gtacctgctc 1140
tccgccgagt gcaccgtgtt cctggaccac gagaacgcca acaagatcct caaccggccc 1200
aagcgctaca actccggcaa gctggaggag ttcgtgcagg ggaacctcga gcgcgagtgc 1260
atggaggaga agtgctcgtt cgaggaggcg cgggaggtgt tcgagaacac cgagcgcacc 1320
acggagttct ggaagcagta cgtggacggg gaccagtgcg agtcgaaccc gtgcctcaac 1380
ggggggtcgt gcaaggacga catcaactcg tacgagtgct ggtgcccctt cggcttcgag 1440
ggcaagaact gcgagctgga cgtgacctgc aacatcaaga acgggcgctg cgagcagttc 1500
tgcaagaaca gcgccgacaa caaggtggtc tgctcctgca ccgaggggta ccgcctcgcg 1560
gagaaccaga agtcctgcga gccggccgtg cccttcccct gcggccgcgt gtccgtcagc 1620
cagacgtcga agctgacgcg cgccgagacc gtcttcccgg acgtggacta cgtgaactcg 1680
acggaggccg agaccatcct ggacaacatc acccagagca cccagtcctt caacgacttc 1740
acgcgggtgg tcggcggcga ggacgccaag cccgggcagt tcccgtggca ggtcgtcctc 1800
aacgggaagg tcgacgcgtt ctgcggcggg agcatcgtga acgagaagtg gatcgtgacc 1860
gccgcgcact gcgtcgagac gggcgtgaag atcaccgtgg tggccgggga gcacaacatc 1920
gaggagacgg agcacaccga gcagaagcgg aacgtgatcc gcatcatccc gcaccacaac 1980
tacaacgccg ccatcaacaa gtacaaccac gacatcgcgc tcctcgagct ggacgagccg 2040
ctggtcctca actcctacgt cacgccgatc tgcatcgccg acaaggagta cacgaacatc 2100
ttcctgaagt tcgggagcgg ctacgtctcg ggctggggcc gcgtgttcca caaggggcgc 2160
agcgcgctcg tgctccagta cctgcgggtc cccctggtcg accgcgcgac ctgcctcctc 2220
tccacgaagt tcacgatcta caacaacatg ttctgcgcgg ggttccacga gggcggccgg 2280
gacagctgcc agggcgacag cgggggcccg cacgtgacgg aggtggaggg cacgagcttc 2340
ctgaccggga tcatctcgtg gggcgaggag tgcgcgatga aggggaagta cggcatctac 2400
accaaggtca gccggtacgt gaactggatc aaggagaaga cgaagctgac gtgatgaaga 2460
tctacgggtg gcatccctgt gacccctccc cagtgcccct cctggccctg gaagttgcca 2520
ctccagtgcc caccagcctt gtcctaataa aattaagttg catcattttg tctgactagg 2580
tgtccttcta taatattatg gggtggaggg gggtggtatg gagcaagggg caagttggga 2640
agacaacctg tagggcctgc ggggtctatt gggaaccaag ctggagtgca gtggcacaat 2700
cttggctcac tgcaatctcc gcctcctggg ttcaagcgat tctcctgcct cagcctcccg 2760
agttgttggg attccaggca tgcatgacca ggctcagcta atttttgttt ttttggtaga 2820
gacggggttt caccatattg gccaggctgg tctccaactc ctaatctcag gtgatctacc 2880
caccttggcc tcccaaattg ctgggattac aggcgtgaac cactgctccc ttccctgtcc 2940
ttctgatttt gtaggtaacc acgtgcggac cgagcggccg caggaacccc tagtgatgga 3000
gttggccact ccctctctgc gcgctcgctc gctcactgag gccgggcgac caaaggtcgc 3060
ccgacgcccg ggctttgccc gggcggcctc agtgagcgag cgagcgcgca gctgcctgca 3120
gg 3122
<210> 4
<211> 1383
<212> DNA
<213> Искусственная последовательность
<220>
<223> Кодон-оптимизированная нуклеиновая кислота, кодирующая
рекомбинантный фактора свёртывания крови IX (вариант hFIXco-v2)
<400> 4
atgcagcggg tgaacatgat catggccgag tccccaggcc tgattaccat ctgtctgctg 60
ggctacctgc tgagcgccga atgcaccgtg tttctggacc acgagaacgc caacaagatc 120
ctgaaccgcc ctaagcggta caactccggc aagctggagg agtttgtgca gggcaatctg 180
gagcgggagt gtatggagga gaagtgcagc ttcgaggagg ccagggaggt gttcgagaac 240
accgagagga ccaccgagtt ctggaagcag tatgtggacg gcgaccagtg cgagtctaat 300
ccttgtctga atggcgggag ctgcaaggac gacatcaaca gctacgagtg ctggtgccct 360
ttcggcttcg agggcaagaa ttgcgagctg gacgtgacct gcaacatcaa gaacggccgg 420
tgtgagcagt tctgcaagaa cagcgccgac aacaaggtgg tgtgctcctg caccgaggga 480
tacaggctgg ccgagaatca gaagagctgt gagcccgccg tgccattccc ctgtggcaga 540
gtgtctgtga gccagaccag caagctgacc agagccgaga ccgtgtttcc agacgtggac 600
tacgtgaaca gcaccgaggc cgagaccatc ctggataata tcacccagtc cacccagagc 660
ttcaacgact tcaccagagt ggtgggaggc gaggatgcca agccaggaca gtttccctgg 720
caggtggtgc tgaatggcaa ggtggacgcc ttctgcggag gcagcatcgt gaacgagaag 780
tggattgtga ccgcagccca ctgcgtggag actggcgtga agattaccgt ggtcgccggc 840
gagcacaata tcgaagagac cgagcacacc gagcagaagc gcaacgtgat ccggatcatc 900
cctcaccaca actacaacgc agccatcaac aagtacaacc acgacatcgc cctgctggag 960
ctggacgagc cactggtgct gaactcttac gtgaccccta tctgcatcgc cgacaaggag 1020
tacaccaaca tcttcctgaa gttcggcagc ggctacgtga gcggatgggg cagagtgttt 1080
cacaagggca ggagcgccct ggtgctgcag tatctgagag tgccactggt ggacagagct 1140
acctgcctgc tgagcaccaa gttcaccatc tacaacaaca tgttctgcgc cggcttccac 1200
gaggggggaa gagactcttg ccagggcgat tccggcggac cacacgtgac cgaagtggag 1260
ggcaccagct tcctgaccgg catcatctcc tggggcgagg aatgcgccat gaagggcaag 1320
tacggcatct acaccaaggt gagcaggtac gtgaactgga tcaaggagaa gaccaagctg 1380
acc 1383
<210> 5
<211> 3123
<212> DNA
<213> Искусственная последовательность
<220>
<223> экспрессионная кассета с кодон-оптимизированным геном
рекомбинантного фактора свёртывания крови IX (вариант
AAV5-hFIXco-v2)
<400> 5
cctgcaggca gctgcgcgct cgctcgctca ctgaggccgc ccgggcgtcg ggcgaccttt 60
ggtcgcccgg cctcagtgag cgagcgagcg cgcagagagg gagtggccaa ctccatcact 120
aggggttcct gcggccgcac gcgtgccgcc accatggtcg agcttgggct gcaggtcgag 180
ggcactggga ggatgttgag taagatggaa aactactgat gacccttgca gagacagagt 240
attaggacat gtttgaacag gggccggcga tcagcaggta gctctagagg atccccgtct 300
gtctgcacat ttcgtagagc gagtgttccg atactctaat ctccctaggc aaggttcata 360
tttgtgtagg ttacttattc tccttttgtt gactaagtca ataatcagaa tcagcaggtt 420
tggagtcagc ttggcaggga tcagcagcct gggttggaag gagggggtat aaaagcccct 480
tcaccaggag aagccgtcac acagatccac aagctcctga caggaagctc taggtgactc 540
tcttaaggta gcctccgcgg attcgaatcc cggccgggaa cggtgcattg gaacgcggat 600
tccccgtgcc aagagtgacg taagtaccgc ctatagagtc tataggccca caaaaaatgc 660
tttcttcttt taatatactt ttttgtttat cttatttcta atactttccc taatctcttt 720
ctttcagggc aataatgata caatgtatca tgcctctttg caccattcta aagaataaca 780
gtgataattt ctgggttaag gcaatagcaa tatttctgca tataaatatt tctgcatata 840
aattgtaact gatgtaagag gtttcatatt gctaatagca gctacaatcc agctaccatt 900
ctgcttttat tttatggttg ggataaggct ggattattct gagtccaagc taggcccttt 960
tgctaatcat gttcatacct cttatcttcc tcccacagct cctgggcaac gtgctggtct 1020
gtgtgctggc ccatcacttt ggcaaagaat tgggattcga acatcgatat aaatgcagcg 1080
ggtgaacatg atcatggccg agtccccagg cctgattacc atctgtctgc tgggctacct 1140
gctgagcgcc gaatgcaccg tgtttctgga ccacgagaac gccaacaaga tcctgaaccg 1200
ccctaagcgg tacaactccg gcaagctgga ggagtttgtg cagggcaatc tggagcggga 1260
gtgtatggag gagaagtgca gcttcgagga ggccagggag gtgttcgaga acaccgagag 1320
gaccaccgag ttctggaagc agtatgtgga cggcgaccag tgcgagtcta atccttgtct 1380
gaatggcggg agctgcaagg acgacatcaa cagctacgag tgctggtgcc ctttcggctt 1440
cgagggcaag aattgcgagc tggacgtgac ctgcaacatc aagaacggcc ggtgtgagca 1500
gttctgcaag aacagcgccg acaacaaggt ggtgtgctcc tgcaccgagg gatacaggct 1560
ggccgagaat cagaagagct gtgagcccgc cgtgccattc ccctgtggca gagtgtctgt 1620
gagccagacc agcaagctga ccagagccga gaccgtgttt ccagacgtgg actacgtgaa 1680
cagcaccgag gccgagacca tcctggataa tatcacccag tccacccaga gcttcaacga 1740
cttcaccaga gtggtgggag gcgaggatgc caagccagga cagtttccct ggcaggtggt 1800
gctgaatggc aaggtggacg ccttctgcgg aggcagcatc gtgaacgaga agtggattgt 1860
gaccgcagcc cactgcgtgg agactggcgt gaagattacc gtggtcgccg gcgagcacaa 1920
tatcgaagag accgagcaca ccgagcagaa gcgcaacgtg atccggatca tccctcacca 1980
caactacaac gcagccatca acaagtacaa ccacgacatc gccctgctgg agctggacga 2040
gccactggtg ctgaactctt acgtgacccc tatctgcatc gccgacaagg agtacaccaa 2100
catcttcctg aagttcggca gcggctacgt gagcggatgg ggcagagtgt ttcacaaggg 2160
caggagcgcc ctggtgctgc agtatctgag agtgccactg gtggacagag ctacctgcct 2220
gctgagcacc aagttcacca tctacaacaa catgttctgc gccggcttcc acgagggggg 2280
aagagactct tgccagggcg attccggcgg accacacgtg accgaagtgg agggcaccag 2340
cttcctgacc ggcatcatct cctggggcga ggaatgcgcc atgaagggca agtacggcat 2400
ctacaccaag gtgagcaggt acgtgaactg gatcaaggag aagaccaagc tgacctgaag 2460
atctacgggt ggcatccctg tgacccctcc ccagtgcccc tcctggccct ggaagttgcc 2520
actccagtgc ccaccagcct tgtcctaata aaattaagtt gcatcatttt gtctgactag 2580
gtgtccttct ataatattat ggggtggagg ggggtggtat ggagcaaggg gcaagttggg 2640
aagacaacct gtagggcctg cggggtctat tgggaaccaa gctggagtgc agtggcacaa 2700
tcttggctca ctgcaatctc cgcctcctgg gttcaagcga ttctcctgcc tcagcctccc 2760
gagttgttgg gattccaggc atgcatgacc aggctcagct aatttttgtt tttttggtag 2820
agacggggtt tcaccatatt ggccaggctg gtctccaact cctaatctca ggtgatctac 2880
ccaccttggc ctcccaaatt gctgggatta caggcgtgaa ccactgctcc cttccctgtc 2940
cttctgattt tgtaggtaac cacgtgcgga ccgagcggcc gcaggaaccc ctagtgatgg 3000
agttggccac tccctctctg cgcgctcgct cgctcactga ggccgggcga ccaaaggtcg 3060
cccgacgccc gggctttgcc cgggcggcct cagtgagcga gcgagcgcgc agctgcctgc 3120
agg 3123
<210> 6
<211> 130
<212> DNA
<213> Искусственная последовательность
<220>
<223> Левый (первый) ITR (инвертированные концевые повторы)
<400> 6
cctgcaggca gctgcgcgct cgctcgctca ctgaggccgc ccgggcgtcg ggcgaccttt 60
ggtcgcccgg cctcagtgag cgagcgagcg cgcagagagg gagtggccaa ctccatcact 120
aggggttcct 130
<210> 7
<211> 372
<212> DNA
<213> Природная последовательность
<220>
<223> последовательность TTR промотора (промотор транстиретина)
<400> 7
tcgagcttgg gctgcaggtc gagggcactg ggaggatgtt gagtaagatg gaaaactact 60
gatgaccctt gcagagacag agtattagga catgtttgaa caggggccgg cgatcagcag 120
gtagctctag aggatccccg tctgtctgca catttcgtag agcgagtgtt ccgatactct 180
aatctcccta ggcaaggttc atatttgtgt aggttactta ttctcctttt gttgactaag 240
tcaataatca gaatcagcag gtttggagtc agcttggcag ggatcagcag cctgggttgg 300
aaggaggggg tataaaagcc ccttcaccag gagaagccgt cacacagatc cacaagctcc 360
tgacaggaag ct 372
<210> 8
<211> 493
<212> DNA
<213> Природная последовательность
<220>
<223> интрон гена hBG1 (фрагмент гена β глобина человека, несущий
интрон)
<400> 8
cgaatcccgg ccgggaacgg tgcattggaa cgcggattcc ccgtgccaag agtgacgtaa 60
gtaccgccta tagagtctat aggcccacaa aaaatgcttt cttcttttaa tatacttttt 120
tgtttatctt atttctaata ctttccctaa tctctttctt tcagggcaat aatgatacaa 180
tgtatcatgc ctctttgcac cattctaaag aataacagtg ataatttctg ggttaaggca 240
atagcaatat ttctgcatat aaatatttct gcatataaat tgtaactgat gtaagaggtt 300
tcatattgct aatagcagct acaatccagc taccattctg cttttatttt atggttggga 360
taaggctgga ttattctgag tccaagctag gcccttttgc taatcatgtt catacctctt 420
atcttcctcc cacagctcct gggcaacgtg ctggtctgtg tgctggccca tcactttggc 480
aaagaattgg gat 493
<210> 9
<211> 479
<212> DNA
<213> Природная последовательность
<220>
<223> сигнал полиаденилирования hGH1 (сигнал полиаденилирования гена
гормона роста человека)
<400> 9
acgggtggca tccctgtgac ccctccccag tgcccctcct ggccctggaa gttgccactc 60
cagtgcccac cagccttgtc ctaataaaat taagttgcat cattttgtct gactaggtgt 120
ccttctataa tattatgggg tggagggggg tggtatggag caaggggcaa gttgggaaga 180
caacctgtag ggcctgcggg gtctattggg aaccaagctg gagtgcagtg gcacaatctt 240
ggctcactgc aatctccgcc tcctgggttc aagcgattct cctgcctcag cctcccgagt 300
tgttgggatt ccaggcatgc atgaccaggc tcagctaatt tttgtttttt tggtagagac 360
ggggtttcac catattggcc aggctggtct ccaactccta atctcaggtg atctacccac 420
cttggcctcc caaattgctg ggattacagg cgtgaaccac tgctcccttc cctgtcctt 479
<210> 10
<211> 141
<212> DNA
<213> Искусственная последовательность
<220>
<223> правый (второй) ITR
<400> 10
aggaacccct agtgatggag ttggccactc cctctctgcg cgctcgctcg ctcactgagg 60
ccgggcgacc aaaggtcgcc cgacgcccgg gctttgcccg ggcggcctca gtgagcgagc 120
gagcgcgcag ctgcctgcag g 141
<210> 11
<211> 724
<212> PRT
<213> Природная последовательность
<220>
<223> Природная последовательность белка VP1 капсида AAV5 дикого типа
<400> 11
Met Ser Phe Val Asp His Pro Pro Asp Trp Leu Glu Glu Val Gly Glu
1 5 10 15
Gly Leu Arg Glu Phe Leu Gly Leu Glu Ala Gly Pro Pro Lys Pro Lys
20 25 30
Pro Asn Gln Gln His Gln Asp Gln Ala Arg Gly Leu Val Leu Pro Gly
35 40 45
Tyr Asn Tyr Leu Gly Pro Gly Asn Gly Leu Asp Arg Gly Glu Pro Val
50 55 60
Asn Arg Ala Asp Glu Val Ala Arg Glu His Asp Ile Ser Tyr Asn Glu
65 70 75 80
Gln Leu Glu Ala Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala Asp
85 90 95
Ala Glu Phe Gln Glu Lys Leu Ala Asp Asp Thr Ser Phe Gly Gly Asn
100 105 110
Leu Gly Lys Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro Phe
115 120 125
Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Thr Gly Lys Arg Ile
130 135 140
Asp Asp His Phe Pro Lys Arg Lys Lys Ala Arg Thr Glu Glu Asp Ser
145 150 155 160
Lys Pro Ser Thr Ser Ser Asp Ala Glu Ala Gly Pro Ser Gly Ser Gln
165 170 175
Gln Leu Gln Ile Pro Ala Gln Pro Ala Ser Ser Leu Gly Ala Asp Thr
180 185 190
Met Ser Ala Gly Gly Gly Gly Pro Leu Gly Asp Asn Asn Gln Gly Ala
195 200 205
Asp Gly Val Gly Asn Ala Ser Gly Asp Trp His Cys Asp Ser Thr Trp
210 215 220
Met Gly Asp Arg Val Val Thr Lys Ser Thr Arg Thr Trp Val Leu Pro
225 230 235 240
Ser Tyr Asn Asn His Gln Tyr Arg Glu Ile Lys Ser Gly Ser Val Asp
245 250 255
Gly Ser Asn Ala Asn Ala Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr
260 265 270
Phe Asp Phe Asn Arg Phe His Ser His Trp Ser Pro Arg Asp Trp Gln
275 280 285
Arg Leu Ile Asn Asn Tyr Trp Gly Phe Arg Pro Arg Ser Leu Arg Val
290 295 300
Lys Ile Phe Asn Ile Gln Val Lys Glu Val Thr Val Gln Asp Ser Thr
305 310 315 320
Thr Thr Ile Ala Asn Asn Leu Thr Ser Thr Val Gln Val Phe Thr Asp
325 330 335
Asp Asp Tyr Gln Leu Pro Tyr Val Val Gly Asn Gly Thr Glu Gly Cys
340 345 350
Leu Pro Ala Phe Pro Pro Gln Val Phe Thr Leu Pro Gln Tyr Gly Tyr
355 360 365
Ala Thr Leu Asn Arg Asp Asn Thr Glu Asn Pro Thr Glu Arg Ser Ser
370 375 380
Phe Phe Cys Leu Glu Tyr Phe Pro Ser Lys Met Leu Arg Thr Gly Asn
385 390 395 400
Asn Phe Glu Phe Thr Tyr Asn Phe Glu Glu Val Pro Phe His Ser Ser
405 410 415
Phe Ala Pro Ser Gln Asn Leu Phe Lys Leu Ala Asn Pro Leu Val Asp
420 425 430
Gln Tyr Leu Tyr Arg Phe Val Ser Thr Asn Asn Thr Gly Gly Val Gln
435 440 445
Phe Asn Lys Asn Leu Ala Gly Arg Tyr Ala Asn Thr Tyr Lys Asn Trp
450 455 460
Phe Pro Gly Pro Met Gly Arg Thr Gln Gly Trp Asn Leu Gly Ser Gly
465 470 475 480
Val Asn Arg Ala Ser Val Ser Ala Phe Ala Thr Thr Asn Arg Met Glu
485 490 495
Leu Glu Gly Ala Ser Tyr Gln Val Pro Pro Gln Pro Asn Gly Met Thr
500 505 510
Asn Asn Leu Gln Gly Ser Asn Thr Tyr Ala Leu Glu Asn Thr Met Ile
515 520 525
Phe Asn Ser Gln Pro Ala Asn Pro Gly Thr Thr Ala Thr Tyr Leu Glu
530 535 540
Gly Asn Met Leu Ile Thr Ser Glu Ser Glu Thr Gln Pro Val Asn Arg
545 550 555 560
Val Ala Tyr Asn Val Gly Gly Gln Met Ala Thr Asn Asn Gln Ser Ser
565 570 575
Thr Thr Ala Pro Ala Thr Gly Thr Tyr Asn Leu Gln Glu Ile Val Pro
580 585 590
Gly Ser Val Trp Met Glu Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp
595 600 605
Ala Lys Ile Pro Glu Thr Gly Ala His Phe His Pro Ser Pro Ala Met
610 615 620
Gly Gly Phe Gly Leu Lys His Pro Pro Pro Met Met Leu Ile Lys Asn
625 630 635 640
Thr Pro Val Pro Gly Asn Ile Thr Ser Phe Ser Asp Val Pro Val Ser
645 650 655
Ser Phe Ile Thr Gln Tyr Ser Thr Gly Gln Val Thr Val Glu Met Glu
660 665 670
Trp Glu Leu Lys Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln
675 680 685
Tyr Thr Asn Asn Tyr Asn Asp Pro Gln Phe Val Asp Phe Ala Pro Asp
690 695 700
Ser Thr Gly Glu Tyr Arg Thr Thr Arg Pro Ile Gly Thr Arg Tyr Leu
705 710 715 720
Thr Arg Pro Leu
<210> 12
<211> 588
<212> PRT
<213> Природная последовательность
<220>
<223> Природная последовательность белка VP2 капсида AAV5 дикого типа
<400> 12
Thr Ala Pro Thr Gly Lys Arg Ile Asp Asp His Phe Pro Lys Arg Lys
1 5 10 15
Lys Ala Arg Thr Glu Glu Asp Ser Lys Pro Ser Thr Ser Ser Asp Ala
20 25 30
Glu Ala Gly Pro Ser Gly Ser Gln Gln Leu Gln Ile Pro Ala Gln Pro
35 40 45
Ala Ser Ser Leu Gly Ala Asp Thr Met Ser Ala Gly Gly Gly Gly Pro
50 55 60
Leu Gly Asp Asn Asn Gln Gly Ala Asp Gly Val Gly Asn Ala Ser Gly
65 70 75 80
Asp Trp His Cys Asp Ser Thr Trp Met Gly Asp Arg Val Val Thr Lys
85 90 95
Ser Thr Arg Thr Trp Val Leu Pro Ser Tyr Asn Asn His Gln Tyr Arg
100 105 110
Glu Ile Lys Ser Gly Ser Val Asp Gly Ser Asn Ala Asn Ala Tyr Phe
115 120 125
Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe His Ser
130 135 140
His Trp Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Tyr Trp Gly
145 150 155 160
Phe Arg Pro Arg Ser Leu Arg Val Lys Ile Phe Asn Ile Gln Val Lys
165 170 175
Glu Val Thr Val Gln Asp Ser Thr Thr Thr Ile Ala Asn Asn Leu Thr
180 185 190
Ser Thr Val Gln Val Phe Thr Asp Asp Asp Tyr Gln Leu Pro Tyr Val
195 200 205
Val Gly Asn Gly Thr Glu Gly Cys Leu Pro Ala Phe Pro Pro Gln Val
210 215 220
Phe Thr Leu Pro Gln Tyr Gly Tyr Ala Thr Leu Asn Arg Asp Asn Thr
225 230 235 240
Glu Asn Pro Thr Glu Arg Ser Ser Phe Phe Cys Leu Glu Tyr Phe Pro
245 250 255
Ser Lys Met Leu Arg Thr Gly Asn Asn Phe Glu Phe Thr Tyr Asn Phe
260 265 270
Glu Glu Val Pro Phe His Ser Ser Phe Ala Pro Ser Gln Asn Leu Phe
275 280 285
Lys Leu Ala Asn Pro Leu Val Asp Gln Tyr Leu Tyr Arg Phe Val Ser
290 295 300
Thr Asn Asn Thr Gly Gly Val Gln Phe Asn Lys Asn Leu Ala Gly Arg
305 310 315 320
Tyr Ala Asn Thr Tyr Lys Asn Trp Phe Pro Gly Pro Met Gly Arg Thr
325 330 335
Gln Gly Trp Asn Leu Gly Ser Gly Val Asn Arg Ala Ser Val Ser Ala
340 345 350
Phe Ala Thr Thr Asn Arg Met Glu Leu Glu Gly Ala Ser Tyr Gln Val
355 360 365
Pro Pro Gln Pro Asn Gly Met Thr Asn Asn Leu Gln Gly Ser Asn Thr
370 375 380
Tyr Ala Leu Glu Asn Thr Met Ile Phe Asn Ser Gln Pro Ala Asn Pro
385 390 395 400
Gly Thr Thr Ala Thr Tyr Leu Glu Gly Asn Met Leu Ile Thr Ser Glu
405 410 415
Ser Glu Thr Gln Pro Val Asn Arg Val Ala Tyr Asn Val Gly Gly Gln
420 425 430
Met Ala Thr Asn Asn Gln Ser Ser Thr Thr Ala Pro Ala Thr Gly Thr
435 440 445
Tyr Asn Leu Gln Glu Ile Val Pro Gly Ser Val Trp Met Glu Arg Asp
450 455 460
Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro Glu Thr Gly Ala
465 470 475 480
His Phe His Pro Ser Pro Ala Met Gly Gly Phe Gly Leu Lys His Pro
485 490 495
Pro Pro Met Met Leu Ile Lys Asn Thr Pro Val Pro Gly Asn Ile Thr
500 505 510
Ser Phe Ser Asp Val Pro Val Ser Ser Phe Ile Thr Gln Tyr Ser Thr
515 520 525
Gly Gln Val Thr Val Glu Met Glu Trp Glu Leu Lys Lys Glu Asn Ser
530 535 540
Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Asn Asn Tyr Asn Asp Pro
545 550 555 560
Gln Phe Val Asp Phe Ala Pro Asp Ser Thr Gly Glu Tyr Arg Thr Thr
565 570 575
Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
580 585
<210> 13
<211> 532
<212> PRT
<213> Природная последовательность
<220>
<223> Природная последовательность белка VP3 капсида AAV5 дикого типа
<400> 13
Met Ser Ala Gly Gly Gly Gly Pro Leu Gly Asp Asn Asn Gln Gly Ala
1 5 10 15
Asp Gly Val Gly Asn Ala Ser Gly Asp Trp His Cys Asp Ser Thr Trp
20 25 30
Met Gly Asp Arg Val Val Thr Lys Ser Thr Arg Thr Trp Val Leu Pro
35 40 45
Ser Tyr Asn Asn His Gln Tyr Arg Glu Ile Lys Ser Gly Ser Val Asp
50 55 60
Gly Ser Asn Ala Asn Ala Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr
65 70 75 80
Phe Asp Phe Asn Arg Phe His Ser His Trp Ser Pro Arg Asp Trp Gln
85 90 95
Arg Leu Ile Asn Asn Tyr Trp Gly Phe Arg Pro Arg Ser Leu Arg Val
100 105 110
Lys Ile Phe Asn Ile Gln Val Lys Glu Val Thr Val Gln Asp Ser Thr
115 120 125
Thr Thr Ile Ala Asn Asn Leu Thr Ser Thr Val Gln Val Phe Thr Asp
130 135 140
Asp Asp Tyr Gln Leu Pro Tyr Val Val Gly Asn Gly Thr Glu Gly Cys
145 150 155 160
Leu Pro Ala Phe Pro Pro Gln Val Phe Thr Leu Pro Gln Tyr Gly Tyr
165 170 175
Ala Thr Leu Asn Arg Asp Asn Thr Glu Asn Pro Thr Glu Arg Ser Ser
180 185 190
Phe Phe Cys Leu Glu Tyr Phe Pro Ser Lys Met Leu Arg Thr Gly Asn
195 200 205
Asn Phe Glu Phe Thr Tyr Asn Phe Glu Glu Val Pro Phe His Ser Ser
210 215 220
Phe Ala Pro Ser Gln Asn Leu Phe Lys Leu Ala Asn Pro Leu Val Asp
225 230 235 240
Gln Tyr Leu Tyr Arg Phe Val Ser Thr Asn Asn Thr Gly Gly Val Gln
245 250 255
Phe Asn Lys Asn Leu Ala Gly Arg Tyr Ala Asn Thr Tyr Lys Asn Trp
260 265 270
Phe Pro Gly Pro Met Gly Arg Thr Gln Gly Trp Asn Leu Gly Ser Gly
275 280 285
Val Asn Arg Ala Ser Val Ser Ala Phe Ala Thr Thr Asn Arg Met Glu
290 295 300
Leu Glu Gly Ala Ser Tyr Gln Val Pro Pro Gln Pro Asn Gly Met Thr
305 310 315 320
Asn Asn Leu Gln Gly Ser Asn Thr Tyr Ala Leu Glu Asn Thr Met Ile
325 330 335
Phe Asn Ser Gln Pro Ala Asn Pro Gly Thr Thr Ala Thr Tyr Leu Glu
340 345 350
Gly Asn Met Leu Ile Thr Ser Glu Ser Glu Thr Gln Pro Val Asn Arg
355 360 365
Val Ala Tyr Asn Val Gly Gly Gln Met Ala Thr Asn Asn Gln Ser Ser
370 375 380
Thr Thr Ala Pro Ala Thr Gly Thr Tyr Asn Leu Gln Glu Ile Val Pro
385 390 395 400
Gly Ser Val Trp Met Glu Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp
405 410 415
Ala Lys Ile Pro Glu Thr Gly Ala His Phe His Pro Ser Pro Ala Met
420 425 430
Gly Gly Phe Gly Leu Lys His Pro Pro Pro Met Met Leu Ile Lys Asn
435 440 445
Thr Pro Val Pro Gly Asn Ile Thr Ser Phe Ser Asp Val Pro Val Ser
450 455 460
Ser Phe Ile Thr Gln Tyr Ser Thr Gly Gln Val Thr Val Glu Met Glu
465 470 475 480
Trp Glu Leu Lys Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln
485 490 495
Tyr Thr Asn Asn Tyr Asn Asp Pro Gln Phe Val Asp Phe Ala Pro Asp
500 505 510
Ser Thr Gly Glu Tyr Arg Thr Thr Arg Pro Ile Gly Thr Arg Tyr Leu
515 520 525
Thr Arg Pro Leu
530
<210> 14
<211> 724
<212> PRT
<213> Искусственная последовательность
<220>
<223> модифицированный белок VP1 капсида AAV5, который включает замены
S2A и T711S
<400> 14
Met Ala Phe Val Asp His Pro Pro Asp Trp Leu Glu Glu Val Gly Glu
1 5 10 15
Gly Leu Arg Glu Phe Leu Gly Leu Glu Ala Gly Pro Pro Lys Pro Lys
20 25 30
Pro Asn Gln Gln His Gln Asp Gln Ala Arg Gly Leu Val Leu Pro Gly
35 40 45
Tyr Asn Tyr Leu Gly Pro Gly Asn Gly Leu Asp Arg Gly Glu Pro Val
50 55 60
Asn Arg Ala Asp Glu Val Ala Arg Glu His Asp Ile Ser Tyr Asn Glu
65 70 75 80
Gln Leu Glu Ala Gly Asp Asn Pro Tyr Leu Lys Tyr Asn His Ala Asp
85 90 95
Ala Glu Phe Gln Glu Lys Leu Ala Asp Asp Thr Ser Phe Gly Gly Asn
100 105 110
Leu Gly Lys Ala Val Phe Gln Ala Lys Lys Arg Val Leu Glu Pro Phe
115 120 125
Gly Leu Val Glu Glu Gly Ala Lys Thr Ala Pro Thr Gly Lys Arg Ile
130 135 140
Asp Asp His Phe Pro Lys Arg Lys Lys Ala Arg Thr Glu Glu Asp Ser
145 150 155 160
Lys Pro Ser Thr Ser Ser Asp Ala Glu Ala Gly Pro Ser Gly Ser Gln
165 170 175
Gln Leu Gln Ile Pro Ala Gln Pro Ala Ser Ser Leu Gly Ala Asp Thr
180 185 190
Met Ser Ala Gly Gly Gly Gly Pro Leu Gly Asp Asn Asn Gln Gly Ala
195 200 205
Asp Gly Val Gly Asn Ala Ser Gly Asp Trp His Cys Asp Ser Thr Trp
210 215 220
Met Gly Asp Arg Val Val Thr Lys Ser Thr Arg Thr Trp Val Leu Pro
225 230 235 240
Ser Tyr Asn Asn His Gln Tyr Arg Glu Ile Lys Ser Gly Ser Val Asp
245 250 255
Gly Ser Asn Ala Asn Ala Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr
260 265 270
Phe Asp Phe Asn Arg Phe His Ser His Trp Ser Pro Arg Asp Trp Gln
275 280 285
Arg Leu Ile Asn Asn Tyr Trp Gly Phe Arg Pro Arg Ser Leu Arg Val
290 295 300
Lys Ile Phe Asn Ile Gln Val Lys Glu Val Thr Val Gln Asp Ser Thr
305 310 315 320
Thr Thr Ile Ala Asn Asn Leu Thr Ser Thr Val Gln Val Phe Thr Asp
325 330 335
Asp Asp Tyr Gln Leu Pro Tyr Val Val Gly Asn Gly Thr Glu Gly Cys
340 345 350
Leu Pro Ala Phe Pro Pro Gln Val Phe Thr Leu Pro Gln Tyr Gly Tyr
355 360 365
Ala Thr Leu Asn Arg Asp Asn Thr Glu Asn Pro Thr Glu Arg Ser Ser
370 375 380
Phe Phe Cys Leu Glu Tyr Phe Pro Ser Lys Met Leu Arg Thr Gly Asn
385 390 395 400
Asn Phe Glu Phe Thr Tyr Asn Phe Glu Glu Val Pro Phe His Ser Ser
405 410 415
Phe Ala Pro Ser Gln Asn Leu Phe Lys Leu Ala Asn Pro Leu Val Asp
420 425 430
Gln Tyr Leu Tyr Arg Phe Val Ser Thr Asn Asn Thr Gly Gly Val Gln
435 440 445
Phe Asn Lys Asn Leu Ala Gly Arg Tyr Ala Asn Thr Tyr Lys Asn Trp
450 455 460
Phe Pro Gly Pro Met Gly Arg Thr Gln Gly Trp Asn Leu Gly Ser Gly
465 470 475 480
Val Asn Arg Ala Ser Val Ser Ala Phe Ala Thr Thr Asn Arg Met Glu
485 490 495
Leu Glu Gly Ala Ser Tyr Gln Val Pro Pro Gln Pro Asn Gly Met Thr
500 505 510
Asn Asn Leu Gln Gly Ser Asn Thr Tyr Ala Leu Glu Asn Thr Met Ile
515 520 525
Phe Asn Ser Gln Pro Ala Asn Pro Gly Thr Thr Ala Thr Tyr Leu Glu
530 535 540
Gly Asn Met Leu Ile Thr Ser Glu Ser Glu Thr Gln Pro Val Asn Arg
545 550 555 560
Val Ala Tyr Asn Val Gly Gly Gln Met Ala Thr Asn Asn Gln Ser Ser
565 570 575
Thr Thr Ala Pro Ala Thr Gly Thr Tyr Asn Leu Gln Glu Ile Val Pro
580 585 590
Gly Ser Val Trp Met Glu Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp
595 600 605
Ala Lys Ile Pro Glu Thr Gly Ala His Phe His Pro Ser Pro Ala Met
610 615 620
Gly Gly Phe Gly Leu Lys His Pro Pro Pro Met Met Leu Ile Lys Asn
625 630 635 640
Thr Pro Val Pro Gly Asn Ile Thr Ser Phe Ser Asp Val Pro Val Ser
645 650 655
Ser Phe Ile Thr Gln Tyr Ser Thr Gly Gln Val Thr Val Glu Met Glu
660 665 670
Trp Glu Leu Lys Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln
675 680 685
Tyr Thr Asn Asn Tyr Asn Asp Pro Gln Phe Val Asp Phe Ala Pro Asp
690 695 700
Ser Thr Gly Glu Tyr Arg Ser Thr Arg Pro Ile Gly Thr Arg Tyr Leu
705 710 715 720
Thr Arg Pro Leu
<210> 15
<211> 588
<212> PRT
<213> Искусственная последовательность
<220>
<223> модифицированный белок VP2 капсида AAV5, который включает замену
T575S
<400> 15
Thr Ala Pro Thr Gly Lys Arg Ile Asp Asp His Phe Pro Lys Arg Lys
1 5 10 15
Lys Ala Arg Thr Glu Glu Asp Ser Lys Pro Ser Thr Ser Ser Asp Ala
20 25 30
Glu Ala Gly Pro Ser Gly Ser Gln Gln Leu Gln Ile Pro Ala Gln Pro
35 40 45
Ala Ser Ser Leu Gly Ala Asp Thr Met Ser Ala Gly Gly Gly Gly Pro
50 55 60
Leu Gly Asp Asn Asn Gln Gly Ala Asp Gly Val Gly Asn Ala Ser Gly
65 70 75 80
Asp Trp His Cys Asp Ser Thr Trp Met Gly Asp Arg Val Val Thr Lys
85 90 95
Ser Thr Arg Thr Trp Val Leu Pro Ser Tyr Asn Asn His Gln Tyr Arg
100 105 110
Glu Ile Lys Ser Gly Ser Val Asp Gly Ser Asn Ala Asn Ala Tyr Phe
115 120 125
Gly Tyr Ser Thr Pro Trp Gly Tyr Phe Asp Phe Asn Arg Phe His Ser
130 135 140
His Trp Ser Pro Arg Asp Trp Gln Arg Leu Ile Asn Asn Tyr Trp Gly
145 150 155 160
Phe Arg Pro Arg Ser Leu Arg Val Lys Ile Phe Asn Ile Gln Val Lys
165 170 175
Glu Val Thr Val Gln Asp Ser Thr Thr Thr Ile Ala Asn Asn Leu Thr
180 185 190
Ser Thr Val Gln Val Phe Thr Asp Asp Asp Tyr Gln Leu Pro Tyr Val
195 200 205
Val Gly Asn Gly Thr Glu Gly Cys Leu Pro Ala Phe Pro Pro Gln Val
210 215 220
Phe Thr Leu Pro Gln Tyr Gly Tyr Ala Thr Leu Asn Arg Asp Asn Thr
225 230 235 240
Glu Asn Pro Thr Glu Arg Ser Ser Phe Phe Cys Leu Glu Tyr Phe Pro
245 250 255
Ser Lys Met Leu Arg Thr Gly Asn Asn Phe Glu Phe Thr Tyr Asn Phe
260 265 270
Glu Glu Val Pro Phe His Ser Ser Phe Ala Pro Ser Gln Asn Leu Phe
275 280 285
Lys Leu Ala Asn Pro Leu Val Asp Gln Tyr Leu Tyr Arg Phe Val Ser
290 295 300
Thr Asn Asn Thr Gly Gly Val Gln Phe Asn Lys Asn Leu Ala Gly Arg
305 310 315 320
Tyr Ala Asn Thr Tyr Lys Asn Trp Phe Pro Gly Pro Met Gly Arg Thr
325 330 335
Gln Gly Trp Asn Leu Gly Ser Gly Val Asn Arg Ala Ser Val Ser Ala
340 345 350
Phe Ala Thr Thr Asn Arg Met Glu Leu Glu Gly Ala Ser Tyr Gln Val
355 360 365
Pro Pro Gln Pro Asn Gly Met Thr Asn Asn Leu Gln Gly Ser Asn Thr
370 375 380
Tyr Ala Leu Glu Asn Thr Met Ile Phe Asn Ser Gln Pro Ala Asn Pro
385 390 395 400
Gly Thr Thr Ala Thr Tyr Leu Glu Gly Asn Met Leu Ile Thr Ser Glu
405 410 415
Ser Glu Thr Gln Pro Val Asn Arg Val Ala Tyr Asn Val Gly Gly Gln
420 425 430
Met Ala Thr Asn Asn Gln Ser Ser Thr Thr Ala Pro Ala Thr Gly Thr
435 440 445
Tyr Asn Leu Gln Glu Ile Val Pro Gly Ser Val Trp Met Glu Arg Asp
450 455 460
Val Tyr Leu Gln Gly Pro Ile Trp Ala Lys Ile Pro Glu Thr Gly Ala
465 470 475 480
His Phe His Pro Ser Pro Ala Met Gly Gly Phe Gly Leu Lys His Pro
485 490 495
Pro Pro Met Met Leu Ile Lys Asn Thr Pro Val Pro Gly Asn Ile Thr
500 505 510
Ser Phe Ser Asp Val Pro Val Ser Ser Phe Ile Thr Gln Tyr Ser Thr
515 520 525
Gly Gln Val Thr Val Glu Met Glu Trp Glu Leu Lys Lys Glu Asn Ser
530 535 540
Lys Arg Trp Asn Pro Glu Ile Gln Tyr Thr Asn Asn Tyr Asn Asp Pro
545 550 555 560
Gln Phe Val Asp Phe Ala Pro Asp Ser Thr Gly Glu Tyr Arg Ser Thr
565 570 575
Arg Pro Ile Gly Thr Arg Tyr Leu Thr Arg Pro Leu
580 585
<210> 16
<211> 532
<212> PRT
<213> Искусственная последовательность
<220>
<223> модифицированный белок VP3 капсида AAV5, который включает замену
T519S
<400> 16
Met Ser Ala Gly Gly Gly Gly Pro Leu Gly Asp Asn Asn Gln Gly Ala
1 5 10 15
Asp Gly Val Gly Asn Ala Ser Gly Asp Trp His Cys Asp Ser Thr Trp
20 25 30
Met Gly Asp Arg Val Val Thr Lys Ser Thr Arg Thr Trp Val Leu Pro
35 40 45
Ser Tyr Asn Asn His Gln Tyr Arg Glu Ile Lys Ser Gly Ser Val Asp
50 55 60
Gly Ser Asn Ala Asn Ala Tyr Phe Gly Tyr Ser Thr Pro Trp Gly Tyr
65 70 75 80
Phe Asp Phe Asn Arg Phe His Ser His Trp Ser Pro Arg Asp Trp Gln
85 90 95
Arg Leu Ile Asn Asn Tyr Trp Gly Phe Arg Pro Arg Ser Leu Arg Val
100 105 110
Lys Ile Phe Asn Ile Gln Val Lys Glu Val Thr Val Gln Asp Ser Thr
115 120 125
Thr Thr Ile Ala Asn Asn Leu Thr Ser Thr Val Gln Val Phe Thr Asp
130 135 140
Asp Asp Tyr Gln Leu Pro Tyr Val Val Gly Asn Gly Thr Glu Gly Cys
145 150 155 160
Leu Pro Ala Phe Pro Pro Gln Val Phe Thr Leu Pro Gln Tyr Gly Tyr
165 170 175
Ala Thr Leu Asn Arg Asp Asn Thr Glu Asn Pro Thr Glu Arg Ser Ser
180 185 190
Phe Phe Cys Leu Glu Tyr Phe Pro Ser Lys Met Leu Arg Thr Gly Asn
195 200 205
Asn Phe Glu Phe Thr Tyr Asn Phe Glu Glu Val Pro Phe His Ser Ser
210 215 220
Phe Ala Pro Ser Gln Asn Leu Phe Lys Leu Ala Asn Pro Leu Val Asp
225 230 235 240
Gln Tyr Leu Tyr Arg Phe Val Ser Thr Asn Asn Thr Gly Gly Val Gln
245 250 255
Phe Asn Lys Asn Leu Ala Gly Arg Tyr Ala Asn Thr Tyr Lys Asn Trp
260 265 270
Phe Pro Gly Pro Met Gly Arg Thr Gln Gly Trp Asn Leu Gly Ser Gly
275 280 285
Val Asn Arg Ala Ser Val Ser Ala Phe Ala Thr Thr Asn Arg Met Glu
290 295 300
Leu Glu Gly Ala Ser Tyr Gln Val Pro Pro Gln Pro Asn Gly Met Thr
305 310 315 320
Asn Asn Leu Gln Gly Ser Asn Thr Tyr Ala Leu Glu Asn Thr Met Ile
325 330 335
Phe Asn Ser Gln Pro Ala Asn Pro Gly Thr Thr Ala Thr Tyr Leu Glu
340 345 350
Gly Asn Met Leu Ile Thr Ser Glu Ser Glu Thr Gln Pro Val Asn Arg
355 360 365
Val Ala Tyr Asn Val Gly Gly Gln Met Ala Thr Asn Asn Gln Ser Ser
370 375 380
Thr Thr Ala Pro Ala Thr Gly Thr Tyr Asn Leu Gln Glu Ile Val Pro
385 390 395 400
Gly Ser Val Trp Met Glu Arg Asp Val Tyr Leu Gln Gly Pro Ile Trp
405 410 415
Ala Lys Ile Pro Glu Thr Gly Ala His Phe His Pro Ser Pro Ala Met
420 425 430
Gly Gly Phe Gly Leu Lys His Pro Pro Pro Met Met Leu Ile Lys Asn
435 440 445
Thr Pro Val Pro Gly Asn Ile Thr Ser Phe Ser Asp Val Pro Val Ser
450 455 460
Ser Phe Ile Thr Gln Tyr Ser Thr Gly Gln Val Thr Val Glu Met Glu
465 470 475 480
Trp Glu Leu Lys Lys Glu Asn Ser Lys Arg Trp Asn Pro Glu Ile Gln
485 490 495
Tyr Thr Asn Asn Tyr Asn Asp Pro Gln Phe Val Asp Phe Ala Pro Asp
500 505 510
Ser Thr Gly Glu Tyr Arg Ser Thr Arg Pro Ile Gly Thr Arg Tyr Leu
515 520 525
Thr Arg Pro Leu
530
<210> 17
<211> 1383
<212> DNA
<213> Природная последовательность
<220>
<223> нуклеиновая кислота, кодирующая рекомбинантный фактор свёртывания
крови IX дикого типа (hFIX-wt) с мутацией R338L
<400> 17
atgcagcgcg tgaacatgat catggcagaa tcaccaggcc tcatcaccat ctgcctttta 60
ggatatctac tcagtgctga atgtacagtt tttcttgatc atgaaaacgc caacaaaatt 120
ctgaatcggc caaagaggta taattcaggt aaattggaag agtttgttca agggaacctt 180
gagagagaat gtatggaaga aaagtgtagt tttgaagaag cacgagaagt ttttgaaaac 240
actgaaagaa caactgaatt ttggaagcag tatgttgatg gagatcagtg tgagtccaat 300
ccatgtttaa atggcggcag ttgcaaggat gacattaatt cctatgaatg ttggtgtccc 360
tttggatttg aaggaaagaa ctgtgaatta gatgtaacat gtaacattaa gaatggcaga 420
tgcgagcagt tttgtaaaaa tagtgctgat aacaaggtgg tttgctcctg tactgaggga 480
tatcgacttg cagaaaacca gaagtcctgt gaaccagcag tgccatttcc atgtggaaga 540
gtttctgttt cacaaacttc taagctcacc cgtgctgaga ctgtttttcc tgatgtggac 600
tatgtaaatt ctactgaagc tgaaaccatt ttggataaca tcactcaaag cacccaatca 660
tttaatgact tcactcgggt tgttggtgga gaagatgcca aaccaggtca attcccttgg 720
caggttgttt tgaatggtaa agttgatgca ttctgtggag gctctatcgt taatgaaaaa 780
tggattgtaa ctgctgccca ctgtgttgaa actggtgtta aaattacagt tgtcgcaggt 840
gaacataata ttgaggagac agaacataca gagcaaaagc gaaatgtgat tcgaattatt 900
cctcaccaca actacaatgc agctattaat aagtacaacc atgacattgc ccttctggaa 960
ctggacgaac ccttagtgct aaacagctac gttacaccta tttgcattgc tgacaaggaa 1020
tacacgaaca tcttcctcaa atttggatct ggctatgtaa gtggctgggg aagagtcttc 1080
cacaaaggga gatcagcttt agttcttcag taccttagag ttccacttgt tgaccgagcc 1140
acatgtcttc tatctacaaa gttcaccatc tataacaaca tgttctgtgc tggcttccat 1200
gaaggaggta gagattcatg tcaaggagat agtgggggac cccatgttac tgaagtggaa 1260
gggaccagtt tcttaactgg aattattagc tggggtgaag agtgtgcaat gaaaggcaaa 1320
tatggaatat ataccaaggt atcccggtat gtcaactgga ttaaggaaaa aacaaagctc 1380
act 1383
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2020 |
|
RU2760301C1 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2020 |
|
RU2783313C1 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2021 |
|
RU2761879C1 |
| МОДИФИЦИРОВАННЫЙ ФАКТОР IX, А ТАКЖЕ КОМПОЗИЦИИ, СПОСОБЫ И ВАРИАНТЫ ПРИМЕНЕНИЯ ПЕРЕНОСА ГЕНОВ В КЛЕТКИ, ОРГАНЫ И ТКАНИ | 2016 |
|
RU2811445C2 |
| Выделенный модифицированный белок VP1 капсида аденоассоциированного вируса 5 серотипа (AAV5), капсид и вектор на его основе | 2019 |
|
RU2751592C2 |
| Способ получения модифицированного капсида аденоассоциированного вируса | 2021 |
|
RU2831732C1 |
| ВАРИАНТ AAV, КОМПОЗИЦИИ И СПОСОБЫ, В КОТОРЫХ ОН ИСПОЛЬЗУЕТСЯ, А ТАКЖЕ СПОСОБЫ ЕГО ПРИМЕНЕНИЯ ДЛЯ ПЕРЕНОСА ГЕНОВ В КЛЕТКИ, ОРГАНЫ И ТКАНИ | 2014 |
|
RU2837753C2 |
| Выделенная нуклеиновая кислота, которая кодирует слитый белок на основе FVIII-BDD и гетерологичного сигнального пептида, и ее применение | 2022 |
|
RU2818229C2 |
| РЕКОМБИНАНТНЫЕ AAV ВЕКТОРЫ, ЭКСПРЕССИРУЮЩИЕ ОСТЕОПРОТЕКТИВНЫЕ ГЕНЫ, ВКЛЮЧАЯ HAS2 И ЛУБРИЦИН, ПРИГОДНЫЕ ПРИ ЛЕЧЕНИИ ОСТЕОАРТРИТА И СХОДНЫХ ЗАБОЛЕВАНИЙ СУСТАВОВ У МЛЕКОПИТАЮЩИХ | 2017 |
|
RU2771490C2 |
| Кодон-оптимизированная нуклеиновая кислота, которая кодирует белок фактора свёртывания крови VIII c делетированным B доменом, и ее применение | 2022 |
|
RU2808564C2 |
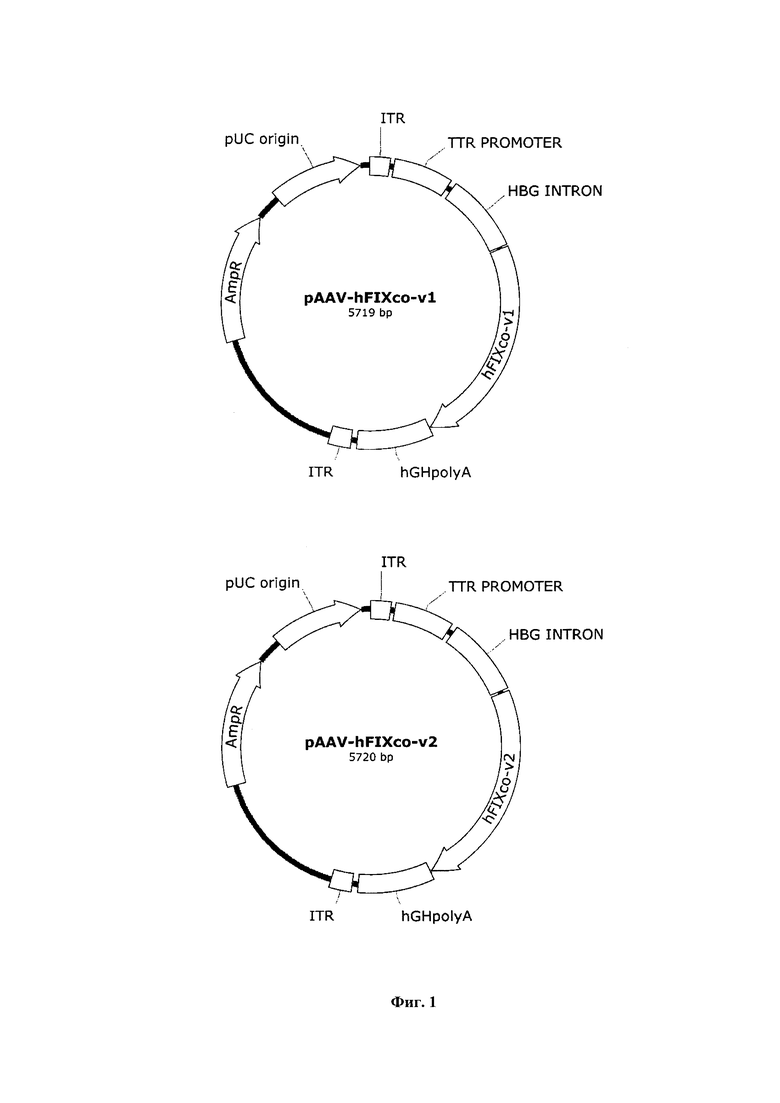
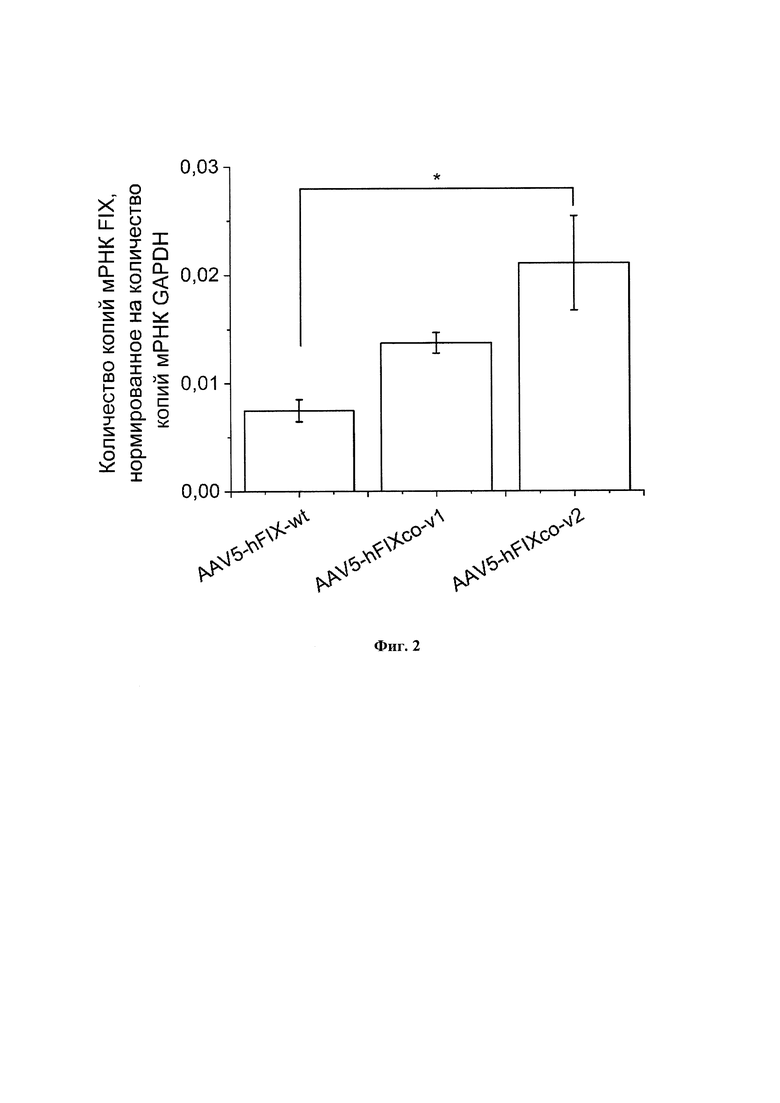
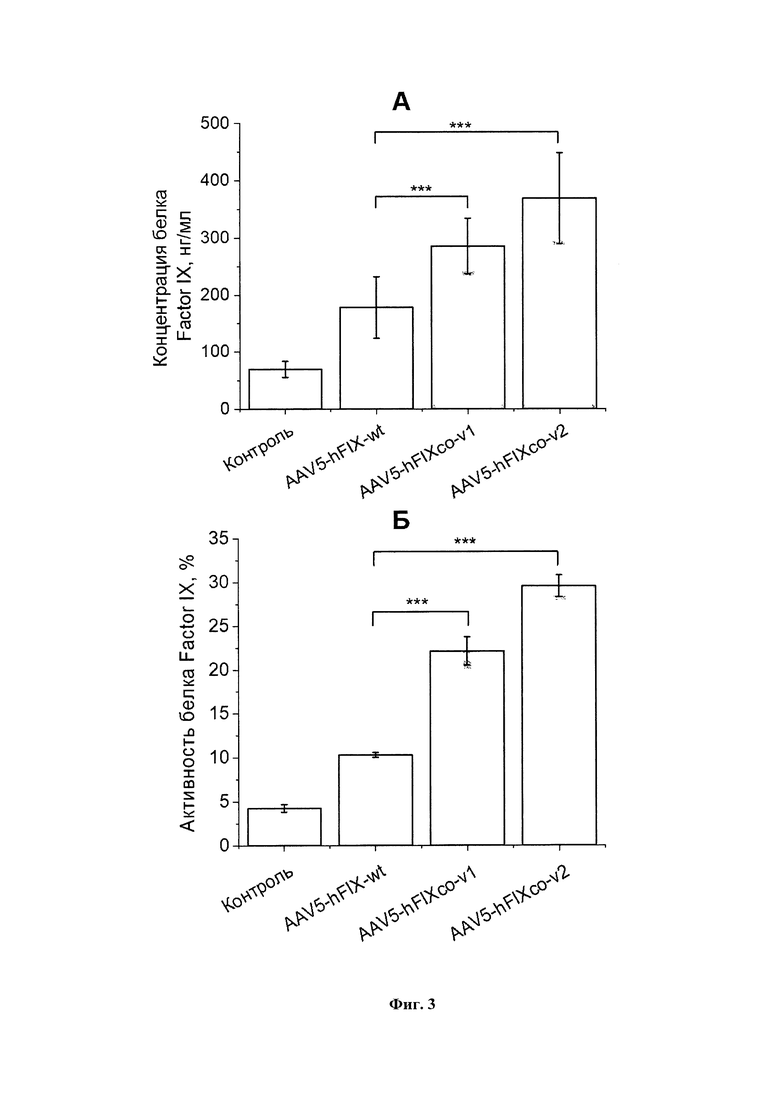
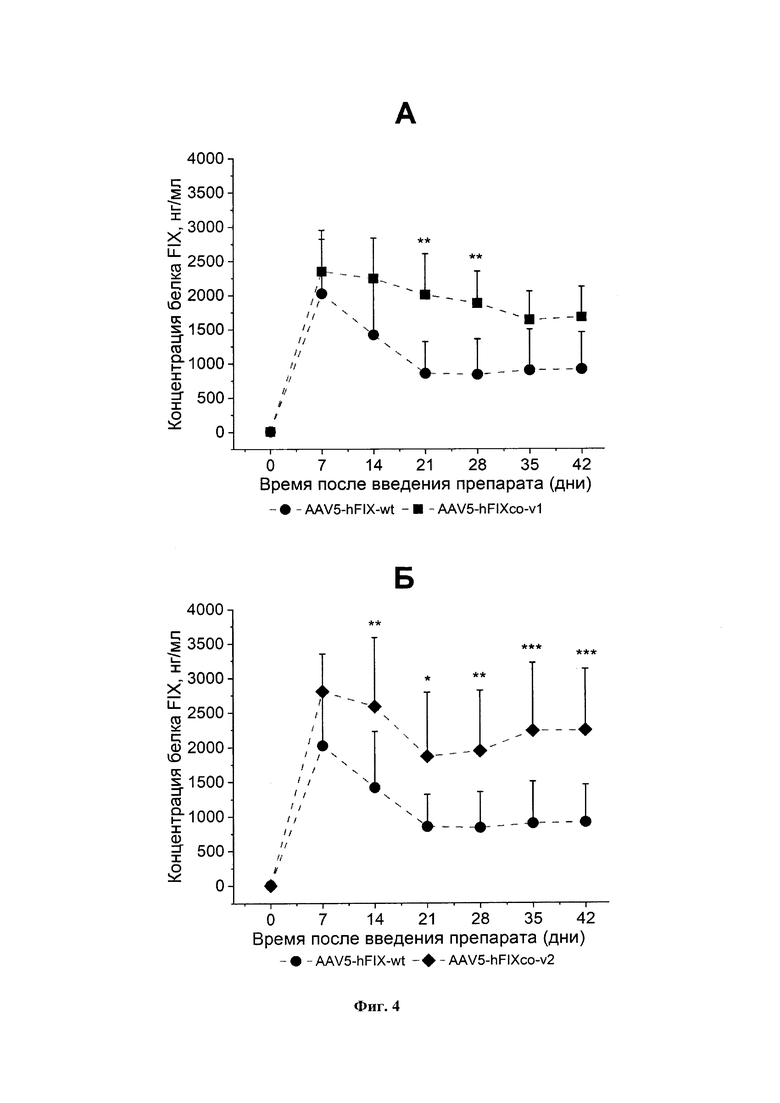
Настоящая заявка относится к области биотехнологии и может быть применима в медицине. Более конкретно, настоящее изобретение относится к выделенной кодон-оптимизированной нуклеиновой кислоте, которая кодирует белок FIX (фактор свертывания крови IX), экспрессионной кассете и вектору на ее основе, а также к рекомбинантному вирусу на основе AAV5 (аденоассоциированный вирус 5 серотипа) для увеличения экспрессии гена FIX в целевых клетках и их применению. 7 н. и 3 з.п. ф-лы, 5 пр., 1 табл., 4 ил.
1. Выделенная кодон-оптимизированная нуклеиновая кислота, кодирующая белок FIX (фактор свертывания крови IX) с аминокислотной последовательностью SEQ ID NO: 1, которая включает нуклеотидную последовательность, которую выбирают из группы: SEQ ID NO: 2 или SEQ ID NO: 4.
2. Экспрессиоиная кассета, которая включает кодон-оптимизированную нуклеиновую кислоту по п. 1.
3. Экспрессионная кассета по п. 2, включающая следующие элементы в направлении от 5'-конца к 3'-концу:
первый ITR (инвертированные концевые повторы);
TTR промотор (промотор транстиретина);
интрон гена hBG1 (фрагмент гена β глобина человека, несущий интрон);
кодон-оптимизированную нуклеиновую кислоту по п. 1;
сигнал полиаденилирования hGH1 (сигнал полиаденилирования гена гормона роста человека);
второй ITR.
4. Экспрессионная кассета по п. 3, которая включает нуклеотидную последовательность, которую выбирают из группы: SEQ ID NO: 3 или SEQ ID NO: 5.
5. Экспрессионный вектор, который включает кодон-оптимизированную нуклеиновую кислоту по п. 1 или экспрессионную кассету по любому из пп. 2-4.
6. Выделенный рекомбинантный вирус на основе AAV5 (аденоассоциированный вирус 5 серотипа) для увеличения экспрессии гена FIX в целевых клетках, который включает нуклеиновую кислоту по п. 1 или экспрессионную кассету по любому из пп. 2-4.
7. Рекомбинантный вирус на основе AAV5 по п. 6, где капсид включает белок VP1 AAV5.
8. Фармацевтическая композиция для доставки гена FIX в целевые клетки, включающая рекомбинантный вирус на основе AAV5 по любому из пп. 6, 7 в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
9. Применение рекомбинантного вируса на основе AAV5 по пп. 6, 7 или композиции по п. 8 для доставки гена FIX в целевые клетки.
10. Способ доставки гена FIX в целевые клетки субъекта с гемофилией В, включающий введение рекомбинантного вируса на основе AAV5 по любому из пп. 6, 7 или композиции по п. 8 в клетки субъекта.
| WO 2020118069 A2, 11.06.2020 | |||
| WO 2018217731 A1, 29.11.2018 | |||
| WO 2016004113 A1, 07.01.2016 | |||
| WO 2011005968 A1, 13.01.2011 | |||
| РЕКОМБИНАНТНАЯ МОЛЕКУЛА ДНК, КОДИРУЮЩАЯ МОДИФИЦИРОВАННЫЙ СВИНОЙ ФАКТОР VIII (POL 1212), ЭКСПРЕССИРУЮЩИЕ ВЕКТОРЫ, МОДИФИЦИРОВАННЫЙ СВИНОЙ ФАКТОР VIII, ТЕРАПЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБЫ ПОЛУЧЕНИЯ БЕЛКА МОДИФИЦИРОВАННОГО СВИНОГО ФАКТОРА VIII (ВАРИАНТЫ) И ЛИНИИ КЛЕТОК (ВАРИАНТЫ) | 2001 |
|
RU2285724C2 |
Авторы
Даты
2024-12-13—Публикация
2021-03-05—Подача