Предлагаемое изобретение относится к области медицины (нейрохирургия, регенеративная медицина) и нейробиологии, касается способа in vitro определения биосовместимости скаффолдов для нейротрансплантации, который может быть использован для первичной оценки биосовместимости и безопасности применения скаффолдов для нейротрансплантации.
На сегодняшний день остро стоит проблема восстановления ткани головного мозга после повреждений различного генеза. Потеря структурных и функциональных элементов центральной нервной системы влечет за собой рост острого неврологического дефицита, нарушение когнитивных функций (Mishchenko et al. Features of Primary Hippocampal Cultures Formation on Scaffolds Based on Hyaluronic Acid Glycidyl Methacrylate. 2018. CTM, Killen et al. Metabolism and inflammation: implications for traumatic brain injury therapeutics. 2019. Expert Review of Neurotherapeutics). Отсутствие эффективного лечения может привести к значительным ухудшениям состояния здоровья пациентов вплоть до глубокой инвалидизации. Перспективным подходом для преодоления данной проблемы является использование биоинженерных конструктов (скаффолдов), применение которых позволит поддерживать необходимую анатомическую структуру в зоне поражения с целью обеспечения свободного транспорта биологических жидкостей и постепенного его замещения естественной нервной тканью.
Скаффолды представляют собой трехмерные биоактивные матриксы, способствующие морфологическому и функциональному восстановлению тканей головного мозга после различного рода повреждений или хирургических вмешательств.
Для успешного приживления и стимулирования регенеративных процессов нейротрансплантаты должны обладать рядом свойств, в частности, биосовместимостью, отсутствием цитотоксичности и иммунологического отторжения, наличием адгезивной поверхности, контролируемой скоростью биодеградации, оптимальным размером пор для пространственного распределения клеток и васкуляризации, а также для поддержания нормального метаболизма и выживаемости клеток (Smith et al. Development of Self-Assembled Nanoribbon Bound Peptide-Polyaniline Composite Scaffolds and Their Interactions with Neural Cortical Cells. 2018. Bio engineering, Dave, Gomes. Interactions at scaffold interfaces: Effect of surface chemistry, structural attributes and bioaffinity. 2019. Materials Science & Engineering).
Ключевым критерием возможности применения скаффолдов считается биосовместимость, поэтому перед непосредственным их использованием при нейрохирургических операциях важно определить наличие/отсутствие цитотоксического воздействия конструктов на клетки головного мозга.
Так, например, известен носитель для трансплантируемых клеток для замещения дефекта, полученного при черепно-мозговой травме (скаффолд), для определения биосовместимости которого использовалась визуализация целостности ткани мозга с помощью МРТ и тестирование когнитивного поведения мышей (RU 2659842 С2, кл. А61В 17/00, A61K 31/722, A61K 31/728, опубл. 04.07.2018 г.).
Известен способ получения искусственной твердой мозговой оболочки на основе коллагена, влияние которой на ткани головного мозга крыс оценивалось только с помощью иммуногистологического исследования (RU 2723738 С1, кл. A61F 2/02, А61Р 25/00, А61Р 41/00, опубл. 17.06.2020 г.).
Минусом указанных способов является не всестороннее исследование, недостаточное для определения биосовместимости имплантов.
Известен способ определения цитотоксичности трансплантатов, основанный на количественном анализе клеточной составляющей скаффолда с использованием окрашивания образцов флуорохромом Hoechst, обладающим высокой специфичностью к двухцепочечной молекуле ДНК, и проведении флуоресцентной микроскопии (RU №2675376 С1, кл. G01N 33/52, опубл. 19.12.2018 г.). Данный метод подходит для клеточных культур, способных к делению, например, мезенхимальных стволовых клеток, фибробластов, в связи с чем не может быть применим для первичных нейрональных культур.
Известен способ микроскопической оценки цитотоксичности компонентов материалов скаффолдов, в соответствии с которым проводят инкубацию эритроцитов с компонентами материалов конструктов при 37°С в течение 30 мин., после чего эритроциты смешивают с аутологичной плазмой крови, помещают каплю на предметное стекло и проводят микрофотосъемку с объективом 100×. Цитотоксичность трансплантатов оценивают по изменению морфологии эритроцитов и их агрегатов в аутологичной плазме крови (RU 2653476 С1, кл. G01N 33/48, опубл. 08.05.2018 г.).
Известен способ оценки биосовместимости скаффолдов, включающий имплантацию скаффолда подкожно крысам, в котором после 7 суток имплантации под наркозом выполняется забор крови в объеме 3-5 мл и определение концентрации фактора роста эндотелия сосудов-A (VEGF) и синдекана-1, рассчитываются их соотношение, для нормировки величины соотношения концентраций VEGF и синдекана-1 ее умножают на поправочный коэффициент К, определяемый как соотношение медианного значения концентраций синдекана-1 и VEGF у интактных животных, если нормированная величина соотношения концентраций VEGF и синдекана-1 не превышает 2, считается, что скаффолд является не биосовместимым (RU №2714461 С1, кл. G09B 23/28, опубл. 17.02.2020 г.).
Несмотря на то, что данные методы позволяют снизить время определения биосовместимости скаффолдов, они не предоставляют информации по токсичному воздействию исследуемых конструктов на первичные нейрональные культуры in vitro.
В задачу изобретения положена разработка способа in vitro определения биосовместимости скаффолдов для нейротрансплантации.
Техническим результатом от использования заявленного изобретения является повышение эффективности и точности оценки рисков развития патологических реакций, которые могут привести к отторжению трансплантата, определение целесообразности применения создаваемых конструктов в нейротрансплантации.
Поставленная задача достигается тем, что способ in vitro определения биосовместимости скаффолдов для нейротрансплантации включает сокультивирование первичных нейрональных культур со скаффолдами на поверхности конструктов, определение показателей жизнеспособности, морфометрических параметров и показателей функциональной активности клеток в культуре, оценку уровня цитотоксичности материала скаффолда, его адгезивных свойств и оптимальности архитектоники скаффолда для нейротрансплантации на основании регистрируемых параметров, при этом оценку жизнеспособности проводят с использованием флуоресцентных красителей пропидий йодида и бис-бензимида, а также качественно с использованием шкалы цитотоксичности согласно ГОСТ Р ИСО 10993-5:2009 (ISO 10993-5:2009), по результатам которой скаффолд считают биосовместимым, если количество живых клеток составляет 90% и более от всех клеток культуры, оценку морфометрических параметров клеточной культуры, культивируемой на поверхности конструкта, осуществляют с использованием сканирующей микроскопии и программы ImageJ, по результатам которой при снижении показателей в группе со скаффолдом относительно контрольной в 1,5 раза и более, считают, что материал конструкта и его структура оказывает деструктивное воздействие на культуру клеток, анализ спонтанной кальциевой активности проводят с использованием специфического кальциевого красителя Oregon Green 488 ВАРТА-1 AM и конфокального лазерного сканирующего микроскопа, по результатам которого скаффолд считают биосовместимым при количестве клеток, проявляющих кальциевую активность, 80% и более, длительности кальциевых событий 8-10 секунд, частоты кальциевых осцилляций 1,5-2 (количество кальциевых событий/мин.); первичные нейрональные культуры получают из эмбриональной ткани головного мозга мыши; экспериментальные методы, позволяющие оценить безопасность использования конструктов, проводят на 14 день культивирования клеточных культур.
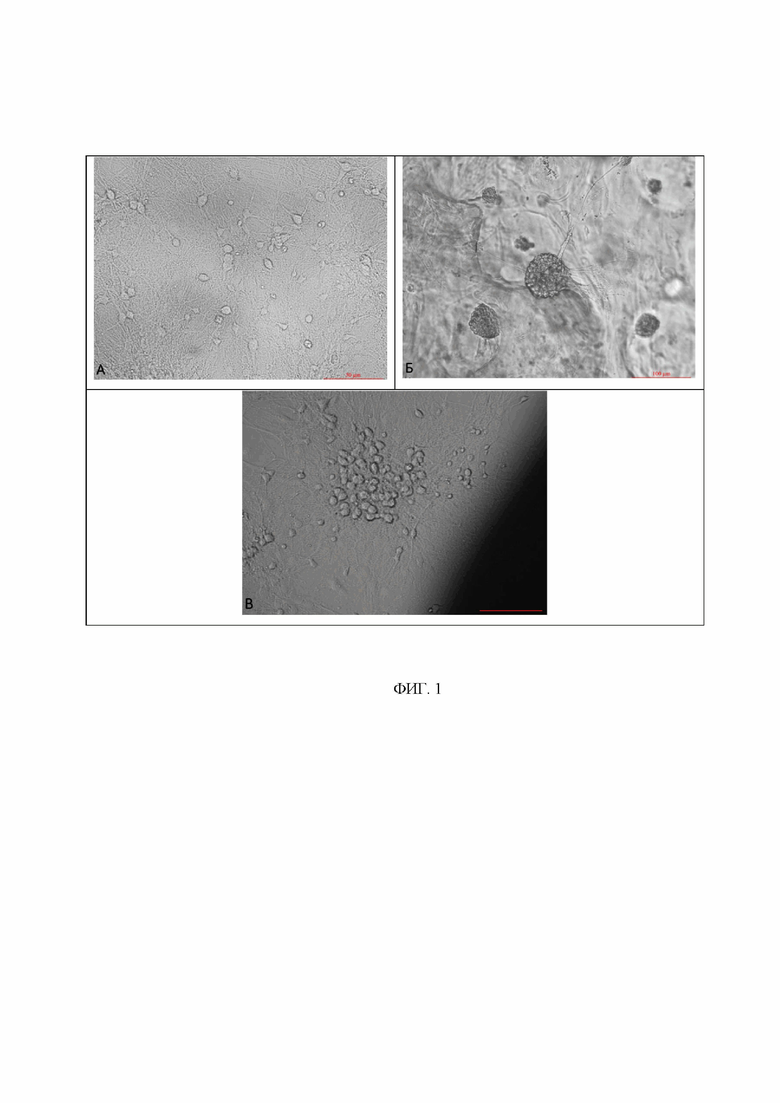
На фиг. 1 представлены репрезентативные микрофотографии первичных нейрональных культур на 14 день культивирования in vitro, где: А интактная культура, Б - культура на скаффолде, В - культура рядом со скаффолдом. Масштабная линейка - 50, 100 мкм.
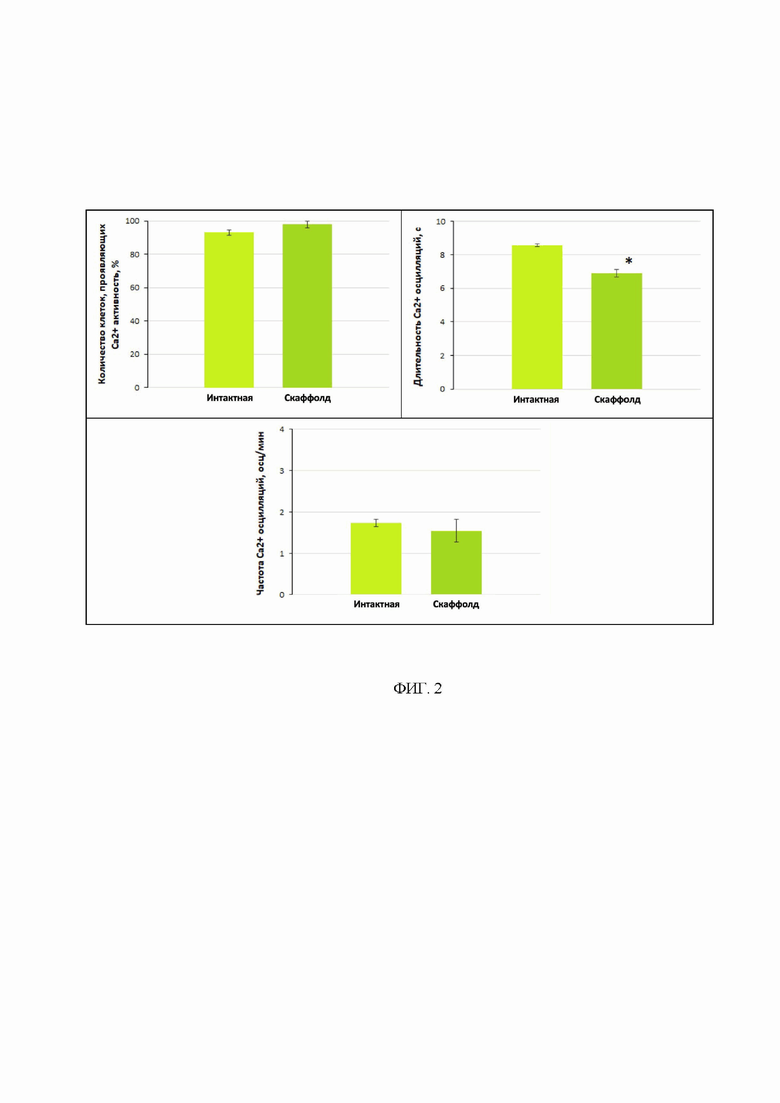
На фиг. 2 представлены параметры спонтанной кальциевой активности клеток первичных нейрональных культур на 14 день сокультивирования со скаффолдом. * - различия достоверны относительно группы «Интактная», р<0,05, критерий Манна-Уитни.
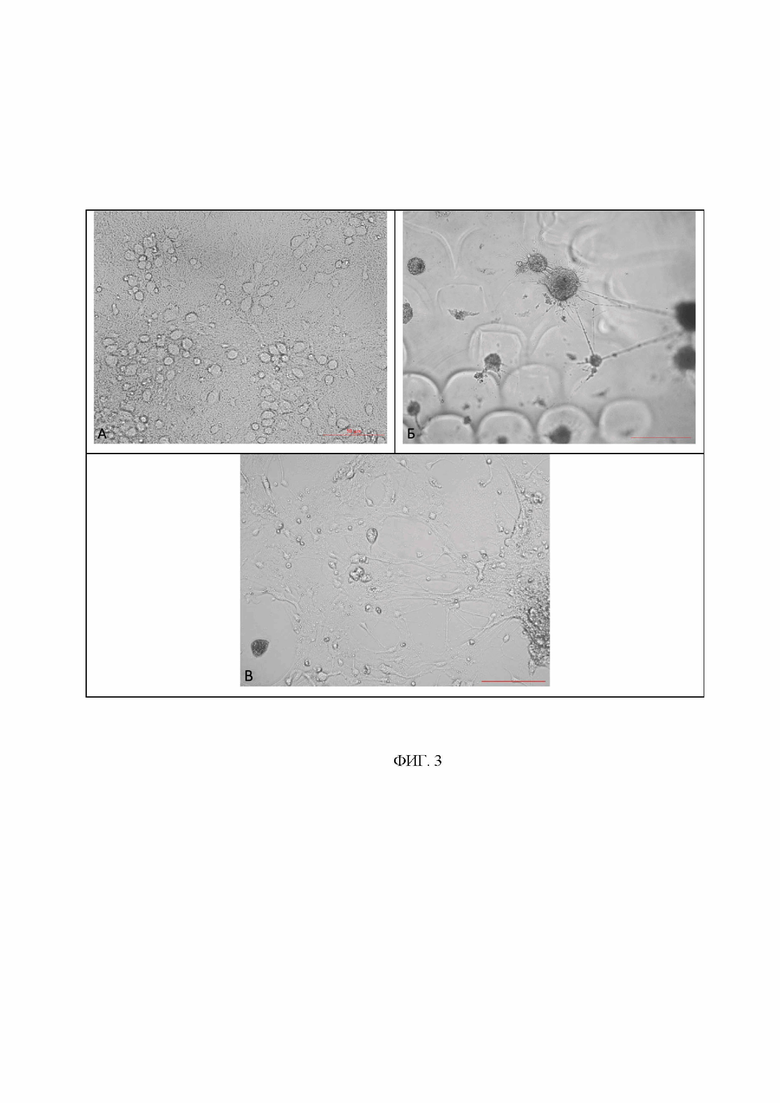
На фиг. 3 представлены репрезентативные микрофотографии первичных нейрональных культур на 14 день культивирования in vitro, где: А интактная культура, Б - культура на скаффолде, В - культура рядом со скаффолдом. Масштабная линейка - 50, 100 мкм.
Предлагаемый способ in vitro определения биосовместимости скаффолдов для нейротрансплантации осуществляют следующим образом.
Способ оценки биосовместимости скаффолдов основан на сокультивировании первичных нейрональных культур, полученных из эмбриональной ткани головного мозга мыши, и последующим анализом следующих показателей:
- количество жизнеспособных клеток первичных нейрональных культур при их сокультивировании со скаффолдом;
- морфометрические параметры клеток первичной нейрональной культуры при сокультивировании со скаффолдом (диаметр Ферета, площадь поверхности клеток, площадь поверхности конгломератов);
- параметры спонтанной кальциевой активности клеток первичной нейрональной культуры при сокультивировании со скаффолдом (количество клеток, проявляющих кальциевую активность, частота и длительность кальциевых осцилляций).
Показания биосовметимости скаффолдов с клетками нервной системы выражаются:
- количество жизнеспособных клеток первичных нейрональных культур при их сокультивировании со скаффолдом достигает 90% и более;
- морфометрические параметры клеток первичной нейрональной культуры при сокультивировании со скаффолдом: диаметр Ферета 10-14 мкм; площадь поверхности клеток 60-120 мкм2; площадь поверхности конгломератов 8000 мкм2 и более;
- параметры спонтанной кальциевой активности клеток первичной нейрональной культуры при сокультивировании со скаффолдом: количество клеток, проявляющих кальциевую активность 80% и более; частота кальциевых событий 1,5-2 количество кальциевых событий/мин.; длительность кальциевых осцилляций 8-10 секунд.
Скаффолды считаются биосовместимыми при одновременном выполнении данных условий.
Для экспериментального обоснования данного способа были изучены образцы скаффолдов, полученных методом микромолдинга, разработанных для не йротранс плантации.
Клетки первичных нейрональных культур были получены по стандартному протоколу (Vedunova et al. Seizure-like activity in hyaluronidase-treated dissociated hippocampal cultures. 2013. Front Cell Neurosci.) из ткани головного мозга эмбрионов мыши (линия SHK) 18-го дня гестации. Хирургически извлеченные отделы головного мозга эмбрионов подвергались механической обработке, а затем 20-минутной инкубации с 0,25% раствором трипсина (Life Technologies, США) в условиях CO2-инкубатора. Полученная клеточная суспензия трехкратно промывалась натрий-фосфатным буфером, затем средой для культивирования (состав: 92,75% нейробазальная среда (Neurobasal™ "Invitrogen"), 5% сыворотка эмбриональная телячья ("ПанЭко"), 2% биоактивная добавка В27 ("Invitrogen"), 0,25% L-глутамин ("Invitrogen") и далее подвергалась центрифугированию (3 мин., 1000 об./мин.). После удаления надосадочной жидкости клеточная суспензия помещалась на поверхность скаффолда (плотность 27000 кл/см2), выдерживалась в СО2-инкубаторе в течение 15 минут, после чего производился долив культуральной среды до объема 2 мл.
Жизнеспособность первичных нейрональных культур поддерживалась в течение 21 дня в условиях СО2-инкубатора (температура 35,5°С, газовая смесь содержит 5% СО2). Замена питательной среды (состав: 94,5% Neurobasal™, 4% В27, 1% L-глутамин, 0,5% сыворотка эмбриональная телячья) проводится 1 раз в 2 суток. Морфологическое состояние первичных нейрональных культур и оценка адгезивных свойств материала скаффолда анализировали в дни замены культуральной среды с помощью инвертированного флуоресцентного микроскопа.
Количественный анализ жизнеспособности первичных нейрональных культур сокультивируемых со скаффолдами производился на 14 день культивирования путем окрашивания флуоресцентными красителями пропидий иодидом (Sigma-Aldrich, США) и бис-бензимидом (Sigma-Aldrich, США), обеспечивающими визуализацию ядер погибших клеток и общего количества клеток в культуре соответственно. С использованием инвертированного флуоресцентного микроскопа в 10 полях зрения производился подсчет пропидий иодид положительно окрашенных и бис-бензимид положительно окрашенных клеток с последующим анализом их процентного соотношения. В случае наличия автофлуоресценции скаффолда оценка жизнеспособности проводится относительно клеток, находящихся в непосредственной близости к скаффолду.
Качественный анализ цитотоксичности скаффолдов для клеток нервной системы производился с использованием шкалы цитотоксичности согласно ГОСТ Р ИСО 10993-5:2009 (ISO 10993-5:2009) (табл. 1). Согласно данной шкале скаффолды не проявляют токсического действия при наличии 90-100% жизнеспособных клеток в культуре.

На 14 день сокультивирования первичных нейрональных культур со скаффолдами осуществлялась оценка морфометрических параметров клеток с помощью метода сканирующей электронной микроскопии и последующей обработкой данных в программе Image J. Проводилось измерение следующих параметров: диаметр Ферета (мкм) (максимальное расстояние между краями клеток), площадь поверхности отдельных клеток и их конгломератов (мкм2). Сравнение данных параметров клеточной культуры, культивируемой со скаффолдом, с клеточной культурой, выращенной при отсутствии скаффолда по стандартному протоколу (далее - интактная культура) (Vedunova et al. Seizure-like activity in hyaluronidase-treated dissociated hippocampal cultures. 2013. Front Cell Neurosci.) с использованием адгезивного агента (полиэтиленимина), позволяет определить наличие деструктивного влияния материала конструкта на морфологические параметры клеток.
На 14 день сокультивирования первичных нейрональных культур со скаффолдами анализировалась функциональная активность клеток с использованием методики кальциевого имиджинга. Детекция цитоплазматического Са2+, как одного из ключевых регуляторов метаболических каскадов в клетке, позволяет провести тонкий анализ активности как нейронов, так и глии (Мищенко и др. Применение методики прижизненного детектирования экспрессии мРНК в сочетании с кальциевым имиджингом для исследования нейросетевой активности in vitro. 2018. Биологические мембраны, Захаров и др. Флуоресцентный сканирующий мониторинг кальциевой активности нейронов гиппокампа при последовательном воздействии модуляторов синаптической передачи. 2011. Вестник Нижегородского университета им. Н.И. Лобачевского). Кальциевые события детектировали с помощью специфического кальциевого красителя Oregon Green 488 ВАРТА-1 AM (OGB1) (Invitrogen, США) и конфокального лазерного сканирующего микроскопа. Осуществлялась регистрация временных серий изображений поля флуоресценции OGB1. Изменение интенсивности флуоресценции (усл. ед.) показывает зависимость внутриклеточной концентрации ионов кальция от времени и характеризует функциональную активность клеток в культуре. Выделение и анализ кальциевых осцилляций проводились с помощью программы Astroscanner (свидетельство о государственной регистрации программы для ЭВМ №2014662670). Учитывались параметры: общая длительность кальциевых осцилляций (с), частота возникновения кальциевых осцилляций (количество кальциевых событий/мин.), количество клеток в культуре, проявляющих кальциевую активность (%).
Пример 1.
На этапе 0-14 дней сокультивирования первичных нейрональных культур со скаффолдами, представляющими собой нетканые пленки (состав: коллаген 1 типа нативный нереконструированный из шкуры крупного рогатого скота, сшитый с помощью диглицидилового эфира бутанодиола) отмечается активное прикрепление клеток к материалу и их дальнейшее развитие на поверхности конструкта в виде клеточных конгломератов (кол-во конгломератов/200 мкм2 7,47±1,03, площадь поверхности конгломератов 8073,01±5003,29 мкм2), образующих между собой связи.
Анализ морфометрических показателей не выявил достоверных различий с контрольной культурой, культивируемой без присутствия скаффолда (табл. 2), что говорит об отсутствии влияния материала на морфометрические характеристики клеток.
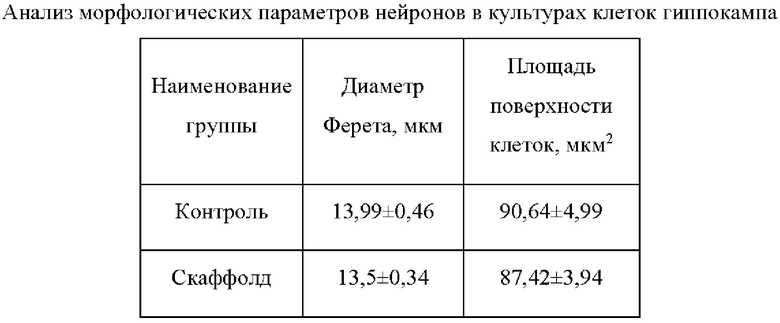
Установлено, что скаффолды обладают автофлуоресценцией, в связи с чем оценка жизнеспособности проводилась относительно клеток, находящихся в непосредственной близости к скаффолду.
Количественный анализ жизнеспособности клеток первичных нейрональных культур не выявил достоверных различий от группы культур, культивируемых без скаффолда (табл. 3), что свидетельствует об отсутствии токсических свойств.

Данные жизнеспособности подтверждаются качественным анализом (просмотр микрофотографий, полученных методом световой микроскопии - не менее 10 полей зрения) (рис. 1). Согласно шкале ГОСТ Р ИСО 10993-5:2009 цитотоксичность материала скаффолдов составляет 0 баллов (не цитотоксичный).
Анализ функциональной кальциевой активности первичных нейрональных культур, сокультивируемых со скаффолдом, не выявил значимых различий в проценте активных клеток и частоты кальциевых осцилляций по сравнению со значениями, зарегистрированными в группе культур, культивируемых без скаффолда (рис. 2). Тем не менее отмечается модуляция метаболической активности клеток, характеризующаяся снижением длительности кальциевых осцилляций. Изменения могут быть связаны с ослаблением потока кальция из эндоплазматического ретикулума или сниженной концентрацией кальция в эндоплазматическом ретикулуме, но не свидетельствуют о цитотоксическом эффекте.
На основе полученных результатов можно сделать заключение, что материал тестируемого скаффолда имеет хорошие адгезивные свойства и высокую биосовместимость с клетками нервной системы, характеризующуюся отсутствием токсических эффектов и наличием функционально активных клеточных конгломератов на поверхности конструкта. Разработанный образец скаффолда может быть рекомендован к проведению исследований in vivo для установления степени биосовместимости на организменном уровне.
Пример 2.
На этапе 0-14 дней сокультивирования первичных нейрональных культур со скаффолдами, представляющими собой сшитый гидрогелевый объем в виде цилиндра диаметром 5 мм и высотой 1 мм (состав: метакрилированная гиалуроновая кислота, синтез 14.1н (степень замещения 39%) - 20%; полиэтиленгликоль диакрилат, Mn=575 - 2.5%; рибофлавин мононуклеотид - 0.0025%; триэтаноламин - 0.5%, физраствор 76.9975%), отмечается активное прикрепление клеток к материалу и их дальнейшее развитие на поверхности конструкта в виде клеточных конгломератов (кол-во конгломератов/200 мкм2 9,71±0,8, площадь поверхности конгломератов 4162,81±1491,30 мкм2), образующих между собой связи.
Анализ морфометрических показателей выявил снижение диаметра Ферета и площади поверхности клеток относительно интактной группы (табл. 4), что может быть связано с не оптимальной архитектоникой конструкта.
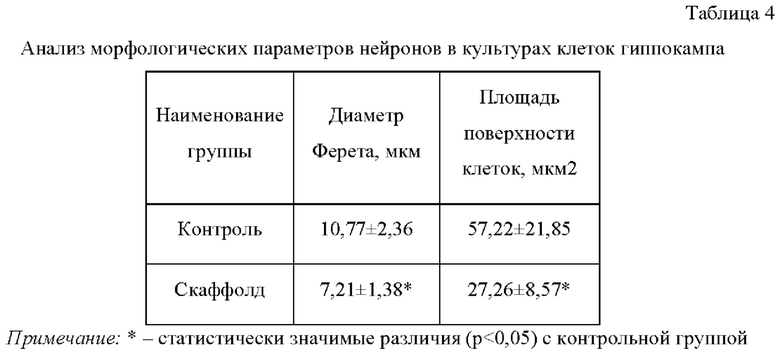
Установлено, что скаффолды обладают автофлуоресценцией, в связи с чем оценка жизнеспособности проводилась относительно клеток, находящихся в непосредственной близости к скаффолду.
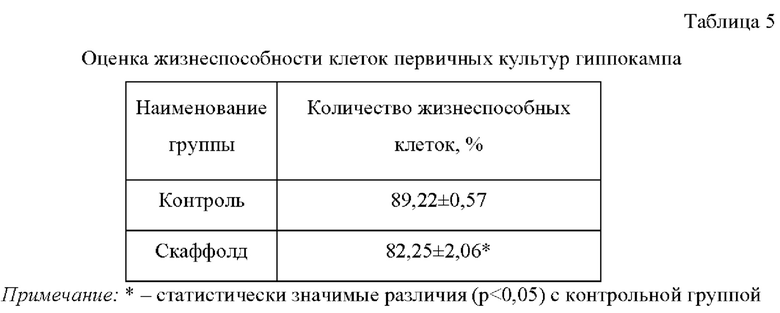
Количественный анализ жизнеспособности клеток первичных нейрональных культур выявил достоверные различия в проценте живых клеток по сравнению с показателями группы культур, культивируемых без скаффолда (табл. 5), что говорит о наличии цитотоксического эффекта.
Данные жизнеспособности подтверждаются качественным анализом (просмотр микрофотографий, полученных методом световой микроскопии не менее 10 полей зрения) (рис. 3). Согласно шкале ГОСТ Р ИСО 10993-5:2009 цитотоксичность материала скаффолдов составляет 1 балл (легкая цитотоксичность).
На основе полученных результатов можно сделать заключение, что материал тестируемого скаффолда имеет хорошие адгезивные свойства для клеток нервной системы, однако имеет не оптимальную архитектонику для полноценного их развития, а также обладает легким цитотоксическим действием. Разработанный образец скаффолда может быть рекомендован к проведению исследований in vivo для установления степени биосовместимости на организменном уровне только после существенной доработки.
Таким образом, предлагается эффективный способ первичной оценки биосовместимости скаффолдов, предназначенных для нейротрансплантации.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ IN VIVO ОПРЕДЕЛЕНИЯ БИОСОВМЕСТИМОСТИ СКАФФОЛДОВ ДЛЯ НЕЙРОТРАНСПЛАНТАЦИИ | 2021 |
|
RU2812608C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3D-СКАФФОЛДОВ С ФУНКЦИЕЙ УСКОРЕНИЯ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ | 2024 |
|
RU2841294C1 |
| МАТРИЦА ДЛЯ КЛЕТОЧНОЙ ТРАНСПЛАНТОЛОГИИ | 2011 |
|
RU2521194C2 |
| Способ получения органоидов мозга (нейросфер) на скаффолдах из высокоориентированных нановолокон | 2021 |
|
RU2797859C1 |
| Способ получения тканеинженерной in vitro модели плоскоклеточного рака головы и шеи человека | 2023 |
|
RU2825474C1 |
| СПОСОБ ФАБРИКАЦИИ КОНСТРУКТОВ ИЗ ФОСФАТОВ КАЛЬЦИЯ | 2019 |
|
RU2725111C1 |
| Способ получения многокомпонентных сфероидов для in vitro моделирования высоко- и умеренно дифференцированного плоскоклеточного рака кожи или органов головы и шеи человека | 2022 |
|
RU2798548C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИМЕРНОГО МАТЕРИАЛА ДЛЯ ЗАМЕЩЕНИЯ ДЕФЕКТОВ КОСТИ | 2020 |
|
RU2758863C1 |
| Способ получения инъекционного резорбируемого имплантата на основе поликапролактона и мультипотентных стромальных клеток пупочного канатика | 2017 |
|
RU2660550C1 |
| Трансплантат - тканеинженерная надхрящница для восстановления хряща субъекта | 2023 |
|
RU2822238C1 |
Настоящее изобретение к области клеточной и тканевой биологии, медицины и нейробиологии, в частности к способу in vitro определения биосовместимости скаффолдов для нейротрансплантации. Для осуществления способа сокультивируют первичные нейрональные культуры с начальной плотностью клеток 27000 клеток/см2, полученных из ткани головного мозга эмбрионов мыши линии SHK, со скаффолдами на поверхности конструктов. Далее определяют показатели жизнеспособности, морфометрические параметры и показатели функциональной активности клеток в культуре, оценивают уровни цитотоксичности материала скаффолда, его адгезивные свойства и оптимальность архитектоники скаффолда. При этом оценку жизнеспособности проводят с использованием флуоресцентных красителей пропидий йодида и бис-бензимида, а также качественно с использованием шкалы цитотоксичности, согласно которой материал скаффолда не проявляет токсического действия на нервные клетки при наличии 90-100% жизнеспособных клеток в культуре. Оценку морфометрических параметров клеточной культуры осуществляют с использованием сканирующей микроскопии и программы ImageJ, по результатам которой при снижении диаметра Ферета и площади поверхности клеток в 1,5 раза и более, считают, что материал конструкта оказывает деструктивное воздействие на культуру клеток. Анализ спонтанной кальциевой активности проводят с использованием специфического кальциевого красителя Oregon Green 488 BAPTA-1 АМ и конфокального лазерного сканирующего микроскопа, по результатам которого скаффолд считают биосовместимым при количестве клеток, проявляющих кальциевую активность, не менее 80%, длительности кальциевых событий 8-10 секунд, частоты кальциевых осцилляций 1,5-2 количество кальциевых событий/мин. Адгезивные свойства скаффолда оценивают по площади поверхности клеточных конгломератов и по их количеству, согласно которым материал скаффолда обладает хорошими адгезивными свойствами для нервных клеток при формировании на скаффолде не менее 7 клеточных конгломератов/200 мкм2 с площадью поверхности не менее 8000 мкм2. Настоящее изобретение позволяет повысить эффективность и точность оценки рисков развития патологических реакций, которые могут привести к отторжению трансплантата. 1 з.п. ф-лы, 3 ил., 5 табл., 2 пр.
1. Способ in vitro определения биосовместимости скаффолдов для нейротрансплантации включает сокультивирование первичных нейрональных культур со скаффолдами на поверхности конструктов, определение показателей жизнеспособности, морфометрических параметров и показателей функциональной активности клеток в культуре, оценку уровня цитотоксичности материала скаффолда, его адгезивных свойств и оптимальности архитектоники скаффолда для нейротрансплантации на основании регистрируемых параметров, при этом оценку жизнеспособности проводят с использованием флуоресцентных красителей пропидий йодида и бис-бензимида, а также качественно с использованием шкалы цитотоксичности, согласно которой материал скаффолда не проявляет токсического действия на нервные клетки при наличии 90-100% жизнеспособных клеток в культуре, проявляет легкую цитотоксичность при наличии 80-90% жизнеспособных клеток в культуре, проявляет среднюю цитотоксичность при наличии 70-80% жизнеспособных клеток в культуре, проявляет значительную цитотоксичность при наличии менее 70% жизнеспособных клеток в культуре, оценку морфометрических параметров клеточной культуры, культивируемой на поверхности конструкта, осуществляют с использованием сканирующей микроскопии и программы ImageJ, по результатам которой при снижении показателей, таких как диаметр Ферета и площадь поверхности клеток, в группе со скаффолдом относительно контрольной в 1,5 раза и более считают, что материал конструкта и его структура оказывает деструктивное воздействие на культуру клеток, анализ спонтанной кальциевой активности проводят с использованием специфического кальциевого красителя Oregon Green 488 BAPTA-1 АМ и конфокального лазерного сканирующего микроскопа, по результатам которого скаффолд считают биосовместимым при количестве клеток, проявляющих кальциевую активность, не менее 80%, длительности кальциевых событий 8-10 секунд, частоты кальциевых осцилляций 1,5-2 количество кальциевых событий/мин, адгезивные свойства скаффолда оценивают по площади поверхности клеточных конгломератов и по их количеству, согласно которым материал скаффолда обладает хорошими адгезивными свойствами для нервных клеток при формировании на скаффолде не менее 7 клеточных конгломератов/200 мкм2 с площадью поверхности не менее 8000 мкм2, используют первичные нейрональные культуры с начальной плотностью клеток 27000 клеток/см2, полученные из ткани головного мозга эмбрионов мыши линии SHK.
2. Способ по п. 1, отличающийся тем, что экспериментальные методы, позволяющие оценить безопасность использования скаффолдов, проводят на 14 день культивирования первичных нейрональных культур.
| T.A | |||
| MISHCHENKO et al | |||
| Features of primary hippocampal cultures formation on scaffolds based on hyaluronic acid glycidyl methacrylate, pp.103-110, DOI: 10.17691/stm2018.10.1.13 | |||
| СПОСОБ МИКРОСКОПИЧЕСКОЙ ОЦЕНКИ ЦИТОТОКСИЧНОСТИ КОМПОНЕНТОВ МАТЕРИАЛОВ СКАФФОЛДОВ | 2017 |
|
RU2653476C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО АНАЛИЗА КЛЕТОЧНОЙ СОСТАВЛЯЮЩЕЙ СКАФФОЛДА | 2017 |
|
RU2675376C1 |
Авторы
Даты
2022-07-21—Публикация
2020-12-30—Подача