Предлагаемое изобретение относится к области медицины, биологии и ветеринарии, и может быть использовано для определения кинетики биодеградации полимерных скаффолдов, используемых в тканевой инженерии и регенеративной медицине при пластике или замещении дефектов тканей организма.
Дефекты костных тканей, полученные в результате хирургических вмешательств, механических травм или врожденных аномалий, представляют актуальную современную медицинскую и социальную проблему во всем мире, значимость которой увеличивается из года в год. Тканевая инженерия и регенеративная медицина являются главными междисциплинарными областями, которые занимаются восстановлением и замещением поврежденной костной ткани. В настоящее время устранение дефектов костной ткани в тканевой инженерии и регенеративной медицине связано с объединением ряда технологий, ключевые компоненты которых включают трехмерные скаффолды и клетки, подсаженные на скаффолд перед имплантацией (Кузнецова, Д.С. Костные имплантаты на основе скаффолдов и клеточных систем в тканевой инженерии (обзор) / Д.С. Кузнецова, П.С. Тимашев, В.Н. Баграташвили и др. // Современные технологии в медицине. 2014. Т. 6. С. 201-212). Использование биодеградируемых полимеров для синтеза скаффолдов способствует клеточной жизнеспособности и восстановлению костной ткани, которая замещает со временем материал скаффолда. Успех устранения костного дефекта зависит от большого количества параметров, из которых крайне важным является скорость биодеградации материала скаффолда. В целом, основная функция скаффолда заключается в обеспечении временного каркаса для подсаженных клеток и платформы для формирующейся костной ткани в месте дефекта. В связи с этим скорость биодеградации материала должна коррелировать со скоростью восстановления собственной ткани, замещающей скаффолд, важно определить кинетику биодеградации полимерных скаффолдов.
В настоящее время активно развиваются подходы к оценке скорости биодеградации скаффолдов in vivo с помощью оптических методов. Такие подходы включают использование флуоресцентных маркеров-красителей с целью последующего их мониторинга, используя способы флуоресцентного биоимиджинга. Так в работе Wang с соавт. (Wang, W.L. Enhanced Bone Tissue Regeneration by Porous Gelatin Composites Loaded with the Chinese Herbal Decoction Danggui Buxue Tang / W.L. Wang, S.Y. Sheu, Y.S. Chen [et al.] // PLoS One. - 2015. - Vol. 10, N. 6. - P. e0131999) скаффолды, имплантированные в дефект черепа мыши, были визуализированы путем инъекции в хвостовую вену флуоресцентного красителя XenoLight RediJect Bone Probe 680, который идентифицирует отложения гидроксиапатита - основного минерального компонента костной ткани. Визуализация происходила с помощью установки для оптического биоимиджинга IVIS in vivo (Xenogen Alameda, CA).
Существенным недостатком известного способа является необходимость экзогенного введения в организм флуоресцентного красителя-маркера. Флуоресцентный краситель представляет собой, как правило, синтетически синтезированное вещество, чужеродное для организма, которое вследствие этого может вызывать иммунную реакцию, а также обладать токсичными свойствами.
Известен способ определения кинетики биодеградации скаффолдов (Zhu, N. А study on the in vitro degradation of poly(L-lactide)/chotosan microspheres scaffolds / N. Zhu, D. Cooper, X. Chen et al. // Frontiers of Materials Science. 2013. V. 7, N. 1. P. 76-82), который основан на регистрации изменения массы в биологических средах, а так же морфологическом анализе имплантов ex vivo. Основным недостатком указанного способа является то, что для определения кинетики биодеградации необходимо произвести забор имплантированного скаффолда.
В качестве прототипа выбран известный способ определения кинетики биодеградации полимерных скаффолдов in vivo, включающий создание модели травмы черепной ткани лабораторного животного, имплантацию полимерного скаффолда с флуоресцентными метками и подсаженными стволовыми клетками в сформированный дефект и регистрацию флуоресцентного сигнала от имплантированного скаффолда с помощью инструментальных методов (Kim, S.H. Near-infrared fluorescence imaging for noninvasive trafficking of scaffold degradation / S.H. Kim, J.H. Lee, H. Hyun et al. // Scientific Reports. 2013. V. 3. P. 1198).
Известный способ осуществляют следующим образом.
В процессе синтеза полимерного скаффолда в его структуру внедряют флуоресцентный краситель ZW800-1 ближнего ИК-диапазона. Для этого флуоресцентный краситель подвергают модификации с помощью реагента-активатора карбоновых кислот, N-гидроксисукцинимида (NHS). Готовую реакционную систему «NHS эфир-флуоресцентный краситель» в фосфатном буфере вносят в скаффолд. Таким образом, на выходе получают ZW800-1 скаффолд, флуоресцирующий в ближнем ИК-диапазоне. В синтезированный скаффолд внедряют стволовые клетки. После создания модели травмы черепной ткани лабораторному животному имплантируют ZW800-1 скаффолд. В течение 28 дней с помощью интраоперационной системы оптического биоимиджинга FLARE™ со специально подобранными фильтрами (длина волны возбуждения 750±25 нм, длина волны эмиссии 810±20 нм) регистрируют флуоресцентный сигнал от имплантированного скаффолда. Полученные флуоресцентные изображения обрабатывают с целью получения количественных данных. По изменению интенсивности флуоресцентного сигнала скаффолда после имплантации судят о скорости их биодеградации. Интенсивность флуоресцентного сигнала прямо коррелирует с размером скаффолда.
Известный способ относится к неинвазивным методам исследования, однако имеет ряд недостатков.
1. В процессе синтеза полимерного скаффолда флуоресцентный краситель в структуре скаффолда может распределяться по его объему неравномерно. Это приводит к отклонению полученных оценок степени биодеградации скаффолда от реальных значений, что снижает точность известного способа.
2. Известный способ позволяет регистрировать флуоресцентный сигнал только в ближнем ИК-диапазоне с точным подбором настроек и фильтров для визуализации в связи со строго определенными длинами волн возбуждения и эмиссии флуоресцентного сигнала, что усложняет и удлиняет время исследования.
3. Используемый флуоресцентный краситель ZW800-1 и дополнительные компоненты синтеза могут обладать токсичными свойствами, что приводит к повышенным нагрузкам на нормально функционирующие органы (печень, почки, селезенка). Поэтому экзогенные модифицированные флуоресцентные красители могут использоваться только в доклинических исследованиях, а внедрение их в клиническую практику невозможно.
Задачей предлагаемого изобретения является создание способа определения кинетики биодеградации полимерного скаффолда, лишенного недостатков прототипа.
Техническим результатом предлагаемого изобретения является повышение точности определения, снижение токсической нагрузки и упрощение способа.
Технический результат достигается тем, что для определения кинетики биодеградации полимерного скаффолда in vivo, в способе, включающем создание модели травмы черепной костной ткани на лабораторном животном, имплантацию полимерного скаффолда с флуоресцентными метками и подсаженными стволовыми клетками в сформированный дефект и регистрацию флуоресцентного сигнала от имплантированного скаффолда с помощью инструментальных методов, скаффолд синтезируют с помощью метода микростереолитографии, под действием лазерного излучения, по всему объему скаффолда в процессе синтеза формируются флуоресцентные центры, с помощью флуоресцентной микроскопии регистрируют интенсивность флуоресценции полимерного скаффолда на 2, 45 и 90 дни эксперимента при длинах волн возбуждения 340, 450 и 572 нм и длинах волн эмиссии 470, 515 и 629 нм.
Предлагаемое изобретение отвечает критериям «новизна» и «изобретательский уровень», так как в процессе проведения патентно-информационных исследований не выявлены источники научно-медицинской и патентной документации, порочащие новизну предлагаемого способа, равно как и технических решений с существенными признаками предлагаемого способа.
Технический результат предлагаемого способа заключается в повышении точности определения кинетики биодеградации полимерного скаффолда in vivo за счет того, что флуоресцентные центры создаются в процессе формирования структуры скаффолда, а не добавляются после. По этой же причине исчезает необходимость в добавлении экзогенных флуоресцентных красителей и других визуализирующих агентов в скаффолды после их синтеза, что исключает токсическое воздействие на органы лабораторного животного.
Способ иллюстрируется фиг. 1 и 2.
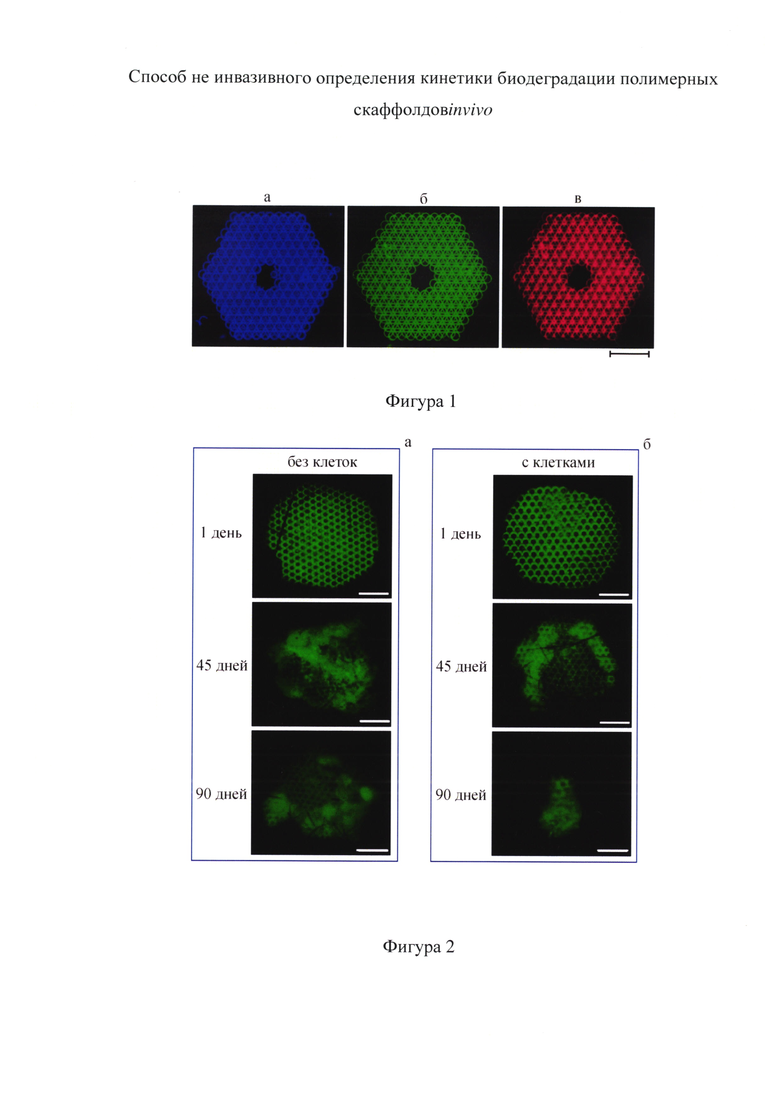
Фиг. 1 - изображения полученных скаффолдов в свете флуоресценции при различных комбинациях длин волн возбуждения/эмиссии, а - 340/470 нм, б - 450/515 нм, в - 572/629 нм. Шкала 1 мм.
Фиг. 2 - изображения скаффолдов в свете флуоресценции в черепе мыши при разных сроках имплантации без подсаженных клеток (а) и с подсаженными клетками (б). Длина волны возбуждения 450 нм, эмиссии 515 нм. Шкала 1 мм.
Проведенные эксперименты показали, что при инициации пространственной сшивки полимеров под действием излучения лазера, радикалы, сформированные при распаде фотоинициатора, однородно встраиваются в трехмерную структуру материала, создавая стабильную долгоживущую флуоресцентную форму. Как видно из фиг. 1, структуры, сформированные с использованием фотоинициатора лазерными технологиями, обладают сильной флуоресценцией во всей видимой области спектра. При этом было установлено, что интенсивность флуоресцентного сигнала однозначно зависит от размера скаффолда, и с его уменьшением в процессе биодеградации так же уменьшается. Это происходит за счет разрушения структуры полимера и вымывания фрагментов макромолекул. Фиг. 2 иллюстрирует зарегистрированное уменьшение интенсивности флуоресценции скаффолда в процессе его биодеградации, которая происходит как с подсаженными в скаффолд клетками, так и без них.
Проведенные авторами исследования показали, что флуоресцентный сигнал от сформированного лазерным излучением полимерного скаффолда после имплантации надежно регистрируется, при этом его интенсивность определяется с помощью известных компьютерных программ. А полученная временная зависимость уменьшения интенсивности флуоресцентного сигнала позволяет характеризовать кинетику биодеградации скаффолда in vivo. Поскольку структуры синтезированного скаффолда имеют сильный флуоресцентный сигнал во всей области видимого спектра, их можно визуализировать с помощью обыкновенных коммерческих установок, выбирая в зависимости от конкретных условий наиболее удобную комбинацию длин волн возбуждения и эмиссии.
Предлагаемый способ осуществляют следующим образом.
У лабораторных животных с помощью стоматологического оборудования формируют костный дефект черепа. Синтезируют полимерный скаффолд из четырехфункционального полилактида с помощью метода микростереолитографии под действием излучения лазера. Полимер растворяют в хлористом метилене, после чего на покровное стекло наносят слой раствора толщиной 500 мкм. Лазерное излучение фокусируют в объем слоя и по заданной компьютерной модели начинают перемещение столика для формирования необходимой структуры. Разработанная компьютерная модель состоит из взаимосвязанных полых цилиндров (высота 150 мкм, диаметр внешний 160 мкм, диаметр внутренний 80 мкм). Затем на сформированный скаффолд подсаживают клеточную культуру, в качестве которой используют мультипотентные мезенхимальные стволовые клетки (ММСК) костного мозга мышей. Скаффолд имплантируют в созданный дефект. Кинетику биодеградации полимерного скаффолда определяют по изменению интенсивности флуоресценции с помощью флуоресцентной Zoom-микроскопии (Axio Zoom.V16, Карл Цейс, Германия) на 2, 45 и 90 дни эксперимента при длинах волн возбуждения 340, 450 и 572 нм и длинах волн эмиссии 470, 515 и 629 нм. Полученные флуоресцентные изображения обрабатывают в программе ImageJ. В качестве количественной оценки определяют интегральное значение интенсивности флуоресцентного сигнала и площадь скаффолда. Примеры конкретного исполнения даны в виде протоколов экспериментов.
Пример 1
Животное - мышь линии С57/В16, самец массой 22 г. В черепе сформирован 4-мм костный дефект. В место дефекта внедрен скаффолд, синтезированный с помощью метода микростереолитографии под действием лазерного излучения, что позволило сформировать флуоресцентные центры по всему объему скаффолда. Стволовые клетки не подсаживались. На второй день после имплантации интенсивность флуоресцентного сигнала зарегистрирована с помощью Zoom-микроскопа Axio Zoom. V16 (Карл Цейс, Германия) при длине волны возбуждения 340 нм и длине волны эмиссии 470 нм. Изображения обработаны в программе ImageJ. Площадь скаффолда, которая имеет флуоресцентный сигнал, и интегральное значение интенсивности сигнала условно приняты за 100%. Спустя 45 дней и 90 дней после имплантации проведена повторная регистрация флуоресцентного сигнала и обработка полученных изображений. Показано, что через 45 дней после имплантации уровень автофлуоресценции скаффолда составлял 58% от первоначального, а площадь - 84%. Внешне полимерный скаффолд терял четкие границы. Спустя 90 дней после имплантации, уровень флуоресцентного сигнала и площадь полимерного скаффолда без подсаженных клеток практически не изменились по сравнению с этими же параметрами в 45 дней и составляли 50% и 80% соответственно.
Пример 2
Животное - мышь линии С57/В16, самец массой 23 г. В черепе сформирован 4-мм костный дефект. В место дефекта внедрен скаффолд, синтезированный с помощью метода микростереолитографии под действием лазерного излучения, что позволило сформировать флуоресцентные центры по всему объему скаффолда и с предварительно подсаженными мультипотентными мезенхимальными стволовыми клетками (ММСК) костного мозга мышей. На вторые сутки после имплантации интенсивность флуоресцентного сигнала зарегистрирована с помощью Zoom-микроскопа Axio Zoom. V16 (Карл Цейс, Германия) при длине волны возбуждения 450 нм и длине волны эмиссии 515 нм. Изображения обработаны в программе ImageJ. Площадь скаффолда и интегральное значение интенсивности сигнала условно приняты за 100%. Спустя 45 дней и 90 дней после имплантации, проведена повторная регистрация флуоресцентного сигнала скаффолда и обработка полученных изображений. Показано, что через 45 дней после имплантации уровень флуоресценции скаффолда с ММСК составлял 48% от первоначального, а площадь - 82%. Внешне скаффолды с ММСК так же как и без клеток теряли четкие границы. Спустя 90 дней после имплантации уровень флуоресцентного сигнала и площадь скаффолдов с ММСК существенно уменьшились и составляли 30 и 47% от первоначального. Внешне от скаффолда с ММСК оставалась небольшая плохо структурированная часть с неровными границами.
Пример 3
Животное - мышь линии С57/В16, самец массой 23 г. В черепе сформирован 4-мм костный дефект. В место дефекта внедрен скаффолд, синтезированный с помощью метода микростереолитографии под действием лазерного излучения, что позволило сформировать флуоресцентные центры по всему объему скаффолда и с подсаженными ММСК, которые предварительно подвергались направленной остеогенной дифференцировке (ММСК-ОД). На вторые сутки после имплантации интенсивность флуоресцентного сигнала зарегистрирована с помощью Zoom-микроскопа Axio Zoom. V16 (Карл Цейс, Германия) при длине волны возбуждения 572 нм и длине волны эмиссии 629 нм. Изображения обработаны в программе ImageJ. Площадь скаффолда, которая имела флуоресцентный сигнал, и интегральное значение интенсивности сигнала условно приняты за 100%. Спустя 45 и 90 дней после имплантации проведена повторная регистрация флуоресцентного сигнала и обработка полученных изображений. Показано, что через 45 дней после имплантации уровень флуоресценции скаффолда с ММСК-ОД составлял 60% от первоначального, а площадь - 75%. Спустя 90 дней после имплантации уровень флуоресцентного сигнала и площадь скаффолдов с ММСК-ОД уменьшились более чем в три раза и составляли 17 и 21% от первоначального. Внешне от скаффолда с ММСК-ОД оставалась небольшая плохо структурированная часть с неровными границами.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ НЕИНВАЗИВНОГО МОНИТОРИНГА БИОДЕГРАДАЦИИ ПОЛИМЕРНОГО СКАФФОЛДА | 2024 |
|
RU2832295C1 |
| Способ определения жизнеспособности клеток в биомедицинских клеточных продуктах в процессе регенерации | 2021 |
|
RU2777257C1 |
| ПРИМЕНЕНИЕ БАКТЕРИАЛЬНОЙ БЕТА-ЛАКТАМАЗЫ ДЛЯ ДИАГНОСТИКИ IN VITRO И ВИЗУАЛИЗАЦИИ, ДИАГНОСТИКИ И ЛЕЧЕНИЯ IN VIVO | 2009 |
|
RU2520661C2 |
| Биоактивный полимерный пористый каркас | 2016 |
|
RU2665175C2 |
| Способ пробоподготовки клеточно-инженерной конструкции на основе полимолочной кислоты и культуры эукариотических клеток для гистологического анализа | 2022 |
|
RU2793462C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИМЕРНОГО МАТЕРИАЛА ДЛЯ ЗАМЕЩЕНИЯ ДЕФЕКТОВ КОСТИ | 2020 |
|
RU2758863C1 |
| СПОСОБ ПРИМЕНЕНИЯ ФИКОБИЛИПРОТЕИНОВ В КАЧЕСТВЕ ОПТИЧЕСКИХ СЕНСОРОВ ЛОКАЛЬНОЙ ТЕМПЕРАТУРЫ В ЖИВЫХ КЛЕТКАХ И ТКАНЯХ | 2021 |
|
RU2780954C1 |
| БИОПОЛИМЕРНЫЙ МАТРИКС ДЛЯ ПРОЛИФЕРАЦИИ КЛЕТОК И РЕГЕНЕРАЦИИ НЕРВНЫХ ТКАНЕЙ | 2011 |
|
RU2478398C1 |
| СПОСОБ ИССЛЕДОВАНИЯ РАННЕЙ ФАРМАКОЦИТОКИНЕТИКИ ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТОВ IN VITRO | 2007 |
|
RU2342654C1 |
| Способ in vitro определения биосовместимости скаффолдов для нейротрансплантации | 2020 |
|
RU2776455C2 |
Изобретение относится к медицине, биологии и ветеринарии и может быть использовано для определения кинетики биодеградации полимерных скаффолдов in vivo, используемых в тканевой инженерии и регенеративной медицине при пластике или замещении дефектов тканей организма. Для этого создают модель травмы черепной костной ткани на лабораторном животном, проводят имплантацию полимерного скаффолда с флуоресцентными метками и подсаженными стволовыми клетками в сформированный дефект и регистрацию флуоресцентного сигнала от имплантированного скаффолда. Скаффолд синтезируют с помощью метода микростереолитографии под действием лазерного излучения. При этом по всему объему скаффолда формируются флуоресцентные центры. С помощью флуоресцентной микроскопии регистрируют интенсивность флуоресценции полимерного скаффолда на 2, 45 и 90 дни эксперимента при длинах волн возбуждения 340, 450 и 572 нм и соответственно длинах волн эмиссии 470, 515 и 629 нм. Способ обеспечивает повышение точности определения, снижение токсической нагрузки и упрощение процедуры. 2 ил., 3 пр.
Способ определения кинетики биодеградации полимерных скаффолдов in vivo, включающий создание модели травмы черепной костной ткани на лабораторном животном, имплантацию полимерного скаффолда с флуоресцентными метками и подсаженными стволовыми клетками в сформированный дефект и регистрацию флуоресцентного сигнала от имплантированного скаффолда, отличающийся тем, что скаффолд синтезируют с помощью метода микростереолитографии под действием лазерного излучения, по всему объему скаффолда формируются флуоресцентные центры, с помощью флуоресцентной микроскопии регистрируют интенсивность флуоресценции полимерного скаффолда на 2, 45 и 90 дни эксперимента при длинах волн возбуждения 340, 450 и 572 нм и соответственно длинах волн эмиссии 470, 515 и 629 нм.
| KIM S.H | |||
| et al | |||
| Near-infrared fluorescence imaging for noninvasive trafficking of scaffold degradation | |||
| Scientific Reports | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| V | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| P | |||
| Приспособление для перемещения нижней крышки в загрузочной коробке генератора | 1923 |
|
SU1198A1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРЕХМЕРНЫХ МАТРИЦ ДЛЯ ТКАНЕПОДОБНЫХ СТРУКТУР ИЗ КЛЕТОК ЖИВОТНОГО ПРОИСХОЖДЕНИЯ | 2008 |
|
RU2396342C1 |
| УНИВЕРСАЛЬНЫЙ ГЕТЕРОГЕННЫЙ КОЛЛАГЕНОВЫЙ МАТРИКС ДЛЯ ИМПЛАНТАЦИИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2003 |
|
RU2249462C1 |
| ПРЕПАРАТ СТВОЛОВЫХ КЛЕТОК С РЕПРОГРАММИРОВАННЫМ КЛЕТОЧНЫМ СИГНАЛИНГОМ, СПОСОБ ПОЛУЧЕНИЯ ЭТОГО ПРЕПАРАТА И ЕГО ПРИМЕНЕНИЕ | 2008 |
|
RU2428475C2 |
| US 8268342 B2, 18.09.2012 | |||
| US 20090317478 A1, 24.12.2009 | |||
| Костные имплантаты на основе скаффолдов и клеточных систем в тканевой инженерии (обзор) | |||
| Современные технологии в медицине, 2014, т.6, N4 http://www.stm-journal.ru/ru/numbers/2014/4/1115/html | |||
| FARKAS B et al | |||
| Four-order stiffness variation of laser-fabricated photopolymer biodegradable scaffolds by laser parameter modulation | |||
| Mater Sci Eng C Mater Biol Appl | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Устройство двукратного усилителя с катодными лампами | 1920 |
|
SU55A1 |
Авторы
Даты
2017-10-23—Публикация
2016-09-29—Подача