ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В данной заявке испрашивается приоритет согласно заявке на патент Индии No. 202011033169, поданной 3 августа 2020 года, описание которой включено в данное описание ссылкой во всей ее полноте.
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к некоторым производным 1,5-бензотиазепина и 1,2,5-бензотиадиазепина, как описано здесь. Эти соединения представляют собой модуляторы желчных кислот, обладающие активностью ингибирования апикального натрий-зависимого переносчика желчных кислот (ASBT) и/или переносчика желчных кислот в печени (LBAT). Изобретение также относится к фармацевтическим композициям, содержащим эти соединения, и к применению этих соединений в лечении сердечно-сосудистых заболеваний, нарушений метаболизма жирных кислот и утилизации глюкозы, желудочно-кишечных заболеваний и заболеваний печени.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Желчные кислоты представляют собой физиологические детергенты, которые играют важную роль в кишечной абсорбции и транспорте липидов, питательных веществ и витаминов. Они также являются сигнальными молекулами, которые активируют ядерные рецепторы и сигнальные пути клеток, которые регулируют липидный, глюкозный и энергетический метаболизм. Желчные кислоты являются стероидными кислотами, которые синтезируются из холестерина в печени и хранятся в желчном пузыре в виде смешанных мицелл. Во время пищеварения двенадцатиперстная кишка инициирует выброс гормонов, которые вызывают сокращение желчного пузыря, тем самым высвобождая желчные кислоты в тонком кишечнике, где они обеспечивают всасывание жирорастворимых витаминов и холестерина. Когда желчные кислоты достигают подвздошной кишки, они реадсорбируются из кишечника и секретируются в кровь портальной вены для возвращения в печень через портальное венозное кровообращение. Таким образом, более 90% желчных кислот перерабатываются и возвращаются в печень. Эти желчные кислоты затем транспортируются через синусоидальную мембрану гепатоцитов и повторно секретируются через канальцевую мембрану в желчь. При первом прохождении 75-90% желчных кислот поглощаются гепатоцитами, завершая один цикл энтерогепатической циркуляции. Фракция желчных кислот, которая не выводится печенью, попадает в системный кровоток, где свободные желчные кислоты фильтруются почечными клубочками, эффективно регенерируются в проксимальных канальцах и выводятся обратно в большой круг кровообращения. Интересно, что наибольшая часть желчных кислот, секретируемых через канальцевую мембрану в желчь, поступает из рециркулирующего пула, и менее 10% приходится на новый синтез в печени de novo. Небольшая часть желчных кислот, которая не реабсорбируется в подвздошной кишке, достигает толстой кишки. Внутри просвета кишечника первичные желчные кислоты превращаются во вторичные желчные кислоты под действием кишечных бактерий, главным образом, в результате реакций одинарного или двойного дегидроксилирования стероидного ядра. Желчные кислоты, которые не всасываются в кишечнике, затем выводятся с калом.
В целом, эффективная транспортная система помогает поддерживать постоянный пул желчных кислот, обеспечивая достаточно высокие уровни конъюгированных желчных кислот в тонком кишечнике, чтобы способствовать всасыванию липидов, а также снизить бактериальную нагрузку на тонкий кишечник. Эта система также минимизирует потерю желчных кислот с калом и мочой и защищает кишечные и гепатобилиарные компартменты, устраняя потенциально цитотоксические детергенты (согласно обзорам Kosters и Karpen (Xenobiotica 2008, vol. 38, p.1043-1071); Chiang (J. Lipid Res. 2009, vol. 50, p.1955-1966); и Dawson (Handb. Exp.Pharmacol. 2011, vol. 201, p.169-203)).
Было обнаружено, что регулирование размера пула желчных кислот играет ключевую роль в гомеостазе холестерина за счет преобразования холестерина в желчную кислоту в печени, что является основным путем выведения холестерина из организма. Печень играет важную роль в удалении из организма эндогенных и ксенобиотических соединений. Нормальная гепатобилиарная секреция и энтерогепатическая циркуляция необходимы для выведения из организма эндогенных соединений, таких как холестерин, билирубин и их метаболиты, тем самым поддерживая гомеостаз липидов и желчных кислот (Kosters and Karpen, Xenobiotica 2008, vol. 38, p. 1043-1071).
Реабсорбция желчных кислот в подвздошной кишке может подавляться соединениями-ингибиторами апикального натрий-зависимого переносчика желчных кислот (ASBT). Сообщалось, что ингибирование реабсорбции желчных кислот полезно в лечении нескольких заболеваний, включая дислипидемию, диабет, ожирение, запоры, холестатические заболевания печени, неалкогольный стеатогепатит и другие заболевания печени. Ряд соединений-ингибиторов ASBT был раскрыт за последние десятилетия, см., например, WO 93/16055, WO 94/18183, WO 94/18184, WO 96/05188, WO 96/08484, WO 96/16051, WO 97/33882, WO 98/03818, WO 98/07449, WO 98/40375, WO 99/35135, WO 99/64409, WO 99/64410, WO 00/47568, WO 00/61568, WO 00/38725, WO 00/38726, WO 00/38727, WO 00/38728, WO 00/38729, WO 01/66533, WO 01/68096, WO 02/32428, WO 02/50051, WO 03/020710, WO 03/022286, WO 03/022825, WO 03/022830, WO 03/061663, WO 03/091232, WO 03/106482, WO 2004/006899, WO 2004/076430, WO 2007/009655, WO 2007/009656, WO 2011/137135, WO 2019/234077, WO 2020/161216, WO 2020/161217, DE 19825804, ЕР 864582, ЕР 489423, ЕР 549967, ЕР 573848, ЕР 624593, ЕР 624594, ЕР 624595, ЕР 624596, ЕР 0864582, ЕР 1173205, ЕР 1535913 и ЕР 3210977.
Несмотря на ряд соединений-ингибиторов ASBT, о которых сообщалось ранее, существует потребность в дополнительных соединениях, модулирующих желчные кислоты, которые имеют оптимизированный профиль в отношении эффективности, селективности и биодоступности.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Было обнаружено, что некоторые производные бензотиазепина и бензотиадиазепина являются мощными ингибиторами апикального натрий-зависимого переносчика желчных кислот (ASBT) и/или переносчика желчных кислот печени (LBAT) и могут быть полезны для лечения заболеваний, при которых желательно ингибирование циркуляции желчных кислот.
Таким образом, в первом аспекте изобретение относится к соединению формулы (I)

где М, R1, R2, R3, R4, R5A и R5B являются такими, как указано в Таблице 1 ниже, или его фармацевтически приемлемой соли:






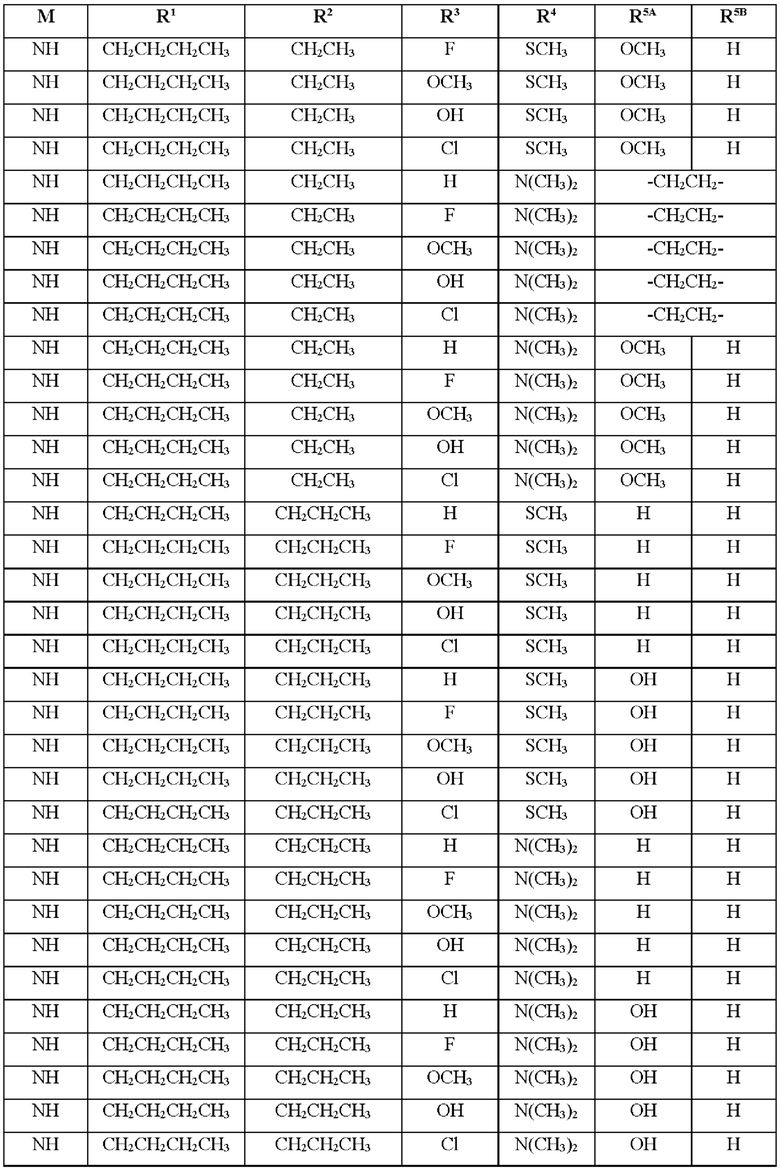


В конкретном воплощении соединение формулы (I) выбрано из группы, состоящей из:
(S)-3-(((S)-3-бутил-5-(4-фторфенил)-3-метил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропановой кислоты;
(S)-3-(((R)-3-бутил-5-(4-фторфенил)-3-метил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропановой кислоты;
(R)-3-(((S)-3-бутил-5-(4-фторфенил)-3-метил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропановой кислоты;
(R)-3-(((R)-3-бутил-5-(4-фторфенил)-3-метил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропановой кислоты;
1-(((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)метил)циклопропан-1-карбоновой кислоты;
(S)-1-(((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)метил)циклопропан-1-карбоновой кислоты;
(R)-1-(((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)метил)циклопропан-1-карбоновой кислоты;
3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2,2-диметилпропановой кислоты;
(S)-3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2,2-диметилпропановой кислоты;
(R)-3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2,2-диметилпропановой кислоты;
3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фтор-2-метилпропановой кислоты;
(S)-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фтор-2-метилпропановой кислоты;
(R)-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фтор-2-метилпропановой кислоты;
3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-метоксипропановой кислоты;
3-((3,3-дибутил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-метоксипропановой кислоты;
(S)-3-((3,3-дибутил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-метоксипропановой кислоты;
(R)-3-((3,3-дибутил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-метоксипропановой кислоты;
3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-этоксипропановой кислоты;
3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-этоксипропановой кислоты;
3-((3,3-диэтил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2,2-диметилпропановой кислоты; и
2-гидрокси-3-((7-(метилтио)-1,1-диоксидо-5-фенил-3,3-дипропил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)пропановой кислоты;
или его фармацевтически приемлемой соли.
Используемый здесь термин «фармацевтически приемлемый» относится к тем соединениям, материалам, композициям и/или лекарственным формам, которые подходят для фармацевтического применения человеком и которые обычно безопасны, нетоксичны и не являются нежелательными ни с биологической, ни с иной точки зрения.
Используемый здесь термин «примерно» относится к значению или параметру в данном документе, который включает (и описывает) воплощения, которые относятся к этому значению или параметру как таковому. Например, описание, относящееся к «примерно 20», включает описание «20». Числовые диапазоны включают числа, определяющие диапазон. Вообще говоря, термин «примерно» относится к указанному значению переменной и ко всем значениям переменной, которые находятся в пределах экспериментальной ошибки указанного значения (например, в пределах 95% доверительного интервала для среднего) или в пределах 10 процентов от указанного значения, в зависимости от того, какое из них больше.
1,5-Бензотиазепиновые и 1,2,5-бензотиадиазепиновые соединения формулы (I) или их фармацевтически приемлемые соли являются ингибиторами апикального натрий-зависимого переносчика желчных кислот (ингибиторы ASBT), переносчика желчных кислот печени (ингибиторы LBAT) или как апикального натрий-зависимого переносчика желчных кислот, так и переносчика желчных кислот печени (двойные ингибиторы ASBT/LBAT). Следовательно, они полезны в лечении или предупреждении состояний, нарушений и заболеваний, при которых желательно ингибирование циркуляции желчных кислот, таких как сердечно-сосудистые заболевания, нарушения метаболизма жирных кислот и утилизации глюкозы, желудочно-кишечных заболеваний и заболеваний печени.
Сердечно-сосудистые заболевания и нарушения метаболизма жирных кислот и утилизации глюкозы включают, без ограничения, гиперхолестеринемию; нарушения обмена жирных кислот; сахарный диабет 1 и 2 типа; осложнения диабета, в том числе катаракту, микро- и макрососудистые заболевания, ретинопатию, невропатию, нефропатию и замедленное заживление ран, ишемию тканей, диабетическую стопу, артериосклероз, инфаркт миокарда, острый коронарный синдром, нестабильную стенокардию, стабильную стенокардию, инсульт, окклюзионную болезнь периферических артерий, кардиомиопатию, сердечную недостаточность, нарушения сердечного ритма и рестеноз сосудов; заболевания, связанные с диабетом, такие как инсулинорезистентность (нарушение гомеостаза глюкозы), гипергликемию, гиперинсулинемию, повышенные уровни жирных кислот или глицерина в крови, ожирение, дислипидемию, гиперлипидемию, включая гипертриглицеридемию, метаболический синдром (синдром X), атеросклероз и гипертензию; и для повышения уровня липопротеинов высокой плотности.
Заболевания и расстройства желудочно-кишечного тракта включают запор (включая хронический запор, функциональный запор, хронический идиопатический запор (CIC), периодический/спорадический запор, запор на фоне сахарного диабета, запор на фоне инсульта, запор на фоне хронического заболевания почек, запор на фоне рассеянного склероза, запор на фоне болезни Паркинсона, запор на фоне системного склероза, запор, вызванный лекарствами, синдром раздраженного кишечника с запором (IBS-C), синдром раздраженного кишечника смешанный (IBS-M), детский функциональный запор и запор, вызванный опиоидами); болезнь Крона; первичную мальабсорбцию желчных кислот; синдром раздраженного кишечника (IBS); воспалительное заболевание кишечника (IBD); воспаление подвздошной кишки; и рефлюксную болезнь и ее осложнения, такие как пищевод Барретта, желчный рефлюксный эзофагит и желчный рефлюксный гастрит.
Заболевание печени, как определено в данном документе, представляет собой любое заболевание печени и связанных с ней органов, таких как поджелудочная железа, воротная вена, паренхима печени, внутрипеченочные желчные протоки, внепеченочные желчные протоки и желчный пузырь. В некоторых случаях заболевание печени представляет собой заболевание печени, зависимое от желчных кислот.Заболевания и нарушения печени включают, без ограничения, наследственное нарушение метаболизма печени; врожденные нарушения синтеза желчной кислоты; врожденные аномалии желчных протоков; атрезию желчевыводящих путей; билиарную атрезию после проведения операции по Касаи; посттрансплантационную атрезию желчных путей; неонатальный гепатит; неонатальный холестаз; наследственные формы холестаза; церебросухожильный ксантоматоз; вторичный дефект синтеза желчных кислот (ВА); синдром Цельвегера; заболевание печени, связанное с муковисцидозом; дефицит альфа1-антитрипсина; синдром Алажиля (ALGS); синдром Байлера; первичный дефект синтеза желчной кислоты (ВА); прогрессирующий семейный внутрипеченочный холестаз (PFIC), включая PFIC-1, PFIC-2, PFIC-3 и неспецифический PFIC, PFIC после отведения желчи и посттрансплантационный PFIC; доброкачественный рецидивирующий внутрипеченочный холестаз (BRIC), включая BRIC1, BRIC2 и неспецифический BRIC, BRIC после трансплантации желчных путей и BRIC после трансплантации печени; аутоиммунный гепатит; первичный билиарный цирроз (РВС); фиброз печени; неалкогольную жировую болезнь печени (NAFLD); неалкогольный стеатогепатит (NASH); портальную гипертензию; холестаз; холестаз при синдроме Дауна; лекарственный холестаз; внутрипеченочный холестаз беременных (желтуха при беременности); внутрипеченочный холестаз; внепеченочный холестаз; холестаз, связанный с парентеральным питанием (PNAC); холестаз, связанный с низким уровнем фосфолипидов; синдром холестаза с лимфедемами 1 (LSC1); первичный склерозирующий холангит (PSC); холангит, связанный с иммуноглобулином G4; первичный билиарный холангит; желчекаменную болезнь (желчные камни); желчный литиаз; холедохолитиаз; желчнокаменный панкреатит; болезнь Кароли; злокачественное новообразование желчных протоков; злокачественное новообразование, вызывающее непроходимость желчного дерева; стриктуры желчных путей; холангиопатию при СПИД; ишемическую холангиопатию; кожный зуд из-за холестаза или желтухи; панкреатит; хроническое аутоиммунное заболевание печени, ведущее к прогрессирующему холестазу; стеатоз печени; алкогольный гепатит; острый жировой гепатоз; ожирение печени при беременности; лекарственный гепатит; нарушения при перенасыщении железом; врожденный дефект синтеза желчных кислот 1-го типа (BAS 1-го типа); лекарственное поражение печени (DILI); фиброз печени; врожденный фиброз печени; цирроз печени; гистиоцитоз клеток Лангерганса (LCH); неонатальный ихтиоз, склерозирующий холангит (NISCH); эритропоэтическую протопорфирию (ЕРР); идиопатическую дуктопению в зрелом возрасте (IAD); идиопатический неонатальный гепатит (INH); несиндромальную недостаточность междольковых желчных протоков (NS PILBD); цирроз у детей североамериканских индейцев (NAIC); саркоидоз печени; амилоидоз; некротический энтероколит; токсичность сывороточной желчной кислоты, включая нарушения сердечного ритма (например, фибрилляцию предсердий) при аномальном профиле сывороточных желчных кислот, кардиомиопатию, связанную с циррозом печени («холекардию»), и истощение скелетных мышц, связанное с холестатической болезнью печени; поликистоз печени; вирусный гепатит (включая гепатит А, гепатит В, гепатит С, гепатит D и гепатит Е); гепатоцеллюлярную карциному (гепатому); холангиокарциному; рак желудочно-кишечного тракта, связанный с желчными кислотами; и холестаз, вызванный опухолями и новообразованиями печени, желчевыводящих путей и поджелудочной железы. Соединения формулы (I) или их фармацевтически приемлемые соли также полезны для усиления терапии кортикостероидами при заболевании печени.
Другие заболевания, которые можно лечить или предупреждать с помощью соединений формулы (I) или их фармацевтически приемлемых солей, включают синдромы гиперабсорбции (включая абеталипопротеинемию, семейную гипобеталипопротеинемию (FHBL), болезнь задержки хиломикронов (CRD) и ситостеролемию); гипервитаминоз и остеопетроз; гипертензию; клубочковую гиперфильтрацию; поликистоз почек (PKD), включая аутосомно-доминантный поликистоз почек (ADPKD) и аутосомно-рецессивный поликистоз почек (ARPKD); и кожный зуд при почечной недостаточности. Соединения также полезны для защиты от повреждения почек, связанного с заболеванием печени или метаболическим заболеванием.
Транспорт желчных кислот в организме человека контролируется действием членов семейства белков-переносчиков растворенных веществ SLC10, в частности, полипептида, переносящего Na+-таурохолат (NTCP, также называемого переносчиком желчных кислот печени (LBAT); символ гена SLC10A1), который экспрессируется в синусоидальной мембране гепатоцитов, и апикального натрий-зависимого переносчика желчных кислот (ASBT, также называемого переносчиком желчных кислот подвздошной кишки (IBAT), ISBT, АВАТ или NTCP2; генный символ SLC10A2), который экспрессируется в апикальной мембране энтероцитов подвздошной кишки, клетках проксимальных почечных канальцев, билиарном эпителии, больших холангиоцитах и эпителиальных клетках желчного пузыря. В печени желчные кислоты эффективно извлекаются из портальной крови переносчиком желчных кислот печени (LBAT) и повторно секретируются через канальцевую мембрану с помощью насоса экспорта солей желчных кислот (BSEP; символ гена АВСВ11). Реабсорбция желчных кислот в подвздошной кишке осуществляется апикальным натрий-зависимым переносчиком желчных кислот (ASBT), где его обычно называют переносчиком желчных кислот в подвздошной кишке (IBAT). Как LBAT, так и ASBT действуют как электрогенные котранспортеры растворенного натрия, которые переносят два или более иона Na+ на молекулу растворенного вещества.
Ксенобиотики и эндобиотики, включая желчные кислоты, поглощаются печенью из портальной крови и секретируются в желчь различными транспортными белками с индивидуальной специфичностью к субстрату. Конъюгированные с глицином и таурином желчные кислоты существуют в анионной форме и не могут проникать через мембраны путем диффузии и, таким образом, полностью зависят от мембранных транспортных белков для входа или выхода из гепатоцита (Kosters and Karpen, Xenobiotica 2008, vol. 38, p. 1043-1071). ASBT и LBAT предпочитают конъюгированные с глицином и таурином соли желчных кислот по сравнению с их неконъюгированными аналогами и демонстрируют более высокое сродство к солям дигидрокси-желчных кислот, чем к солям тригидрокси-желчных кислот. Субстратов, не являющихся желчными кислотами, для ASBT пока не обнаружено, однако также было обнаружено, что LBAT переносит различные стероидные сульфаты, гормоны и ксенобиотики.
LBAT не так подробно охарактеризован как ASBT, с точки зрения требований к ингибированию лекарственными средствами. Dong et al. идентифицировали одобренные FDA лекарственные средства, которые ингибируют LBAT человека, и сравнили требования к ингибированию LBAT и ASBT. Был проведен ряд исследований ингибирования LBAT с использованием лекарственных средств, одобренных FDA, в сочетании с разработкой итеративной вычислительной модели. Скрининговые исследования позволили идентифицировать 27 лекарственных средств в качестве новых ингибиторов LBAT, включая ирбесартан (Ki равно 11,9 мкМ) и эзетимиб (Ki равно 25,0 мкМ). Общая особенность фармакофора указывает на то, что два гидрофоба и один акцептор водородной связи важны для ингибирования LBAT. Из 72 лекарственных средств, проверенных in vitro, в общей сложности 31 лекарственное средство ингибировало LBAT, в то время как 51 лекарственное средство (то есть более половины) ингибировало ASBT. Следовательно, несмотря на перекрытие ингибиторов, ASBT неожиданно оказался более пермиссивным к ингибированию лекарственного средства, чем LBAT, и это может быть связано с тем, что LBAT обладает меньшим количеством фармакофорных свойств (Dong et al., Mol. Pharm. 2013, vol. 10, p. 1008 1019).
Vaz et al. описывают идентификацию дефицита LBAT как новую врожденную ошибку метаболизма с относительно мягким клиническим фенотипом. Идентификация дефицита LBAT подтверждает, что этот переносчик является основной системой импорта конъюгированных солей желчных кислот в печень, но также указывает на то, что вспомогательные переносчики способны поддерживать энтерогепатический цикл в его отсутствие (Vaz et al., Hepatology 2015, vol. 61, p. 260-267). Эти данные подтверждают гипотезу о том, что ингибирование LBAT является безопасным механизмом действия, поскольку гепатоциты все еще имеют возможность поглощать необходимое количество желчных кислот.
Liu et al. описывают идентификацию нового типа гиперхоланемии, которая связана с гомозиготностью по мутации p.Ser267Phe в SLC10A1 (LBAT). Частота аллелей этой мутации в гене SLC10A1 варьирует в разных популяциях, при этом наибольшая частота встречается в Южном Китае (8% и 12% у китайских популяций Хань и Дай, соответственно) и во Вьетнаме (11%). Считалось, что эта «скрытая» гиперхоланемия затронула 0,64% китайской популяции Южных Хань, 1,44% популяции Дай и 1,21% населения Вьетнама. Также наблюдалось повышение уровней конъюгированной и неконъюгированной ВА в сыворотке крови у гомозиготных индивидуумов. Liu et al. предполагают, что это обнаружение, скорее всего, связано со снижением транспорта ВА из портального кровотока в гепатоциты. Это подтверждает гипотезу о том, что физиологическая функция энтерогепатической циркуляции заключается не только в рециркуляции желчных кислот, но и в удалении желчных кислот из кровотока для достижения гомеостаза (Karpen and Dawson, Hepatology 2015, vol. 61, p. 24-27). Альтернативно, печень может синтезировать повышенные уровни желчных кислот для компенсации пониженной энтерогепатической рециркуляции у гомозиготных носителей. Поскольку LBAT также переносит неконъюгированные желчные кислоты, увеличение количества неконъюгированных желчных кислот в этом исследовании не было неожиданным (Liu et al., Scientific Reports 2017, 7: 9214, p. 1-7).
Было обнаружено, что LBAT отрицательно регулируется при нескольких формах холестатического поражения печени и холестаза, тогда как ASBT отрицательно регулируется при различных желудочно-кишечных расстройствах, таких как болезнь Крона, первичная мальабсорбция желчных кислот, воспалительные заболевания кишечника и воспаление подвздошной кишки, но положительно регулируется при холестазе. LBAT также функционирует как клеточный рецептор для проникновения вируса гепатита В (HBV) и вируса гепатита D (HDV), которые, в свою очередь, являются основной причиной заболеваний печени и гепатоцеллюлярной карциномы.
Ингибирование ASBT было исследовано на предмет снижения уровня холестерина в плазме и улучшения инсулинорезистентности, а также для уменьшения нагрузки желчных кислот в печени при холестатической болезни печени. Кроме того, было обнаружено, что ингибирование ASBT восстанавливает уровни инсулина и нормогликемию, что делает ингибирование ASBT перспективным лечением сахарного диабета 2 типа. Ингибиторы ASBT также используют для лечения функциональных запоров.
Поскольку ASBT преимущественно экспрессируется в подвздошной кишке (где его часто называют IBAT), ингибиторы ASBT не обязательно должны быть доступны системно. С другой стороны, ASBT также экспрессируется в клетках проксимальных канальцев почек. Следовательно, системные ингибиторы ASBT могут также ингибировать обратный захват желчных кислот почками. Полагают, что это приведет к повышению уровня желчных кислот в моче и к усиленному удалению желчных кислот из организма с мочой. Поэтому ожидается, что системно доступные ингибиторы ASBT, которые оказывают свое действие не только на подвздошную кишку, но и на почки, приведут к большему снижению уровней желчных кислот, чем несистемно доступные ингибиторы ASBT, которые оказывают свое действие только на подвздошную кишку.
Соединения, обладающие высокой активностью ингибирования ASBT, особенно подходят для лечения заболеваний печени, вызывающих холестаз, таких как прогрессирующий семейный внутрипеченочный холестаз (PFIC), синдром Алажиля, атрезия желчных путей и неалкогольный стеатогепатит (NASH).
Атрезия желчевыводящих путей представляет собой редкое заболевание печени у детей, которое включает частичную или полную закупорку (или даже отсутствие) крупных желчных протоков. Эта блокировка или отсутствие вызывает холестаз, который приводит к накоплению желчных кислот, которые повреждают печень. В некоторых воплощениях накопление желчных кислот происходит во внепеченочных желчных протоках. В некоторых воплощениях накопление желчных кислот происходит во внутрипеченочных желчных протоках. Современный стандарт лечения представляет собой процедуру Касаи, являющуюся операцией по удалению закупоренных желчных протоков и прямому соединению части тонкой кишки с печенью. В настоящее время нет одобренных лекарственных препаратов для лечения этого расстройства.
В настоящем документе предложены способы лечения атрезии желчных путей у субъекта, нуждающегося в этом, включающие введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых воплощениях субъект прошел процедуру Касаи перед введением соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых воплощениях субъекту вводят соединение формулы (I) или его фармацевтически приемлемую соль до прохождения процедуры Касаи. В некоторых воплощениях лечение атрезии желчных путей снижает уровень сывороточных желчных кислот у субъекта. В некоторых воплощениях уровень сывороточных желчных кислот определяют, например, с помощью ферментативного анализа ELISA или анализов для измерения общего количества желчных кислот, как описано у Danese et al., PLoS One. 2017, vol. 12 (6): e0179200, который полностью включен в настоящий документ ссылкой. В некоторых воплощениях уровень сывороточных желчных кислот может снижаться, например, на 10-40%, 20-50%, 30-60%, 40-70%, 50-80% или более 90% от уровня сывороточных желчных кислот до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых воплощениях лечение атрезии желчных путей включает лечение зуда.
PFIC представляет собой редкое генетическое заболевание, которым по оценкам страдает один на каждые 50000-100000 детей, рожденных во всем мире, и которое вызывает прогрессирующее, опасное для жизни заболевание печени.
Одним из проявлений PFIC является зуд, который часто приводит к серьезному ухудшению качества жизни. В некоторых случаях PFIC приводит к циррозу и печеночной недостаточности. Современные методы лечения включают частичное внешнее отведение желчных протоков (PEBD) и трансплантацию печени, однако эти варианты могут нести значительный риск послеоперационных осложнений, а также психологических и социальных проблем.
Были идентифицированы три альтернативных генных дефекта, которые коррелируют с тремя отдельными подтипами PFIC, известными как типы 1, 2 и 3:
• PFIC типа 1, который иногда называют «болезнью Байлера», вызывается нарушением секреции желчи из-за мутаций в гене АТР8 В1, который кодирует белок, помогающий поддерживать соответствующий баланс жиров, известных как фосфолипиды, в клеточных мембранах в желчных протоках. Дисбаланс этих фосфолипидов связан с холестазом и повышенным содержанием желчных кислот в печени. У субъектов, пораженных PFIC типа 1, холестаз обычно развивается в первые месяцы жизни, а при отсутствии хирургического лечения прогрессирует до цирроза и терминальной стадии заболевания печени до конца первого десятилетия жизни.
• PFIC типа 2, который иногда называют «синдромом Байлера», вызывается нарушением секреции солей желчных кислот из-за мутаций в гене АВСВ11, который кодирует белок, известный как насос экспорта желчной соли, который выводит желчные кислоты из печени. У субъектов с PFIC типа 2 часто развивается печеночная недостаточность в течение первых нескольких лет жизни, и они подвержены повышенному риску развития типа рака печени, известного как гепатоцеллюлярная карцинома.
• PFIC типа 3, который обычно проявляется в первые годы детства прогрессирующим холестазом, вызывается мутациями в гене АВСВ4, который кодирует переносчик, перемещающий фосфолипиды через клеточные мембраны.
Кроме того, предполагается, что причиной PFIC являются мутации гена TJP2, гена NR1H4 или гена Myo5b. Кроме того, у некоторых субъектов с PFIC нет мутации ни в одном из генов АТР8 В1, АВСВ11, АВСВ4, TJP2, NR1H4 или Myo5b. В этих случаях причина данного состояния неизвестна.
Типичные мутации гена АТР8 В1 или полученного белка перечислены в Таблицах 2 и 3 с нумерацией на основе человеческого белка АТР8 В1 дикого типа (например, SEQ ID NO: 1) или гена (например, SEQ ID NO: 2). Типичные мутации гена АВСВ11 или полученного белка перечислены в Таблицах 4 и 5 с нумерацией на основе человеческого белка АВСВ11 дикого типа (например, SEQ ID NO: 3) или гена (например, SEQ ID NO: 4).
Специалистам в данной области техники понятно, что положение аминокислоты в последовательности референсного белка, которое соответствует конкретному положению аминокислоты в SEQ ID NO: 1 или 3, может быть определено путем выравнивания последовательности референсного белка с SEQ ID NO: 1 или 3 (например, с помощью программного обеспечения, такого как ClustalW2). Изменения в этих остатках (называемые в данном документе «мутациями») могут включать одиночные или множественные аминокислотные замены, вставки внутри последовательностей или фланкирующие их, а также делеции внутри последовательностей или фланкирующие их. Как может быть понятно специалистам в данной области техники, положение нуклеотида в последовательности референсного гена, которое соответствует определенному положению нуклеотида в SEQ ID NO: 2 или 4, может быть определено путем выравнивания последовательности референсного гена с SEQ ID NO: 2 или 4 (например, с помощью программного обеспечения, такого как ClustalW2). Изменения этих остатков (называемые в данном документе «мутациями») могут включать замены одного или нескольких нуклеотидов, вставки внутри последовательностей или фланкирующие их, а также делеции внутри последовательностей или фланкирующие их. См. также Kooistra, et al., "KLIFS: A structural kinase-ligand interaction database," Nucleic Acids Res. 2016, vol. 44, no. D1, pp. D365-D371, который полностью включен в настоящий документ ссылкой.
Каноническая последовательность белка АТР8 В1 (SEQ ID NO: 1) - Uniprot ID 043520


Каноническая последовательность ДНК для АТР8 В1 (SEQ ID NO: 2)
















Список литературы для Таблиц 2 и 3
1 Folmer et al., Hepatology. 2009, vol. 50(5), p. 1597-1605.
2 Hsu et al., Hepatol Res. 2009, vol. 39(6), p. 625-631.
3 Alvarez et al., Hum Mol Genet. 2004, vol. 13(20), p. 2451-2460.
4 Davit-Spraul et al., Hepatology 2010, vol. 51(5), p. 1645-1655.
5 Vitale et al., J Gastroenterol. 2018, vol. 53(8), p. 945-958.
6 Klomp et al., Hepatology 2004, vol. 40(1), p. 27-38.
7 Zarenezhad et al., Hepatitis Monthly: 2017, vol. 17(2); e43500.
8 Dixon et al., Scientific Reports 2017, vol. 7, 11823.
9 Painter et al., Eur J Hum Genet. 2005, vol. 13(4), p. 435-439.
10 Deng et al., World J Gastroenterol. 2012, vol. 18(44), p. 6504-6509.
11 Giovannoni et al., PLoS One. 2015, vol. 10(12): e0145021.
12 Li et al., Hepatology International 2017, vol. 11, No. 1, Supp.Supplement 1, pp. S180. Abstract Number: OP284.
13 Togawa et al., Journal of Pediatric Gastroenterology and Nutrition 2018, vol. 67, Supp.Supplement 1, pp. S363. Abstract Number: 615.
14 Miloh et al., Gastroenterology 2006, vol. 130, No. 4, Suppl. 2, pp. A759-A760. Meeting Info.: Digestive Disease Week Meeting/107th Annual Meeting of the American-Gastroenterological-Association. Los Angeles, CA, USA. May 19.
15 Dröge et al., Zeitschrift fur Gastroenterologie 2015, vol. 53, No. 12. Abstract Number: A3-27. Meeting Info: 32. Jahrestagung der Deutschen Arbeitsgemeinschaft zum Studium der Leber. Dusseldorf, Germany. 22 Jan 2016-23 Jan 2016
16 Mizuochi et al., Clin Chim Acta. 2012, vol. 413(15-16), p. 1301-1304.
17 Liu et al., Hepatology International 2009, vol. 3, No. 1, p. 184-185. Abstract Number: PE405. Meeting Info: 19th Conference of the Asian Pacific Association for the Study of the Liver. Hong Kong, China. 13 Feb 2009-16 Feb 2009
18 McKay et al., Version 2. F1000Res. 2013; 2: 32. DOI: 10.12688/f1000research.2-32. v2
19 Hasegawa et al., Orphanet J Rare Dis. 2014, vol. 9:89.
20 Stone et al., J Biol Chem. 2012, vol. 287(49), p. 41139-51.
21 Kang et al., J Pathol Transl Med. 2019 May 16. doi: 10.4132/jptm.2019.05.03. [Epub ahead of print]
22 Sharma et al., BMC Gastroenterol. 2018, vol. 18(1), p. 107.
23 Uegaki et al., Intern Med. 2008, vol. 47(7), p. 599-602.
24 Goldschmidt et al., Hepatol Res. 2016, vol. 46(4), p. 306-311.
25 Liu et al., J Pediatr Gastroenterol Nutr. 2010, vol. 50(2), p. 179-183.
26 Jung et al., J Pediatr Gastroenterol Nutr. 2007, vol. 44(4), p. 453-458.
27 Bounford. University of Birmingham. Dissertation Abstracts International, (2016) Vol.75, No. 1С. Order No.: AAI10588329. ProQuest Dissertations & Theses.
28 Stolz et al., Aliment Pharmacol Ther. 2019, vol. 49(9), p. 1195-1204.
29 Ivashkin et al., Hepatology International 2016, vol. 10, No. 1, Supp.SUPPL. 1, pp. S461. Abstract Number: LBO-38. Meeting Info: 25th Annual Conference of the Asian Pacific Association for the Study of the Liver, APASL 2016. Tokyo, Japan. 20 Feb 2016-24 Feb 2016
30 Blackmore et al., J Clin Exp Hepatol. 2013, vol. 3(2), p. 159-161.
31 Matte et al., J Pediatr Gastroenterol Nutr. 2010, vol. 51(4), p. 488-493.
32 Squires et al., J Pediatr Gastroenterol Nutr. 2017, vol. 64(3), p. 425-430.
33 Hayshi et al., EBioMedicine. 2018, vol. 27, p. 187-199.
34 Nagasaka et al., J Pediatr Gastroenterol Nutr. 2007, vol. 45(1), p. 96-105.
35 Wang et al., PLoS One. 2016; vol. 11(4): e0153114.
36 Narchi et al., Saudi J Gastroenterol. 2017, vol. 23(5), p. 303-305.
37 Alashkar et al., Blood 2015, vol. 126, No. 23. Meeting Info.: 57th Annual Meeting of the American-Society-of-Hematology. Orlando, FL, USA. December 05-08, 2015. Amer Soc Hematol.
38 Ferreira et al., Pediatric Transplantation 2013, vol. 17, Supp.SUPPL. 1, pp.99. Abstract Number: 239. Meeting Info: IPTA 7th Congress on Pediatric Transplantation. Warsaw, Poland. 13 Jul 2013-16 Jul 2013.
39 Pauli-Magnus et al., J Hepatol. 2005, vol. 43(2), p. 342-357.
40 Jericho et al., Journal of Pediatric Gastroenterology and Nutrition 2015, vol. 60(3), p. 368-374.
41 van derWoerd et al.,PLoS One. 2013, vol. 8(11): e80553.
42 Copeland et al., J Gastroenterol Hepatol. 2013, vol. 28(3), p. 560-564.
43 Dröge et al., J Hepatol. 2017, vol. 67(6), p. 1253-1264.
44 Chen et al., Journal of Pediatrics 2002, vol. 140(1), p .119-124.
45 Jirsa et al., Hepatol Res. 2004, vol. 30(1), p. 1-3.
46 van der Woerd et al., Hepatology 2015, vol. 61(4), p. 1382-1391.
В некоторых воплощениях мутация в АТР8 В1 выбрана из L127P, G308V, Т456М, D554N, F529del, I661T, Е665Х, R930X, R952X, R1014X и G1040R.
Каноническая последовательность белка АВСВ11 (SEQ ID NO: 3) - Uniprot ID 095342
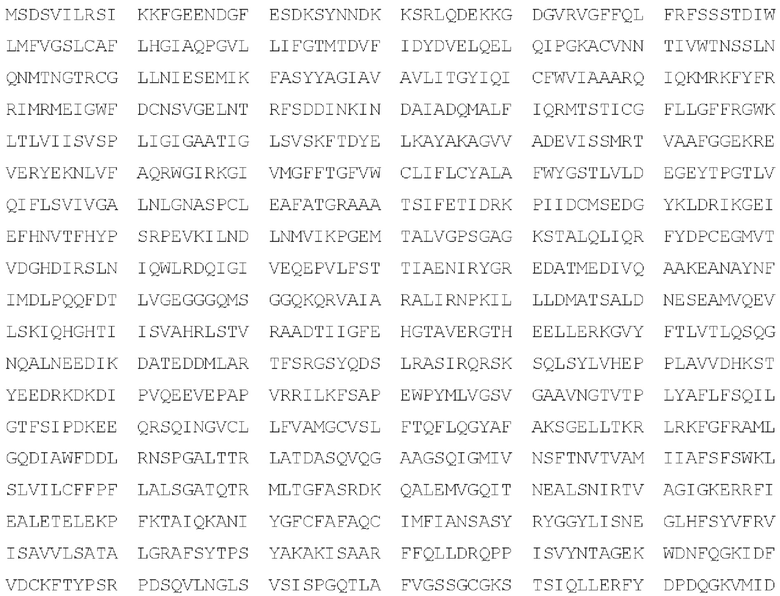

Каноническая последовательность ДНК АВСВ11 (SEQ ID NO: 4)
























Список литературы для Таблиц 4 и 5
1 Noe et al., J Hepatol. 2005, vol. 43(3), p. 536-543.
2 Lam et al., Am J Physiol Cell Physiol. 2007, vol. 293(5), p. C1709-16.
3 Stindt et al., Liver Int. 2013, vol. 33(10), p. 1527-1735.
4 Gao et al., Shandong Yiyao 2012, vol. 52(10), p. 14-16.
5 Strautnieks et al., Gastroenterology. 2008, vol. 134(4), p. 1203-1214.
6 Kagawa et al., Am J Physiol Gastrointest Liver Physiol. 2008, vol. 294(1), p. G58-67.
7 Byrne et al., Hepatology. 2009, vol. 49(2), p. 553-567.
8 Chen et al., J Pediatr. 2008, vol. 153(6), p. 825-832.
9 Davit-Spraul et al., Hepatology 2010, vol. 51(5), p. 1645-1655.
10 Dröge et al., Sci Rep.2016, vol. 6: 24827.
11 Lang et al., Pharmacogenet Genomics. 2007, vol. 17(1), p. 47-60.
12 Ellinger et al., World J Gastroenterol. 2017, vol. 23(29), p.: 5295-5303.
13 Vitale et al., J Gastroenterol. 2018, vol. 53(8), p. 945-958.
14 Knisely et al., Hepatology. 2006, vol. 44(2), p. 478-86.
15 Ellis et al., Hepatology. 2018, vol. 67(4), p. 1531-1545.
16 Lam et al., J Hepatol. 2006, vol. 44(1), p. 240-242.
17 Varma et al., Hepatology 2015, vol. 62(1), p. 198-206.
18 Treepongkaruna et al.. World J Gastroenterol. 2009, vol. 15(34), p. 4339-4342.
19 Zarenezhad et al.. Hepatitis Monthly: 2017, vol. 17(2); e43500.
20 Hayashi et al., Hepatol Res. 2016, vol. 46(2), p. 192-200.
21 Guorui et al., Linchuang Erke Zazhi 2013, vol. 31(10), 905-909.
22 van Mil et al., Gastroenterology. 2004, vol. 127(2), p. 379-384.
23 Anzivino et al.. Dig Liver Dis. 2013, vol. 45(3), p. 226-232.
24 Park et al., World J Gastroenterol. 2016, vol. 22(20), p. 4901-4907.
25 Imagawa et al., J Hum Genet. 2018, vol. 63(5), p. 569-577.
26 Giovannoni et al., PLoS One. 2015, vol. 10(12): e0145021.
27 Hu et al., Mol Med Rep.2014, vol. 10(3), p. 1264-1274.
28 Lang et al,. Drag Metab Dispos. 2006, vol. 34(9), p. 1582-1599.
29 Masahata et al., Transplant Proc. 2016, vol. 48(9), p. 3156-3162.
30 Holz et al., Hepatol Commun. 2018, vol. 2(2), p. 152-154.
31 Li et al., Hepatology International 2017, vol. 11, No. 1, Supp.Supplement l, pp. S180. Abstract Number: OP284.
32 Francalanci et al.. Laboratory Investigation 2011, vol. 91, Supp.SUPPL. 1, pp. 360A. Abstract Number: 1526.
33 Francalanci et al., Digestive и Liver Disease 2010, vol. 42, Supp.SUPPL. 1, pp. S16. Abstract Number: T.N.5.
34 Shah et al., J Pediatr Genet. 2017, vol. 6(2), p. 126-127.
35 Gao et al., Hepatitis Monthly 2017, vol. 17(10), e55087/1-e55087/6.
36 Evason et al., Am J Surg Pathol. 2011, vol. 35(5), p. 687-696.
37 Davit-Spraul et al., Mol Genet Metab. 2014, vol. 113(3), p. 225-229.
38 Maggiore et al., J Hepatol. 2010, vol. 53(5), p. 981-6.
39 McKay et al., Version 2. F1000Res. 2013; 2: 32. DOI: 10.12688/f1000research.2-32. v2
40 Liu et al., Pediatr Int. 2013, vol. 55(2), p. 138-144.
41 Waisbourd-Zinman et al., Ann Hepatol. 2017, vol. 16(3), p. 465-468.
42 Griffin, et al., Canadian Journal of Gastroenterology and Hepatology 2016, vol. 2016. Abstract Number: A200. Meeting Info: 2016 Canadian Digestive Diseases Week, CDDW 2016. Montreal, QC, United States. 26 Feb 2016-29 Feb 2016
43 Qiu et al., Hepatology 2017, vol. 65(5), p. 1655-1669.
44 Imagawa et al., Sci Rep.2017, 7:41806.
45 Kang et al., J Pathol Transl Med. 2019 May 16. doi: 10.4132/jptm.2019.05.03. [Epub ahead of print]
46 Takahashi et al., Eur J Gastroenterol Hepatol. 2007, vol. 19(11), p. 942-6.
47 Shimizu et al., Am J Transplant. 2011, vol. 11(2), p. 394-398.
48 Krawczyk et al., Ann Hepatol. 2012, vol. 11(5), p. 710-744.
49 Sharma et al., BMC Gastroenterol. 2018, vol. 18(1), p. 107.
50 Sattler et al., Journal of Hepatology 2017, vol. 66, No. 1, Suppl. S, pp.S177. Meeting Info.: International Liver Congress / 52nd Annual Meeting of the European-Association-for-the-Study-of-the-Liver. Amsterdam, NETHERLANDS. April 19-23, 2017. European Assoc Study Liver.
51 Jung et al., J Pediatr Gastroenterol Nutr. 2007, vol. 44(4), p. 453-458.
52 Sciveres. Digestive и Liver Disease 2010, vol. 42, Supp.SUPPL. 5, pp. S329. Abstract Number: CO18. Meeting Info: 17th National Congress SIGENP. Pescara, Italy. 07 Oct 2010-09 Oct 2010
53 Sohn et al., Pediatr Gastroenterol Hepatol Nutr. 2019, vol. 22(2), p. 201-206.
54 Ho et al., Pharmacogenet Genomics. 2010, vol. 20(1), p. 45-57.
55 Wang et al., Hepatol Res. 2018, vol. 48(7), p. 574-584.
56 Shaprio et al., J Hum Genet. 2010, vol. 55(5), p. 308-313.
57 Bounford. University of Birmingham. Dissertation Abstracts International, (2016) Vol.75, No. 1С.Order No.: AAI10588329. ProQuest Dissertations & Theses.
58 Stolz et al., Aliment Pharmacol Ther. 2019, vol. 49(9), p. 1195-1204.
59 Jankowska et al., J Pediatr Gastroenterol Nutr. 2014, vol. 58(1), p. 92-95.
60 Kim. Journal of Pediatric Gastroenterology and Nutrition 2016, vol. 62, Supp.SUPPL. 1, pp. 620. Abstract Number: H-P-045. Meeting Info: 49th Annual Meeting of the European Society for Paediatric Gastroenterology, Hepatology и Nutrition, ESPGHAN 2016. Аthеns, Greece. 25 May 2016-28 May 2016.
61 Pauli-Magnus et al., Hepatology 2003, vol. 38, No. 4 Suppl. 1, pp. 518A. print. Meeting Info.: 54th Annual Meeting of the American Association for the Study of Liver Diseases. Boston, MA, USA. October 24-28, 2003. American Association for the Study of Liver Diseases.
62 Li et al., Hepatology International 2017, vol. 11, No. 1, Supp.Supplement 1, pp. S362. Abstract Number: PP0347. Meeting Info: 26th Annual Conference of the Asian Pacific Association for the Study of the Liver, APASL 2017. Shanghai, China. 15 Feb 2017-19 Feb 2017.
63 Rumbo et al., Transplantation 2018, vol. 102, No. 7, Supp.Supplement 1, pp. S848. Abstract Number: P.752. Meeting Info: 27th International Congress of The Transplantation Society, TTS 2018. Madrid, Spain. 30 Jun 2018-05 Jul 2018.
64 Lee et al., Pediatr Gastroenterol Hepatol Nutr. 2017, vol. 20(2), p. 114-123.
65 Sherrif et al., Liver international: official journal of the International Association for the Study of the Liver 2013, vol. 33, No. 8, pp. 1266-1270.
66Blackmore et al., J Clin Exp Hepatol. 2013, vol. 3(2), p. 159-161.
67 Matte et al., J Pediatr Gastroenterol Nutr. 2010, vol. 51(4), p. 488-493.
68 Lin et al., Zhongguo Dang Dai Er Ke Za Zhi. 2018, vol. 20(9), p. 758-764.
69 Harmanci et al., Experimental and Clinical Transplantation 2015, vol. 13, Supp.SUPPL. 2, pp. 76. Abstract Number: P62. Meeting Info: 1st Congress of the Turkic World Transplantation Society. Astana, Kazakhstan. 20 May 2015-22 May 2015.
70 Herbst et al., Mol Cell Probes. 2015, vol. 29(5), p. 291-298.
71 Moghadamrad et al., Hepatology. 2013, vol. 57(6), p. 2539-2541.
72 Holz et al., Zeitschrift fur Gastroenterologie 2016, vol. 54, No. 8. Abstract Number: KV275. Meeting Info: Viszeralmedizin 2016, 71. Jahrestagung der Deutschen Gesellschaft fur Gastroenterologie, Verdauungs- und Storfwechselkrankheiten mit Sektion Endoskopie - 10. Herbsttagung der Deutschen Gesellschaft fur Allgemein- und Viszeralchirurgie. Hamburr, Germany. 21 Sep 2016-24 Sep 2016.
73 Wangetal., PLoS One. 2016; vol. 11(4): e0153114.
74 Hao et al., International Journal of Clinical and Experimental Pathology 2017, vol. 10(3), p. 3480-3487.
75 Arnell et al., J Pediatr Gastroenterol Nutr. 2010, vol. 51(4), p. 494-499.
76 Sharma et al., Indian Journal of Gastroenterology 2017, vol. 36, No. 1, Supp.Supplement 1, pp. A99. Abstract Number: M-20. Meeting Info: 58th Annual Conference of the Indian Society of Gastroenterology, ISGCON 2017. Bhubaneswar, India. 14 Dec 2017-17 Dec 2017.
77 Beauséjour et al., Can J Gastroenterol. 2011, vol. 25(6), p. 311-314.
78 Imagawa et al., Journal of Pediatric Gastroenterology and Nutrition 2016, vol. 63, Supp.Supplement 2, pp. S51. Abstract Number: 166. Meeting Info: World Congress of Pediatric Gastroenterology, Hepatology and Nutrition 2016. Montreal, QC, Canada. 05 Oct 2016-08 Oct 2016.
79 Peng et al., Zhonghua er ke za zhi (Chinese journal of pediatrics) 2018, vol. 56, No. 6, pp. 440-444.
80 Tibesar et al., Case Rep Pediatr. 2014, vol. 2014: 185923.
81 Ng et al., Journal of Pediatric Gastroenterology and Nutrition 2018, vol. 66, Supp.Supplement 2, pp. 860. Abstract Number: H-P-127. Meeting Info: 51st Annual Meeting European Society for Paediatric Gastroenterology, Hepatology и Nutrition, ESPGHAN 2018. Geneva, Switzerland. 09 May 2018-12 May 2018.
82 Wong et al., Clin Chem. 2008, vol. 54(7), p. 1141-1148.
83 Pauli-Magnus et al., J Hepatol. 2005, vol. 43(2), p. 342-357.
84 Jericho et al., Journal of Pediatric Gastroenterology and Nutrition. 60, vol. 3, p. 368-374.
85 Scheimann et al., Gastroenterology 2007, vol. 132, No. 4, Suppl. 2, pp. A452. Meeting Info.: Digestive Disease Week Meeting/108th Annual Meeting of the American-Gastroenterological-Association. Washington, DC, USA. May 19-24, 2007. Amer Gastroenterol Assoc; Amer Assoc Study Liver Dis; Amer Soc Gastrointestinal Endoscopy; Soc Surg Alimentary Tract.
86 Jaquotot-Haerranz et al., Rev Esp Enferm Dig. 2013, vol. 105(1), p. 52-54.
87 Khosla et al., American Journal of Gastroenterology 2015, vol. 110, No. Suppl. 1, pp. S397. Meeting Info.: 80th Annual Scientific Meeting of the American-College-of-Gastroenterology. Honolulu, HI, USA. October 16-21, 2015.
88 Dröge et al., J Hepatol. 2017, vol. 67(6), p. 1253-1264.
89 Liu et al., Liver International 2010, vol. 30(6), p. 809-815.
90 Chen et al., Journal of Pediatrics 2002, vol. 140(1), p. 119-124.
91 патент США No. 9295677.
В некоторых воплощениях мутация в АВСВ11 выбрана из А167Т, G238V, V284L, E297L, R470Q, R470X, D482G, R487H, А570Т, N591S, A865V, G982R, R1153C и R1268Q.
Предложены способы лечения PFIC (например, PFIC-1 и PFIC-2) у субъекта, которые включают выполнение анализа образца, полученного от субъекта, чтобы определить, есть ли у субъекта мутация, ассоциированная с PFIC (например, мутация АТР8 В1, АВСВ11, АВСВ4, TJP2, NR1H4 или Myo5b), и введение (например, специфическое или селективное введение) терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли субъекту, у которого определена мутация, ассоциированная с PFIC. В некоторых воплощениях мутация представляет собой мутацию АТР8 В1 или АВСВ11. Например, мутация, представленная в любой из Таблиц 1-4. В некоторых воплощениях мутация в АТР8 В1 выбрана из L127P, G308V, Т456М, D554N, F529del, I661T, Е665Х, R930X, R952X, R1014X и G1040R. В некоторых воплощениях мутация в АВСВ11 выбрана из А167Т, G238V, V284L, Е297Г, R470Q, R470X, D482G, R487H, А570Т, N591S, A865V, G982R, R1153C и R1268Q.
Также предложены способы лечения PFIC (например, PFIC-1 и PFIC-2) у субъекта, нуждающегося в этом, включающие: (а) обнаружение мутации, ассоциированной с PFIC (например, мутация АТР8 В1, АВСВ11, АВСВ4, TJP2, NR1H4 или Myo5b) у субъекта; и (б) введение субъекту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых воплощениях способы лечения PFIC могут включать введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли субъекту, имеющему мутацию, ассоциированную с PFIC (например, мутацию АТР8 В1, АВСВ11, АВСВ4, TJP2, NR1H4 или Myo5b). В некоторых воплощениях мутация представляет собой мутацию АТР8 В1 или АВСВ11. Например, мутация, представленная в любой из Таблиц 1-4. В некоторых воплощениях мутация в АТР8 В1 выбрана из L127P, G308V, Т456М, D554N, F529del, I661T, Е665Х, R930X, R952X, R1014X и G1040R. В некоторых воплощениях мутация в АВСВ11 выбрана из А167Т, G238V, V284L, Е297Г, R470Q, R470X, D482G, R487H, А570Т, N591S, A865V, G982R, R1153C и R1268Q.
В некоторых воплощениях изобретения субъект определен как имеющий мутацию, ассоциированную с PFIC, у субъекта или в образце биопсии из субъекта с помощью любых признанных в данной области тестов, включая секвенирование следующего поколения (NGS). В некоторых воплощениях изобретения субъект определен как имеющий мутацию, ассоциированную с PFIC, с использованием одобренного регулирующим органом, например, одобренного FDA теста или анализа для идентификации мутации, ассоциированной с PFIC, у субъекта или образца биопсии из субъекта, либо путем выполнения любого из неограничивающих примеров анализов, описанных в данном документе. Дополнительные методы диагностики PFIC описаны в Gunaydin, М. et al., Hepat Med. 2018, vol. 10, p. 95-104, полностью включенном в настоящий документ ссылкой.
В некоторых воплощениях лечение PFIC (например, PFIC-1 или PFIC-2) снижает уровень сывороточных желчных кислот у субъекта. В некоторых воплощениях уровень сывороточных желчных кислот определяют, например, с помощью ферментативного анализа ELISA или анализов для измерения общего количества желчных кислот, как описано в Danese et al., PLoS One. 2017, vol. 12(6): e0179200, полностью включенном в настоящий документ ссылкой. В некоторых воплощениях уровень сывороточных желчных кислот может снижаться, например, на 10-40%, 20-50%, 30-60%, 40-70%, 50-80% или более 90% от уровня сывороточных желчных кислот до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых воплощениях лечение PFIC включает лечение зуда.
Поскольку LBAT экспрессируется на гепатоцитах, LBAT и вещества с двойным ингибированием ASBT/LBAT должны иметь по меньшей мере некоторую биодоступность и свободную фракцию в крови. Поскольку соединения-ингибиторы LBAT должны переноситься только из кишечника в печень, ожидается, что относительно низкая системная экспозиция таких соединений будет достаточной, тем самым минимизируя потенциальный риск любых побочных эффектов в остальной части тела. Ожидается, что ингибирование LBAT и ASBT будет иметь по меньшей мере аддитивный эффект в снижении концентрации внутрипеченочных желчных кислот. Также ожидается, что двойной ингибитор ASBT/LBAT может снижать уровни желчных кислот, не вызывая диареи, как это иногда наблюдается с ингибиторами ASBT.
Ожидается, что соединения, обладающие высокой эффективностью ингибирования LBAT и достаточной биодоступностью, будут особенно подходящими для лечения гепатита. Ожидается, что соединения, обладающие активностью двойного ингибирования ASBT/LBAT и достаточной биодоступностью, будут особенно подходящими для лечения неалкогольного стеатогепатита (NASH).
NASH представляет собой распространенное и серьезное хроническое заболевание печени, которое имеет сходство с алкогольной болезнью печени, но встречается у людей, которые пьют мало или совсем не употребляют алкоголь. У пациентов с NASH накопление жира в печени, известное как неалкогольная жировая болезнь печени (NAFLD) или стеатоз, и другие факторы, такие как высокий уровень холестерина LDL и инсулинорезистентность, вызывают хроническое воспаление в печени и могут привести к прогрессирующему рубцеванию ткани, известному как фиброз, и циррозу, за которыми в конечном итоге следует печеночная недостаточность и смерть. Было обнаружено, что у пациентов с NASH общие концентрации сывороточных желчных кислот значительно выше, чем у здоровых субъектов в условиях голодания (увеличение NASH в 2,2-2,4 раза) и во всех временных точках после приема пищи (увеличение NASH в 1,7-2,2 раза). Они вызваны повышенным содержанием первичных и вторичных желчных кислот, конъюгированных с таурином и глицином. Пациенты с NASH демонстрировали более высокую вариабельность профиля желчных кислот натощак и после приема пищи. Эти результаты показывают, что пациенты с NASH имеют более высокое воздействие желчных кислот натощак и после приема пищи, включая более гидрофобные и цитотоксические вторичные виды. Повышенное воздействие желчных кислот может быть связано с повреждением печени и патогенезом NAFLD и NASH (Ferslew et al., Dig Dis Sci. 2015, vol. 60, p. 3318-3328). Следовательно, вероятно, что ингибирование ASBT и/или LBAT будет полезным для лечения NASH.
NAFLD характеризуется стеатозом печени без вторичных причин стеатоза печени, включая чрезмерное употребление алкоголя, другие известные заболевания печени или длительный прием стеатогенных медикаментов (Chalasani et al., Hepatology 2018, vol. 67(1), p. 328-357). NAFLD можно разделить на неалкогольную жировую болезнь печени (NAFL) и неалкогольный стеатогепатит (NASH). Согласно Chalasani et al., NAFL определяют как наличие не менее 5% стеатоза печени без признаков гепатоцеллюлярного повреждения в виде баллонирования гепатоцитов. NASH определяют как наличие не менее 5% стеатоза печени и воспаления с повреждением гепатоцитов (например, баллонированием), с фиброзом печени или без него. NASH также часто связан с воспалением и фиброзом печени, который может прогрессировать до цирроза, терминальной стадии заболевания печени и гепатоцеллюлярной карциномы. Хотя фиброз печени не всегда присутствует при NASH, тяжесть фиброза, если она присутствует, может быть связана с долгосрочными последствиями.
Существует множество подходов, используемых для оценки наличия у субъекта NAFLD и, в случае наличия, степени тяжести заболевания, включая дифференциацию NAFLD на NAFL или NASH. В некоторых воплощениях степень тяжести NAFLD можно оценить с помощью NAS. В некоторых воплощениях обработку NAFLD можно оценить с помощью NAS. В некоторых воплощениях NAS может быть определен, как описано в Kleiner et al., Hepatology. 2005, 41(6): 1313-1321, которая полностью включена в настоящий документ ссылкой. См., например, Таблицу 6, где представлена упрощенная схема NAS, адаптированная Kleiner.

В некоторых воплощениях NAS определяют неинвазивно, например, как описано в публикации заявки США №2018/0140219, которая полностью включена в настоящий документ ссылкой. В некоторых воплощениях NAS определяют для образца от субъекта до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых воплощениях NAS определяют в течение периода времени или после периода введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых воплощениях более низкий балл NAS в течение периода времени или после периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли по сравнению с периодом до введения соединения формулы (I) или его фармацевтически приемлемой соли указывает на лечение NAFLD (например, NASH). Например, уменьшение NAS на 1, 2, 3, 4, 5, 6 или 7 указывает на лечение NAFLD (например, NASH). В некоторых воплощениях NAS после введения соединения формулы (I) или его фармацевтически приемлемой соли составляет 7 или меньше. В некоторых воплощениях NAS в течение периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли составляет 5 или меньше, 4 или меньше, 3 или меньше или 2 или меньше. В некоторых воплощениях NAS в течение периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли составляет 7 или меньше. В некоторых воплощениях NAS в течение периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли составляет 5 или меньше, 4 или меньше, 3 или меньше или 2 или меньше. В некоторых воплощениях NAS после периода введения соединения формулы (I) или его фармацевтически приемлемой соли составляет 7 или меньше. В некоторых воплощениях NAS после периода введения соединения формулы (I) или его фармацевтически приемлемой соли составляет 5 или меньше, 4 или меньше, 3 или меньше или 2 или меньше.
Дополнительные подходы к определению и оценке NASH у субъекта включают определение одного или более из следующих: стеатоз печени (например, накопление жира в печени); воспаление печени; биомаркеры, указывающие на одно или более из поражения печени, воспаления печени, фиброза печени и/или цирроза печени (например, сывороточные маркеры и панели). Дополнительные примеры физиологических показателей NASH могут включать морфологию печени, эластичность печени и размер или массу печени субъекта. В некоторых воплощениях NASH у субъекта подтверждают накоплением печеночного жира и обнаружением биомаркера, указывающего на повреждение печени. Например, повышенный уровень ферритина в сыворотке и низкие титры аутоантител в сыворотке могут быть общими признаками NASH.
В некоторых воплощениях способы оценки NASH включают магнитно-резонансную томографию либо с помощью спектроскопии, либо с помощью протонной плотности жировой фракции (MRI-PDFF) для количественной оценки стеатоза, транзиентной эластографии (FIBROSCAN®), градиента венозного давления в печени (HPVG), измерения эластичности печени с помощью MRE для диагностики значительного фиброза и/или цирроза печени и оценки гистологических особенностей биопсии печени. В некоторых воплощениях магнитно-резонансную томографию используют для обнаружения одного или более из стеатогепатита (NASH-MRI), фиброза печени (Fibro-MRI) и стеатоза. См., например, публикации заявок США №2016/146715 и 2005/0215882, каждая из которых полностью включена в настоящий документ ссылкой.
В некоторых воплощениях лечение NASH может включать уменьшение одного или более симптомов, связанных с NASH; уменьшение степени стеатоза печени; снижение NAS; уменьшение воспаления печени; снижение уровня биомаркеров, указывающих на одно или более из повреждения печени, воспаления, фиброза печени и/или цирроза печени; и уменьшение фиброза и/или цирроза, отсутствие дальнейшего прогрессирования фиброза и/или цирроза, или замедление прогрессирования фиброза и/или цирроза у субъекта после введения одной или более доз соединения формулы (I) или его фармацевтически приемлемой соли.
В некоторых воплощениях лечение NASH включает уменьшение одного или более симптомов, связанных с NASH, у субъекта. Типичные симптомы могут включать один или более из следующих симптомов: увеличение печени, усталость, боль в правом подреберье, вздутие живота, увеличение кровеносных сосудов непосредственно под поверхностью кожи, увеличение молочных желез у мужчин, увеличение селезенки, красные ладони, желтуха и зуд. В некоторых воплощениях у субъекта нет симптомов. В некоторых воплощениях общая масса тела субъекта не увеличивается. В некоторых воплощениях общая масса тела субъекта уменьшается. В некоторых воплощениях индекс массы тела (BMI) субъекта не увеличивается. В некоторых воплощениях индекс массы тела (BMI) у субъекта снижается. В некоторых воплощениях соотношение талии и бедер (Waist То Hip, WTH) субъекта не увеличивается. В некоторых воплощениях соотношение талии и бедер (WTH) субъекта уменьшается.
В некоторых воплощениях лечение NASH можно оценить путем измерения стеатоза печени. В некоторых воплощениях изобретения лечение NASH включает уменьшение стеатоза печени после введения соединения формулы (I) или его фармацевтически приемлемой соли, как описано в данном документе. В некоторых воплощениях стеатоз печени определяют одним или более способами, выбранными из группы, состоящей из ультрасонографии, компьютерной томографии (СТ), магнитно-резонансной томографии, магнитно-резонансной спектроскопии (MRS), магнитно-резонансной эластографии (MRE), транзиентной эластографии (ТЕ) (например, FIBROSCAN®), измерения размера или массы печени или с помощью биопсии печени (см., например, Di Lascio et al., Ultrasound Med Biol. 2018, vol. 44(8), p.1585-1596; Lv et al., J Clin Transl Hepatol. 2018, vol. 6(2), p.217-221; Reeder et al., J Magn Reson Imaging. 2011, vol. 34(4), spcone; и de Ledinghen V, et al., J Gastroenterol Hepatol. 2016, vol. 31(4), p.848-855, каждый из которых полностью включен в настоящий документ ссылкой). Субъект с диагнозом NASH может иметь стеатоз печени более чем примерно 5%, например, от примерно 5% до примерно 25%, от примерно 25% до примерно 45%, от примерно 45% до примерно 65% или более чем примерно 65% стеатоза печени. В некоторых воплощениях изобретения субъект со стеатозом печени от более чем примерно 5% до примерно 33% имеет стеатоз печени 1 стадии, субъект со стеатозом печени от примерно 33% до примерно 66% имеет стеатоз печени 2 стадии, и субъект со стеатозом печени более чем примерно 66% стеатоза печени имеет стеатоз печени 3 стадии.
В некоторых воплощениях степень стеатоза печени определяют до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых воплощениях степень стеатоза печени определяют в течение периода времени или после периода введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых воплощениях изобретения снижение степени стеатоза печени в течение периода времени или после периода введения соединения формулы (I) или его фармацевтически приемлемой соли по сравнению с тем, что было до введения соединения формулы (I) или его фармацевтически приемлемой соли, указывает на лечение NASH. Например, уменьшение степени стеатоза печени от примерно 1% до примерно 50%, от примерно 25% до примерно 75% или от примерно 50% до примерно 100% указывает на лечение NASH. В некоторых воплощениях снижение степени стеатоза печени на примерно 5%, примерно 10%, примерно 15%, примерно 20%, примерно 25%, примерно 30%, примерно 35%, примерно 40%, примерно 45%, примерно 50%, примерно 55%, примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90% или примерно 95% указывает на лечение NASH.
В некоторых воплощениях наличие воспаления печени определяют одним или более методами, выбранными из группы, состоящей из биомаркеров, указывающих на воспаление печени, и образца(ов) биопсии печени из субъекта. В некоторых воплощениях степень тяжести воспаления печени определяют по образцу(ам) биопсии печени из субъекта. Например, воспаление печени в образце биопсии печени можно оценить, как описано в Kleiner et al., Hepatology 2005, vol. 41(6), p. 1313-1321 и Brunt et al., Am J Gastroenterol 1999, vol. 94, p. 2467-2474, каждый из которых включен в данный документ ссылкой полностью. В некоторых воплощениях степень тяжести воспаления печени определяют до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых воплощениях степень тяжести воспаления печени определяют в течение периода времени или после периода введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых воплощениях изобретения снижение тяжести воспаления печени в течение периода времени или после периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли по сравнению с тем, что было до введения соединения формулы (I) или ее фармацевтически приемлемой соли, указывает на лечение NASH. Например, уменьшение тяжести воспаления печени от примерно 1% до примерно 50%, от примерно 25% до примерно 75% или от примерно 50% до примерно 100% указывает на лечение NASH. В некоторых воплощениях снижение тяжести воспаления печени примерно на 5%, примерно 10%, примерно 15%, примерно 20%, примерно 25%, примерно 30%, примерно 35%, примерно 40%, примерно 45%, примерно 50%, примерно 55%, примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90% или примерно 95% указывает на лечение NASH.
В некоторых воплощениях лечение NASH включает лечение фиброза и/или цирроза, например, уменьшение тяжести фиброза, отсутствие дальнейшего прогрессирования фиброза и/или цирроза печени или замедление прогрессирования фиброза и/или цирроза. В некоторых воплощениях наличие фиброза и/или цирроза определяют одним или несколькими способами, выбранными из группы, состоящей из транзиентной эластографии (например, FIBROSCAN®), неинвазивных маркеров фиброза печени и гистологических характеристик биопсии печени. В некоторых воплощениях степень тяжести (например, стадию) фиброза определяют одним или более способами, выбранными из группы, состоящей из транзиентной эластографии (например, FIBROSCAN®), системы оценок фиброза, биомаркеров фиброза печени (например, неинвазивные биомаркеры) и градиента печеночного венозного давления (HVPG). Неограничивающие примеры систем оценок фиброза включают систему оценок фиброза NAFLD (см., например, Angulo et al., Hepatology 2007, vol. 45 (4), p. 846-54), систему оценок фиброза в Brant et al., Am. J. Gastroenterol. 1999, vol. 94, p. 2467-2474, систему оценок фиброза в Kleiner et al., Hepatology 2005, vol. 41(6), p. 1313-1321, и систему оценок фиброза ISHAK (см. Ishak et al., J. Hepatol. 1995, vol. 22, p. 696-699), содержание каждого из которых полностью включено в настоящий документ ссылкой.
В некоторых воплощениях степень тяжести фиброза определяют до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых воплощениях степень тяжести фиброза определяют в течение периода времени или после периода введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых воплощениях изобретения снижение степени тяжести фиброза в течение периода времени или после периода введения соединения формулы (I) или его фармацевтически приемлемой соли по сравнению с тем, что было до введения соединения формулы (I) или его фармацевтически приемлемой соли, указывает на лечение NASH. В некоторых воплощениях уменьшение тяжести фиброза, отсутствие дальнейшего прогрессирования фиброза и/или цирроза или замедление прогрессирования фиброза и/или цирроза указывает на лечение NASH. В некоторых воплощениях степень тяжести фиброза определяют с использованием системы оценки, такой как любая из систем оценки фиброза, описанных в данном документе, например, оценка может указывать на стадию фиброза, например, стадию 0 (без фиброза), стадию 1, стадию 2, стадию 3 и стадию 4 (цирроз) (см., например, Kleiner et al). В некоторых воплощениях снижение стадии фиброза представляет собой уменьшение степени тяжести фиброза. Например, уменьшение на 1, 2, 3 или 4 стадии является уменьшением степени тяжести фиброза. В некоторых воплощениях уменьшение стадии, например, от стадии 4 до стадии 3, от стадии 4 до стадии 2, от стадии 4 до стадии 1, от стадии 4 до стадии 0, от стадии 3 до стадии 2, от стадии 3 до стадии 1, от стадии 3 до стадии 0, от стадии 2 до стадии 1, от стадии 2 до стадии 0 или от стадии 1 до стадии 0 указывает на лечение NASH. В некоторых воплощениях стадия фиброза уменьшается от стадии 4 до стадии 3, от стадии 4 до стадии 2, от стадии 4 до стадии 1, от стадии 4 до стадии 0, от стадии 3 до стадии 2, от стадии 3 до стадии 1, от стадии 3 до стадии 0, от стадии 2 до стадии 1, от стадии 2 до стадии 0 или от стадии 1 до стадии 0 после введения соединения формулы (I) или его фармацевтически приемлемой соли, по сравнению с тем, что было до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых воплощениях стадия фиброза уменьшается от стадии 4 до стадии 3, от стадии 4 до стадии 2, от стадии 4 до стадии 1, от стадии 4 до стадии 0, от стадии 3 до стадии 2, от стадии 3 до стадии 1, от стадии 3 до стадии 0, от стадии 2 до стадии 1, от стадии 2 до стадии 0 или от стадии 1 до стадии 0 в течение периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли по сравнению с тем, что было до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых воплощениях стадия фиброза уменьшается от стадии 4 до стадии 3, от стадии 4 до стадии 2, от стадии 4 до стадии 1, от стадии 4 до стадии 0, от стадии 3 до стадии 2, от стадии 3 до стадии 1, от стадии 3 до стадии 0, от стадии 2 до стадии 1, от стадии 2 до стадии 0 или от стадии 1 до стадии 0 после периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли их по сравнению с тем, что было до введения соединения формулы (I) или его фармацевтически приемлемой соли.
В некоторых воплощениях присутствие NASH определяют одним или более биомаркерами, указывающими на один или более из следующих признаков: повреждение печени, воспаление, фиброз печени и/или цирроз печени, или системами их оценок. В некоторых воплощениях степень тяжести NASH определяют одним или более биомаркерами, указывающими на один или более из следующих признаков: повреждение печени, воспаление, фиброз печени и/или цирроз печени, или системами их оценок. Уровень биомаркера можно определить, например, путем измерения, количественной оценки и мониторинга уровня экспрессии гена или мРНК, кодирующей биомаркер и/или пептид или белок биомаркера. Неограничивающие примеры биомаркеров, указывающих на одно или более из поражения печени, воспаления, фиброза печени и/или цирроза печени и/или системы их оценок, включают индекс соотношения аспартатаминотрансферазы (AST) и тромбоцитов (APRI); соотношение аспартатаминотрансферазы (AST) и аланинаминотрансферазы (ALT) (AAR); оценку в баллах FIB-4, которая основана на уровнях APRI, аланинаминотрансферазы (ALT) и возрасте субъекта (см., например, McPherson et al., Gut 2010, vol. 59(9), p. 1265-9, которая полностью включена в настоящий документ ссылкой); гиалуроновую кислоту; провоспалительные цитокины; панель биомаркеров, состоящую из α2-макроглобулина, гаптоглобина, аполипопротеина А1, билирубина, гамма-глутамилтранспептидазы (GGT) во взаимосвязи с возрастом и полом субъекта для измерения фиброза и некровоспалительной активности в печени (например, FIBROTEST®, FIBROSURE®), панель биомаркеров, состоящую из билирубина, гамма-глутамилтрансферазы, гиалуроновой кислоты, α2-макроглобулина во взаимосвязи с возрастом и полом субъекта (например, HEPASCORE®; см., например, Adams et al., Clin. Chem. 2005, vol. 51(10), p. 1867-1873), и панель биомаркеров, состоящую из тканевого ингибитора металлопротеиназы-1, гиалуроновой кислоты и α2-макроглобулина (например, FIBROSPECT®); панель биомаркеров, состоящую из тканевого ингибитора металлопротеиназы 1 (TIMP-1), амино-концевого пропептида проколлагена III типа (PIIINP) и гиалуроновой кислоты (НА) (например, оценки генерализованного фиброза печени (ELF), см., например, Lichtinghagen R, et al., J Hepatol. 2013 Aug;59(2):236-42, который полностью включен в настоящий документ ссылкой). В некоторых воплощениях наличие фиброза определяют по одному или более показателям FIB-4, панели биомаркеров, состоящей из α2-макроглобулина, гаптоглобина, аполипопротеина А1, билирубина, гамма-глутамилтранспептидазы (GGT) во взаимосвязи с возрастом и полом субъекта для измерения фиброза и некровоспалительной активности в печени (например, FIBROTEST®, FIBROSURE®), панели биомаркеров, состоящей из билирубина, гамма-глутамилтрансферазы, гиалуроновой кислоты, α2-макроглобулина во взаимосвязи с возрастом и полом субъекта (например, HEPASCORE®; см., например, Adams et al., Clin. Chem. 2005, vol. 51(10), p. 1867-1873), и панели биомаркеров, состоящей из тканевого ингибитора металлопротеиназы-1, гиалуроновой кислоты и α2-макроглобулина (например, FIBROSPECT®); и панели биомаркеров, состоящей из тканевого ингибитора металлопротеиназ 1 (TIMP-1), аминоконцевого пропептида проколлагена III типа (PIIINP) и гиалуроновой кислоты (НА) (например, оценка генерализованного фиброза печени (ELF)). В некоторых воплощениях уровень аспартатаминотрансферазы (AST) не увеличивается. В некоторых воплощениях уровень аспартатаминотрансферазы (AST) снижается. В некоторых воплощениях уровень аланинаминотрансферазы (ALT) не увеличивается. В некоторых воплощениях уровень аланинаминотрансферазы (ALT) снижается. В некоторых воплощениях «уровень» фермента относится к концентрации фермента, например, в крови. Например, уровень AST или ALT может быть выражен в единицах/л.
В некоторых воплощениях степень тяжести фиброза определяют одним или более из оценки FIB-4, панели биомаркеров, состоящей из α2-макроглобулина, гаптоглобина, аполипопротеина А1, билирубина, гамма-глутамилтранспептидазы (GGT) во взаимосвязи с возрастом и полом субъекта для измерения фиброза и некровоспалительной активности в печени (например, FIBROTEST®, FIBROSURE®), панели биомаркеров, состоящей из билирубина, гамма-глутамилтрансферазы, гиалуроновой кислоты, α2-макроглобулина во взаимосвязи с возрастом и полом субъекта (например, HEPASCORE®; см., например, Adams et al., Clin. Chem. 2005, vol. 51(10), p. 1867-1873, который полностью включен в настоящий документ ссылкой), и панели биомаркеров, состоящей из тканевого ингибитора металлопротеиназы-1, гиалуроновой кислоты и α2-макроглобулина (например, FIBROSPECT®); и панели биомаркеров, состоящей из тканевого ингибитора металлопротеиназ 1 (TIMP-1), аминоконцевого пропептида проколлагена III типа (PIIINP) и гиалуроновой кислоты (НА) (например, оценка генерализованного фиброза печени (ELF)).
В некоторых воплощениях воспаление печени определяют по уровню биомаркеров воспаления печени, например, провоспалительных цитокинов. Неограничивающие примеры биомаркеров, указывающих на воспаление печени, включают интерлейкин(IL)-6, интерлейкин(IL)-1β, фактор некроза опухоли (TNF)-α, трансформирующий фактор роста (TGF)-β, хемотаксический белок моноцитов (МСР)-1, С-реактивный белок (CRP), PAI-1 и изоформы коллагена, такие как Col1al, Col1a2 и Col4a1 (см., например, Neuman, et al., Can. J. Gastroenterol. Hepatol. 2014, vol. 28(11), p. 607-618 и патент США №9872844, каждый из которых полностью включен в настоящий документ ссылкой). Воспаление печени также можно оценить по изменению инфильтрации макрофагами, например, по изменению уровня экспрессии CD68. В некоторых воплощениях воспаление печени может быть определено путем измерения или мониторинга сывороточных уровней или циркулирующих уровней одного или более из интерлейкина(IL)-6, интерлейкина(IL)-1β, фактора некроза опухоли (TNF)-α, трансформирующего фактора роста (TGF)-β, хемотаксического белка моноцитов (МСР)-1 и С-реактивного белка (CRP).
В некоторых воплощениях уровень одного или более биомаркеров, указывающих на одно или более из повреждения печени, воспаления, фиброза печени и/или цирроза печени, определяют для образца от субъекта до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых воплощениях уровень одного или более биомаркеров, указывающих на одно или более из повреждения печени, воспаления, фиброза печени и/или цирроза печени, определяют в течение периода времени или после периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых воплощениях снижение уровня одного или более биомаркеров, указывающих на одно или более из повреждения печени, воспаления, фиброза печени и/или цирроза печени в течение периода времени или после периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли по сравнению с тем, что было до введения соединения формулы (I) или его фармацевтически приемлемой соли, указывает на лечение NASH. Например, снижение уровня одного или более биомаркеров, указывающих на одно или более из повреждения печени, воспаления, фиброза печени и/или цирроза печени, на по меньшей мере примерно 5%, по меньшей мере примерно 10%, по меньшей мере примерно 15%, по меньшей мере примерно 20%, по меньшей мере примерно 25%, по меньшей мере примерно 30%, по меньшей мере примерно 35%, по меньшей мере примерно 40%, по меньшей мере примерно 45%, по меньшей мере примерно 50%, по меньшей мере примерно 55%, по меньшей мере примерно 60%, по меньшей мере примерно 65%, по меньшей мере примерно 70%, по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или по меньшей мере примерно 99% указывает на лечение NASH. В некоторых воплощениях снижение уровня одного или более биомаркеров, указывающих на одно или более из повреждения печени, воспаления, фиброза печени и/или цирроза печени, после введения соединения формулы (I) или его фармацевтически приемлемой соли, составляет по меньшей мере примерно 5%, по меньшей мере примерно 10%, по меньшей мере примерно 15%, по меньшей мере примерно 20%, по меньшей мере примерно 25%, по меньшей мере примерно 30%, по меньшей мере примерно 35%, по меньшей мере примерно 40%, по меньшей мере, примерно 45%, по меньшей мере, примерно 50%, по меньшей мере, примерно 55%, по меньшей мере, примерно 60%, по меньшей мере, примерно 65%, по меньшей мере, примерно 70%, по меньшей мере, примерно 75%, по меньшей мере, примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или по меньшей мере примерно 99%. В некоторых воплощениях уровень одного или более биомаркеров, указывающих на одно или более из повреждения печени, воспаления, фиброза печени и/или цирроза печени, в течение периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли составляет по меньшей мере примерно 5%, по меньшей мере примерно 10%, по меньшей мере примерно 15%, по меньшей мере примерно 20%, по меньшей мере примерно 25%, по меньшей мере примерно 30%, по меньшей мере примерно 35%, по меньшей мере примерно 40%, по меньшей мере примерно 45%, по меньшей мере примерно 50%, по меньшей мере примерно 55%, по меньшей мере примерно 60%, по меньшей мере примерно 65%, по меньшей мере примерно 70%, по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или по меньшей мере примерно 99%. В некоторых воплощениях уровень одного или более биомаркеров, указывающих на одно или более из повреждения печени, воспаления, фиброза печени и/или цирроза печени, после периода времени введения соединения формулы (I) или его фармацевтически приемлемой соли составляет по меньшей мере примерно 5%, по меньшей мере примерно 10%, по меньшей мере примерно 15%, по меньшей мере примерно 20%, по меньшей мере примерно 25%, по меньшей мере примерно 30%, по меньшей мере примерно 35%, по меньшей мере примерно 40%, по меньшей мере примерно 45%, по меньшей мере примерно 50%, по меньшей мере примерно 55%, по меньшей мере примерно 60%, по меньшей мере примерно 65%, по меньшей мере примерно 70%, по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, по меньшей мере примерно 95% или по меньшей мере примерно 99%.
В некоторых воплощениях лечение NASH снижает уровень сывороточных желчных кислот у субъекта. В некоторых воплощениях уровень сывороточных желчных кислот определяют, например, с помощью ферментативного анализа ELISA или анализов для измерения общего количества желчных кислот, как описано в Danese et al., PLoS One. 2017, vol. 12 (6): e0179200, который полностью включен в настоящий документ ссылкой. В некоторых воплощениях уровень сывороточных желчных кислот может снижаться, например, на 10-40%, 20-50%, 30-60%, 40-70%, 50-80% или более 90% от уровня сывороточных желчных до введения соединения формулы (I) или его фармацевтически приемлемой соли. В некоторых воплощениях NASH представляет собой NASH с сопутствующим холестазом. При холестазе выделение желчи, в том числе желчных кислот, из печени блокируется. Желчные кислоты могут вызывать повреждение гепатоцитов (см., например, Perez MJ, Briz О. World J. Gastroenterol. 2009, vol. 15(14), p. 1677-1689), вероятно, вызывая или увеличивая прогрессирование фиброза (например, цирроза) и увеличивая риск гепатоцеллюлярной карциномы (см., например, Sorrentino Р et al., Dig. Dis. Sci. 2005, vol. 50(6), p. 1130-1135 и Satapathy SK и Sanyal AJ. Semin. Liver Dis. 2015, vol. 35(3), p. 221-235, каждый из которых полностью включен в настоящий документ ссылкой). В некоторых воплощениях лечение NASH включает лечение зуда. В некоторых воплощениях лечение NASH с сопутствующим холестазом включает лечение зуда. В некоторых воплощениях у субъекта с NASH с сопутствующим холестазом наблюдается зуд.
Типичные биомаркеры NASH представлены в Таблице 7.


Изменение инфильтрации макрофагов (например, изменение уровня экспрессии CD68) Список литературы для Таблицы 7
1 McPherson et al., Gut. 2010, vol. 59(9), p. 1265-1269.
2 Adams, et al. Clin Chem. 2005, vol. 51(10), p. 1867-1873.
3 Lichtinghagen, et al. J Hepatol. 2013, vol. 59(2), p. 236-242.
4 Neuman, et al. Can J Gastroenterol Hepatol. 2014, vol. 28(11), p. 607-618.
5 патент США No. 9872844
Некоторые соединения формулы (I) или их фармацевтически приемлемые соли могут иметь более высокую свободную фракцию в плазме. В некоторых воплощениях свободная фракция составляет более чем примерно 0,2%, например более чем примерно 0,4%, например более чем примерно 0,6%, например более чем примерно 0,8%, например более чем примерно 1,0%, например больше чем примерно 1,25%, например более чем примерно 1,5%, например более чем примерно 1,75%, например более чем примерно 2,0%, например более чем примерно 2,5%, например более чем примерно 3%, например более чем примерно 4%, например более чем примерно 5%, например более чем примерно 7,5%, например более чем примерно 10%, или, например, более чем примерно 20%.
Некоторые соединения формулы (I) или их фармацевтически приемлемые соли могут выделяться с мочой. В некоторых воплощениях доля соединения, которая выводится с мочой, составляет более чем примерно 0,2%, например более чем примерно 0,4%, например более чем примерно 0,6%, например более чем примерно 0,8%, например более чем примерно 1,0%, например более чем примерно 2%, например более чем примерно 3%, например более чем примерно 5%, например более чем примерно 7,5%, например более чем примерно 10%, например более чем примерно 15%, например более чем примерно 20%, например более чем примерно 30% или, например, более чем примерно 50%.
После абсорбции из кишечника некоторые соединения формулы (I) или их фармацевтически приемлемые соли могут циркулировать через энтерогепатическую циркуляцию. В некоторых воплощениях доля соединения, которая циркулирует через энтерогепатическую циркуляцию, составляет более чем примерно 0,1%, например более чем примерно 0,2%, например более чем примерно 0,3%, например более чем примерно 0,5%, например более чем примерно 1,0%, например более чем примерно 1,5%, например более чем примерно 2%, например более чем примерно 3%, например более чем примерно 5%, например более чем примерно 7%, например более чем примерно 10%, например более чем примерно 15%, например более чем примерно 20%, например более чем примерно 30% или, например, более чем примерно 50%.
Некоторые соединения формулы (I) или их фармацевтически приемлемые соли могут вызывать почечную экскрецию солей желчных кислот. В некоторых воплощениях доля циркулирующих желчных кислот, которая выводится почечным путем, составляет более чем примерно 1%, например более чем примерно 2%, например более чем примерно 5%, например более чем примерно 7%, например более чем примерно 10%, например более чем примерно 15%, например более чем примерно 20% или, например, более чем примерно 25%.
Некоторые соединения формулы (I) или их фармацевтически приемлемые соли могут показывать улучшенную или оптимальную проницаемость. Проницаемость может быть измерена в клетках Сасо2, и значения даны как значения Рарр (кажущаяся проницаемость) в см/с. В некоторых воплощениях проницаемость составляет более чем по меньшей мере примерно 0,1×10-6 см/с, например более чем примерно 0,2×10-6 см/с, например более чем примерно 0,4×10-6 см/с, например более чем примерно 0,7×10-6 см/с, например более чем примерно 1,0×10-6 см/с, например более чем примерно 2×10-6 см/с, например более чем примерно 3×10-6 см/с, например более чем примерно 5×10-6 см/с, например более чем примерно 7×10-6 см/с, например более чем примерно 10×10-6 см/с, например более чем примерно 15×10-б см/с.
Некоторые соединения формулы (I) или их фармацевтически приемлемые соли могут показывать улучшенную или оптимальную биодоступность. В некоторых воплощениях пероральная биодоступность составляет более чем примерно 5%, например более чем примерно 7%, например более чем примерно 10%, например более чем примерно 15%, например более чем примерно 20%, например более чем примерно 30%, например более чем примерно 40%, например более чем примерно 50%, например более чем примерно 60%, например более чем примерно 70% или например, более чем примерно 80%. В других воплощениях пероральная биодоступность составляет от примерно 10 до примерно 90%, например от примерно 20 до примерно 80%, например от примерно 30 до примерно 70% или, например, от примерно 40 до примерно 60%.
Некоторые соединения формулы (I) или их фармацевтически приемлемые соли могут быть субстратом для соответствующих переносчиков в почках.
Некоторые соединения формулы (I) или их фармацевтически приемлемые соли могут вызывать повышение концентраций желчных кислот в кишечнике, печени и сыворотке, которые не вызывают неблагоприятных желудочно-кишечных эффектов.
Некоторые соединения формулы (I) или их фармацевтически приемлемые соли могут снижать концентрацию желчных кислот в печени, не вызывая желудочно-кишечных расстройств, таких как диарея.
Используемые в данном документе термины «лечение», «проводить лечение» и «лечить» относятся к регрессированию, облегчению, отсрочке начала или ингибированию развития заболевания или расстройства или одного или более их симптомов, описанных в данном документе. В некоторых воплощениях лечение можно проводить после развития одного или более симптомов. В других воплощениях лечение можно проводить в отсутствие симптомов. Например, лечение может быть назначено восприимчивому индивидууму до появления симптомов (например, в свете симптомов в анамнезе и/или в свете генетических или других факторов восприимчивости). Лечение также может быть продолжено после исчезновения симптомов, например, для предупреждения или отсрочки их повторного появления.
Подходящая фармацевтически приемлемая соль соединения по изобретению представляет собой, например, соль присоединения основания соединения по изобретению, которая является достаточно кислой, такой как соль щелочного металла (например, соль натрия или калия), соль щелочно-земельного металла (например, соль кальция или магния), соль аммония или соль с органическим основанием, которое дает физиологически приемлемый катион, например, соль с метиламином, диметиламином, триметиламином, пиперидином, морфолином или трис-(2-гидроксиэтил)амином.
Некоторые соединения формулы (I) или их фармацевтически приемлемые соли могут иметь хиральные центры и/или геометрические изомерные центры (Е- и Z-изомеры). Следует понимать, что изобретение охватывает все такие оптические изомеры, диастереоизомеры и геометрические изомеры, которые обладают активностью ингибирования ASBT и/или LBAT. Изобретение также охватывает любые и все таутомерные формы соединений формулы (I) или их фармацевтически приемлемых солей, которые обладают активностью ингибирования ASBT и/или LBAT. Некоторые соединения формулы (I) или их фармацевтически приемлемые соли могут существовать в несольватированных, а также в сольватированных формах, таких как, например, гидратированные формы. Следует понимать, что изобретение охватывает все такие сольватированные формы, которые обладают активностью ингибирования ASBT и/или LBAT.
В другом аспекте изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли и один или более фармацевтически приемлемых эксципиентов. Эксципиенты могут, например, включать наполнители, связывающие вещества, разрыхлители, скользящие вещества и смазывающие вещества. Как правило, фармацевтические композиции могут быть приготовлены обычным способом с использованием общепринятых эксципиентов.
Примеры подходящих наполнителей включают, без ограничения, дигидрат фосфата дикальция, сульфат кальция, лактозу (например, моногидрат лактозы), сахарозу, маннит, сорбит, целлюлозу, микрокристаллическую целлюлозу, сухой крахмал, гидролизованный крахмал и прежелатинизированный крахмал.
Примеры подходящих связывающих веществ включают, без ограничения, крахмал, прежелатинизированный крахмал, желатин, сахара (такие как сахароза, глюкоза, декстроза, лактоза и сорбит), полиэтиленгликоль, воски, натуральные и синтетические камеди (такие как камедь акации и трагакантовая камедь), альгинат натрия, производные целлюлозы (такие как гидроксипропилметилцеллюлоза (или гипромеллоза), гидроксипропилцеллюлоза и этилцеллюлоза) и синтетические полимеры (например, сополимеры акриловой кислоты и метакриловой кислоты, сополимеры метакриловой кислоты, сополимеры метилметакрилата, сополимеры аминоалкилметакрилата, сополимеры полиакриловой кислоты/полиметакриловой кислоты и поливинилпирролидон (повидон)).
Примеры подходящих разрыхлителей включают, без ограничения, сухой крахмал, модифицированный крахмал (такой как (частично) прежелатинизированный крахмал, крахмалгликолят натрия и карбоксиметилкрахмал натрия), альгиновую кислоту, производные целлюлозы (такие как карбоксиметилцеллюлоза натрия, гидроксипропилцеллюлоза и низкозамещенная гидроксипропилцеллюлоза (L-HPC)) и перекрестно-сшитые полимеры (такие как кармеллоза, кроскармеллоза натрия, кармеллоза кальция и перекрестно-сшитый PVP (кросповидон)).
Примеры подходящих скользящих веществ и смазывающих веществ включают, без ограничения, тальк, стеарат магния, стеарат кальция, стеариновую кислоту, глицерилбегенат, коллоидный диоксид кремния, водный диоксид кремния, синтетический силикат магния, тонкодисперсный оксид кремния, крахмал, лаурилсульфат натрия, борную кислоту, оксид магния, воски (такие как карнаубский воск), гидрогенизированное масло, полиэтиленгликоль, бензоат натрия, полиэтиленгликоль и минеральное масло.
Фармацевтическая композиция может быть обычно покрыта одним или более чем одним слоем покрытия. Также предусмотрены слои энтеросолюбильного покрытия или слои покрытия для замедленного или целевого высвобождения соединения формулы (I) или его фармацевтически приемлемых солей. Слои покрытия могут содержать один или более агентов покрытия и возможно могут содержать пластификаторы и/или пигменты (или красители).
Примеры подходящих агентов покрытия включают, без ограничения, полимеры на основе целлюлозы (такие как этилцеллюлоза, гидроксипропилметилцеллюлоза (или гипромеллоза), гидроксипропилцеллюлоза, фталат ацетата целлюлозы, сукцинат ацетата целлюлозы, сукцинат ацетата гидроксипропилметилцеллюлозы и фталат гидроксипропилметилцеллюлозы), полимеры на основе винила (например, поливиниловый спирт) и полимеры на основе акриловой кислоты и ее производных (например, сополимеры акриловой кислоты и метакриловой кислоты, сополимеры метакриловой кислоты, сополимеры метилметакрилата, сополимеры аминоалкилметакрилата, сополимеры полиакриловой кислоты/полиметакриловой кислоты).
Примеры подходящих пластификаторов включают, без ограничения, триэтилцитрат, глицерилтриацетат, трибутилцитрат, диэтилфталат, ацетилтрибутилцитрат, дибутилфталат, дибутилсебацинат и полиэтиленгликоль.
Примеры подходящих пигментов включают, без ограничения, диоксид титана, оксиды железа (такие как желтые, коричневые, красные или черные оксиды железа) и сульфат бария.
Фармацевтическая композиция может быть в форме, подходящей для перорального введения, для парентеральной инъекции (включая внутривенную, подкожную, внутримышечную и внутрисосудистую инъекцию), для местного введения или для ректального введения. В предпочтительном воплощении фармацевтическая композиция находится в форме, подходящей для перорального введения, такой как таблетка или капсула.
Дозировка, необходимая для терапевтического или профилактического лечения, будет зависеть от пути введения, тяжести заболевания, возраста и массы тела пациента и других факторов, обычно рассматриваемых лечащим врачом при определении подходящей схемы лечения и уровня дозировки для конкретного пациента.
Количество вводимого соединения будет варьировать для пациента, которого лечат, и может варьировать от примерно 1 мкг/кг массы тела до примерно 50 мг/кг массы тела в сутки. Стандартная лекарственная форма, такая как таблетка или капсула, обычно будет содержать от примерно 1 до примерно 250 мг активного ингредиента, например от примерно 1 до примерно 100 мг, или от примерно 1 до примерно 50 мг, или от примерно 1 до примерно 20 мг, например примерно 2,5 мг, или примерно 5 мг, или примерно 10 мг или примерно 15 мг. Суточная доза может быть введена как разовая доза или разделена на одну, две, три или более стандартных доз. Суточная доза модулятора желчной кислоты, вводимая перорально, предпочтительно составляет от примерно 0,1 до примерно 250 мг, более предпочтительно от примерно 1 до примерно 100 мг, например от примерно 1 до примерно 5 мг, например от примерно 1 до примерно 10 мг, например от примерно 1 до примерно 15 мг или от примерно 1 до примерно 20 мг.
В другом аспекте изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли для использования в качестве лекарственного средства. Изобретение также относится к применению соединения формулы (I) или его фармацевтически приемлемой соли в качестве лекарственного средства.
В другом аспекте изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли для использования в лечении или предупреждении любого из заболеваний, перечисленных в данном документе. Изобретение также относится к применению соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения или предупреждения любого из заболеваний, перечисленных в данном документе. Изобретение также относится к способу лечения или предупреждения любого из перечисленных в данном документе заболеваний у субъекта, такого как человек, включающему введение субъекту, нуждающемуся в таком лечении или предупреждении, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
Комбинированная терапия
В одном аспекте изобретения соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с по меньшей мере одним другим терапевтически активным агентом, например, с одним, двумя, тремя или более другими терапевтически активными агентами. Соединение формулы (I) или его фармацевтически приемлемая соль и по меньшей мере один другой терапевтически активный агент можно вводить одновременно, последовательно или раздельно. Терапевтически активные агенты, которые подходят для комбинации с соединениями формулы (I), включают, без ограничения, известные активные агенты, которые полезны в лечении любого из вышеупомянутых состояний, расстройств и заболеваний.
В одном воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с другим ингибитором ASBT. Подходящие ингибиторы ASBT описаны в WO 93/16055, WO 94/18183, WO 94/18184, WO 96/05188, WO 96/08484, WO 96/16051, WO 97/33882, WO 98/03818, WO 98/07449, WO 98/40375, WO 99/35135, WO 99/64409, WO 99/64410, WO 00/47568, WO 00/61568, WO 00/38725, WO 00/38726, WO 00/38727, WO 00/38728, WO 00/38729, WO 01/66533, WO 01/68096, WO 02/32428, WO 02/50051, WO 03/020710, WO 03/022286, WO 03/022825, WO 03/022830, WO 03/061663, WO 03/091232, WO 03/106482, WO 2004/006899, WO 2004/076430, WO 2007/009655, WO 2007/009656, WO 2011/137135, WO 2019/234077, WO 2020/161216, WO 2020/161217, DE 19825804, ЕР 864582, ЕР 489423, ЕР 549967, ЕР 573848, ЕР 624593, ЕР 624594, ЕР 624595, ЕР 624596, ЕР 0864582, ЕР 1173205, ЕР 1535913 и ЕР 3210977, все из которых полностью включены в настоящий документ ссылкой. Конкретные примеры подходящих ингибиторов ASBT включают 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)-1'-фенил-1'-[N'-(карбоксиметил)карбамоил]метил}карбамоилметокси)-2,3,4,5-тетрагидро-1,5-бензотиазепин (элобиксибат) и 1,1-диоксо-3,3-дибутил-5-фенил-7-метилтио-8-(N-{(R)-α-[N-((S)-1-карбоксипропил)карбамоил]-4-гидроксибензил}карбамоилметокси)-2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин (одевиксибат).
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации со связующим желчные кислоты (также называемым секвестрантом желчных кислот или смолой), таким как колесевелам, холестирамин или холестипол. В предпочтительном воплощении такой комбинации связующее желчных кислот изготовлено в виде препарата для высвобождения в толстой кишке. Примеры таких препаратов раскрыты, например, в WO 2017/138877, WO 2017/138878, WO 2019/032026 и WO 2019/032027, все из которых полностью включены в настоящий документ ссылкой.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором DPP-IV, включая глиптины, такие как ситаглиптин, вилдаглиптин, саксаглиптин, линаглиптин, гемиглиптин, анаглиптин, тенелиглиптин, трелаглиптин, аллоглиптин, омариглиптин, эвоглиптин, гозоглиптин и дутоглиптин или их фармацевтически приемлемые соли.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором HMG СоА редуктазы, таким как флувастатин, ловастатин, правастатин, симвастатин, аторвастатин, питавастатин, церивастатин, мевастатин, розувастатин, бервастатин или далвастатин или их фармацевтически приемлемая соль.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором абсорбции холестерина, таким как эзетимиб или его фармацевтически приемлемая соль.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с агонистом PPAR-альфа, включая фибраты, такие как клофибрат, безафибрат, ципрофибрат, клинофрибрат, клофибрид, фенофибрат, гемфиброзил, ронифибрат и симфрибрат или их фармацевтически приемлемую соль.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с гамма-агонистом PPAR, включая тиазолидиндионы, такие как пиоглитазон, розиглитазон и лобеглитазон или их фармацевтически приемлемые соли.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с двойным агонистом PPAR альфа/гамма, включая глитазары, такие как сароглитазар, алеглитазар, мураглитазар или тесаглитазар или их фармацевтически приемлемые соли.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с двойным агонистом PPAR альфа/дельта, таким как элафибранор.
В еще одном воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с пан-агонистом PPAR (т.е. агонистом PPAR, который обладает активностью во всех подтипах: α, γ и δ), таким как IVA337.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с модуляторами рецептора фарнезоида X (FXR), включая агонисты FXR, такие как кафестол, хенодезоксихолевая кислота, 6α-этилхенодезоксихолевая кислота (обетихолевая кислота; INT-747), фексарамин, тропифексор, цилофексор и МЕТ409.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с модулятором рецептора TGR5, включая агонисты TGR5, такие как 6α-этил-23(S)-метилхолевая кислота (INT-777).
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с двойным агонистом FXR/TGR5, таким как INT-767.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с урсодезоксихолевой кислотой (UDCA). В еще одном воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с нор-урсодезоксихолевой кислотой (нор-UDCA).
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с модулятором FGF19, таким как NGM282.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с агонистом FGF21, таким как BMS-986036.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором интегрина, таким как PLN-74809 и PLN-1474.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором CCR2/CCR5, таким как ценикривирок.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором протеазы каспазы, таким как эмриказан.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором галектина-3, таким как GR-MD-02.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором стеароил-СоА десатуразы (SCD), таким как арамхол (арахидиламидохолановая кислота).
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором киназы 1 (ASK1), регулирующим сигнал апоптоза, таким как селонсертиб.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором LOXL2, таким как симтузумаб.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором АСС, таким как GS-0976.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с агонистом рецептора тиреоидного гормона-β, таким как MGL3196.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с агонистом GLP-1, таким как лираглутид.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с двойными агонистами глюкагоноподобного пептида и рецептора глюкагона, такими как SAR425899.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором митохондриального переносчика пирувата, таким как MSDC-0602K.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с антиоксидантным агентом, таким как витамин Е.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором SGLT1, ингибитором SGLT2 или двойным ингибитором SGLT1 и SGLT2. Примерами таких соединений являются дапаглифлозин, сотаглифлозин, канаглифлозин, эмпаглифлозин, LIK066 и SGL5213.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором диацилглицерин-О-ацилтрансферазы 2 (DGAT2), таким как DGAT2RX и PF-06865571.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором синтазы жирных кислот (FASN), таким как TVB-2640.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с активатором АМР-активируемой протеинкиназы (AMPK), таким как PXL-770.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с антагонистом рецептора глюкокортикоидов (GR), антагонистом рецептора минералокортикоидов (MR) или двойным антагонистом GR/MR. Примерами таких соединений являются МТ-3995 и CORT-118335.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с антагонистом каннабиноидного рецептора 1 (СВ1), таким как IM102.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с Klothoβ (KLB) и активатором рецептора фактора роста фибробластов (FGFR), таким как MK-3655 (ранее известный как NGM-313).
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором хемокинового (с-с-мотив) лиганда 24 (CCL24), таким как СМ101.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с антагонистом A3, таким как PBF-1650.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с антагонистом рецептора Р2х7, таким как SGM 1019.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с агонистами рецептора P2Y13, такими как CER-209.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с сульфатированным оксистеролом, таким как Dur-928.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с антагонистом рецептора лейкотриена D4 (LTD4), таким как MN-001.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором Т-клеток-естественных киллеров 1 типа (NKT1), таким как GRI-0621.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с анти-липополисахаридным (LPS) соединением, таким как IMM-124E.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором VAP1, таким как BI1467335.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с агонистом аденозинового рецептора A3, таким как CF-102.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с активатором SIRT-1, таким как NS-20.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с агонистом рецептора 1 никотиновой кислоты, таким как ARI-3037MO.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с антагонистом TLR4, таким как JKB-121.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором кетогексокиназы, таким как PF-06835919.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с агонистом рецептора адипонектина, таким как ADP-335.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором аутотаксина, таким как РАТ-505 и PF8380.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с антагонистом хемокинового (с-с-мотив) рецептора 3 (CCR3), таким как бертилимумаб.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации со стимулятором хлоридных каналов, таким как кобипростон и любипростон.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором белка теплового шока 47 (HSP47), таким как ND-L02-s0201.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором фактора транскрипции белка, связывающегося с регуляторным элементом стерола (SREBP), таким как САТ-2003 и MDV-4463.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с бигуанидином, таким как метформин.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с инсулином.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором гликогенфосфорилазы и/или ингибитором глюкозо-6-фосфатазы.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с сульфонилмочевиной, такой как глипизид, глибенкламид и глимепирид.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с меглитинидом, таким как репаглинид, натеглинид и ормиглитинид.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором глюкозидазы, таким как акарбоза или миглитол.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором скваленсинтазы, таким как TAK-475.
В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят в комбинации с ингибитором РТРВ1, таким как тродускемин, эртипротафиб, JTT-551 и кларамин.
Получение соединений
Соединения по настоящему изобретению могут быть получены в виде свободной кислоты или ее фармацевтически приемлемой соли способами, описанными ниже. В последующем описании таких способов понятно, что, где это уместно, подходящие защитные группы будут добавлены и впоследствии удалены из различных реагентов и промежуточных продуктов способом, который будет легко понятен специалистам в области органического синтеза. Обычные методики использования таких защитных групп, а также примеры подходящих защитных групп описаны, например, в руководстве Greene's Protective Groups in Organic Synthesis P.G.M Wutz and T.W. Greene, 4th Edition, John Wiley & Sons, Hoboken, 2006.
Общие способы
Все использованные растворители были аналитической чистоты. Для реакций обычно использовали коммерчески доступные безводные растворители. Исходные материалы были доступны из коммерческих источников или были получены в соответствии с описанными в литературе методиками. 1,1-Диоксид 3,3-дибутил-8-гидрокси-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепина и 1,1-диоксид 8-гидрокси-7-(метилтио)-5-фенил-3,3-дипропил-2,3,4,5-тетрагидро-1,5-бензотиазепина могут быть получены как описано в WO 02/50051 (методы 26 и 117, соответственно). 7-Бром-3,3-диэтил-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5Н)-он и 1,1-диоксид 3,3-диэтил-8-гидрокси-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепина могут быть получены как описано в WO 2019/234077 (Промежуточные соединения 56 и 60, соответственно). Комнатная температура относится к 20-25°С.Составы смеси растворителей даны в объемных процентах или объемных соотношениях.
ЖХ-МС:
Название прибора: Agilent 1290 infinity II.
Метод А: Подвижная фаза: А: 0,1% НСООН в воде: ACN (95:5), В: ACN; скорость потока: 1,5 мл/мин; колонка: ZORBAX XDB С-18 (50×4,6 мм, 3,5 мкм).
Метод В: Подвижная фаза: А: 10 мМ NH4HCO3 в воде, В: ACN; скорость потока: 1,2 мл/мин; колонка: XBridge С8 (50×4,6 мм, 3,5 мкм).
Метод С: Подвижная фаза: А: 0,1% НСООН в воде: ACN (95:5), В: ACN; скорость потока: 1,5 мл/мин; колонка: ATLANTIS dC18 (50×4,6 мм, 5 мкм).
Метод D: Подвижная фаза: А: 10 мМ NH4OAC в воде, В: ACN; скорость потока: 1,2 мл/мин; колонка: Zorbax Extend C18 (50×4,6 мм, 5 мкм).
Метод Е: Подвижная фаза: А: 0,1% TFA в воде: ACN (95:5), В: 0,1% TFA в ACN; скорость потока: 1,5 мл/мин; колонка: XBridge С8 (50×4,6 мм, 3,5 мкм).
Метод F: Подвижная фаза: А: 0,1% TFA в воде, В: 0,1% TFA в ACN; скорость потока: 0,8 мл/мин; колонка: ZORBAX ECLIPSE PLUS С18 (50×2,1 мм), 1,8 мкм.
Метод G: Подвижная фаза: А: 0,1% TFA в воде, В: 0,1% TFA в ACN; скорость потока: 0,8 мл/мин; колонка: Acquity UPLC ВЕН С18 (2,1×50 мм), 1,7 мкм.
Метод Н: Подвижная фаза: А: 10 мМ NH4OAC, В: 100% ACN; скорость потока: 0,8 мл/мин; колонка: Acquity UPLC ВЕН С18 (2,1×50 мм); 1,7 мкм.
Метод I: Подвижная фаза: А: 0,1% НСООН в воде: ACN (95:5), В: ACN; скорость потока: 0,8 мл/мин; колонка: ZORBAX ECLIPSE PLUS С18 (2,1×50 мм), 1,8 мкм.
Метод J: Подвижная фаза: А: 0,1% TFA в воде, В: ACN; скорость потока: 1,0 мл/мин; колонка: Zorbax Extend C18 (50×4,6 мм), 5 мкм.
Метод K: Подвижная фаза: А: 0,1% TFA в воде, В: 0,1% TFA в ACN; скорость потока: 1,5 мл/мин; колонка: XBridge С8 (50×4,6 мм), 3,5 мкм.
Метод L: Подвижная фаза: А: 0,1% TFA в воде, В: 100% ACN; скорость потока: 1,5 мл/мин; колонка: XBridge С8 (50×4,6 мм), 3,5 мкм.
УЭЖХ:
Название прибора: waters Acquity I Class
Метод А: Подвижная фаза: А: 0,1% НСООН в воде, В: 0,1% НСООН в ACN; скорость потока: 0,8 мл/мин; колонка: Acquity UPLC HSS Т3 (2,1×50 мм); 1,8 мкм. Название прибора: Shimadzu Nexera Х2 LC / 2020 MSD
Метод В: Подвижная фаза: А: 0,1% НСООН в воде, В: ACN; скорость потока: 0,8 мл/мин; колонка: Acquity UPLC ВЕН С18 (2,1×50 мм); 1,7 мкм.
ВЭЖХ:
Название прибора: приборы серии Agilent 1260 Infinity II с использованием % с УФ-детектированием (maxplot).
Метод А: Подвижная фаза: А: 10 мМ NH4HCO3 в воде, В: ACN; скорость потока: 1,0 мл/мин; колонка: XBridge С8 (50×4,6 мм, 3,5 мкм).
Метод В: Подвижная фаза: А: 0,1% TFA в воде, В: 0,1% TFA в ACN; скорость потока: 2,0 мл/мин; колонка: XBridge С8 (50×4,6 мм, 3,5 мкм).
Метод С: Подвижная фаза: А: 10 мМ NH4OAC в воде Milli-q, В: ACN; скорость потока: 1,0 мл/мин; колонка: Phenomenex Gemini С18 (150×4,6 мм, 3,0 мкм).
Метод D: Подвижная фаза: А: 0,1% TFA в воде, В: ACN; скорость потока: 1,0 мл/мин; колонка: ATLANTIS dC18 (250×4,6 мм, 5,0 мкм).
Метод Е: Подвижная фаза: А: 0,1% TFA в воде, В: ACN, скорость потока: 2,0 мл/мин; колонка: X-Bridge С8 (50×4,6 мм, 3,5 мкм).
Хиральная СФХ:
Название прибора: PIC СФХ 10 (аналитический)
Соотношение между СО2 и сорастворителем находится в диапазоне между 60:40 и 80:20
Метод А: Подвижная фаза: 0,5% изопропиламин в IPA; скорость потока: 3 мл/мин; колонка: YMC Amylose-SA (250×4,6 мм, 5 мкм).
Метод В: Подвижная фаза: 0,5% изопропиламин в IPA; скорость потока: 3 мл/мин; колонка: Chiralpak AD-H (250×4,6 мм, 5 мкм).
Метод С: Подвижная фаза: 20 мМ аммиак в метаноле; скорость потока: 3 мл/мин; колонка: YMC Cellulose-SC (250×4,6 мм, 5 мкм).
Метод D: Подвижная фаза: метанол; скорость потока: 3 мл/мин; колонка: Lux Al (250×4,6 мм, 5 мкм).
Метод Е: Подвижная фаза: 0,5% изопропиламин в метаноле; скорость потока: 5 мл/мин; колонка: Lux С4.
Метод F: Подвижная фаза: 0,5% изопропиламин в метаноле; скорость потока: 3 мл/мин; колонка: YMC Cellulose-SC.
Метод G: Подвижная фаза: 0,5% изопропиламин в метаноле; скорость потока: 3 мл/мин; колонка: Lux Al.
Метод Н: Подвижная фаза: 0,5% изопропиламин в IPA; скорость потока: 3 мл/мин; колонка: Lux Al (250×4,6 мм, 5 мкм).
Метод I: Подвижная фаза: 0,5% изопропиламин в метаноле; скорость потока: 3 мл/мин; колонка: Chiral CCS (250×4,6 мм, 5 мкм).
Метод J: Подвижная фаза: 0,5% изопропиламин в IPA; скорость потока: 5 мл/мин; колонка: YMC Cellulose-SC AD-H (250×4,6 мм, 5 мкм).
Метод K: Подвижная фаза: 0,5% изопропиламин в метаноле; скорость потока: 4 мл/мин; колонка: (R,R)-Whelk-01 (250×4,6 мм, 5 мкм).
Метод L: Подвижная фаза: 0,5% изопропиламин в IPA; скорость потока: 3 мл/мин; колонка: Chiralcel ОХ-Н (250×4,6 мм, 5 мкм).
Метод М: Подвижная фаза: 0,5% изопропиламин в IPA; скорость потока: 5 мл/мин; колонка: YMC Cellulose-SC (250×4,6 мм, 5 мкм).
Метод N: Подвижная фаза: метанол, скорость потока: 5 мл/мин; колонка: Chiralcel ОХ-Н (250×4,6 мм, 5 мкм).
Метод О: Подвижная фаза: 0,1% изопропиламин в ГРА:метанол (1:1), скорость потока: 3 мл/мин; колонка: Chiralpak AS-H (250×4,6 мм, 5 мкм).
Метод Р: Подвижная фаза: 0,5% изопропиламин в метаноле, скорость потока: 3 мл/мин; колонка: Chiralpak AS-H (250×4,6 мм, 5 мкм).
Метод Q: Подвижная фаза: IPA, скорость потока: 3 мл/мин; колонка: Lux Al (250×4,6 мм, 5 мкм).
Метод R: Подвижная фаза: 0,1% изопропиламин в IPA:метанол (1:1), скорость потока: 3 мл/мин; колонка: Lux A1 (250×4,6 мм, 5 мкм).
Метод S: Подвижная фаза: 0,5% изопропиламин в метаноле, скорость потока: 3 мл/мин; колонка: Chiralpak ОХ-Н (250×4,6 мм, 5 мкм).
Метод Т: Подвижная фаза: 0,5% изопропиламин в IPA, скорость потока: 4 мл/мин; колонка: YMC Cellulose-SB (250×4,6 мм, 5 мкм).
Метод U: Подвижная фаза: 0,5% изопропиламин в IPA, скорость потока: 3 мл/мин; колонка: Chiralpak AS-H (250×4,6 мм, 5 мкм).
Преп.ВЭЖХ:
Название прибора: Agilent 1290 Infinity II
Метод А: Подвижная фаза: А: 0,1% TFA в воде; подвижная фаза; В: 0,1% TFA в ACN; скорость потока: 2,0 мл/мин; колонка: X-Bridge С8 (50×4,6 мм, 3,5 мкм).
Метод В: Подвижная фаза: А: 10 мМ NH4OAC в воде; В: ACN; скорость потока: 35 мл/мин; колонка: X select С18 (30×150 мм, 5 мкм).
Метод С: Подвижная фаза: А: 10 мМ NH4HCO3 в воде; В: ACN; скорость потока: 1,0 мл/мин; колонка: XBridge С8 (50×4,6 мм, 3,5 мкм).
Метод D: Подвижная фаза: А: 0,1% НСООН в воде; В: ACN; скорость потока: 1,0 мл/мин; колонка: X-select С18 (30×150 мм, 5 мкм).
Хиральная препаративная СФХ:
Название прибора: PIC СФХ 100 и PSC СФХ 400
Соотношение между СО2 и сорастворителем находится в диапазоне между 60:40 и 80:20
Метод А: Подвижная фаза: 0,5% изопропиламин в IPA; скорость потока: 3 мл/мин; колонка: YMC Amylose-SA (250×30 мм, 5 мкм).
Метод В: Подвижная фаза: 0,5% изопропиламин в IPA; скорость потока: 3 мл/мин; колонка: Chiralpak AD-H (250×30 мм, 5 мкм).
Метод С: Подвижная фаза: 20 мМ аммиак в метаноле; скорость потока: 3 мл/мин; колонка: YMC Cellulose-SC (250×30 мм, 5 мкм).
Метод D: Подвижная фаза: метанол; скорость потока: 3 мл/мин; колонка: Chiral CCS (250×30 мм, 5 мкм).
Метод Е: Подвижная фаза: метанол; скорость потока: 3 мл/мин; колонка: Lux A1 (250×30 мм, 5 мкм).
Метод F: Подвижная фаза: 0,5% изопропиламин в IPA; скорость потока: 3 мл/мин; колонка: Lux A1 (250×30 мм, 5 мкм).
Метод G: Подвижная фаза: 0,5% изопропиламин в метаноле; скорость потока: 3 мл/мин; колонка: Chiral CCS (250×30 мм, 5 мкм).
Метод Н: Подвижная фаза: 0,5% изопропиламин в IPA, скорость потока: 5 мл/мин; колонка: YMC Amylose-SC (250×30 мм, 5 мкм).
Метод J: Подвижная фаза: 0,5% изопропиламин в IPA; скорость потока: 3 мл/мин; колонка: Chiralcel ОХ-Н (250×30 мм, 5 мкм).
Метод K: Подвижная фаза: 0,5% изопропиламин в метаноле; скорость потока: 5 мл/мин; колонка: YMC Cellulose-SC (250×30 мм, 5 мкм).
Метод L: Подвижная фаза: метанол; скорость потока: 5 мл/мин; колонка: Chiralcel ОХ-Н (250×30 мм, 5 мкм).
Метод М: Подвижная фаза: 0,5% изопропиламин в метаноле; скорость потока: 3 мл/мин; колонка: Lux A1 (250×30 мм, 5 мкм).
Сокращения
ACN ацетонитрил
DCM дихлорметан
DBAD ди-трет-бутилазодикарбоксилат
DMF диметилформамид
IPA изопропиловый спирт
ЖХ-МС жидкостная хроматография - масс-спектрометрия
ВЭЖХ высокоэффективная жидкостная хроматография
РЕ петролейный эфир
СФХ сверхкритическая флюидная хроматография
TFA трифторуксусная кислота
THF тетрагидрофуран
ТСХ тонкослойная хроматография
УЭЖХ ультраэффективная жидкостная хроматография
Изобретение далее будет описано с помощью следующих примеров, которые не ограничивают изобретение ни в каком аспекте. Все цитированные документы и источники информации включены посредством ссылки.
ПРИМЕРЫ
Промежуточное соединение 1
2-(((2-Амино-4-бром-5-метоксифенил)тио)метил)-2-метилгексановая кислота
К перемешиваемому раствору 5-бром-6-метоксибензо[d]тиазол-2-амина (63 г, 0,243 моль) в воде (630 мл) добавляли KOH (218,2 г, 3,89 моль) и реакционную смесь перемешивали в течение 16 часов при 120°С. После завершения взаимодействия (контролируется посредством ЖХ-МС) реакционную смесь охлаждали до комнатной температуры. Затем добавляли по каплям раствор 2-(бромметил)-2-метилгексановой кислоты (70,5 г, 6,31 моль) в THF (210 мл) и реакционную смесь перемешивали в течение 16 часов при комнатной температуре. После завершения взаимодействия (контролируется посредством ЖХ-МС) реакционную смесь охлаждали до 0°С и подкисляли конц. HCl (рН примерно 2). Реакционную смесь экстрагировали EtOAc (2×350 мл) и объединенный органический слой промывали водой (150 мл) и рассолом (150 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество переносили в том виде, как оно получено, на следующую стадию без какой-либо дополнительной очистки. Выход: 75 г (неочищенное, коричневая смола).
ЖХ-МС: (Метод А) 376,1 (М+), 378,0 (М++2), Rt: 2,44 мин, 92,97% (макс.).
Промежуточное соединение 2
7-Бром-3-бутил-8-метокси-3-метил-2,3-дигидро-1,5-бензотиазепин-4(5Н)-он
К перемешиваемому раствору 2-(((2-амино-4-бром-5-метоксифенил)тио)метил)-2-метилгексановой кислоты (Промежуточное соединение 1; 75,0 г, 0,199 моль) в EtOAc (750 мл) при 0°С добавляли по каплям триэтиламин (60,4 г, 0,59 моль) и раствор 1-пропанфосфонового ангидрида (50% в EtOAc, 95,1 г, 0,29 моль). Реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После завершения взаимодействия (контролируется посредством УЭЖХ) реакционную смесь гасили водой (150 мл) и водный слой экстрагировали EtOAc (2×200 мл). Объединенный органический слой промывали рассолом (150 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 10-12% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 63% (45 г, не совсем белое твердое вещество).
1Н ЯМР (400 МГц, DMSO-d6): δ 9.62 (s, 1H), 7.33 (s, 1H), 7.13 (s, 1H), 3.83 (s, 3Н), 3.17 (s, 2Н), 1.46-1.44 (m, 2Н), 1.22 (s, 3Н), 1.17-1.14 (m, 4Н), 0.79 (t, J=6,8 Гц, 3Н). ЖХ-МС: (Метод А) 360,0 (М++2), Rt: 2,64 мин, 97,14% (макс.).
Промежуточное соединение 3
7-Бром-3-бутил-5-(4-фторфенил)-8-метокси-3-метил-2,3-дигидро-1,5-бензотиазепин-4(5Н)-он

К раствору 7-бром-3-бутил-8-метокси-3-метил-2,3-дигидро-1,5-бензотиазепин-4(5Н)-она (Промежуточное соединение 2; 5 г, 14 ммоль) в 1-бром-4-фторбензоле (50 мл) добавляли сухой K2CO3 (3,9 г, 28 ммоль), CuI (0,26 г, 1,4 ммоль) и трис[2-(2-метоксиэтокси)этил]амин (0,9 г, 2,8 ммоль) и реакционную смесь нагревали в течение 16 часов при 135°С. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь концентрировали в вакууме. Полученный остаток затем распределяли между водой (25 мл) и EtOAc (25 мл). Водную часть экстрагировали EtOAc (2×100 мл) и объединенный органический слой промывали охлажденной на льду водой (100 мл) и рассолом (100 мл). Органическую часть сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Полученный остаток растирали с петролейным эфиром. Полученное твердое вещество затем отфильтровывали и сушили с получением указанного в заголовке соединения. Выход: 85% (5,5 г, бледно-коричневое твердое вещество).
ЖХ-МС: (Метод Е) 451,9 (М++Н), Rt: 3,26 мин, 81,86% (макс.).
Промежуточное соединение 4
7-Бром-3-бутил-5-(4-фторфенил)-8-метокси-3-метил-2,3,4,5-тетрагидро-1,5-бензотиазепин

К раствору 7-бром-3-бутил-5-(4-фторфенил)-8-метокси-3-метил-2,3-дигидро-1,5-бензотиазепин-4(5Н)-она (Промежуточное соединение 3; 5,2 г, 11,5 ммоль) в THF (50 мл) при 0°С добавляли диметилсульфид борана (1 M b THF, 58 мл, 58 ммоль) и реакционную смесь нагревали в течение 16 часов при 75°С. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь охлаждали до 0°С, добавляли метанол (60 мл) и реакционную смесь нагревали в течение 2 часов при 60°С. Реакционную смесь затем охлаждали до комнатной температуры, концентрировали в вакууме и полученный остаток распределяли между водой (50 мл) и EtOAc (50 мл). Водный слой экстрагировали EtOAc (2×100 мл) и объединенный органический слой промывали охлажденной на льду водой (100 мл) и рассолом (100 мл). Органическую часть сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения. Выход: 5,3 г (неочищенная бесцветная смола).
ЖХ-МС: (Метод Е) 439,9 (М++Н), Rt: 3,55 мин, 87,61% (макс.).
Промежуточное соединение 5
1,1-Диоксид 7-бром-3-бутил-5-(4-фторфенил)-8-метокси-3-метил-2,3,4,5-тетрагидро-1,5-бензотиазепина

К раствору 7-бром-3-бутил-5-(4-фторфенил)-8-метокси-3-метил-2,3,4,5-тетрагидро-1,5-бензотиазепина (Промежуточное соединение 4; 5,3 г, 12,1 ммоль) в смеси THF и воды (8:2, 55 мл) добавляли оксон (37,16 г, 120,8 ммоль) и реакционную смесь перемешивали в течение 16 часов при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) водный слой экстрагировали EtOAc (2×100 мл) и объединенный органический слой промывали охлажденной на льду водой (100 мл) и рассолом (100 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 15% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 75% (4,3 г, белое твердое вещество).
1Н ЯМР (400 МГц, DMSO-d6): δ 7.45 (s, 1Н), 7.21 (s, 1H), 7.12-7.05 (m, 4H), 3.93 (s, 3H), 3.85-3.61 (m, 2H), 3.29 (s, 2H), 1.52-1.39 (m, 1H), 1.37-1.26 (m, 1H), 1.25-1.03 (m, 4H), 0.98 (s, 3H), 0.81-0.74 (m, 3Н). ЖХ-МС: (Метод E) 470,1 (M+), Rt: 3,21 мин, 98,04% (макс.).
Промежуточное соединение 6
1,1-Диоксид 3-бутил-5-(4-фторфенил)-8-гидрокси-3-метил-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепина

К раствору 1,1-диоксида 7-бром-3-бутил-5-(4-фторфенил)-8-метокси-3-метил-2,3,4,5-тетрагидро-1,5-бензотиазепина (Промежуточное соединение 5; 4,3 г, 9,14 ммоль) в DMF (43 мл) добавляли тиометоксид натрия (3,2 г, 45,7 ммоль) и реакционную смесь перемешивали в течение 12 часов при 80°С. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь гасили охлажденной на льду водой (25 мл) и водный слой экстрагировали EtOAc (2×50 мл). Объединенный органический слой промывали охлажденной на льду водой (50 мл) и рассолом (50 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 30% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 90% (3,5 г, не совсем белое твердое вещество).
1Н ЯМР (400 МГц, DMSO-d6): δ 10.57 (s, 1H), 7.31 (s, 1H), 7.04-6.98 (m, 2Н), 6.92-6.88 (m, 2Н), 6.71 (s, 1H), 3.81-3.65 (m, 2Н), 3.34-3.20 (m, 2Н), 2.20 (s, 3Н), 1.55-1.39 (m, 1Н), 1.38-1.05 (m, 5Н), 0.99 (s, 3Н), 0.81-0.77 (m, 3Н). ЖХ-МС: (Метод Е) 424,2 (М++Н), Rt: 2,78 мин, 98,08% (макс.).
Разделение энантиомеров:
1,1-Диоксид (S)-3-бутил-5-(4-фторфенил)-8-гидрокси-3-метил-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепина и 1,1-диоксид (R)-3-бутил-5-(4-фторфенил)-8-гидрокси-3-метил-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепина
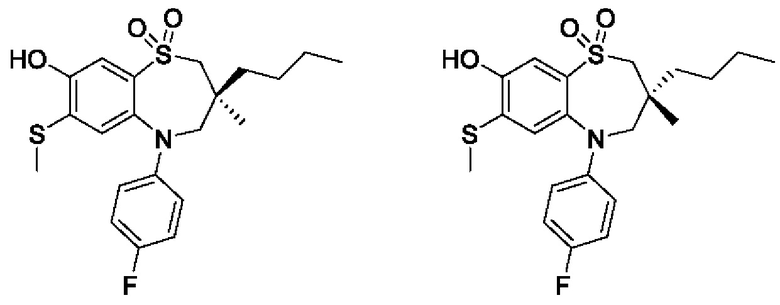
Эти два энантиомера рацемического 1,1-диоксида 3-бутил-5-(4-фторфенил)-8-гидрокси-3-метил-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепина (2,8 г, 6,61 ммоль) разделяли посредством хиральной СФХ (Метод М). Материал концентрировали в вакууме при 40°С. Первая элюирующаяся фракция соответствовала энантиомеру 1, и вторая элюирующаяся фракция соответствовала энантиомеру 2. Абсолютная конфигурация этих двух энантиомеров не известна.
Энантиомер 1: Выход: 42% (1,2 г, белое твердое вещество). 1Н ЯМР (400 МГц, DMSO-d6): δ 10.56 (s, 1H), 7.30 (s, 1H), 7.04-6.98 (m, 2Н), 6.92-6.88 (m, 2Н), 6.71 (s, 1H), 3.80-3.50 (m, 2Н), 3.20-3.15 (m, 2Н), 2.21 (s, 3Н), 1.58-1.36 (m, 1H), 1.35-1.03 (m, 5Н), 0.99 (s, 3Н), 0.80 (t, J=9,20 Гц, 3Н). ЖХ-МС: (Метод Е) 424,2 (М++Н), Rt: 2,79 мин, 93,0% (макс.). ВЭЖХ: (Метод В) Rt: 5,56 мин, 93,77% (макс.). Хиральная СФХ: (Метод М) Rt: 1,70 мин, 99,78% (макс.).
Энантиомер 2: Выход: 44% (1,25 г, белое твердое вещество). 1Н ЯМР (400 МГц, DMSO-d6): δ 10.57 (s, 1H), 7.30 (s, 1H), 7.03-6.99 (m, 2Н), 6.92-6.91 (m, 2Н), 6.71 (s, 1H), 4.00-3.40(m, 2Н), 3.24-3.16 (m, 2Н), 2.21 (s, 3Н), 1.62-1.38 (m, 1H), 1.38-1.10 (m, 5Н), 0.99 (s, 3Н), 0.80 (t, J=8,40 Гц, 3Н). ЖХ-МС: (Метод Е) 424,2 (М++Н), Rt: 2,79 мин, 98,86% (макс.). ВЭЖХ: (Метод В) Rt: 5,56 мин, 97,15% (макс.). Хиральная СФХ: (Метод М) Rt: 2,51 мин, 99,72% (макс.).
Промежуточное соединение 7
Метил-3-((3-бутил-5-(4-фторфенил)-3-метил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропаноат
(индивидуальные диастереомеры)
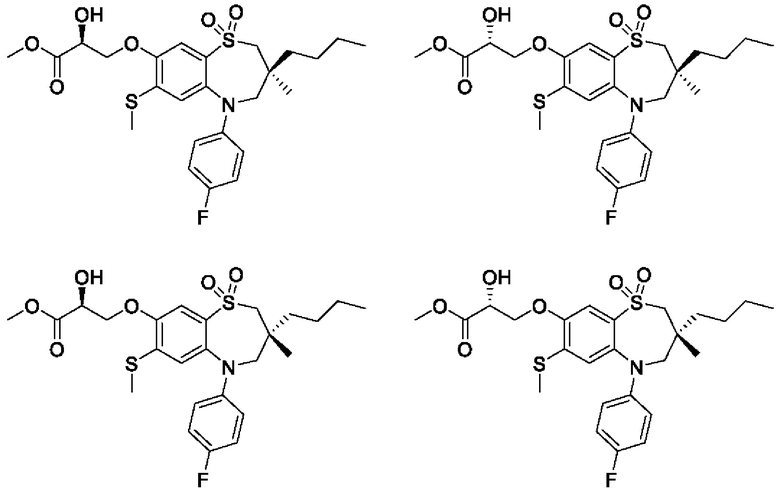
Диастереомеры 1 и 2
К перемешиваемому раствору энантиомера 1 1,1-диоксида 3-бутил-5-(4-фторфенил)-8-гидрокси-3-метил-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепина (Промежуточное соединение 6; 400 мг, 0,94 ммоль) в DMF (4 мл) добавляли порциями Cs2CO3 (615 мг, 1,83 моль) и метил-оксиран-2-карбоксилат (867 мг, 8,49 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 72 часов. Реакционную смесь гасили разбавленной HCl (1,5 н., 5 мл) и разбавляли водой (5 мл). Водный слой экстрагировали EtOAc (2×50 мл) и объединенные органические слои промывали водой (10 мл) и рассолом (10 мл). Органическую часть сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 35% EtOAc/PE; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 50% (250 мг, белая смола).
1Н ЯМР (400 МГц, DMSO-d6): δ 7.34 (s, 1H), 7.07-6.99 (m, 4Н), 6.71 (s, 1H), 5.90 (d, J=6,0 Гц, 1H), 4.48 (d, J=4,8 Гц, 1H), 4.27 (s, 2Н), 3.69 (s, 5Н), 3.40-3.20 (m, 2Н), 2.19 (s, 3Н), 1.52-1.38 (m, 1H), 1.38-1.02 (m, 5Н), 0.99 (s, 3Н), 0.79 (t, J=7,20 Гц, 3Н). ЖХ-МС: (Метод Е) 526,0 (М++Н), Rt: 2,95 мин, 97,92% (макс.). ВЭЖХ: (Метод В) Rt: 5,50 мин, 96,34% (макс.).
Эти два диастереомера (210 мг, 0,39 ммоль) разделяли посредством хиральной СФХ (Метод G). Материал концентрировали в вакууме при 40°С. Первая элюирующаяся фракция соответствовала диастереомеру 1, и вторая элюирующаяся фракция соответствовала диастереомеру 2.
Диастереомеры 3 и 4
Смесь диастереомеров 3 и 4 указанного в заголовке соединения получали в соответствии с той же методикой, начиная с 400 мг энантиомера 2 Промежуточного соединения 6. Выход: 50% (250 мг, желтая смола).
1Н ЯМР (400 МГц, DMSO-d6): δ 7.34 (s, 1H), 7.08-6.99 (m, 4Н), 6.72 (s, 1H), 5.89 (d, J=7,6 Гц, 1H), 4.49-4.47 (m, 1H), 4.27-4.26 (m, 2Н), 3.69-3.67 (m, 5Н), 3.23-3.20 (m, 2Н), 2.19 (s, 3Н), 1.55-1.40 (m, 1H), 1.40-1.05 (m, 5Н), 0.99 (s, 3Н), 0.79 (t, J=9,60 Гц, 3Н). ЖХ-МС: (Метод Е) 526,0 (М++Н), Rt: 2,95 мин, 97,93% (макс.). ВЭЖХ: (Метод В) Rt: 5,50 мин, 96,46% (макс.).
Эти два диастереомера (210 мг, 0,39 ммоль) разделяли посредством хиральной СФХ (Метод G). Материал концентрировали в вакууме при 40°С.Первая элюирующаяся фракция соответствовала диастереомеру 3, и вторая элюирующаяся фракция соответствовала диастереомеру 4.
Диастереомер 1: Выход: 38% (80 мг, светло-желтое твердое вещество). 1Н ЯМР (400 МГц, DMSO-d6): δ 7.34 (s, 1Н), 7.08-6.99 (m, 4H), 6.71 (s, 1H), 5.89 (d, J=8,0 Гц, 1H), 4.48 (d, J=6,0 Гц, 1H), 4.27 (t, J=4,0 Гц, 2H), 3.69 (s, 5H), 3.31-3.22 (m, 2H), 2.19 (s, 3Н), 1.52-1.38 (m, 1H), 1.30-1.10 (m, 5H), 0.99 (s, 3Н), 0.79 (t, J=9,20 Гц, 3Н). ЖХ-МС: (Метод G) 526,2 (М++Н), Rt: 2,32 мин, 99,80% (макс.). ВЭЖХ: (Метод В) Rt: 5,58 мин, 99,40% (макс.). Хиральная СФХ: (Метод G) Rt: 2,68 мин, 99,38% (макс.).
Диастереомер 2: Выход: 38% (80 мг, светло-желтое твердое вещество). 1Н ЯМР (400 МГц, DMSO-d6): δ 7.34 (s, 1H), 7.08-6.96 (m, 4H), 6.72 (s, 1H), 5.89 (d, J=7,6 Гц, 1H), 4.48 (d, J=6,8 Гц, 1H), 4.27 (d, J=5,6 Гц, 2H), 3.69 (s, 5H), 3.31-3.22 (m, 2H), 2.19 (s, 3Н), 1.55-1.40 (m, 1H), 1.24-1.11 (m, 5H), 0.99 (s, 3Н), 0.79 (t, J=9,20 Гц, 3Н). ЖХ-МС: (Метод G) 526,2 (М++Н), Rt: 2,32 мин, 98,65% (макс.). ВЭЖХ: (Метод В) Rt: 5,50 мин, 99,46% (макс.). Хиральная СФХ: (Метод G) Rt: 4,02 мин, 99,75% (макс.).
Диастереомер 3: Выход: 40% (85 мг, светло-желтое твердое вещество). 1Н ЯМР (400 МГц, DMSO-d6): δ 7.35 (s, 1Н), 7.08-6.99 (m, 4Н), 6.72 (s, 1H), 5.89 (d, J=7,6 Гц, 1H), 4.49-4.48 (m, 1H), 4.28-4.26 (m, 2Н), 3.75-3.50 (m, 5Н), 3.23-3.17 (m, 2Н), 2.19 (s, 3Н), 1.55-1.35 (m, 1H), 1.32-1.06 (m, 5Н), 1.00 (s, 3Н), 0.90-0.70 (m, 3Н). ЖХ-МС: (Метод Е) 526,0 (М++Н), Rt: 2,98 мин, 97,37% (макс.). ВЭЖХ: (Метод В) Rt: 5,58 мин, 96,35% (макс.). Хиральная СФХ: (Метод G) Rt: 2,36 мин, 99,90% (макс.).
Диастереомер 4: Выход: 38% (80 мг, светло-желтое твердое вещество). 1Н ЯМР (400 МГц, DMSO-d6): δ 7.35 (s, 1H), 7.07-6.99 (m, 4H), 6.72 (s, 1H), 5.89 (d, J=6,0 Гц, 1H), 4.50-4.47 (m, 1H), 4.30-4.23 (m, 2H), 3.95-3.45 (m, 5H), 3.27-3.23 (m, 2H), 2.19 (s, 3Н), 1.27-1.08 (m, 6H), 0.99 (s, 3Н), 0.79 (t, J=7,20 Гц, 3Н). ЖХ-МС: (Метод Е) 526,1 (М++Н), Rt: 2,96 мин, 97,20% (макс.). ВЭЖХ: (Метод В) Rt: 5,51 мин, 99,09% (макс.). Хиральная СФХ: (Метод G) Rt: 3,31 мин, 99,48% (макс.).
Абсолютная конфигурация этих четырех диастереомеров не известна.
Промежуточное соединение 8
2-(((2-Амино-5-метоксифенил)тио)метил)-2-этилгексановая кислота

К перемешиваемому раствору 6-метоксибензо[d]тиазол-2-амина (270 г, 1,498 моль) в воде (2700 мл) добавляли KOH (1345 г, 23,96 моль) и реакционную смесь перемешивали в течение 16 часов при 120°С. После завершения взаимодействия (контролируется посредством ЖХ-МС) реакционную смесь охлаждали до комнатной температуры. Затем добавляли по каплям раствор 2-(бромметил)-2-этилгексановой кислоты (533 г, 2,25 моль) в THF (1000 мл) и полученную реакционную смесь перемешивали в течение 16 часов при комнатной температуре. После завершения взаимодействия (контролируется посредством ЖХ-МС) реакционную смесь охлаждали до 0°С и подкисляли концентрированной HCl (рН примерно 2). Реакционную смесь экстрагировали EtOAc (2x4000 мл) и объединенный органический слой промывали водой (1000 мл) и рассолом (1000 мл). Органическую часть затем сушили над безводным Na2SO4 и концентрировали в вакууме с получением неочищенного вещества, которое переносили в том виде, как оно получено, на следующую стадию без какой-либо дополнительной очистки. Выход: 590 г (неочищенное, коричневая смола).
ЖХ-МС: (Метод А) 312,1 (М++Н), Rt: 2,24 мин, 97,34% (макс.).
Промежуточное соединение 9
3-Бутил-3-этил-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5Н)-он

К перемешиваемому раствору 2-(((2-амино-5-метоксифенил)тио)метил)-2-этилгексановой кислоты (Промежуточное соединение 8; 590 г, 1,89 моль) в EtOAc (2500 мл) при 0°С добавляли по каплям триэтиламин (530 мл, 3,78 моль) и раствор 1-пропанфосфонового ангидрида (50% в EtOAc; 785 г, 2,46 моль) и реакционную смесь перемешивали в течение 16 часов при комнатной температуре. После завершения взаимодействия (контролируется посредством ЖХ-МС) к этой реакционной смеси добавляли воду (2000 мл) и водный слой экстрагировали EtOAc (2×2000 мл). Объединенный органический слой промывали рассолом (800 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Это неочищенное вещество очищали посредством промывки метанолом с получением указанного в заголовке соединения. Выход: 48% (265 г, не совсем белое твердое вещество).
1Н ЯМР (300 МГц, DMSO-d6): δ 9.53 (s, 1H), 7.04-7.01 (m, 2Н), 6.87-6.86 (m, 1H), 3.72 (s, 3Н), 2.50 (s, 2Н), 1.68-1.66 (m, 4Н), 1.50-1.48 (m, 4Н), 0.79-0.72 (m, 6Н). ЖХ-МС: (Метод А) 294,3 (М++Н), Rt: 2,68 мин, 99,47% (макс.).
Промежуточное соединение 10
7-Бром-3-бутил-3-этил-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5Н)-он

К перемешиваемому раствору 3-бутил-3-этил-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5Н)-она (Промежуточное соединение 9; 265 г, 0,903 моль) в смеси 1:1 DCM и ацетонитрила (2650 мл) добавляли порциями N-бромсукцинимид (209 г, 1,17 моль) и реакционную смесь перемешивали в течение 16 часов при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь концентрировали. Полученное неочищенное вещество обрабатывали охлажденным ацетонитрилом и перемешивали в течение 30 минут.Полученный осадок отфильтровывали и промывали охлажденным ацетонитрилом (2×100 мл) и сушили в вакууме с получением указанного в заголовке соединения. Выход: 179 г (79%, неочищенное, коричневое твердое вещество).
1H ЯМР (300 МГц, DMSO-d6): δ 9.61 (s, 1Н), 7.33 (s, 1H), 7.10 (s, 1H), 3.82 (s, 3H), 2.98 (s, 2H), 1.70-1.68 (m, 4H), 1.48-1.45 (m, 4H), 0.84-0.82 (m, 6H). ЖХ-МС: (Метод A) 372,0 (M++H), Rt: 2,83 мин, 99,20% (макс.).
Промежуточное соединение 11
7-Бром-3-бутил-3-этил-5-(4-фторфенил)-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5Н)-он и 3-бутил-3-этил-5-(4-фторфенил)-7-йод-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5Н)-он

К перемешиваемому раствору 7-бром-3-бутил-3-этил-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5Н)-она (Промежуточное соединение 10; 15 г, 40,2 ммоль) в 1-фтор-4-йодбензоле (50 мл) добавляли йодид меди(I) (1,58 г, 0,8 ммоль) и K2CO3 (11 г, 80,5 ммоль) и реакционную смесь продували азотом в течение 20 минут для дегазирования. Затем добавляли трис[2-(2-метоксиэтокси)этил]амин (1,3 мл, 4,0 ммоль) в атмосфере азота и полученную реакционную смесь нагревали в течение 16 часов при 135°С. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь фильтровали через целит и эту набивку целита промывали EtOAc (200 мл). Фильтрат промывали водой (100 мл) и рассолом (75 мл) и сушили над безводным Na2SO4. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 5% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 64% (12,2 г, не совсем белое твердое вещество).
ЖХ-МС: (Метод Е) 467,1 (М++2) для 7-бромзамещенного соединения и 514,1 (М++Н) для 7-йодзамещенного соединения), Rt: 3,33 мин, 92,83% (макс.).
Промежуточное соединение 12
7-Бром-3-бутил-3-этил-5-(4-фторфенил)-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепин и 3-бутил-3-этил-5-(4-фторфенил)-7-йод-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепин

К перемешиваемому раствору смеси 7-бром-3-бутил-3-этил-5-(4-фторфенил)-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5Н)-она и 3-бутил-3-этил-5-(4-фторфенил)-7-йод-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5Н)-она (Промежуточное соединение 11; 12 г, 25,7 ммоль) в THF (100 мл) при 0°С добавляли по каплям диметилсульфид борана (2 М в THF; 38 мл, 77 ммоль) и реакционную смесь кипятили с обратным холодильником в течение 16 часов при 65°С. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь охлаждали до 0°С, гасили метанолом (20 мл) и нагревали в течение 2 часов при 65°С. Полученную реакционную смесь затем охлаждали до комнатной температуры и концентрировали в вакууме. Остаток разбавляли водой (100 мл) и водный слой экстрагировали DCM (2×100 мл). Объединенный органический слой промывали водой (50 мл) и рассолом (50 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество переносили в том виде, как оно получено, на следующую стадию без какой-либо дополнительной очистки. Выход: 10 г (неочищенное, черная смола).
ЖХ-МС: (Метод Е) 451,8 (М++Н) для 7-бромзамещенного соединения и 499,7 (М++Н) для 7-йодзамещенного соединения, Rt: 3,78 мин, 75,13% (макс.).
Промежуточное соединение 13
1,1-Диоксид 7-бром-3-бутил-3-этил-5-(4-фторфенил)-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепина и 1,1-диоксид 3-бутил-3-этил-5-(4-фторфенил)-7-йод-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепина
К перемешиваемому раствору смеси 7-бром-3-бутил-3-этил-5-(4-фторфенил)-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепина и 3-бутил-3-этил-5-(4-фторфенил)-7-йод-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепина (Промежуточное соединение 12; 10 г, 26,6 ммоль) в THF (100 мл) и воде (60 мл) добавляли при 0°С оксон (81 г, 26,6 ммоль). Полученную реакционную смесь перемешивали в течение 16 часов при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь фильтровали через воронку Бюхнера и фильтрат экстрагировали EtOAc (2×200 мл). Объединенный органический слой промывали водой (100 мл) и рассолом (100 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 15% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 54% (7 г, белое твердое вещество).
ЖХ-МС: (Метод Е) 486,0 (М++2) для 7-бромзамещенного соединения и 532,0 (М++Н) для 7-йодзамещенного соединения, Rt: 2,87 мин, 91,53% (макс.).
Промежуточное соединение 14
1,1-Диоксид 3-бутил-3-этил-5-(4-фторфенил)-8-гидрокси-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепина

К перемешиваемому раствору смеси 1,1-диоксида 7-бром-3-бутил-3-этил-5-(4-фторфенил)-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепина и 1,1-диоксида 3-бутил-3-этил-5-(4-фторфенил)-7-йод-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепина (Промежуточное соединение 13; 3 г, 6,2 ммоль) в DMF (16 мл) добавляли при комнатной температуре тиометоксид натрия (2,1 г, 31 ммоль) и реакционную смесь перемешивали в течение 16 часов при 65°С.После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь охлаждали до комнатной температуры и гасили водой (25 мл). Водный слой экстрагировали EtOAc (2×50 мл). Объединенный органический слой промывали рассолом (20 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 10% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 77% (2,13 г, коричневое твердое вещество).
1Н ЯМР (400 МГц, DMSO-d6): δ 10.49 (s, 1H), 7.28 (s, 1H), 7.06-6.96 (m, 4Н), 6.61 (s, 1Н), 3.62 (bs, 2Н), 3.21 (s, 2Н), 2.17 (s, 3Н), 1.61-1.25 (m, 4Н), 1.20-1.01 (m, 4Н), 0.81-0.74 (m, 6Н). ЖХ-МС: (Метод А) 438,1 (М++Н), Rt: 2,78 мин, 87,79% (макс.).
Промежуточное соединение 15
Этил-1-(((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)метил)циклопропан-1-карбоксилат

К перемешиваемому раствору 1,1-диоксида 3-бутил-3-этил-5-(4-фторфенил)-8-гидрокси-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепина (Промежуточное соединение 14; 200 мг, 0,45 ммоль) в DMF (5 мл) добавляли трифенилфосфин (180 мг, 0,68 ммоль), этил-(1-гидроксиметил)циклопропанкарбоксилат (99 мг, 0,68 ммоль) и DBAD (210 мг, 0,91 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 4 часов. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь разбавляли водой (10 мл) и водный слой экстрагировали EtOAc (2×10 мл). Объединенный органический слой промывали водой (15 мл) и рассолом (15 мл) и сушили над безводным Na2SO4. Органическую часть фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 11% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 93% (240 мг, бесцветная смола).
ЖХ-МС: (Метод Е) 564,1 (М++Н), Rt: 3,33 мин, 95,41% (макс.).
Промежуточное соединение 16
Метил-3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2,2-диметилпропаноат

К перемешиваемому раствору 1,1-диоксида 3-бутил-3-этил-5-(4-фторфенил)-8-гидрокси-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепина (Промежуточное соединение 14; 0,5 г, 1,10 ммоль) в THF (10 мл) при 0°С добавляли метил-3-гидрокси-2,2-диметилпропаноат (0,15 г, 1,10 ммоль) и трифенилфосфин (0,43 г, 1,60 ммоль) и реакционную смесь перемешивали в течение 5 минут.Затем добавляли DBAD (0,50 г, 2,20 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 24 часов. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь гасили водой (10 мл) и водный слой экстрагировали EtOAc (2×15 мл). Объединенный органический слой промывали водой (2×15 мл) и рассолом (15 мл) и сушили над безводным Na2SO4. Органическую часть фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 10% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 47% (0,30 г, белое твердое вещество).
ЖХ-МС: (Метод Е) 552,1(М++Н), Rt: 3,32 мин, 85,43% (макс.).
Промежуточное соединение 17
Метил-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидрокси-2-метилпропаноат

К перемешиваемому раствору 1,1-диоксида 3,3-диэтил-8-гидрокси-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепина (3,0 г, 9,4 ммоль) в DMF (10 мл) добавляли Cs2CO3 (6,11 г, 18,8 ммоль) и реакционную смесь перемешивали в течение 15 минут при комнатной температуре. Затем добавляли метил-2-метилглицидат (3,27 г, 28,2 ммоль) и реакционную смесь перемешивали в течение 72 часов при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь гасили разбавленной HCl (15 мл) и разбавляли водой (10 мл). Водный слой экстрагировали EtOAc (2×15 мл) и объединенный органический слой промывали водой (15 мл) и рассолом (15 мл). Органическую часть сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 10% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 29,35% (1,5 г, бесцветное твердое вещество).
ЖХ-МС: (Метод Е) 508,2 (М++Н), Rt: 2,72 мин, 99,88% (макс.).
Промежуточное соединение 18
Метил-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фтор-2-метилпропаноат

К перемешиваемому раствору метил-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидрокси-2-метилпропаноата (Промежуточное соединение 17; 300 мг, 0,59 ммоль) в DCM (10 мл) при -10°С добавляли трифторид диэтиламиносеры (0,09 г, 0,70 ммоль) и реакционную смесь перемешивали в течение 2 часов. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь гасили водой (5 мл) и водный слой экстрагировали EtOAc (2×5 мл).
Объединенный органический слой промывали водой (5 мл) и рассолом (5 мл) и сушили над безводным Na2SO4. Органическую часть фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 20% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 43% (130 мг, не совсем белое твердое вещество).
ЖХ-МС: (Метод Е) 510,3 (М++Н), Rt: 2,89 мин, 98,90% (макс.).
Разделение энантиомеров:
Метил-(R)-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фтор-2-метилпропаноат и метил-(S)-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фтор-2-метилпропаноат

Эти два энантиомера рацемического метил-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фтор-2-метилпропаноата (100 мг, 0,19 ммоль) разделяли посредством хиральной СФХ (Метод В). Материал концентрировали в вакууме при 40°С. Первая элюирующаяся фракция соответствовала энантиомеру 1, и вторая элюирующаяся фракция соответствовала энантиомеру 2. Абсолютная конфигурация этих двух энантиомеров не известна.
Энантиомер 1: Выход: 30% (30 мг, белое твердое вещество). 1Н ЯМР (400 МГц, DMSO-d6): δ 7.36 (s, 1H), 7.22 (t, J=8,4 Гц, 2Н), 6.99 (d, J=7,2 Гц, 2Н), 6.86 (t, J=7,6 Гц, 1Н), 6.71 (s, 1H), 4.50-4.39 (m, 2H), 3.76 (s, 3Н), 3.69 (bs, 2H), 3.26 (s, 2H), 2.16 (s, 3Н), 1.60-1.52 (m, 5H), 1.38-1.32 (m, 2H), 0.75 (t, J=7,2 Гц, 6H). ЖХ-МС: (Метод Е) 510,0 (М++Н), Rt: 3,04 мин, 96,42% (макс.). ВЭЖХ: (Метод В) Rt: 5,90 мин, 97,43% (макс.).
Энантиомер 1: Выход: 30% (30 мг, белое твердое вещество). 1Н ЯМР (400 МГц, DMSO-d6): 7.35 (s, 1Н), 7.22 (t, J=8,4 Гц, 2Н), 6.99 (d, J=7,2 Гц, 2Н), 6.86 (t, J=7,6 Гц, 1Н), 6.70 (s, 1H), 4.50-4.42 (m, 2Н), 3.70 (s, 3Н), 3.60 (m, 2Н), 3.26 (s, 2Н), 2.16 (s, 3Н), 1.65-1.52 (m, 5Н), 1.37-1.32 (m, 2Н), 0.75 (t, J=7,6 Гц, 6Н). ЖХ-МС: (Метод Е) 510,0 (М++Н), Rt: 3,04 мин, 98,16% (макс.). ВЭЖХ: (Метод В) Rt: 5,90 мин, 99,29% (макс.).
Промежуточное соединение 19
Метил-3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропаноат

К перемешиваемому раствору 1,1-диоксида 3-бутил-3-этил-5-(4-фторфенил)-8-гидрокси-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепина (Промежуточное соединение 14; 750 мг, 1,71 ммоль) в DMF (6 мл) добавляли Cs2CO3 (1,11 г, 3,42 ммоль) и реакционную смесь перемешивали в течение 15 минут при комнатной температуре. Затем добавляли по каплям метил-оксиран-2-карбоксилат (0,42 мл, 5,14 ммоль) и реакционную смесь перемешивали в течение 16 часов при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь гасили разбавленной HCl (1,5 н., 1 мл) и разбавляли водой (1 мл). Водный слой экстрагировали EtOAc (2×5 мл). Объединенный органический слой промывали водой (5 мл) и рассолом (5 мл) и сушили над безводным Na2SO4. Органическую часть фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 20-30% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 50% (300 мг, бесцветная смола).
1Н ЯМР: (400 МГц, DMSO-d6): δ 7.34 (s, 1H), 7.17-7.07 (m, 4H), 6.61 (s, 1H), 5.89 (d, J=6,0 Гц, 1H), 4.49-4.46 (m, 1H), 4.25 (t, J=2,8 Гц, 2H), 3.68 (s, 3Н), 3.62 (bs, 2Н), 3.29 (s, 2Н), 2.15 (s, 3Н), 1.40-1.33 (m, 4Н), 1.20-1.10 (m, 4Н), 0.78-0.72 (m, 6Н). ЖХ-МС: (Метод Е) 540,2 (М++Н), Rt: 2,90 мин, 94,13% (макс.).
Промежуточное соединение 20
Метил-3-((3-бутил-3-этил-5-(4-фторфенил)-7-(мети лтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-метоксипропаноат

К перемешиваемому раствору метил-3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропаноата (Промежуточное соединение 19; 100 мг, 0,18 ммоль) в DMF (2 мл) при 0°С добавляли гидрид натрия (60%, 3,71 мг, 0,09 ммоль) и реакционную смесь перемешивали в течение 15 минут при комнатной температуре. Затем добавляли по каплям раствор метилйодида (0,04 мл, 0,55 ммоль) в DMF (1 мл) и реакционную смесь перемешивали в течение 1 часа при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь гасили разбавленной HCl (1,5 н., 1 мл) и разбавляли водой (1 мл). Водный слой экстрагировали EtOAc (2×10 мл). Объединенный органический слой промывали водой (10 мл) и рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 20-30% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 57% (60 мг, белое твердое вещество).
1Н ЯМР (400 МГц, DMSO-d6): δ 7.32 (s, 1H), 7.07 (d, J=6,80 Гц, 4Н), 6.60 (s, 1H), 4.38-4.27 (m, 3Н), 3.70 (s, 3Н), 3.68 (s, 2Н), 3.41 (s, 3Н), 3.28 (s, 2Н), 2.15 (s, 3Н), 1.37-1.32 (m, 4Н), 1.16-1.09 (m, 4Н), 0.77-0.72 (m, 6Н). ЖХ-МС: (Метод Е) 554,3 (М++Н), Rt: 3,01 мин, 98,12% (макс.).
Промежуточное соединение 21
7-Бром-3,3-дибутил-5-(4-фторфенил)-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5Н)-он и 3,3-дибутил-5-(4-фторфенил)-7-йод-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5Н)-он

К перемешиваемому раствору 7-бром-3,3-дибутил-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5Н)-она (3 г, 7,49 ммоль) в 4-фторйодбензоле (30 мл) добавляли йодид меди(I) (0,14 г, 0,74 ммоль) и K2CO3 (2,07 г, 14,9 ммоль) и этот раствор продували азотом в течение 20 минут для дегазирования. Затем добавляли трис[2-(2-метоксиэтокси)этил]амин (0,49 г, 1,49 ммоль) в атмосфере азота и полученную реакционную смесь нагревали в течение 16 часов при 135°С. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь фильтровали через целит и эту набивку целита промывали EtOAc (25 мл). Фильтрат промывали водой (15 мл) и рассолом (15 мл) и сушили над безводным Na2SO4. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 20% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 95% (3,5 г, бледно-желтое твердое вещество).
ЖХ-МС: (Метод Е) 494,0 (М+) для 7-бромзамещенного соединения и 541,9 (М++Н) для 7-йодзамещенного соединения, Rt: 3,50 мин, 96,61% (макс.).
Промежуточное соединение 22
7-Бром-3,3-дибутил-5-(4-фторфенил)-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепин и 3,3-дибутил-5-(4-фторфенил)-7-йод-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепин

К перемешиваемому раствору смеси 7-бром-3,3-дибутил-5-(4-фторфенил)-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5Н)-она и 3,3-дибутил-5-(4-фторфенил)-7-йод-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5Н)-она (Промежуточное соединение 21; 3,5 г, 7,07 ммоль) в THF (35 мл) при 0°С добавляли по каплям диметилсульфид борана (2 М в THF; 5,3 мл, 10,61 ммоль) и реакционную смесь кипятили с обратным холодильником в течение 16 часов при 65°С.После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь охлаждали до 0°С, гасили метанолом (10 мл) и нагревали в течение 2 часов при 65°С.Полученную реакционную смесь затем охлаждали до комнатной температуры, концентрировали в вакууме и остаток распределяли между водой (50 мл) и EtOAc (50 мл). Водный слой экстрагировали DCM (2×50 мл) и объединенный органический слой промывали водой (25 мл) и рассолом (25 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме с получением неочищенного вещества. Полученное неочищенное вещество переносили в том виде, как оно получено, на следующую стадию без какой-либо дополнительной очистки. Выход: 3,6 г (неочищенное, светло-желтая смола).
ЖХ-МС: (Метод Е) 482,0 (М++2Н) для 7-бромзамещенного соединения и 527,9 (М++Н) для 7-йодзамещенного соединения, Rt: 3,86 мин, 81,04% (объединенный для указанных бром- и йодзамещенных соединений) (макс.).
Промежуточное соединение 23
1,1-Диоксид 7-бром-3,3-дибутил-5-(4-фторфенил)-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепина и 1,1-диоксид 3,3-дибутил-5-(4-фторфенил)-7-йод-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепина

К перемешиваемому раствору смеси 7-бром-3,3-дибутил-5-(4-фторфенил)-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепина и 3,3-дибутил-5-(4-фторфенил)-7-йод-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепина (Промежуточное соединение 22; 3,6 г, 7,49 ммоль) в уксусной кислоте (36 мл) добавляли при 0°С вольфрамат натрия (360 мг, 0,01 ммоль) и пероксид водорода (30% в H2O; 2,6 мл, 22,47 ммоль) и полученную реакционную смесь перемешивали в течение 16 часов при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь фильтровали через воронку Бюхнера и фильтрат экстрагировали EtOAc (2×50 мл). Объединенный органический слой промывали водой (25 мл) и рассолом (25 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 12% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 79% (3,4 г, не совсем белое твердое вещество).
ЖХ-МС: ((Метод А) 512,2 (М++Н) для 7-бромзамещенного соединения и 560,2 (М++Н) для 7-йодзамещенного соединения; Rt: 3,40 мин, 70,63% (макс.).
Промежуточное соединение 24
1,1-Диоксид 3,3-дибутил-5-(4-фторфенил)-8-гидрокси-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепина

К перемешиваемому раствору смеси 1,1-диоксида 7-бром-3,3-дибутил-5-(4-фторфенил)-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепина и 1,1-диоксида 3,3-дибутил-5-(4-фторфенил)-7-йод-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепина (Промежуточное соединение 23; 1,6 г, 3,12 ммоль) в DMF (16 мл) добавляли при комнатной температуре тиометоксид натрия (1,09 г, 15,6 ммоль) и реакционную смесь перемешивали в течение 16 часов при 65°С.После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь охлаждали до комнатной температуры и затем гасили водой (15 мл). Водный слой экстрагировали EtOAc (2×25 мл) и объединенный органический слой промывали рассолом (10 мл). Органическую часть сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 30% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 90% (1,3 г, не совсем белое твердое вещество).
1Н ЯМР (400 МГц, DMSO-d6): δ 10.48 (s, 1H), 7.28 (d, J=4,4 Гц, 1Н), 7.08-7.01 (m, 4H), 6.59 (s, 1H), 3.80-3.67 (m, 2H), 3.22 (s, 2H), 2.16 (s, 3Н), 1.36-1.33 (m, 4H), 1.12-1.03 (m, 8H), 0.79-0.77 (m, 6H). ЖХ-МС: (Метод Е) 466,0 (М++Н), Rt: 3,23 мин, 88,86% (макс.).
Промежуточное соединение 25
Метил-3-((3,3-дибутил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропаноат
К перемешиваемому раствору 1,1-диоксида 3,3-дибутил-5-(4-фторфенил)-8-гидрокси-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепина (Промежуточное соединение 24; 400 мг, 0,8602 ммоль) в DMF (4 мл) добавляли Cs2CO3 (560 мг, 1,72 ммоль) и реакционную смесь перемешивали в течение 15 минут при комнатной температуре. Затем добавляли по каплям метил-оксиран-2-карбоксилат (0,2 мл, 2,58 ммоль) и реакционную смесь перемешивали в течение 16 часов при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь гасили разбавленной HCl (1,5 н., 5 мл) и водный слой экстрагировали EtOAc (2×5 мл). Объединенный органический слой промывали водой (5 мл) и рассолом (5 мл) и сушили над безводным Na2SO4. Органическую часть фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 20-30% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 44% (215 мг, бесцветная смола).
ЖХ-МС: (Метод Е) 568,1 (М++Н), Rt: 3,18 мин, 93,04% (макс.).
Промежуточное соединение 26
Метил-3-((3,3-дибутил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-метоксипропаноат
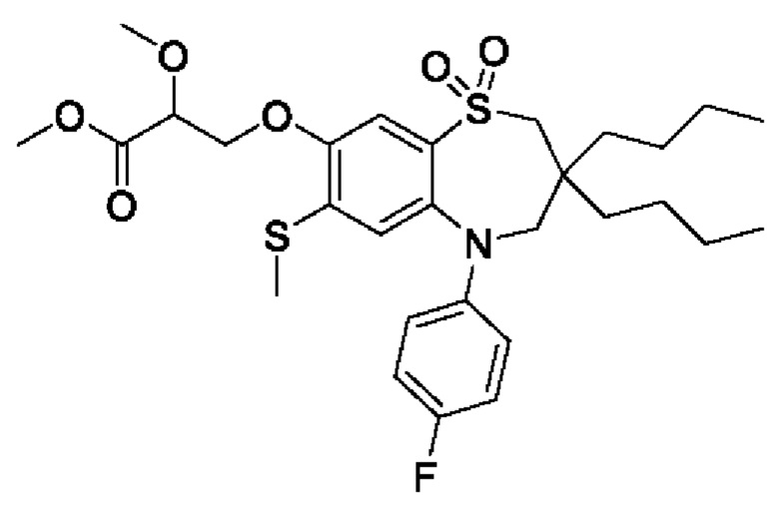
К перемешиваемому раствору метил-3-((3,3-дибутил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропаноата (Промежуточное соединение 25; 125 мг, 0,22 ммоль) в DMF (2,5 мл) при 0°С добавляли гидрид натрия (60%, 8,80 мг, 0,22 ммоль) и реакционную смесь перемешивали в течение 5 минут.Затем добавляли метилйодид (0,08 мл, 1,32 ммоль) и реакционную смесь перемешивали в течение 1 часа при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь гасили разбавленной HCl (1,5 н., 5 мл) и водный слой экстрагировали EtOAc (2×10 мл). Объединенный органический слой промывали водой (10 мл) и рассолом (10 мл) и сушили над безводным Na2SO4. Органическую часть фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 20-30% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 38% (50 мг, белое твердое вещество).
ЖХ-МС: (Метод Е) 582,2 (М++Н), Rt: 3,29 мин, 97,76% (макс.).
Промежуточное соединение 27
Метил-3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропаноат
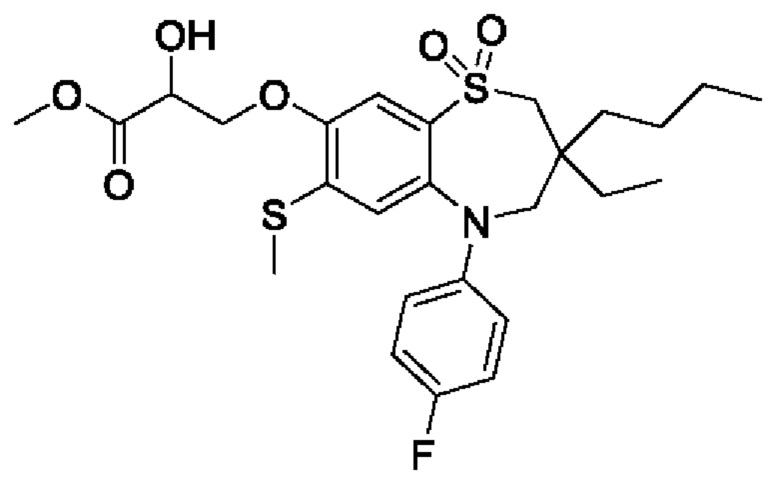
К раствору 1,1-диоксида 3-бутил-3-этил-5-(4-фторфенил)-8-гидрокси-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепина (Промежуточное соединение 14; 750 мг, 1,71 ммоль) в DMF (10 мл) добавляли Cs2CO3 (1,11 г, 3,42 ммоль) и метил-оксиран-2-карбоксилат (0,52 г, 5,14 ммоль) и реакционную смесь перемешивали в течение 12 часов при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь гасили водой (10 мл) и водный слой экстрагировали EtOAc (2×15 мл). Объединенный органический слой промывали водой (15 мл) и рассолом (15 мл) и сушили над безводным Na2SO4. Органическую часть фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 45% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 50% (300 мг, бесцветная смола).
ЖХ-МС: (Метод Е) 540,2 (М++Н), Rt: 2,90 мин, 94,11% (макс.).
Промежуточное соединение 28
Метил-3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-этоксипропаноат

К суспензии NaH (60%, 21 мг, 0,55 ммоль) в безводном DMF (2 мл) при 0°С добавляли раствор метил-3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропаноата (Промежуточное соединение 27; 300 мг, 0,55 ммоль) в DMF (5 мл) и реакционную смесь перемешивали в течение 5 минут.Затем добавляли этилйодид (260 мг, 1,67 ммоль) и реакционную смесь перемешивали в течение 3 часов при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь гасили разбавленной HCl (1,5 н., 5 мл) при 0°С и водный слой экстрагировали EtOAc (2×10 мл). Объединенный органический слой промывали водой (15 мл) и рассолом (15 мл) и сушили над безводным Na2SO4. Органическую часть фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 25% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 31% (98 мг, бесцветная смола).
ЖХ-МС: (Метод Е) 568,3 (М++Н), Rt: 3,09 мин, 65,63% (макс.).
Промежуточное соединение 29
Метил-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропаноат

К раствору 1,1-диоксида 3,3-дибутил-8-гидрокси-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепина (1,5 г, 3,35 ммоль) в DMF (10 мл) добавляли Cs2CO3 (2,18 г, 6,70 ммоль) и метил-оксиран-2-карбоксилат (1,02 г, 10,05 ммоль) и реакционную смесь перемешивали в течение 12 часов при КТ. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь гасили водой (50 мл) и водный слой экстрагировали EtOAc (2×30 мл). Объединенный органический слой промывали водой (50 мл) и рассолом (50 мл) и сушили над безводным Na2SO4. Органическую часть фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 45% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 45% (600 мг, бесцветная смола).
ЖХ-МС: (Метод Е) 550,1 (М++Н), Rt: 3,20 мин, 98,81% (макс.).
Промежуточное соединение 30
Метил-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-этоксипропаноат
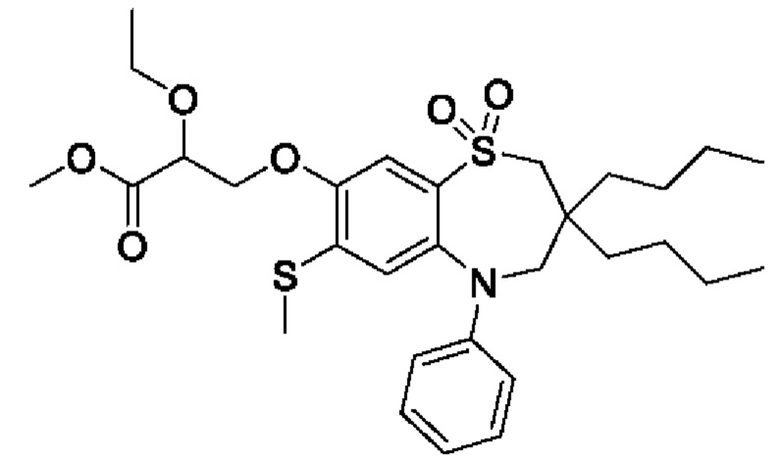
К суспензии NaH (60%, 35 мг, 0,55 ммоль) в безводном DMF (3 мл) при 0°С добавляли раствор метил-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропаноата (Промежуточное соединение 29; 500 мг, 0,91 ммоль) в DMF (7 мл) и реакционную смесь перемешивали в течение 10 минут.Затем добавляли этилйодид (426 мг, 2,73 ммоль) и реакционную смесь перемешивали в течение 3 часов при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь гасили разбавленной HCl (1,5 н., 10 мл) при 0°С и водный слой экстрагировали EtOAc (2×15 мл). Объединенный органический слой промывали водой (20 мл) и рассолом (20 мл) и сушили над безводным Na2SO4. Органическую часть фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 25% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 30% (300 мг, бесцветная смола).
ЖХ-МС: (Метод Е) 578,3 (М++Н), Rt: 3,28 мин, 71,90% (макс.).
Промежуточное соединение 31
7-Бром-3,3-диэтил-5-(4-фторфенил)-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5Н)-он

К перемешиваемому раствору 7-бром-3,3-диэтил-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5Н)-она (20 г, 0,06 моль) в 4-бромфторбензоле (200 мл) добавляли йодид меди(I) (1,10 г, 0,006 моль) и K2CO3 (16,05 г, 0,12 моль) и реакционную смесь продували азотом в течение 20 минут для дегазифицирования. Затем добавляли в атмосфере азота трис[2-(2-метоксиэтокси)этил]амин (3,75 г, 0,01 моль) и полученную реакционную смесь нагревали в течение 3 суток при 135°С. После завершения взаимодействия (контролируется посредством ТСХ и УЭЖХ) реакционную смесь фильтровали через целит и эту набивку целита промывали EtOAc (100 мл). Фильтрат концентрировали в вакууме и полученный остаток распределяли между водой (100 мл) и EtOAc (50 мл). Водный слой экстрагировали EtOAc (2×100 мл) и объединенный органический слой промывали водой (70 мл) и рассолом (70 мл). Органическую часть сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 2-4% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 70% (18,0 г, белое твердое вещество).
1Н ЯМР (400 МГц, DMSO-d6): δ 7.36 (s, 1H), 7.22-7.14 (m, 5Н), 3.90 (s, 3Н), 3.15 (s, 2Н), 1.50-1.45 (m, 4Н), 0.78 (t, J=9,6 Гц, 6Н). ЖХ-МС: (Метод Е) 440,1 (М++2), Rt: 2,97 мин, 96,42% (макс.). ВЭЖХ: (Метод Е) Rt: 5,97 мин, 94,16% (макс.).
Промежуточное соединение 32
7-Бром-3,3-диэтил-5-(4-фторфенил)-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепин

К перемешиваемому раствору 7-бром-3,3-диэтил-5-(4-фторфенил)-8-метокси-2,3-дигидро-1,5-бензотиазепин-4(5Н)-она (Промежуточное соединение 31; 18,0 г, 0,04 моль) в THF (90 мл) при 0°С добавляли по каплям диметилсульфид борана (2М в THF, 102 мл, 0,21 моль) и реакционную смесь кипятили с обратным холодильником в течение 48 часов при 70°С. После завершения взаимодействия (контролируется посредством УЭЖХ) реакционную смесь охлаждали до 0°С и гасили метанолом (50 мл). Полученный раствор нагревали в течение 2 часов при 70°С и затем охлаждали до комнатной температуры и концентрировали в вакууме. Полученный остаток распределяли между водой (100 мл) и EtOAc (50 мл) и водный слой экстрагировали EtOAc (2×100 мл). Объединенный органический слой промывали водой (70 мл) и рассолом (70 мл) и сушили над безводным Na2SO4. Органическую часть концентрировали в вакууме и полученное неочищенное вещество переносили на следующую стадию без какой-либо дополнительной очистки. Выход: 21 г (неочищенное белое твердое вещество).
1Н ЯМР (400 МГц, DMSO-d6): δ 7.12-6.95 (m, 5Н), 6.88 (s, 1Н), 3.81 (s, 3Н), 3.70-3.45 (m, 2H), 2.78 (s, 2H), 1.45-1.18 (m, 4H), 0.70 (t, J=7,6 Гц, 6H). ЖХ-МС: (Метод Е) 424,9 (М++2), Rt: 3,44 мин, 86,38% (макс.). ВЭЖХ: (Метод Е) Rt: 6,97 мин, 94,07% (макс.).
Промежуточное соединение 33
1,1-Диоксид 7-бром-3,3-диэтил-5-(4-фторфенил)-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепина
К перемешиваемому раствору 7-бром-3,3-диэтил-5-(4-фторфенил)-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепина (Промежуточное соединение 32; 21,0 г, 0,05 моль) в THF (147 мл) добавляли при 0°С воду (63 мл), оксон (152,1 г, 0,49 моль) и реакционную смесь перемешивали в течение 48 часов при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь фильтровали. Фильтрат разбавляли водой (100 мл) и водный слой экстрагировали EtOAc (2×100 мл). Объединенный органический слой промывали водой (70 мл) и рассолом (70 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 10% MeOH/DCM; силикагель: 230-400 меш) и полученный продукт растирали с петролейным эфиром (2×100 мл) с получением указанного в заголовке соединения. Выход: 93% (21,0 г, коричневое твердое вещество).
1Н ЯМР (400 МГц, DMSO-d6): δ 7.44 (s, 1H), 7.25-7.02 (m, 5Н), 3.92 (s, 3Н), 3.66 (s, 2Н), 3.33 (s, 2Н), 1.60-1.42 (m, 2Н), 1.42-1.28 (m, 2Н), 0.71 (t, J=9,6 Гц, 6Н). ЖХ-МС: (Метод Е) 458,1 (М++2), Rt: 2,94 мин, 95,31% (макс.).
Промежуточное соединение 34
1,1-Диоксид 3,3-диэтил-5-(4-фторфенил)-8-гидрокси-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепина

К перемешиваемому раствору 1,1-диоксида 7-бром-3,3-диэтил-5-(4-фторфенил)-8-метокси-2,3,4,5-тетрагидро-1,5-бензотиазепина (Промежуточное соединение 33; 10,0 г, 0,02 моль) в DMF (100 мл) добавляли тиометоксид натрия (7,67 г, 0,11 моль) при комнатной температуре и полученную смесь перемешивали в течение 16 часов при 70°С. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь гасили водой (100 мл) и водный слой экстрагировали EtOAc (2×100 мл). Объединенный органический слой промывали рассолом (50 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 36-50% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 88% (7,90 г, не совсем белое твердое вещество).
1Н ЯМР (400 МГц, DMSO-d6): δ 10.54 (s, 1H), 7.30 (s, 1H), 7.09-6.99 (m, 2Н), 6.99-6.91 (m, 2Н), 6.64 (s, 1H), 3.72-3.50 (m, 2Н), 3.25-3.18 (m, 2Н), 2.18 (s, 3Н), 1.65-1.46 (m, 2Н), 1.43-1.25 (m, 2Н), 0.74 (t, J=7,20 Гц, 6Н). ЖХ-МС: (Метод I) 410,0 (М++Н), Rt: 2,46 мин, 92,37% (макс.). ВЭЖХ: (Метод Е) Rt: 5,33 мин, 94,90% (макс.).
Промежуточное соединение 35
Метил-3-((3,3-диэтил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2,2-диметилпропаноат

К перемешиваемому раствору 1,1-диоксида 3,3-диэтил-5-(4-фторфенил)-8-гидрокси-7-(метилтио)-2,3,4,5-тетрагидро-1,5-бензотиазепина (Промежуточное соединение 35; 300 мг, 0,73 ммоль) в THF (10 мл) добавляли метил-3-гидрокси-2,2-диметилпропаноат (96 мг, 0,73 ммоль), трифенилфосфин (288 мг, 1,09 ммоль) и DBAD (336 мг, 1,46 ммоль) и реакционную смесь перемешивали в течение 16 часов при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь разбавляли водой (10 мл) и водный слой экстрагировали EtOAc (2×20 мл). Объединенный органический слой промывали водой (25 мл) и рассолом (25 мл) и сушили над безводным Na2SO4. Органическую часть фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 10-20% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 78% (300 мг, белая смола).
ЖХ-МС: (Метод Е) 524,0 (М++Н), Rt: 3,17 мин, 93,5% (макс.).
Промежуточное соединение 36
Метил-2-гидрокси-3-((7-(метилтио)-1,1-диоксидо-5-фенил-3,3-дипропил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)пропаноат

К перемешиваемому раствору 1,1-диоксида 8-гидрокси-7-(метилтио)-5-фенил-3,3-дипропил-2,3,4,5-тетрагидро-1,5-бензотиазепина (500 мг, 1,19 ммоль) в DMF (10 мл) добавляли Cs2CO3 (777 мг, 2,38 ммоль) и метил-оксиран-2-карбоксилат (365 мг, 3,57 ммоль) и реакционную смесь перемешивали в течение 4 суток при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ; приблизительно 50% превращение) реакционную смесь гасили разбавленной HCl (1,5 н., 10 мл) и водный слой экстрагировали этилацетатом (2×10 мл). Объединенный органический слой сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 30-40% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 24% (150 мг, желтая смола).
ЖХ-МС: (Метод K) 521,9 (М++Н), Rt: 3,03 мин, 95,10% (макс.).
Пример 1
3-((3-Бутил-5-(4-фторфенил)-3-метил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропановая кислота
(индивидуальные диастереомеры)
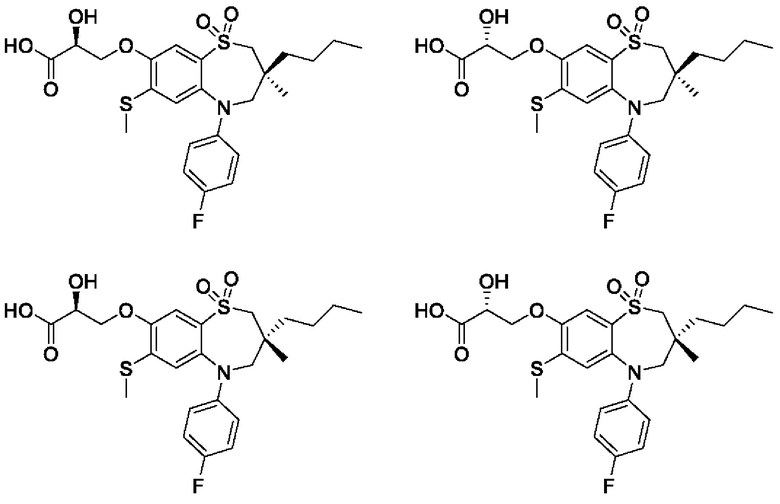
Диастереомер 1
К перемешиваемому раствору диастереомера 1 метил-3-((3-бутил-5-(4-фторфенил)-3-метил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропаноата (Промежуточное соединение 7; 80 мг, 0,15 ммоль) в 1,4-диоксане (1 мл) добавляли водн. HCl (6 н., 3 мл) и реакционную смесь нагревали при 80°С в течение 16 часов. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь разбавляли водой (5 мл) и водный слой экстрагировали EtOAc (2×20 мл). Объединенный органический слой промывали водой (5 мл) и рассолом (5 мл) и сушили над безводным Na2SO4. Органическую часть фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 10-20% MeOH/DCM; силикагель: 230-400 меш) с получением указанного в заголовке соединения.
Диастереомеры 2, 3 и 4 указанного в заголовке соединения получали согласно той же методике, начиная с 80-85 мг диастереомеров 2, 3 и 4 Промежуточного соединения 7, соответственно.
Диастереомер 1: Выход: 32% (25 мг, белое твердое вещество). 1Н ЯМР (400 МГц, DMSO-d6): δ 7.36 (s, 1Н), 7.07-6.99 (m, 4Н), 6.73 (s, 1H), 4.33 (d, J=6,8 Гц, 1H), 4.12 (s, 2Н), 3.69-3.52 (m, 2Н), 3.31-3.22 (m, 2Н), 2.20 (s, 3Н), 1.55-1.38 (m, 1H), 1.30-1.10 (m, 5Н), 0.99 (s, 3Н), 0.76 (t, J=8,4 Гц, 3Н). ЖХ-МС: (Метод Е) 512,0 (М++Н), Rt: 2,83 мин, 98,75% (макс.). ВЭЖХ: (Метод В) Rt: 5,10 мин, 98,25% (макс.). Хиральная СФХ: (Метод G) Rt: 2,59 мин, 99,42% (макс.).
Диастереомер 2: Выход: 32% (25 мг, белое твердое вещество). 1Н ЯМР (400 МГц, DMSO-d6): δ 7.35 (s, 1H), 7.06-6.98 (m, 4Н), 6.72 (s, 1H), 4.35 (d, J=9,2 Гц, 1H), 4.07-4.04 (m, 2Н), 3.62 (m, 2Н), 3.21 (m, 2Н), 2.20 (s, 3Н), 1.55-1.39 (m, 1Н), 1.35-1.05 (m, 5Н), 1.03 (s, 3Н), 0.79 (t, J=8,4 Гц, 3Н). ЖХ-МС: (Метод Е) 512,0 (М++Н), Rt: 2,82 мин, 99,25% (макс.). ВЭЖХ: (Метод В) Rt: 5,11 мин, 98,71% (макс.). Хиральная СФХ: (Метод G) Rt: 4,19 мин, 99,14% (макс.).
Диастереомер 3: Выход: 49% (40 мг, не совсем белое твердое вещество). 1Н ЯМР (400 МГц, DMSO-d6): δ 7.36 (s, 1H), 7.07-6.98 (m, 4Н), 6.72 (s, 1H), 4.33-4.30 (m, 1H), 4.21-4.15 (m, 2Н), 3.88-3.44 (m, 2Н), 3.22 (s, 2Н), 2.20 (s, 3Н), 1.46-1.33 (m, 1H), 1.32-1.10 (m, 5Н), 1.04 (s, 3Н), 0.80 (t, J=7,2 Гц, 3Н). ЖХ-МС: (Метод Е) 512,0 (М++Н), Rt: 2,83 мин, 98,66% (макс.). ВЭЖХ: (Метод В) Rt: 5,10 мин, 98,19% (макс.). Хиральная СФХ: (Метод G) Rt: 2,50 мин, 99,54% (макс.).
Диастереомер 4: Выход: 52% (40 мг, не совсем белое твердое вещество). 1Н ЯМР (400 МГц, DMSO-d6): δ 7.36 (s, 1H), 7.07-6.98 (m, 4H), 6.73 (s, 1H), 4.33 (d, J=8,4 Гц, 1H), 4.17-4.11 (m, 2H), 3.90-3.45 (m, 2H), 3.33-3.30 (m, 2H), 2.20 (s, 3Н), 1.58-1.39 (m, 1H), 1.33-1.08 (m, 5H), 1.00 (s, 3H), 0.80 (t, J=7,2 Гц, 3Н). ЖХ-МС: (Метод Н) 512,2 (М++Н), Rt: 2,06 мин, 96,13% (макс.). ВЭЖХ: (Метод В) Rt: 5,10 мин, 96,16% (макс.). Хиральная СФХ: (Метод G) Rt: 3,88 мин, 99,19% (макс.).
Абсолютная конфигурация этих четырех диастереомеров не известна.
Пример 2
1-(((3-Бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)метил)циклопропан-1-карбоновая кислота
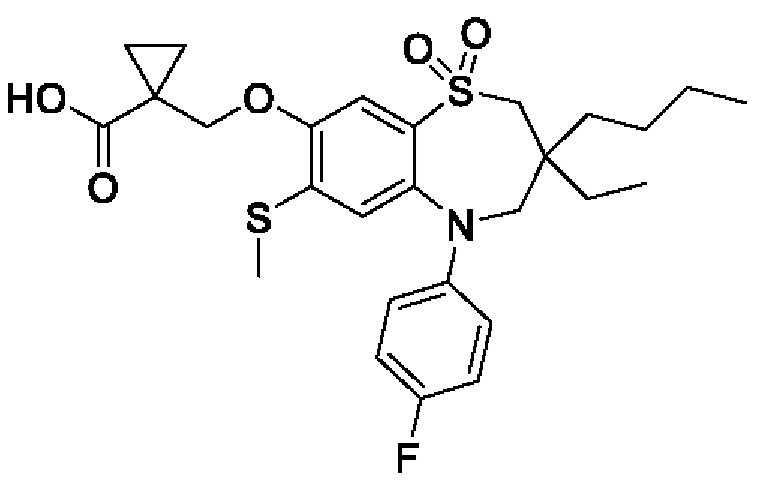
К перемешиваемому раствору этил-1-(((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)метил)-циклопропан-1-карбоксилата (Промежуточное соединение 15; 240 мг, 0,42 ммоль) в смеси 1,4-диоксана и воды (7:3, 10 мл) добавляли гидроксид лития (36 мг, 0,85 ммоль) и реакционную смесь перемешивали в течение 1 часа при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь подкисляли разбавленной HCl (1,5 н., рН примерно 4) и разбавляли охлажденной на льду водой (2 мл). Водный слой экстрагировали EtOAc (2×10 мл) и объединенный органический слой промывали водой (10 мл) и рассолом (10 мл). Органическую часть сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Полученное неочищенное вещество растирали с гексаном, затем фильтровали с получением указанного в заголовке соединения. Выход: 22% (50 мг, белое твердое вещество).
1Н ЯМР (400 МГц, DMSO-d6): δ 12.42 (s, 1H), 7.27 (s, 1H), 7.05-7.07 (m, 4H), 6.63 (s, 1H), 4.19 (s, 2H), 3.84-3.54 (bs, 2H), 3.27 (s, 2H), 2.16 (s, 3Н), 1.59-1.36 (m, 4H), 1.35-0.98 (m, 8H), 0.79-0.69 (m, 6H). ЖХ-МС: (Метод Е) 536,2 (М++Н), Rt: 2,92 мин, 98,33% (макс.). ВЭЖХ: (Метод В) Rt: 5,91 мин, 96,58% (макс.).
Пример 3
(S)-1-(((3-Бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)метил)циклопропан-1-карбоновая кислота и (R)-1-(((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)метил)циклопропан-1-карбоновая кислота

Эти два энантиомера рацемической 1-(((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)метил)-циклопропан-1-карбоновой кислоты (Пример 2; 40 мг, 0,074 ммоль) разделяли посредством хиральной СФХ (Метод О). Материал концентрировали в вакууме при 40°С. Первая элюирующаяся фракция соответствовала энантиомеру 1, и вторая элюирующаяся фракция соответствовала энантиомеру 2. Абсолютная конфигурация этих двух энантиомеров не известна.
Энантиомер 1: Выход: 32% (13 мг, не совсем белое твердое вещество). 1H ЯМР (400 МГц, DMSO-d6): δ 12.40 (s, 1H), 7.28 (s, 1H), 7.06 (d, J=8,0 Гц, 4Н), 6.63 (s, 1H), 4.19 (s, 2Н), 3.65 (bs, 2Н), 3.27 (s, 2Н), 2.15 (s, 3Н), 1.45-1.35 (m, 4Н), 1.24-1.19 (m, 3Н), 1.11-1.07 (m, 5Н), 0.82-0.68 (m, 6Н). ЖХ-МС: (Метод Е) 536,2 (М++Н), Rt: 2,91 мин, 97,46% (макс.). ВЭЖХ: (Метод Е) Rt: 5,99 мин, 96,04% (макс.). Хиральная СФХ: (Метод О) Rt: 2,74 мин, 97,81% (макс.).
Энантиомер 2: Выход: 10% (4 мг, не совсем белое твердое вещество). 1Н ЯМР (400 МГц, DMSO-d6): δ 12.41 (s, 1H), 7.28 (s, 1H), 7.06 (d, J=8,4 Гц, 4Н), 6.63 (s, 1H), 4.19 (s, 2Н), 3.66 (bs, 2Н), 3.32 (s, 2Н), 2.16 (s, 3Н), 1.51-1.36 (m, 4Н), 1.31-1.24 (m, 3Н), 1.11-1.07 (m, 6Н), 0.80-0.70 (m, 6Н). ЖХ-МС: (Метод Е) 536,1 (М++Н), Rt: 3,07 мин, 95,83% (макс.). ВЭЖХ: (Метод Е) Rt: 5,995 мин, 95,29% (макс.). Хиральная СФХ: (Метод О) Rt: 3,70 мин, 99,39% (макс.).
Пример 4
3-((3-Бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2,2-диметилпропановая кислота

К перемешиваемому раствору метил-3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2,2-диметил-пропаноата (Промежуточное соединение 16; 300 мг, 0,54 ммоль) в смеси 1,4-диоксана и воды (7:3, 10 мл) добавляли гидроксид лития (45 мг, 1,0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь подкисляли разбавленной HCl (1,5 н., рН примерно 4) и разбавляли охлажденной на льду водой (2 мл). Водный слой экстрагировали EtOAc (2×5 мл) и объединенный органический слой промывали водой (5 мл) и рассолом (5 мл). Органическую часть сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 9% MeOH/DCM; силикагель: 230-400 меш) и полученный остаток снова очищали посредством преп.ВЭЖХ (Метод А) с получением указанного в заголовке соединения. Выход: 41% (130 мг, белое твердое вещество).
1Н ЯМР (400 МГц, DMSO-d6): δ 12.43 (s, 1Н), 7.27 (s, 1H), 7.07-7.05 (m, 4Н), 6.26 (s, 1Н), 4.05 (s, 2H), 3.67 (bs, 2H), 3.34-3.28 (m, 2H), 2.15 (s, 3Н), 1.50-1.34 (m, 4H), 1.25 (s, 6H), 1.22-1.04 (m, 4H), 0.78-0.72 (m, 6H). ЖХ-МС: (Метод Е) 538,1 (М++Н), Rt: 3,13 мин, 97,56% (макс.). ВЭЖХ: (Метод В) Rt: 6,04 мин, 96,19% (макс.).
Пример 5
(S)-3-((3-Бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2,2-диметилпропановая кислота и (R)-3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2,2-диметилпропановая кислота
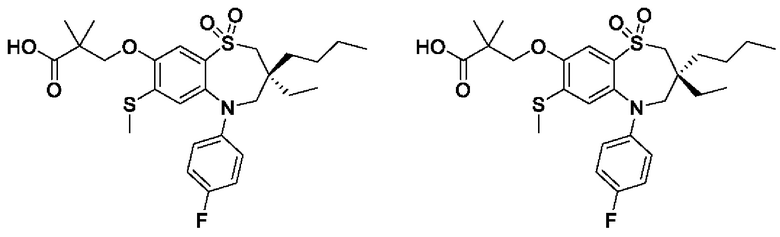
Эти два энантиомера рацемической 3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2,2-диметил-пропановой кислоты (Пример 4; 100 мг, 0,18 ммоль) разделяли посредством СФХ (Метод Н). Материал концентрировали в вакууме при 40°С. Первая элюирующаяся фракция соответствовала энантиомеру 1, и вторая элюирующаяся фракция соответствовала энантиомеру 2. Абсолютная конфигурация этих двух энантиомеров не известна.
Энантиомер 1: Выход: 33% (33 мг, белое твердое вещество). 1Н ЯМР (400 МГц, DMSO-d6): δ 12.43 (s, 1H), 7.27 (s, 1H), 7.07 (t, J=8,00 Гц, 4Н), 6.63 (s, 1H), 4.06 (s, 2Н), 3.66 (s, 2Н), 3.28 (s, 2Н), 2.16 (s, 3Н), 1.31-1.33 (m, 10Н), 1.02-1.04 (m, 4Н), 0.73-0.75 (m, 6Н). ЖХ-МС: (Метод Н) 538,5 (М++Н), Rt: 2,33 мин, 96,81% (макс.). ВЭЖХ: (Метод В) Rt: 6,05 мин, 95,30% (макс.). Хиральная СФХ: (Метод Н) Rt: 3,35 мин, 99,93% (макс.).
Энантиомер 2: Выход: 26% (26 мг, белое твердое вещество). 1Н ЯМР (400 МГц, DMSO-d6): δ 12.40 (s, 1H), 7.27 (s, 1H), 7.05-7.07 (m, 4Н), 6.63 (s, 1H), 4.06 (s, 1H), 3.65 (s, 2Н), 3.28 (s, 2Н), 2.16 (s, 3Н), 1.31-1.33 (m, 11Н), 1.02-1.04 (m, 4Н), 0.73-0.75 (m, 6Н). ЖХ-МС: (Метод Н) 538,5 (М++Н), Rt: 2,33 мин, 97,41% (макс.). ВЭЖХ: (Метод В) Rt: 6,02 мин, 95,58% (макс.). Хиральная СФХ: (Метод Н) Rt: 2,74 мин, 99,96% (макс.).
Пример 6
3-((3,3-Диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фтор-2-метилпропановая кислота

К перемешиваемому раствору 1,1-диоксида 3,3-диэтил-8-(2-гидрокси-2-метоксипропокси)-7-(метилтио)-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепина (Промежуточное соединение 18; 30 мг, 0,05 ммоль) в смеси 1,4-диоксана и воды (2:3, 5 мл) добавляли гидроксид лития (4,9 мг, 0,11 ммоль) и реакционную смесь перемешивали в течение 1 часа при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь подкисляли разбавленной HCl (1,5 н., рН примерно 4) и разбавляли охлажденной на льду водой (2 мл). Водный слой экстрагировали EtOAc (2×5 мл) и объединенный органический слой промывали водой (5 мл) и рассолом (5 мл). Органическую часть сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 9% MeOH/DCM; силикагель: 230-400 меш) и полученный остаток снова очищали посредством преп.ВЭЖХ (Метод А) с получением указанного в заголовке соединения. Выход: 68% (20 мг, белое твердое вещество).
1Н ЯМР (400 МГц, DMSO-d6): 13.53 (bs, 1Н), 7.35 (s, 1Н), 7.22 (t, J=8,4 Гц, 2Н), 6.99 (d, J=7,2 Гц, 2Н), 6.84 (t, J=7,6 Гц, 1H), 6.72 (s, 1H), 4.49-4.38 (m, 2Н), 3.70 (s, 2Н), 3.26 (s, 2Н), 2.17 (s, 3Н), 1.62-1.57 (m, 5Н), 1.37-1.32 (m, 2Н), 0.75 (t, J=7,2 Гц, 6Н). ЖХ-МС: (Метод Е) 496,0 (М++Н), Rt: 2,84 мин, 99,03% (макс.). ВЭЖХ: (Метод В) Rt: 5,25 мин, 97,49% (макс.).
Пример 7
(S)-3-((3,3-Диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фтор-2-метилпропановая кислота и (R)-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фтор-2-метилпропановая кислота

Энантиомер 1
К перемешиваемому раствору энантиомера 1 метил 3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фтор-2-метилпропаноата (Промежуточное соединение 18; 30 мг, 0,07 ммоль) в смеси 1,4-диоксана и воды (2:3, 5 мл) добавляли гидроксид лития (5 мг, 0,11 ммоль) и реакционную смесь перемешивали в течение 1 часа при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь подкисляли разбавленной HCl (1,5 н., рН примерно 4) и разбавляли охлажденной на льду водой (2 мл). Водный слой экстрагировали EtOAc (2×5 мл) и объединенный органический слой промывали водой (5 мл) и рассолом (5 мл). Органическую часть сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 9% МеОН DCM; силикагель: 230-400 меш) с получением указанного в заголовке соединения.
Энантиомер 2 указанного в заголовке соединения получали согласно той же методике, начиная с 30 мг энантиомера 2
Промежуточного соединения 18.
Энантиомер 1: Выход: 77% (22 мг, белое твердое вещество). 1Н ЯМР (400 МГц, DMSO-d6): 13.54 (bs, 1H), 7.36 (s, 1H), 7.22 (dd, J=7,2, 8,8 Гц, 2Н), 6.96 (d, J=7,2 Гц, 2Н), 6.84 (t, J=7,2 Гц, 1H), 6.72 (s, 1Н), 4.47-4.38 (m, 2Н), 3.67 (s, 2Н), 3.26 (s, 2Н), 2.17 (s, 3Н), 1.62-1.57 (m, 5Н), 1.37-1.32 (m, 2Н), 0.75 (t, J=7,2 Гц, 6Н). ЖХ-МС: (Метод Е) 496,2 (М++Н), Rt: 2,64 мин, 98,33% (макс.). ВЭЖХ: (Метод В) Rt: 5,35 мин, 98,75% (макс.). Хиральная СФХ (Метод G): Rt: 1,80 мин, 98,82% (макс.).
Энантиомер 2: Выход: 77,54% (22 мг, белое твердое вещество). 1Н ЯМР (400 МГц, DMSO-d6): 13.52 (bs, 1Н), 7.36 (s, 1H), 7.22 (t, J=8,4 Гц, 2H), 6.96 (d, J=7,6 Гц, 2H), 6.84 (t, J=7,6 Гц, 1H), 6.72 (s, 1H), 4.47-4.38 (m, 2H), 3.68 (s, 2H), 3.27 (s, 2H), 2.17 (s, 3H), 1.62-1.57 (m, 5H), 1.37-1.32 (m, 2H), 0.75 (t, J=7,2 Гц, 6H). ЖХ-МС: (Метод E) 496,2 (M++H), Rt: 2,64 мин, 98,23% (макс.). ВЭЖХ: (Метод В) Rt: 5,35 мин, 98,42% (макс.). Хиральная СФХ (Метод G): Rt: 2,58 мин, 98,47% (макс.).
Абсолютная конфигурация этих двух энантиомеров не известна.
Пример 8
3-((3-Бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-метоксипропановая кислота

К перемешиваемому раствору метил-3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-метоксипропаноата (Промежуточное соединение 20; 60 мг, 0,10 ммоль) в 1,4-диоксане (1,5 мл) добавляли гидроксид лития (5,19 мг, 0,217 ммоль) и реакционную смесь перемешивали в течение 2 часов при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь подкисляли разбавленной HCl (1,5 н., 2 мл) и водный слой экстрагировали EtOAc (2×10 мл). Объединенный органический слой промывали водой (5 мл) и рассолом (5 мл) и сушили над безводным Na2SO4. Органическую часть фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством преп.ВЭЖХ (Метод А) с получением указанного в заголовке соединения. Выход: 27% (16 мг, белое твердое вещество).
1Н ЯМР (400 МГц, DMSO-d6): δ 13.20 (s, 1H), 7.33 (s, 1H), 7.07 (d, J=7,20 Гц, 4Н), 6.62 (s, 1H), 4.36-4.09 (m, 3Н), 3.65 (bs, 2Н), 3.34 (s, 2Н), 3.29 (s, 3Н), 2.16 (s, 3Н), 1.52-1.37 (m, 4Н), 1.11-0.99 (m, 4Н), 0.77-0.72 (m, 6Н). ЖХ-МС: (Метод Е) 540,0 (М++Н), Rt: 2,97 мин, 98,12% (макс.). ВЭЖХ: (Метод В) Rt: 5,59 мин, 99,49% (макс.).
Пример 9
3-((3,3-Дибутил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-метоксипропановая кислота
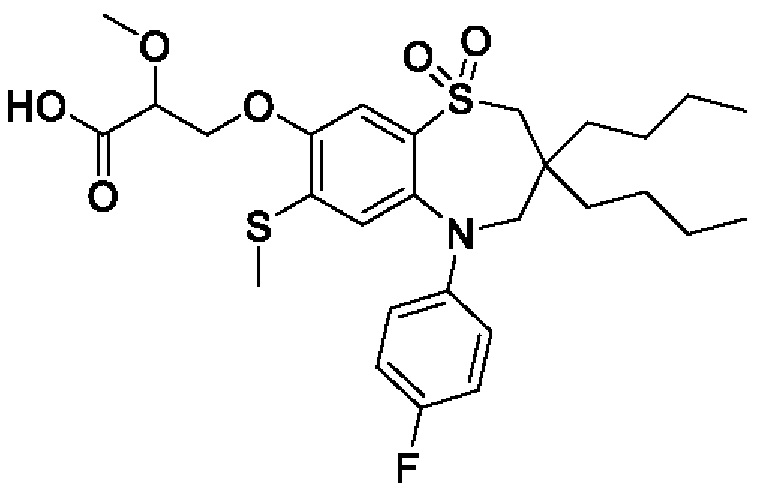
К перемешиваемому раствору метил-3-((3,3-дибутил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-метоксипропаноата (Промежуточное соединение 26; 50 мг, 0,08 ммоль) в смеси 1,4-диоксана и воды (3 мл) добавляли гидроксид лития (7,22 мг, 0,17 ммоль) и реакционную смесь перемешивали в течение 2 часов при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь подкисляли разбавленной HCl (1,5 н., 2 мл) и водный слой экстрагировали EtOAc (2×10 мл). Объединенный органический слой промывали водой (5 мл) и рассолом (5 мл) и сушили над безводным Na2SO4. Органическую часть фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством преп.ВЭЖХ (Метод А) с получением указанного в заголовке соединения. Выход: 24% (12 мг, белое твердое вещество).
1Н ЯМР (400 МГц, DMSO-d6): δ 13.06 (s, 1H), 7.32 (s, 1H), 7.09 (d, J=6,8 Гц, 4Н), 6.59 (s, 1H), 4.36-4.33 (m, 1Н), 4.27-4.23 (m, 1H), 4.12 (bs, 1H), 3.64 (bs, 2H), 3.40 (s, 3H), 3.29 (s, 2H), 2.15 (s, 3H), 1.37-1.34 (m, 4H), 1.24-1.02 (m, 8H), 0.76 (t, J=6,80 Гц, 6H). ЖХ-МС: (Метод E) 568,1 (M++H), Rt: 3,15 мин, 98,26% (макс.). ВЭЖХ: (Метод В) Rt: 6,07 мин, 97,56% (макс.).
Пример 10
(S)-3-((3,3-Дибутил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-метоксипропановая кислота и (R)-3-((3,3-дибутил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-метоксипропановая кислота

Эти два энантиомера рацемической 3-((3,3-дибутил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-метокси-пропановой кислоты (Пример 9; 30 мг, 5,29 ммоль) разделяли посредством хиральной СФХ (Метод Н). Материал концентрировали в вакууме при 40°С. Первая элюирующаяся фракция соответствовала энантиомеру 1, и вторая элюирующаяся фракция соответствовала энантиомеру 2. Абсолютная конфигурация этих двух энантиомеров не известна.
Энантиомер 1: Выход: 16% (5,0 мг, белое твердое вещество). 1Н ЯМР (400 МГц, DMSO-d6): δ 13.12 (s, 1H), 7.33 (s, 1H), 7.09 (d, J=6,8 Гц, 4Н), 6.59 (s, 1H), 4.35-4.33 (m, 1Н), 4.27-4.23 (m, 1Н), 4.15-4.13 (m, 1Н), 3.62 (bs, 2Н), 3.40 (s, 3Н), 3.38 (s, 2Н), 2.15 (s, 3Н), 1.41-1.37 (m, 6Н), 1.35-1.03 (m, 6Н), 0.76 (t, J=6,40 Гц, 6Н). ЖХ-МС: (Метод Е) 568,2 (М++Н), Rt: 2,78 мин, 94,49% (макс.). ВЭЖХ: (Метод В) Rt: 6,09 мин, 97,7% (макс.). Хиральная СФХ: (Метод Н) Rt: 3,55 мин, 99,58% (макс.).
Энантиомер 2: Выход: 26% (8 мг, белое твердое вещество). 1Н ЯМР (400 МГц, DMSO-d6): δ 13.05 (s, 1H), 7.33 (s, 1H), 7.09 (d, J=6,8 Гц, 4Н), 6.59 (s, 1Н), 4.36-4.33 (m, 1H), 4.27-4.23 (m, 1H), 4.15-4.13 (m, 1H), 3.62 (bs, 2H), 3.40 (s, 3H), 3.29 (s, 2H), 2.14 (s, 3H), 1.41-1.30 (m, 6H), 1.30-1.02 (m, 6H), 0.76 (t, J=6,80 Гц, 6H). ЖХ-МС: (Метод E) 568,2 (M++H), Rt: 2,78 мин, 87,94% (макс.). ВЭЖХ: (Метод В) Rt: 6,09 мин, 90,72% (макс.). Хиральная СФХ: (Метод Н) Rt: 4,32 мин, 95,74% (макс.).
Пример 11
3-((3-Бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-этоксипропановая кислота
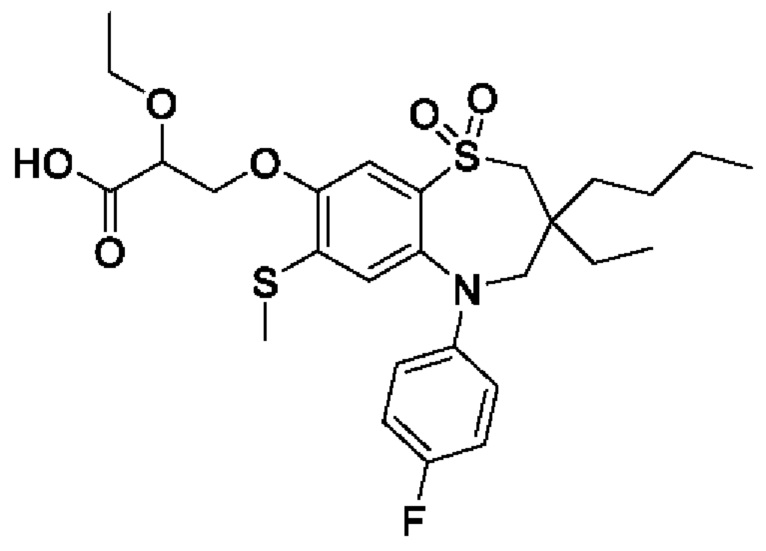
К перемешиваемому раствору метил-3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-этокси-пропаноата (Промежуточное соединение 28; 97 мг, 0,17 ммоль) в смеси 1,4-диоксана и воды (7:3, 4 мл) добавляли гидроксид лития (14 мг, 0,34 ммоль) и реакционную смесь перемешивали в течение 2 часов при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь подкисляли разбавленной HCl (1,5 н., рН примерно 3) и разбавляли охлажденной на льду водой (2 мл). Водный слой экстрагировали EtOAc (2×10 мл) и объединенный органический слой затем промывали водой (10 мл) и рассолом (10 мл). Органическую часть сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Полученное неочищенное вещество растирали с гексаном, фильтровали и сушили в вакууме с получением указанного в заголовке соединения. Выход: 40% (20 мг, белое твердое вещество).
1Н ЯМР (400 МГц, DMSO-d6): δ 12.91 (bs, 1H), 7.37 (s, 1H), 7.08-7.06 (m, 4Н), 6.62 (s, 1Н), 4.35-4.33 (m, 1Н), 4.28-4.24 (m, 2Н), 3.72-3.68 (m, 2Н), 3.57-3.52 (m, 2Н), 3.29-3.21 (m, 2Н), 2.16 (s, 3Н), 1.59-1.33 (m, 4Н), 1.22-0.95 (m, 7Н), 0.79-0.68 (m, 6Н). ЖХ-МС: (Метод Е) 554,3 (М++Н), Rt: 2,87 мин, 99,83% (макс.). ВЭЖХ: (Метод В) Rt: 5,89 мин, 97,41% (макс.).
Пример 12
3-((3,3-Дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-этоксипропановая кислота

К перемешиваемому раствору метил-3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-этоксипропаноата (Промежуточное соединение 30; 50 мг, 0,08 ммоль) в смеси 1,4-диоксана и воды (5:1, 3 мл) добавляли гидроксид лития (7,2 мг, 0,17 ммоль) и реакционную смесь перемешивали в течение 2 часов при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь подкисляли разбавленной HCl (1,5 н., 2 мл) и водный слой экстрагировали EtOAc (2×10 мл). Объединенный органический слой промывали водой (5 мл) и рассолом (5 мл) и сушили над безводным Na2SO4. Органическую часть фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством преп.ВЭЖХ (Метод А) с получением указанного в заголовке соединения. Выход: 51% (25 мг, белое твердое вещество).
1Н ЯМР (400 МГц, DMSO-d6): δ 7.38 (s, 1H), 7.23 (t, J=8,4 Гц, 2Н), 7.01 (d, J=8,0 Гц, 2Н), 6.88 (t, J=6,8 Гц, 1H), 6.67 (s, 1H), 4.36-4.34 (m, 1H), 4.27-4.23 (m, 2Н), 3.70-3.67 (m, 2Н), 3.56 (s, 2Н), 3.28 (s, 2Н), 2.15 (s, 3Н), 1.43-1.36 (m, 2Н), 1.33-1.24 (m, 3Н), 1.17-1.03 (m, 10Н), 0.77 (t, J=6,80 Гц, 6Н). ЖХ-МС: (Метод Е) 564,3 (М++Н), Rt: 3,08 мин, 99,82% (макс.). ВЭЖХ: (Метод В) Rt: 6,39 мин, 97,45% (макс.).
Пример 13
3-((3,3-Диэтил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2,2-диметилпропановая кислота

К раствору метил-3-((3,3-диэтил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2,2-диметилпропаноата (Промежуточное соединение 35; 300 мг, 0,57 ммоль) в смеси 1,4-диоксана и воды (7:3, 10 мл) добавляли гидроксид лития (48 мг, 1,14 ммоль) и реакционную смесь перемешивали в течение 1 часа при комнатной температуре. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь подкисляли разбавленной HCl (1,5 н., рН примерно 3) и разбавляли охлажденной на льду водой (2 мл). Водный слой экстрагировали EtOAc (2×10 мл) и объединенный органический слой затем промывали водой (20 мл) и рассолом (20 мл). Органическую часть сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Полученное неочищенное вещество растирали с гексаном, затем фильтровали с получением указанного в заголовке соединения. Выход: 15% (45 мг, белое твердое вещество).
1Н ЯМР (400 МГц, DMSO-d6): δ 12.43 (s, 1H), 7.28 (s, 1H), 7.09-7.02 (m, 4H), 6.66 (s, 1H), 4.07 (s, 2H), 3.69 (s, 2H), 3.27 (s, 2H), 2.17 (s, 3Н), 1.55-1.49 (m, 2H), 1.38-1.31 (m, 2H), 1.25 (s, 6H), 0.74 (t, J=7,6 Гц, 6H). ЖХ-МС: (Метод Е) 510,2 (М++Н), Rt: 2,78 мин, 98,4% (макс.). ВЭЖХ: (Метод В) Rt: 5,55 мин, 96,41% (макс.).
Пример 14
2-Гидрокси-3-((7-(метилтио)-1,1-диоксидо-5-фенил-3,3-дипропил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)пропановая кислота

К перемешиваемому раствору метил-2-гидрокси-3-((7-(метилтио)-1,1-диоксидо-5-фенил-3,3-дипропил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)пропаноата (Промежуточное соединение 36; 150 мг, 0,29 ммоль) в 1,4-диоксане (5 мл) добавляли 6 н. HCl (3 мл) при комнатной температуре и реакционную смесь перемешивали в течение 16 часов при 100°С. После завершения взаимодействия (контролируется посредством ТСХ) реакционную смесь разбавляли водой (10 мл) и водный слой экстрагировали этилацетатом (2×10 мл). Объединенный органический слой сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством колоночной хроматографии Isolera (элюент: 40-50% EtOAc/РЕ; силикагель: 230-400 меш) с получением указанного в заголовке соединения. Выход: 46% (70 мг, белое твердое вещество).
1Н ЯМР (400 МГц, DMSO-d6): δ 12.81 (s, 1H), 7.35 (s, 1H), 7.23 (t, J=8,4 Гц, 2Н), 7.00 (d, J=7,6 Гц, 2Н), 6.87 (t, J=7,2 Гц, 1H), 6.68 (s, 1Н), 5.80-5.40 (m, 1H), 4.42-4.32 (m, 1H), 4.32-4.15 (m, 2H), 3.88-3.58 (m, 2H), 3.28 (s, 2H), 2.15 (s, 3H), 1.52-1.35 (m, 2H), 1.32-1.12 (m, 6H), 0.70 (t, J=6,80 Гц, 6H). ЖХ-МС: (Метод К) 507,9 (М++Н), Rt: 2,69 мин, 97,77% (макс.). ВЭЖХ: (Метод Е) Rt: 5,32 мин, 95,61% (макс.).
БИОЛОГИЧЕСКИЕ АНАЛИЗЫ
Протокол анализа IBAT (ч/м)
10000 клеток (клетки со сверхэкспрессией IBAT человека или мыши) высевали в 96-луночные планшеты (Corning CLS3809) в 200 мкл среды MEM-альфа (Gibco 12571-063) с добавлением 10% FBS (Gibco 10438026), содержащего пуромицин (Gibco A1113803) (10 мкг/мл) и инкубировали при 37°С в 5% СО2 в течение 48 часов. После инкубации среду сливали из лунок и клетки дважды промывали 300 мкл основной среды MEM-альфа (без FBS). После декантации основной среды MEM-альфа каждый раз планшеты постукивали о бумажное полотенце для обеспечения максимального удаления остаточной среды. Разведения тестируемого ингибитора (максимальная тестовая концентрация 10 мкМ, 3-кратное серийное разведение, 10 точек), приготовленные в DMSO (Sigma D2650), добавляли в инкубационную смесь (поддерживая конечную концентрацию DMSO 0,2%), содержащую 0,25 мкМ 3Н-таурохолевой кислоты (ARC ART-1368) и 5 мкМ охлажденной таурохолевой кислоты (Sigma Т4009). Затем в лунки добавляли 50 мкл инкубационной смеси, содержащей тестируемые ингибиторы (в двух экземплярах), и планшеты инкубировали в течение 20 минут в инкубаторе с СО2 при 37°С. После инкубации реакцию останавливали, выдерживая планшеты на смеси льда с водой в течение 2-3 минут, а затем инкубационную смесь полностью аспирировали из лунок. Лунки дважды промывали 250 мкл охлажденной немеченой 1 мМ таурохолевой кислоты, растворенной в HEPES (Gibco 15630080)-забуференном (10 мМ) HBSS (Gibco 14175079) (рН 7,4). Планшеты постукивали о бумажное полотенце после каждой промывки, чтобы обеспечить максимальное удаление блокирующего буфера.
100 мкл MicroScint-20 (PerkinElmer 6013621) добавляли в лунки и оставляли на ночь при комнатной температуре, а затем считывали показания планшетов на счетчике сцинтилляции и люминесценции для микропланшетов TopCount NXT™ от PerkinElmer по протоколу 3Н Test (время считывания на лунку установлено 120 секунд).
Протокол LBAT (ч/м)
20000 клеток (клетки со сверхэкспрессией LBAT человека или мыши) засевали в 96-луночный планшет (Corning CLS3809) в 100 мкл среды MEM-альфа (Gibco 12571-063) с добавлением 10% FBS (Gibco 10438026), содержащего генетицин (Gibco 10131-027) (1 мг/мл) и инкубировали при 37°С в 5% СО2 в течение 24 часов. После инкубации среду сливали из лунок и клетки дважды промывали 300 мкл основной среды MEM-альфа (без FBS). После декантации основной среды MEM-альфа каждый раз планшеты постукивали о бумажное полотенце, чтобы обеспечить максимальное удаление остаточной среды. Для человеческого LBAT инкубационную смесь готовили путем добавления разведений тестируемого ингибитора (3-кратное серийное разведение в DMSO (Sigma D2650), 10 точек) в MEM-альфа (без FBS), содержащем 0,3 мкМ 3Н-таурохолевой кислоты (ARC ART-1368) и 7,5 мкМ охлажденной таурохолевой кислоты (Sigma Т4009) (поддерживая конечную концентрацию DMSO 0,2%). Для мышиного LBAT инкубационную смесь готовили путем добавления разведений тестируемого ингибитора (3-кратное серийное разведение в DMSO, 10 точек) в MEM-альфа (без FBS), содержащем 0,3 мкМ 3Н-таурохолевой кислоты и 25 мкМ охлажденной таурохолевой кислоты, поддерживая конечную 0,2% концентрацию DMSO).
Затем в лунки добавляли 50 мкл инкубационной смеси, содержащей тестируемые ингибиторы (в двух экземплярах), и планшеты инкубировали в течение 20 минут в инкубаторе с СО2 при 37°С. После инкубации реакцию останавливали, выдерживая планшеты на смеси льда с водой в течение 2-3 минут, а затем инкубационную смесь полностью аспирировали из лунок. Лунки дважды промывали 250 мкл охлажденной немеченой 1 мМ таурохолевой кислоты, растворенной в HEPES (Gibco 15630080)-забуференном (10 мМ) HBSS (Gibco 14175079) (рН 7,4). Планшеты постукивали о бумажное полотенце после каждой промывки, чтобы обеспечить максимальное удаление блокирующего буфера.
100 мкл MicroScint-20 (PerkinElmer 6013621) добавляли в лунки и оставляли на ночь при комнатной температуре, затем считывали показания с планшетов на счетчике сцинтилляции и люминесценции для микропланшетов TopCount NXT™ от PerkinElmer по протоколу 3Н Test (время считывания на лунку составляло 120 секунд, с нормальной ориентацией планшета).
Двунаправленный анализ проницаемости (клетки Сасо-2)
Клетки Сасо-2 (Evotec) высевали при плотности 70000 клеток/лунку в 24-луночные планшеты для культивирования клеток Millicell® со вставками и выдерживали в инкубаторе (37°С, 5% СО2, 95% RH) в течение 21 суток со сменой среды через день.
Исходные растворы (10 мМ) тестируемых соединений, атенолола (маркер низкой проницаемости), пропранолола (маркер высокой проницаемости) и дигоксина (субстрат для пути транспорта P-gp) готовили в диметилсульфоксиде (DMSO). Промежуточный основной раствор (1 мМ) получали разбавлением 10 мкл 10 мМ основного раствора 90 мкл чистого DMSO. Рабочий исходный раствор (10 мкМ) готовили разбавлением 50 мкл 1 мМ 4950 мкл буфера FaSSIF. После добавления соединений к FaSSIF образцы подвергали обработке ультразвуком в течение 2 часов и центрифугировали при 4000 об/мин в течение 30 минут при 37°С. 4 мл полученной надосадочной жидкости использовали непосредственно в анализе. Конечная концентрация DMSO в экспериментах переноса составляла 1%.
В день анализа монослои Сасо-2 дважды промывали буфером для переноса (HBSS, рН 7,4) и предварительно инкубировали в течение 30 минут (37°С, 5% СО2, 95% RH) в инкубаторе. Электрическое сопротивление монослоев измеряли с помощью системы Millicell® - ERS. Для анализа были выбраны монослои со значениями трансэпителиального электрического сопротивления (TEER) более 350 Ом⋅см2.
Анализ проводили в направлении абсорбции (А2 В) и в направлении секреции (В2А). Эксперименты по переносу инициировали добавлением транспортного буфера для анализа (буфер FaSSIF, приготовленного в HBSS), состоящего из соединений, в донорный отсек (апикальная камера А-В; базолатеральная камера В-А) в дублируемых (n=2) лунках. Не содержащий лекарственное средство буфер HBSS (рН 7,4), содержащий 1% бычьего сывороточного альбумина (BSA), вводили в приемные отсеки (А-В-базолатеральный; В-А-апикальный). Объемы апикального и базолатерального отделов составляли 0,4 и 0,8 мл, соответственно. После добавления дозируемого раствора планшеты инкубировали в инкубаторе в течение 120 минут при 37°С. Через 120 минут образцы донора и получателя собирали и сопоставляли матрицу (1:1, 30 мкл исследуемого образца+30 мкл пустого буфера) с противоположным буфером. Матрицу дозируемых образцов приводили в соответствие (1:1, 30 мкл исследуемого образца +30 мкл пустого буфера) с противоположным буфером. Образцы обрабатывали, добавляя ацетонитрил, содержащий внутренний стандарт (60 мкл исследуемого образца +200 мкл ацетонитрила, содержащего внутренний стандарт толбутамид, 500 нг/мл). Образцы встряхивали и центрифугировали при 4000 об/мин в течение 10 минут.Полученную надосадочную жидкость (100 мкл) разбавляли 100 мкл воды и переносили в свежие 96-луночные планшеты. Концентрацию соединений в образцах анализировали методом тандемной масс-спектрометрии с жидкостной хроматографией (ЖХ-МС/МС) с использованием биоаналитического метода исследовательского уровня, если применимо.
Среднюю кажущуюся проницаемость (Рарр, ×10-6 см/сек) тестируемых соединений, атенолола, пропранолола и дигоксина рассчитывали следующим образом:

где dq/dt представляет собой скорость переноса (скорость переноса соединения в приемном отсеке), Со представляет собой начальную концентрацию в донорном отсеке, А представляет собой площадь поверхности эффективной мембраны фильтра.
Протокол анализа на основе HepaRG
Криоконсервированный флакон с дифференцированными клетками HepaRG (Biopredic International HPR116080) размораживали в среде HepaRG для размораживания/посева/общего назначения (Biopredic International ADD670C) с добавлением 200 мМ глутамакса (Gibco 35050061) в соответствии с протоколом, предоставленным Biopredic International. 70000 клеток на лунку высевали в 96-луночный планшет (Corning CLS3809) в 100 мкл среды HepaRG для размораживания/посева/общего назначения с добавлением 200 мМ глутамакса и инкубировали при 37°С в 5% СО2 в течение 24 часов. После инкубации посевную среду заменяли средой для поддержания/метаболизма HepaRG (Biopredic International ADD620C) и инкубировали в течение 6 суток со свежей средой для поддержания/метаболизма HepaRG каждые 48 часов. Через 7 суток инкубации после посева инкубационную среду сливали из лунок и клетки промывали два раза 250 мкл базальной среды William's Е (Gibco 12551032). Каждый раз после декантации базальной среды William's Е планшеты простукивали о бумажное полотенце, чтобы обеспечить максимальное удаление остаточной среды. Инкубационную смесь готовили путем добавления разведений тестируемого ингибитора (3-кратное серийное разведение в DMSO (Sigma D2650)) в среду William's Е (базальную), содержащую 0,3 мкМ 3Н-таурохолевой кислоты (ARC ART-1368) и 7,5 мкМ охлажденной таурохолевой кислоты (Sigma Т4009) (поддерживая конечную концентрацию 0,2% DMSO). Затем в лунки (в двух экземплярах) добавляли 50 мкл инкубационной смеси, содержащей тетсируемые ингибиторы, и планшеты инкубировали в течение 30 минут в инкубаторе с 5% СО2 при 37°С. После инкубации реакцию останавливали, выдерживая планшеты на смеси льда с водой в течение 2-3 минут, а затем инкубационную смесь полностью аспирировали из лунок. Лунки дважды промывали 250 мкл охлажденной немеченой 1 мМ таурохолевой кислоты, растворенной в HEPES (Gibco 15630080)-забуференном (10 мМ) HBSS (Gibco 14175079) (рН 7,4). После каждой промывки планшеты простукивали о бумажное полотенце, чтобы обеспечить максимальное удаление блокирующего буфера.
100 мкл MicroScint-20 (PerkinElmer 6013621) добавляли в лунки и выдерживали в течение ночи при комнатной температуре, затем считывали показания с планшетов на счетчике сцинтилляции и люминесценции для микропланшетов TopCount NXT™ от PerkinElmer по протоколу 3Н Test (время считывания на лунку составляло 120 секунд, с нормальной ориентацией планшета).
Приготовление разведений тестируемых соединений
Все тестируемые соединения были предоставлены в форме порошка при комнатной температуре. Готовили 10 мМ исходных тестируемых соединений в DMSO, разделяли на аликвоты и хранили при -20°С. Из исходного 10 мМ DMSO соединений готовили 3-кратное серийное разведение в DMSO, чтобы получить в общей сложности 10 разведений тестируемых соединений. 0,5 мкл этого разведения в DMSO добавляли к 250 мкл базальной среды без FBS, содержащей 3Н-таурохолевую кислоту и охлажденную таурохолевую кислоту, для приготовления инкубационной смеси.
Исследования биодоступности
Использовали мышей-самцов (C57BL/6 или CD1) или крыс Wistar в возрасте 8-9 недель. Для каждого тестируемого соединения использовали две группы по 3 животных в каждой. Одной группе вводили однократную внутривенную дозу 1 мг/кг (носитель 100% DMSO) через хвостовую вену, а другой группе вводили однократную пероральную дозу 10 мг/кг через желудочную иглу. Группу, которой вводили пероральную дозу, не кормили в течение ночи. Образцы крови собирали через 0,083, 0,25, 0,5, 1, 2, 4, 6, 8 и 24 часа после внутривенного введения и через 0,25, 0,5, 1, 2, 4, 6, 8 и 24 часа после перорального введения. Кровь брали из подкожной вены. В качестве антикоагулянта использовали 0,2% EDTA. Образцы анализировали с помощью биоаналитического метода исследовательской степени, разработанного для оценки тестируемого соединения в плазме с использованием системы ЖХ-МС/МС.
Результаты
Биологические данные для соединений Примеров показаны в Таблице 8 ниже.
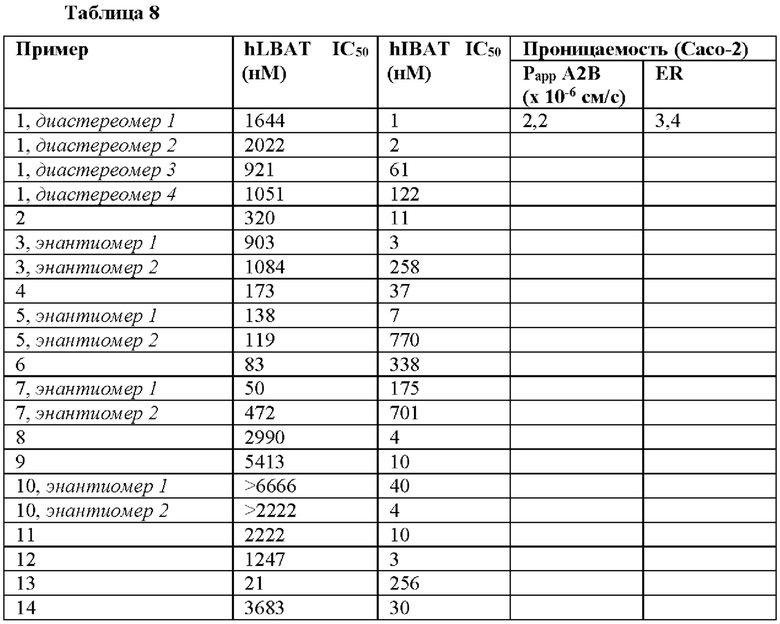
Модель PD: Оценка влияния тестируемого соединения на общие уровни желчных кислот у самцов мышей C57BL6
Мышей C57BL/6N Тас в возрасте 8-9 недель использовали для изучения влияния модуляторов желчных кислот на уровни желчных кислот. После завершения периода карантина и акклиматизации животных рандомизировали по массе тела на х экспериментальных групп: (1) контрольная, носитель, и (2) тестируемое соединение у мг/кг перорально один раз в день. Животным вводили тестируемое соединение в течение 7 суток. На 5 сутки исследования животных по отдельности помещали в свежие клетки. На 7 сутки из каждой клетки собирали фекалии с последующим забором крови у каждого животного ретроорбитальным путем. Животных умерщвляли, чтобы забрать печень и терминальную часть подвздошной кишки у каждого животного для дальнейшего анализа. Массу тела и потребление пищи измеряли два раза в неделю. Липидные профили сыворотки анализировали в образцах сыворотки на 7 сутки. Общее количество желчных кислот в сыворотке измеряли в образцах сыворотки на 7 сутки. Фекальное выделение желчи измеряли в образце кала на 7 сутки. Экспрессию CYP7A1 и SHP в печени количественно оценивали в образцах печени на 7 сутки. Триглицериды печени и общий холестерин анализировали в образцах печени на 7 сутки.
Модель желчных кислот в моче: оценка тестируемых соединений на уровни желчных кислот в моче у самцов мышей C57BL/6.
Мышей C57BL/6N Тас в возрасте 8-9 недель использовали для изучения влияния модуляторов желчных кислот на уровни желчных кислот. После завершения периода карантина и акклиматизации животных рандомизировали по массе тела на х экспериментальных групп: (1) контрольная, носитель, и (2) тестируемое соединение у мг/кг перорально один раз в день. Животным вводили тестируемое соединение в течение 7 суток. На 6 сутки исследования животных переводили в метаболическую клетку. На 7 сутки из каждой метаболической клетки собирали фекалии и мочу с последующим забором крови у каждого животного ретроорбитальным путем. Животных умерщвляли, чтобы забрать почки у каждого животного для дальнейшего анализа. Массу тела измеряли два раза в неделю. Общее количество желчных кислот в сыворотке измеряли в образцах сыворотки на 7 сутки. Экскрецию желчных кислот с калом измеряли в образце кала на 7 сутки. Выведение желчных кислот с мочой измеряли в образце на 7 сутки. Почечную экспрессию ASBT, OSTa, OSTAb и MRP2 количественно определяли в образцах на 7 сутки.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ALBIREO AB
<120> СОЕДИНЕНИЯ БЕНЗОТИА(ДИ)АЗЕПИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ
МОДУЛЯТОРОВ ЖЕЛЧНЫХ КИСЛОТ
<130> NP0570WO
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 1251
<212> PRT
<213> Homo sapiens
<400> 1
Met Ser Thr Glu Arg Asp Ser Glu Thr Thr Phe Asp Glu Asp Ser Gln
1 5 10 15
Pro Asn Asp Glu Val Val Pro Tyr Ser Asp Asp Glu Thr Glu Asp Glu
20 25 30
Leu Asp Asp Gln Gly Ser Ala Val Glu Pro Glu Gln Asn Arg Val Asn
35 40 45
Arg Glu Ala Glu Glu Asn Arg Glu Pro Phe Arg Lys Glu Cys Thr Trp
50 55 60
Gln Val Lys Ala Asn Asp Arg Lys Tyr His Glu Gln Pro His Phe Met
65 70 75 80
Asn Thr Lys Phe Leu Cys Ile Lys Glu Ser Lys Tyr Ala Asn Asn Ala
85 90 95
Ile Lys Thr Tyr Lys Tyr Asn Ala Phe Thr Phe Ile Pro Met Asn Leu
100 105 110
Phe Glu Gln Phe Lys Arg Ala Ala Asn Leu Tyr Phe Leu Ala Leu Leu
115 120 125
Ile Leu Gln Ala Val Pro Gln Ile Ser Thr Leu Ala Trp Tyr Thr Thr
130 135 140
Leu Val Pro Leu Leu Val Val Leu Gly Val Thr Ala Ile Lys Asp Leu
145 150 155 160
Val Asp Asp Val Ala Arg His Lys Met Asp Lys Glu Ile Asn Asn Arg
165 170 175
Thr Cys Glu Val Ile Lys Asp Gly Arg Phe Lys Val Ala Lys Trp Lys
180 185 190
Glu Ile Gln Val Gly Asp Val Ile Arg Leu Lys Lys Asn Asp Phe Val
195 200 205
Pro Ala Asp Ile Leu Leu Leu Ser Ser Ser Glu Pro Asn Ser Leu Cys
210 215 220
Tyr Val Glu Thr Ala Glu Leu Asp Gly Glu Thr Asn Leu Lys Phe Lys
225 230 235 240
Met Ser Leu Glu Ile Thr Asp Gln Tyr Leu Gln Arg Glu Asp Thr Leu
245 250 255
Ala Thr Phe Asp Gly Phe Ile Glu Cys Glu Glu Pro Asn Asn Arg Leu
260 265 270
Asp Lys Phe Thr Gly Thr Leu Phe Trp Arg Asn Thr Ser Phe Pro Leu
275 280 285
Asp Ala Asp Lys Ile Leu Leu Arg Gly Cys Val Ile Arg Asn Thr Asp
290 295 300
Phe Cys His Gly Leu Val Ile Phe Ala Gly Ala Asp Thr Lys Ile Met
305 310 315 320
Lys Asn Ser Gly Lys Thr Arg Phe Lys Arg Thr Lys Ile Asp Tyr Leu
325 330 335
Met Asn Tyr Met Val Tyr Thr Ile Phe Val Val Leu Ile Leu Leu Ser
340 345 350
Ala Gly Leu Ala Ile Gly His Ala Tyr Trp Glu Ala Gln Val Gly Asn
355 360 365
Ser Ser Trp Tyr Leu Tyr Asp Gly Glu Asp Asp Thr Pro Ser Tyr Arg
370 375 380
Gly Phe Leu Ile Phe Trp Gly Tyr Ile Ile Val Leu Asn Thr Met Val
385 390 395 400
Pro Ile Ser Leu Tyr Val Ser Val Glu Val Ile Arg Leu Gly Gln Ser
405 410 415
His Phe Ile Asn Trp Asp Leu Gln Met Tyr Tyr Ala Glu Lys Asp Thr
420 425 430
Pro Ala Lys Ala Arg Thr Thr Thr Leu Asn Glu Gln Leu Gly Gln Ile
435 440 445
His Tyr Ile Phe Ser Asp Lys Thr Gly Thr Leu Thr Gln Asn Ile Met
450 455 460
Thr Phe Lys Lys Cys Cys Ile Asn Gly Gln Ile Tyr Gly Asp His Arg
465 470 475 480
Asp Ala Ser Gln His Asn His Asn Lys Ile Glu Gln Val Asp Phe Ser
485 490 495
Trp Asn Thr Tyr Ala Asp Gly Lys Leu Ala Phe Tyr Asp His Tyr Leu
500 505 510
Ile Glu Gln Ile Gln Ser Gly Lys Glu Pro Glu Val Arg Gln Phe Phe
515 520 525
Phe Leu Leu Ala Val Cys His Thr Val Met Val Asp Arg Thr Asp Gly
530 535 540
Gln Leu Asn Tyr Gln Ala Ala Ser Pro Asp Glu Gly Ala Leu Val Asn
545 550 555 560
Ala Ala Arg Asn Phe Gly Phe Ala Phe Leu Ala Arg Thr Gln Asn Thr
565 570 575
Ile Thr Ile Ser Glu Leu Gly Thr Glu Arg Thr Tyr Asn Val Leu Ala
580 585 590
Ile Leu Asp Phe Asn Ser Asp Arg Lys Arg Met Ser Ile Ile Val Arg
595 600 605
Thr Pro Glu Gly Asn Ile Lys Leu Tyr Cys Lys Gly Ala Asp Thr Val
610 615 620
Ile Tyr Glu Arg Leu His Arg Met Asn Pro Thr Lys Gln Glu Thr Gln
625 630 635 640
Asp Ala Leu Asp Ile Phe Ala Asn Glu Thr Leu Arg Thr Leu Cys Leu
645 650 655
Cys Tyr Lys Glu Ile Glu Glu Lys Glu Phe Thr Glu Trp Asn Lys Lys
660 665 670
Phe Met Ala Ala Ser Val Ala Ser Thr Asn Arg Asp Glu Ala Leu Asp
675 680 685
Lys Val Tyr Glu Glu Ile Glu Lys Asp Leu Ile Leu Leu Gly Ala Thr
690 695 700
Ala Ile Glu Asp Lys Leu Gln Asp Gly Val Pro Glu Thr Ile Ser Lys
705 710 715 720
Leu Ala Lys Ala Asp Ile Lys Ile Trp Val Leu Thr Gly Asp Lys Lys
725 730 735
Glu Thr Ala Glu Asn Ile Gly Phe Ala Cys Glu Leu Leu Thr Glu Asp
740 745 750
Thr Thr Ile Cys Tyr Gly Glu Asp Ile Asn Ser Leu Leu His Ala Arg
755 760 765
Met Glu Asn Gln Arg Asn Arg Gly Gly Val Tyr Ala Lys Phe Ala Pro
770 775 780
Pro Val Gln Glu Ser Phe Phe Pro Pro Gly Gly Asn Arg Ala Leu Ile
785 790 795 800
Ile Thr Gly Ser Trp Leu Asn Glu Ile Leu Leu Glu Lys Lys Thr Lys
805 810 815
Arg Asn Lys Ile Leu Lys Leu Lys Phe Pro Arg Thr Glu Glu Glu Arg
820 825 830
Arg Met Arg Thr Gln Ser Lys Arg Arg Leu Glu Ala Lys Lys Glu Gln
835 840 845
Arg Gln Lys Asn Phe Val Asp Leu Ala Cys Glu Cys Ser Ala Val Ile
850 855 860
Cys Cys Arg Val Thr Pro Lys Gln Lys Ala Met Val Val Asp Leu Val
865 870 875 880
Lys Arg Tyr Lys Lys Ala Ile Thr Leu Ala Ile Gly Asp Gly Ala Asn
885 890 895
Asp Val Asn Met Ile Lys Thr Ala His Ile Gly Val Gly Ile Ser Gly
900 905 910
Gln Glu Gly Met Gln Ala Val Met Ser Ser Asp Tyr Ser Phe Ala Gln
915 920 925
Phe Arg Tyr Leu Gln Arg Leu Leu Leu Val His Gly Arg Trp Ser Tyr
930 935 940
Ile Arg Met Cys Lys Phe Leu Arg Tyr Phe Phe Tyr Lys Asn Phe Ala
945 950 955 960
Phe Thr Leu Val His Phe Trp Tyr Ser Phe Phe Asn Gly Tyr Ser Ala
965 970 975
Gln Thr Ala Tyr Glu Asp Trp Phe Ile Thr Leu Tyr Asn Val Leu Tyr
980 985 990
Thr Ser Leu Pro Val Leu Leu Met Gly Leu Leu Asp Gln Asp Val Ser
995 1000 1005
Asp Lys Leu Ser Leu Arg Phe Pro Gly Leu Tyr Ile Val Gly Gln
1010 1015 1020
Arg Asp Leu Leu Phe Asn Tyr Lys Arg Phe Phe Val Ser Leu Leu
1025 1030 1035
His Gly Val Leu Thr Ser Met Ile Leu Phe Phe Ile Pro Leu Gly
1040 1045 1050
Ala Tyr Leu Gln Thr Val Gly Gln Asp Gly Glu Ala Pro Ser Asp
1055 1060 1065
Tyr Gln Ser Phe Ala Val Thr Ile Ala Ser Ala Leu Val Ile Thr
1070 1075 1080
Val Asn Phe Gln Ile Gly Leu Asp Thr Ser Tyr Trp Thr Phe Val
1085 1090 1095
Asn Ala Phe Ser Ile Phe Gly Ser Ile Ala Leu Tyr Phe Gly Ile
1100 1105 1110
Met Phe Asp Phe His Ser Ala Gly Ile His Val Leu Phe Pro Ser
1115 1120 1125
Ala Phe Gln Phe Thr Gly Thr Ala Ser Asn Ala Leu Arg Gln Pro
1130 1135 1140
Tyr Ile Trp Leu Thr Ile Ile Leu Ala Val Ala Val Cys Leu Leu
1145 1150 1155
Pro Val Val Ala Ile Arg Phe Leu Ser Met Thr Ile Trp Pro Ser
1160 1165 1170
Glu Ser Asp Lys Ile Gln Lys His Arg Lys Arg Leu Lys Ala Glu
1175 1180 1185
Glu Gln Trp Gln Arg Arg Gln Gln Val Phe Arg Arg Gly Val Ser
1190 1195 1200
Thr Arg Arg Ser Ala Tyr Ala Phe Ser His Gln Arg Gly Tyr Ala
1205 1210 1215
Asp Leu Ile Ser Ser Gly Arg Ser Ile Arg Lys Lys Arg Ser Pro
1220 1225 1230
Leu Asp Ala Ile Val Ala Asp Gly Thr Ala Glu Tyr Arg Arg Thr
1235 1240 1245
Gly Asp Ser
1250
<210> 2
<211> 3756
<212> DNA
<213> Homo sapiens
<400> 2
atgagtacag aaagagactc agaaacgaca tttgacgagg attctcagcc taatgacgaa 60
gtggttccct acagtgatga tgaaacagaa gatgaacttg atgaccaggg gtctgctgtt 120
gaaccagaac aaaaccgagt caacagggaa gcagaggaga accgggagcc attcagaaaa 180
gaatgtacat ggcaagtcaa agcaaacgat cgcaagtacc acgaacaacc tcactttatg 240
aacacaaaat tcttgtgtat taaggagagt aaatatgcga ataatgcaat taaaacatac 300
aagtacaacg catttacctt tataccaatg aatctgtttg agcagtttaa gagagcagcc 360
aatttatatt tcctggctct tcttatctta caggcagttc ctcaaatctc taccctggct 420
tggtacacca cactagtgcc cctgcttgtg gtgctgggcg tcactgcaat caaagacctg 480
gtggacgatg tggctcgcca taaaatggat aaggaaatca acaataggac gtgtgaagtc 540
attaaggatg gcaggttcaa agttgctaag tggaaagaaa ttcaagttgg agacgtcatt 600
cgtctgaaaa aaaatgattt tgttccagct gacattctcc tgctgtctag ctctgagcct 660
aacagcctct gctatgtgga aacagcagaa ctggatggag aaaccaattt aaaatttaag 720
atgtcacttg aaatcacaga ccagtacctc caaagagaag atacattggc tacatttgat 780
ggttttattg aatgtgaaga acccaataac agactagata agtttacagg aacactattt 840
tggagaaaca caagttttcc tttggatgct gataaaattt tgttacgtgg ctgtgtaatt 900
aggaacaccg atttctgcca cggcttagtc atttttgcag gtgctgacac taaaataatg 960
aagaatagtg ggaaaaccag atttaaaaga actaaaattg attacttgat gaactacatg 1020
gtttacacga tctttgttgt tcttattctg ctttctgctg gtcttgccat cggccatgct 1080
tattgggaag cacaggtggg caattcctct tggtacctct atgatggaga agacgataca 1140
ccctcctacc gtggattcct cattttctgg ggctatatca ttgttctcaa caccatggta 1200
cccatctctc tctatgtcag cgtggaagtg attcgtcttg gacagagtca cttcatcaac 1260
tgggacctgc aaatgtacta tgctgagaag gacacacccg caaaagctag aaccaccaca 1320
ctcaatgaac agctcgggca gatccattat atcttctctg ataagacggg gacactcaca 1380
caaaatatca tgacctttaa aaagtgctgt atcaacgggc agatatatgg ggaccatcgg 1440
gatgcctctc aacacaacca caacaaaata gagcaagttg attttagctg gaatacatat 1500
gctgatggga agcttgcatt ttatgaccac tatcttattg agcaaatcca gtcagggaaa 1560
gagccagaag tacgacagtt cttcttcttg ctcgcagttt gccacacagt catggtggat 1620
aggactgatg gtcagctcaa ctaccaggca gcctctcccg atgaaggtgc cctggtaaac 1680
gctgccagga actttggctt tgccttcctc gccaggaccc agaacaccat caccatcagt 1740
gaactgggca ctgaaaggac ttacaatgtt cttgccattt tggacttcaa cagtgaccgg 1800
aagcgaatgt ctatcattgt aagaacccca gaaggcaata tcaagcttta ctgtaaaggt 1860
gctgacactg ttatttatga acggttacat cgaatgaatc ctactaagca agaaacacag 1920
gatgccctgg atatctttgc aaatgaaact cttagaaccc tatgcctttg ctacaaggaa 1980
attgaagaaa aagaatttac agaatggaat aaaaagttta tggctgccag tgtggcctcc 2040
accaaccggg acgaagctct ggataaagta tatgaggaga ttgaaaaaga cttaattctc 2100
ctgggagcta cagctattga agacaagcta caggatggag ttccagaaac catttcaaaa 2160
cttgcaaaag ctgacattaa gatctgggtg cttactggag acaaaaagga aactgctgaa 2220
aatataggat ttgcttgtga acttctgact gaagacacca ccatctgcta tggggaggat 2280
attaattctc ttcttcatgc aaggatggaa aaccagagga atagaggtgg cgtctacgca 2340
aagtttgcac ctcctgtgca ggaatctttt tttccacccg gtggaaaccg tgccttaatc 2400
atcactggtt cttggttgaa tgaaattctt ctcgagaaaa agaccaagag aaataagatt 2460
ctgaagctga agttcccaag aacagaagaa gaaagacgga tgcggaccca aagtaaaagg 2520
aggctagaag ctaagaaaga gcagcggcag aaaaactttg tggacctggc ctgcgagtgc 2580
agcgcagtca tctgctgccg cgtcaccccc aagcagaagg ccatggtggt ggacctggtg 2640
aagaggtaca agaaagccat cacgctggcc atcggagatg gggccaatga cgtgaacatg 2700
atcaaaactg cccacattgg cgttggaata agtggacaag aaggaatgca agctgtcatg 2760
tcgagtgact attcctttgc tcagttccga tatctgcaga ggctactgct ggtgcatggc 2820
cgatggtctt acataaggat gtgcaagttc ctacgatact tcttttacaa aaactttgcc 2880
tttactttgg ttcatttctg gtactccttc ttcaatggct actctgcgca gactgcatac 2940
gaggattggt tcatcaccct ctacaacgtg ctgtacacca gcctgcccgt gctcctcatg 3000
gggctgctcg accaggatgt gagtgacaaa ctgagcctcc gattccctgg gttatacata 3060
gtgggacaaa gagacttact attcaactat aagagattct ttgtaagctt gttgcatggg 3120
gtcctaacat cgatgatcct cttcttcata cctcttggag cttatctgca aaccgtaggg 3180
caggatggag aggcaccttc cgactaccag tcttttgccg tcaccattgc ctctgctctt 3240
gtaataacag tcaatttcca gattggcttg gatacttctt attggacttt tgtgaatgct 3300
ttttcaattt ttggaagcat tgcactttat tttggcatca tgtttgactt tcatagtgct 3360
ggaatacatg ttctctttcc atctgcattt caatttacag gcacagcttc aaacgctctg 3420
agacagccat acatttggtt aactatcatc ctggctgttg ctgtgtgctt actacccgtc 3480
gttgccattc gattcctgtc aatgaccatc tggccatcag aaagtgataa gatccagaag 3540
catcgcaagc ggttgaaggc ggaggagcag tggcagcgac ggcagcaggt gttccgccgg 3600
ggcgtgtcaa cgcggcgctc ggcctacgcc ttctcgcacc agcggggcta cgcggacctc 3660
atctcctccg ggcgcagcat ccgcaagaag cgctcgccgc ttgatgccat cgtggcggat 3720
ggcaccgcgg agtacaggcg caccggggac agctga 3756
<210> 3
<211> 1321
<212> PRT
<213> Homo sapiens
<400> 3
Met Ser Asp Ser Val Ile Leu Arg Ser Ile Lys Lys Phe Gly Glu Glu
1 5 10 15
Asn Asp Gly Phe Glu Ser Asp Lys Ser Tyr Asn Asn Asp Lys Lys Ser
20 25 30
Arg Leu Gln Asp Glu Lys Lys Gly Asp Gly Val Arg Val Gly Phe Phe
35 40 45
Gln Leu Phe Arg Phe Ser Ser Ser Thr Asp Ile Trp Leu Met Phe Val
50 55 60
Gly Ser Leu Cys Ala Phe Leu His Gly Ile Ala Gln Pro Gly Val Leu
65 70 75 80
Leu Ile Phe Gly Thr Met Thr Asp Val Phe Ile Asp Tyr Asp Val Glu
85 90 95
Leu Gln Glu Leu Gln Ile Pro Gly Lys Ala Cys Val Asn Asn Thr Ile
100 105 110
Val Trp Thr Asn Ser Ser Leu Asn Gln Asn Met Thr Asn Gly Thr Arg
115 120 125
Cys Gly Leu Leu Asn Ile Glu Ser Glu Met Ile Lys Phe Ala Ser Tyr
130 135 140
Tyr Ala Gly Ile Ala Val Ala Val Leu Ile Thr Gly Tyr Ile Gln Ile
145 150 155 160
Cys Phe Trp Val Ile Ala Ala Ala Arg Gln Ile Gln Lys Met Arg Lys
165 170 175
Phe Tyr Phe Arg Arg Ile Met Arg Met Glu Ile Gly Trp Phe Asp Cys
180 185 190
Asn Ser Val Gly Glu Leu Asn Thr Arg Phe Ser Asp Asp Ile Asn Lys
195 200 205
Ile Asn Asp Ala Ile Ala Asp Gln Met Ala Leu Phe Ile Gln Arg Met
210 215 220
Thr Ser Thr Ile Cys Gly Phe Leu Leu Gly Phe Phe Arg Gly Trp Lys
225 230 235 240
Leu Thr Leu Val Ile Ile Ser Val Ser Pro Leu Ile Gly Ile Gly Ala
245 250 255
Ala Thr Ile Gly Leu Ser Val Ser Lys Phe Thr Asp Tyr Glu Leu Lys
260 265 270
Ala Tyr Ala Lys Ala Gly Val Val Ala Asp Glu Val Ile Ser Ser Met
275 280 285
Arg Thr Val Ala Ala Phe Gly Gly Glu Lys Arg Glu Val Glu Arg Tyr
290 295 300
Glu Lys Asn Leu Val Phe Ala Gln Arg Trp Gly Ile Arg Lys Gly Ile
305 310 315 320
Val Met Gly Phe Phe Thr Gly Phe Val Trp Cys Leu Ile Phe Leu Cys
325 330 335
Tyr Ala Leu Ala Phe Trp Tyr Gly Ser Thr Leu Val Leu Asp Glu Gly
340 345 350
Glu Tyr Thr Pro Gly Thr Leu Val Gln Ile Phe Leu Ser Val Ile Val
355 360 365
Gly Ala Leu Asn Leu Gly Asn Ala Ser Pro Cys Leu Glu Ala Phe Ala
370 375 380
Thr Gly Arg Ala Ala Ala Thr Ser Ile Phe Glu Thr Ile Asp Arg Lys
385 390 395 400
Pro Ile Ile Asp Cys Met Ser Glu Asp Gly Tyr Lys Leu Asp Arg Ile
405 410 415
Lys Gly Glu Ile Glu Phe His Asn Val Thr Phe His Tyr Pro Ser Arg
420 425 430
Pro Glu Val Lys Ile Leu Asn Asp Leu Asn Met Val Ile Lys Pro Gly
435 440 445
Glu Met Thr Ala Leu Val Gly Pro Ser Gly Ala Gly Lys Ser Thr Ala
450 455 460
Leu Gln Leu Ile Gln Arg Phe Tyr Asp Pro Cys Glu Gly Met Val Thr
465 470 475 480
Val Asp Gly His Asp Ile Arg Ser Leu Asn Ile Gln Trp Leu Arg Asp
485 490 495
Gln Ile Gly Ile Val Glu Gln Glu Pro Val Leu Phe Ser Thr Thr Ile
500 505 510
Ala Glu Asn Ile Arg Tyr Gly Arg Glu Asp Ala Thr Met Glu Asp Ile
515 520 525
Val Gln Ala Ala Lys Glu Ala Asn Ala Tyr Asn Phe Ile Met Asp Leu
530 535 540
Pro Gln Gln Phe Asp Thr Leu Val Gly Glu Gly Gly Gly Gln Met Ser
545 550 555 560
Gly Gly Gln Lys Gln Arg Val Ala Ile Ala Arg Ala Leu Ile Arg Asn
565 570 575
Pro Lys Ile Leu Leu Leu Asp Met Ala Thr Ser Ala Leu Asp Asn Glu
580 585 590
Ser Glu Ala Met Val Gln Glu Val Leu Ser Lys Ile Gln His Gly His
595 600 605
Thr Ile Ile Ser Val Ala His Arg Leu Ser Thr Val Arg Ala Ala Asp
610 615 620
Thr Ile Ile Gly Phe Glu His Gly Thr Ala Val Glu Arg Gly Thr His
625 630 635 640
Glu Glu Leu Leu Glu Arg Lys Gly Val Tyr Phe Thr Leu Val Thr Leu
645 650 655
Gln Ser Gln Gly Asn Gln Ala Leu Asn Glu Glu Asp Ile Lys Asp Ala
660 665 670
Thr Glu Asp Asp Met Leu Ala Arg Thr Phe Ser Arg Gly Ser Tyr Gln
675 680 685
Asp Ser Leu Arg Ala Ser Ile Arg Gln Arg Ser Lys Ser Gln Leu Ser
690 695 700
Tyr Leu Val His Glu Pro Pro Leu Ala Val Val Asp His Lys Ser Thr
705 710 715 720
Tyr Glu Glu Asp Arg Lys Asp Lys Asp Ile Pro Val Gln Glu Glu Val
725 730 735
Glu Pro Ala Pro Val Arg Arg Ile Leu Lys Phe Ser Ala Pro Glu Trp
740 745 750
Pro Tyr Met Leu Val Gly Ser Val Gly Ala Ala Val Asn Gly Thr Val
755 760 765
Thr Pro Leu Tyr Ala Phe Leu Phe Ser Gln Ile Leu Gly Thr Phe Ser
770 775 780
Ile Pro Asp Lys Glu Glu Gln Arg Ser Gln Ile Asn Gly Val Cys Leu
785 790 795 800
Leu Phe Val Ala Met Gly Cys Val Ser Leu Phe Thr Gln Phe Leu Gln
805 810 815
Gly Tyr Ala Phe Ala Lys Ser Gly Glu Leu Leu Thr Lys Arg Leu Arg
820 825 830
Lys Phe Gly Phe Arg Ala Met Leu Gly Gln Asp Ile Ala Trp Phe Asp
835 840 845
Asp Leu Arg Asn Ser Pro Gly Ala Leu Thr Thr Arg Leu Ala Thr Asp
850 855 860
Ala Ser Gln Val Gln Gly Ala Ala Gly Ser Gln Ile Gly Met Ile Val
865 870 875 880
Asn Ser Phe Thr Asn Val Thr Val Ala Met Ile Ile Ala Phe Ser Phe
885 890 895
Ser Trp Lys Leu Ser Leu Val Ile Leu Cys Phe Phe Pro Phe Leu Ala
900 905 910
Leu Ser Gly Ala Thr Gln Thr Arg Met Leu Thr Gly Phe Ala Ser Arg
915 920 925
Asp Lys Gln Ala Leu Glu Met Val Gly Gln Ile Thr Asn Glu Ala Leu
930 935 940
Ser Asn Ile Arg Thr Val Ala Gly Ile Gly Lys Glu Arg Arg Phe Ile
945 950 955 960
Glu Ala Leu Glu Thr Glu Leu Glu Lys Pro Phe Lys Thr Ala Ile Gln
965 970 975
Lys Ala Asn Ile Tyr Gly Phe Cys Phe Ala Phe Ala Gln Cys Ile Met
980 985 990
Phe Ile Ala Asn Ser Ala Ser Tyr Arg Tyr Gly Gly Tyr Leu Ile Ser
995 1000 1005
Asn Glu Gly Leu His Phe Ser Tyr Val Phe Arg Val Ile Ser Ala
1010 1015 1020
Val Val Leu Ser Ala Thr Ala Leu Gly Arg Ala Phe Ser Tyr Thr
1025 1030 1035
Pro Ser Tyr Ala Lys Ala Lys Ile Ser Ala Ala Arg Phe Phe Gln
1040 1045 1050
Leu Leu Asp Arg Gln Pro Pro Ile Ser Val Tyr Asn Thr Ala Gly
1055 1060 1065
Glu Lys Trp Asp Asn Phe Gln Gly Lys Ile Asp Phe Val Asp Cys
1070 1075 1080
Lys Phe Thr Tyr Pro Ser Arg Pro Asp Ser Gln Val Leu Asn Gly
1085 1090 1095
Leu Ser Val Ser Ile Ser Pro Gly Gln Thr Leu Ala Phe Val Gly
1100 1105 1110
Ser Ser Gly Cys Gly Lys Ser Thr Ser Ile Gln Leu Leu Glu Arg
1115 1120 1125
Phe Tyr Asp Pro Asp Gln Gly Lys Val Met Ile Asp Gly His Asp
1130 1135 1140
Ser Lys Lys Val Asn Val Gln Phe Leu Arg Ser Asn Ile Gly Ile
1145 1150 1155
Val Ser Gln Glu Pro Val Leu Phe Ala Cys Ser Ile Met Asp Asn
1160 1165 1170
Ile Lys Tyr Gly Asp Asn Thr Lys Glu Ile Pro Met Glu Arg Val
1175 1180 1185
Ile Ala Ala Ala Lys Gln Ala Gln Leu His Asp Phe Val Met Ser
1190 1195 1200
Leu Pro Glu Lys Tyr Glu Thr Asn Val Gly Ser Gln Gly Ser Gln
1205 1210 1215
Leu Ser Arg Gly Glu Lys Gln Arg Ile Ala Ile Ala Arg Ala Ile
1220 1225 1230
Val Arg Asp Pro Lys Ile Leu Leu Leu Asp Glu Ala Thr Ser Ala
1235 1240 1245
Leu Asp Thr Glu Ser Glu Lys Thr Val Gln Val Ala Leu Asp Lys
1250 1255 1260
Ala Arg Glu Gly Arg Thr Cys Ile Val Ile Ala His Arg Leu Ser
1265 1270 1275
Thr Ile Gln Asn Ala Asp Ile Ile Ala Val Met Ala Gln Gly Val
1280 1285 1290
Val Ile Glu Lys Gly Thr His Glu Glu Leu Met Ala Gln Lys Gly
1295 1300 1305
Ala Tyr Tyr Lys Leu Val Thr Thr Gly Ser Pro Ile Ser
1310 1315 1320
<210> 4
<211> 3966
<212> DNA
<213> Homo sapiens
<400> 4
atgtctgact cagtaattct tcgaagtata aagaaatttg gagaggagaa tgatggtttt 60
gagtcagata aatcatataa taatgataag aaatcaaggt tacaagatga gaagaaaggt 120
gatggcgtta gagttggctt ctttcaattg tttcggtttt cttcatcaac tgacatttgg 180
ctgatgtttg tgggaagttt gtgtgcattt ctccatggaa tagcccagcc aggcgtgcta 240
ctcatttttg gcacaatgac agatgttttt attgactacg acgttgagtt acaagaactc 300
cagattccag gaaaagcatg tgtgaataac accattgtat ggactaacag ttccctcaac 360
cagaacatga caaatggaac acgttgtggg ttgctgaaca tcgagagcga aatgatcaaa 420
tttgccagtt actatgctgg aattgctgtc gcagtactta tcacaggata tattcaaata 480
tgcttttggg tcattgccgc agctcgtcag atacagaaaa tgagaaaatt ttactttagg 540
agaataatga gaatggaaat agggtggttt gactgcaatt cagtggggga gctgaataca 600
agattctctg atgatattaa taaaatcaat gatgccatag ctgaccaaat ggcccttttc 660
attcagcgca tgacctcgac catctgtggt ttcctgttgg gatttttcag gggttggaaa 720
ctgaccttgg ttattatttc tgtcagccct ctcattggga ttggagcagc caccattggt 780
ctgagtgtgt ccaagtttac ggactatgag ctgaaggcct atgccaaagc aggggtggtg 840
gctgatgaag tcatttcatc aatgagaaca gtggctgctt ttggtggtga gaaaagagag 900
gttgaaaggt atgagaaaaa tcttgtgttc gcccagcgtt ggggaattag aaaaggaata 960
gtgatgggat tctttactgg attcgtgtgg tgtctcatct ttttgtgtta tgcactggcc 1020
ttctggtacg gctccacact tgtcctggat gaaggagaat atacaccagg aacccttgtc 1080
cagattttcc tcagtgtcat agtaggagct ttaaatcttg gcaatgcctc tccttgtttg 1140
gaagcctttg caactggacg tgcagcagcc accagcattt ttgagacaat agacaggaaa 1200
cccatcattg actgcatgtc agaagatggt tacaagttgg atcgaatcaa gggtgaaatt 1260
gaattccata atgtgacctt ccattatcct tccagaccag aggtgaagat tctaaatgac 1320
ctcaacatgg tcattaaacc aggggaaatg acagctctgg taggacccag tggagctgga 1380
aaaagtacag cactgcaact cattcagcga ttctatgacc cctgtgaagg aatggtgacc 1440
gtggatggcc atgacattcg ctctcttaac attcagtggc ttagagatca gattgggata 1500
gtggagcaag agccagttct gttctctacc accattgcag aaaatattcg ctatggcaga 1560
gaagatgcaa caatggaaga catagtccaa gctgccaagg aggccaatgc ctacaacttc 1620
atcatggacc tgccacagca atttgacacc cttgttggag aaggaggagg ccagatgagt 1680
ggtggccaga aacaaagggt agctatcgcc agagccctca tccgaaatcc caagattctg 1740
cttttggaca tggccacctc agctctggac aatgagagtg aagccatggt gcaagaagtg 1800
ctgagtaaga ttcagcatgg gcacacaatc atttcagttg ctcatcgctt gtctacggtc 1860
agagctgcag ataccatcat tggttttgaa catggcactg cagtggaaag agggacccat 1920
gaagaattac tggaaaggaa aggtgtttac ttcactctag tgactttgca aagccaggga 1980
aatcaagctc ttaatgaaga ggacataaag gatgcaactg aagatgacat gcttgcgagg 2040
acctttagca gagggagcta ccaggatagt ttaagggctt ccatccggca acgctccaag 2100
tctcagcttt cttacctggt gcacgaacct ccattagctg ttgtagatca taagtctacc 2160
tatgaagaag atagaaagga caaggacatt cctgtgcagg aagaagttga acctgcccca 2220
gttaggagga ttctgaaatt cagtgctcca gaatggccct acatgctggt agggtctgtg 2280
ggtgcagctg tgaacgggac agtcacaccc ttgtatgcct ttttattcag ccagattctt 2340
gggacttttt caattcctga taaagaggaa caaaggtcac agatcaatgg tgtgtgccta 2400
ctttttgtag caatgggctg tgtatctctt ttcacccaat ttctacaggg atatgccttt 2460
gctaaatctg gggagctcct aacaaaaagg ctacgtaaat ttggtttcag ggcaatgctg 2520
gggcaagata ttgcctggtt tgatgacctc agaaatagcc ctggagcatt gacaacaaga 2580
cttgctacag atgcttccca agttcaaggg gctgccggct ctcagatcgg gatgatagtc 2640
aattccttca ctaacgtcac tgtggccatg atcattgcct tctcctttag ctggaagctg 2700
agcctggtca tcttgtgctt cttccccttc ttggctttat caggagccac acagaccagg 2760
atgttgacag gatttgcctc tcgagataag caggccctgg agatggtggg acagattaca 2820
aatgaagccc tcagtaacat ccgcactgtt gctggaattg gaaaggagag gcggttcatt 2880
gaagcacttg agactgagct ggagaagccc ttcaagacag ccattcagaa agccaatatt 2940
tacggattct gctttgcctt tgcccagtgc atcatgttta ttgcgaattc tgcttcctac 3000
agatatggag gttacttaat ctccaatgag gggctccatt tcagctatgt gttcagggtg 3060
atctctgcag ttgtactgag tgcaacagct cttggaagag ccttctctta caccccaagt 3120
tatgcaaaag ctaaaatatc agctgcacgc ttttttcaac tgctggaccg acaaccccca 3180
atcagtgtat acaatactgc aggtgaaaaa tgggacaact tccaggggaa gattgatttt 3240
gttgattgta aatttacata tccttctcga cctgactcgc aagttctgaa tggtctctca 3300
gtgtcgatta gtccagggca gacactggcg tttgttggga gcagtggatg tggcaaaagc 3360
actagcattc agctgttgga acgtttctat gatcctgatc aagggaaggt gatgatagat 3420
ggtcatgaca gcaaaaaagt aaatgtccag ttcctccgct caaacattgg aattgtttcc 3480
caggaaccag tgttgtttgc ctgtagcata atggacaata tcaagtatgg agacaacacc 3540
aaagaaattc ccatggaaag agtcatagca gctgcaaaac aggctcagct gcatgatttt 3600
gtcatgtcac tcccagagaa atatgaaact aacgttgggt cccaggggtc tcaactctct 3660
agaggggaga aacaacgcat tgctattgct cgggccattg tacgagatcc taaaatcttg 3720
ctactagatg aagccacttc tgccttagac acagaaagtg aaaagacggt gcaggttgct 3780
ctagacaaag ccagagaggg tcggacctgc attgtcattg cccatcgctt gtccaccatc 3840
cagaacgcgg atatcattgc tgtcatggca cagggggtgg tgattgaaaa ggggacccat 3900
gaagaactga tggcccaaaa aggagcctac tacaaactag tcaccactgg atcccccatc 3960
agttga 3966
<---
Изобретение относится к соединению, выбранному из группы, состоящей из (S)-3-(((S)-3-бутил-5-(4-фторфенил)-3-метил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропановой кислоты; (S)-3-(((R)-3-бутил-5-(4-фторфенил)-3-метил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропановой кислоты; (R)-3-(((S)-3-бутил-5-(4-фторфенил)-3-метил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропановой кислоты; (R)-3-(((R)-3-бутил-5-(4-фторфенил)-3-метил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропановой кислоты; 1-(((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)метил)циклопропан-1-карбоновой кислоты; (S)-1-(((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)метил)циклопропан-1-карбоновой кислоты; (R)-1-(((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)метил)циклопропан-1-карбоновой кислоты; 3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2,2-диметилпропановой кислоты; (S)-3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2,2-диметилпропановой кислоты и т.д., или его фармацевтически приемлемой соли, которые являются модуляторами желчных кислот и обладают активностью ингибирования апикального натрий-зависимого переносчика желчных кислот (ASBT) и/или переносчика желчных кислот в печени (LBAT). Изобретение относится также к фармацевтической композиции, содержащей указанные соединения, и к применению этих соединений в качестве лекарственного средства, обладающего активностью ингибирования апикального натрий-зависимого переносчика желчных кислот (ASBT) и/или переносчика желчных кислот в печени (LBAT), для лечения сердечно-сосудистых заболеваний, нарушений метаболизма жирных кислот, желудочно-кишечных заболеваний и заболеваний печени. 3 н. и 4 з.п. ф-лы, 8 табл., 14 пр.
1. Соединение, выбранное из группы, состоящей из:
(S)-3-(((S)-3-бутил-5-(4-фторфенил)-3-метил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропановой кислоты;
(S)-3-(((R)-3-бутил-5-(4-фторфенил)-3-метил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропановой кислоты;
(R)-3-(((S)-3-бутил-5-(4-фторфенил)-3-метил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропановой кислоты;
(R)-3-(((R)-3-бутил-5-(4-фторфенил)-3-метил-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-гидроксипропановой кислоты;
1-(((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)метил)циклопропан-1-карбоновой кислоты;
(S)-1-(((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)метил)циклопропан-1-карбоновой кислоты;
(R)-1-(((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)метил)циклопропан-1-карбоновой кислоты;
3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2,2-диметилпропановой кислоты;
(S)-3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2,2-диметилпропановой кислоты;
(R)-3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2,2-диметилпропановой кислоты;
3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фтор-2-метилпропановой кислоты;
(S)-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фтор-2-метилпропановой кислоты;
(R)-3-((3,3-диэтил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-фтор-2-метилпропановой кислоты;
3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-метоксипропановой кислоты;
3-((3,3-дибутил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-метоксипропановой кислоты;
(S)-3-((3,3-дибутил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-метоксипропановой кислоты;
(R)-3-((3,3-дибутил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-метоксипропановой кислоты;
3-((3-бутил-3-этил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-этоксипропановой кислоты;
3-((3,3-дибутил-7-(метилтио)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2-этоксипропановой кислоты;
3-((3,3-диэтил-5-(4-фторфенил)-7-(метилтио)-1,1-диоксидо-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)-2,2-диметилпропановой кислоты и
2-гидрокси-3-((7-(метилтио)-1,1-диоксидо-5-фенил-3,3-дипропил-2,3,4,5-тетрагидро-1,5-бензотиазепин-8-ил)окси)пропановой кислоты;
или его фармацевтически приемлемая соль.
2. Фармацевтическая композиция, обладающая активностью ингибирования апикального натрий-зависимого переносчика желчных кислот (ASBT) и/или переносчика желчных кислот в печени (LBAT), которая содержит терапевтически эффективное количество соединения по п. 1 и один или более фармацевтически приемлемых эксципиентов.
3. Применение соединения по п. 1 в качестве лекарственного средства, обладающего активностью ингибирования апикального натрий-зависимого переносчика желчных кислот (ASBT) и/или переносчика желчных кислот в печени (LBAT).
4. Применение по п. 3 в лечении или предупреждении сердечно-сосудистого заболевания или нарушения метаболизма жирных кислот или утилизации глюкозы, такого как гиперхолестеринемия; нарушения обмена жирных кислот; сахарный диабет 1 и 2 типа; осложнения диабета, в том числе катаракта, микро- и макрососудистые заболевания, ретинопатия, невропатия, нефропатия и замедленное заживление ран, ишемия тканей, диабетическая стопа, артериосклероз, инфаркт миокарда, острый коронарный синдром, нестабильная стенокардия, стабильная стенокардия, инсульт, окклюзионная болезнь периферических артерий, кардиомиопатия, сердечная недостаточность, нарушения сердечного ритма и рестеноз сосудов; заболевания, связанные с диабетом, такие как инсулинорезистентность (нарушение гомеостаза глюкозы), гипергликемия, гиперинсулинемия, повышенные уровни жирных кислот или глицерина в крови, ожирение, дислипидемия, гиперлипидемия, включая гипертриглицеридемию, метаболический синдром (синдром X), атеросклероз и гипертензия; и для повышения уровня липопротеинов высокой плотности.
5. Применение по п. 3 в лечении или предупреждении заболевания или расстройства желудочно-кишечного тракта, такого как запор (включая хронический запор, функциональный запор, хронический идиопатический запор (CIC), периодический/спорадический запор, запор на фоне сахарного диабета, запор на фоне инсульта, запор на фоне хронического заболевания почек, запор на фоне рассеянного склероза, запор на фоне болезни Паркинсона, запор на фоне системного склероза, запор, вызванный лекарствами, синдром раздраженного кишечника с запором (IBS-C), синдром раздраженного кишечника смешанный (IBS-M), детский функциональный запор и запор, вызванный опиоидами); болезнь Крона; первичная мальабсорбция желчных кислот; синдром раздраженного кишечника (IBS); воспалительное заболевание кишечника (IBD); воспаление подвздошной кишки и рефлюксная болезнь и ее осложнения, такие как пищевод Барретта, желчный рефлюксный эзофагит и желчный рефлюксный гастрит.
6. Применение по п. 3 в лечении или предупреждении заболевания или нарушения печени, такого как наследственное нарушение метаболизма печени; врожденные нарушения синтеза желчных кислот; врожденные аномалии желчных протоков; атрезия желчевыводящих путей; атрезия желчевыводящих путей после проведения операции по Касаи; посттрансплантационная атрезия желчевыводящих путей; неонатальный гепатит; неонатальный холестаз; наследственные формы холестаза; церебросухожильный ксантоматоз; вторичный дефект синтеза желчных кислот (ВА); синдром Цельвегера; заболевание печени, связанное с муковисцидозом; дефицит альфа1-антитрипсина; синдром Алажиля (ALGS); синдром Байлера; первичный дефект синтеза желчных кислот (ВА); прогрессирующий семейный внутрипеченочный холестаз (PFIC), включая PFIC-1, PFIC-2, PFIC-3 и неспецифический PFIC, PFIC после отведения желчи и посттрансплантационный PFIC; доброкачественный рецидивирующий внутрипеченочный холестаз (BRIC), включая BRIC1, BRIC2 и неспецифический BRIC, BRIC после трансплантации желчных путей и BRIC после трансплантации печени; аутоиммунный гепатит; первичный билиарный цирроз (PBC); фиброз печени; неалкогольная жировая болезнь печени (NAFLD); неалкогольный стеатогепатит (NASH); портальная гипертензия; холестаз; холестаз при синдроме Дауна; лекарственный холестаз; внутрипеченочный холестаз беременности (желтуха при беременности); внутрипеченочный холестаз; внепеченочный холестаз; холестаз, связанный с парентеральным питанием (PNAC); холестаз, связанный с низким содержанием фосфолипидов; синдром холестаза с лимфедемами 1 (LSC1); первичный склерозирующий холангит (PSC); холангит, связанный с иммуноглобулином G4; первичный билиарный холангит; желчекаменная болезнь (желчные камни); желчный литиаз; холедохолитиаз; желчнокаменный панкреатит; болезнь Кароли; злокачественное новообразование желчных протоков; злокачественное новообразование, вызывающее непроходимость желчного дерева; стриктуры желчных путей; холангиопатия при СПИД; ишемическая холангиопатия; кожный зуд из-за холестаза или желтухи; панкреатит; хроническое аутоиммунное заболевание печени, ведущее к прогрессирующему холестазу; стеатоз печени; алкогольный гепатит; острый жировой гепатоз; ожирение печени при беременности; лекарственный гепатит; нарушения при перенасыщении железом; врожденный дефект синтеза желчных кислот 1 типа (BAS 1 типа); лекарственное поражение печени (DILI); фиброз печени; врожденный фиброз печени; цирроз печени; гистиоцитоз клеток Лангерганса (LCH); неонатальный ихтиоз, склерозирующий холангит (NISCH); эритропоэтическая протопорфирия (EPP); идиопатическая дуктопения в зрелом возрасте (IAD); идиопатический неонатальный гепатит (INH); несиндромальная недостаточность междольковых желчных протоков (NS PILBD); цирроз у детей североамериканских индейцев (NAIC); саркоидоз печени; амилоидоз; некротический энтероколит; токсичность сывороточной желчной кислоты, включая нарушения сердечного ритма (например, фибрилляцию предсердий) при аномальном профиле сывороточных желчных кислот, кардиомиопатию, связанную с циррозом печени («холекардию»), и истощение скелетных мышц, связанное с холестатической болезнью печени; поликистоз печени; вирусный гепатит (включая гепатит A, гепатит B, гепатит C, гепатит D и гепатит E); гепатоцеллюлярная карцинома (гепатома); холангиокарцинома; рак желудочно-кишечного тракта, связанный с желчными кислотами; и холестаз, вызванный опухолями и новообразованиями печени, желчевыводящих путей и поджелудочной железы; или в усилении терапии кортикостероидами при заболевании печени.
7. Применение по п. 3 в лечении или предупреждении синдромов гиперабсорбции (включая абеталипопротеинемию, семейную гипобеталипопротеинемию (FHBL), болезнь задержки хиломикронов (CRD) и ситостеролемию); гипервитаминоза и остеопетроза; гипертензии; клубочковой гиперфильтрации; поликистоза почек (PKD), включая аутосомно-доминантный поликистоз почек (ADPKD) и аутосомно-рецессивный поликистоз почек (ARPKD); и кожного зуда при почечной недостаточности; или в защите от повреждения почек, связанного с заболеванием печени или метаболическим заболеванием.
| СОЕДИНЕНИЯ БЕНЗОТИАЗЕПИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ ЖЕЛЧНЫХ КИСЛОТ | 2020 |
|
RU2817535C2 |
| Станок для придания концам круглых радиаторных трубок шестигранного сечения | 1924 |
|
SU2019A1 |
| Станок для придания концам круглых радиаторных трубок шестигранного сечения | 1924 |
|
SU2019A1 |
| ИНГИБИТОРЫ IBAT ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ПЕЧЕНИ | 2011 |
|
RU2591188C2 |
Авторы
Даты
2025-06-05—Публикация
2021-08-03—Подача