00
о со ю 1 Изобретение относится к производным 6,6 метилен-бнс (2,2,4-триметил-1,2-дигвдрохиноли (МТДХ) оби (ей формулы Н ч и Хг - Н, SOjNa, ЗОзСа или , 2 При условии, что оба они не могут быть одновременно водородом, обладающим радиозащитным действием, а также способностью повьЕиать чувствительност к облучению гипосимических клеток. Известен 6,б-метилен-5ыс(2,2,4-триметш11,2-дигидрохинолин), обладающий способност повышать чувствительность опухолей к облучению 1. Цель изобретения - поиск новых соединений в ряду 1,2-дигидрохинолина, которые защищают здоровые ткани от действия облучения, поскольку обладают радиозащитными свойствами и в то же время селективно повыщают чувствительность к облучению гилосимических клеток. Поставленная цель достигается новыми про изводными 6,6 -метилен- ис (2,2,4-триметил-1,2 -дагидрохинолирга) формулы (1), обладающими радиозащитным действием и способностью повышать чувствительность к облзчению гипосимичсских клеток. Предаагаемые соединения получают сульфированием б,б -метилен-бг/с(2,2,4-триметил-1,2-дигидрохинолина) серной кислотой с последующим переводом в соль или сульфонамид известными способами. Пример 1. 358 г 6,6-метилен- ыс (2,2,4-триметил-1,2 -дигидрохинолин) растворяют в 1000 г 96%-ной серной кислоты и смес перемешивают при 80-95 С до образования прозрачного раствора, после чего ее вливают в насыщенный раствор хлористого натрия. Реакционная смесь охлаждается и при этом выпадает осадок 6,6-метилен-5//с(2;2-диметил-4-метаисульфокислота-Ма-1,2-дигидрохинолина) Д)}я очистки сырого продукта его смещива ют с водной суспензией эквимолекулярного количества гироокиси кальция и растворимую в воде кальциевую соль дисульфированного продукта отделяют путем фильтрования, а к водному раствору добавляют эквимолекуляр ное количество хлористого натрия. Выпадаю щий осадок карбоната кальция отфильтровывают, а образующийся 6,6-метилен-б с(2,2диметил-4-метансульфокислота-Ыа-1,2-дигидрохи нолин) выделяют после упаривания водного раствора. (Ьлучснный продукт можно пере92кристаллизовать из смеси воды и метанола, взятых в объемном соотнощении 1:1. Выход Вычислено: мол.в. 562; S 11,38%. Найдено: мол.в. 559; S 10,82%. Пример 2. В колбе, снабженной мешалкой, термометром, газоотводной трубкой и капельной воронкой, перемещивают 358 г 6,6 -метилен-5мс (2,2,4-триметил-1,2-дагидрохинодина) в 1500 г метиленхлорида. При охлаждении и перемешивании к раствору добавляют 350 г хлорсульфокислоты, поддерживая температуру 5-20° С. Реакционную смесь перемешивают затем при комнатной температуре до прекращения выделения газообразного хлористого водорода, после чего ее выливают на 300 г измельченного льда и отсасывают на фильтре выпадающий в осадок 6,6-метилен-(2,2-диметил-4-метансульфохлорид-1,2-дигидрохинолин-2 ,2 ,4 -триметил-1 ,2 -дигидрохинолин). 365 г полученного таким образом сырого моносульфохлорида кипятят с 15%-ным водным раствором гидроокиси натрия пока рН раствора не будет 7,2. Выпадающую в осадок натриевую соль моносульфокислоты после охлаждения отделяют и очищают, получая кальциевую соль, как в примере 1. В результате получают 345 г 6,6-метилен-(2,2-диметил-4- метансульфокислота- N а-1,2- дигидрохинолин-2 ,2 ,4 -триметил-1 ,2-дигидрохинолина). Пример 3. 365 г полученного по примеру 2 6,6-метилен-(2,2-диметил-4-метансульфохлорид-1,2-дигидрохинолин-2 ,2 ,4. -триметил-1 ,2-дигидрохинолйна) растворяют в 500 мл воды и добавляют к полученному раствору при перемешивании 300 мл 20.-ного раствора гидрата окиси аммония. Смесь нагревают до 70°С. При охлаждении выпадает осадок 6,6-метилен- (2,2-диметил-4-метаисульфонамид-1,2-дигидрохинолин-2 ,2 ,4-триметил-1 ,2-дигидрохинолина), который отсасывают на фильтре и псрекристаллизовывают из с.меси метанола и коды, взятых в объемном соотношении 1:1. В результате получают 315 г продукта, мол. в. которого, определенный с помощью збулиоскопии, равен 437 (рассчитанный мол. в. 441). Активность предлагаемых соединений определяют in vitro, для чего измеряют их ингибирующее действие на полимеризацию акриловой кислоты при 60° С и сравнивают с аналогичным действием 3,5-ди-7/ сГ-бутил-4-окситалуола (БОТ) и L-аскорбиновой кислоты. Тем самым определяют способность соединений к связыванию радикалов. Время, ч, необходимое для полимеризации для ка/кдого сое;щнсния приведено мнже. Контрольный ОПЬЕТ16 БОТ, 0.02%120 L-Аскорбиновая кислота, 0,02%18 МДТХ-дисульфокислота, 0,02% 400 Из опытов по определению острой токсичноСти соединений, проведе1шых на мышах, установлено, что при однократном введении, со лей щелошо-земельных металлов моно- и дисульфокислот, соответственно моно- и дисуль фонамидных производных, в количестве 5 г/кг смертность в течение 10 дней составляет 0%, т. е. DL 50 выше 5 г/кг. При парентеральном введении при дозе 3 г/кг смертность составляет 0%. Проводившиеся в течение 90 дней испытания на токсичность показали, что при введении в организм соединений в количестве 250 мг/кг веса подопытного живот ного они не оказывают токсического действия Новое действие предлагаемых соединений исследуют вначале при облучении всего организма подопытного животного. В качестве подопытных животных используют CFLP-мышей со средним весом 20-22 г, В каждой группе 8 самцов и 8 самок. Все тело животных контрольной группы облучают дозой 7 Ги. Тем мышам, на которых изучают действие соединений, в течение 10 дней вводят перорально новое антиокислительпое средство в количестве 0,5 г/кг в день. После окончания указанного курса лечения все тело подопытных животных облучают дозой 7 Ги. Существенной разницы в действии различных водорастворимых антиокислительных активных веществ не габлюдается. В результате опытов установле ю, что по истсчеш-ш месяца из KOFITрольной гругиты в живых остались две мыши, тогда как из группы мышей, прошедших курс лечения, в живых осталось в среднем 12 мышей, Д)1Я Х -распределения это дает р ;0,001. В случае DLgo-Дозы модификационный фактор равен 3,5. Модификационный фактор (МФ) означает отношение смертности животных контрольной группы к смертности животных, прошедших курс лечения. Перед облучением подопытных животных ОЬ9о-ДОзой (прсдпочтительно за 2 ч) им вводят парентерально 1000 мг/к живого веса натриевой соли МТДХ-дисульфокислоты. Зашитнос действие соединений при этом составляет 100%. Известные радиозащитные соединения, такие как цистеин, цистеамин (|1)-меркаптоамин), ЛЕТ (S-2-ампноэтилизотИуропийдигидробромид) и 5-2/3-а пиюпропиламии)-этилтио(})осфориая кислота (WP-2721) эффективны только при субтоксичных дозах, и продолжительность их действия после введения очень мала. Известно. что соединения, обладающие радиозащитиыми свойствами, лучше зашишают клетки здоровых тканей, че.м клетки злокачественных опухолей. Другое преимущество предлагаемых соединений заключается в том, что концентра1шя плазмы водорастворимого антиокислителя на порядок выше, чем соответствующая величина МТДХ. При определении концентра1ши плазмы в ней наряду с неразложивцшмся соединением, являющимся, по-видимому, первым метаболитом, обнаружен также МТДХ, образовавшийся в результате десульфирования. При этом концентрация МТДХ такова как если бы в организм вводили не предлагаемое соединение, а сам МТДХ. МТДХ обнаружен также и в печени. Радиозащитное действие водорасторимых антиакислителсй можно объяшить тем, что энергия излучения концентрируется в первую очередь на веществе, обладающем антиоккслительными свойствами и, кроме того, стабилизирующим действием зтих веществ на мембраны. Поэтому образующиеся под действием облучения радикалы и перекиси теряют свою активность в насыщенных кислородом клетках. Преимущество новых сульфопроизводных заключается также в том, что в то время как они защищают здоровые клетки от радиоизлучения, образующийся при учительном систематическом введении их в оргаиизг/t МТДХ повышает чувствительность к облучению гипоксимических клеток. Новые активные вещества могут, таким образом, использоваться для лечения псех тех опухолей, для лечения которых используется МТДХ. В опухолях на стадии их развития до половины жизни и в метастазах непрерывно возрастает концентрация свободных радикалов и перекисей, обнаруживаемь(х с помощью электроспипового резонанса (ЭСР). Канцерогенные вещества, имеющиеся в окружающей среде, играют существенную роль при возникновении злокачественн1 1х опухолей. Эти вещества содержат свобо Ц ые радикалы или способствуют их образованию в живом организме. Можно поэтому ожидать, что соедине1шя с антиокислительными свойствами, нейтрализующие активность радикалов, оказывают антикапцерогениое действие. Благодаря тому, что предлагаемые соединения контролируют реакции свободных рагшкалоп, они могут использоваться для терапевтических и профилактических целей. Это доказано на модельной системе, в качестве которой использовали гепатотоксическое и в то же время канцерогенное вещество, а именно диметилсу.чьфоксид. 0,3 мл димстилсульфоксида в виде водного раствора вводили парентерально или подкожно мыишм. При этом в течение 10 дней 7 из 0 подопытных ж-ивотиых погибли. Если же мьипам вводили парентерально или подкожно 100 мг дисульфокислоты или 60 мл }щсульфоамида, растворенJ1НЫХ или суспендированных в смеси воды и диметилформамида, го смертность составляла 0%, т. е. наблюдалось 100%-ное защитное дшствие. Механизм действия новых антиокнслителБНых веществ до конца не выяснен. Тем не менее тормозящее действие их на развитие опухолей убедительно доказано: в присутствии большого количества витамина С (1-Нафтиламин не вызывает рака мочевого пузыря, а в тех случаях, когда в пищевые продукты добавляют антиокислительные веще тва, количество пациентов с раком толстой кищки и раком желудка, а также смерность среди них ниже. До настоящего времени известные синтегические вещества с ярко выраженными антиокислительными свойствами нельзя было использовать в терапии вследст вие их токсичности и неблагоприятных фарма кокинетических средств. Водорастворимые нетоКсические и в то же время высокоэффективные антиокислительные средства могут таким образом применяться не только в терапии, но и при профилактике в случае всех канцерогенных веществ и предшественников (чапример бензопирина, диметилбензантрацена в случае предшественников KaKueporefmbix нитрозоаминоп и т. д.), когда канцерогенное действие связано с реакциями свободных радикалов. При этом они могут вводиться в ор ганизм перорально или парентерально. Предложенные соединения также способствуют снижению или увеличению чувствительно ти к радиоизлучению в период от 30 мин до 6 ч после радиации. Эти соединения повышают токсичность оксигенного зффекта у новорожденных крыс и помеще1тя их в инкубато Вещества, обладающие антиокислительными свойствами, тормозят распад хлорзстерола и
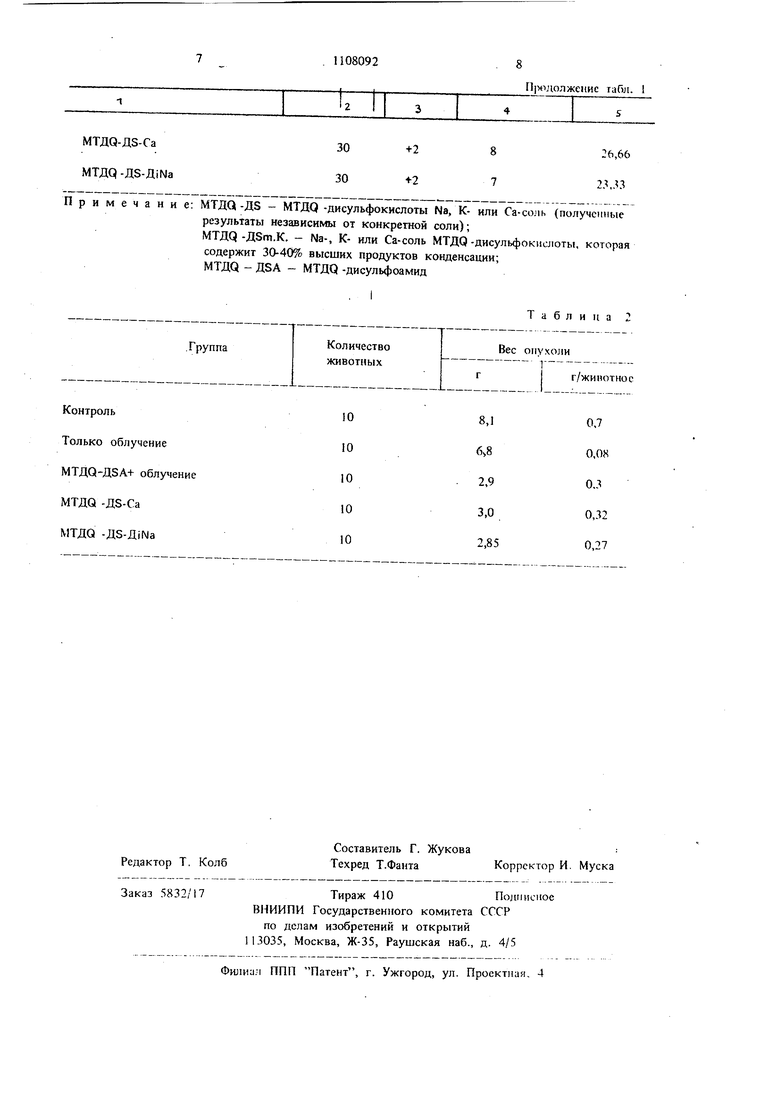
Таблица I 1нОгут таким образом использоваться при ле- ченни атеросклероза, а также болезней с на(гледственной дегенерацией, например болезни Саирмайера-Фогта, или некоторых типов гемолитической анемии новорожденных и цирроза печени, т. е. в тех случаях, когда при возникновении болезней или их патогенезе играют роль реакции свободных радикалов. Радиозащитное действие предлагаемых соединений доказывается представленными в виде таблиц результатами опытов, осуществленных в оптимальный момент. Знак (-) означает, что осуществляли обработку до облучения, знак (+) показывает, что фармацевтическую композицию использовали лишь после облучения. В табл. 1 представлены результаты изучения радиозащитного действия в случае самцов CFLP мыщей. Доза 7 Ги (700 Р), облучение всего тела, I г/кг, интраперитонеапьно, одноразовая доза. Момент оценки 30 мин после облучения. В табл. 2 представлены результаты изучения общего действия медикаментов и облучения после предварительной обработки самцов CFY крыс с Yoshida solid опухолью (100 г). Введе1ше лекарства: 8 да1ей предварительной обработки и непрерывная обработка после облучения, 200 мг/кг в день , перорально. Комбинированная обработка: 1-8 дней пред-. варительной обработки; 9 дней имплантация опухо;(и, подкожно, при стерильных условиях. На 19-й день облучение 3 Гй (300 Р), на 35-й день животных умерщвляют. Таким образом, получены новые соединения, обладающие ценными фармакологическими свойствами.
Г1|1 1долже11ие rafui.


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных сульфокислот 1,2-дигидрохинолина | 1980 |
|
SU990083A3 |
| (2,2-Диметил-1,2-дигидрохинолин-4-ил)метилсульфокислота или ее натриевая соль, как антиокислитель в добавках к кормам | 1980 |
|
SU975710A1 |
| Способ получения (2,2-диметил-1,2-дигидрохинолин-4-ил)-метилусульфокислоты или ее солей | 1980 |
|
SU888818A3 |
| Способ фармакологической защиты от ионизирующих излучений | 2017 |
|
RU2663465C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ДЛЯ ВЫВЕДЕНИЯ РАДИОЦЕЗИЯ ИЗ ОРГАНИЗМА ЖИВОТНЫХ | 2011 |
|
RU2497376C2 |
| 8-ГИДРОКСИ-2,2,4-ТРИМЕТИЛ-1,2-ДИГИДРОХИНОЛИН ИЛИ ЕГО БРОМИСТОВОДОРОДНАЯ СОЛЬ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2001 |
|
RU2209206C1 |
| РАДИОЗАЩИТНОЕ СРЕДСТВО | 2010 |
|
RU2428192C1 |
| Способ лечения радиационных поражений организма и способ получения биологического препарата для лечения радиационных поражений организма | 2020 |
|
RU2760551C1 |
| СРЕДСТВО ДЛЯ ПРЕДУПРЕЖДЕНИЯ ЛУЧЕВОЙ БОЛЕЗНИ | 1998 |
|
RU2161973C2 |
| Биологически активное средство, обладающее антимутагенным действием | 2023 |
|
RU2823630C1 |
Производные 6,6-метилен-бис 
мтда-дз-са
30 30
МТДр-Д5-Д Ыа
Примечание: МТДЦ-Д5 - МТДО -дисульфокислоты Na, К- или Са-соль (полученные результаты независимы от конкретной соли);
MTДQ-ДЗт.К. - Na-, К- или Са-соль МТДО-дисульфокиолоты, которая содержит 30-40% высших продуктов конденсации; МТДа - ДВА - МТДО -дисульфоамид
ГруппаКоличестваВес опухоли
животных1
Контроль108,10,7
Только облучение106 80,0«
МТДО-Д5А+ облучение102,90.3
МТДО Д5-Са103,00,32
МТДО -Д5-Д Ыа102,850,27
8
26,66
7 23,33
Таблица 2
гг/жипотнос
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Патент США № 4025631, кл | |||
| СПЕКТРОМЕТР СОВПАДЕНИЙ | 1973 |
|
SU424256A1 |
| Шеститрубный элемент пароперегревателя в жаровых трубках | 1918 |
|
SU1977A1 |
Авторы
Даты
1984-08-15—Публикация
1980-11-17—Подача