fTf A/v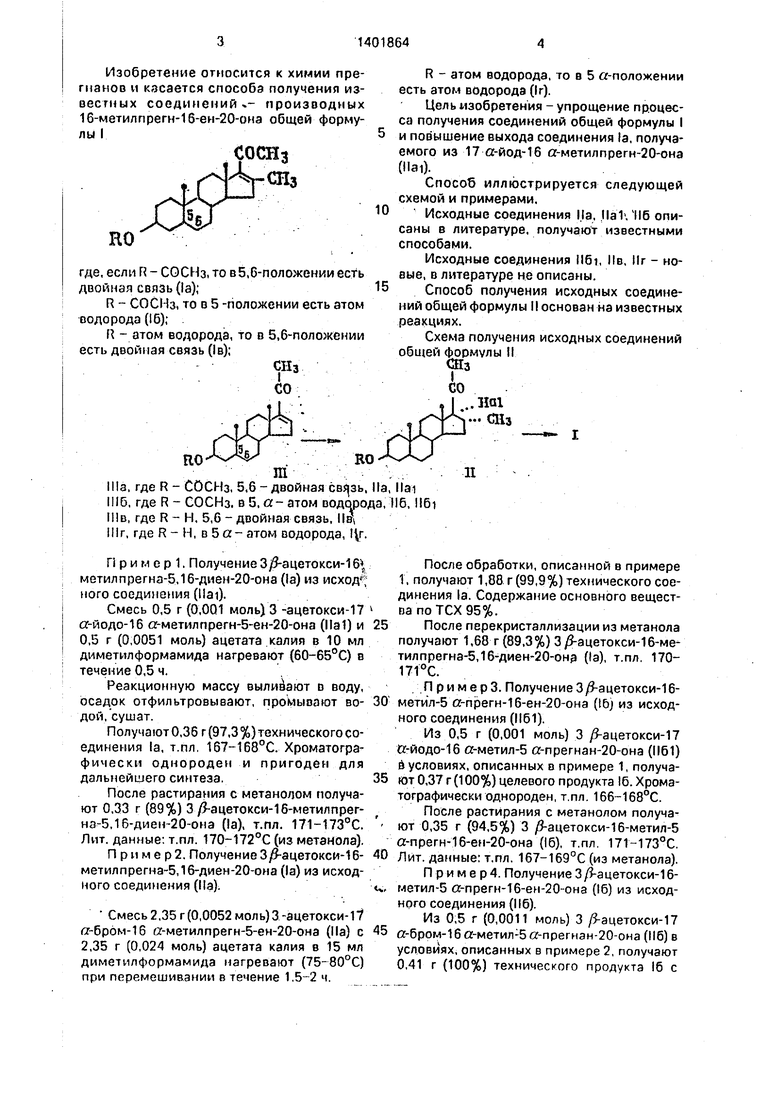


| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ НОВЫХ 3β-АЦЕТОКСИ-17α-ГИДРОПЕРОКСИ-16α-МЕТИЛПРЕГНАНОВ ИЗ Δ-20-КЕТОСТЕРОИДОВ И СПОСОБ ПОЛУЧЕНИЯ 3β-АЦЕТОКСИ-17α-ГИДРОКСИ-16α-МЕТИЛПРЕГНАНОВ С ИСПОЛЬЗОВАНИЕМ 3β-АЦЕТОКСИ-17α-ГИДРОПЕРОКСИ-16α-МЕТИЛПРЕГНАНОВ | 2009 |
|
RU2418805C1 |
| Способ получения 5- -бром-6 фторпроизводных прегнана | 1972 |
|
SU568372A3 |
| СПОСОБ ПОЛУЧЕНИЯ 6-ДЕГИДРО-6-МЕТИЛГИДРОКОРТИЗОНА ИЛИ ЕГО ЭФИРОВ ИЗ 21-АЦЕТАТА ГИДРОКОРТИЗОНА | 2017 |
|
RU2663893C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6α-МЕТИЛГИДРОКОРТИЗОНА ИЛИ ЕГО ЭФИРОВ ИЗ 21-АЦЕТАТА ГИДРОКОРТИЗОНА | 2017 |
|
RU2663484C1 |
| СТЕРОИДЫ, СПОСОБ ПОЛУЧЕНИЯ СТЕРОИДОВ, СПОСОБ ПОЛУЧЕНИЯ 16-МЕТИЛЕНСТЕРОИДОВ, СОЕДИНЕНИЯ | 1992 |
|
RU2099346C1 |
| Способ получения производных 6 -фтор-16 ,18-диметил1,4-прегнадиен-3,20-диона | 1971 |
|
SU504493A4 |
| Способ получения 21-ацетокси-6 фтор-4-прегнен-3,20-дионов | 1973 |
|
SU524522A3 |
| ПРОИЗВОДНЫЕ ПРЕГНАНА, НЕЗАМЕЩЕННЫЕ В 17α-ПОЛОЖЕНИИ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОМЫШЛЕННЫЕ ПРОДУКТЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2177951C2 |
| Способ получения производных 6 -фтор-16 ,18-диметил-1,4прегнадиен-3,20-диона | 1971 |
|
SU468409A3 |
| СПОСОБ ПОЛУЧЕНИЯ 11БЕТА, 17АЛЬФА, 21-ТРИГИДРОКСИ-16АЛЬФА-МЕТИЛ-9АЛЬФА-ФТОРПРЕГНА-1,4-ДИЕН-3,20-ДИОНА (ДЕКСАМЕТАЗОНА) ИЗ ФИТОСТЕРИНА | 2013 |
|
RU2532902C1 |
изобретение касается химии прегнанов, в чааноаи получения производных 16-мetилпpeгн- 16-ен-20-она общей формулы 1, где а) R-C(0)CH и в положении 5 - 6 - двойная связь; б) R-C(0)CH и в положения 5а - водород- в) R - И и В положении 5-6- двойная свйзь; г) R - Н и в положении 5 5а - водород используемых в синтезе глкжококортикоидных веществ. Цель - упрощение процесса Последний ведут из соединения общей ф-лы 2, где 1) при а Hal - Вг, 1; 2) при б Hat - Вг, 1; 3) при в Hal - I; 4) при г Hal - I; 5) в случае R-C{0)Cy и в положении 5 - 6 - двойная связь Hal - 1. и ацетата калия в среде диметилформами- да лри 60 - 80 . Указанные соединения ф-лы 11 - новые вещества, получаемые известным методом. Способ позволяет снизить температуру процесса.; сократить расход дегидрогаяоидирующего агента в два раза, исключить необходимость ис- ,пользования инертного . получить целевой продукт с высокой чистотой (95 - 96%) и выходом до 99.9%. а также расширить группу исходных веществ. 1 З.П. ф-лы.
СИ
I
со .Hal
CJi
J
О I- ОС
ov
4
Изобретение относится к химии пре- гианов и касается способа получения известных соединений - произеодных 1б-метилпрегн-1б-ен-20-она общей формулы I
СОСНз Шз
где, если R- СОСНз.то в5,6-лоложенииест ь двойная связь (1а);
R - СОСИз, то в 5 -положении есть атом водорода (16);
R - атом водорода, то в 5,6-положении есть двойная связь (1в);
СИз
СО
Ilia, где R - СОСНз, 5,6 -двойная , Па, llai 1116, где R - СОСНз. в 5, а- атом водорода, 116, Il6i IllB, где R - Н, 5,6 - двойная связь, 1|Д Illr, где R - Н, в 5а- атом водорода, .
П р и м е р 1. Получение 3; -ацетокси-16| метил прегна-5,16-диен-20-она (1а) из исход ; него соединения (llai).
Смесь 0,5 г (0,001 моль) 3 -ацетокси-17 сг-йодо-Тб а-метилпрегн-5-ен-20-она (Па1) и 25 0,5 г (0,0051 моль) ацетата калия в 10 мл диметилформамида нагревают (60-65°С) в течение 0,5 ч.
Реакционную массу выливают в воду, осадок отфильтровывают, промывают во- 30 дои, сушат.
Получают 0,36 г (97,3%) технического соединения 1а, т.пл, 167-168°С. Хроматогра- фически однороден и пригоден для дальнейшего синтеза.35
После растирания с метанолом получают 0,33 г (89%) 3 Дaцeтoкcи-16-мeтилпpeг- нa-5,16-диeн-20-oнa (1а), т.пл. . Лит. данные: т.пл. 170-172 С (из метанола).
П р и м е р 2. Получение 3/ ацетокси-16- 40 метилпрегна-5,16-диен-20-она (1а) из исходного соединения (Па)..
Смесь2,35г(0,0052моль)3-ацетокси-17 а-бр6м-16 а-метилпрегн-5-ен-20-она (На) с 45 2,35 г (0,024 моль) ацетата калия в 15 мл диметилформамида нагревают (75-80°С) при перемешивании в течение 1.5-2 ч.
0
5
R - атом водорода, то в 5 а-положении есть атом водорода (1г).
Цель изобретения - упрощение процесса получения соединений общей формулы I и повышение выхода соединения 1а, получаемого из 17 а-йод-1б а-метилпрегн-20-она (llai).
Способ иллюстрируется следующей схемой и примерами.
Исходные соединения Па, Ila1 115 описаны в литературе, получают известными способами.
Исходные соединения Пбг, Ив, Иг - новые, в литературе не описаны.
Способ получения исходных соединений общей формулы II основан на известных реакциях.
Схема получения исходных соединений общей формулы И
После обработки, описанной в примере Т, получают 1,88 г (99,9%) технического соединения 1а. Содержание основного вещества по ТСХ 95%.
После перекристаллизации из метанола получают 1,68 г (89,3 %) 3 /8-ацетокси-16-ме- тилпрегна-5,16-диен 20-онэ (ta), т.пл, 170- 171°С.
. .П римерЗ. ПолучениеЗД-ацетокси-16- метил-5 а-прегн-16-ен-20-она (I5j из исходного соединения (1161).
Из 0,5 г (0,001 моль) 3/5-ацетокси-17 С:-йодо-16 а-метил-5 о:-прегнан-20-она (1161) и условиях, описанных в примере 1, получают 0,37 г (100%) целевого продукта 16. Хрома- тографически однороден, т.пл. 166-168°С.
После растирания с метанолом получают 0,35 г (94,5%) 3 /3-ацетокси-16-метил-5 а-прегн-16-ен-20-она (16), т.пл. 171-173°С. Лит. данные: т.пл. 167-169°С(из метанола).
При м е р4. Получение 3/ -ацетокси-16- метил-5 о:-прегн-16-ен-20-она (16) из исходного соединения (116).
Из 0,5 г (0,0011 моль) 3 / -ацетокси-17 а-6ром-16а-метил-5а-прегман-20-она (116) в условиях, описанных в примере 2, получают 0,41 г (100%) технического продукта 16 с
содержанием основного вещества по ТСХ 97%.т.пл. 165-16б°С.
После растирания с метанолом получают 0,38 г (92,7%) 3 / ацетокси-1б-метил-5 а-прегн-1б-ен-20-она (16), т,пл. 169-172 0.
П р и м е р 5. Получение 3/9-гидрокси-16- метилпрегна-5,16-диен-20-она (1в) из исходного соединения (Ив).
Из 0,88 г (0,00176 моль) 3 Д-гидрокси-17 а-йодо-16 а-метилпрегн-5-ен-20-она (Ив) в условиях, описанных в примере 1, получают 0,62 г(98,4%) целевого продукта 1в содержанием основного вещества (по ТСХ) 97%,
После перекристаллизации из этилаце- тата получаютО,55г(87,3%)3/ -гидрокси-16- метилпрегн-5,16-диен-20-она (1в), т,пл, 191-192°С, Лит, данные: т.пл, 193-195°С.
П ри мер 6. ПолучениеЗу5-гидрокси-16- метилпрегн-16-ен-20-она (1г) из исходного соединения (Иг),
Из 0,27 г (0,00058 моль)ЗуЗ-гидрокси-17 а-йодо-1 6 а-метил-5-й:-прегн-16-ен-20-она (Иг), в условиях, описанных в примере 2, получают 0,19 г целевого продукта 1г.
Выход количественный. Содержание основного вещества (по ТСХ) 96%. т.пл. 176-180°С.
После перекристаллизации из отилово- го спирта получают 0,15 г(79%)3-гидрокси- 16-метилпрегн-16-ен-20-она (г), т.пл, 183-184°С. Лит. данные: т.пл. 183-185°С(из эфира петролейного эфира).
Пример 7. Получение соединения 16 (температура ниже 60°С).
К 0,2 г (0,00044 моль) 3 /З-ацетокси-17 (7-бром-16 а-метил-5 а-прегнан-20-она (Пб) добавляют 0,2 г ацетата калия и нагревают (52-54°С) при перемешивании в течение 13 ч. После обработки, описанной в примере 1, получают 0,16 г (99%) 3 / -ацетокси-16-ме- тил-5 а-прегн-16-ен-20-она (16) качества, идентичного описанному в примере 4,
П р и м е р 7а. Полученное 3,/ -ацетокси- 16-метилпрбгна-5,16-диен-20-она (1а) (температура ниже 60°С).
0,5 г (0,001 моль}3 ацетокси-17а-йодо- 16а-метилпрегн-5-ен-20-она (Иа1) нагревают с 0,5 г ацетата калия в 10 мл диметилформамида при 45-50°С в течение 3 ч. Конец реакции контролируется исчезновением исходного соединения (Hal) по ТСХ.
После обработки, описанной в примере 1, получаюг 0,35 г (94,3%) 3 / -ацетокси-16- метилпрегна-5,16-диен-20-она (1а), идентичного описанному в примере 1.
Пример8(с использованием в качестве дегалоидирующего агента ацетата натрия или ацетата бария).
1 г (0,0002 моль) 3/ -ацетокси-17 (/-йодо- 16 а-метилпрегн-5-ен-20-она (llai) нагревают с 1 г ацетата натрия (или ацетата бария) в 20 мл диметилформамида в течение 7 ч. 5По ТСХ в реакционной массе есть следовое количество 3 ацетокси-16-метилп- регн-5,16-диен-20-она (1а), на основной продукт - исходное соединение (llai).
Пример9(с использованием в каче- 0 стве растворителя ацетона).
1 г (0,002 моль) 3./ -ацетокси-17 а-йодо- 16 а-метилпрегн-5-ен-20-она (Па 1) кипятят в
15мл ацетона с 1 г ацетата калия в течение 9-10 ч.
5 По данным ТСХ в реакционной массе остается-около 10% исходного соединения llai.
Пример 10 (с использованием е качестве растворителя ацетонитрила),
01 г (0,002 моль) 3/ -ацетокси-17 а-йодо16сг-метилпрегн-5-ен-20-она (llai) в 15 мл ацетонитрила кипятят с 1,5 г ацетата калия в течение 9 ч.
По данным ТСХ реакционная масса со- 5 держит в основном исходное соединение llai.
Примеры получения исходных соединений общей формулы М.
Пример 11. Получение 3/ -ацетокси-17 0 а-йодо-16 а-метил-б С :-прегнан 20-она (Il6i), К суспензии 2 г (0,0056 моль) 3 Д-aцeтoк- cи-5a-пpeги-16-eн-20-oнa (1116) в 50 мл тет- рагидрофурана и 0,18 г монохлористой меди, охяажденной до (-10°С), при перема- 5 шивании и в токе азота добавляют 9 мл эфирного раствора метилмагнийбромида при температуре (-5°)С. Через 5 мин к реакционной массе в один прием добавляют 1,7 г (0,0067 моль) йода, перемешивают 5 мин, 0 К реакционной массе приливают 5 мл 10%- ного раствора тиосульфата натрия и 100 мл . 20%-ного раствора хлористого аммония. Верхний слой отделяют и выливают в 300 мл воды. Осадок отфильтровывают, промыва- 5 ют водой, сушат.
Получают 2,63 г (93,9 %) 3 /б-ацетокси- 7 а-йодо-16 С Г-метил-5 о:-прегнан-20-она (Il6i) в виде белого кристаллического порошка, нерастворимого в воде, растворимого в хло- роформе, бензоле, ацетоне, т.пл. 130-132°С (из метанола),
ИК-спектр,- 1730, 1700. Масс-спектр: М отсутствует. 373 (М -J). ПМР-спектр (CDCis). д , м.д.: 0,82 с, 0,86 5 с (СНз анг.), 1.12 д (СНз при Cie), 2,02 с (СНзСОО), 2.49 с (СНзСО). 4.67 м (Н при Сз). Найдено. %: С 57,99; Н 7.64.
C24H37J03
Вычислено. %: С 57.60; Н 7,45.
Пример 12, ПолучениеЗ/ -гидрокси-17 «-(юдо-Тб а-метилпреги-5-е11-20-оиа (Ив).
Из 2 г (0,0064 моль) 3 /3-гидроксипрегн- 5,|0-диен-20-011а (1Ив) в условиях, описзн- fibix о примере 11. получают 2.4 г (82,3%) 3 /3-П1дрокси-17(2;-йодо-1бс :-метилпрегн-5-ен- 20-она (Ив) в виде белого кристаллического порошка, нерастворимого в хлороформе, спиртах, ацетона, т.пл. 112-115°С (из этилового спирта).
ИК-спектр. 3320, 1690.
Масс-спектр: 456 (М% 438 (М - НаО). 339(), 311 (M -J-H20).
ПМР-спектр, д , М.Д.: 0,92 с, 1,04 с (СНз aijr.), 1,16 д (СНз при CIG). 2,54 с (СНзСО), 5,:}6 м (i I при Сб).
Найдено, %: С 57,41; Н 7,51.
I C22H33J02
I Вычислено, %: С 57,90; Н 7,29.
I П рпмер 13. ПолучениеЗ/З-гидрокси-17 а-р10Ао-16 а-метил-Б а-прегнан-20-она (Иг).
Из 2 г 3 /З-гидрокси-5 а-прегн-16-ен-20- он а (1116), как в примере 11, получено 1,9 г (65%) 3 /З-гидрокси-17 а-йодо-16 а-метил-В а-прегнан-20-она в виде белого кристалли- чс|ского порошка, нерастворил ого в воде, растворимого в спиртах, ацетоне, хлоро- Ф0рме, т.пл. 168-170°С (из ацетона - гекса 4).
I ИК-спектр, см 3430, 1685.
i Масс-спектр: 458 (М), 331 (ivf -J), 288 (КГ-J -.СОСНз).
ПМР-спектр. д , м.д,: 0,80 с, 0,86 с (СНз ailir.), 1,12 д (СНз при Cie). 2,49 с (СНзСО), 3,160 м(Н при Сз).
; Пример 14. Получение3 б-ацетокси-17 а-|бром-16 «-метил-5 а-прегнан-20-она (116).
Из 2 г (0,0056 моль) 3 /З-ацетокси-5 а- п|эегн-16-ен-она (1Иб) в условиях примера 11 п|элучают 2,38 г (85%) 3 /З-ацетокси-17 «- б|5ом-16 а-метил-5 а-прегнан-20-она (116), Т.1ПЛ.. 153-155°С (из гексана, метанола, аце- т(|)нитрила). Лит, данные: т.пл. 138-142°С(из мбтанола),
ИК-спектр, 1720, 1700. Масс-спектр: 452 (М, 373 (М -J). ПМР-спектр, д, м,д.: 0,82 с (СНз анг.), 1 т Д (СНз при Ci6). 2,02 с (СНзСОО), 2,36 с (фНзСО), 4,69м (Н при Сю).
Фор мула изобретения
Из-за расхождения температуры плавления 116 с описанной приведены данные элементного анализа.
Найдено, %: С 63,89; Н 8,15; Вг 17,58, 5С24Нз7ВгОз
Вычислено, %: С 63,57; Н 8,22; Вг 17,62. Пример 15. 0,5 г (0,001 моль) 3 /З-ацетокси-17 а-йодо-16 а-метил-5 а-пре- 10 гнан-20-она и 0,1 г (0,001 мрль) ацетата калия в 10 мл диметилформамида нагревают 1,5 ч при 60-70°С. После обработки описанной в примере 1, получают 0,36 г (98%) целевого продукта 16 с качеством, указанным 15 в примере 1.
Способ позволяет упростить процесс, а именно;
значительно снизить температуру про- 20 цесса;
сократить расход дегидрогалоидирую- щего агента в 2 раза;
использовать более дешевый дегидро- галоидирующий агент - ацетат калия вместо 25 бромистого лития и карбоната лития;
исключить Использование инертного газа;
получать целевой продукт с высоким содержанием основного вещества без очист- 30 ки;
повысить выход очищенного целевого продукта 1а на 64%;
расширить группу исходных продуктов для синтеза целевых соединений общей 35 формулы I..
(56) Патент США N 312602, кл. 260-239, 57, 1964.
H.Reimann, O.Lagneetko Sarre. The 40 Synthesis of 17-Biomo-16 a-methyl- progesterones.-J. Org. Chem., 32(7), 1967, 2321-2324.
Патент США N 3422123, кл, 260-397,4, опублик. 1969.
45 P. de Ruggieri VM (1) Steroid 16-Metil- pregnani.- II. Farmaco. XVI, N: 7, 1961, 583- 590.
Патент США № 3070614, кл, 260-397.4, 1962,
где, если R - СОСНз, то в 5,6-положении есть двойная связь (1а);
R - СОСНз, то в 5 а -положении есть
атом водорода (16); R - Н, то в 5,6-положении есть двойная
связь (1в);
R - Н, то в 5 с -положении есть атом водорода (1 г);, путем взаимодействия производных 17 а - галоид-16 а -метил-прегнан-20 она с дегид-..
55
рогалоидирующим агентом в среде ли в 5 с -положении - атом водород,
диметилформамида при нагревании, отли- о На - атом брома (Иб). Hat - атом
чающийся тем. что. с целью упрощенияйода(11б),
процесса, в качестве производных 17 а -га-R . водорода и в положении 5,6 .лоид-16 а -метилпрегнан-20-она использу-двойная связь, то Hal - атом йода (Пв),
ют соединения общей формулы Иили в 5 а -положении - атом водорода,
то Hal атом йода (Иг),
ет 3ив качестве дегидрогалоидирующего агенсо. .iiai10 используют ацетат калия и процесс про .с 1водят при 60 - 80 С.
что для получения 3 р -ацетокси-16-метилпП.,/Ч/ЧУрегна,16-диен-20-она в качестве исходно15 го соединения используют соединение
где. если R - СОСНз и в положении 5,6 - общей формулы II, где R - СОСНз. в поло- двойная связь, то Haf-атом брома (На), Hal жении 5.6 - двойная связь и Haf - атом -атом йода(IIа),|йода.

Авторы
Даты
1993-11-15—Публикация
1986-05-08—Подача