Изобретение относится к синтезу производных сульфонилмочевин, в частности к замещенным сульфонилмочевинам общей формулы: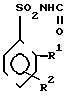
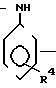 R3
R3
(I) где: при R1 = Cl, R2 = R3 = R4 = H или при R2 = H R3 = 3- или 4-Cl, а R4 = 4-OCH3 или 4-Cl или Н;
при R1 = COOCH3, то R2 = R3 = R4 = H,
при R1 = CH3 R2 = H, S-CH3, S-NO2, R3 = =3-Cl, R4 = 4-Cl;
при R1 = H R2 = 3-CH3 или 3-NO2, R3 = =3-Cl, R4 = 4-Cl;
при R1 = NO2 R2 = H, R3 = 3-Cl, R4 = 4-Cl, которые проявляют гербицидную активность и могут быть использованы в сельском хозяйстве в качестве гербицидов.
Целью изобретения является изыскание новых производных бензолсульфонилмочевин, обладающих высокой гербицидной активностью.
Соединения формулы I получают взаимодействием замещенных фенилизоцианатов с соответственно замещенными арилсульфонамидами, взятыми в молярном соотношении 1-1,02: 1. Реакцию проводят в среде ароматического растворителя, например n-ксилола или хлорбензола при перемешивании и нагревании в течение 4-5 ч при температуре 110-140оС. Выход целевого продукта составляет 60-80%.
Полученные сульфонилмочевины, как правило, нерастворимы в реакционной среде и выделяются кристаллизацией и фильтрацией технического продукта.
Способ получения соединения I иллюстрируется следующими примерами.
П р и м е р 1. N-(3, 4-дихлорфенил)-N1-(2,5-диметилфенил) сульфонилмочевина.
В четырехгорлую колбу, снабженную мешалкой, термометром, обратным холодильником с хлоркальциевой трубкой загружают 18,4 г (0,1 моль) 2,5-диметил- бензолсульфонамида, 50 мл сухого хлорбензола и дозируют в течение 5 мин 18,8 г (0,1 моль) 3,4-дихлорфенилизоцианата. Реакционную смесь нагревают до кипения. При этом сульфонамид постепенно растворяется. Реакцию продолжают 4 ч при температуре 130оС. Затем реакционную массу охлаждают до 15оС, осадок отфильтровывают, промывают толуолом и сушат. Получают 30,27 г продукта с содержанием основного вещества (по данным жидкостной хроматографии) 98,5%. Выход 80%.
Элементный анализ.
Найдено, %: С 48,08; Н 4,05; S 9,06; Cl 19,22.
Вычислено, %: С 48,26; Н 3,75; S 8,58; Cl 19,03.
П р и м е р 2. N-фенил-N1-[(2-хлорфенил)сульфонил]мочевина.
В четырехгорлую колбу загружают 11,9 г (0,1 моль) фенилизоцианата, 19,15 г (0,1 моль) о-хлорбензолсульфонамида и 70 мл хлорбензола. Смесь кипятят при перемешивании в течение 10 ч. Затем реакционную массу охлаждают до 20оС, осадок отфильтровывают, промывают толуолом и сушат. Получают 19,64 г технического продукта с содержанием основного вещества 98%. Выход 62%.
Элементный анализ.
Найдено, %: С 51,03; Н 3,12; S 9,16; Cl 10,96.
Вычислено, %: С 50,24; Н 3,54; S 9,98; Cl 11,43.
Характеристика синтезированных соединений приведена в табл. 1.
Гербицидная активность соединений 1 иллюстрируется следующими примерами.
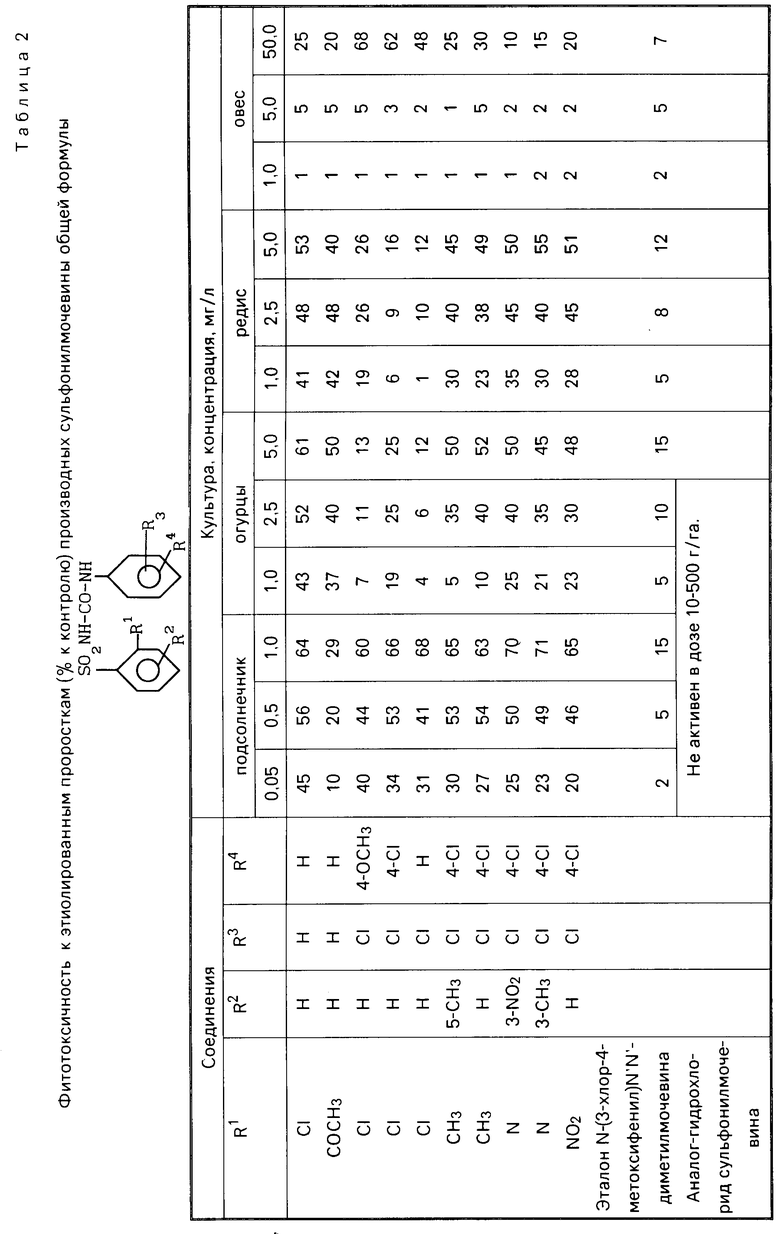
П р и м е р 3. Семена подсолнечника, огурцов, редиса, овса проращивают в термостате, затем заливают водными суспензиями испытуемых препаратов и выдерживают в термостате 2 сут при температуре 25оС. Фитотоксичность определяют по ингибированию веса проростков в сравнении с контролем. Результаты представлены в табл. 2.
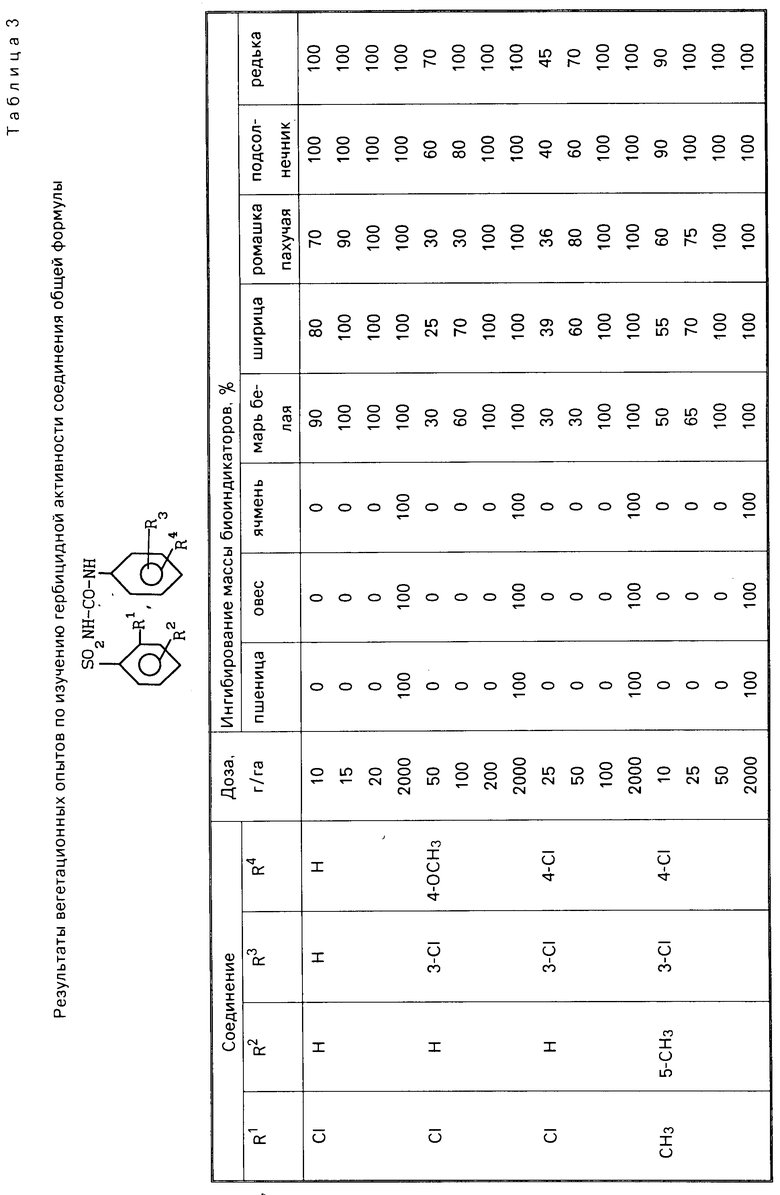
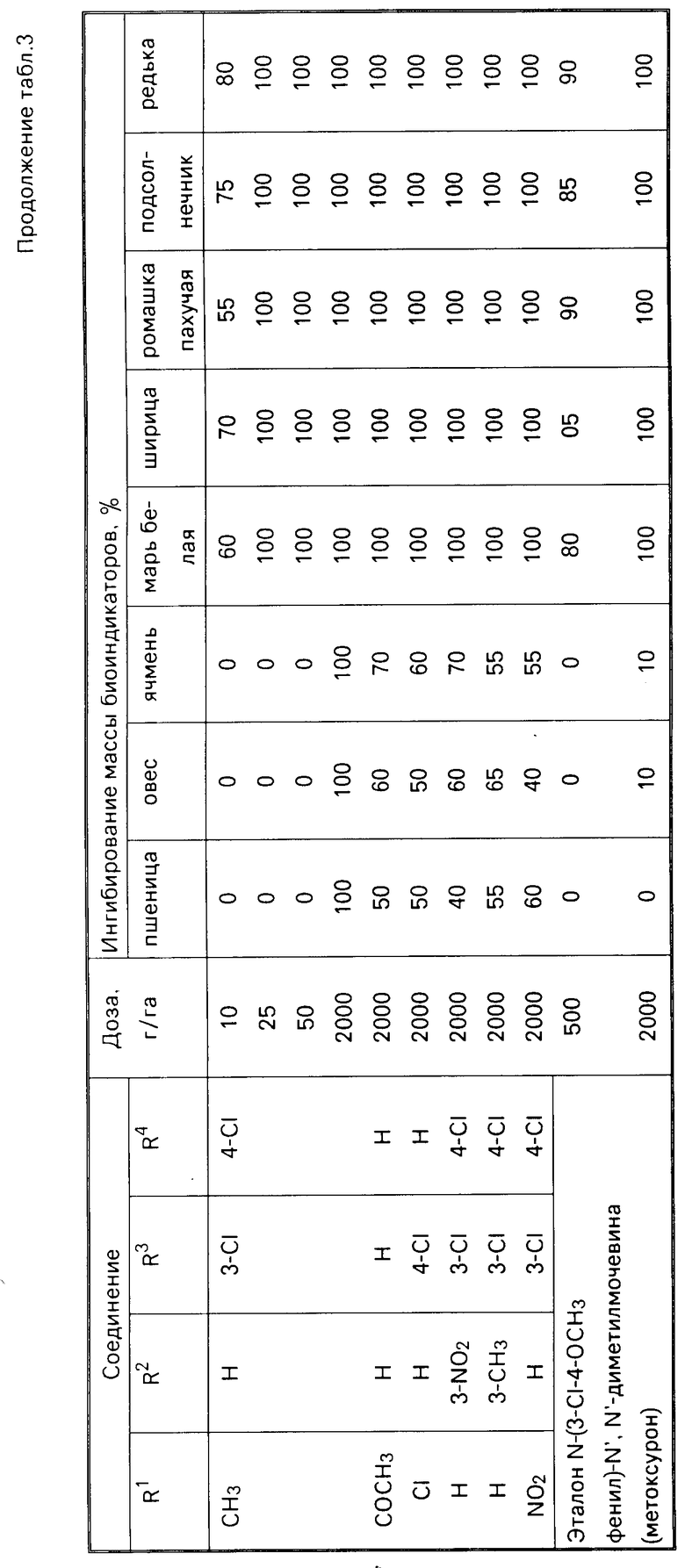
П р и м е р 4. В теплице в вегетационных сосудах выращивают растения пшеницы, овса, ячменя, мари белой, ширицы, ромашки пахучей, подсолнечника, редьки дикой до фазы 2-4 листьев (высота 5-15 см в зависимости от вида). Растения обрабатывают водными суспензиями препаратов. Гербицидное действие устанавливают через 2 недели по ингибированию массы биоиндикаторов по отношению к контролю. Результаты представлены табл. 3.
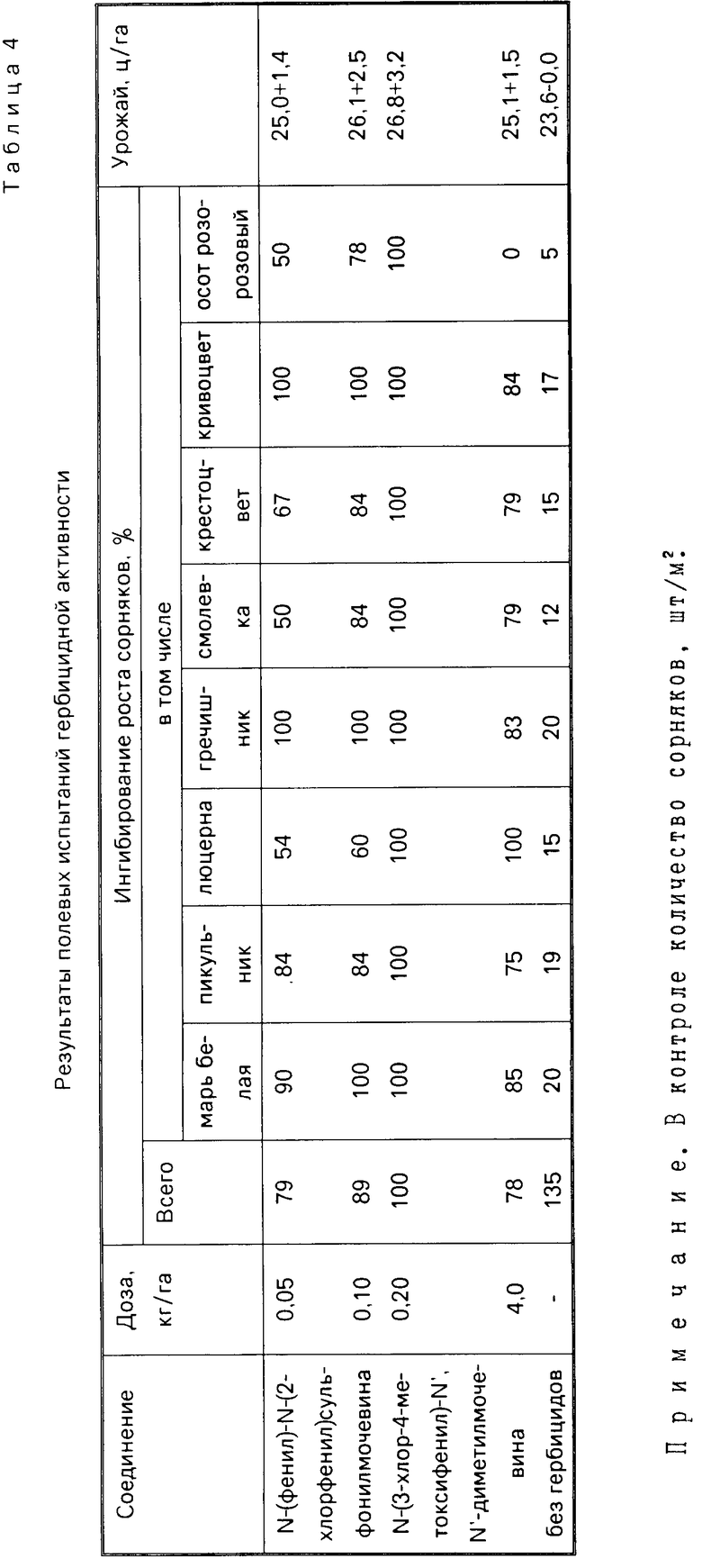
П р и м е р 5. Посевы яровой пшеницы при естественном засорении обрабатывают препаратами в фазу кущения. Учет действия препаратов устанавливают по ингибированию массы сорняков через 3 недели после обработки. Как видно из представленных табл. 2-4, предложенные соединения более активны по сравнению с эталоном-метоксуроном.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ N-(1,3,5-ТРИАЗИН-2-ИЛ)АМИНОКАРБОНИЛАРИЛСУЛЬФОНАМИДОВ | 1995 |
|
RU2103263C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ГЕРБИЦИДНОГО СОСТАВА | 2007 |
|
RU2344600C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ГЕРБИЦИДНОГО СОСТАВА | 1993 |
|
RU2034467C1 |
| СПОСОБ ПОЛУЧЕНИЯ АРИЛСУЛЬФОНИЛИЗОЦИАНАТОВ | 1986 |
|
SU1422601A1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ГЕРБИЦИДНОГО СОСТАВА | 2007 |
|
RU2343708C1 |
| СУЛЬФАМИДНЫЕ ПРОИЗВОДНЫЕ 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЕ ГЕРБИЦИДНУЮ И РОСТСТИМУЛИРУЮЩУЮ АКТИВНОСТЬ | 1988 |
|
SU1596696A1 |
| 4-АМИНОХИНАЗОЛИНОВЫЕ АНТАГОНИСТЫ СЕЛЕКТИВНЫХ НАТРИЕВЫХ И КАЛЬЦИЕВЫХ ИОННЫХ КАНАЛОВ | 2004 |
|
RU2378260C2 |
| ПРОИЗВОДНЫЕ 1,3,4-ТИАДИАЗОЛА, ОБЛАДАЮЩИЕ РОСТРЕГУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 1988 |
|
SU1582574A1 |
| СПОСОБ ДЕХЛОРИРОВАНИЯ ЗАМЕЩЕННЫХ ХЛОРАРОМАТИЧЕСКИХ СОЕДИНЕНИЙ | 1998 |
|
RU2152921C1 |
| СОЕДИНЕНИЯ ЗАМЕЩЕННОГО ПИРАЗОЛА, СОДЕРЖАЩЕГО ПИРИМИДИНИЛ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2016 |
|
RU2687089C2 |
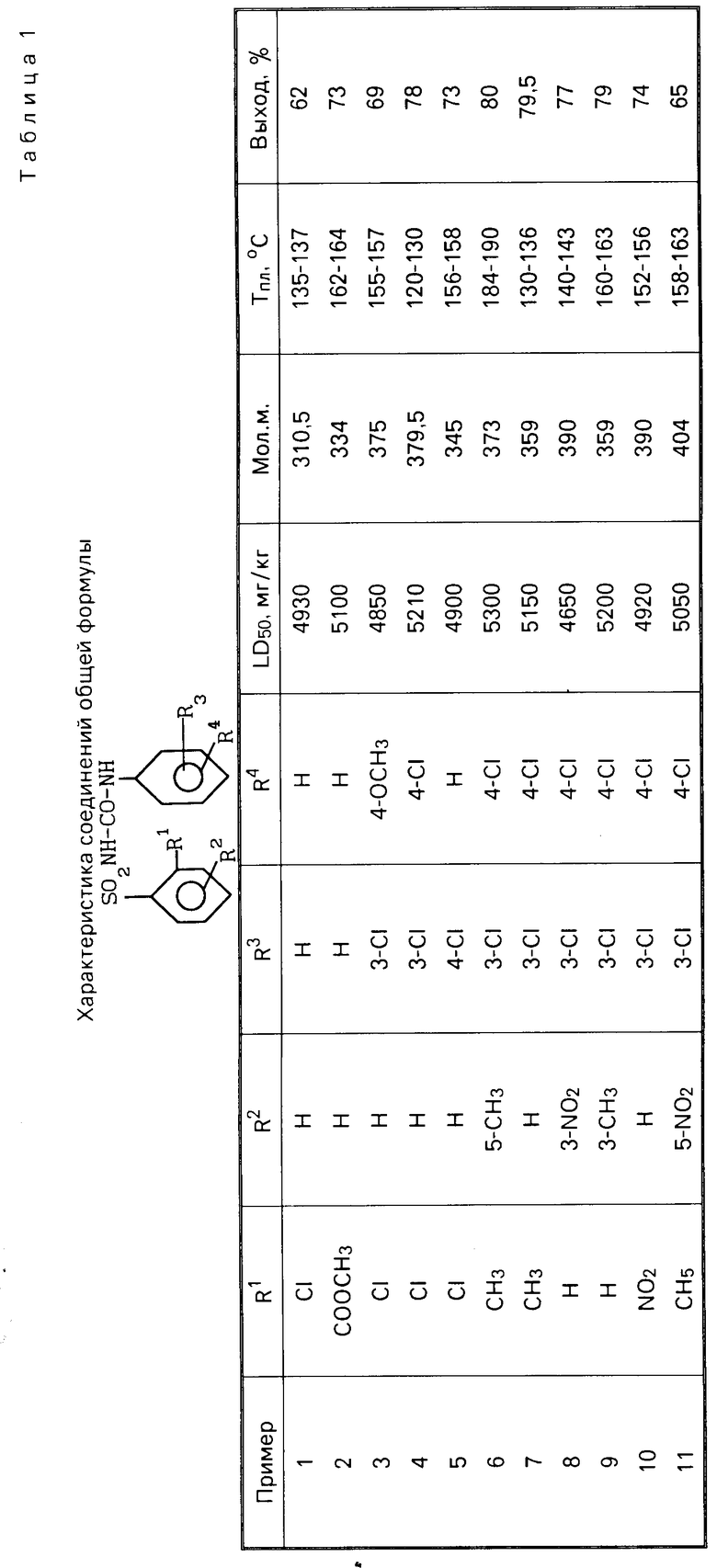
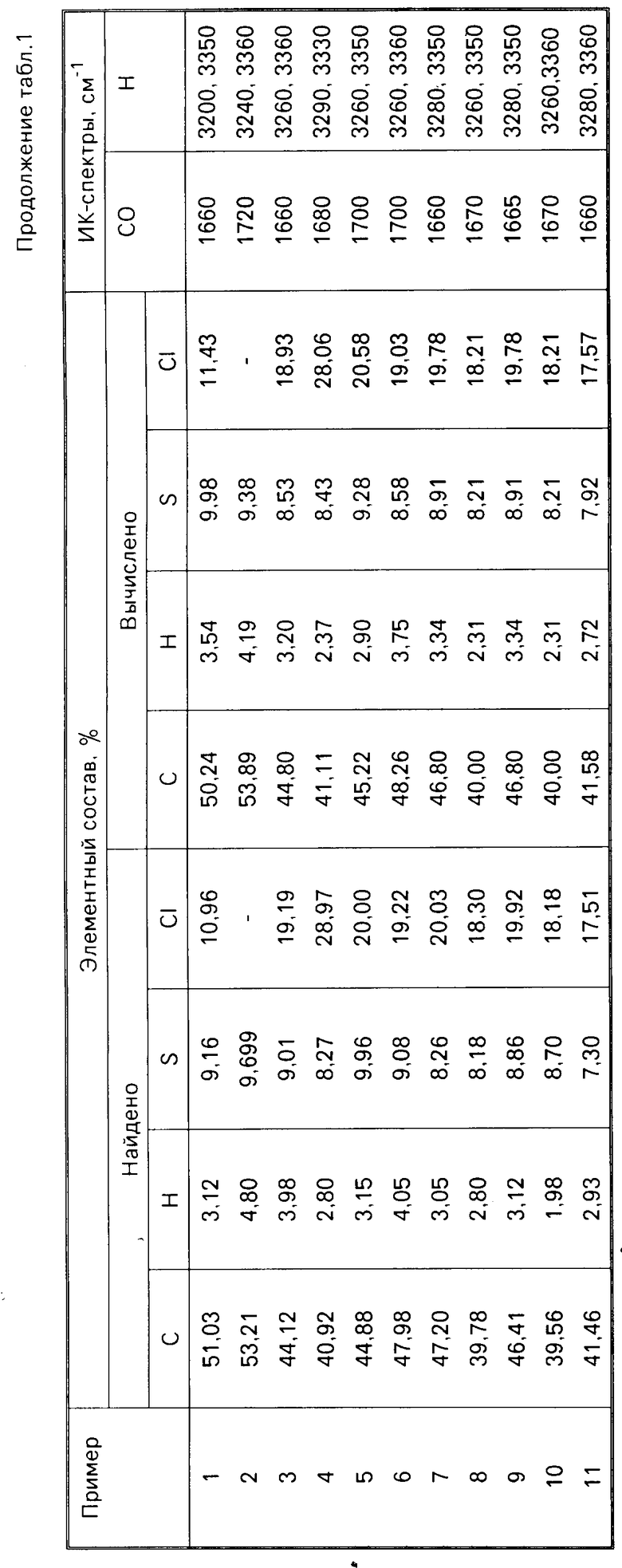
Изобретение относится к производным сульфонилмочевин, в частности к замещенным сульфонилмочевинам формулы 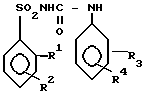 , где когда R1= Cl, то R2=R3=R4=H или в случае R2= H, то R3-3- или 4-Cl, а R4= 4-OCH3 или 4-Cl или H когда R1= COOCH3, то R2=R3=R4=H, когда R1=CH3, то R4= 4-Cl, а R2=H, S-CH3, S-NO2; R3= 3-Cl, когда R1= H, то R4= 4-Cl, R3= 3-Cl, R2= 3CH3 или 3-NO2, когда R1= NO2, то R2= H, R3= 3-Cl, R4= 4Cl, которые проявляют гербицидную активность. Цель - выявление новых соединений, обладающих более высокой активностью. Получение целевых соединений ведут из замещенных фенилизоцианатов и соответственно замещенных арилсульфонамидов (при молярном соотношении 1 - 1,02 : 1). Реакцию ведут в среде ароматического растворителя при 110 - 140°С в течение 4 - 5 ч. Выход 60 - 80%. 4 табл.
, где когда R1= Cl, то R2=R3=R4=H или в случае R2= H, то R3-3- или 4-Cl, а R4= 4-OCH3 или 4-Cl или H когда R1= COOCH3, то R2=R3=R4=H, когда R1=CH3, то R4= 4-Cl, а R2=H, S-CH3, S-NO2; R3= 3-Cl, когда R1= H, то R4= 4-Cl, R3= 3-Cl, R2= 3CH3 или 3-NO2, когда R1= NO2, то R2= H, R3= 3-Cl, R4= 4Cl, которые проявляют гербицидную активность. Цель - выявление новых соединений, обладающих более высокой активностью. Получение целевых соединений ведут из замещенных фенилизоцианатов и соответственно замещенных арилсульфонамидов (при молярном соотношении 1 - 1,02 : 1). Реакцию ведут в среде ароматического растворителя при 110 - 140°С в течение 4 - 5 ч. Выход 60 - 80%. 4 табл.
ЗАМЕЩЕННЫЕ СУЛЬФОНИЛМОЧЕВИНЫ, ПРОЯВЛЯЮЩИЕ ГЕРБИЦИДНУЮ АКТИВНОСТЬ.
Замещенные сульфонилмочевины общей формулы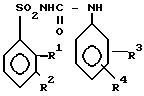
где, когда R1 = Cl, то R2 = R3 = R4 = H или в случае R2 = H, то R3 - 3 - или 4-Cl, а R4 = 4-OCH3 или 4-Cl или H, когда R1 = COOCH3 = COOCH3, то R2 = R3 = R4 = H, когда R1 = CH3, то R4 = 4-Cl, а R2 = H, S -CH3, S-NO2, R3 = 3-Cl, когда R1 = H, то R4 = 4-Cl, R3 = 3-Cl, R2 = 3-CH3 или 3-NO2, когда R1 = NO2, то R2 - H, R3 = 3-Cl, R4 - 4-Cl,
проявляющие гербицидную активность.
| Авторское свидетельство СССР N 1128557, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-03-27—Публикация
1986-01-06—Подача