Изобретение относится к биотехнологии, а именно к прикладной энзимологии, и может быть использовано в медицинской и пищевой промышленности.
Целью изобретения является получение фермента β -глюкозидазы с высокой удельной активностью и термостабильностью.
Для этого штамм Escherichia coli ВКПМ-3223 выращивают до достижения максимального уровня удельной активности β-глюкозидазы в культуре, клетки лизируют, прогревают полученный лизат осаждают фермент из надосадка органическим растворителем в соотношении от 1: 1 до 1: 10.
П р и м е р 1. Выращивание штамма E. coli ВКПМ В-3223.
А. Выращивание в колбах.
Для получения посевного материала в колбу объемом 300 мл, содержащую 100 мл бульона Хоттингера и 100 мкг/мл ампициллина, вносят одну колонию штамма С600/рСИ201 с чашки Петри с агаризованной L-средой (1% триптона, 0,5% дрожжевого экстракта, 0,5% NaCl, 2% агара), содержащей 100 мкг/мл ампициллина, и выращивают в течение ночи при 37оС с качанием. Затем полученную ночную культуру вносят в отношении 1: 1000 в колбы объемом 1 л, содержащие 400 мл бульона Хоттингера, и выращивают 20-50 ч при тех же условиях.
Активность определяют следующим образом.
Клетки осаждают центрифугированием в течение 5 мин при 5000 об/мин, ресуспендируют в равном объеме ледяной воды, лизируют ультразвуком, центрифугируют в течение 25 мин при 15000 об/мин и определяют активность БГ и концентрацию белка (см. пример 3). Активность составляет 15-25 ед/мг белка.
Б. Выращивание в ферментере.
Посевной материал, полученный как описано в примере 1А, вносят в отношении 1: 100 в 60-литровый ферментер, содержащий 50 л бульона Хоттингера, и выращивают с аэрацией при 37оС в течение 20-50 ч до достижения активности 15-425 ед/мг белка.
П р и м е р 2. Получение ферментного препарата β -глюкозидазы.
Выращенную по примеру 1 культуру осаждают центрифугированием. Затем клетки обрабатывают одним из следующих способов.
А. Клетки ресуспендируют в 1: 10 начального объема ледяной воды и лизируют ультразвуком порциями по 50 мл в течение 15 мин на установке УЗДН-2Т.
Б. Клетки ресуспендируют в ледяном буфере (10 мМ Tris-HCl, рН 7,0; мМ ЭДТА, 1 мг/мл лизоцима) из расчета 4 мл на 1 г биомассы и инкубируют при 0оС 15 мин.
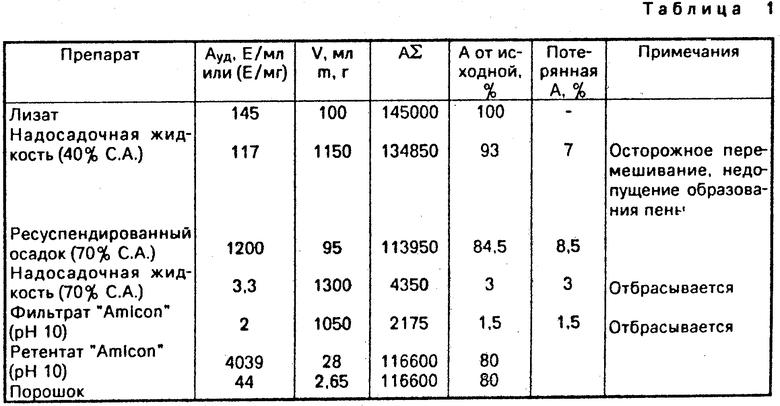
Затем полученные препараты прогревают 60 мин при 60оС, денатурированные белки и клеточные обломки удаляют центрифугированием в течение 30 мин при 15000 об/мин. К ледяному надосадку добавляют равный объем ацетона, охлажденного до -20оС, инкубируют 15 мин при 0оС. Образовавшийся осадок собирают центрифугированием в течение 5 мин при 5000 об/мин, либо фильтрацией через мембранный фильтр и высушивают под вакуумом.
Активность полученного препарата составляет 30-45 ед/мг препарата, содержание белка - 0,5-0,8 мг/кг препарата, а удельная активность - около 40-65 ед/мг белка.
Температура термоинактивации 55-65оС выбрана из следующих соображений. При более высокой температуре происходит инактивация фермента, а при более низкой - денатурирует меньшая часть белков E. coli, что приводит к получению препарата с меньшей активностью.
Если вместо осаждения ацетоном к надосадку добавляют два объема этанола (-20оС), то активность полученного препарата составляет 40-60 ед/мг белка препарата; а если десять объемов этанола - 20-35 ед/мг белка.
П р и м е р 3. Выделение β -глюкозидазы из замороженной биомассы Е. coli методом сульфатного осаждения.
Суспендируют биомассу в буфере (100 mM трис, 5 mM ЭДТА, рН 8) до получения 20% -ной суспензии.
Лизируют при помощи лизоцима (1 - 2 мг/мл) при перемешивании в течение 0,5 ч до достижения максимальной активности в неосветленном лизате (при 20-25оС). Необходимо контролировать рН среды и при понижении его дотитровывать до 8 1 м трис-ом).
Проводят подкисление до рН 6 (при 25оС).
Прогревают в течение 1 ч при 60оС в присутствии 1 mM CaCl2.
Осаждают и выдерживают 0,5 ч при 0 - +4оС для формирования осадка.
Центрифугируют 0,5 ч при 14000 об/мин и температуре 0 - +2оС.
Осаждают балластные белки сульфатом аммония - 40% -ного насыщения (0оС, добавляют мелкоизмельченного (NH4)2SO4 при перемешивании, недопустимо вспенивание; выдерживают 0,5 ч при 0оС).
Центрифугируют в течение 0,5 ч при 14000 об/мин и температуре 0 - +2оС.
Осаждают фракции белков, содержащие β -глюкозидазу (70% -ного насыщения (NH4)2SO4; выдерживают 0,5 ч при 0оС.
Центрифугируют в течение 0,5 ч при 14000 об/мин и температуре 0 - +2оС.
Ресуспендируют осадки в минимальном объеме воды (1/10 первонач. V), центрифугируют при 14000 об/мин в течение 1 ч при 0оС или 20000 об/мин в течение 0,5 ч.
Концентрируют на ультрамембране (РМ-10 Amicon), обессоливают (промывка 6-ю объемами воды).
Лиофилизируют.
1. Выделение β -глюкозидазы методом сульфатного осаждения.
П р и м е р 4. Определение активности β-глюкозидазы общепринятым методом.
К 1,8 мл 2 мМ раствора паранитрофенил-β-D-глюкозида в 50 мМ фосфатцитратном буфере (рН 5,4) добавляют 0,2 мл раствора БГ, инкубируют 3 и 5 мин при 60оС, затем добавляют 1 мл 1 М ледяного раствора Na2CO3 и определяют поглощение при 400 нм. Активность определяют при разведениях фермента, обеспечивающих линейное возрастание активности за время измерения или при увеличении концентрации фермента. За единицу активности принимают количество фермента, обpазующего 1 мкмоль паранитрофенола в 1 мин.
П р и м е р 5. Очистка до гомогенности и характеристика β -глюкозидаты.
Из препарата, полученного по примеру 2А, фермент очищают до гомогенности с помощью ионообменной хроматографии на Toyoperl-ДЕАЕ 65ОМ" ("Toyosoda", Япония) и гельфильтрации на Toyoperl-60. Гомогенность фермента и его молекулярный вес определяют с помощью электрофореза в SDS-ПААГ по Лэмли. Изоточку определяют изофокусировкой в пластинах ПААГ производства фирмы LКВ, Швеция. Определение оптимума рН и температурной стабильности определяют по графику зависимости обратных начальных скорости реакции от обратных концентраций субстрата.
Удельную активность определяют при 60оС и рН 5,4. Она составляет около 150 ед/мг белка.
Сравнение свойств БГ из штамма В-3223 с известным и коммерческим препаратом БГ фирмы "Toyobo" приведено в табл. 2.
Положительный эффект фермента β -глюкозидазы:
более высокая термостабильность, потеря активности за 1 ч - 2% (у известного фермента из Clostridium thermocellum - 6-7% );
более высокая удельная активность - 150 ед/мг (у фермента Clostridium thermocellum - 133);
более высокое сродство фермента с субстратом позволяет работать при низких концентрациях субстратов.
(56) Каталог фирмы Sigma, США, 1987, N 64511, с. 621.
B. Ait, N. Greuzet and G. Cattaneo, Biochem. Biophys. Res. Comm, 1979, v. 90, N 2, р. 537.

Изобретение относится к биотехнологии, а именно к прикладной энзимологии, и может быть использовано в медицинской и пищевой промышленности. С целью получения фермента b -глюкозидазы с высокой удельной активностью и термостабильностью штамм Escherichia coli ВКПМ В-3223 выращивают до достижения максимального уровня удельной активности фермента, клетки лизируют, прогревают полученный лизат и осаждают фермент из надосадка органическим растворителем в соотношении от 1: 1 до 1: 10. При этом получают фермент b -глюкозидазу со следующими свойствами: субстратная специфичность - гидролизует паранитрофенил- b -D-глюкозид (ПНФГ), целлобиозу и не гидролизует арбутин. Удельная активность при гидролизе ПНФГ - 150 ед/мг белка (за единицу активности принимают количество фермента, образующего 1 мк/моль паранитрофенола на 1 мин), целлобиозы - 6 ед/мг; - молекулярная масса - 75000 ± 5000 дальтон; - изоэлектрическая точка - 5,5 + 0,1 единиц рН; -рН оптимум - 5,4 + 0,3; -диапазон рН-стабильности 6,0 - 7,0 при рН 5,5 остаточная активность - 75% , при рН 7,5 - 70% ; термостабильность: остаточная активность при инкубации в течение 60 мин в Tris - NCl буфере, рН 6,9 при 50С - 100% , 60С - 98% , 65С - 90% ; константа Михаэлиса: (1,2± 0,1)·10-4 M (рН 5,4, субстрат ПНФГ), ((3,5± 0,1)·10-5 M (рН 7,0 субстрат ПНФГ); -ингибиторы: дельтаглюконолактон (при концентрации выше 10-3 M ); -оптимум температуры - 60± 2°C. Преимущества полученного фермента β -глюкозидазы заключаются в более высокой термостабильности удельной активности - (150 ед/мг и более высоком сродстве ферментов с субстратом по сравнению с известным ферментом b -глюкозидазы из Clostridium thermocellum, что позволяет работать при низких концентрациях субстратов. 2 табл.
β -ГЛЮКОЗИДАЗА, ПРОДУЦИРУЕМАЯ ШТАММОМ БАКТЕРИЙ ESCHERICHIA COLI ВКПМ В-3223, имеющая следующие свойства:
субстратная специфичность - гидролизует паранитрофенил- β -D-глюкозид (ПНФГ), целлобиозу и не гидролизует арбутин. Удельная активность при гидролизе ПНФГ - 150 ед/мг белка (за единицу активности принимают количество фермента, образующего 1 мкмоль паранитрофенола за 1 мин), целлобиозы - 6 ед/мг;
мол. м. - 75000 ± 5000 дальтон (при определении методом электрофореза в SDS - ПААГ);
изоэлектрическая точка - 5,5 ± 0,1 единиц pH (при определении методом изоэлектрофокусировки в ПААГ с амфолитами);
pH-оптимум - 5,4 ± 0,3 (в фосфат-цитратном буфере при 60oС, субстрат ПНФГ);
диапазон pH-стабильности 6,0 - 7,0 (50 ммоль фосфат-цитратный буфер 25oС) в течение 68 ч, на субстрате ПНФГ);
при pH 5,5 остаточная активность 75% , при pH 7,5 - 70% (условия те же);
термостабильность: остаточная активность при инкубации в течение 60 мин в трис-HC1-буфере, pH 6,9 при 50oС - 100% , 60oС - 98% , 65oС - 90% ;
константа Михаэлиса: (1,2 + 0,1) · 10-4 моль (pH 5,4, субстрат ПНФГ), (3,52 ± 0,1) · 10-5 моль (pH 7,0, субстрат ПНФГ);
ингибиторы: дельтаглюконолактон при концентрации выше 10-3 моль; оптимум температуры -60 ± 2oС.
Авторы
Даты
1994-03-15—Публикация
1988-10-26—Подача