Изобретение относится к области экспериментальной эмбриологии млекопитающих и биотехнологии.
Целью изобретения является повышение выхода созревших ооцитов с неповрежденным генетическим аппаратом.
Способ состоит в следующем. Из яичников коров путем надреза фолликулоз (не менее 0,5 мм в диаметре) выделяют ооциты в комплексе с гранулезными клетками и помещают в культуральную среду ТС-199 на растворе Хэнкса с гепарином 2 ед/мл и антибиотиками 100 ед/мл пенициллина и стрептомицина 50 мкг/мл. Промывают ооциты от посторонних клеток в той же среде и помещают во флакончики с теми же компонентами. Затем во флакончики с клетками, находящимися в культуральной среде, добавляют20% фетальной сыворотки и мозговой нейритстимулирующий белок в различной концентрации: от 50 до 375 нг/мл. В качестве контроля одновременно в одном опыте берут ооциты и культивируют в той же
среде, но только в присутствии 20% фетальной сыворотки без факторов роста. Флакончики с клетками помещают в термостат для инкубирования при 37°С в атмосфере 5% С02- По мере культивирования в течение 30 ч проводят, цитогенетический анализ ооцитов на разных стадиях мейоза, т.е. подсчи- тывают процент созревших и дегенерированных ооцитов. Окрашивание и фиксацию клеток проводят по методу Тарковского.
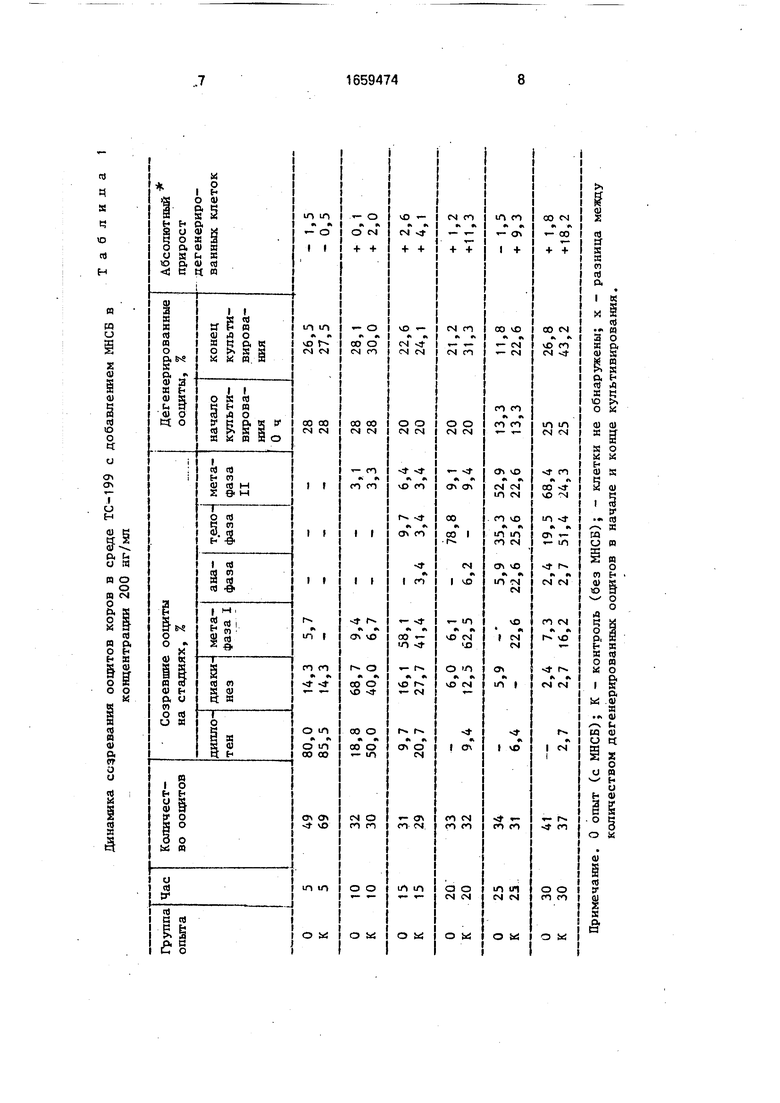
Результаты приведены в табл. 1.
Под термином ооциты всегда имеется в виду комплекс ооцитов с гранулезными клетками. Низкий уровень дегенерации ооцитов свидетельствует о благоприятных условиях культивирования клеток.
П р и м е р 1. Через 5 ч культивирования ооцитов в среде ТС-199 с добавлением 200 нг/мл МНСБ, большинство клеток, как в опытной так и в контрольной группах (80 и 85,5% соответственно) находятся на стадии диплотены. Дегенерация в опытной и контсл
с
ON СЛ
2 2
рольной группах составляет статистически недостоверные величины (26,5 и 27,5%),
П р и м е р 2. 81,2% ооцитов в опытной группе через 10 ч культивирования инициировали мейоз, дегенерация при этом составляет 28,1 %. В контрольной группе 50% ооцитов на тех же стадиях развиваются, а дегенерация составляет 30%.
П р и м е р 3. Через 15ч культивирования ооциты в опытной группе в основном достигают стадии метафазы I (58,1%), клетки с дегенерированными хромосомами составляют 22,6 против 24,1% в контроле.
Пример 4, 20 ч культивирования ооцитов опытной группы характеризуются синхронным выходом клеток на стадию те- лофазы - 78,8% и достоверно меньшим числом ооцитов с дегенерированным хромосомным материалом по сравнению с контрольной группой (21,2 против 31,1% в контроле).
П р и м е р 5. Более половины ооцитов опытной группы достигают стадии метафазы II через 25 ч культивирования, в контрольной группе их число достигает 22,6%. Продолжает оставаться достоверной разница между контрольной и опытной группами по выходу ооцитов с дегенерацией хромосом (11.8% в опыте по сравнению с 22,6% в контроле).
П р и м е р 6. Через 30 ч культивирования 87,9% ооцитов опытной группы находятся на завершающих стадиях развития (телофз- за+метафаза II), в контрольной группе завершают свое созревание 75,7% ооцитов В контрольной группе зафиксирован высокий уровень клеток с признаками хромосомной дегенерации (43,2%), в то время как в опытной группе уровень дегенерации продолжает оставаться довольно низким (на уровне исходного состояния популяций ооцитов, поставленных на культивирование - 26,8 против 25% дегенерированного хромосомного материала на 0 ч - начало культивирования). В начале культивирования при выделении ооцитов и в зависимости от техники обработки, чистоты среды и др., часть ооцитов гибнет.
Таким образом, как видно из таблицы, через 25-30 ч культивирования с МНСБ ооциты достигают стадии нуклеарного созревания, т.е. более половины ооцитов достигают стадии метафазы II с низким уровнем хромосомной дегенерации (пример 5, 6) по сравнению с контролем. Дегенерация в конце культивирования в опыте примерно в 2 раза ниже, чем в контроле (через 25-30 ч). Данные по определению разницы между количеством дегенериро- ванных ооцитов в начале (на 0 ii) и конце
культивирования (абсолютный прирост де- генерированных клеток) свидетельствует о том, ню через 30 ч ооциты в 10 раз меньше дегенерируют а присутствии МНСБ (1,8% в
опыте м 18,2% в контроле).
Если после завершения мейоза, т.е. при достижении ооцитами стадии метафазы I (через 30 ч) оставить ооциты в той же среде культивирования до 60 ч, то наблюдается
0 резкое повышение дегенерировакных ооцитов в контроле (без МНСБ) по сравнению с ооцитами в среде, содержащей МНСБ: 75% в контроле и 29,6% в опыте. Этот факт свидетельствует о положитель5 ном влиянии МИСБ на поддержание жизнеспособности клеток ооцитов в культуре.
МНСБ также оказывает положительное влияние на выход биологически полноценных (по состоянию хромосом) ооцитов, син0 хрониэацию процесса мейоза, а также позволяет определить время, необходимое для протекания каждой из стадий мейоза. Кроме того, низкий процент дегенерированных ооцитов в присутствии МНСБ свиде5 тельствует также с положительном влиянии МНСБ на культуру ооцитов, на созревание этих клеток.
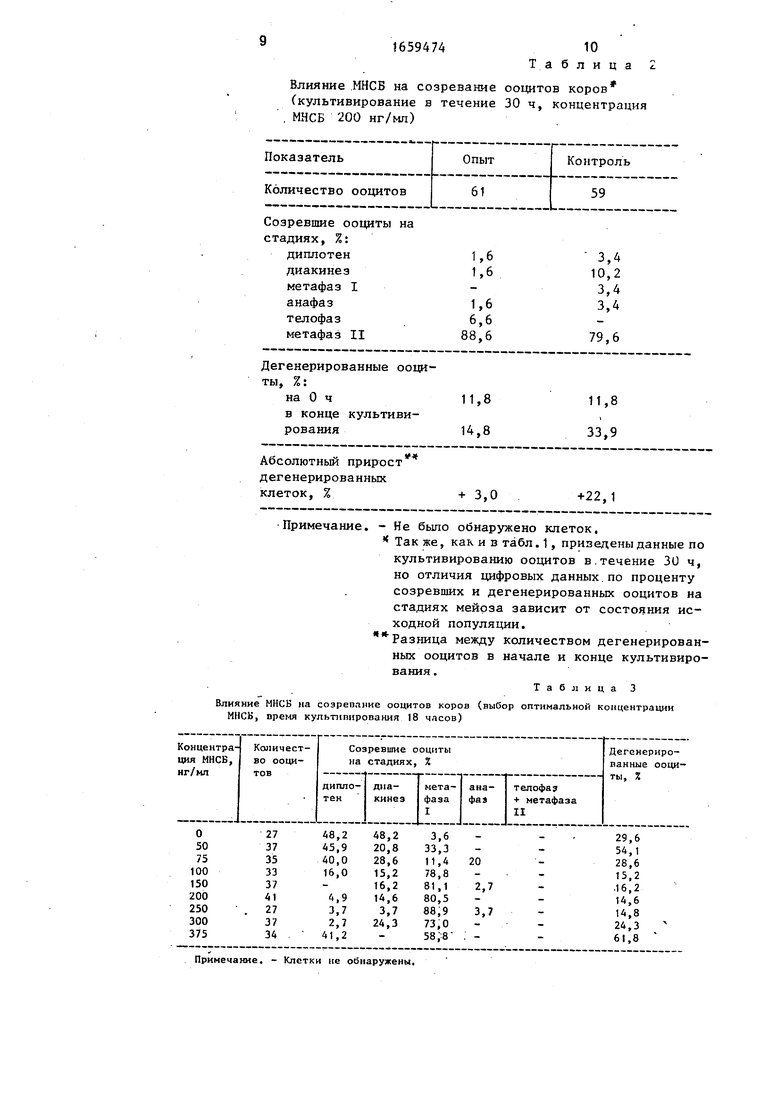
В табл. 2 приводятся данные по результатам культивирования в присутствии
0 МНСБ и без него. В примерах 7 и 8 показаны стадии созревания, процент их созревания (выход созревших ооцитов) и процент деге- нерированных ооцитов (по состоянию хромосом).
5 П р и м е р 7, В данном эксперименте через 30 ч культивирования почти все ооциты (88,6%) достигают завершающей стадии мейоза (метафазы II) в присутствии оптимальной концентрации МНСБ, причем с
0 низким уровнем дегенерации (в 2,3 раза ниже, чем в контроле: 33,9% в контроле по сравнению с 14,8% в присутствии МНСБ), Следует отметить, что на стадии метафазы ii болыиинст ъо клеток в культуре ооцитов ока5 зывается в значительной степени синхронизированной, т.е. большинство клеток находится на стадии метафазы II.
Примере, Применение в качестве добавки в культуральную среду с ооцитами
0 МНСБ приводит к получению высокого процента выхода созревших ооцитов на завер- шающихстадияхразвития
(телофаза+метафаза II) 95,2%, что на 15,2% выше по сравнению с контролем (7У,6%).
5 Абсолютный прирост дегенерированных клеток в опыте (с МНСБ) примерно в 7 раз ниже, чем в контроле (3% по сравнению с 22,1%).
П р и м е р 9. Мозговой нейритстимули- рующий белок, влияние которого изучается
на модели ооцитов, выделен из мозга крупного рогатого скота, представляет собой ка- тионный гидрофобный белок с мол.мае. 15000 Д. Биологическая активность МНСБ 5 (нейритостимулирующая) сохраняется при термокислотной обработке. Белок выделен с помощью кислотной экстракции, ультра- Фильтрации, препаративного электрофореза, хроматографии на гепаринсефарозе. 10
Таким образом, помещение ооцитов в комплексе с гранулезными клетками в куль- туральную среду, а также добавление туда МНСБ для улучшения условий культивирования в совокупности с цитогенетическим 15 тестированием хромосомного, аппарата клетки, позволяет повысить информацию об уровне качества культивирования и повысить качество культивирования.
В табл. 3 отражены данные эксперимен- 20 тов по влиянию МНСБ в разной концентрации (50-375 нг/мл) на созревание ооцитов на стадиях мейоза. Состояние ооцитов оценивают по проценту созревания и проценту дегенерации ооцитов. В примерах 10-17 от- 25 ражены данные по влиянию разных концен- траций МНСБ на качество культивирования
ооцитов.
Пример 0. При культивировании ооцитов в среде без МНСБ через 18 ч куль- 30 тивирования 51,8% ооцитов продвигаются в своем развитии со стадии диплотены на стадии диакинез метафаза I, причем 29,6% клеток имеют признаки дегенерации.
Пример. При введении в культу- 35 ральнуюсреду 75 нг/мл МНСБ,40% ооцитов находятся на стадии диплотены, а в состоянии дегенерации 28,6% клеток.
П р и м е р 12. Применение МНСБ в концентрации 100 нг/мл обеспечивает 40 94%-ю инициацию мейоза (диакинез+мета- фаэа I) и меньшее количество ооцитов с де- генерациями хромосом (15,2%).
П р и м е р 13. При использовании МНСБ в концентрации 150 нг/мл все ооциты через 45 18ч проходят стадию диплотены, а процент дегенерации составляет 16,2%.
П р и м е р 14. 95,1 % ооцитов вступают в стадии диакинеза и метафазы I через 18ч культивирования в среде Т С-199 с добавкой 200 нг/мл МНСБ, причем основная часть 50
клеток находится на стадии метафазы 1 - 80,5%. Число дегенерированных клеток а среде с фактором роста почти в 2 раза меньше, чем в контрольной группе (14,6% в опыте по сравнению с 29,6% в контроле).
П р и м е р 15. 96,3% ооцитов продвигаются в своем развитии при концентрации МНСБ -250 нг/мл, достигнув стадий диакинеза, метафазы I, анафазы, а количество клеток с дегенерированными хромосомами при этом составляет 14,8%.
Пример16. Культивирование ооцитов в присутствии 300 нг/мл МНСБ позволяет 97,3% ооцитов достичь стадий диакинеза и метафазы I, у 24,3% клеток наблюдается дегенерация хромосом, т.е. по выходу ооцитов с признаками дегенерации опытная группа не имеет достоверных различий с контрольной (24,3% против 29,6%).
П р и м е р 17. Культивирование ооцитов в присутствии 375 нг/мл МНСБ уменьшает процент созревших ооцитов и резко увеличивает процент дегенерированных ооцитов 61,8%.
Таким образом, концентрация МНСБ 200 нг/мл является оптимальной, так как количество дегенерированных клеток составило лишь 14,6%. Следует отметить, что оценка состояния ооцитов по % созревания и дегенерации независима одна от другой, так как под термином созревания ооцитов имеется ввиду только нуклеарное созревание, а дегенерация ооцитов оценивается по самым разным признакам аномалии мейоза, которые были перечислены ранее.
Формула изобретения
Способ культивирования ооцитов коров, включающий забор фолликулов, выделение из них клеток гранулезы с последующим культивированием их в питательной среде с фетальной сывороткой и полипептидным фактором роста, отличающийся тем, что, с целью повышения выхода созревших ооцитов с неповрежденным генетическим аппаратом, культивирование клеток гранулезы осуществляют одновременно с ооцитами, а в качестве полипептидного фактора роста используют мозговой нейритстимулирующий белок в концентрации 100-250 нг/мл.
Динамика созревания ооцитов коров в среде ТС-199 с добавлением МНСБ в
концентрации 200 нг/мл
Т а б л и л а 1


| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЦИТОЛОГИЧЕСКОЙ ДИАГНОСТИКИ НАРУШЕНИЯ СПЕРМАТОГЕНЕЗА | 2007 |
|
RU2328736C1 |
| СПОСОБ ДИАГНОСТИКИ ГЕНЕРАТИВНОЙ ПОТЕНЦИИ ЯИЧНИКОВ | 2008 |
|
RU2367949C1 |
| СПОСОБ ЭКСТРАКОРПОРАЛЬНОГО КУЛЬТИВИРОВАНИЯ ООЦИТОВ КОРОВ | 2009 |
|
RU2410063C1 |
| Питательная среда для культивирования ооцитов крупного рогатого скота in vitro | 2021 |
|
RU2778147C1 |
| ПРИМЕНЕНИЕ ЦИКЛИЧЕСКОГО ТРИПЕПТИДА ДЛЯ УЛУЧШЕНИЯ КЛЕТОЧНОГО ЭНЕРГЕТИЧЕСКОГО МЕТАБОЛИЗМА | 2016 |
|
RU2737116C2 |
| СПОСОБ ПРОФЕССИОНАЛЬНОГО ОТБОРА ЛИЦ ДЛЯ РАБОТ ПО УНИЧТОЖЕНИЮ БОЕВЫХ ОТРАВЛЯЮЩИХ ВЕЩЕСТВ | 2016 |
|
RU2642603C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭМБРИОНОВ СВИНЕЙ IN VITRO | 2007 |
|
RU2340177C1 |
| СПОСОБ ЭКСТРАКОРПОРАЛЬНОГО КУЛЬТИВИРОВАНИЯ ООЦИТОВ КОРОВ | 2015 |
|
RU2602448C1 |
| СПОСОБ ПРОФИЛАКТИКИ И КОРРЕКЦИИ ЦИТОГЕНЕТИЧЕСКИХ НАРУШЕНИЙ | 2012 |
|
RU2504392C1 |
| ПАРТЕНОГЕНЕТИЧЕСКАЯ АКТИВАЦИЯ ЧЕЛОВЕЧЕСКИХ ООЦИТОВ ДЛЯ ПОЛУЧЕНИЯ ЧЕЛОВЕЧЕСКИХ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК | 2006 |
|
RU2469085C2 |
Изобретение относится к области экспериментальной эмбриологии млекопитающих и биотехнологии. Целью изобретения является повышение созревших ооцитов с неповрежденным генетическим аппаратом. Для этого культивирование ооцитов осуществляют одновременно с клетками грануле- зы, в культуральной среде ТС-199 с 20% фетальной сыворотки, используя в качестве полипептидного фактора роста мозговой нитритстимулирующий белок в концентра- ции 100-250 нг/мл. 3 табл.
Примечание. О опыт (с МНСБ); К - контроль (без МНСБ); - клетки не обнаружены; х - разница между количеством дегенерированных ооцитов в начале и конце культивирования.
165947410
Таблица
Влияние МНСБ на созревание ооцитов коров (культивирование в течение 30 ч, концентрация , МНСБ 200 нг/мл)
Созревшие ооциты стадиях, 7,1
диплотен
диакинеэ
метафаз I
Дегенерированные ооциты, %:
Абсолютный прирост дсгенерированных клеток, %
Примечание. - Не было обнаружено клеток.
Так же, как и в табл. 1, приведены данные по культивированию ооцитов в.течение 3U ч, но отличия цифровых данных по проценту созревших и дегенерированных ооцитов на стадиях мейоза зависит от состояния исходной популяции.
Разница между количеством дегенерированных ооцитов в начале и конце культивирования.
Таблица 3
Влияние МНСБ на созревание ооцитов коров (выбор оптимальной концентрации MUCH, время культнпнрования 18 часов)
3,4
10,2
3,4
У
+ 3,0
+22,1
| D | |||
| Gospodarowlcz, H | |||
| Blaleckl, 1 Endocrinology, 1979 | |||
| v | |||
| Счетная таблица | 1919 |
|
SU104A1 |
| 757764. | |||
Авторы
Даты
1991-06-30—Публикация
1988-03-18—Подача