Изобретение касается гетероциклических веществ, а именно N-ацильных производных 4-фенил-пирролидин-2-онов общей формулы (1)
R где a) R1 дипропилметил, R2=R3 водород;
где a) R1 дипропилметил, R2=R3 водород;
б) R1 4-хлорфеноксиметил, R2=R3 водород,
в) R1 3-пиридил, R2=R3 водород,
г) R1 4-хлорфенил, R2=R3 водород;
д) R1 4-метоксифенил, R2 этоксикарбонил, R3 водород,
е) R1 дипропилметил, R2 этоксикарбонил, R3 водород,
ж) R1 дипропилметил, R2 водород, R3 хлор,
з) R1 4-метоксифенил, R2 водород, R3 хлор,
и) R1 4-хлорфенокасиметил, R2 водород, R3 хлор,
которые обладают церебропротективным (ноотропным) действием и могут найти применение в медицине.
В медицинской практике в качестве ноотропного средства широко применяется пирацетам: 2-оксо-1-пирролидинилацетамид. Его недостатком является необходимость использования в течение длительного времени, что приводит к появлению побочных эффектов.
Цель изобретения создание в ряду пирролидона-2 новых веществ, обладающих более высокой неотропной активностью при низкой токсичности.
П р и м е р 1. N-Дипропилацетил-4-фенилпирролидин-2-он (1а)
Раствор 32,4 г (0,2 моль) 4-фенил-пирролидона в 300 мл толуола и 35,8 г (0,22 моль) дипропилацетилхлорида кипятят 20 ч при 140оС (температура бани), охлаждают, добавляют 10 г триэтиламина, нагревают 1 ч при 100оС, охлаждают, промывают реакционную массу насыщенным раствором К2СО3 и 2 раза водой, сушат над СаCl2, отгоняют в вакууме растворитель, остаток перегоняют и получают 1а, выход 87% т.кип. 163-165оС/2 мм.
Найдено, C 75,49, H 8,78, N 4,82
C18H25NO2
Вычислено, C 75,22, H 8,77, N 4,87.
ИК-спектр, ν см-1: 1740 (С=О) и 1690 (С=О).
П р и м е р 2. N-(n-Хлорфеноксиацетил)-4-фенил-пирролидин-2-он (1б).
Смесь 6,8 г (0,032 моль) хлорангидрида n-хлорфеноксиуксусной кислоты, 4,8 г (0,03 моль) 4-фенил-пирролид-2-она, 3 мл (0,032 моль) триэтиламина в 30 мл толуола кипятят 3 ч при 110-120оС, выпавший осадок фильтруют, промывают толуолом, затем водой, 2 н. NaOH, водой, сушат и получают соединение 1б, выход 7,5 г (76,5%), т.пл. 127-128оС (из бензола):
Найдено, C 65,71; H 5,02, Cl 10,56
C18H16ClNO3
Вычислено, C 65,55, H 4,89, Cl 10,75
ИК-спектр (KBr), ν см-1: 1733 и 1709 ( СО), 1670 ( СО).
ПМР-спектр, (CDCl3), δ м.д. 2,85 т (2Н, 3-СН-пирролидона), 3,40-3,82 м (2Н, 5-СН2), 4,05-4,30 м (1Н, 4-СН), 5,15 с (2Н, СН2О), 6,7-7,2 м (9Н, аром. ).
Масс-спектр: 331 (М+), 329 (М+).
П р и м е р 3. N-Никотиноил-4-фенил-пирролидин-2-он (1в).
Смесь хлорангидрида никотиновой кислоты из 2,52 г (0,02 моля) никотиновой кислоты и SOCl2, 2,9 г (0,18 моль) 4-фенилпирролид-2- она, 3,6 мл (0,04 моль) триэтиламина в 15 мл толуола нагревают 9 ч при 100-110оС, выпавший осадок фильтруют, промывают бензолом и водой, сушат и получают 3,1 г (58,5%) соединения 1в, т.пл. 146-147оС (бензол).
Найдено, C 72,05, H 5,49, N 10,59
C16H14N2O2
Вычислено, C 72,16, H 5,29, N 10,53
ИК-спектр (KBr), см-1: 1746 (ν СО), 1671 ( СО). ПМР-спектр (CDCl3), δ м. д. 2,75 (2Н, 3-СН2 пирролидона), 3,45-4,5 м (3Н, 4-СН и 5-СН2), 7,24 с (6Н, С6Н5+2Н Ру), 7,82 м (1Н, 6Н Ру) и 8,75 м (2Н, 4Н+5Н Ру).
Масс-спектр: 266 (М+).
П р и м е р 4. N-(4-Хлорбензоил)-4-фенил-пирролидин-2-он (1 г).
Синтезирован аналогично соединению 1в с использованием 1 эквивалента триэтиламина. Выход соединения 1 г 15,7 г (65,4%), т.пл. 157-158оС (из бензола).
Найдено, C 68,40, H 4,65, Cl 11,64, N 4,69
C17H14ClNO2
Вычислено, C 68,11, H 4,71, Cl 11,83, N 4,67
ИК-спектр (KBr), см-1: 1746 ( ν СО), 1671 (ν СО). ПМР- спектр (CDCl3),δ м. д. 2,62 т (СН2, 3-СН2), 3,40-4,30 м (3Н, 4СН+5-СН2), 7,10-7,50 м (9Н, аром.). Масс-спектр: 301 (М+), 289 (М+), 273 (М-СО), 271 (М-СО).
П р и м е р 5. N-(4-Метоксибензоил)-3-этоксикарбонил-4- фенилпирролидин-2-он (1д).
Синтезирован аналогично соединению 1, при нагревании в течение 6 ч. Выход 66% т.пл. 137-138оС (из бензола).
Найдено, C 68,71, H 5,73
C21H21NO5
Вычислено, C 68,65, H 5,76
ИК-спектр (KBr), см-1: 1751 (C=O), 1724 (С=О), 1679 (С=О).
ПМР-спектр (CDCl3), δ м.д. 1,25 т (3Н, СН3-СН2), 3,78 д (1Н, 3-Н пирролидона), 3,83 с (3Н, ОСН3), 3,97 (1Н, 4-Н пирролидона), 4,04 д.д. (1Н, 5-Н пирролидона), 4,22 к (2Н, СН2-СН3), 4,31 д.д. (1Н, 5-Н пирролидона), 6,90 м (2Н, аром.), 7,20-7,40 м (5Н, аром.), 7,69 м (2Н, аром.).
П р и м е р 6. N-Дипропилацетил-3-этоксикарбонил-4-фенил- пирролидин-2-он (1е).
Синтезирован аналогично соединению 1а с использованием 1,5 экв. дипропилацетилхлорида и 1,5 экв. триэтиламина и кипячении в течение 4 ч. Выход 5,7 г (76%), т.пл. 50-51оС (из гексана).
Найдено, C 70,22, H 8,05
C21H29NO4
Вычислено, C 70,17, H 8,13
ИК-спектр, (KBr), ν см-1: 1746 (С=О), 1725 (С=О), 1697 (С=О).
ПМР-спектр (CDCl3), δ м.д. 0,9 т (3Н, СН3), 1,2-1,8 м (14Н, 2С3Н7), 3,72 д. д. (1Н, 5-Н пирролидона), 3,8 м (1Н, СН(С3Н7)2), 3,83 д (1Н, 3-Н пирролидона), 3,95 м (1Н, 4-Н пирролидона), 4,24 к (2Н, СН2-СН3), 4,33 д.д. (1Н, 5-Н пирролидона), 7,20-7,40 м (5Н, аром).
П р и м е р 7. N-Дипропилацетил-4-(4-хлорфенил)пирролидин-2-он (1ж).
Смесь 38,8 г (0,2 моль) 4-(4-хлорфенил)-пирролидин-2-она, 35,8 г (0,22 моль) дипропилацетилхлорида и 300 мл толуола нагревают 6 ч при 130оС на масляной бане до прекращения выделения HCl охлаждают, смесь промывают 100 мл насыщенного раствора К2СО3 и 2 раза 100 мл воды. Выпавший осадок отфильтровывают, толуольный раствор сушат над CaCl2, растворитель отгоняют в вакууме, остаток перегоняют и получают 51 г (79%) 1ж, т.кип. 200-202оС (0,5 мм).
Найдено, C 66,71, H 7,03, Cl 11,06, N 4,55
C18H24ClNO2
Вычислено, C 67,17, H 7,52, Cl 11,02, N 4,35
П р и м е р 8. N-(4-Метоксибензоил)-4-(4-хлорфенил)пирролидин-2- он (1з).
Синтезирован аналогично соединению 1б, выход 19,6 г (59% ), т.пл. 163,5-165оС (из толуола).
Найдено, C 65,62, H 4,95, Cl 10,84, N 4,45
C18H16ClNO3
Вычислено, C 65,55, H 4,89, Cl 10,75, N 4,25
ИК-спектр, см-1: 1750, 1655, 1605, 1360, 1030.
П р и м е р 9. N-(4-хлорфеноксиацетил)-4-(4-хлорфенил)пирролидин- 2-он (1и).
Синтезирован аналогично соединению 1б, выход 11,0 г (78,6%), т.пл. 181,5-183оС (хлорбензол).
Найдено, C 59,56, H 4,27, Cl 19,54, N 3,94
C18H15Cl2NO3
Вычислено, C 59,36; H 4,15, Cl 19,47, N 4,15
Фармакологическую активность соединений I изучали в острых опытах на белых беспородных мышах весом 18-22 г и крысах весом 180-220 г. Вещества вводили внутрибрюшинно за 40 мин до регистрации эффекта. Ноотропная (церебропротективная) активность соединений I и пирацетама оценивалась по следующим показателям: антиамнестическая активность в условиях выработки условного рефлекса активного избегания (УРАИ) с применением в качестве амнезирующих воздействий максимального электрошока (МЭШ), противогипоксическая активность в условиях модели гипоксии с гиперкапнией в гермообъеме.
Кроме того, оценивалось влияние соединений I на судорожное воздействие коразола, влияние на ориентировочно-исследовательскую активность и координацию движений по тексту вращающегося стержня, а также токсичность соединений.
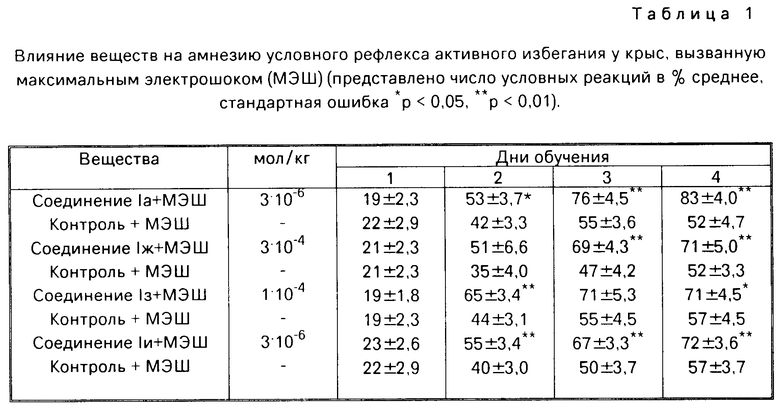
Влияние на амнезию, вызванную применением электрошока.
Антиамнестическое действие соединений I изучали в опытах на крысах в условиях методики условного рефлекса активного избегания (УРАИ) в камере для вспрыгивания на стержень. В качестве условного раздражителя служил звуковой сигнал. Через 8 с после него крысам наносили электрокожное раздражение на лапы (40 В) как безусловный сигнал продолжительностью 12 с. Регистрировали число условных реакций (вспрыгиваний на стержень в течение 8 с) при 10 опытах комбинациях в день в течение 4 дней эксперимента. Непосредственно после ежедневной тренировки крысы получали через ушные электроды электроконвульсивный шок (МЭШ) как амнестический фактор. Вещества вводили ежедневно за 60 мин до тренировки, внутрибрюшинно.
Установлено, что все соединения I обладают антиамнестической активностью (табл. 1), ослабляя угнетающее воздействие МЭШ на процесс обучения крыс условному рефлексу активного избегания. При этом под влиянием соединений Ia, д, ж, з, и у крыс достоверно увеличивалось количество избеганий тока, особенно на 3-й и 4-й дни обучения. Наибольшей активностью обладало соединение Ia, причем его антиамнестические свойства выявлялись во 100 раз меньших дозах, чем это характерно для пирацетама.
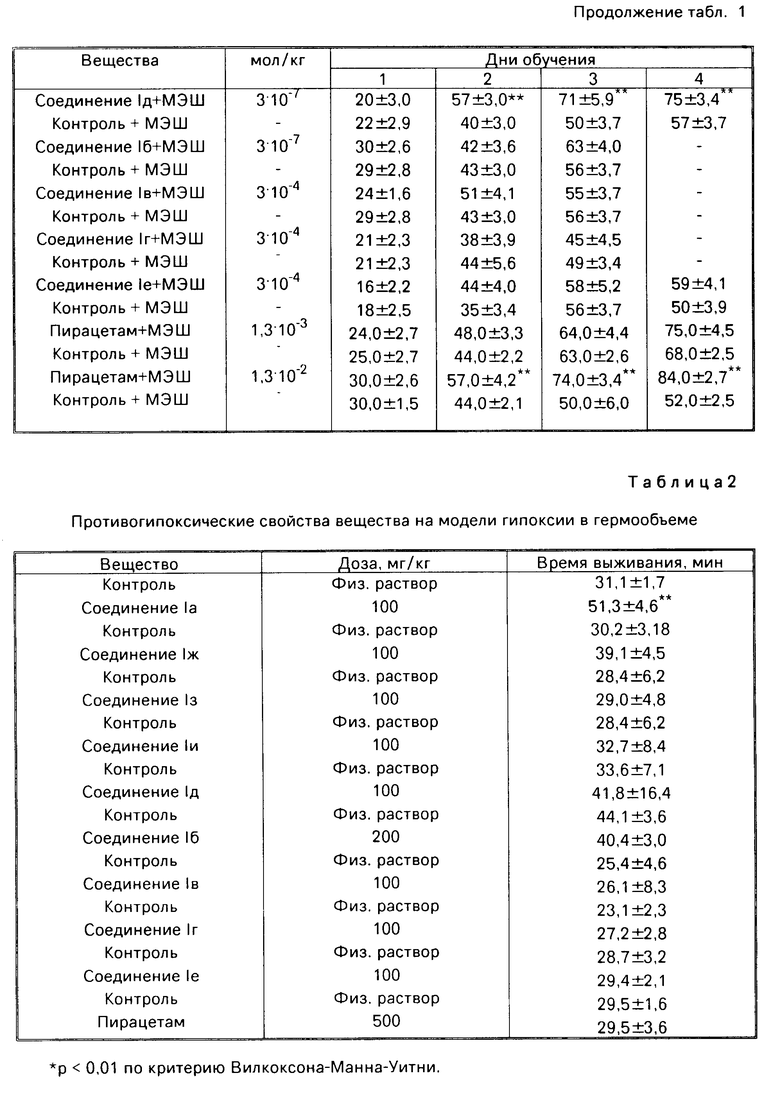
Антигипоксическое действие соединений I изучали на модели гипоксической гипоксии в гермообъеме. В условиях модели гипоксии с гиперкапнией регистрировали продолжительность жизни каждого животного, помещенного в герметично закупоренную емкость объемом 200 мл.
Установлено, что соединения I обладают противогипоксической активностью по данному тесту (табл.2). Так, соединение Ia в дозе 100 мг/кг более чем в 1,5 раза увеличивает продолжительность жизни животных в гермокамере. Пирацетам в дозе 500 мг/кг не обладает защитным эффектом в условиях этой модели.
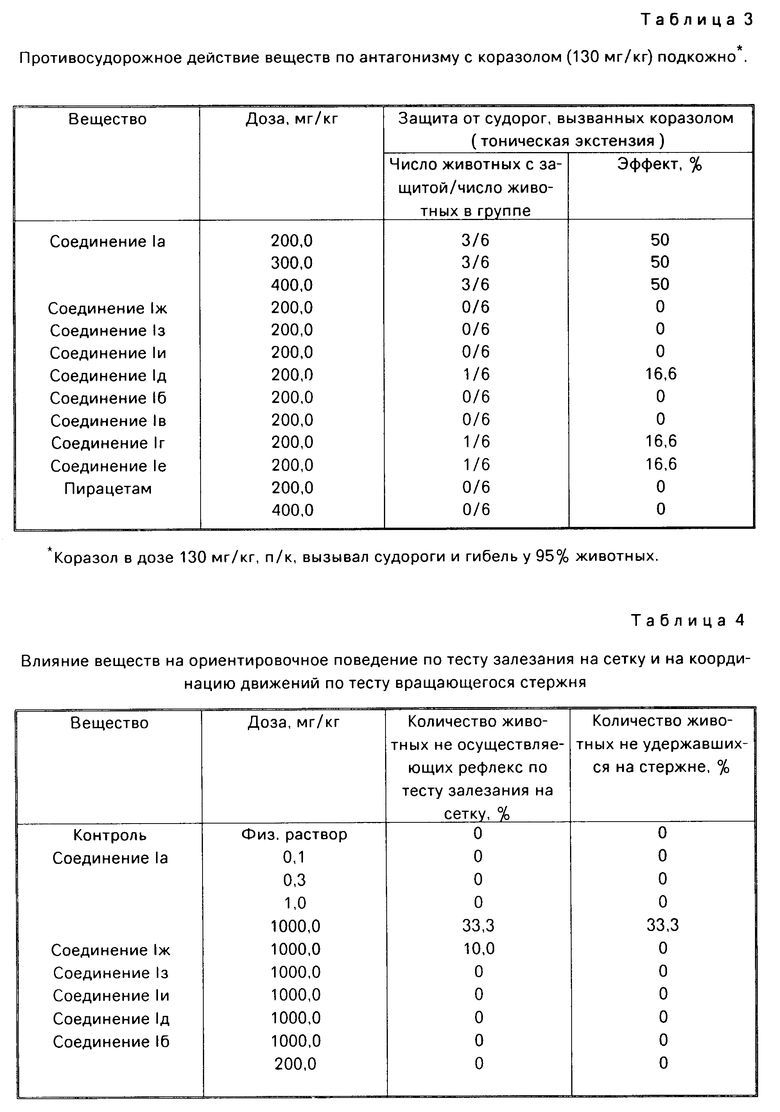
Противосудорожное действие соединений оценивали в опытах на мышах по антагонизму с коразолом по способности веществ предупреждать тонико-клонический компонент судорожного припадка и гибель животных. Коразол в дозе 130 мг/кг (ЭД95-доза, вызывающая судороги и гибель у 95% животных) вводили подкожно за 10 мин до проявления максимального эффекта заявляемых веществ. Регистрировали процент животных, у которых наблюдался защитный эффект.
Установлено, что соединение Ia в дозах 200 мг/кг, 300 мг/кг и 400 мг/кг обладает способностью предупреждать, у 50% животных тонико-экстензорный компонент судорожного припадка и гибель, вызванные коразолом (табл.3). Остальные соединения I в дозе 200 мг/кг в условиях этого теста не обладали противосудорожными свойствами.
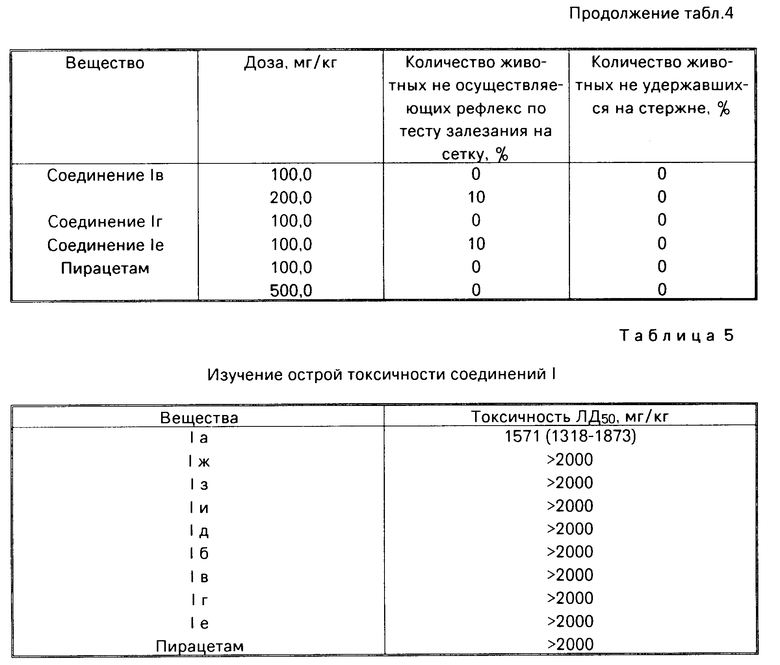
Для оценки влияния веществ на ориентировочное поведение использовали тест залезания на сетку, а для оценки нарушений координации движений тест вращающегося стержня. Все изученные соединения в дозах 100 мг/кг и 200 мг/кг не нарушали ориентировочно-исследовательского поведения в тесте залезания на сетку и не вызывали у животных нарушения координации движений на вращающемся стержне (табл.4).
Острая токсичность соединений I.
Токсичность соединений изучалась в опытах на мышах при внутрибрюшинном введении. Регистрацию гибели животных проводили через 24 ч после введения веществ.
Установлено, что все изученные вещества обладали низкой токсичностью.
Таким образом, соединения I превосходят пирацетам по церебропротекторному (ноотропному) действию, обладая низкой токсичностью.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ АНТИДИАБЕТИЧЕСКИЕ АГЕНТЫ | 2000 |
|
RU2265012C2 |
| CПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1,2,3,6-ТЕТРАГИДРОПИРРОЛО[1,2-d][1,4]ДИАЗОЦИНОВ | 2008 |
|
RU2378279C1 |
| НОВЫЕ ПРОИЗВОДНЫЕ ПИРРОЛИДИН-3,4-ДИКАРБОКСАМИДА | 2005 |
|
RU2379288C2 |
| 1-ФЕНИЛ-БЕНЗИМИДАЗОЛЬНЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ РАССТРОЙСТВА ИЛИ ЗАБОЛЕВАНИЯ, ЧУВСТВИТЕЛЬНОГО К МОДУЛЯЦИИ ГАМК-РЕЦЕПТОРНОГО КОМПЛЕКСА ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ | 1997 |
|
RU2194699C2 |
| СПОСОБ ПОЛУЧЕНИЯ С-ФОСФОРИЛИРОВАННЫХ АЛКИЛАМИДИНОВ | 2007 |
|
RU2334752C1 |
| ПРОИЗВОДНЫЕ 1,3,4-ТИОДИАЗОЛ-2-КАРБОНОВЫХ КИСЛОТ | 1992 |
|
RU2050357C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗОЦИКЛОАЛКЕНИЛДИГИДРООКСИАЛКАНОВЫХ КИСЛОТ | 1990 |
|
RU2012554C1 |
| ПРОИЗВОДНЫЕ ПИРРОЛО(2,1-b)ТИАЗОЛА И ПРОИЗВОДНЫЕ 2-ТИОКСОПИРРОЛИДИНА В КАЧЕСТВЕ ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ ДЛЯ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРРОЛО(2,1-b)ТИАЗОЛА | 1991 |
|
RU2026288C1 |
| ПРОИЗВОДНЫЕ N-АЦИЛПРОЛИЛДИПЕПТИДОВ | 1993 |
|
RU2119496C1 |
| Способ получения аммонийных солей 3-амино-8-гидрокси-1,6-диоксо-4-циано-2,7-диазаспиро[4.4]нон-3-ен-2-идов | 2016 |
|
RU2631856C1 |
Изобретение касается гетероциклических веществ, в частности N-ацильных производных 4-фенил-пирролидин-2-онов общей ф-лы: 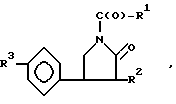 где а) при R2=R3-H, R1 дипропилметил, 4-хлорфеноксиметил, 3-пиридил, 4-хлорфинил, б) при R2 этоксикарбонил и R3 H, R1 4-метоксифенил, дипропилметил, в) при R2-H и R3 хлор, R1 -4-метоксифенил, 4-хлорфеноксиметил, дипропилметил, проявляющих церебропротективную (ноотропную) активность, что может найти применение в медицине. Цель создание более активных веществ указанного класса. Получение ведут реакцией соответствующих 4-фенил-пирролидин-2-онов с соответствующими хлорангидридами в толуоле в присутствии триэтиламина. Выход, т. пл.°С, или т.кип.°С (мм рт.ст.), бруттоформула, токсичность ЛД50, мг/кг (в/б): а) 87, 163-165 (2), C18H25NO2, 1571, б) 76,5, 127-128, C18H16ClNO3, >2000, в) 58,5, 146-147, C16H14N2O2, >2000, г) 65,4, 157-158, C17H14ClNO2, >2000, д) 66, 137 138, C21H21NO5, >2000, е) 76, 50 51, C21H29NO4, >2000, ж) 79,200 202/0,5 мм, C18H24ClNO2, >2000, з) 59,163,5-165, C18H16ClNO3, >2000, и) 78,6, 181,5-183, C18H15Cl2NO3, >2000. Новые вещества превосходят по антиамнестическому воздействию пирацетам в 10-100 раз. 5 табл.
где а) при R2=R3-H, R1 дипропилметил, 4-хлорфеноксиметил, 3-пиридил, 4-хлорфинил, б) при R2 этоксикарбонил и R3 H, R1 4-метоксифенил, дипропилметил, в) при R2-H и R3 хлор, R1 -4-метоксифенил, 4-хлорфеноксиметил, дипропилметил, проявляющих церебропротективную (ноотропную) активность, что может найти применение в медицине. Цель создание более активных веществ указанного класса. Получение ведут реакцией соответствующих 4-фенил-пирролидин-2-онов с соответствующими хлорангидридами в толуоле в присутствии триэтиламина. Выход, т. пл.°С, или т.кип.°С (мм рт.ст.), бруттоформула, токсичность ЛД50, мг/кг (в/б): а) 87, 163-165 (2), C18H25NO2, 1571, б) 76,5, 127-128, C18H16ClNO3, >2000, в) 58,5, 146-147, C16H14N2O2, >2000, г) 65,4, 157-158, C17H14ClNO2, >2000, д) 66, 137 138, C21H21NO5, >2000, е) 76, 50 51, C21H29NO4, >2000, ж) 79,200 202/0,5 мм, C18H24ClNO2, >2000, з) 59,163,5-165, C18H16ClNO3, >2000, и) 78,6, 181,5-183, C18H15Cl2NO3, >2000. Новые вещества превосходят по антиамнестическому воздействию пирацетам в 10-100 раз. 5 табл.
N-Ацильные производные 4-фенил-пирролидин-2-онов общей формулы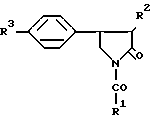
где а) R1-дипропилметил, R2 R3.-водород;
б) R1-4-хлорфеноксиметил, R2 R3 водород;
в) R1-3-пиридил, R2 R3 водород,
г) R1-4-хлорфенил, R2 R3 водород,
д) R1-4-метоксифенил, R2 этоксикарбонил, R3 водород,
е) R1-дипропилметил, R2 этоксикарбонил, R3 водород;
ж) R1-дипропилметил, R2 водород, R3 хлор;
з) R1-4-метоксифенил, R2 водород, R3 хлор;
и) R1-4-хлорфеноксиметил, R2 водород, R3 хлор, обладающие церебропротективным (ноотропным) действием.
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1986, с.1, с.117. |
Авторы
Даты
1995-10-10—Публикация
1990-05-30—Подача