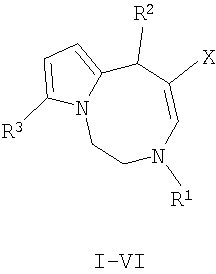
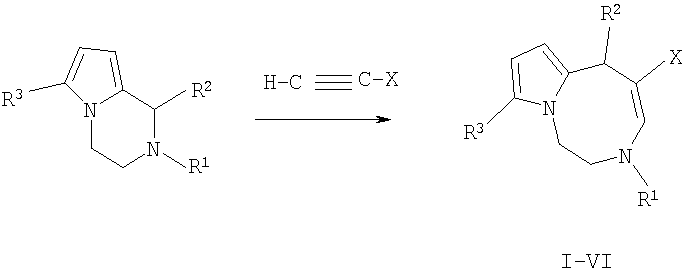
Изобретение относится к способу получения нового класса соединений с общей формулой I-VI:
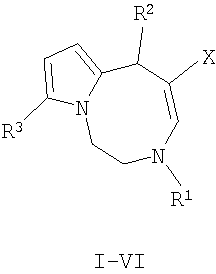
где:
Синтез близких по строению соединений описан лишь в двух работах (Т.А.Гудашева, Н.И.Василевич, Р.У.Островская, С.С.Трофимов, Т.А.Воронина, А.П.Сколдинов, Г.Г.Розанцев. Синтез и ноотропная активность пирролидино[1,2-а]диазациклоалканонов. Химико-фармацевтический журнал. 1996,12-15):

а также в работе (A.A.Mazurov, S.A.Andronatti, T.I.Korotenko, N.I.Sokolenko, A.I.Diadenko, Y.E,Shapiro, V.Y.Gorbatuk, T.A.Voronina. Design of novel cognitive enhancer (8S, 10aS)-8-carbamoil-1,2,3,6,7,8,9,10a-octahydro-5H, 10H-hyrrolo[l,2-a] [1,4]diazocin-5,10-dione. Bioorganic&Medicinal Chemistry Lettres, Vol.6, №21, pp.2595-2600,1996):
Техническим результатом, на решение которого направлено изобретение, является получение нового класса соединений 1,2,3,6-тетрагидропирроло[1,2-d][1,4]диазоцинов, которые могут представлять интерес в качестве ноотропных соединений (Т.А.Гудашева, Н.И.Василевич, Р.У.Островская, С.С.Трофимов, Т.А.Воронина, А.П.Сколдинов, Г.Г.Розанцев. Синтез и ноотропная активность пирролидино[1,2-а]диазациклоалканонов. Химико-фармацевтический журнал. 1996, 12-15).
Технический результат достигается тем, что способ получения производных 1,2,3,6-тетрагидропирроло[1,2-d][1,4]диазоцинов с общей структурной формулой:
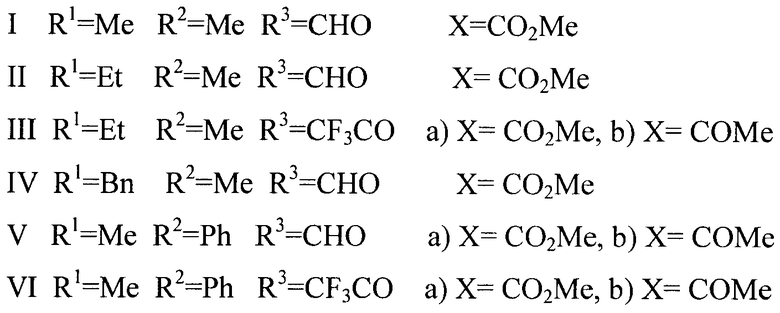
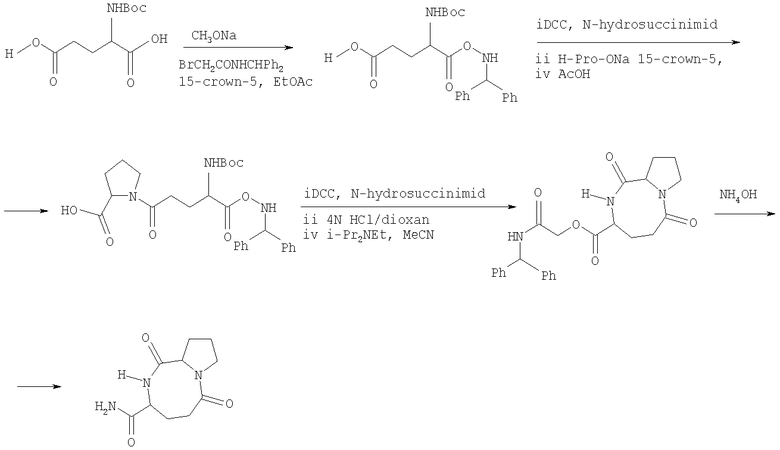
заключается в том, что производные 1,2,3,4-тетрагидропирроло[1,2-a]пиразинов растворяют в ацетонитриле и подвергают взаимодействию с двумя молями метилпропиолата или ацетилацетилена при кипячении не менее 7 часов, остаток, полученный по окончании реакции и удаления растворителя, очищают с помощью колоночной хроматографии на оксиде алюминия.
Таким образом, предложенный способ позволяет в один этап из 1,2-диметил; 1-метил-2-этил; 1-метил-2-бензил; 1-фенил-2-метил-1,2,3,4-тетрагидропирроло[1,2-a] пиразин-6-карбальдегидов и 1-метил-2-этил-6-трифторацетил; 1-фенил-2-метил-6-трифторацетил-1,2,3,4-тетрагидропирроло[1,2-а]пиразинов получить производные 1,2,3,6-тетрагидропирроло [1,2-d][1,4]диазоцинов.
Способ осуществляется следующим образом. К раствору тетрагидропирроло[1,2-а]пиразинов (1 ммоль) в 20 мл ацетонитрила добавляют 2 ммоль активированного алкина (метилпропиолат, ацетилацетилен). Реакционную массу выдерживают при кипении растворителя. Ход реакции контролируют с помощью тонкослойной хроматографии на силуфоле, элюент - этилацетат. Время реакции составляет от 7 часов до 5 дней. После окончания реакции растворитель упаривают досуха, полученный остаток очищают с помощью колоночной хроматографии на оксиде алюминия, элюент - этилацетат-гексан, 1:10. Таким образом, 1,2,3,6-тетрагидропирроло[1,2-d][1,4]диазоцины получают из 1,2,3,4-тетрагидропирроло[1,2-a]пиразинов при взаимодействии с метилпропиолатом или ацетилацетиленом в один этап в кипящем ацетонитриле:
Выходы тетрагидропирроло[1,2-d][1,4]диазоцинов колеблются от 11 до 51% и зависят от природы заместителей в положениях 1 и 2 исходных тетрагидропирроло [1,2-a]пиразинов.
Строение полученных соединений подтверждено методами масс-спектрометрии, ИК спектроскопии и спектроскопии ПМР.
Пример 1
К раствору 0,5 г (2,8 ммоль) тетрагидропирролопиразина (R1=R2=Me, R3=CHO) в 20 мл ацетонитрила прибавляют 0,47 г (5,6 ммоль) метилпропиолата, далее кипятят 2 дня. Ход реакции контролируют с помощью тонкослойной хроматографии на силуфоле, элюент - этилацетат. После окончания реакции растворитель упаривают досуха, остаток очищают с помощью колоночной хроматографии на Аl2О3. Смесью этилацетата с гексаном, 1:10, выделяют 0,11 г тетрагидропирролодиазоцина I.
(Е)-Метил 9-формил-3,6-диметил-1,2,3,6-тетрагидропирроло[1,2-d][1,4]диазоцин-5-карбоксилат (I): выход 14%, желтые кристаллы с т.пл. 122-124°С, ИК спектр (в КВr): 1669, 1641, 1608 см -1. 1Н ПМР (CDCl3, 400 МГц): δ=1.55 (д, 3Н, J=7.4 Гц, СНСН 3), 3.0 (с, 3Н, СН3-N), 3.60 (дт, 1Н, J=4.5, 15.6 Гц, 2-СН2), 3.69 (с, 3Н, ОСН3), 3.89 (ддд, 1Н, J=4.5, 11.4, 15.6 Гц, 1-СН2), 4.41 (дт, 1Н, J=4.5, 15.6 Гц, 2-СН2), 4.68 (кв, 1Н, J=7.4 Гц, СНСН3), 5.38 (ддд, 1Н, J=4.5, 11.4, 15.6, 1-СН2), 6.07 (д, 1Н, J=4.0 Гц, 7-Н), 6.86 (д, 1Н, J=4.0 Гц, 8-Н), 7.47 (с, 1Н, 4-Н), 9.38 (с, 1Н, СНО). Масс-спектр m/z: 262 (M+). C14H18N2O3. Вычислено: N 10.69%, найдено: N 10.63%.
Пример 2
К раствору 0,46 г (2,4 ммоль) тетрагидропирролопиразина (R1=Et, R2=Me, R3=CHO) в 20 мл ацетонитрила прибавляют 0,40 г (4,8 ммоль) метилпропиолата, далее кипятят 5 дней. Ход реакции контролируют с помощью тонкослойной хроматографии на силуфоле, элюент - этилацетат. После окончания реакции растворитель упаривают досуха, остаток очищают с помощью колоночной хроматографии на Аl2О3. Смесью этилацетата с гексаном, 1:10, выделяют 0,081 г тетрагидропирролодиазоцина II.
(Е)-Метил-3-этил-9-формил-6-метил-1,2,3,6-тетрагидропирроло[1,2-d][1,4]диазоцин-5-карбоксилат (II): выход 12%, желтые кристаллы с т.пл. 104-106°С, ИК спектр (в КВr): 1716, 1656, 1610 см -1. 1Н ПМР (CDCl3, 400 МГц): δ=1.10 (т, 3Н, J=7.2 Гц, СН2 СН 3), 1.53 (д, 3Н, J=7.4 Гц, СНСН 3), 3.17-3.29 (м, 2Н, СН 2СН3), 3.68 (с, 3Н, ОСН3), 3.74 (уш.с, 1Н, 1-CH2), 3.84 (ддд, 1Н, J=4.1, 9.2, 15.4 Гц, 1-СН2), 4.44 (дт, 1Н, J=4.1, 15.3 Гц, 2-СН2), 4.68 (кв, 1Н, J=7.44 Гц, СНСН3), 5.39 (м, 1Н, 1-СН2), 6.05 (д, 1Н, J=3.9 Гц, 7-Н), 6.85 (д, 1Н,.7=3.9 Гц, 8-Н), 7.52 (с, 1Н, 4-Н), 9.36 (с, 1Н, СНО). Масс-спектр m/z: 276 (М+). С15Н20N2O3. Вычислено: N 10.12%, найдено: N 10.14%.
Пример 3
К раствору 0,33 г (1,3 ммоль) тетрагидропирролопиразина (R1=Et, R2=Me, R3=CF3CO) в 15 мл метанола прибавляют 0,22 г (2,6 ммоль) метилпропиолата, далее кипятят 1 день. Ход реакции контролируют с помощью тонкослойной хроматографии на силуфоле, элюент - этилацетат-гексан, 1:2. После окончания реакции растворитель упаривают досуха, остаток очищают с помощью колоночной хроматографии на Аl2О3. Смесью этилацетата с гексаном, 1:10, выделяют 0,14 г тетрагидропирролодиазоцина IIIa.
(Е)-Метил 3-этил-9-трифторацетил-6-метил-1,2,3,6-тетрагидропирроло[1,2-d][1,4]диазоцин-5-карбоксилат (IIIа): выход 24%, желтое кристаллизующееся масло, ИК спектр (в КВr): 1681, 1604 см-1. 1H ПМР (СDСl3, 400 МГц): δ=1.13 (т, 3Н, J=7.2 Гц, СН2 СН 3), 1.55 (д, 3Н, J=7.3 Гц, СНСН 3), 3.24 (м, 2Н, СН 2СН3), 3.70 (с, 3Н, ОСН3), 3.73 (т, 1Н, J=4.9 Гц, 2-СН2), 3.82 (ддд, 1Н, J=5.3, 9.2, 15.2 Гц, 1-СН2), 4.55 (дт, 1Н, J=4.9, 15.5 Гц, 2-СН2), 4.70 (кв, 1Н, J=7.3 Гц, СНСН3), 5.26 (ддд, 1Н, J=4.9, 9.8, 15.2 Гц, 1-СН2), 6.13 (д, 1Н, J=4.3 Гц, 7-Н), 7.22 (кв, 1Н, J=2.1 Гц, 8-Н), 7.53 (с, 1Н, 4-Н). Масс-спектр, m/z: 344 (М+). С16Н19F3N2O3. Вычислено: N 8.14%, найдено: N8.15%.
Пример 4
К раствору 0,33 г (1,3 ммоль) тетрагидропирролопиразина (R1=Et, R2=Me, R3=СF3СО) в 15 мл метанола прибавляют 0,18 г (2,6 ммоль) ацетилацетилена, далее кипятят 1 день. Ход реакции контролируют с помощью тонкослойной хроматографии на силуфоле, элюент - этилацетат-гексан, 1:1. После окончания реакции растворитель упаривают досуха, остаток очищают с помощью колоночной хроматографии на Аl2О3. Смесью этилацетата с гексаном, 1:10, вымывают 0,07 г тетрагидропирролодиазоцина IIIb.
1-(5-ацетил-3-этил-6-метил-1,2,3,6-тетрагидропирроло[1,2-d][1,4]диазоцин-9-ил)-2,2,2-трифторэтанон (IIIb): выход 12%, желтое кристаллизующееся масло, ИК спектр (в КВr): 1645, 1586 см-1. 1H ПМР (СDСl3, 400 МГц): δ=1.16 (т, 3Н, J=7.2 Гц, CH2 СН 3), 1.52 (д, 3Н, J=7.4 Гц, СНСН 3), 2.23 (с, 3Н, СOСН3), 3.31 (м, 2Н, СН 2СН3), 3.68 (дт, 1Н, J=4.4, 15.7 Гц, 2-СН2), 3.97 (ддд, 1Н, J=4.4, 11.2, 16.0 Гц, 1-СН3), 4.46 (дт, 1Н, J=3.9, 15.6 Гц, 2-СН2), 5.01 (кв, 1Н, J=7.4 Гц, СНСН3), 5.37 (ддд, 1Н, J=5.5, 11.2, 16.0 Гц, 1-СН2), 6.09 (д, 1Н, J=4.4 Гц, 7-Н), 7.20 (кв, 1Н, J=2.1 Гц, 8-Н), 7.39 (с, 1Н, 4-Н). Масс-спектр, m/z: 328 (М+). C16H19F3N2O2. Вычислено: N 8.40%, найдено: N 8.53%.
Пример 5
К раствору 0,36 г (1,4 ммоль) тетрагидропирролопиразина (R1=Bn, R2=Me, R3=CHO) в 20 мл метанола прибавляют 0,24 г (2,8 ммоль) метилпропиолата, далее кипятят 3 дня. Ход реакции контролируют с помощью тонкослойной хроматографии на силуфоле, элюент - этилацетат-гептан, 1:3. После окончания реакции растворитель упаривают досуха, остаток очищают с помощью колоночной хроматографии на Аl2О3. Смесью этилацетата с гексаном, 1:10, выделяют 0,08 г тетрагидропирролодиазоцина IV.
(Е)-Метил 3-бензил-9-формил-6-метил-1,2,3,6-тетрагидропирроло[1,2-d][1,4]диазоцин-5-карбоксилат (IV): выход 17%, желтые кристаллы с т.пл. 68-70°С, ИК спектр (в КВr): 1689, 1655, 1619 см-1. 1H ПМР (CDCl3, 400 МГц): δ=1.52 (д, 3Н, J=6.3 Гц, СНСН 3), 3.29 (с, 2Н, СН 2Н3), 3.42 (ус, 1Н, 2-СН3), 3.68 (с, 3Н, ОСН3), 4.31 (уш.с, 1Н, 2-СН2), 4.38 (м, 1Н, 1-СН2), 4.44 (кв, 1Н, J=6.3 Гц, СНСН3), 4.55 (ддд, 1Н, J=2,7, 7.1, 13.7 Гц, 1-СН2), 6.26 (д, 1Н, J=3.9 Гц, 7-Н), 6.93 (д, 1Н, J=3.9 Гц, 8-Н), 7.19 (д, 2Н, J=7.1 Гц, С6Н5), 7.29 (м, 4Н, С6Н5), 7.59 (с, 1Н, 4-Н), 9.47 (с, 1Н, СНО). Масс-спектр m/z: 338 (М+). С20Н22N2O3. Вычислено: N 6.55%, найдено: N 6.70%.
Пример 6
К раствору 0,37 г (1,5 ммоль) тетрагидропирролопиразина (R3=Me, R2=Ph, R3=CHO) в 15 мл ацетонитрила прибавляют 0,25 г (3,0 ммоль) метилпропиолата, далее кипятят 5 дней. Ход реакции контролируют с помощью тонкослойной хроматографии на силуфоле, элюент - этилацетат-гексан, 1:1. После окончания реакции растворитель упаривают досуха, остаток очищают с помощью колоночной хроматографии на Аl2О3. Смесью этилацетата с гексаном, 1:10, выделяют 0,23 г тетрагидропирролодиазоцина Va.
(Е)-Метил 3-метил-9-формил-6-фенил-1,2,3,6-тетрагидропирроло[1,2-d][1,4]диазоцин-5-карбоксилат (Va): выход 50%, желтые кристаллы с т.пл. 163-164°С, ИК спектр (в КВr): 1783, 1653, 1601 см-1. 1H ПМР (CDCl3, 400 МГц): δ=2.85 (дд, 1Н, J=5.1, 15.8 Гц, 2-СН2), 3.00 (с, 3Н, NCH3), 3.76 (уш.с, 4Н, 1-CH2, ОСН3), 3.85 (м, 1Н, 2-СН2), 5.43 (тд, 1Н, J=4.8, 13.9 Гц, 1-CH2), 6.18 (с, 1Н, 6-Н), 6.27 (д, 1Н, J=3.9 Гц, 7-Н), 7.00 (д, 1Н, J=3.9 Гц, 8-Н), 7.05 (д, 2Н, J=7.7 Гц, С6Н5), 7.19 (т, 2Н, J=7.0 Гц, С6Н5), 7.30 (т, 2Н, J=7.1 Гц, С6Н5), 7.69 (с, 1Н, 4-Н), 9.48 (с, 1Н, СНО). Масс-спектр, m/z: 324 (M+). C19H20N2O3. Вычислено: N 8.64%, найдено: N 8.54%.
Пример 7
К раствору 0,30 г (1,3 ммоль) тетрагидропирролопиразина (R1=Me, R2=Ph, R3=CHO) в 15 мл метанола прибавляют 0,18 г (2,6 ммоль) ацетилацетилена, далее кипятят в течение 4 дня. Ход реакции контролируют с помощью тонкослойной хроматографии на силуфоле, элюент - этилацетат-гексан, 1:1. После окончания реакции растворитель упаривают досуха, остаток очищают с помощью колоночной хроматографии на Аl2О3. Смесью этилацетата с гексаном, 1:10, выделяют 0,14 г тетрагидропирролодиазоцина Vb.
(Е)-5-ацетил-3-метил-6-фенил-1,2,3,6-тетрагидропирроло[1,2-d][1,4]диазоцин-9-карбальдегид (Vb): выход 32%, желтые кристаллы с т.пл. 170-171°С, ИК спектр (в КВr): 1657, 1580 см-1. 1H ПМР (СDСl3, 400 МГц): δ=2.37 (с, 3Н, СOСН3), 2.86 (дд, 1Н, J=4.9, 15.7 Гц, 2-СН2), 3.06 (с, 3Н, NСН3), 3.75 (дд, 1Н, J=3.4, 15.1 Гц, 1-СН2), 3.90 (м, 1Н, 2-СН3), 5.49 (тд, 1Н, J=5.5, 14.5 Гц, 1-СН2), 6.51 (с, 1Н, 6-Н), 6.25 (д, 1Н, J=3.9 Гц, 7-Н), 6.92 (д, 2Н, J=7.6 Гц, С6Н3), 6.98 (д, 1Н, J=3.9 Гц, 8-Н), 7.18 (т, 2Н, J=7.0 Гц, С6Н5), 7.27 (т, 2Н, J=6.0 Гц, С6Н5), 7.51 (с, 1Н, 4-Н), 9.48 (с, 1Н, СНО). Масс-спектр m/z: 308 (М+). C19H20N2O2. Вычислено: N 9.08%, найдено: N 9.20%.
Пример 8
К раствору 0,25 г (0,8 ммоль) тетрагидропирролопиразина (R1=Me, R2=Ph, R3=CF3CO) в 8 мл метанола прибавляют 0,14 г (1,6 ммоль) метилпропиолата, далее кипятят в течение 7 часов. Ход реакции контролируют с помощью тонкослойной хроматографии на силуфоле, элюент - этилацетат-гексан, 1:3. После окончания реакции растворитель упаривают досуха, остаток очищают с помощью колоночной хроматографии на Аl2O3. Смесью этилацетата с гексаном, 1:10, выделяют 0,10 г тетрагидропирролодиазоцина VIa.
(Е)-Метил 3-этил-9-трифторацетил-6-фенил-1,2,3,6-тетрагидропирроло[1,2-d][1,4]диазоцин-5-карбоксилат (VIa): выход 32%, белые кристаллы с т.пл. 155-160°С, ИК спектр (в КВr): 1681, 1604 см-1. 1Н ПМР (CDCl3, 400 МГц): δ=2.85 (дд, 1Н, J=5.4, 15.8 Гц, 2-СН2), 3.01 (с, 3Н, NСН3), 3.77 (с, 3Н, ОСН3), 3.85 (дт, 1Н, J=4.0, 14.7 Гц, 1-СН3), 3.93 (дт, 1Н, J=4.1, 16.7 Гц, 2-СН2), 5.35 (ддд, 1Н, J=5.1, 12.0, 14.7 Гц, 1-СН2), 6.25 (с, 1Н, 6-Н), 6.33 (д, 1Н, J=3.9 Гц, 7-Н), 7.05 (д, 2Н, J=7.5 Гц, С6Н5), 7.27 (м, 3Н, С6Н5), 7.34 (уш. с, 1Н, 8-Н), 7.70 (с, 1Н, 4-Н). Масс-спектр, m/z: 392 (М+). С20Н19F3N2O3. Вычислено: N 7.14%, найдено: N 7.25%.
Пример 9
К раствору 0,40 г (1,3 ммоль) тетрагидропирролопиразина (R1=Me, R2=Ph, R3=CF3CO) в 10 мл метанола прибавляют 0,18 г (2,6 ммоль) ацетилацетилена, далее кипятят 7 часов. Ход реакции контролируют с помощью тонкослойной хроматографии на силуфоле, элюент - этилацетат-гексан, 1:3. После окончания реакции растворитель упаривают досуха, остаток очищают с помощью колоночной хроматографии на Аl2О3. Смесью этилацетата с гексаном, 1:10, выделяют 0,12 г тетрагидропирролодиазоцина VIb.
1-(5-ацетил-3-этил-6-фенил-1,2,3,6-тетрагидропирроло[1,2-d][1,4]диазоцин-9-ил)-2,2,2-трифторэтанон (VIb): выход 7%, желтые кристаллы с т.пл. 155-160°С, ИК спектр (в КВr): 1645, 1586 см-1. 1H ПМР (CDCl3, 400 МГц): δ=2.37 (с, 3Н, СOСН3), 2.87 (дд, 1Н, J=4.4, 15.9 Гц, 2-СН3), 3.01 (с, 3H, NCH3), 3.79 (дд, 1Н, J=2.6, 15.3 Гц, 1-СН2), 4.01 (тд, 1Н, J=3.7, 16.6 Гц, 2-СН2), 5.42 (тд, 1Н, J=5.5, 14.6 Гц, 1-СН2), 6.28 (д, 1Н, J=4.2 Гц, 7-Н), 6.58 (с, 1Н, 6-Н), 6.93 (д, 2Н, J=7.6 Гц, С6Н5), 7.19 (т, 2Н, J=7.0 Гц, С6Н5), 7.29 (т, 2Н, J=7.2 Гц, С6Н5), 7.34 (кв, J=1.9 Гц, 1Н, 8-Н), 7.53 (с, 1Н, 4-Н). Масс-спектр, m/z: 328 (М+). С16Н19F3N2O2. Вычислено: N 8.40%, найдено: N 8.53%.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-ОКСО-4H-ХРОМЕНОВ, СОДЕРЖАЩИХ ВИНИЛЬНУЮ И ЕНАМИННУЮ ГРУППИРОВКИ | 2011 |
|
RU2468018C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4,5,6,9-ТЕТРАГИДРОТИЕНО[3,2-d]АЗОЦИНОВ | 2006 |
|
RU2320649C9 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 5,8,9,10-ТЕТРАГИДРОПИРИМИДО[4,5-d]АЗОЦИНОВ, ИМЕЮЩИХ В 4-М ПОЛОЖЕНИИ ТРИФЛАТНУЮ, ВТОРИЧНУЮ И ТРЕТИЧНУЮ АМИНОГРУППЫ | 2011 |
|
RU2478637C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗО[7,8]АЗОНИНО[5,4-b]ИНДОЛОВ, 7,9-ЭТЕНОАЗЕЦИНО[5,4-b]ИНДОЛОВ И 7,9-ЭТАНОАЗЕЦИНО[5,4-b]ИНДОЛОВ | 2009 |
|
RU2397984C1 |
| СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЯ, СОЕДИНЕНИЯ, КОМПЛЕКСНЫЙ МЕТАЛЛООРГАНИЧЕСКИЙ КАТАЛИЗАТОР | 2012 |
|
RU2652807C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛОНОВ, СПОСОБ ПОЛУЧЕНИЯ И БИОЛОГИЧЕСКИЕ ПРИМЕНЕНИЯ | 2008 |
|
RU2491283C2 |
| ПРЕДШЕСТВЕННИКИ ВИТАМИНА D, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ | 2000 |
|
RU2247710C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-АРИЛ-2-ОКСО-2Н-ХРОМЕН-3-КАРБОНИТРИЛОВ | 2015 |
|
RU2577524C1 |
| ЗАМЕЩЕННЫЕ АМИНО ШЕСТИЧЛЕННЫЕ НАСЫЩЕННЫЕ ГЕТЕРОАЛИЦИКЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ DPP-IV ДЛИТЕЛЬНОГО ДЕЙСТВИЯ | 2016 |
|
RU2720488C2 |
| 1-ЗАМЕЩЕННЫЕ-3-[(1Е)-1-АЛКЕНИЛ]-4-(5-АЛКОКСИ-1,2-ДИМЕТИЛ-1Н-ИНДОЛ-3-ИЛ)-1Н-ПИРРОЛ-2,5-ДИОНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФЛУОРЕСЦИРУЮЩИХ ФОТОХРОМОВ | 2008 |
|
RU2397979C2 |
Описывается способ получения нового класса соединений - производных 1,2,3,6-тетрагидропирроло[1,2-d][1,4]диазоцина общей формулы I-VI
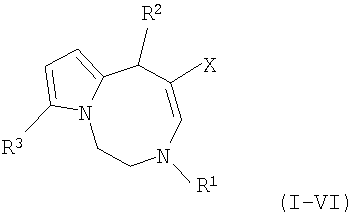
где:
I R1=Me; R2-Me; R3=CHO; X=CO2Me;
II R1=Et; R2=Me; R3=CHO; X=CO2Me;
III R1=Et; R2=Me; R3=CF3CO; a) X=CO2Me, b) X=COMe;
IV R1=Bn; R2=Me; R3=CHO; X=CO2Me;
V R1=Me; R2=Ph; R3=CHO; a) X=CO2Me, b) X=COMe;
VI R1=Me; R2=Ph; R3=CF3CO; a) X=CO2Me, b) X=COMe,
которые могут представлять интерес в качестве ноотропных средств. Способ заключается в том, что соответствующее производное 1,2,3,4-тетрагидропирроло[1,2-а]пиразина растворяют в ацетонитриле и подвергают взаимодействию с двумя молями соединения Н-С=С-Х при кипячении не менее 7 часов, остаток, полученный по окончании реакции и удаления растворителя, очищают с помощью колоночной хроматографии на оксиде алюминия.
Способ получения производных 1,2,3,6-тетрагидропирроло[1,2-d][1,4]диазоцинов общей структурной формулы
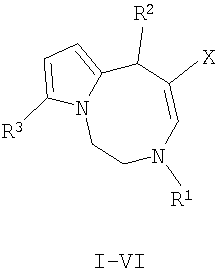

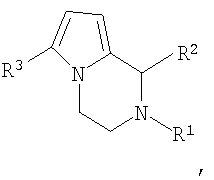
где R1-R3 имеют указанные выше значения, растворяют в ацетонитриле и подвергают взаимодействию с двумя молями соединения общей формулы Н-С≡С-Х, где Х имеет указанное выше значение, при кипячении не менее 7 ч, остаток, полученный по окончании реакции и удаления растворителя, очищают с помощью колоночной хроматографии на оксиде алюминия.
| Гудашева Т.А | |||
| и др | |||
| Химико-фармацевтический журнал, 1996, №12, с.17 | |||
| Mazurov А.А | |||
| et al | |||
| Bioorganic & Medicinal Chemistry Lettres, 1996, Vol.6, №21, p.2595-2600 | |||
| ПРОИЗВОДНЫЕ АМИДОВ, ЯВЛЯЮЩИЕСЯ ИНГИБИТОРАМИ МАТРИЧНЫХ МЕТАЛЛОПРОТЕАЗ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2132851C1 |
| ДИАЗЕПИНОИНДОЛЫ - ИНГИБИТОРЫ ФОСФОДИЭСТЕРАЗ-IV | 1995 |
|
RU2174517C2 |
Авторы
Даты
2010-01-10—Публикация
2008-05-28—Подача