селекции В.И. Ермакоеа не дала положительных результатов.
Наиболее близким к предлагаемому изобретению по технической сущности является способ клепального микроразмно- жения взрослых растений свилеватой карельской березы, Способ включает четыре этапа: введение в культуру верхушечных и пазушных почек и инициация роста каллуса на среде Мурасиге и Скуга (MS-1A) с 1 мг/л БАП в течение двух недель; индукция почкообразования на среде с 10 мг/л БАП, 0,2 мг/л НУК в течение 2-3 недель; удлинение побегов на среде MS с уменьшенной вдвое концентрацией макросолей, 0,5 мг/л БАП, 0,5 мг/л ИУК в течение четырех недель; укоренение на среде MS с половинным содержанием макросолей и сахарозы, без гормонов в течение четырех недель.
Недостатками данного способа являют- ся многоступенчатость технологии (4 этапа), что связано с дополнительными экономическими и временными затратами (12-13 недель), относительно низкий процент укореняемости и приживаемости растений при высадке в открытый грунт, высокий процент инфицирования и гибели регенерантов на этапах культивирования. Кроме того, повышенное использование БАП на втором этапе (10 мг/л) может вызвать нежелатель- ные изменения в генотипе, а длительность укоренения без гормонов (до четырех недель) нежелательна для развития побегов,
Целью изобретения является увеличение выхода растений - регенерантов гибри- дов карельской березы и сокращение сроков выращивания.
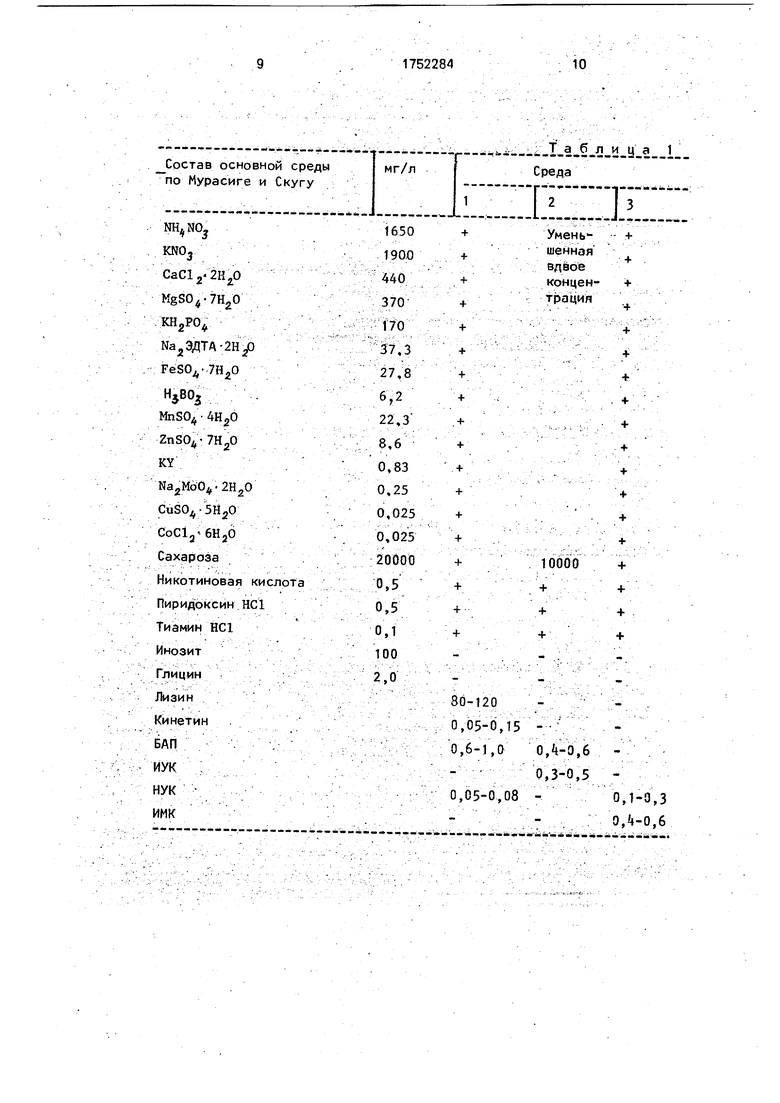
Цель достигается тем, что согласно способу клонального микроразмножения гибридов карельской березы в качестве ис- ходных эксплантов используют верхушечные и пазушные почки гибридов карельской березы, рост каллуса и формирование конгломерата микропобегов проводят на основной агаризованной питательной среде по Мурасиге и Скугу с добавками 80-120 мг/л лизина, 0,05-0,15 мг/л кинетина, 0,6- 1,0 мг/л БАП (бензиламинопурина), 0,05- 0,08 мг/л НУК (нафтилуксусная кислота) (среда 1), с последующим субкультивирова- нием и удлинением побегов на основной агаризованной среде с уменьшенной вдвое концентрацией макросолей и сахарозы и с дополнением 0,4-0,6 мг/л БАП, 0,3-0,5 мг/л ИУК (среда 2), укоренение растений-регене- рантов проводят на основной жидкой питательной среде с дополнением 0,4-0,6 мг/л ИМК (индолил-3-масляная кислота), НУК 0,1-0,3 мг/л (среда 3). Культуры выращивают при освещении люминесцентными лампами (10000 лк) на 16-часовом фотопериоде при 25 С и относительной влажности воздуха 70%. Укорененные растения-регене- ранты высаживают в почву в теплицу с последующей высадкой в открытый грунт.
Способ осуществляют следующим образом.
Молодые неодревесневшие побеги текущего года длиной 3-5 см обмывают в слабом мыльном растворе, а затем промывают водопроводной водой. Растительный материал сначала стерилизуют в лэминаре в течение 1 мин в 70% этаноле, а затем - 3 мин в диациде. По окончании стерилизации промывают трехкратно автоклавированной дистиллированной водой.
В стерильных условиях вычленяют пазушные почки и помещают в питательную среду в пробирки Среда 1 для культивирования почек с последующим образованием и ростом каллуса содержит, кроме основной среды по Мурасмге и Скуг/ (Murashige, Skoog, 1962), 80-120 мг/л лизина, 0,05- 0.15 мг/л кинетина, 0,6-1,0 мг/л БАП, 0,05- 0,08 мг/л НУК, сахарозу 20 г/л, агар 0,4%. На этой среде через три недели образуется плотный каллус желтовато-бурого цвета. Через две недели он увеличивается в мзссе и наблюдается многочисленное образование почек зеленого цвета с последующим появлением укороченных побегов с молодыми листьями Затем этот каллус с образовавшимся конгломератом /аленьких побегов переносят на среду 2Ч на которой происходит удлинение побегов в течение 3-4 недель. Среда 2 с уменьшенной адвое концентрацией макросолей содержит 0,4- 0,6 мг/л БАП и 0,3-0,5 мг/л ИУК, 10 г/л сахарозы и 0,4%-ный агар. На среде 2 проводят мультипликацию побегов, т. е., помещая выросшие побеги, подрезав с основания и удалив верхушку, на свежую среду, можно, повторяя этот процесс многократно, добиться выхода максимального числа побегов из одного экспланта.
Выросшие до 2,0-3,0 см растения пересаживают на жидкую питательную среду 3 для корнеобразования. Эта среда состоит из минеральных солей по Мурусиге и Скугу с добавками лизина 80-120 мг/л, ИМК 0,4- 0,6 мг/л, НУК 0,1-0,3 мг/л, сахарозы 20 г/л. На этой среде побеги формируют корни в течение 10-15 дней. По достижении корнями 3-5 см в длину растения пересаживают в почвенную смесь с торфом. Горшки с растениями ставят в теплицу для доращивания,
Способ апробирован в лабораторно- производственных условиях.
П р и м е р 1, Материалом для размно- жения служат гибриды карельской березы,
полученные под руководством В.И. Ермакова и произрастающие на агробиостанции. Пазушные почки взяты со взрослых деревьев, возраст которых 18-23 года.
Молодые неодревесневшие побеги дли- ной 3-5 см отрезают, поверхностно стерилизуют в растворе детергента, а затем промывают в проточной воде. В стерильных условиях (в ламинаре) кусочки побегов сначала стерилизуют в течение 1 мин в 70%- ном этаноле, а затем в диациде 3 мин. По окончании стерилизации промывают трехкратно автоклавированной дистилиро- ванной водой. После этого в стерильных условиях (шкаф с ламинарным течением воздуха) отделяют почки от побегов, удаляют у них покровные чешуи. Пробирки со средой 1 (табл. 1) с добавками лизин 100 мг/л, кинетин 0,1 мг/л, БАП 0,85 мг/л НУК 0,065 мг/л (оптимальные концентрации) эвтоклавировали при 1 атм в течение 30 мин, воду - при 1,5 атм в течение 1 ч. Экспланты помещают на питательную среду 1 в биологические пробирки (21 х 200 мл), которые закрывают стерильными марлевыми пробками. Пробирки помещают на светоплощадку при освещении люминесцентными лампами (10000 лк) на 16-часовом фотопериоде при 25°С и 70% относительной влажности воздуха. Через три недели на нижней части почки образуется каллус желто-бурого цвета, который, спустя 2 недели,увеличивается в массе, наблюдается массовое образование почек зеленого цвета. Этот каллус далее субкультивируют на среде для элонгации побегов.
Для элонгации побегов используют среду 2 (табл. 1), которая представляет собой основную среду с уменьшенной вдвое концентрацией макросолей и с дополнением 0,5 мг/л БАП и 0,4 мг/л ИУК (оптимальные концентрации), сахарозой 10 г/л и агаром 0,4%. На этой среде проводят мультипликацию побегов. Побеги гибридов, достигшие 2,0-3,0 см, в течение трех недель пересажи- вают на жидкую питательную среду 3 для корнеобразования (табл. 1), состоящую из минеральных солей по Мурасиге и Скугу с дополнением ИМК 0,5 мг/л, НУК 0,2 мг/л (оптимальные концентрации), сахарозы 20 г/л. По достижении корнями 3-5 см в длину растения пересаживают в почвенную смесь с торфом. Горшки с растениями ставят в теплицу для доращивания. Полив обильный, Приживаемость растений со- ставляет 76%. Наблюдения показывают нормальный рост и развитие растений.
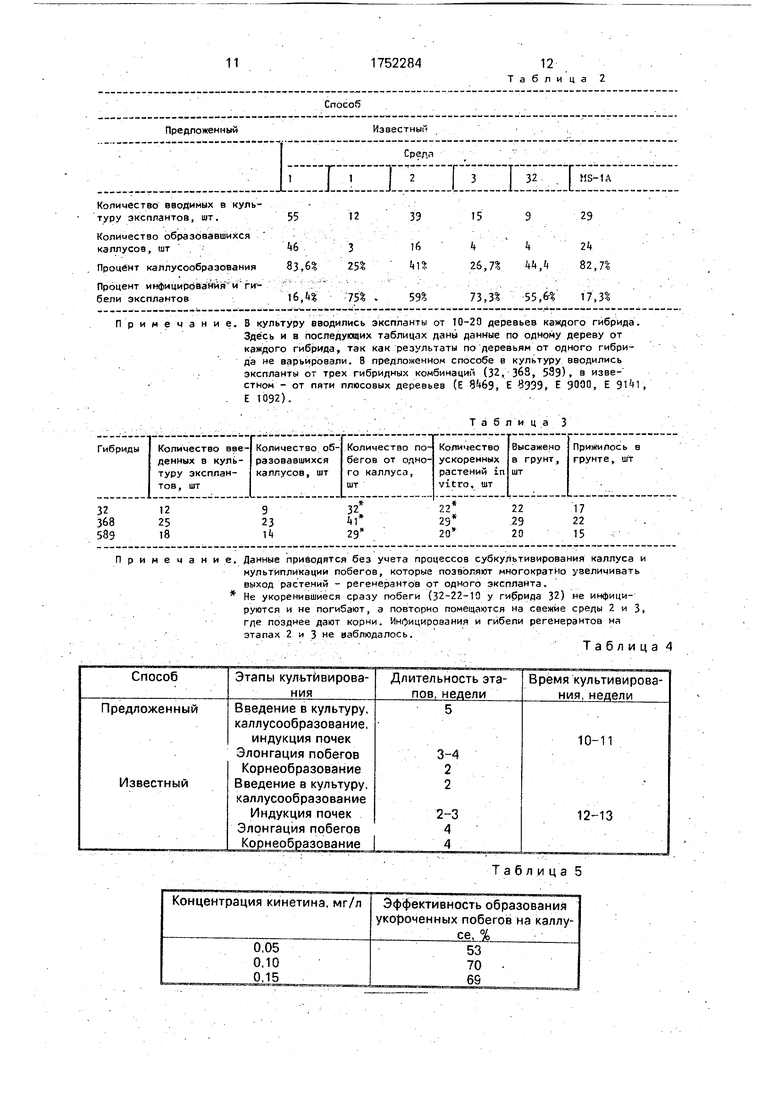
Сравнение результатов каллусообразо- вания показывает, что процент каллусооб- разования у предложенного способа
(83,6%) выше, чем даже на лучшей из сред для инициации каллуса (MS-1 А) у известного (82,7%).
На этапах культивирования (этапе 1 - 4) у известного способа случаи бактериального инфицирования и гибели составляют 40-101%. В предложенном способе инфицирования и гибель эксплантов наблюдается только на этапе 1 (табл. 2), что составляет в среднем 16,4%, на этапах органогенеза (этапы 2-3) инфицирования и гибели регене- рантов не на блюд а ют (табл. 3).
Сравнение результатов укоренения in vitro показывает, что предложенный способ позволяет достигнуть укоренения in vitro у деревьев всех испытанных гибридов (например, у гибрида 32 из 32 побегов 22 укореняются сразу на среде 3, а 10 инертных побегов после повторного помещения на среды 2,3 тоже дают корни), в тоже время у известного способа укоренение in vitro достигнуто не у всех деревьев и процент укоренения низок из-за инфицирования и гибели регенерантов на этапах 2-4 (40- 101%).
В предложенном способе приживаемость растений, высаженных в грунт, составляет в среднем 76%, в известном способе данные по приживаемости не приводятся.
Предложенный способ позволяет проводить культивирование взрослых деревьев карельской березы в укороченные сроки 10- 11 недель (известный способ 12-13 недель) за 3 этапа (табл. 4).
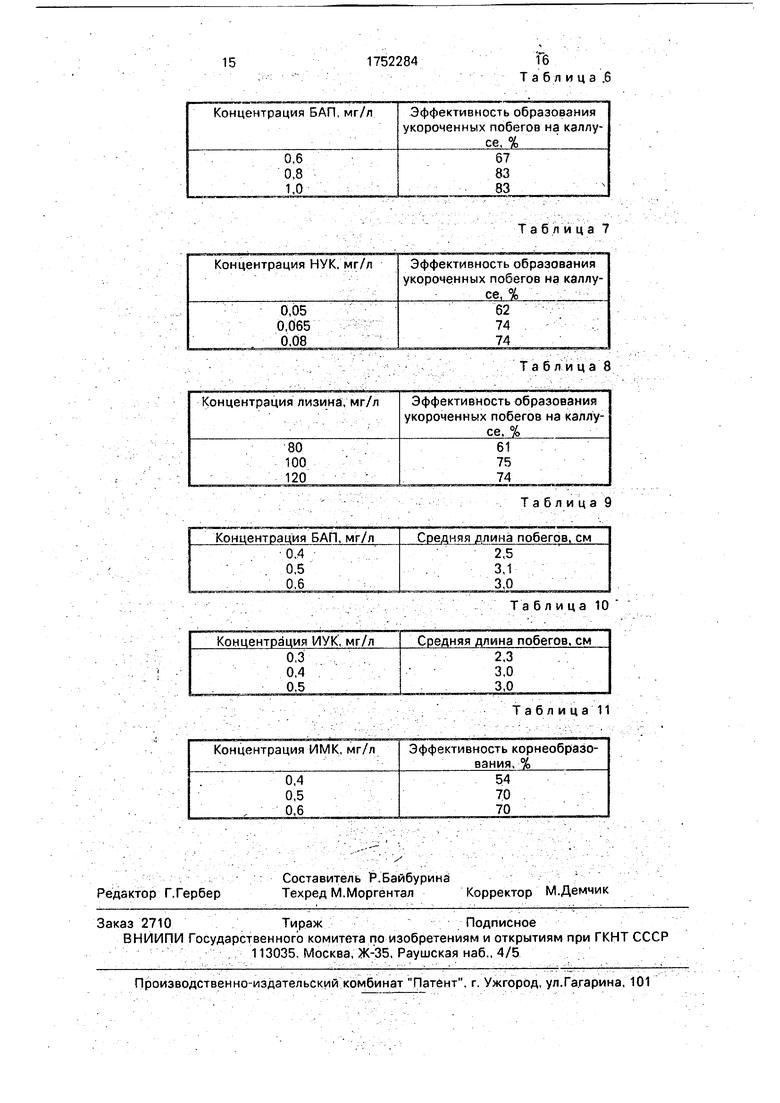
Пример 2. С молодых неодревесневших зеленых побегов отделяют пазушные почки и культивируют их на питательной среде 1 с различными концентрациями гормональных веществ. В процессе экспериментов выявлены предельные значения и оптимальные концентрации кинетина, БАП, ИУК, НУК, лизина соответственно. Результаты представлены в табл. 5-8.
П р и м е р 3. Растительный материал тот же, что и в примере 1 и 2. После культивирования на среде 1 полученные множественные микропобеги отделяли и- субкультивировали индивидуально на среде 2 с различными концентрациями БАП и ИУК, с целью удлинения. Экспериментально определяют предельные и оптимальные концентрации БАП и ИУК соответственно. Результаты представлены в табл. 9 и 10.
П р и м е р 4. После культивирований на средах 1 и 2 выросшие микропобеги пересаживают на среду 3 для стимулирования образования корней с различными концентрациями ИМК. Экспериментально определяют предельные значения и оптимальные концентрации ИМК. Результаты приведены в табл. 11.
В культуру вводят растения нескольких гибридных комбинаций. Преимуществами предлагаемого способа являются: возможность промышленного использования в лесном хозяйстве уникальных гибридов карельской березы с ценной древесиной, которые ранее не могли быть использованы в производстве вследствие трудности их размножения черенкованием; возможность размножения взрослых деревьев; возможность многократной мультипликации; сокращение сроков получения укорененных растений до 10-11 недель; подготовка укоренившихся растений в условиях теплицы к началу вегетации в открытом грунте; возможность выращивания посадочного материала независимо от времени года.
Среды, используемые для клонального микроразмножения гибридов карельской березы, представлены в табл. 1.
Результаты каллусообразования у предложенного и известного способов представлены в табл. 2.
Результаты размножения гибридов карельской березы (сентябрь-октябрь 1988 г.) представлены в табл. 3.
Этапы культивирования и их длительность у предложенного и известного способов приведены в табл. 4.
Результаты роста каллуса и формирования конгломерата молодых побегов в зависимости от концентрации кинетика приведены в табл. 5.
Результаты роста каллуса и формирования конгломерата молодых побегов в зависимости от концентрации БАП представлены в табл. 6.
Результаты роста каллуса и формирования конгломерата молодых побегов в зависимости от концентрации НУК приведены в табл. 7.
Результаты роста каллуса и формирования конгломерата молодых побегов в зависимости от концентрации лизина приведены в табл. 8.
Результаты удлинения побегов в зависимости от концентрации БАП приведены в табл. 9.
Результаты удлинения побегов в зависимости от концентрации ИУК приведены в табл. 10.
Эффективность корнеобразованця в зависимости от концентрации ИМК приведена в табл. 11.
i
Формулаизобретения
Способ клонального микроразмножения гибридов карельской березы, включающий посев верхушечных и пазушных почек на агаризованную питательную среду Мурасиге-Скуга, содержащую в своем составе фитогормоны, культивирование до получения побегов, их удлинение на питательной среде Мурасиге-Скуга с уменьшенной вдвое концентрацией макросолей и содержащей в
качестве фитогормонов 6-бензиламинопу- рин и индолилуксусную кислоту с последующим переносом на питательную среду для укоренения, отличающийся тем, что, с целью увеличения выхода растений-регенерантов и сокращения сроков выращивания, посев верхушечных и пазушных почек проводят на питательную среду, содержащую в качестве фитогормонов 80-120 мг/л лизина, 0,05-0,15 мг/л кинетика, 0,61.0 мг/л б-бензиламинопурина и 0,05- 0,08 мг/л НУК, субкультивирование побегов и их удлинение проводят на питательной среде при концентрации б-бензиламинопурина 0,3-0,5 мг/л и индолилмасляной
кислоты ,5 мг/л, а укоренение осуществляют на жидкой питательной среде Мурасиге-Скуга, содержащей дополнительно 0,4-0.6 мг/л индолилмасляной и 0.1- 0,3 мг/л нафтилуксусной кислоты.
Примечание. В культуру вводились экспланты от 10-20 деревьев каждого гибрида. Здесь и в последующих таблицах даны данные по одному дереву от каждого гибрида, так как результаты по деревьям от одного гибрида не варьировали. 8 предложенном способе в культуру вводились экспланты от трех гибридных комбинаций (32, 368, 539), в известном - от пяти плюсовых деревьев (Е 8469, Е 83Э9, Е 9000, Е , Е 1092).
Таблица 3



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ клонального микроразмножения растений сем. Betulaceae | 2016 |
|
RU2627194C1 |
| СПОСОБ КЛОНАЛЬНОГО МИКРОРАЗМНОЖЕНИЯ СЕЛЕКЦИОННОГО ПОСАДОЧНОГО МАТЕРИАЛА БЕРЕЗЫ КАРЕЛЬСКОЙ | 1994 |
|
RU2066953C1 |
| СПОСОБ ПОЛУЧЕНИЯ МИКРОПОБЕГОВ РАСТЕНИЙ СЕМЕЙСТВА BETULACEAE | 2016 |
|
RU2650754C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ МИКРОРАЗМНОЖЕНИЯ КАЛЬЦЕФИЛЬНЫХ РАСТЕНИЙ В КУЛЬТУРЕ IN VITRO | 2014 |
|
RU2552174C1 |
| Способ микроклонального размножения гибридов осины | 1988 |
|
SU1581741A1 |
| Способ получения растительного сырья ириса сибирского (Iris sibirica L.) методами биотехнологии | 2017 |
|
RU2677921C1 |
| СПОСОБ РАЗМНОЖЕНИЯ ГРЕЧИХИ IN VITRO | 2013 |
|
RU2538167C1 |
| Способ микроклонального размножения кирказона маньчжурского (Aristolochia manshuriensis Kom.) | 2023 |
|
RU2807740C1 |
| СПОСОБ МИКРОКЛОНАЛЬНОГО РАЗМНОЖЕНИЯ ИРИСА СИБИРСКОГО (I.SIBIRICA L.) | 2011 |
|
RU2479992C1 |
| СПОСОБ МИКРОРАЗМНОЖЕНИЯ СТЕВИИ STEVIA REBAUDIANA L. | 1993 |
|
RU2092036C1 |
Использование: сельское и лесное хозяйство, для получения посадочного материала ценных видов березы. Проводят клональное микроразмножение гибридов карельской березы путем посева верхушечных и пазушных почек на агаризованную питательную среду Мурасигэ-Скуча, содержащую, мг/л: лизин 80-120; кинетин 0,05- 0,15; 6-бензиламинопурин 0,6-1.0 и НУК 0,05-0,08, после этого проводят субкультивирование и удлинение полученных побегов на питательной среде при концентрации 6- бензиламинопурина 0,3-0,5 мг/л индолил- масляной кислоты 0,3-0,5 мг/л, а укоренение осуществляют на жидкой питательной среде Мурасига-Скуча, содержащей дополнительно 0,4-0,6 мг/л индолилмасляной и 0,1-0,3 мг/л нафтилук- сусной кислоты, 11 табл. СО с До разработки технологии клонального микроразмножения, Позволяющей получать растения генетически идентичные исходному, ценные гибриды и клоны карельской березы не могли быть использованы для создания.промышленных плантаций на древесное сырье высокого декоративного качества. Известны способы клонального микроразмножения некоторых видов березы, в частности японской белой березы, березы бородавчатой, бурой свилеватой карельской березы. Апробация данных способов на уникальных гибридах карельской березы ел ю ю 00
Примечание. Данные приводятся без учета процессов субкультивирования каллуса и мультипликации побегов, которые позволяют многократно увеличивать выход растений - регенерантов от одного экспланта. Не укоренившиеся сразу побеги (32-22-10 у гибрида 32) не инфицируются и не погибают, э повторно помещаются на свежие среды 2 и 3, где позднее дают корни. Инфицирования и гибели регенерантов на этапах 2 и 3 не ваблюдалось.
Таблица 4
Таблица 5
Таблица 7
Таблица 9
Таблица 10
| Akiro Saito | |||
| In vitro plantlet regeneration from adventitious buds induced on cuttings of peeted twigs of Japanese white birch | |||
| - Journal Japan Forestry Soc | |||
| Приспособление для получения кинематографических стерео снимков | 1919 |
|
SU67A1 |
| V.Chalupa | |||
| Rychle vegetatlvni mnozeni nekterych llstnatych lesnich in vitro | |||
| - Lesnictvi | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Переставная шейка для вала | 1921 |
|
SU309A1 |
| Matschke J., Evald D., Bolland G., Schneck H | |||
| Mb glichkeiten der beschleunigten venmehrung von Braunmaserbirken, - Beitr | |||
| Forstwirtschaft | |||
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| Leena Ryynanen, Martti Ryynanen | |||
| Propagation of adult curlybirch Succeeds with tissue culture | |||
| - Silva Fennika | |||
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| Способ подпочвенного орошения с применением труб | 1921 |
|
SU139A1 |
| Изобретение относится к биотехнологии и воспроизводству лесных древесных растений в лесном хозяйстве | |||
| Береза карельская характеризуется необычной структурой древесины, ее декоративность высоко ценится на мировом рынке | |||
| При семенном размножении лишь у небольшой части растений проявляется узорчатая структура древесины | |||
| Сохранить этот хозяйственно-ценный признак можно лишь вегетативным размножением | |||
| Однако вегетативное размножение ее черенкованием затруднено, а прививками дает небольшой процент выхода. | |||
Авторы
Даты
1992-08-07—Публикация
1990-04-02—Подача