1
(21)4877000/02
(22)20.08.90,
(46)15,12,92. Бюл.№ 46
(71)МГУ им. М.В.Ломоносова
(72)В.И.Горшков, В.А.Иванов и И.В.Стаина (56) Горшков В.И., Панченков Г.М., Чумаков В.А. Непрерывный противоточный ио нооб- менный м.етод разделения рубидия и калия - Физ. химия, 1964, т. 38, № 5, с. 1358.
Авторское свидетельство СССР № 659179, кл. С 22 В 26/10, 1979.
Горшков В.И., Иванова М.В., Курбанов A.M., Иванов В.А. Новые методы ионообменного разделения Вестн, Моск. ун-та, Химия, 1977, Ыз 5, т. 18, с. 553.
(54) СПОСОБ ИЗВЛЕЧЕНИЯ ЦЕЗИЯ И/ИЛИ РУБИДИЯ ИЗ СМЕСЕЙ - :.- (57) Использование: разделение смесейще лбчных элементов, содержащих рубидий и {Щзмй, путём сорбции разделяемой смеси из 1целбчнсЛ-6 р а;ств6раг гранулиройанным фе но формальдегидным катйонитом в Н-фор- ме; в колонне и вытеснения сорбировайной смеси из ирнита кислым раствором. Сущ ШстьТ сорбцию разйеляемых ионов прово дят из раств о ра Сме сй их щелочей и солей, отйосйтельн ое содержйниё солей в котором не превышает (а- 1X1 - Хо)/а , где а - равновесный коэффициент ра зделе- нйя, Х0 - доля цШйя в раств:брв или доля рубидия в растворе, не содержащем цезия.
.:4 -ил.; ;; ... .-. . .




| название | год | авторы | номер документа |
|---|---|---|---|
| Способ ионообменного разделения смесей растворенных веществ | 1976 |
|
SU659179A1 |
| Способ разделения смесей веществ | 1976 |
|
SU657834A2 |
| СПОСОБ ВЫДЕЛЕНИЯ РУБИДИЯ ИЗ СМЕСЕЙ С КАЛИЕМ НЕПРЕРЫВНЫМ ПРОТИВОТОЧНЫМ ИОННЫМ ОБМЕНОМ | 1973 |
|
SU376322A1 |
| СПОСОБ ИОНООБМЕННОГО РАЗДЕЛЕНИЯ ИОНОВ МЕДИ (II) И НИКЕЛЯ (II) | 2011 |
|
RU2466101C1 |
| Способ хроматографического выделения иттрия из растворов,содержащих соединения тяжелых редкоземельных элементов | 1982 |
|
SU1057061A1 |
| СПОСОБ ИЗВЛЕЧЕНИЯ ГАЛЛИЯ ИЗ АЛЮМИНАТНЫХ РАСТВОРОВ | 1998 |
|
RU2157421C2 |
| СПОСОБ ИЗВЛЕЧЕНИЯ БРОМА ИЗ РАССОЛОВ | 1994 |
|
RU2078023C1 |
| СПОСОБ ИЗВЛЕЧЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ ИЗ ЭКСТРАКЦИОННОЙ ФОСФОРНОЙ КИСЛОТЫ | 2013 |
|
RU2544731C2 |
| СПОСОБ ПОЛУЧЕНИЯ МИНЕРАЛЬНЫХ ВЕЩЕСТВ ИЗ МОРСКОЙ ВОДЫ | 1992 |
|
RU2006476C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАПТИВНО-СЕЛЕКТИВНОГО К РЕДКОЗЕМЕЛЬНЫМ МЕТАЛЛАМ ИОНООБМЕННОГО МАТЕРИАЛА | 2012 |
|
RU2515455C2 |

Изобретение относится к способам выделения рубидия и цезия из их взаимных смесей или смесей с другими щелочными металлами, прежде всего с калием, а Также к способам их очистки от примесей ионов щелочных металлов. Изобретение может быть использовано в технологии извлечения рубидия и цезия их минерального сырья, из продуктов комплексной переработки гидроминерального сырья, в технологии получения высокоочищенных
соединений рубидия и цезия.
j
Известен способ разделения смеси ионов рубидия и калия путем сорбции смеси их хлоридов в колонне с неподвижным слоем нитрованного сульфокатионита 6 водородной форме ;и последующей десорбции разделяемой смеби раствором хлорида кальция с концентрацией, не превышающей 0,1 г-экв/л.; :
v Известен способ непрерывного разделения смеси ионов-щелочных металлов, содержащей ионы рубидия и цезия, в противоточных колоннах с использованием
бифункционального сульфофенольногр ка- тионита КУ-1, включающий непрерывную
.сорбцию смеси разделяемых ионов из раствора их солей на водородной форме катио- нита и непрерывную десорбцию разделяемой смеси раствором хлорида бария с концентрацией, не превышающей 0,17 . г-экв/л.- - . :
Главным недостатком указанных способов является необходимость регенерации йонита, заключающейся в его переводе из формы двухзаряднЫх ибной в водородную форму, перед повторным использованием. Для регенерации требуется значительное количество реактивов (кислоты). Регенера- ционные растворы необходимо перерабатывать для выделения соли двухзарядного
«
иона и возврата ее в процесс. Вспомогательные ионы могут быть источником загрязнения получаемых препаратов. Кроме того недостатком указанных способов являются невысокие (не выше 0,17 r-экв/л) концентрации растворов, при которых проводится разделение.
Наиболее близким к предлагаемому является способ ионообменного разделения смесей веществ (преимущественно смесей рубидия и цезия). В этом способе концентрирование рубидия осуществляют, пропуская раствор смеси гидроксидов и солей разделяемых ионов цезия и рубидия определенного состава через бифункциональный сульфофенольный катионит КУ-1, насыщенный разделяемыми ионами только по сульфогруппам. Для концентрирования цезия через полученный на предыдущей стадии ионит, насыщенный разделяемыми ионами как по сульфогруппам, так и по фе- нольным группам, пропускают раствор, содержащий смесь кислоты и солей разделяемых ионов с определенным соотношением концентраций, вытесняя разделяемые ионы преимущественно со слабокислотных групп. В данном спосЪбе не требуются никакие вспомогательные ионы кроме К4 и нет ограничений в концентрации раствора; для повторного использования ионита не нужна его регенерация.
Указанный способ обладает рядом недостатков. Вследствие того, что сорбция и десорбция разделяемых ионов происходит только на части емкбсти ионита (составляющей 2/3 от полной), производительность способа, пропорциональная разности (од -1)-(«1-1)/Зпри концентрировании микрокомпонента ( сц и оп ) равновесные коэффициенты разделения при обмене из щелочных и нейтральных (или кислых) растворов, соответственно) уступают производительности способов, в которых сорбция и десорбция разделяемых ионов реализуется на полной емкости ионита с коэффициентом разделения, близким ai (в этом случае производительность пропорциональна GZ -1). Особенность способа и связанная с ней сложность заключается в том, что эффективное разделение происходит лишь в определенном, достаточно узком интервале соотношений потоков (относительно сорбционного фронта) разделяемых ионов с раствором и иони- том. который определяется различием величин Oi и «1 и регулируется соотношением концентраций солей и щелочей или солей и кислоты в пропускаемых через
ионит растворах, Так при разделении экви- нормальной смеси ионов цезия и рубидия наиболее эффективное разделение осуществляется при концентрациях гидроксидов
и солей, соответственно, 0,315 и 0,207 г- экв/л, а при изменении концентрации солей более, чем на 0,025 r-экв/л (что составляет 5% от общей концентрации раствора) в ту или другую сторону, степень разделения
резко снижается. Вследствие этого требуется весьма точное поддержание этих составов. Достигаемые степени разделения смесей также зависят от различия величин 05 и а и ниже, чем в способах с полной
сорбцией и десорбцией разделяемой смеси и сопоставимой величиной а.
Целью изобретения является повышение производительности и степени разделения смесей щелочных элементов, а также
его упрощение.
Поставленная цель достигается в предлагаемом способе тем, что сорбцию разделяемой смеси осуществляют из щелочного раствора в колонне с гранулированной фенолформальдегидной смолой в водородной форме, а десорбируют разделяемые ионы раствором кислоты. Предпочтительно сорбцию разделяемых ионов предлагается проводить из раствора смеси их щелочей и солей, относительное содержание солей в котором не превышает величины (а - 1)(1 - Х0)/а, где Х0 - доля прочнее сорбируемого компонента в этом растворе. Изобретение иллюстрируется фиг.1-4.
Фенолформальдегидные смолы являются слабокислотными катионитами, ионообменные свойства которых определяются фенольными группами с эффективными величинами рК 10-12. Замещение ионов водорода другими катионами происходит лишь из щелочных растворов. Вследствие чрезвычайно высокой селективности фе- нольных групп к ионам водорода полная десорбция катионов металлов легко осуществляется не только сильными кислотами, но и многими слабыми (например, уксусной) любой концентрации. Переход фенолфор- мальдегидных ионитов из водородной формы в солевую сопровождается четким
изменением его окраски от желтой к фиолетово-коричневой. При разработке предлагаемого способа установлено, что фемольные катиониты проявляют значительно более высокую селективность по отношению к
смесям ионов цезия и рубидия, а также к смесям этих ионов с другими щелочными элементами по сравнению не только с суль- фокатионитами и нитрованными сульфока- тионитами, ноисульфофенольными. Так для
обмена ионов Cs+ - Rt+1 Rb+ - K+; Cs+ - Na+ из 0,1 N растворов щелочей соотношением компонентов 1:1 на фенольном катионите значения а равны, соответственно, 2,5; 1,5 и 3,5, в то время как при обмене этих же ионов на наиболее селективном из извест- ных полимерных ионитов,
КУ-1 из нейтральных растворов - 1,6: 1,3 и 2,5, а из щелочных - 1,8, 1,3 и 2,0. Установлено, что более высокая селективность фе- нольного катионита сохраняется во всем интервале возможных соотношений обменивающихся компонентов, причем селективность увеличивается при уменьшении относительного содержания в pacfeope прочнее сорбируемого компонента. Так для Rb+-K+при их соотношении врастворе 1:19 величина а. составляет 2,0 -2,1 и не изменяется при увеличении концентрации раствора и при наличии солей этих элементов в растворе.
Указанные свойства фенолформальде- гидных смол позволяют использовать их для разделения смесей ионов щелочных металлов фронтальной и обратной фронтальной хроматографией как в колоннах с неподвижным слоем ионита, так и в непрерывном варианте в противоточных колоннах. Из научно-технической литературы неизвестно использование фенолформаль- дегидных смол для разделения смесей ще- лочных элементов.
Возможность полной десорбции ионов металлов растворами кислот устраняет необходимость тонкой регулировки соотношения потоков фаз, существующую в из- вестном способе, что значительно упрощает разделение. Цветовые переходы в зонах сорбционных фронтов чрезвычайно упрощают использование в процессах в колоннах, особенно в противоточных колоннах, где требуется удерживать сорбционные фронты фиксированными относительно стенок колонны.
Более высокая селективность феноль- ных ионитов к смесям, содержащим ионы рубидия и цезия, по сравнению с сульфофе- нольным ионитом, а также возможность полной десорбции разделяемых ионов кислотами, как следует из сделанных выше пояснений, приводит к повышению производительности и степени разделения по сравнению с известными способами.
При разделении в колонне с неподвижным слоем ионита через фенолформальде- гидную смолу, предварительно обработанную кислотой, пропускают раствор смеси гидроксидов разделяемых ионов (или раствор смеси гидроксидов и солей
разделяемых ионов, о чем будет сказано далее), а выходящий из колонны раствор собирают фракциями. Фенольные группы ионита R-OH реагируют с поступающей щелочью (МеОН), нейтрализуя ее:
R - ОН + МеОН - ОМе + НаО Происходит сорбция разделяемых ионов с движущейся достаточно резкой сорбцион- ной границей. В процессе сорбции смеси ионов щелочных металлов происходит их разделение по типу фронтальной хроматографии с накоплением слабее сорбирумого компонента взЧунё ко До нны, примыкающей к с орбцион ному фронту.
Если раствор содержит не только гидро- ксиды разделяемых элементов, но и примесь их солей, то из зоны ионоо бменной сорбции выходит не чистая вода , как в рассмотренном выше случае, а раствор этих солей
R - ОН +МеОН + MeCl R - ОМе + НаО+ + MeCl
Как следует из материального баланса и подтверждается экспериментально, очистка слабее сорбируемого компонента от примеси сильнее сорбируемого происходит и в этом случае, но накапливаемый компонент выходит из зоны ионообменного поглощения разделяемой смеси в виде раствора солей с измененным ионным Отношением Из балансового соотношения, получаемого в предложении равновесности фаз в точке питания колонны раст вором,
Хш.Сщ (g-1)(1-X0)
Х0Сс 1 + (а- 1) Хо
где Х0 и Хсо - эквивалентные доли сильнее сорбируемого ионитом компонента смеси в исходном растворе и в выходящем растворе солей Сщ и Сс - концентрации щелочей и солей в исходном растворе (г-экв/л), следует, что полное разделение (Xto 0) имеет место приTSTGsSTrfl- 0(2)
Оптимальным является такое относительное содержание солей в исходном растворе, которое определяется равенством в этом выражении. В этом случае количество выходящей из зоны ионообменной сорбции соли в точности соответствует скорости накопления слабее сорбируемого компонента. Например, при разделении смеси ионов калия и рубидия с соотношением 19:1 (а 2,1; Хо 0,05) оптимальным является состав раствора, в котором
Сс/(Сс + Сш) 0,5.
Для выделения сильнее сорбируемого компонента смеси через ионит в колонне, обработанный щелочным раствором разде0)
ляемых ионов, пропускают раствор кислоты, а выходящий из колонны раствор собирают фракциями. В процессе десорбции разделяемых ионов происходит их разделение по типу обратной фронтальной хроматографии с накоплением сильнее сорбируемого ионитом компонента в зоне колонны, примыкающей к сорбционному фронту. На получающемся на этой стадии ионите в Н -форме можно непосредственно повторять первую стадию.
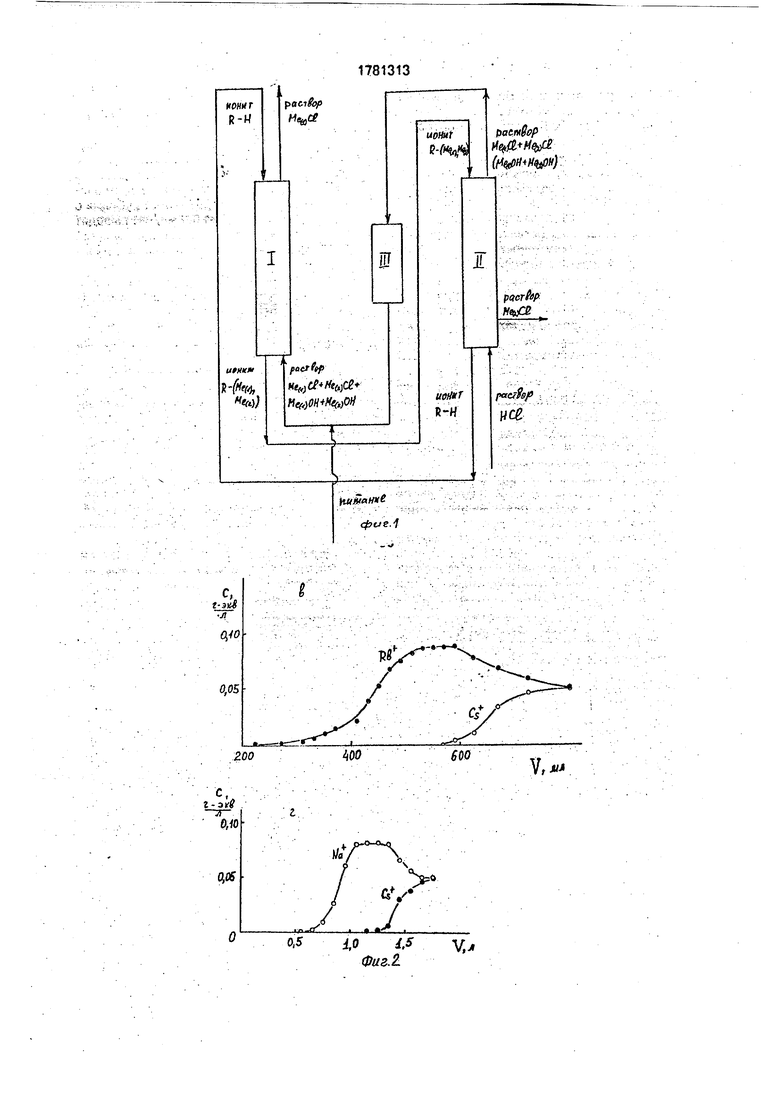
И при сорбции, и при вытеснении ионов щелочных металлов выполняются условия образования стационарных сорбционных фронтов. Поэтому разделение удобно осуществлять в непрерывном варианте с использованием противоточных колонн (фиг.1).
В начале процесса колонну 1 загружают фенольным ионитом, предварительно обработанным кислотой. Через ионит пропускают раствор смеси гидроксидов или гидроксидов и солей разделяемых ионов, содержание солей в котором удовлетворяет соотношению (2). После того, как сорбцион- ная граница приблизится к противоположному от точки питания растворим краю колонны, начинают перемещение ионита, одновременно подавая в колонну ионит в Н+-форме. Фазы движутся вдоль колонны непрерывно или поочередно в противоположных направлениях так, что сорбционная граница остается практически в одном положении относительно стенок колонны. Из колонны на одном конце выходит ионит, состав которого близо к к равновесному с питающим раствором, а на другом - вода в случае питания колонны смесью гидроксидов и солей, как показано на фиг.1. Из колонны в районе сорбционного фронта отбирают раствор, содержащий слабее сорбируемый ионитом компонент, очищенный от сильнее сорбируемого иона. В случае, если состав питающего раствора удовлетворяет равенству (2), весь накапливаемый компонент выводится мз колонны с выходящим солевым раствором, как показано на фиг,1.
Колонну II заполняют ионитом, обработанным в колонне I щелочным раствором. Далее через нее пропускают раствор кислоты/ Ее концентрацию удобно выбрать равной концентрации разделяемых ионов в растворе, питающем колонну I. После установления границы десорбции разделяемых ионов вблизи точки питания колонны раствором кислоты работу продолжают в про- тивоточном режиме или в режиме с поочередным движением фаз. Из колонны выводятся ионит в Н+-форме и раствор смеси солей и гидроксидов разделяемых ионов.
В колонне вблизи фронта десорбции разделяемых ионов постепенно образуется зона, в которой ионит и раствор содержат сильнее сорбируемый компонент разделяемой смеси, сконцентрированный и очищенный от второго компонента. Из этой зоны по мере работы непрерывно или периодически отбирают раствор в качестве продукта. Выходящий из колонны II ионит в Н форме
0 направляют непосредственно или после промывки водой в колонну I. В растворе, выходящем из колонны II. содержание гидроксидов ниже, чем в растворе, питающем колонну I. Далее состав этого раствора из5 меняют, увеличивая содержание гидроксидов, и Направляют на питание колонны I. Увеличить содержание гидроксидов можно, добавляя смесь гидроксидов разделяемых ионов, направляемых на переработку (ста0 дня III на фиг.1), или одним из известных способов - электролизом анионным обменом.
Во всех случаях выигрышной является возможность обрабатывать в колонне I рас5 твор смеси гидроксидов и солей, а не только раствор гидроксидов.
П р и м е р 1. Разделение эквимолярных - смесей ионов щелочных металлов на неподвижном слое фенольного ионита.
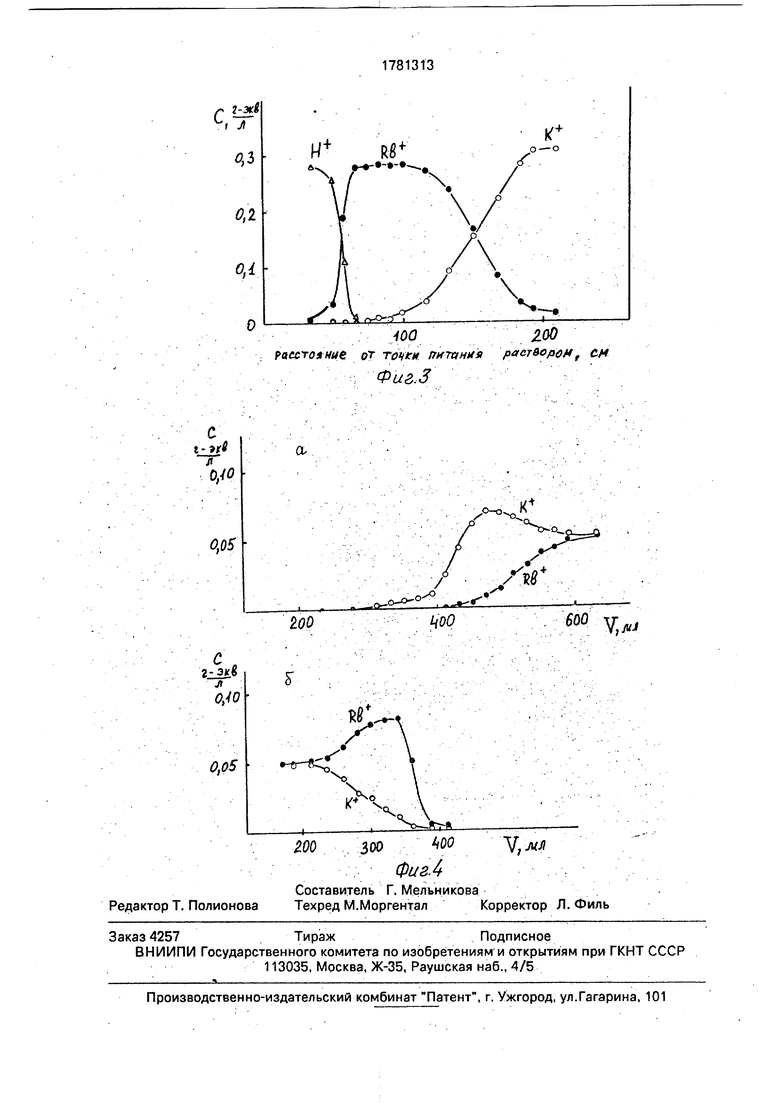
0 Разделение проводят в хроматографи- ческой колонне диаметром 10 мм и высотой слоя ионита (в Н+-форме) 70 см. Скорости пропускания растворов 2 мл/мин. Концент- рирование слабее сорбируемого компонен5 та смеси проводят, пропуская 0,1N раствор смеси гидроксидов разделяемых ионов через колонну с фенолформальдегидной смолой в Н -форме. Выделение второго компонента смеси проводят, пропуская че0 рез ионит, полученный на первой стадии, 0,1 М раствор соляной кислоты. Выходящие из колонны растворы собирают фракциями. На рис.2 приведены распределения концентраций компонентов в фильтратах в процес5 сах разделения смесей Rb+-K+1 Na+-Cs+.
Значительные объемы фильтрата обогащены одним из компонентов. Так в случае смеси удается выделить 320 мл
0 фильтрата, содержащего Rb+ с усредненной его концентрацией 0,05 г-экв/л, примесь цезия в котором составляет 1% (количество выделенного рубидия 14,9 мг-экв). В то же время в 280 мл, при усредненной концент5 рации рубидия 0.0465N (13 мг-экв рубидия) цезий не обнаруживается методом эмиссионной плазменной фотометрии, В прототипе (3,4) на колонне с таким же диаметром и высотой слоя ионита КУ-1, равной 70 см, удается выделить 30 мл раствора 0.35N Rb
(10,5 мг-экв) с примесью более 4% цезия, и даже в наиболее обогащенной фракции фильтрата объемом 5 мл при концентрации Rb+, равной 0,37 г-экв/л (1,8 мг-экв), содержание цезия составляло 3,5%.
П р и м е р 2. Извлечение рубидия из смеси с калием с соотношением компонентов 1:19.
Непрерывное извлечение рубидия из смеси с калием осуществляют с использова- нием двух противоточных ионообменных колонн или колонн с поочередным движением ионита и обрабатываемого раствора (на конструктивных особенностях ионообменных аппаратов не останавливается, т.к. они достаточно подробно изложены в литературе). Высота рабочей части каждой колонны 260 см, диаметр 20 мм. Порядок осуществления стадий процесса в каждой из колонн подробно изложены ыше. В колонне 1 че- рез ионит в Н-форме со скоростью 4 мл/мин пропускают раствор смеси 0,15М гидрокси- дов и 0.15М хлоридов калия и рубидия с соотношением 19:1. В установившемся режиме работы из колонны выводится раствор 0,15М хлорида калия, примесь рубидия в котором не превышает 0,1 %, и ионит в смешанной К+, РЬ+-форме, равновесный с обрабатываемым раствором.
В колонне II через ионит в смешанной К+, РЬ+-форме, отработанный в колонне I, пропускают раствор 0,ЗМ HCI с усредненной скоростью 2 мл/мин. В установившемся режиме в колонне есть достаточно большая зона, ионит и раствор в которой содержит практически чистый рубидий без калия (рис.3); из колонны в точке ее питания иони- том выводится раствор, содержащий катио- ниты калия и рубидия с соотношением 19:1 и с их суммарной концентрацией 0.32М и
концентрацией гидроксидов О, ЮМ. Этот раствор после корректировки его состава до указанного выше с помощью анионита возвращают на питание колонны I. На противоположном конце колонны I выводят ионит в Н-форме, который затем возвращается в первую колонну. Из колонны II из зоны очищенного и сконцентрированного рубидия с усредненной скоростью 6,0 мл/час выводят раствор, содержащий RbCI с концентрацией 0.28М, примесь калия в котором не превышает 1%.
В целом процесс разделения обеспечивает не менее, чем 98%-ное извлечение каждого компонента исходной смеси. При этом в 1 ч из 37,7 ммоль исходной смеси рубидия и цезия получают 36 ммоль KCI и 1,7 ммоль RbCI.
Формула изобретения Способ извлечения цезия и/или рубидия из смесей щелочных элементов, включающий сорбцию из раствора гранулированным фенолформальдегидным катионитом в Н+-форме в колонне и десорбцию кислым раствором, отличающийся тем, что, с целью повышения степени разделения элементов и производительности процесса и его упрощения, сорбцию проводят из раствора смеси щелочей и солей щелочных элементов, относительное содержание солей щелочных элементов в котором не превышает величины ( а-1)(1-Х0)/а, гдео; - равновесный коэффициент разделения, а Х0 - доля цезия в растворе или доля рубидия в растворе, не содержащем цезия, а десорбцию ведут кислым раствором, взятым в количеств, эквивалентном обменной емкости ка- тионита.
нончг R-H
раелЯор
ъ
pacrftf
н се+неисе
He«)0№e(t)0ti
фиг -f
t-3Kf J
o,w
0,05
0,06
..
A5iO 5V,
Фиг.2.
datmSop
(№№&))
Ш
1
pctcrPty
Mwce
ийЛгГ R-H
faO$Sp
усе.
Авторы
Даты
1992-12-15—Публикация
1990-08-20—Подача