Изобретение относится к способу получения α,β-ненасыщенных карбоновых кислот и (или) их производных, например сложных эфиров, нитрилов, амидов, из соединений эфиродикарбоновой кислоты, имеющих общую формулу
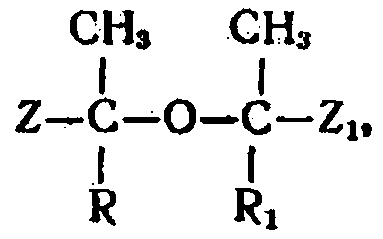
в которой R и R1 - одинаковые или различные радикалы и представляют собой водород, алкильные, арильные или алкенильные остатки, a Z и Z1 - одинаковые или различные карбоксильные группы или их функциональные производные, например группы сложных эфиров карбоновой кислоты, группа нитрилов карбоновой кислоты или амидная группа карбоновой кислоты.
Согласно изобретению α,β-ненасыщенные карбоновые кислоты и (или) их производные получают нагреванием эфиродикарбоновых кислот общей формулы

где R и R1 - одинаковые или различные и представляют собой водород, алкильные, арильные или алкенильные остатки, a Z и Z1 - одинаковы или различны и представляют карбоксильные группы или их функциональные производные, в жидкой фазе до 160-330°С, в полярной реакционной среде, кипящей при температурах выше 190°С, при этом происходит дегидратационное расщепление простого эфира. Возникающую α,β-ненасыщенную карболовую кислоту или ее производные непрерывно удаляют из сферы реакция.
В качестве полярной реакционной среды, кипящей при температуре свыше 190°С, может служить соединение эфиродикарбоновой кислоты приведенной формулы.
Реакцию дегидратационного расщепления, при которой из 1 моль соединения эфиродикарбоновой кислоты или производных получается оптимально 2 миль α,β-ненасыщенной карбоновой кислоты, лучше всего проводить по непрерывной схеме для непрерывного расщепления в присутствии другого полярного, кипящего при температуре выше 190°С, соединения, служащего реакционной средой. Такими могут быть следующие соединения: многоосновные неорганические кислоты, например серная, фосфорная, лучше органические соединения, содержащие кислород, серу и азот, гетероатомы; органические кислоты, например n-толуолсульфокислота, стеариновая, нафталевая, фталевая, янтарная, глутаровая, малеиновая; итаконовая кислоты, их функциональные производные, например их ангидриды, сложные эфиры, амиды; затем высшие простые эфиры и эфирные производные, например, триэтиленгликольдибутиловый эфир, тетраэтиленгликольдиметиловый эфир, эфирные дикарбоновые кислоты или же их производные; далее производные полиэтиленоксидов, обладающие соответствующей точкой кипения, и гетероциклины, например хинолин, акридин.
Предпочтительно применять высокие эфиры или многоосновные карбоновые кислоты, способные к образованию внутренних ангидридов, или производные от них соединения. Эти соединения отличаются длительным сроком службы, т.е. их активность в отношении дегидратирования не снижается даже после весьма длительной работы.
Добавки с основным характером реакции, вносимые в каталитических количествах, оказывают влияние на течение реакции, а именно: они повышают выход α,β-ненасыщенного соединения. В качестве способствующих реакции добавок используют оксиды, гидрокснды, карбонаты, карбоксилаты и алкоголяты щелочных и щелочноземельных металлов, далее амины и фосфины. Концентрация таких добавок в реакционной среде зависит при непрерывном течении реакции от пропускаемого количества, и от скорости пропускания подлежащих расщеплению эфиродикарбоновой кислоты.
Работу ведут предпочтительно при 1-4% по весу от реакционной среды, которая может представлять собой и само подлежащее расщеплению эфиродикарбоновокислотное соединение. Реакционную среду, способную осуществлять расщепление эфиродикарбоновой кислоты, можно дополнительно разводить инертными, кипящими при температурах свыше 190°С, неполярными жидкостями, например цилиндровыми маслами с высокой температурой кипения или парафинами. Во всех случаях вода отщепляется в жидкой фазе, в результате чего достигается экономия энергии и реакционного пространства.
Эфиродикарбоновые кислоты вводят в нагретую до 160-330°С реакционную среду в виде расплава или жидкости (например, в случае, когда эфиродикарбоновая кислота сама представляет собой жидкость), или в виде раствора в каком-либо растворителе, подходящем для данного эфиродикарбоновокислотного соединения, например спирте.
Реакция дегидратации эфиродикарбоновой кислоты проходит через этап промежуточных продуктов, в которых эфиродикарбоновые кислоты или соответствующие функциональные производные временно находятся связанными в виде продуктов их расщепления, а в дальнейшем процессе расщепляются в ненасыщенное соединение.
Во время реакции образуется вновь способное к дегидратированию полярное, кипящее при температуре свыше 190°С, соединение в активной форме.
Таким образом, особенно легко проводят непрерывную дегидратацию соединений эфиродикарбоновой кислоты. То обстоятельство, что средство дегидратации не расходуется, является существенным преимуществом предлагаемого способа.
При дегидратации эфиродикарбоновой кислоты условия можно варьировать таким образом, что в качестве главного продукта реакции получалось либо непосредственно свободная α,β-ненасыщенная карбоновая кислота или ее сложные эфиры.
Если для дегидратационного расщепления используют кислоты, кипящие при температуре выше 190°С, то они могут наряду с дегидратирующим действием оказывать влияние в отношении характера конечных α,β-ненасыщенных продуктов, возникающих из эфиродикарбоновой кислоты или ее производных.
Путем выбора условий реакции можно сохранить остатки Z и Z1, например карбоксильную группу или ее функциональные производные, неизменными или же осуществить превращение в другую группу. Если дегидратации подвергают, например, раствор эфиродикарбоновой кислоты в спирте, то добавлением известных катализаторов, служащих для образования, сложных эфиров, как, например, n-толуолсульфоновая кислота (одновременно и дегидратирующее средство), карбоксильная группа одновременно в основном переводится в сложные эфиры, причем возникает,- например, метиловый эфир метакриловой кислоты.
Дегидратация эфиродикарбоновой кислоты, находящейся в спиртовом растворе в присутствии небольших количеств щелочи в качестве сокатализаторов приводит, соответственно, к получению, при высоком уровне выхода, смесей, в которых ненасыщенное соединение присутствует в большей степени в виде свободной кислоты и незначительно в виде сложного эфира. '
Некоторые соединения карбоновой кислоты, служащие реакционной средой, склонны к сильной сублимации. Ее можно избежать прибавлением другого соединения, кипящего при температуре выше 190°С и не подверженного сублимации. Таким может служить, например, какой-либо диэфир фталевой кислоты, который наряду со своим отщепляющим действием способен подавлять сублимацию ангидрида фталевой кислоты или ангидрида нафталевой кислоты.
Если к реакционной среде добавлять такого рода сложные эфиры (например, диэфир фталевой кислоты), то целесообразно, чтобы их спиртовая составляющая совпадала со спиртовой составляющей выпадающего сложного эфира α,β-ненасыщенной карбоновой кислоты.
Образованные α,β-ненасыщенные кислоты или их производные целесообразно и при периодическом способе приготовления отгонять из реакционного пространства непрерывно при подходящих условиях - совместно с растворителем, примененным для соединения эфиродикарбоновой кислоты, например, спиртом. Можно отгонять с инертными газами, пропускаемыми над реакционным пространством (например, азотом), или же с помощью кипящих при низких температурах органических растворителей, которые вводят в реакционное пространство.
Для предотвращения полимеризации α,β-ненасыщенных соединений карбоновой кислоты служат добавки обычных ингибиторов полимеризации, например, индулин, гидрохинон, монометиловый эфир гидрохинона, пирокатехин, n-третичный бутилпирокатехин, метиленовый голубой краситель, сульфат меди.
Наиболее интересен способ для получения метакриловой кислоты и ее производных. В принципе могут быть получены все производные, как сложные эфиры, нитрилы и амиды. Однако целесообразно получать амиды не в качестве непосредственных продуктов процесса по данному способу, а амидированием α,β-ненасыщенных карболовых кислот. Соответствующим образом можно получать сложные эфиры со спиртовыми составляющими с высоким углеродным числом этерификацией свободной α,β-ненасыщенной карбоновой кислоты или же междумолекулярным обменом группы сложных эфиров.
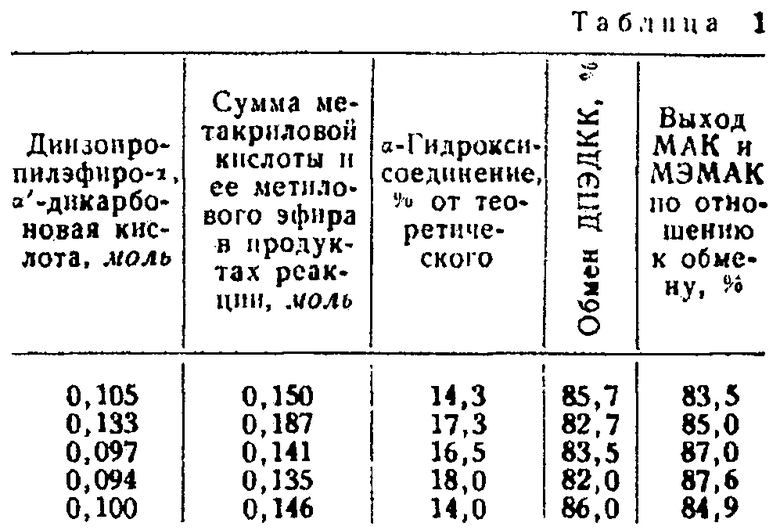
Пример 1. В нагретую до 260-280°С реакционную ванну, состоящую из 60 г ангидрида фталевой кислоты, 40 г диметнлфталата и 0,5 г едкого натра, а также по 0,5 г гидрохинона, монометилового эфира гидрохинона, пирокатехина и n-третичного бутилпирокатехина в качестве ингибиторов полимеризации, вводят последовательно через дозировочную воронку различные количества насыщенного раствора диизопропилэфиро-α,α′-дикарбоновой кислоты (ДПЭДКК) в растворе метанола (36,1%). Реакционную смесь поддерживают в состоянии движения перемешиванием.
Слабый поток азота ускоряет удаление продукта реакции, который грубо конденсируется в мостике Кляйзена с отбросным холодильником Либиха и примыкающим к нему шаровым холодильником и направляется в осадитель, охлаждаемый до температуры от -70 до -80°С.
В промежутках между отдельными опытами этой серии, результаты которых приведены в табл. 1, реакционная ванна охлаждается и дегидратация прерывается.
Как показывают полученные величины выхода по отношению к обмену в отдельных опытах, активность реакционной среды полностью сохраняется и после длительного пользования.
Продукт реакции состоит из метакриловой кислоты (МАК), метилового эфира метакриловой кислоты (МЭМАК) и метанола.
Молярное отношение метакриловой кислоты к метиловому эфиру метакриловой кислоты составляет при первом пропуске примерно 1:0,7 и при последующих пропусках изменяется до 1:0,5.
Пример 2. Как в примере 1, в реакционную среду, состоящую из 60 г ангидрида фталевой кислоты, 40 г диметилфталата и 4 г n-толуолсульфокислоты и ингибитора полимеризации (содержащего по 0,5 г сульфата меди, гидрохинона и монометилового эфира гидрохинона), постепенно вводят 35,6%-ный метанольный раствор 0,1 моль диизопропилэфиро-α,α′-дикарбоновой кислоты. При температуре ~260°С. Реакцию ведут аналогично примеру 1.
Полученный дистиллят содержит 0,131 моль метакрильных соединений, т.е. смеси, состоящей из метакриловой кислоты и метилового эфира метакриловой кислоты, что соответствует 65,5о/0 выхода. Продукт реакции содержал на 1 моль метакриловой кислоты примерно 15 моль метилового эфира метакриловой кислоты. Одновременно с дегидратацией осуществляется также образование сложного эфира примерно 94% от теоретического.
Пример 3.
А. (Неполярная реакционная среда, чисто термическое расщепление). В инертную реакционную ванну, состоящую из 100 г углеводородов, кипящих при температуре свыше 300°С, содержащую 0,5 г метиленового голубого красителя, 0,5 г монометилового эфира гидрохинона и 0,7 г пирокатехина, постепенно вводят при 270°С, перемешивании и пропускании слабого тока азота, как в примере 1, 0,065 моль диизопропилэфиро-α,α′-дикарбоновой кислоты в виде 35,5%-ного раствора в метаноле. Получают продукт, содержащий 0,033 моль метакриловой кислоты, что соответствует 25% от теоретического количества, а также следы метилового эфира метакриловой кислоты. Остаток диизопропилэфиродикарбоновой кислоты количественно разложен на различные продукты расщепления.
Б. (Для сравнения, применение фосфорной кислоты в качестве полярной реакционной среды). К указанной в примере А реакционной среде добавляют 3 г 100%-ной фосфорной кислоты. При температуре около 270°С медленно вводят при перемешивании пропускании тока азота 0,101 моль диизопропилэфиро-α,α′-дикарбоновой кислоты в виде 37,7%-ного раствора в метаноле. Получают 0,118 моль метакрильных соединений, что соответствует общему выходу 58,4% от теоретического. Соотношение метакриловой кислоты к метиловому эфиру метакриловой кислоты составляет 1:3.
В. (Применение диметилового эфира фталевой кислоты в качестве полярной реакционной среды). В качестве примера полярной производной кислоты, кипящей при температуре свыше 190°С, применяют 115 г диметилового эфира фталевой кислоты. 35%-ный раствор диизопропилэфиро-α,α′-дикарбоновой кислоты в метаноле постепенно вводят в реакционную среду при температуре около 270°С и при прочих условиях опыта согласно примерам А и Б.
Из 0,081 моль диизопропилэфиро-α,α′-дикарбоновой кислоты получают 0,093 моль метакрильных соединений, при обмене 75,2%, это соответствует выходу 57,4%, считая на вступившую в реакцию. Отношение ненасыщенной кислоты к ненасыщенному эфиру 1:4.
Пример 4. При условиях примера 1, в нагретой до 260-290°С смеси, состоящей из 60 г ангидрида фталевой кислоты, 40 г бутилового эфира фталевой кислоты и 0,7 г едкого натра в присутствии 0,3 г пирокатехина, 0,7 г монометилового эфира гидрохинона и 0,5 г гидрохинона в качестве ингибитора, идет обменная реакция с почти насыщенным раствором диизопропилэфиро-α,α′-дикарбоновой кислоты в бутаноле (15,2% по весу).
В промежутке между опытами 1 и 2 реакционную ванну охлаждают и дегидратацию прерывают.
Результаты опытов сопоставлены в табл. 2.
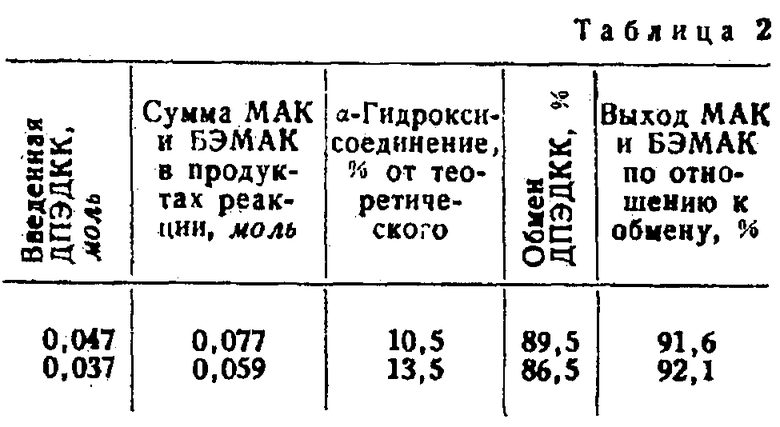
Примечание. БЭМАК - бутиловый эфир метакриловой кислоты.
Мольное соотношение продуктов реакции метакриловой кислоты к бутиловому эфиру метакриловой кислоты в опыте 1 около 1: 1,1 и в опыте 2 около 1:0,7.
Пример 5. В качестве реакционной среды используют одноосновную карбоновую кислоту, кипящую при высокой температуре. Около 35 г стеариновой кислоты, 0,45 г едкого натра и по 0,5 г гидрохинона, монометилового эфира гидрохинона и пирокатехина в качестве ингибиторов нагревают до температуры 280°С. Затем при перемешивании и пропускании тока азота постепенно добавляют подлежащую дегидратации диизопропилэфиро-α,α′-дикарбоновую кислоту в виде 36,8%-ного раствора в метаноле. При обменной реакции 0,069 моль исходного соединения преобразованы в 0,105 моль метакрильных соединений, что соответствует выходу 76%. Молярные количества ненасыщенной кислоты и ненасыщенного эфира относятся как 1:0,7.
Пример 6. Смесь, состоящую из 60 г ангидрида нафталевой кислоты, 56 г диметилового эфира фталевой кислоты (для предотвращения сублимации ангидрида дикарбоновой кислоты), 0,75 г едкого натра и по 0,5 г пирокатехина, гидрохинона и монометилового эфира гидрохинона в качестве ингибиторов нагревают до 270-300°С. В эту реакционную смесь вводят медленно, по каплям при перемешивании 36,5%-ный раствор диизопропилэфиро-α,α′-дикарбоновой кислоты в метаноле. Над реакционной массой пропускают ток азота. Из 0,105 моль диизопропилэфнро-α,α′-дикарбоновой кислоты получают при обменной реакции 0,170 моль метилового эфира метакриловой кислоты, что соответствует выходу 81,0%.
Пример 7. 0,074 моль диметилового эфира диизопропнлэфиро-α,α′-дикарбоновой кислоты в виде 41,6%-ного метанолового раствора постепенно добавляют в условиях реакции примера 1 к нагретой до 250-275°С реакционной смеси, состоящей из 90 г ангидрида фталевой кислоты, 60,5 г диметилфталата, 2 ммл концентрированной серной кислоты и 0,9 г монометилового эфира гидрохинона, а также 0,5 г метиленового голубого красителя в качестве ингибитора. При этом диметиловый эфир диизопропилэфиро-α,α′-дикарбоновой кислоты превращается в результате обменной реакции в метиловый эфир метакриловой кислоты и вследствие частичного омыления в метакриловую кислоту.
Общий выход ненасыщенных соединений 0,068 моль, что соответствует 45,9% по отношению к количеству введенного сложного эфира, причем молярное отношение метакриловой кислоты и диметилового эфира метакриловой кислоты примерно 1:1.
Пример 8. (Непрерывное ведение процесса). Смесь, состоящую из 0,1 моль диизопропилэфиро-α,α′-дикарбоновой кислоты, 0,4 моль ангидрида фталевой кислоты, 0,5 г едкого натра и 0,5 г пирокатехина постепенно нагревают при перемешивании. В конце реакции температура 280°С. После анализа продукта реакции получают 0,118 моль метакриловой кислоты, что соответствует общему выходу 59% от теоретического.
Пример 9. (Эфиродикарбоновая кислота в качестве реакционной среды). В трехгорлой колбе емкостью 100 мл, снабженной магнитной мешалкой, термометром, дефлегматором и регулированием обратного тока, нагревают постепенно с перемешиванием 19,7 г диизопропилэфиро-α,α′-дикарбоновой кислоты, 0,4 г гидроокиси натрия и 0,4 г пирокатехина. При температуре реакционной смеси около 140°С отгоняют дистиллят, температура кипения которого быстро достигает 160°С.
Перегонку заканчивают, когда температура в реакционной колбе поднимается до 250°С. Содержание метакриловой кислоты в продукте реакции, отводимом при слабом обратном токе, определяют при помощи кислотного и бромного чисел. Установлено присутствие в дистилляте 10,8 г метакриловой кислоты, т.е. 60,6% от ожидаемого теоретического количества метакриловой кислоты.
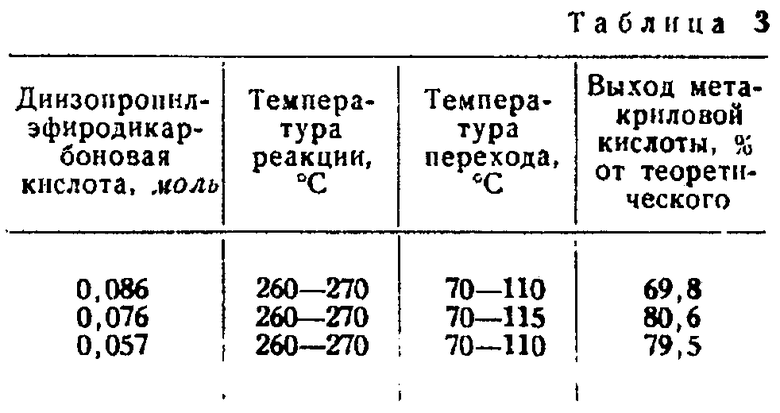
Пример 10. В трехгорлой колбе емкостью 500 мл, снабженной капельной воронкой, термометром, насадкой Кляйзена и магнитной мешалкой, нагревают до 260-270°С 100 г тетраэтиленгликольдиметилэфира, 1 г гидроокиси натрия и 1 г пирокатехина. В эту реакционную массу вводят постепенно при перемешивании последовательно одно за другим различные количества 30-36%-ного раствора в метаноле диизопропилэфиро-α,β-дикарбоновой кислоты. В промежутках между отдельными опытами, результаты которых даны в приведенной ниже таблице, реакционную среду охлаждают и вслед за тем используют для следующего опыта без каких-либо добавок. Далее определяют по кислотному и бромному числам содержание метакриловой кислоты в отдельных продуктах реакции.
Результаты приведенных в табл. 3 опытов показывают, что тетраэтиленгликольдиметилэфир как высококипящая и полярная реакционная среда является подходящей для непрерывного расщепления диизопропилэфиро-дикарбоновой кислоты.
Пример 11. В нагретую до 260-280°С реакционную смесь, состоящую из 60 г ангидрида фталевой кислоты, 40 г диметнлфталата и 4 г толуолсульфокнслоты и по 0,5 г сульфата меди (II) и гидрохинона и монометилового эфира гидрохинона, вводят постепенно 0,1 моль мононитрила диизопропилэфиро-α,α′-монокарбоновой кислоты в виде 40%-ного раствора в этаноле. Полученный дистиллят содержит 0,128 моль метакрильных соединений в виде смеси из метакриловой кислоты, сложного этилового эфира метакриловой кислоты и нитрила метакриловой кислоты, соответственно выходу 64%. Продукт реакции содержит в виде побочного продукта синильную кислоту.
Пример 12. В реакционную ванну согласно примеру 11 вводят при температуре около 270°С 0,1 моль ди-α,α′-феиилдиэтилэфиро-α,α′-дикарбоновой кислоты в виде 20%-ного раствора в метаноле. Полученный дистиллят содержит 0,116 моль α-фенилакрильного соединения, состоящего из 7% свободной кислоты и 93% соответствующего сложного метакрилового эфира, выход 58%.
| название | год | авторы | номер документа |
|---|---|---|---|
| РАДИАЦИОННООТВЕРЖДАЕМЫЕ КОМПОЗИЦИИ | 2007 |
|
RU2425058C2 |
| СПОСОБ ПОЛУЧЕНИЯ МОДИФИЦИРОВАННЫХ ЭПОКСИ(МЕТ)АКРИЛАТНЫХ СМОЛ И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2648042C2 |
| РАЗВЕТВЛЕННЫЕ СЛОЖНЫЕ ПОЛИЭФИРЫ С СУЛЬФОНАТНЫМИ ГРУППАМИ | 2012 |
|
RU2604730C2 |
| СПОСОБ НЕПРЕРЫВНОГО ПОЛУЧЕНИЯ АНГИДРИДОВ НЕНАСЫЩЕННОЙ КАРБОНОВОЙ КИСЛОТЫ | 2007 |
|
RU2443673C2 |
| СМОЛЯНАЯ СМЕСЬ НА ОСНОВЕ ЭПОКСИ(МЕТ)АКРИЛАТНОЙ СМОЛЫ И ЕЕ ПРИМЕНЕНИЕ | 2013 |
|
RU2649437C2 |
| Смешанные эфиры эпоксидных смол | 1974 |
|
SU538004A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ КАРБОКОВЫХКИСЛОТ | 1971 |
|
SU412165A1 |
| УСОВЕРШЕНСТВОВАННЫЙ СПОСОБ ПОЛУЧЕНИЯ АНГИДРИДОВ НЕНАСЫЩЕННЫХ КАРБОНОВЫХ КИСЛОТ | 2007 |
|
RU2458040C2 |
| СПОСОБ НЕПРЕРЫВНОГО РАСТВОРЕНИЯ ТВЕРДОГО ВЕЩЕСТВА В РЕАКЦИОННОЙ СРЕДЕ | 2018 |
|
RU2761042C2 |
| СПОСОБ НАНЕСЕНИЯ ПОКРЫТИЯ НА МЕТАЛЛИЧЕСКИЙ СУБСТРАТ | 2008 |
|
RU2515951C2 |
1. Способ получения α,β-ненасыщенных карбоновых кислот и/или их производных, отличающийся тем, что, эфирокарбоновые кислоты, общей формулы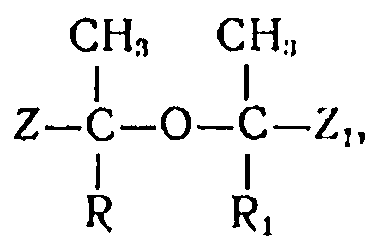
где R и R1 - одинаковые или различные водород, алкильные, арильные или алкенильные радикалы, Z и Z1 - одинаковые или различные карбоксильные группы или их функциональные производные, нагревают в жидкой фазе при температуре 160-330°С в полярной среде, кипящей при температуре выше 190°С, в присутствии каталитических количеств добавок основного характера, ингибиторов полимеризации.
2. Способ по п. 1, отличающийся тем, что в качестве полярной среды применяют многоосновные неорганические кислоты, органические соединения, содержащие гетероатом, многоосновные органические карбоновые кислоты, способные к образованию внутреннего ангидрида, или их функциональные производные, обладающие тем же действием, простые эфиры и их производные.
3. Способ по пп. 1 и 2, отличающийся тем, что в качестве добавок основного характера используют оксиды, алкоголяты, карбонаты.
4. Способ по пп. 1, 2, 3, отличающийся тем, что процесс ведут в среде неполярного инертного растворителя, например цилиндрового масла.
5. Способ по пп. 1, 2, 3, 4, отличающийся тем, что процесс ведут в присутствии катализатора этерификации.
Авторы
Даты
1968-07-17—Публикация
1965-07-28—Подача