Действие хлора на гидраты щелочных и щелочно-земельных металлов, а также на карбонаты щелочных металлов исследовано еще Берцелиусом в 1785 г., а подробно изучено Гэ-Люссаком в 1842 г. Способ получения хлората калия из поташа со времени Берцелиуса оставлен и ни технического и, видимо, ни научного интереса не представлял, между тем процесс получения бертолетовой соли непосредственно из поташа с одновременным получением в качестве побочного продукта хлористого калия заслуживает внимания в СССР, где единственным источником калия является растительный поташ, из которого посредством обработки соляною кислотою специально приготовляют хлористый калий. С другой стороны, при большом производстве и потреблении каустической соды получаемые одновременно большие количества хлора не находят себе сообразного применения, и, таким образом, приобретает экономический смысл производство бертолетовой соли химическим путем из электролитического хлора. В то же время, вследствие имеющей место значительной потребности в хлоре и белильных солях, все количество получающегося одновременно с каустической содой хлора не может быть употреблено исключительно для производства бертолетовой соли химическим путем. Наконец, производство бертолетовой соли непосредственно электролитически имеет свои весьма большие преимущества и нуждается соответственно в больших количествах хлористого калия. Таким образом, в условиях СССР оказывается наиболее целесообразным комбинирование химического и электрохимического производства бертолетовой соли с ведением химического производства непосредственно из поташа и с получением хлористого калия, что и имеет целью предлагаемое изобретение.
Химизм процесса действия хлора на едкие щелочи и карбонаты щелочных металлов можно разделить на два момента. 1) поглощение хлора и образование гипохлорита и 2) разложение образующегося гипохлорита на хлорат и хлорид. Ведь процесс схематически можно представить следующими формулами:
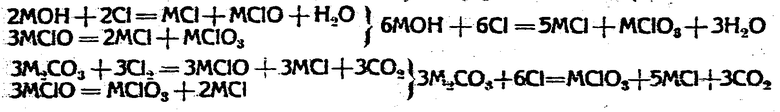
Так как образование хлората происходит через промежуточно образующийся гипохлорит, то выход его зависит от рационального образования и еще в большей мере наивыгоднейшего разложения гипохлорита на хлорат. На стационарную концентрацию гипохлорита, получающегося в процессе хлорирования раствора едкой или углекислой щелочи, и на разложение гипохлорита на хлорат и хлорид оказывают влияние следующие факторы: 1) температура, 2) свет, 3) щелочность раствора, 4) концентрация первоначальной едкой или углекислой щелочи, 5) концентрация хлорида, 6) углекислая кислота, 7) избыток хлора и 8) концентрация HClO. Bhadari (Zeitschr. f. anorg. chem. 13, 385) и Foerster (Journ. prakt. chem. 63, 141) доказали, что с увеличением температуры, при других равных условиях, разложение гипохлорита идет быстрее и, следовательно, стационарная концентрация его в растворе становится меньше, так как при более высокой температуре в единицу времени образующегося гипохлорита разлагается больше, чем при низкой температуре. Самое же разложение протекает с побочной реакцией с выделением кислорода по формуле:
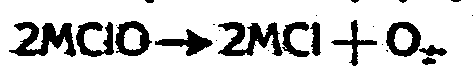
Далее Bhadari доказал, что при высокой температуре и равенстве других условий гипохлорит в единицу времени разлагается тем больше, чем больше концентрация гипехлорита. Количество же выделяющегося кислорода увеличивается с увеличением концентрации гипохлорита и времени нагревания. Опыты авторов с карбонатами приводят к тем же выводам.
Концентрация гипохлорита увеличивается, как показали опыты авторов, при хлорировании на холоду с уменьшением первоначальной концентрации поташа, а при кипячении - с увеличением тока хлора, пропускаемого в раствор. Щелочность среды имеет большое влияние на скорость разложения гипохлорита и побочную реакцию с выделением кислорода, и именно: чем больше щелочность среды, тем меньше в единицу времени при других равных условиях разлагается гипохлорита. Побочная реакция с выделением кислорода увеличивается с уменьшением щелочности среды.
Присутствие хлорида на разложение гипохлорита оказывает, повидимому, каталитическое влияние (Foerster und Jorre. Journ. prakt. chem. 59, 53), при чем при прочих равных условиях ускоряет процесс перехода гипохлорита в хлорат и уменьшает побочную реакцию с выделением кислорода. Присутствие свободной углекислоты также ускоряет переход гипохлорита в хлорат, и хотя угольная кислота более сильная кислота, чем хлорноватистая, тем не менее опыты авторов показали, что избыток CO2 заметно не увеличивает побочную реакцию с выделением кислорода. Избыток хлора при разложении гипохлорита на хлорат имеет как бы два различных каталитических значения. С одной стороны - избыток хлора способствует образованию HClO, которая окисляет гипохлорит по формуле:
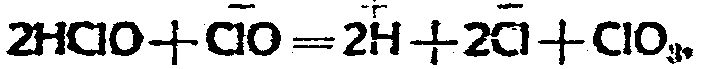
при чем концентрация HClO, согласно формуле:
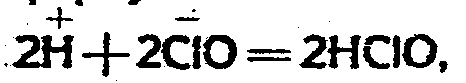
остается постоянной. С другой стороны, избыток хлора способствует саморазложению гипохлорита по формуле
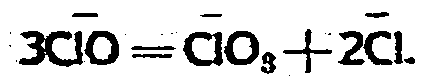
Эти реакции при образовании хлората очень важны, так как протекают без потери кислорода. Опыты с карбонатами, в общем, вполне подтвердили каталитическую роль избытка хлора. При хлорировании раствора поташа слабым током, хлора, но таким, чтобы раствор им был насыщен, т.-е. чтобы в единицу времени поступало хлора больше, чем в этот период раствор поташа может абсорбировать, скорость разложения гипохлорита во много раз менее, чем в опытах, где через такой же раствор поташа пропускался хлор более сильной струей. При хлорировании поташа на ход реакций действуют те же факторы, с той лишь разницей, что при хлорировании карбонатов все время выделяется СО2, которая вначале процесса в большей или меньшей мере, в зависимости от температуры, выделяется в свободном виде, часть ее входит в реакцию с раствором еще не прохлорированного поташа, образуя бикарбонат. Затем, достигнув момента, когда весь карбонат перешел в бикарбонат, хлорируется бикарбонат, обильно выделяя СО2. Далее бикарбонат исчезает, и остающийся гипохлорит от действия хлора и тепла переходит в хлорат.
Все расчеты по установлению выхода от теории исходили из принятого предположения, что процесс хлорирования поташа должен итти по формуле:

Хлорирование на холоду производилось при комнатной температуре (10-15°) в колбе емкостью 500 см3. Через некоторые промежутки времени брались пипеткой в 2,5 см3 две пробы. В одной определялось количество KClO, в другой - KClO3; проба бралась пока жидкость оставалась гомогенной. Скорость хлора отсчитывалась по пузырькам в промывной стклянке с H2SO4, при чем ток хлора 100-150 пузырьков в минуту считался слабым, 150-250 - средним и когда число пузырьков в минуту больше 250 - считался сильным. При холодном хлорировании под конец процесса остается большое количество гипохлорита, очень медленно при этих условиях разлагающегося. Для перевода его в хлорат в одном из опытов гипохлорит разлагался пропусканием среднего тока хлора при медленном нагревании сперва до 40°, потом до 80° и затем до кипения, а в остальных опытах - только кипячением, без пропускания хлора. По окончании опыта полученные KClO3+KCl определились анализом реакционной жидкости.
При среднем токе хлора и небольшой концентрации первоначального раствора поташа процесс образования гипохлорита идет быстрее, чем хлората, максимум же того и другого достигается почти одновременно. При одинаковом среднем токе хлора предельное количество образовавшегося и не изменяющегося в ходе процесса гипохлорита тем больше, чем меньше концентрация взятого раствора поташа.

Выход хлората наилучший, когда большая часть поташа переходит а хлорат на холоду, это происходит лучше с увеличением концентрации взятого раствора поташа, когда стационарное количество гипохлорита в % % калия поташа значительно меньше, чем в более слабых растворах поташа.
Процесс хлорирования при кипячении, при сильном токе хлора идет быстрее, максимальное количество промежуточно образующегося гипохлорита больше и конечный выход хлората также больше. С увеличением концентрации первоначально взятого раствора поташа выход хлората уменьшается. Для хлорирования раствора поташа до начала выделения газов колба с реактивной жидкостью взбалтывалась при помощи водяной турбинки. Скорость хлора регулировалась дифференциальным манометром с H2SO4; давление в реактивной жидкости показывал обыкновенный манометр с H2SO4. Стклянка с реактивной жидкостью была соединена с двумя промывными сосудами с раствором Kl для поглощения не вошедшего в реакцию хлора, а потом с эвдиометром для собирания углекислоты. Температура поддерживалась при помощи водяной бани при 10°С. Первое время раствор поташа жадно поглощает хлор и до известного момента при надлежащем взбалтывании и небольшой скорости хлора никаких газов из реакционной стклянки не выделяется. После же этого происходит обильное выделение углекислоты, в особенности при взбалтывании реакционной жидкости. Скорость процесса при одинаковой t°, давлении, взбалтывании и концентрации зависит от скорости поступающего хлора, а именно - процесс идет тем быстрее, чем больше скорость пропускания хлора. Количество гипохлорита, образующегося к этому моменту, тем меньше, чем больше концентрация взятого раствора поташа, и тем больше, чем больше скорость хлора.
Количество вошедшего к этому моменту в реакцию с хлором калия во всех произведенных опытах почти одинаково, а промежуточно образующийся гипохлорит в течение реакции разлагается на хлорид и хлорат по уравнению
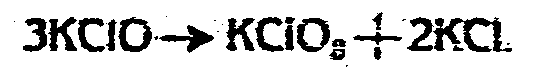
Таким образом, для получения хлората хлорированием поташа, исходная концентрация поташа должна быть средняя (2-4 экв. в 1 литре), раствор должен хлорироваться в сильной струе хлора на холоду до тех пор, пока весь карбонат не будет переведен в гипохлорит и частью в хлорат и не будет более выделяться CO2, затем, реакционная жидкость должна нагреваться осторожно и медленно сначала до 40°, затем выше до 60°, 80° и, наконец, до кипения, при чем все время должен пропускаться хлор тем же сильным током. В результате получается хлорат с выходом, близким к теоретическому (98,5%).
Для экономии хлора и времени при техническом получении хлората целесообразен непрерывный процесс в котором хлор проходит через ряд колб с раствором поташа, соединенных последовательно, при чем взамен прореагировавшей ставилась бы новая, чтобы, меняясь местами, они подвигались к источнику хлора, и часть их, близких к источнику хлора, прогревалась. Постановленные опыты непрерывного процесса хлорирования проводились следующим образом.
Пять колб, вместимостью 300 см3 каждая, соединялись последовательно трубками в ряд. В каждую колбу в одном опыте наливалось 200 см3 раствора поташа в воде, а в других опытах - раствор поташа в насыщенном растворе KCl+KClO3. Температура в начале опыта 10-15°С. Через каждую колбу в течении 6 часов хлор проходил в холодный раствор, два часа в раствор нагретый до 40-60° и два часа - нагретый от 70 до 100°С на водяной бане. Каждая колба, пробыв в цепи 10 часов, снималась. Через каждые два часа, вместо снятой колбы, ставилась новая. Снятая с цепи реакционная жидкость еще содержала гипохлорита 0,04 экв. в 1 л. Для разложения этого гипохлорита и освобождения жидкости от газообразного хлора жидкость кипятилась на огне в течение 30 минут с обратным холодильником. Раствор поташа в насыщенном растворе KCl+KClO3 приготовлялся следующим образом: 200 см3 насыщенного при 15°С раствора
смешивались с определенным количеством крепкого раствора поташа и затем выпаривались до первоначального объема в 200 см3. От добавления лишних ионов калия в жидкости образовывался осадок следующего состава:
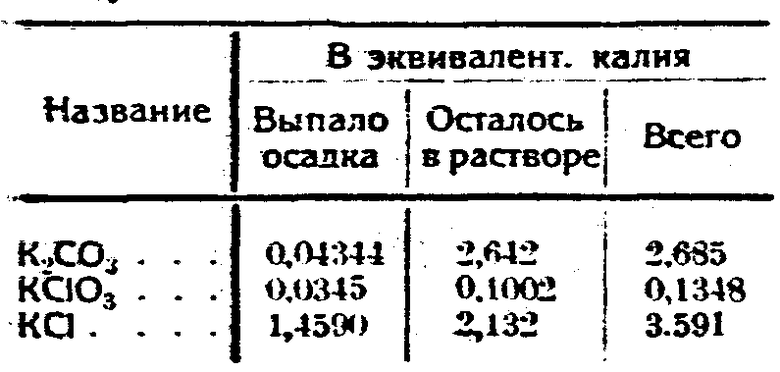
Такого состава и концентрации жидкость шла для хлорирования в цепь. Концентрация гипохлорита в реакционной жидкости, в зависимости от количества поступающего хлора, более или менее быстро достигает максимума, затем его концентрация, повидимому, в зависимости от количества поступающей из предыдущих колб в раствор углекислоты, немного спадает, оставаясь при дальнейшем хлорировании на холоду без нагревания почти без изменений, так как его при этих условиях разлагается в единицу времени столько, сколько вновь образуется от хлора из поташа. Прежде чем хлор начинает поступать в колбу (кроме первоначальной колбы), жидкость уже насыщена углекислотой, поступающей из предыдущих колб, и с большим количеством бикарбоната. Бикарбонатные растворы первое время жадно поглощают хлор, и начало выделения хлора из реакционной колбы совпадает с моментом насыщения раствора бикарбонатом, а разложение последнего - с выделением углекислоты, которая уносит с собой частью и хлор.
Так, напр., из пяти свежих растворов поташа после последней пятой колбы хлор был обнаружен лишь через 3 ч. 45 м. в то время, как около 2-х часов через последнюю колбу проходила в чистом виде выделяющаяся углекислота. Контрольный раствор Kl с крахмалом. Можно установить процесс так, что будет использоваться весь поступивший хлор и одновременно получаться совершенно свободная от хлора углекислота, благодаря промывке в последних колбах раствором бикарбоната или карбоната, еще не насыщенным хлором. Обильно выделяющаяся углекислота из первых колб переводит в следующих карбонат в бикарбонат, а раствор бикарбоната до известного момента насыщенный хлором жадно поглощает хлор, находящийся в смеси с СО2 даже в минимальном количестве.
После хлорирования по способу непрерывного процесса из поташа, растворенного в насыщенном растворе KCl+KClO3, получается также KClO и KClO3, и эти соли, будучи не в состоянии раствориться в уже насыщенной этими же солями жидкости, должны находиться в твердом состоянии наряду с насыщенным раствором. Как известно, растворимость KCl мало увеличивается с увеличением температуры, тогда как растворимость KClO3 сильно увеличивается, и обратно, при охлаждении насыщенного раствора хлорида выпадает немного, а хлората при таком же охлаждении выпадает значительно больше. Таким образом, можно при высокой t° отфильтровать твердый хлорид в то время, как весь хлорат будет в растворе. Если хлорид отсосать на воронке, промыть насыщенным раствором KCl, и еще лучше насыщенным при той же высокой температуре, то можно почти весь хлорид выделить из жидкости совершенно свободным от хлората. Далее, если раствор, освобожденный при высокой t° от твердого KCl, охладить до более низкой t°, то можно выделить значительное количество хлората; для этого надлежит прибавить столько воды, чтобы при охлаждении хлорид не выделялся, и тогда, после отсасывания от маточного раствора и промывки насыщенным раствором хлората, получится чистый хлорат, свободный от хлористого калия. Для этого необходимо брать для хлорирования определенную эмпирически установленную концентрацию поташа в насыщенном растворе
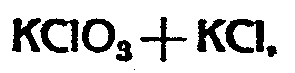
так как при избыточной концентрации взятого поташа избыток образовавшегося хлората не может быть растворен в жидкости даже при кипении, а потому при горячем фильтровании вместе с хлоридом будет отфильтровываться и хлорат. Наоборот, при недостаточной концентрации поташа, помимо нежелательности малой концентрации, ввиду уменьшения выхода, процесс раздельной кристаллизации усложняется, вследствие незначительного выпадения хлората при неизбежном для чистоты продукта прибавлении воды. Подходящей концентрацией поташа в насыщенном при 15° растворе KCl+KClO3 является 2,685 эквивал. При этой концентрации раствора температурой для первой кристаллизации и отфильтрования от KCl является 75-82°. Температура второй кристаллизации для выделения хлората 15-17,5°С. Перед второй кристаллизацией прибавка 18-20% воды для этих концентраций вполне достаточна.
Таким образом, действием хлората на раствор поташа, можно достичь почти количественного превращения поташа в хлорат и хлорид без побочного образования хлорида путем разложения гипохлорита с выделением кислорода. Достижение такого результата возможно при соблюдении условий, благоприятствующих образованию гипохлорита и его неразложению на хлорид и кислород, с другой стороны, условий, благоприятствующих его превращению в хлорат и хлорид. Эти условия сводятся к ведению первой стадии насыщения хлором по возможности на холоду, второй же стадии - при постепенном под′еме температуры и главное при максимальном избытке газообразного хлора. Избыток газообразного хлора и именно увеличение его парциального давления над раствором при общем атмосферном давлении может ускорить процесс превращения гипохлорита в хлорат более, чем вдвое.
Ввиду того, что раствор калия бикарбоната, насыщенный угольной кислотой, весьма жадно и количественно поглощает хлор, возможно осуществить превращение поташа в хлорат и хлорид в виде непрерывного процесса с совершенно количественной утилизацией хлора: и выделением из реакционной системы чистой свободной от хлората угольной кислоты. Вследствие различной растворимости хлората калия и хлорида калия и изменения этих растворимостей с температурой, возможно путем правильного выбора первоначального состава реакционной смеси достичь раздельного выпадения в кристаллическом виде каждого из двух продуктов реакции бертолетовой соли и хлористого калия и тем самым избежать как необходимости специального разделения этих солей, так и всякого специального упаривания растворов. При этом маточный раствор после выделения из него хлористого калия (при 80-90%) и бертолетовой соли (при 15°) Идет снова в реакции с добавлением новой порции поташа и удаляется из цикла только при накоплении в нем посторонних загрязнений.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ГИПОХЛОРИТА КАЛИЯ | 2005 |
|
RU2293705C2 |
| Способ получения хлорида кальция | 1982 |
|
SU1081126A1 |
| Способ получения хлората натрия | 1981 |
|
SU998327A1 |
| АНТИСЕПТИЧЕСКИЙ ПРЕПАРАТ | 2007 |
|
RU2334527C1 |
| Способ получения хлорированного тринатрийфосфата | 1982 |
|
SU1100229A1 |
| СПОСОБ ОБЕЗВРЕЖИВАНИЯ ПУЛЬПЫ ГИПОХЛОРИТА КАЛЬЦИЯ | 2018 |
|
RU2687455C1 |
| Способ получения хлорид-хлоратного кальций натриевого дефолианта | 1981 |
|
SU979272A1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИПОХЛОРИТА ЛИТИЯ | 1993 |
|
RU2078024C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЦЕНТРАТОВ ГИПОХЛОРИТОВ ЩЕЛОЧНЫХ МЕТАЛЛОВ | 1992 |
|
RU2026808C1 |
| БИОЦИДНАЯ КОМБИНАЦИЯ НА ОСНОВЕ ГИПОХЛОРИТА ДЛЯ ПРИМЕНЕНИЯ В СЕЛЬСКОМ ХОЗЯЙСТВЕ | 2009 |
|
RU2483544C2 |
1. Способ непрерывного получения бертолетовой соли и хлористого калия действием хлора на поташ, сразу дающий обе соли в твердом виде без выпаривания или вымораживания растворов, отличающийся тем, что хлором действуют на раствор поташа такой концентрации, что в конце хлористый калий при высокой температуре выпадает в твердом виде, а для превращения поташа в бертолетову соль без побочной реакции разложения гипохлорита на хлористый калий и кислород, первую стадию процесса насыщения поташа хлором, во время которой образуется бикарбонат и получается максимальная концентрация гипохлорита, ведут при умеренном токе хлора и возможно низкой температуре, во второй же стадии, для возможного достижения кислотности раствора, способствующей переходу гипохлорита в бертолетову соль (хлорат), температуру раствора постепенно повышают, одновременно пропуская максимальный избыток хлора.
2. Прием выполнения способа по п. 1, отличающийся тем, что полученный при 80-90° раствор хлористого калия и бертолетовой соли разбавляют 18-20% воды и охлаждают до 15° для выделения бертолетовой соли, после чего насыщают поташем и обрабатывают хлором, как указано в п. 1. доводя под конец реакции температуру до 80-90° для окончания реакции осаждения хлористого калия в твердом виде, и с полученным раствором поступают, как указано выше.
Авторы
Даты
1928-01-31—Публикация
1925-06-01—Подача