(54) СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТА ДЛЯ ЛИЗНСА КЛЕТОК
МИКРООРГАНИЗМОВ водный сырой раствор сложного фермента может далее подвергаться обработке известным обессоливающим агентом, например сульфатом аммония, хлоридом натрия, или же смешиваемым с водой органическим растворителем таким, как низшие алифатические спирты, например метиловый или этиловый спирт, или ацетон, с целью выделения этого сложного фермента из сырого раствора. Для дальнейшей очистки осажденный сложный фермент может растворяться в соответствуюш,ем буферном растворе ацетата концентрацией 0,01 Al и ферментативный раствор может далее подвергаться диализу или процессу гель-фильтрации. Полученный таким ооразом очиш,енный ферментативный раствор может затем подвергаться сушке при температуре ниже 0°С, в результате чего получается очиш,енный ферментативный препарат, состоящий в основном из желаемого сложного фермента. Этот сложный фермент, получаемый из Pellicularia sasakii, и сложный фермент, получаемый из Pellicularia filamentosa, согласно предлагаемому способу растворимы в воде, но нерастворимы в ацетоне и в этаноле. Все эти ферменты имеют общие характеристики: они являются активными в отношении лизирования живых и мертвых клеток бактерий, грибов, дрожжей, базидиомицетов и хлореллы;их активность в отношении лизирования стенок клеток является стабильной при величине рН 3-9, причем оптимальная величина рН 5-7; они имеют оптимальную активность (активность в отношении лизирования стенок клеток) при 30-40 С, но эта оптимальная температура слабо изменяется в зависимости от природы микроорганизмов, клетки которых подвергаются лизированию; активность в отношении лизирования стенок клеток является стабильной в интервале низких температур, но эта активность снижается нри температуре выше их активность в отношении разрушения стенок клеток снижается в результате присутствия ионов Мп++, Ni++ или Zn++; обладают ферментативной активностью целлюлозы, глюканазы, хитиназы, протеазы, геми-целлюлазы и карбоксиметилцеллюлазы; они в основном состоят из компонентов ферментов, каждый из которых имеет молекулярный вес не менее 50 000. Можно полагать, что лизирующий стенки клеток сложный фермент, полученный из Pellicularia sasakii, и сложный фермент, полученный из Pellicularia filamentosa, представляет собой смеси целлюлазы, глюканазы, хитаназы, протеазы, геми-целлюлазы и карбометилцеллюлазы в форме сложного соединения, и они имеют высокую активность в отношении лизирования клеток различных микроорганизмов благодаря синергичному действию отдельных составляющих ферментов, хотл можно полагать, что эти сложные ферменты, полученные из различных видов Pellicularia, имеют составы, которые в большей или в меньшей степени отличаются один от другого, поскольку эти сложные ферменты имеют различные свойства и различную ферментативную активность. Согласно изобретению предлагается сложный фермент, лизирующий стенки клеток, выбранный из числа сложных ферментов, полученных при помощи известного штамма Pellicularia sasakii и из числа сложных ферментов, полученных из известного штамма Pellicularia tilamentosa, причем все эти сложные ферменты имеют следующие общие характеристики:активность в отношении лизирования живых и мертвых клеток, по крайней мере таких организмов, как Aspergillus niger, Penicillium steckii, Saccharomyces cerevisial, Candida utilis, Candida albicans, Candida lipolytica, Lentinus edodes. Bacillus subtilis, Lactobacillus lactis и Chlorella; стабильная активность в отношении лизирования стенок клеток является при величине рН 3-9, причем оптимальная величина рН составляет 5-7; оптимальная активность в отношении лизирования стенок клеток при 30-40°С, но оптимальная температура изменяется в зависимости от природы микроорганизмов, стенки которых подвергаются лизированию; стабильность активности в отношении лизирования стенок клеток при низких температуpax и быстрое снижение ее нри температуре выше 50°С; снижение активности в отношении лизирования стенок клеток в присутствии ионов Мп++, Ni++ или Zn++; ферментативная активность равная активности целлюлазы, карбоксиметилцеллюлазы, глюканазы, хитиназы, протеазы, геми-целлюлазы и амилазы; молекулярный вес компонентов ферментов в основном не менее 50 000. Сложный фермент, образуемый из Pellicularia sasakii, обладает активностью такой целлюлазы, которая имеет оптимальный температурный предел 40-50°С и оптимальную величину рН 5,0, например активностью р-1,3-глюканазы, которая имеет оптимальный температурный предел 40-50°С и оптимальную величину рН 5,0 и обладает активностью такой хитиназы, имеющей оптимальную температуру 35°С, и оптимальную величину рН 4,0-5,5. Сложный фермент, полученный из Pellicularia filamentosa, обладает, кроме того, такой активностью целлюлазы, которая имеет оптимальный температурный предел 40-50°С, например активностью р-1,3-глюканазы, которая имеет оптимальный температурный предел 40-50°С и оптимальную величину рН 5,0, и такой активностью хитиназы, имеющей оптимальную температуру 35°С и оптимальную величину рН 4,0-5,5.
Активности в отношении лизированйя стенок клеток, которые обозначаются как общепринятые характеристики (Ь) - (1) сложных ферментов, соответствующих изобретению, определяются следующим способом и в следующих масштабах.
Получаемое количество сложных ферментных препаратов химически реагирует с 5 мл суспензии клеток Candida utilis IFD -0,396, которые имеют исходную мутность, соответствующую оптической плотности (О. Д.), равной 1,и, измеренной при длине волны 660 нм. Эта реакция осуществляется при 35°С в течение оО мин при величине рН 5,0. После завершения реакции оптическая плотность суспензии клеток, содержащей лизированные и нелизированные клетки, измеряется при длине волн 660 нм. В случае, когда прореагировавшая суспензия клеток теряет 1 /о мутности (или величины О. Д.) по сравнению с исходной суспензией клеток, то указанное количество сложного ферментного препарата имеет активность в отношении лизированйя стенок клеток равную единице. Кроме того, активность целлюлазы, активность р-1,3-глюканазы и активность хитиназы в отношении указанных выше сложных ферментов, соответствующих изобретению, измеряются в соответствии с приведенным ниже описанием в примере 13.
В случае когда лизирование, а именно растворение стенок клеток микроорганизмов осуществляется при использовании сложного фермента, то этот фермент химически реагирует с клетками микроорганизмов, суспензированных в воде. Желательно, чтобы реакция протекала при 20-60 и преимущественно при 30-40°С при рН 2-10, и лучше при рН 3,4-8,0. Температура реакции и величина рН могут быть заданы в соответствии с природой микроорганизма, стенки клеток которого подвергаются лизированию под воздействием сложного фермента. Клетки микроорганизма, подвергаемого лизированию, могут быть либо живыми, либо мертвыми, при их контактировании с ферментом. В любом случае почти все клетки могут растворяться благодаря лизированию стенок клеток и содержимое (внутриклеточное вещество) клеток может удаляться в водную фазу суспензии клеток через 20 ч после начала реакции.
Для того чтобы осуществлялась реакция сложного фермента с клетками микроорганизма, любой ферментный препарат в форме твердого порошка или его водного раствора, или питательного бульона культура, или экстракта этой культуры может быть добавлен в суспензию клеток в воде, величина рН которой доведена до оптимальной величины для осуществления ферментативной реакции. Наряду с этим эти клетки могут быть введены в раствор ферментного препарата в воде или буферный раствор, величина рН которого доведена до оптимальной для осуществления ферментативной реакции.
Когда реакция осуществляется до полного
ее завершения, то клетки полиостью растворяются, не оставляя никакого твердого осадка в растворе. Однако в некоторых случаях количество твердого остатка остается даже после
полного завершения реакции. Возможность растворения клеток до желаемой степени может быть установлена путем определения изменения мутности суспензии клеток или концентрации растворимого компонента протоплазмы клеток или посредством микроскопического наблюдения в условиях наличия клеток в растворе. Таким образом, может быть получен водный раствор клеток, в котором вещество оболочек клеток и протоплазма клеток
растворяются в воде вместе с используемым сложным ферментом.
По желанию полученный раствор клеток может быть отфильтрован для удаления любого твердого осадка. Этот раствор может
быть также нагрет для деактивации оставшихся ферментов в случае, если это необходимо. Далее раствор может подвергаться обработке путем простой дегидратации или выпаривания Б вакууме, в результате чего получается
сухой продукт. Раствор клеток может также обрабатываться соответствуюшим образом, например путем экстракции или хроматографии для извлечения из него любого ценного вещества или веществ.
Предлагаемые сложные ферменты способны лизировать клетки (стенки клеток) различных микроорганизмов таких, как бактерии, грибы, дрожжи, базидомицеты, а также хлореллу. Это свойство сложных ферментов является
более положительным и более ценным, чем, например, свойства известных ферментов, которые извлекают из культуры Corticium rolfsii. Фермент, извлеченный из данной культуры Corticium rolfsii, имеет оптимальный предел
величины рН 2,0-2,5 и ограниченную активность, так что он может лизировать лишь стенки клеток дрожжей и хлореллы. Микроорганизмы разновидности Corticium могут быть отличимы от микроорганизмов разновидности
Pellicuiaria в том отношении, что первый образует такой сплошной спорообразующий слой плодового тела, в котором базидий расположен в непосредственной близости, в то время как последний образует спорообразующий слой плодового тела с разрывом сплошности, в котором базилии находятся на расстоянии друг от друга.
Согласно изобретению предусматривается способ растворения клеток микроорганизмов,
включающих бактерии, грибы, дрожжи, базидиомицеты и хлореллу, который заключается в обработке суспензированных клеток в водной среде сложным ферментом, лизирующим стенки клеток, являющимся известным штаммом Pellicuiaria sasakii или Pellicularia filamentosa или питательным раствором культуры указанного штамма, или его экстракта.
Сложный фермент, лизируюший стенки клеток, может быть использован для экстракции
ценных внутриклеточных веществ из клеток, а также для получения концентрированного экстракта, содержащего питательные вещества или другие ценные вещества, присутствующие в протоплазме клеток различных микроорганизмов таких, как дрожжи, хлорелла, бактерии и грибы, Для этих целей эти клетки обрабатывают сложным ферментом в воде для лизирования стенок клеток и освобождения протоплазмы, в результате чего получается раствор клеток, который далее может быть частично дегидрирован или полностью дегидрирован с получением концентрата или сухого порошка. Кроме того, сложный фермент, лизирующий стенки клеток, соответствующий изобретению, может быть использован для предотвращения порчи пищевых продуктов или напитков, путем введения в них эффективно действуЕОщего количества сложного фермента и путем растворения клеток бактерий или грибковых организмов, которые могут присутствовать или могут быть занесены в пищевые продукты или напитки, и для которых свойственно вызывать порчу пищевых продуктов или напитков. Таким образом, сложные ферменты находят широкое применение во многих областях, папример в пищевой, фармацевтической промышленности, в производстве пестицидов и в приготовлении кормов. Пример 1. В коническую колбу емкостью 300 мл помещают 19 г пшеницы, 1 г высущенных дрожлчей и 18 мл воды. Затем эту колбу нагревают и содержимое ее перемешивают, в результате чего получают однородную пастообразную смесь. Эту среду подвергают обработке паром при 120°С в течение 20 мин с целью стерилизации. Исходную культуру Pellicularia sasakii подвергают инокулированию на стерильную культуральную среду. Выращивание в твердом состоянии щтамма Pellicularia осуществляют в течение 120 ч при постоянной температуре равной 28°С. Полученную в результате культуру смешивают с 80 мл буферного раствора ацетата с рН 4,0 и эту смесь перемешивают при комнатной температуре в течение 1 ч с тем, чтобы ферменты экстрагировались в жидкую фазу. Затем эту смесь фильтруют при постоянном давлении, и полученный фильтрат центрифугируют, в результате чего получают 70 мл прозрачного раствора, содержащего сложный фермент, полученный из Pellicularia sasakii. К этому раствору добавляют 120 мл ацетона, в результате чего выпадает в осадок сложный фермент. Осадок фильтруют и высушивают, получают 700 мг ферментного препарата в порошкообразном состоянии. Фермеитный препарат является активным в отношении лизирования стенок клеток различных микроорганизмов, включающих бактерии, грибы, дрожжи, базидиомицеты и хлореллу. Пример 2. В коническую колбу емкостью 300 мл помещают 10 г отрубей пшеницы, 10 г отрубей риса, 2 г пептона и 20 мл воды. Колбу нагревают и содержимое колбы персмещивают, получая однородную пастообразную смесь. Культуральную среду подвергают обработке паром при 120°С в течение 20 мин с целью стерилизации. Исходную культуру Pellicularia filamentosa инокулируют до стерильной культуральной среды. Выращивание в твердом состоянии щтамма Pellicularia осуществляют при 28°С в течение 170 ч. Полученную культуру смешивают с 80 мл воды и тщательно перемешивают при комнатной температуре с тем, чтобы ферменты экстрагировались в водную фазу. Смесь фильтруют под давлением и полученный фильтрат центрифугируют, в результате чего получают прозрачный раствор, содержащий сложный фермент, полученный из Pellicularia filamentosa. К раствору добавляют сульфат аммония до достил ения степени насыщения 70% и таким образом осаждают сложный фермент. Осадок фильтруют и сушат, получают 1 г ферментного препарата в порошкообразном состоянии. Этот препарат является активным в отношении лизирования стенок клеток различных микроорганизмов, включающих бактерии, грибы, дрожжи, базидиомицеты и хлореллу. Пример 3. В коническую колбу емкостью 1 л помещают 9 г сахарозы, 6 г отрубей риса, 0,6 г порошкообразного высушенного гриба шляпочного (Continellus shutake), 1,5 г сульфата аммония, 1,5 г первичного кислого фосфорнокислого калия, 0,3 г хлористого калия, 0,3 г сульфата магния и 0,003 г сульфата железа (двухвалентного). К содержимому колбы добавляют 300 мл воды с целью растворения растворимого вещества. Эту Культуральную среду в виде водного раствора стерилизуют путем обработки паром при 120°С в течение 20 мин. Исходную культуру Pellicularia filamentosa инокулируют на стерильную жидкую Культуральную среду. Выращивание при одновременном взбалтывании щтамма Pellicularia осуществляют при 23°С в течение 120 ч. Получеиный таким образом питательпый раствор культуры фильтруют, удаляя присутствующее в нем твердое ещество, выпаривают до получения объема, составляющего одну треть от исходиого объема, путем диализа через диализную мембрану. К концентрированному раствору добавляют 00 мл водного 99%-ного раствора спирта, в езультате чего осаждают сложный фермент. садок фильтруют и сушат, получают 450 г ерментного препарата в порошкообразном остоянии. Ферментный препарат является ктивным в отношении лизировапия стенок леток различных микроорганизмов, включащих бактерии, грибы, дрожжи, базидиомиеты и хлореллу. Пример 4. В коническую колбу емкотью 300 мл помещают 5 г тонко измельченых отрубей пшеницы, 0,5 г сульфата аммоия, 0,5 г первичного кислого фосфорнокислого калия, 0,1 г хлористого калия, 0,1 г сульфата магния, 0,001 г сульфата железа (двухвалентного) и 100 мл воды. Содержимое колбы стерилизуют путем обработки паром при 120°С в течение 20 мин. Исходную культуру Pellicularia sasakii инокулируют на стерильную жидкую культивируемую среду. Инкубацию при одновременном встряхивании осуществляют при 28°С в течение 24 ч посредством вращающего встряхивателя, в результате чего получают жидкую семенную культуру.
На 5 деревянных желобах помещают соответственно 200 г отрубей пшеницы, 5 г порошкообразного высушенного шляпочного гриба (Cortinellus shutake) и 160 мл водного 5%-него раствора сульфата аммония. На каждом желобе эти материалы тщательно перемешивают один с другим, получая однородную смесь, которую затем стерилизуют путем обработки паром. 20 мл полученной жидкой семенной культуры, указанной выше, инокулируют до получения культивируемой среды на каждом желобе.
Стационаоное культивирование осушествляют пои 28°С в течение 96 ч. Культупы на этих желобах смешивают одну с другой и соединенную культуру экстрагируют 4 л водного буферного раствора ацетата с рН 4,0.
Экстракт сЬильтруют под давлением и фильтрат центрифугируют, в результате чего цолучяют 3.6 л прозрачного раствора, содержащего сложный (Ьермент, полученный из Pellicularia sasakii. К этому прозрачному раствору добявляют сульфат аммония до степени насыщения 70%, осаждая сложный сЬермент.
Осадок собирают и вводят в 900 мл воды. Водный раствор фермента лиофилизируют в вакууме, в результате чего получают 32 г ферментного препарата в виде порошка.
Ферментный препарат является активным в отношении лизирования стенок клеток различных микроорганизмов, включающих бактерии, . дрожжи, базидиомицеты и хлоре.ллу.
Пример 5. В каждлю из трех конических колб емкостью ЯОО м.я помещают 19 г отрубей пшеницы, 1 г высушенных дрожжей и 18 мл воды, и содержимое каждой колбы нагпевают и перемешивают, в результате чего получают однородную пастообразную смесь. ЭТУ питательную стерилизуют путем обработки паром при 190°С в течение 20 мчн. Исходные КУЛЬТУРЫ Pellicularia sasakii и Pellicularia filameutosa инокулируют соответственно в указанных колбах на стерильной среде. Выращивание в твердом состоянии осуществляют в течение ч при постоянной температуре равной 28°С. После выращивар. получаемые культуры смешивают с поптшями по 80 м.л буферного раствора ацетата, и смеси церемешивают при комнатной температуре в течение 1 ч с тем. чтобы сложные Аеоменты, получаемые из различных вилов Pellicularia, экстрагировались в жидкие Лазы. Эти смеси фильтруют под давлением получаемые фильтраты центрифугируют, в результате чего получают порции по 70 мл трех прозрачных растворов, содержаших сложные ферменты, соответственно.
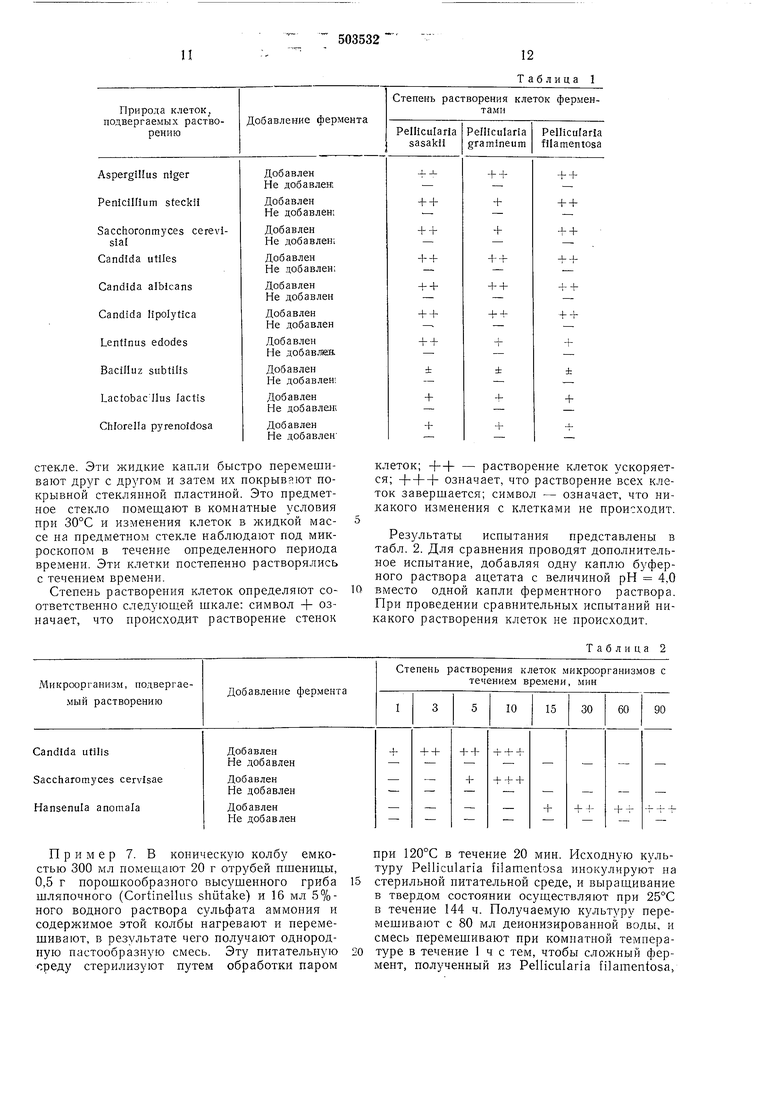
С другой стороны, суспензии клеток грибов, дрожжей, бактерий и хлореллы в воде приготавливают из культур Aspergillus niger, Penicillium stecku. Saccharornyces cereyisiae IFO0209, Candida utieis IFO-0396. Candida albicans, Candida lipolytica и Lentinus edodes,
каждую из которых инкубируют в мальтовой среде; культуры Bacillus subtilis и Lactobacillus bactis инкубируют в бульонной среде, и культуру Chlorella pyrenoidosa - в среде Nakamura, соответственно. Каждую из этих
суспензий клеток, приготовленную указанным способом, помещают в три испытательные трубки. Затем в эти трубки, каждая из которых содержит суспензию клеток, вводят порции по 20 мл указанных выше трех прозрачных растворов соответствующих сложных ферментов. Содержимое каждой испытательной трубки осторожно взбалтывают в течение 20 ч в водяной бане при постоянной температуре равной 35°С, так что эти ферменты химически реагируют со стенками клеток, растворяя эти клетки в суспензии. Суспензии этих клеток наблюдают под МИКРОСКОПОМ с целью определения в какой степени эти клетки растворяются или перевариваются под воздействиом сложных ферментов Pellicularia и Pellicularia filamentosa.
Степень растворения этих клеток определяют согласно шкале: символ ++ означает, что происходит растворение всех клеток. Символ
-.растворение большей части клеток; символ ± - растворение меньшей части клеток; символ - означает, что не происходит растворения никаких клеток. Полученные результаты испытания показапь в табл. . Для сравнения испытание ПОВТОРЯЮТ, лобавляя 2 м- буферного раствора ацетата при величине рН 4,0 вместо указан ых выше прозрачных ферментных растворов. В испытании, проведенном для сравнения, не наблюдается растворения клеток.
Пример 6. Суспензии клеток в физиологическом водном СОЛЯ1ТОМ растворе приготав.гпвяют из КУЛЬТУР Candida utilis IFO-0396, .Sf-charomyces cereyisiae lFO-0209 и Hansinulie anomalie IFO-0122. каждую из которых получают путем выращивания со взбалтыванием микроорганизма в жи.п:кой питательной cperie. содержаптей. вес. %: глюкоза - 3; (NH.V.SO. - 0.8: КНзРОл - 0.5: NaCl - 0,2;
M.eSO.--7HjO - 0.2 и дрожжевой экстракт- 0.1 с величиной рН 5.2. в течение 20 ч при взбалтывании посредством вращающегося взбалтывателя(скоростьвращения
200 об/мин).
ОДНУ каплю каждой суспензии клеток, приготовленной таким образом, помещают на ппедметное стекло, и одну каплю прозрачного растяора сложного фермента Pellicularia . данного в примере 1. добавляют к одной капле суспензии клеток на предметном
И
12
Таблица 1








| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения глюкоамилазы и белкового корма | 1982 |
|
SU1097673A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОДУКТОВ ФЕРМЕНТАЦИИ | 2008 |
|
RU2486235C2 |
| СПОСОБ ВЫРАЩИВАНИЯ ДРОЖЖЕЙ | 2013 |
|
RU2522006C1 |
| СТЕРЕОИЗБИРАТЕЛЬНОЕ МИКРОБНОЕ ВОССТАНОВЛЕНИЕ РАЦЕМИЧЕСКОГО ТЕТРАЛОНА (ЕГО ВАРИАНТЫ) | 1999 |
|
RU2235784C2 |
| ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА TRICHODERMA LONGIBRACHIATUM - ПРОДУЦЕНТ КОМПЛЕКСА КАРБОГИДРАЗ, СОДЕРЖАЩЕГО ЦЕЛЛЮЛАЗЫ, БЕТА-ГЛЮКАНАЗЫ, КСИЛАНАЗЫ, МАННАНАЗЫ И ПЕКТИНАЗЫ | 2004 |
|
RU2287571C2 |
| ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА PENICILLIUM VERRUCULOSUM - ПРОДУЦЕНТ КОМПЛЕКСА ЦЕЛЛЮЛАЗ, КСИЛАНАЗЫ И КСИЛОГЛЮКАНАЗЫ И СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТНОГО ПРЕПАРАТА КОМПЛЕКСА ЦЕЛЛЮЛАЗ, КСИЛАНАЗЫ И КСИЛОГЛЮКАНАЗЫ ДЛЯ ГИДРОЛИЗА ЦЕЛЛЮЛОЗЫ И ГЕМИЦЕЛЛЮЛОЗЫ | 2008 |
|
RU2361918C1 |
| ФЕРМЕНТ С АКТИВНОСТЬЮ ЭНДО-1,3(4)-β-ГЛЮКАНАЗЫ, КОДИРУЮЩАЯ ЕГО ДНК И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1995 |
|
RU2215034C2 |
| ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА PENICILLIUM FUNICULOSUM - ПРОДУЦЕНТ КОМПЛЕКСА КАРБОГИДРАЗ, СОДЕРЖАЩЕГО ЦЕЛЛЮЛАЗЫ, БЕТА-ГЛЮКАНАЗЫ, КСИЛАНАЗЫ, ПЕКТИНАЗЫ И МАННАНАЗЫ | 2002 |
|
RU2287570C2 |
| ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА MYCELIOPHTHORA FERGUSII-ПРОДУЦЕНТ НЕЙТРАЛЬНЫХ ЦЕЛЛЮЛАЗЫ, БЕТА-ГЛЮКАНАЗЫ И КСИЛАНАЗЫ | 2008 |
|
RU2361915C1 |
| ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА TRICHODERMA LONGIBRACHIATUM - ПРОДУЦЕНТ КОМПЛЕКСА КАРБОГИДРАЗ, СОДЕРЖАЩЕГО ЦЕЛЛЮЛАЗЫ, БЕТА-ГЛЮКАНАЗЫ, КСИЛАНАЗЫ, ПЕКТИНАЗЫ И МАННАНАЗЫ | 2001 |
|
RU2195490C2 |

стекле. Эти жидкие капли быстро перемешивают друг с другом и затем их покрывают покрывной стекляпной пластиной. Это предметное стекло помещают в комнатные условия при 30°С и изменения клеток в жидкой массе на предметном стекле наблюдают под микроскопом в течение определенного периода времени. Эти клетки постепенно растворялись с течением времени.
Степень растворения клеток определяют соответственно следующей шкале: символ + означает, что происходит растворение стенок
Пример 7. В коническую колбу емкостью 300 мл помещают 20 г отрубей пшеницы, 0,5 г порошкообразного высушенного гриба шляпочного (Cortinellus shutake) и 16 мл 5%ного водного раствора сульфата аммония и содержимое этой колбы нагревают и перемешивают, в результате чего получают однородную пастообразную смесь. Эту питательную среду стерилизуют путем обработки паром
клеток; - растворение клеток ускоряется; + означает, что растворение всех клеток завершается; символ - означает, что никакого изменения с клетками не происходит.
Результаты испытания представлены в табл. 2. Для сравнения проводят дополнительное испытание, добавляя одну каплю буферного раствора ацетата с величиной рН 4,0 вместо одной капли ферментного раствора. При проведении сравнительных испытаний никакого растворения клеток не происходит.
Таблица 2
при 120°С в течение 20 мин. Исходную культуру Pellicularia filamentosa инокулируют на
стерильной питательной среде, и выращивание в твердом состоянии осуществляют при 25°С в течение 144 ч. Получаемую культуру перемешивают с 80 мл деионизированной воды, и смесь перемешивают при комнатной температуре в течение 1 ч с тем, чтобы сложный фермент, полученный из Pellicularia filamentosa.
13
экстрагировался в жидкостный слой. Далее смесь фильтруют под давлением и фильтрат выпаривают, в результате чего получают 65 мл прозрачного раствора, содержаш.его сложный фермент. К раствору добавляют сульфат аммония до достижения степени насыщения 70%, происходит осаждение сложного фермента. Осадок фильтруют и ВЫСУШИВ я ют. в результате чего получают 1,7 г ферментного препарата в виде порошка.
Ферментный препарат растворяют в буферном растворе ацетата с величиной рН 5,0, получая ферментный раствор, содержащий 1% указанного ферментного препарата. 10 мл ферментного препарата помещают в изогнутую трубку в виде буквы L, и 1 г высушенных дрожжей (дрожжи представляют собой разновидность Candida, которые инкубируют, используя питательнуго среду, содержащую фракцию парафинового углеводорода нефтяного дистиллятного масла в качестве источника углерода) или 1 г высушенной хлореллы дополннтельно поменлают в L-образную трубку. Трубку встряхивают при постоянной температуре 40°С, в результате чего ферменты химически реагируют с клетками дрожжей Пример 8. На данном примере показано, что сложный фермент, соответствующий изобретению, используется для предотвращения порчи различных пищевых продуктов и напитков таких, как томатный, картофельный и апельсиновый соки. Порции по 10 мл томатного, картофельного или апельсинового сока помещают в небольшие сосуды. Одновременно энзим, полученный по примеру 1, очищают при помощи ионообменной смолы. 0,1, 1 и 10 мг конечного очищенного энзима добавляют в указанные сосуды. Несколько сосудов, содержащих продукты или напитки, оставляют без добавления энзима в качестве контроля. Сосуды выдерживают на воздухе при 28°С в течение некоторого времени и затем наличие загрязнения проверягот наблюдением обесцвечивания вида и запаха соков. Результаты испытаний показаны в табл. 4 (символ + обозначает загрязнения, символ - отсутствие загрязнения).
14
или хлореллы, так что происходит лизирование стенок клеток. По прошествии 1 ч или 3 ч реакции к реакционной смеси, находящейся в изогнутой трубке, добавляют 3 мл водного раствора гидрата окиси натрия, повышая величину рН до 7. Смесь гнова встряхивают еще в течение 15 мин и цептоиф тир ют для удаления из нее твердых веществ. Получаемый прозрачный раствор апплизируют на содержание Сахаров и протеинов, которые выделяются из клеток. Сахаров определяют колориметричегким способом при длине волны света 530 ммк, используя в качестве проявляющего агента 3,5-динитросалициловую кислоту, и содержание Сахаров выражается в количестве глюкозы. Количество потеинов рассчитывают, определяя содержание азота в протеинах при помощи известного способа Кьендаля-нингидрина, и умножая найденное содержание азота на 6,25.
Результаты испытания показаны в табл. 3. Для сравнения эту процедуру повторяют, добавляя 10 мл буферного раствора ацетата с величиной рН 5,0 вместо упомянутого выше ферментного раствора.
Таблица 3 Пример 9. К 100 г высушенных клеток дрожжей Candida lipolytica добавляют 1 л водного раствора (рН 5,0) ферментного препарата (концентрация 0,5%), который получают в примере 1. Смесь выдерживают при 35°С в течение 30 мин, в результате чего протекает ферментативная реакция, реакционную смесь затем смешивают с 1 л 0,2 н. раствора гидрата окиси натрия. Затем смесь нагревают при 50°С в течение 30 мин для того, чтобы протеин дрожжевых клеток экстрагировался в водную фазу. Водиый экстракт центрифугируют с целью удаления уплотненных клеток и величину рН всплывщего слоя раствора доводят до 4,0 путем добавления 6 н. соляной кислоты, протеин осаждается при изоэлектрической точке. Количество осажденного и извлеченного протеина соответствует 76% от общего содержания протеина дрожлсевых клеток.
15
В случае, когда эту процедуру повторяют, минуя использование ферментного препарата, то количество осажденного и извлеченного поотеина соответствует лишь 15% от общего сотеожания ппотеина дрожжевых клеток.
Пример 10. 10 г кормя, состоящего из высушенных клеток Candida utilis, лобавляют к 100 мл водного раствооа СрН 6.0), солеожащего 0,5% ферментного препарата, котооый получают по примеру 3. Эту смесь вытепживают при 35°С в течение I ч, так что Ьепменты химически реагируют со стенками плеток дрожжей. Далее Deaкциoннvю cMetb пм 7шивают при температуре ниже 0°С, в чего получают порошкообразный копм. состоящий из обработанных сЬерментов .пожжей Candida. ЭТУ процедуру повторяют без использования (Ьеоментного ппепярата, R результате чего получают порошкообразный КОРМОВОЙ продукт, состоящий nnof-To из вы ушенных при температуре ниже 0°С дрожжей Torula. Исходные необработанные высушенные ДРОЖЖИ Candida, обработанные фепментом ДРОЖЖИ Candida и просто высушенные ПРИ температуре ниже 0°С дрожжи обрабатывают пепсином с целью определения их спосо ности перевариваться.
Ниже приведены данные по спо обности перевариваться пепсином образцов, %: Высушенные необработанные ппожжи Candida (сравнительт-ьтй ппимеп 58.4
ПРИ тPмпenpт - 0°С ттпожж Candida (сравт-тите.яьный ппм рр)60.2
ДРОЖЖИ Candid. обработанные г.пожным гЬс п -т-пм, соответствующим изобретрнчю97,7
Пример 11. V позрачномл ПТ ТВОРУ, содержащему сложный фермент Pellicularia sasakii, полученный по приглеру 5, добавляют двукратный объем ацетона, в результате чего выделяют сложный Леомент. Осадок собирают и высушивают, R результате чего получают порошкообразный ферментный препарат. 20 г
503532 Таблица 4
влажной спекшейся массы (содержание твердого вещества 48 вес. %, состоящей из клеток Candida utilis, добавляют к 100 мл водного раствора (рН 4,0), содержащего 1% указанного порошкообразного ферментного препарата. Получаемую смесь осторожно встряхивают при 35°С в течение 1 ч, в результате чего протекает ферментативная реакция. После этой реакции реакционную смесь центрифугируют, удаляя оставшиеся твердые вещества. Всплывший на поверхность слой раствора лиофилизируют, в результате чего получают 7,8 г сухого порошкообразного экстракта растворимого внутриклеточного вещества клеток Candida utilis. В результате анализа обнаружено, что этот порощкообразный экстракт содержит, %: сырые протеины 54,3; сырые масла 4.0; сырые волокнистые материалы 1,7; зола 6,4 и растворимые азотистые вещества 33,6. Процедуру цовторяют с добавлением 100 мл буферного раствора ацетата с величиной рН 4,0, вместо ферментного раствора, получают лишь 1,7 г сухого порошкообразного продукта после лиофилизации всцлывшего на поверхность слоя раствора.
Пример 12. Инокулум Candida albican.s патогенных дрожжей пр ттяплич ют пУтем ПРИВИВКИ культ фы на скошрт-ном ягяпе .чтих
дрожжей к 100 мл картоЛр ьро-глюкозной среды, инкубирования при 30°С в 24 ч и последующего разбавления этой водой до получения объема, который в десять раз превышяет исходный объем. ПОРЦИИ приготовленного таким обрязом инокулума объемом 1 мл, содержащие 6X10 колоний клеток дпожжей на 1 мл. добавляют к порциям по 10 мл картофельно-глюкозной среды (рН 6,0), содержащей 0,5; 1.2; 4: 8: Ifi и
0 32 мг/мл ферментного препарата Pellicularia ,sasakii. полученного по примеру 1, соответственно. Инoкyлиpoвaнн пo кубируют в стационарных условиях ппи 35°С в течение 24 ч и пос.не этого определяют количе тво лизировянрых к.петок Cяndidя я1Ьirяп«;. Полученные результаты представлены ниже.
ir
Число клеток колоний на 1 мл среды
Отсутствует2X10
0,51X10
17X10
24X10 42X10 8О
16О
32О
Пример 13. Определяют ферментативные активности сложных ферментов, которые получены из культур Pellicularia sasakii и Pellicularia filamentosa по способам, описанным в примерах 4 - 2, соответственно. Определение ферментативных активностей осуществляют следующим образом, (t) Активность целлюлазы
б мл ферментного водного раствора (рН 4,0), содержащего 1% ферментного препарата (сухое порошкообразное состояние) помещают в L-образную трубку и в раствор, находящийся в этой трубке, погружают 2 кусочка фильтровальной бумаги (1 смХ1 см). Этот раствор встряхивают при 40°С посредством встряхивателя, совершающего возвратнопоступательное движение. Измерение осуществляют до тех пор, пока вся фильтровальная бумага полностью не разрушится. Активность целлюлазы рассчитывают согласно уравнению
150
1000,
Активность -: (А ) (П
где X означает время (мин), продолжаюСвойства сложных ферментов, полученных из Pellicularia sasakii Свойства сложных ферментов, полученных из Pellicularia filamentosa
18
щееся до tex пор, пока кусочкй филы-ровальной бумаги полностью не разрушаются; Y - объем (мл) используемого ферментного раствора.
(и) Активность р-1,3-глюкозы
0,5 мл раствора ламинарина концентрации 1 % помещают в испытательную трубку и затем добавляют 0,5 мл разбавленного ферментного раствора (рН 5,0), эту смесь нагревают при 40°С в течение 30 мин. После этого определяют количество глюкозы, присутствующей в реакционной смеси, используя колориметрический способ. 1 мг глюкозы, образующейся в реакционной смеси, считают соответствующей единице активности р-1,3-глюканазы на 0,5 мл указанного разбавленного ферментного раствора. (Hi) Активность хитиназы Эту активность измеряют, используя 1 мл
суспензии 1%-ного порошкообразного (фракция 100 меш) пoли-N-aцeтилглюкoзaминa (рН 5) и при протекании химической реакции меладу 1 мл разбавленного ферментного раствора при 40°С в течение 2 ч.
Образование 1 мкг/мл N-ацетилглюкозамина в реакционной смеси рассматривается соответствующим одной единице активности хитиназы на 1 мл указанного ферментного раствора.
Оптимальную температуру и оптимальную величину рН соответствующих ферментных активностей также измеряют для ферментных препаратов, полученных из Pellicularia sasakii и Pellicularia filamentosa.
Полученные результаты представлены в табл. 5 и 6.
Таблица 5
Таблица 6 Характеристика используемых микроорганизмов. Согласно таксономии, разновидность Pellicularia относится к семейству Corticiaceal порядка Aphyllophoralls, принадлежащего к подклассу Homolasidiae класс Basidomycetes. Разновидность Pellicularia sasakii, который, как известно, вызывает заболевание рисовых растений. Разновидность Pellicularia filamentosa, который, как известно вызывает заболевание картофеля, называемое черной коростой. Известны некоторые штаммы разновидности Pellicularia filamentosa, выделенные согласно методике АТСС (сбор культуры американского типа) AWo 14701, 14702, 14703 и 20206, а также штамм Pellicularia sasakii, выделенный согласно АТСС № 13289 1. Штамм Pellicularia sasakii выделен из пораженных участков рисового растения, зараженного заболеванием, вызывающим гниение «Shecth blight и этот щтамм был выделен согласно методике F.R.I 1170 японского научно-исследовательского института 2. Был выделен также штамм Pellicularia filarnentosa из поврежденных растений картофеля, зараженных черной коростой, и этот штамм был выделен согласно методике F. R. I. № 1171, с той же датой. Тем не менее не было возможности отделить штаммы согласно F.R.I. №№ 1170 и 1171 от известных штаммов Pellicularia sasakii и Pellicularia filamentosa соответственно описанию, приведенному в японской публикапии 3. Морфологические свойства, характерные для упомянутых выще щтаммов Pellicularia sasakii и Pellicularia filamentosa кратко описаны ниже. (i) Вегетативный мицелий находится в волокнистом виде или имеет форму шляпки гриба, и вначале бесцветный, он превращается в желтовато-коричневый в процессе созревания, (ц ) Этот мицелий обычно имеет диаметр 8-12 мкм. (Ш) Образуется склероций (ш) Базидий имеет форму цилиндра или обратную яйцевиднуЕО форму и несет четыре или восемь ответвлений. (о) Получаются бесцветные споры с гладкой поверхностью. (vi) Гимений (спорообразующий слой плодового тела) является плоским. (уи) Плодовое тело образует сетчатую оболочку. Штаммы Pellicularia sasakii и Pellicularia filamentosa могут различаться один от другого тем, что Pellicularia sasakii вызывает заболевание рисовых растений, связанное с гниением, а Pellicularia filamentosa вызывает заболевание черную коросту растений картофеля и заболевание черную ножку баклажанов; кроме того, Pellicularia sasakii образует склероций, окрашенный в черновато-бурый цвет, размером 5-13 мм, базидий размером 8X9 мкм и споры размером 9X7 мкм; а Pellicularia filamentosa образует склероций, окрашенный в бурый цвет размером 1X3 мм, базидий размером 15X8 мкм и споры размером 9X7 мкм. Однако некоторые- таксономеры показали, что Pellicularia sasakii является естественной разновидностью filamentosa. Формула изобретения 1. Способ получения фермента для лизиса клеток микроорганизмов путем культивировапия их продуцентов на питательной среде, содержащей источники углерода и азота с последующим выделением фермента из среды, отличающийся тем, что, с целью получения фермента с более высокой литической активностью, в качестве продуцентов используют микроорганизмы рода Pellicularia. 2. Способ по п. 1, отличающийся тем, что из рода Pellicularia используют вид Pellicularia sasakii. 3. Способ по п. 1, отличающийся тем, что из рода Pelliculari используют вид Pellicularia filamentosa. Псточники информации, принятые во внимание при экспертизе: 1.«Сбор культуры американского типа, Каталог Штаммов, изд. 9, 1970, с. 120. 2.Научное и технологическое агентство Японии Inage, Chiba, City, Япония, 8 ноября 1971. 3.«Справочник по микробиологии, Токио, 1957, с. 376-377.
Авторы
Даты
1976-02-15—Публикация
1972-12-13—Подача