I
Изобретение относится к аналитической химиии, а именно к способам определеия фтора при анализе промежуточных продуктов производства фтористых солей (маточные растворы криолита и фтористого алюминия), отбросных гипсов, апатитов, фосфоритов и др., после отделения фтора дистилляпией в виде HF , Н или их солей.
Известен способ определения фтора титрованием раствором азотнокислого тория .
Существенными недостатками этого способа являются радиоактивность тория, что в значительной степени ограничивает возможность его использования в ряде лабораторий, необходимость предварительного отделения фтора дистилляцией от большинства катионов и анионов, в том числе сульфатов.
Известен прямой потенциометический способ определения фтора, основанный на измерении потенциала системы в отсутствие этанола и расчете содержания
фтора с помощью калибровочного графи- , ка с использованием лантанфториднотч электрода 2.
Однако применяя прямую потенциометрщй, необходимо соблюдать следующие условия.
Анализируемые и стандартные растворы должны быть строго идентичны по солевому составу, ионной силе, а также рН 2, т. е. прямая потенциометрия применима, когда имеется полная априорная информация о сопутствующих фтору элементах и есть уверенность, что их соотношение постоянно.
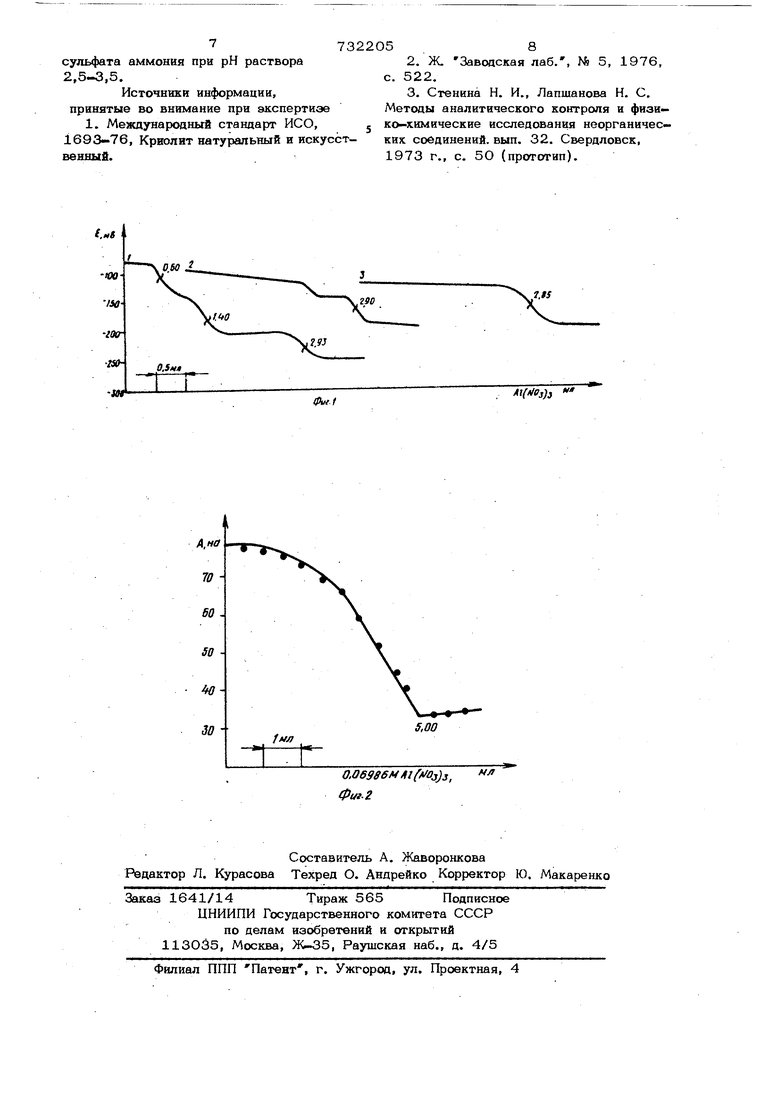
Калибровочный график цолжен строить ся каждый раз перед замером концент-ра ций фтора аналиаируемых растворов, а в случае применения метода стандартных . добавок при определении фтора рассчет ным путем не исключается операция пост- роения н систематической проверки калибровочного графика для нахождения art ;углового коэффициента. 3 Желательно иметь индивидуальные электроды для замера крепких, и слабых концентраций фтора. Даже при соблюдении перечисленных условий коэффициент вариации при определ лении фтора в модельных растворах с ис пользованием лучших образцов электродо отечественного производства составляет 4 %, Наиболее близким к предлагаемому п технической сущности и достигаемому ре зультату является способ определения фтора титрованием раствором азотнокис лого алюминия в этанолововодной (1:1 об) среде при рН 5, содержащей примерно О,2 г - ион/л натрия 3). .Недостатками этого способа являютс значительный расход этанола и сравнительно невысокая степень надежности оп ределения фтора иа-ва неблагоприятногб фактора пересчета, поскольку алюминий и фтор, образуя в условиях титрования ион Аи Fg , реагирует и отношении 1:6, и небольшая ошибка в измерении объема раствора алюминия приводит к шестикратной ошибке в определении фтора. Коэффициент вариации при определении фтора 3,7%. Целью изобретения является разработка надежного и простого способа оп ределения фтора с применением раство- ра азотнокислого алюминия в качестве титранта, т. е. упрощение анализа и по- аышение точности определения. Поставленная цель достигается тем, что титрование проводят в среде 6,О- 6,5 м/л сульфата аммония при рН раствора 2,5.3,5. Введение в титруемый раствор серно кислого аммония определенной концентрации Еозволяет количественно без про межуточных .стадий осуществить реакцию .-vKe -I CFSO. (1) 44 Введение других солей, например . азотнокислого или хлористого аммония, не приводит к количественному получе- ншо иона КС-F из-за образования в при сутствии анионов WOs 1 Cl смеси фторй.ань.х компонеш-ов алюминия с паачич- яым соотношенкем компонентов. Выбор МИ J в сравнении, например, с К или НО обусловлен частичным образованием с катионами щелочных металлов трудно растворимых кристаллов с соотношением А.- F -1:6; Отличительными признаками предлагаемого изобретения являются введение 54 в титруемый раствор аммония copiioKi i-лого до его концентрации 6,0 - 0,5 Д1 создание рН титруемого раствора в nfieделах 2,5-3,5. При меньшей, чем 6М концентрации аммония сернокислого реакция взаимодействия фтора и алюминия протекает в три стации: первоачально образуется смесь и Ne/F. , затем kbf и, наконец, , что соответствует трем скачкам потенциала при титровании с потенциометрической индикацией конечной точки титрования (к.т.т.) (электроды лаш-анфторидш:1й и хлоридсеребряный) (см. фиг. 1 кривые 1 и 2). На фиг. 1 показан график с кривыми потенциометрического титрования F в виде NoF (лантанфторидный и хлоридсеребряный электроды). Кривая 1. 19 мг F, рН 3, раствор, tv ° .(NO,,f3493 М . -70 мл),3 Кривая 2. 3,8 мг F , рН 3, раствор, 4,9 М по (НН. ),SO ,С„. 0,06986 М / I/ --7П 2 4 Ae(No,L ( vobu4,r70 мл). Кривая 3. 3,8 мг F , рН 3, раствор, 6,0 М по (NH ) so. .С , 0,06986М (VSBui. мл). Ь Причем первый и второй скачки потенциала наиболее четко выражены при значительной концентрации фтора (19-50 мг в титруемом объеме). Это является недостатком метода с потенциометрической индикацией к.т.т., поскольку первый или второй скачки потенциала могут быть ошибочно приняты за конец титрования. При большей, чем 6,5 М концентрации аммония сернокислого эатруднительно установить необходимое значение рН раствора. При рН 3,5 образуются соединения с отношением фтора к алюминию более 1, а при рН 2,5 образуется слабая фторис- товодородная кислота.. В обоих случаях наблюдается искажение результатов определения фтора. В выбранных условиях кривая титрования с потенциометрической индикацией к.т.т. имеет один скачок потенциала, соответствующий образованию разнолиганд- ного комплекса A6FSO без промежуточных стадий образования вышеупомянутых форм ионов алюминия с фтором, (см. фиг. 1, кривая 3). Изменение потенциала в к.т.т. составляет 80-9О мВ при изменении объема«0,07 М титранта на 0,5 мл. Предлагаемый способ определения фтора позволяет применить биамперометри- 57 меч-кун индикацию к.т.т. (два алюминиевых. электрода, см. фиг. 2). На фиг. 2 показан график с кривыми оиамперометрического титрования F в вице Hg&iFg (два алюминиевых электрода). -6,7 мг, раствор, 6,0 Л1 по (НН4)„50, 3, В .20 мВ ( /Q 70 мл). Причем бнамперометрическая индикация к. т.т., как наиболее четкая и позвоЛ5пощая анализировать растворы с широким диапазоном концентраций фтора, пред почтительнее потенциометрической. Пример 1. Определение фтора с биамперометрической индикацией к.т.т. Навеску 0,47%-ного раствора И jSiF в количестве 2 г, взятую с точностью 0,0002 г, помещают в полиэтиленовую ячейку, добавляют 2 г сульфата аммония, одну каплю 1О%-ного раствора сер- ной кислоты, перемешивают раствор 3-4 мин магнитной мешалкой. Затем йо-- бавляют 60 мл насыщенного раствора сульфата аммония, рН которого предвари тельно доведен до 3 раствором серной кислоты, и титруют О,Об М раствором нитрата алюминия с биамперометрической индикацией к.т.т., налагая на алюминие вые электроды напряжение 20 мВ. Определено 0,48%H2SiFg со средне квадратичной ошибкой единичного опреде™ ления 0,016%. Пример 2, Определение фтора с потенциометрической индикацией к.т.т. 1О мл исследуемого pacTBojsa фто- 5 ристого натрия, содержащего около 4 мг фтора, помещают в полиэтиленовую ячей ку, добавляют 9 г сульфата аммония, две капли 10%-ного раствора серной кис лоты, перземешивают раствор 3--4 мин магнитной мешалкой. Затем добавляют 6О мг насыщенного раствора сульфата аммония, рН которого предварительно доведен до 3 раствором серной кислоты, и титруют 0,06 М раствором нитрата алюминия с потенциометрической инйика- цией к.т.т. (лантанфторидный и хлорид. серебряный электроды). Предлагаемый способ применим для определения фтора, находящегося в растворе в виде фтористого натрия или крем нефтористоводородной кислоты. Таким образом, преимуществами пред лагаемого способа являются упрощение условий титрования за счет исключения этанола и увеличение точности анализа, объема поскольку ошибка в измор. 56 титранта приводит к однократной (а не шестикратной в сравнении с известным) ошибке в определении фтора. Катионы металлов, образующие нера- створимые или комплексные соединения с фтором (например,Са,Нд,х4 и др.), должны отсутствовать. Это необходимое усло вие, общее для всех титрометрических методов определений фтора, нашедших практическое применение. На погрешность определения фтора предлагаемым способом ье оказывают влияния 22 щза1--иый (весовой по отноше™ НЕЮ к фтору) избыток хлоридов и нитратов, 1О кратн.ый избыток натрия и калия, 2.кратный избыток фосфатов и практичес кг любое количество сульфата и аммония. Предлагаемый титрометрический способ позвапяет анализировать трудно разлагаемые объекты (отбросный сульфат кальция, получающийся в процессе обработки с|мюорита серной кислотойг фосфоритьз. аппатиты и др), ограничиваясь однократной дистилляцией фгора при 290 С (повторная общеприн$ггая цистил ляция фтора при 135 С исключается, , поскольку серная кислота, попадающая в дисгкш: при 290Я после неитрализа. ции аммиаком, анализу не мешает). npsanarsei-iiii-S способом можно опре делять 1-«16 мг фтора в объеме iOO мл (5riO U8-lCr ivia ib/n). Растворы с бо --део высокой гконцентрацкей. фтора несб. ходЕГмо разбзЕлнгь., Упрощанке условкй титрования чистых растворов ftaF г HF ,H2SiFg и их достигается за счет исключения эта«. вола. Коэффициент вариации при определении фтора предлагаемым способом в растворах, содер ке.щих Fg при рН 3, составляет 3,,3%s при рН 1,8%, а в растворах, содержащих фтор в вщз.е HF или MGF , при рН 2,7 составляет 3,5 - 1,6%о Формула Способ определения фтора уитровением раствором соли агдамикин с электрометра ческой индикещией конечной точки ткгр6 вания, о т л и ч го щ и и с я тем, что, с целью упролзнйя ана-пиза н повышения- точности сгпредаченЕЯ фтора, титрование проводят в среде 6,CU6,5 м/л
сульфата аммония при рН раствора 2,5-3,5.
Источники информации, принятые во внимание при экспертизе
1. Международный стандарт ИСО, 1693-76, Криолит натуральный и искусственный.
2.Ж. Заводская лаб., Ms 5, 1976, с. 522.
3.Стенина Н. И., Лапшанова Н. С. Методы аналитического контроля и физи-
ко-химические исследования неорганических соединений, вып. 32. Свердловск, 1973 г., с. 50 (прототип).


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения фтора | 1978 |
|
SU828077A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПРОИЗВЕДЕНИЙ РАСТВОРИМОСТИ И ИОННЫХ ПРОИЗВЕДЕНИЙ МАЛОРАСТВОРИМЫХ СОЛЕЙ И КОМПЛЕКСНЫХ СОЕДИНЕНИЙ | 2002 |
|
RU2240555C2 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АСКОРБИНОВОЙ КИСЛОТЫ В ЛЕКАРСТВЕННЫХ СРЕДСТВАХ | 2018 |
|
RU2696865C1 |
| СПОСОБ РАЗДЕЛЬНОГО ОПРЕДЕЛЕНИЯ НИТРОФЕНОЛОВ В ВОДЕ | 1993 |
|
RU2047861C1 |
| Способ кулонометрического определения галогенидов | 1982 |
|
SU1057837A1 |
| Способ количественного определения @ -аланина | 1980 |
|
SU941898A1 |
| Способ определения витамина В @ | 1990 |
|
SU1755183A1 |
| Способ определения состава реагентного аммиачно-карбонатного раствора | 1991 |
|
SU1784910A1 |
| Способ потенциометрического определения фторидов | 1981 |
|
SU1054779A1 |
| Способ определения азотной кислоты и нитратов | 1976 |
|
SU658083A1 |

, 1{0з)з
Авторы
Даты
1980-05-05—Публикация
1977-06-21—Подача