(54)СПОСОБ КОМПЛЕКСОНОМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ ЖЕЛЕЗА ( HI )


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ количественного определения железа и кобальта в металлических порошках | 1990 |
|
SU1807387A1 |
| Способ извлечения скандия(III) для его последующего определения в системе, содержащей антипирин и сульфосалициловую кислоту | 2015 |
|
RU2645068C2 |
| Способ комплексонометрического определе-Ния МЕди(п) | 1979 |
|
SU833526A1 |
| Способ комплексонометрического определения циркония | 1980 |
|
SU893873A1 |
| Способ определения двух-и трехвалентного железа в присутствии железа металлического | 1980 |
|
SU899481A1 |
| Способ определения фтора | 1978 |
|
SU828077A1 |
| Способ определения общей обменной емкости глин | 1975 |
|
SU917076A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КАЛЬЦИЯ В ПРИСУТСТВИИ ФОСФАТ - ИОНОВ | 1991 |
|
RU2030744C1 |
| СПОСОБ ПОЛУЧЕНИЯ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ ОЛИГОГАЛАКТУРОНОВОЙ КИСЛОТЫ С БИОГЕННЫМИ МЕТАЛЛАМИ (II), КАК СИСТЕМ ДОСТАВКИ БИОГЕННЫХ МЕТАЛЛОВ (II) И СИСТЕМ ВЫВЕДЕНИЯ ТЯЖЕЛЫХ МЕТАЛЛОВ (II) | 2015 |
|
RU2599494C1 |
| Способ потенциометрического определения мо | 1976 |
|
SU693218A1 |

I
Изобретение относится к области аналитической химии, а именно к способам определения железа при анализе основного вещества в ванадийссдержащих объектах.
Известны и широко используются титриметрические способы определения железа в ванадийсодержащих объектах, основанные на окислительно-восстановительных реакциях
Их общим недостатком является нео холимо сть предвари тель н о го отделе и ия железа от ванадия.
К недостаткам данных способов следует .также отнести и необходи- мость удаления избытка восстановителя, используемого для предварительного восстановления Fe ( Ж ) кипячен ем, фильтрованием и другими операциями или добавлением сулемы (в случае использования в качестве восстановителя реакти за, относящегося к разряду ядовитых).
Наиболее близким по технической сущности и достигаемому результату является способ комплексонометрического титрования (рН определения 1-2, индикатор-сульфосалициловая кислота) . Определение железа в присутствии V (IV ) затруднено, так как ионы
. V (IV) подобно ионам Fe ( III ) частично связываются этилендиаминтетрауксусной кислотой (ЭДТА) при рН 1-2 2.
Б связи с этим для определения железа необходимо предварительное отделение V ( IV ) . Последнее осуществляется осаждением жеЛеза в виде гидроокиси. Для осаждения отбирают
0 100 мл сернокислого раствора, .прибавляют почти до нейтральной реакции едкий натр, нагревают до кипения и вливают раствор медленно и при постоянном перемешивании в 100 мл горячего свежеприготовленного 10%5ного раствора едкого натра. Кипятят смесь 2-3 мин, слегка перемешивая, дают осадку осесть и фильтруют через бумажный фильтр средней плотности
0 (фильтр предварительно промывают горячим 5%-ным раствором едкого натра, содержащим немного сульфата натрия, пока не получится 50 мл совершенно бесцветного фильтрата). Осадок про5мывают этим же промывным раствором, растворяют в серной кислоте, доводят рН раствора до значения 1-2, нагревсцот раствор до 45-50, добавляют несколько капель сульфосалициловой кислоты и титруют железо раствором
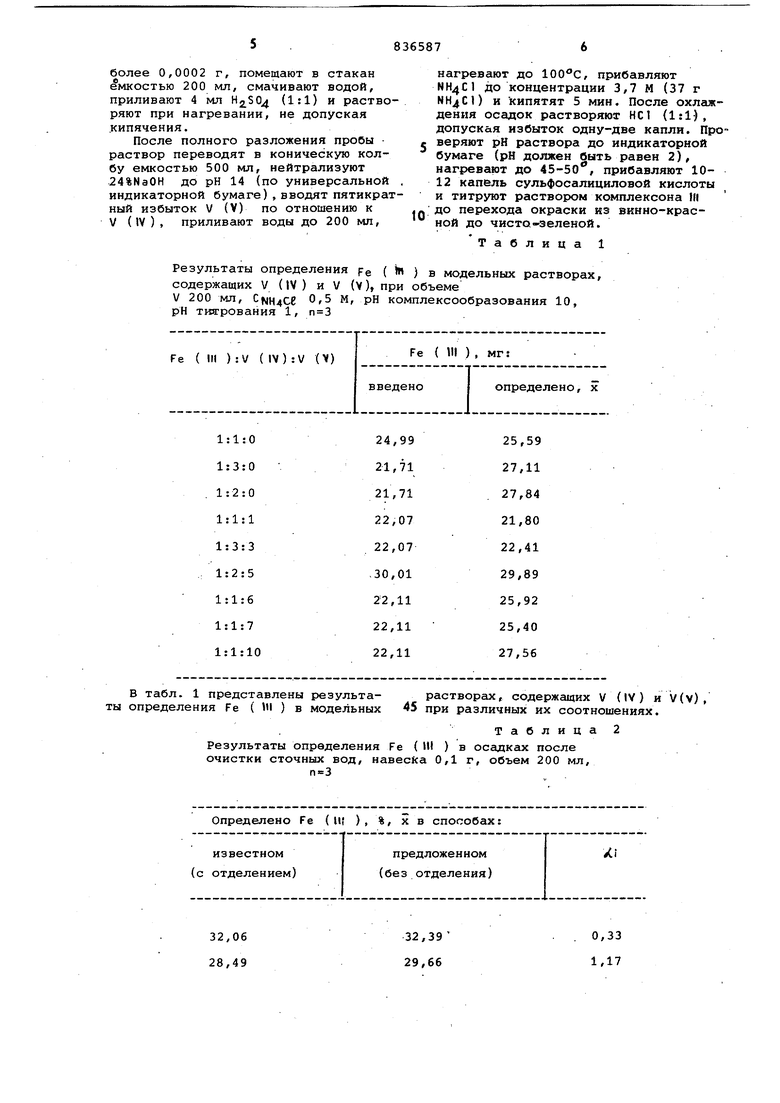
0 ЭДТА до перехода окраски из виннокрасной до чисто-зеленой. Существенным недостатком этого способа является невозможность титрования Fe ( III ) раствором ЭДТА в п сутствии V ( IV) и необходимость, пре .варительного отделения Fe ( HI ) от V (IVJ. К недостаткам данного способа можно также отнести длительность ан лиза и сложность определения (осажд ние, фильтрование, промывание, раст ворение) . Целью изобретения является упрощ ние и повышение точности определени Fe ( III ) в ванадийсодержащих матери лах за счет устранения мешающего вл яния ванадия {IV ). Поставленная цель достигается тем, что по способу определения Fe { 111 ) титрованием раствором ЭДТА при рН 1-2 в присутствии индикатора после связывания V(W) в инертный комплекс путем введения в раствор Г-5-кратного избытка V (v)no отношению к V ( IV) при рН 10-14 и 0,53,7 М раствора соли аммония. Раство с рН «10-14 вьвдерживают при 80 ЮОс в течение мин. Отличительными признаками изобретения являются; доведение рН анали зируемого раствора до 10-14, введение в раствор 1-5-кратного избытка V {V ) по отношению к V (V) , добавление в раствор при рН 10-14 соли аммония, например хлористого аммони . в пределах концентрации 0,5-3,7 М, кипячение раствора в течение 5 15 мин. При V (V) претерпевают изменения от катионной формы (VOj) ) до анионных полиформ ( и др. которые не вступают в реакцию с ион ми аммония и ванадия ( IV) . Результа ты определения Fe ( Я ) в модельных растворах в этих условиях завышены вследствие титрования раствором ЭДТ совместно с Fe ( 11 ) и V (W) . . При V (V) находится в раст воре в виде и при кипячении разлагается до метаванадат-иона в области рН 10-14 метаванадатион образует .с ионами и ванадия (IV ) устойчивый инертный комп, леке, устраняя таким образом влияние V (IV ) на титрование Fe ( III ) раствором ЭДТА при рН 1-2. Повышать рН раствора до значени превышающих 14, представлялось нецелесообразным из-за нерационально го расхода реагентов. При определении Fe ( III ) в присутствии менее однократного избытк V (v) по отношению к V (IV ) получ ны завышенные результаты титровани Fe (III ) . V (W) в данных условиях титруе ся совместно с Fe ( 1Н ) . Введение более пятикратного избыочного количества V (V) привело к олучению завышенных, плохо воспрозводимых результатов. Это вызвано мещением равновесия реакции взаимоействия V (V) с ЭДТА в сторону обазования комплекса. При добавлении в раствор (рН 1014) соли аммония в концентрации менее 0,5 М были .получены завышенные результаты определения Fe (ill ) в моельных растворах. В данных условиях V (IV) не связывается в инертный комплекс и титруется совместно с ионами Fe ( III ) при рН 1-2 раствором ЭДТА. Увеличение концентрации NHt до }k 3,7 М ведет к получению насыщенного относительно ионов NH. раствору. При кипячении раствора менее 5 мин получено завышение в результатах (введено 20 мг Fe, определено 23 мг). Это можно объяснить тем, что М0 не успевает разложиться до VOj-, в связи с чем не достигается полнота связывания V (W) в комплекс. V (V) титруется совместно с Fe (И1 ). Более чем 15-минутное кипячение приведет к увеличению длительности анализа. По предлагаемой методике были проанализированы пробы, полученные при очистке сточных вод. Пример 1. Определение Fe (III ) в осадках после очистки сточных вод от ванадия. 0,1000 г пробы, содержащей 2-5% V ( IV ) , взвешивают с погрешностью не более 0,0002 г, помещают в стакан емкостью 200 мл, смачивают водой, приливают 4 мл (1:1) и растворяют при нагревании, не допуская кипячения. После полного разложения пробы раствор переводят в коническую колбу емкостью 500 мл, нейтрализуют 24% NaOH до рН 10-(по универсальной индикаторной бумаге), вводят однократный избыток V (IV) по отношению к V (IV ), приливают воды до 200 мл, нагревают до 80°С, прибавляют МНлС до концентрации 0,5 М (5 г МНдСП и выдерживают при этой температуре 15 мин. После охлаждения осадок растворяют HCI (1:1), допуская избыток одну-две капли. Проверяют рН раствора по индикаторной бумаге (рН должен быть равен 2), нагревают до 4550, прибавляют 10-12 капель сульфосалициловой кислоты и титруют раствором комплексона Ж до перехода окраски из винно-красной до чистозеленой. Пример 2. Определение Fe ( HI )- в осадках (после очистки сточных вод от ванадия). 0,1000 г пробы, содержащей 2-5% V ( IV ), взвешивают с погрешностью не
более 0,0002 г, помещают в стакан ёмкостью 200 мл, смачивают водой, приливают 4 мл (1:1) и растворяют при нагревании, не допуская .кипячения.
После полного разложения пробы раствор переводят в коническую колбу емкостью 500 мл, нейтрализуют 24%NaOH до рН 14 (по универсальной индикаторной бумаге) , вводят пятикратный избыток V (V) по отношению к V (IV), приливают воды до 200 мл.
Результаты определения ре ( ) в модельных растворах, содержащих V (IV ) и V (V), при объеме V 200 мл, М, рН комплексообразования 10, рН титрования 1,
1:1:0 1:3:0 1:2:0 1:1:1 1:3:3 1:2:5 1:1:6 1:1:7 1:1:10 ты
Определено Fe ( U ), %, х в способах:
нагревают до 100°С, прибавляют NH4C1 до концентрации 3,7 М (37 г МНдС) и кипятят 5 мин. После охлаждения осадок растворяют НС1 (1;1-), допуская избыток одну-две капли. Проверяют рН раствора до индикаторной бумаге (рН должен быть равен 2), нагревают до 45-50 , прибавляют 1012 капель сульфосалициловой кислоты и титруют раствором комплексона 1(1 до перехода окраски из винно-красной до чисто-зеленой.
Таблица 1
25,59 27,11 27,84 21,80 22,41 29,89 25,92 25,40 27,56 В табл. 1 представлены результа- растворах, содержащих V (IV) и V(v), определения Fe ( 41 ) в модельных 45 при различных их соотношениях. Результаты определения Fe ( III ) в осадках после очистки сточных вод, навесКа 0,1 г, объем 200 мл, Таблица 2
.Определено Fe (III), %, х в способах:
Статическая обработка: S воспр. (1) 0,14; S воспр. (2) 0,13; t вычисл. В табл. 2 представлены результаты определения Fe ( HI ) иэвестньм и щ едложенным методами. Преимуществами предлагаемого способа являются .повышение точности определения железа в анализируемом объекте за.счет исключения операции отделения железа в виде гидроокиси по прототипу, так как при отделении возможны потери основного вещества и соосаждение примесей; упрощение условий определения ж елеза за счет исключения операций осаждения,фильт рования, промывания и растворения осадка и, как следствие, сокращение продолжительности анализа (с б до 1,5 ч). Формула изобретения 4.СПОСО6 комплексонометрического определения железа ( П1 ) в ванадийсодержащих образцах, включающий растворение их в серной кислоте и
Продолжение табл. 2 t 0,05 (4) 2,78 последующее титрование железа раствором этилендиаминтетрауксусной кислоты при рН 1-2 в присутствии индикатора, отличающийся тем, что, с целью упрощения и повышения точности определения за счет устранения мешающего влияния ванадия (W ), предварительно перед титрованием в раствор вводят 1-5-кратный избыток ванадия (V), по отношению к ванадию (W), при рН 10-14 и 0,5-3,7 м раствор соли аммония. 2. Способ по п. 1, о т л и -: чающийся тем, что раствор с рН 10-14 выдерживают при 80-100 с в течение 5-15 мин. Источники информации, принятые во внимание при экспертизе 1.Файнберг С.Ю. и Филиппова Н.А. Анализ руд цветных металлов. М., Научн.-техн.изд-во по черной металлургии, 1963, с. 414-430. 2.Шварцеабах Г. и Флашка Г. Комплексонометрическое титрование. М., Химия, 1970, с. 212 (прототип).
Авторы
Даты
1981-06-07—Публикация
1979-07-04—Подача