Изобретение относится к области медицины, а именно к клиническим диагностическим исследованиям, и предназначено для быстрого, надежного и безопасного определения глюкозы в различном материале: крови, моче, ликворе и т. п.
Наиболее точное и специфичное определение глюкозы в биоматериале осуществляется ферментативными методами.
В нашей стране такое исследование проводится с применением системы ферментов глюкозооксидаза-пероксидаза. Данный способ основан на окислении глюкозы глюкозооксидазой с выделением эквимолярного количества перекиси водорода, окисляющей субстрат (хромоген) в присутствии катализатора - пероксидазы с образованием окрашенного соединения. Интенсивность окраски пропорциональна количеству выделившейся перекиси водорода и, следовательно, концентрации глюкозы в исследуемом материале (Балаховский И. С. В сб. : Лабораторные методы исследования в клинике. Справочник. Под ред. В. В. Меньшикова. М. , Медицина, 1987 с. 232; Унифицированные методы лабораторных исследований. Лабораторное дело. 1976, N 6, стр. 373-374; Marka V. Clin. Chim. Acta, v. 4, N 3, p. 395-400; Saifer A. , Gersenfeld S. J. Lab. Clin. Med. , 1958, v. 51, p. 448). В качестве хромогенов использовались (в нашей стране применяются и поныне) высококанцерогенные соединения: орто-толидин и орто-дианизидин (Балаховский И. С. В сб. : Лабораторные методы исследования в клинике. Справочник. Под ред. В. В. Меньшикова. М. , Медицина, 1987, стр. 232. Канцерогенные вещества. Справочник. Под ред. В. С. Турусова. Пер. с англ. М. , Медицина, 1987, с. 22,26; Колб В. Т. , Камышников В. С. Справочник по клинической химии. Изд. 2-е, Минск, Белорусь, 1982, с. 172-174; IARC Monographs on the evaluation of carcimogenic risks to humans. Suppl. 7, IARC, Lyon, 1987 p. 62, 120).
В настоящее время известен хромоген, состоящий из 4-аминоантипирина (4ААП) и фенола или производных фенола (Инструкция по применению унифицированных клинических лабораторных методов исследования. М. , 1986, п. 2.8, с. 87-91; Hallmann l. Klinische Chemie und Mikroskopie, 11 Afl, GEORG THIME VERL, Stuttgart, New York, 1980, S. 239; Pter G. Lehrbuch der Klinischen Chemie, 3 Aufl, Ed. Medizin, Weinheim, Deerfield Beach, Florida, Basel. 1982, S. 171-172). Данный хромоген вводит в состав наборов для определения глюкозы в биоматериале, выпускаемых фирмами Lachema (ЧСФР), Labsystem (Финляндия) и др.
Известно, что 4-аминоантипирин взаимодействует не только с фенолами (их производными), но и с ароматическими аминами. При этом возможно образование окрашенных соединений )Eisenstaedt E. J. Org. Chem. , 1938, 3,2, 153-165).
Однако попытки использования 4ААП и алкилированного анилина не нашли практического применения из-за недостаточно стабильной кинетики реакции, повышенной летучести и окисляемости (Изобретения стран мира. 1987 МКИ G 01 K, N, вып. 108, N 6, с. 88, заявка Японии N 61-29462В; там же 1989. МКИ G 01 K, N, вып. 108, N 11, с. 91, заявка Японии N 63-37904. Kabasakalian P. et al. , Clin. Chem. , 1974, v. 20, N 5, 606-607; Saito Y. et al. , Chem. Pharm. Bull. , 1987. v. 35, N 2, 869-872).
В 1979-1981 г. г. была показана возможность взаимодействия амидопирина и ароматических аминов (Иоганнсен М. Г. , А. с. СССР на изобретение N 885881, 1981). Реакция окисления перекисью водорода смеси амидопирин - солянокислый анилин при пероксидазном или пероксидазоподобном (напр. гемоглобином) катализе отличается интенсивным образованием красителя, высокой стабильностью, чувствительностью при индикации, например, гемоглобина (Иоганнсен М. Г. , Лаб. дело, 1982, N 10, 21(597)-24(600); Гигиена и санитария, 1985, N 5, 75-77). Эти свойства реакции создают предпосылки для разработки определения глюкозы в биологических жидкостях глюкозооксидазным методом. Такой реактив должен обладать высокой чувствительностью, стабильностью развивающейся окраски, быть простым в приготовлении и использовании и безопасным в обращении. Реакция должна протекать в стабилизирующей (буферной) системе, отличной от других систем, применяющихся для определения глюкозы, поскольку реакционная смесь содержит оригинальный хромоген, отличающийся от известных, состоящих из 4ААП и фенолов или алкилированных анилинов.
Наиболее близким к предложенному решению из практически применяющихся для определения глюкозы реактивов является комбинация 4-аминоантипирина и фенола (см. Инструкцию по применению унифицированных клинических лабораторных методов исследования. М. , 1986, п. 2.8. , стр. 87-91). Реактив содержит 0,015 мас. % глюкозооксидазы, 0,001 мас. % пероксидазы, 0,015 мас. % 4ААП и 0,1 мас. % фенола в 0,1 М фосфатном буфере рН 7,0. Работа по данному способу требует обязательного термостатирования при 37оС.
Недостатки этого метода заключаются в необходимости контакта с фенолом, оказывающим прижигающее и токсическое действие, а также в относительном значительном влиянии времени и температуры на развивающуюся окраску. Последние обстоятельства требуют проведения реакции в узком интервале времени и термостатирования. Это создает определенные неудобства при одновременной обработке многих проб, что является обычным для рядовых биохимических лабораторий.
Целью изобретения является достижение высокой стабильности, надежности (правильности) результатов при безопасности в обращении и простоте использования.
Поставленная цель может быть достигнута применением реактива следующего состава, мас. % : глюкозооксидазы 0,007-0,009 пероксидазы 0,0008-0,002 амидопирина 0,045-0,055 анилина гидрохлорида 0,0005-0,002 гидроксиламина гидро- хлорида 0,00007-0,00008 этанола 95% 0,4-0,5 в фосфатном буфере 0,1-0,2 М, рН 5,8-6,2
Реактив готовится следующим образом.
Фосфатный буфер. Состоит из 0,1-0,2 М растворов одно- и двузамещенных фосфатов натрия или калия. При приготовлении учитывается кристаллизационная вода, входящая в состав молекул. рН 5,8-6,2 проверяется на рН-метре.
Ферментный раствор. Готовится растворением 8 мг глюкозооксидазы (активность 70-90 ед/мг) и 1 мг пероксидазы (активность 350 ед/мг) в 100 мл приготовленного ранее фосфатного буфера.
Хромоген (субстрат, образующий краситель). Представляет собой раствор, содержащий 10% амидопиридина и 0,2% солянокислого анилина в 95% этаноле, стабилизированный 1,5% водным раствором солянокислого гидроксиламина в соотношении хромоген: стабилизатор - 10: 1
Реактив для определения глюкозы содержит 0,5 мл хромогена в 100 мл ферментного раствора.
Методика определения глюкозы заключается в депротеинизации биологического материала 3% трихлоруксусной кислоты - ТХУ (0,1 мл материала и 0,9 мл ТХУ). После центрифугирования 10 мин при 1500-3000 об/мин (фактор разделения 1000-2000) 0,5 мл надосадочной жидкости смешивают с 4,5 мл хромогена и через 10-70 мин производят фотометрию при длине световой волны 540 нм, толщине слоя (кюветы) 10 мм против контрольного раствора, содержащего хромоген или дистиллированную воду. Инкубацию проб до фотометрии можно проводить при 18-25оС (комнатной температуре) или при 37оС.
Расчет концентрации глюкозы производится по известной формуле
Cоп= Cст× 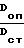 , где Соп - концентрация глюкозы в исследуемой (опытной) пробе;
, где Соп - концентрация глюкозы в исследуемой (опытной) пробе;
Сст - концентрация глюкозы в калибровочном (стандартном) растворе глюкозы известной концентрации;
Dоп - оптическая плотность исследуемой (опытной) пробы;
Dст - оптическая плотность калибровочного (стандартного) раствора глюкозы.
Предлагаемое решение отличается от известных наличием ранее никогда неприменявшихся для определения глюкозы реактивов - амидопирина и солянокислого анилина.
Таким образом, предлагаемое решение соответствует критерию изобретения "новизна".
Сопоставительный анализ предлагаемого решения с прототипом выявляет следующие особенности:
В качестве хромогена используются амидопирин и солянокислый анилин. В прототипе для этой цели - аминоантипирин и фенол.
При этом количество второго компонента хромогена в заявленном решении - анилина составляет 0,001 мас. % , а в прототипе в 100 раз больше - 0,1 мас. % .
Концентрация фермента глюкозооксидазы составляет 0,008 мас. % . В прототипе в 2 раза больше - 0,015 мас. % , что может иметь значение при широком использовании, т. к. глюкозооксидаза - наиболее дорогостоящий из входящих в состав реактива компонентов.
Наличие стабилизатора (гидроксиламина) в субстрате, образующем краситель, позволяет сохранять этот субстрат в течение года всегда готовым к употреблению.
Субстратная смесь в прототипе может храниться в течение нескольких месяцев только в сухом виде.
Оптимальные результаты проведения реакции по заявленному решению получаются при рН 6,0.
Оптимальные результаты работы прототипа получаются при кислотности в 10 раз меньше - рН 7,0ю
Изложенное позволяет сделать вывод о том, что заявленное решение соответствует критерию "существенные отличия".
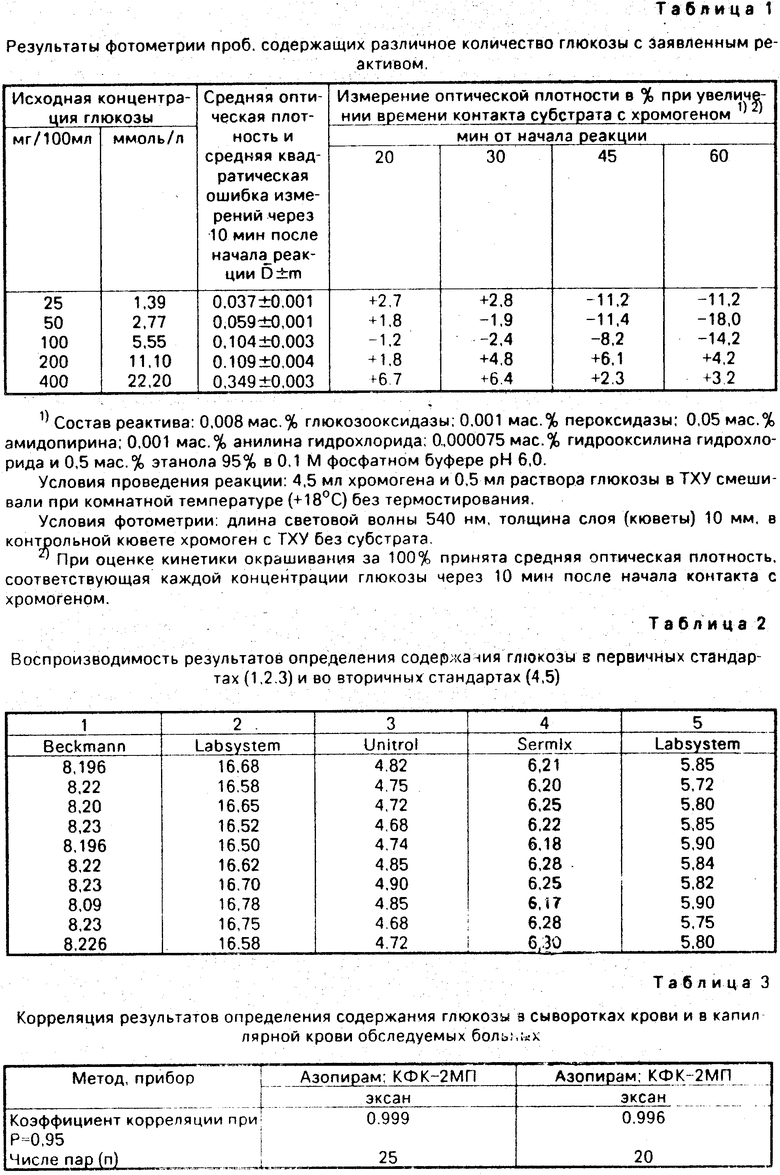
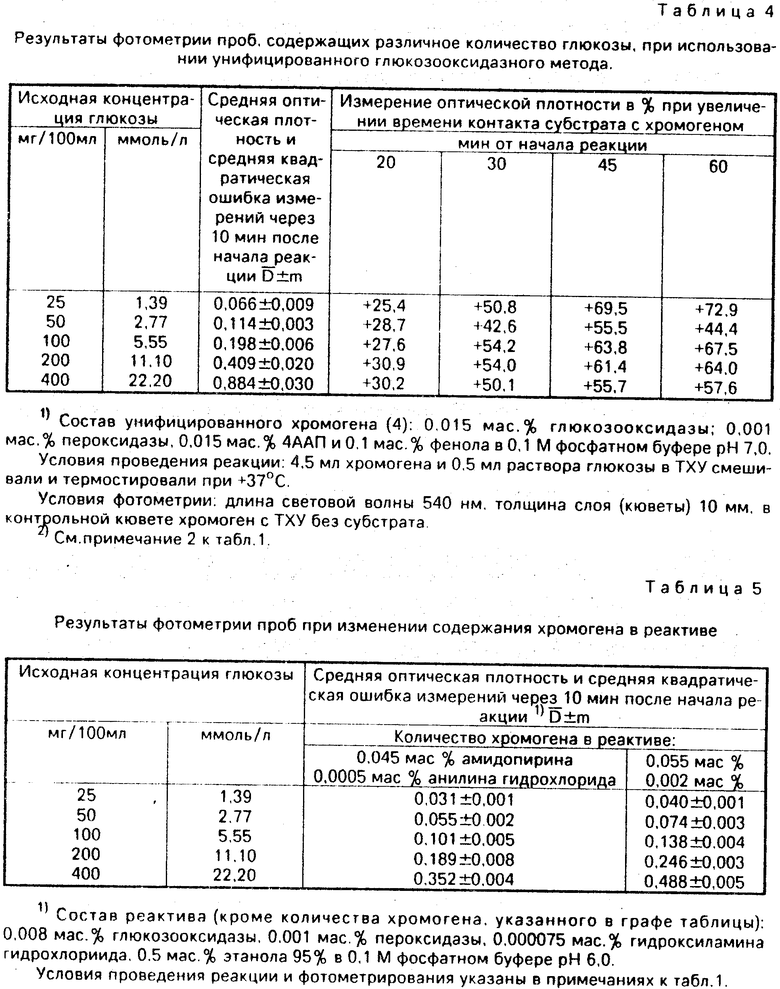
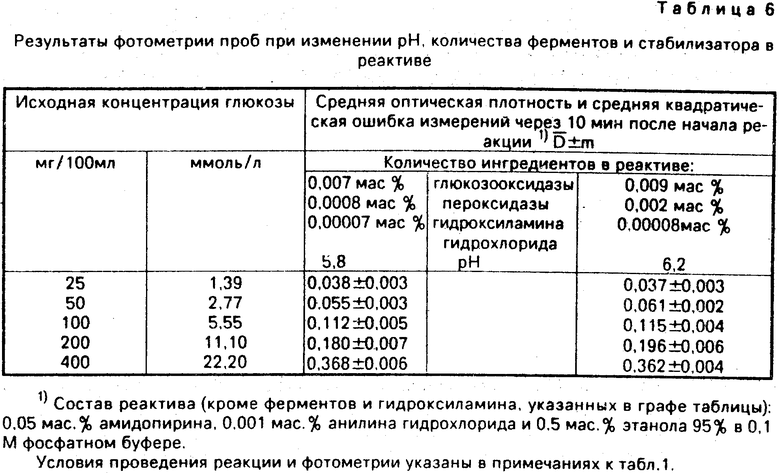
С помощью реактива проведено не менее 600 исследований содержания глюкозы в различных пробах: первичных стандартах - водных растворах, вторичных стандартах - сыворотках, в капиллярной крови больных. Не менее 150 исследований проведено унифицированными глюкозооксидазными методами для сопоставления. Результаты сведены в табл. 1-6.
Сравнительные результаты определения глюкозы с заявленным и унифицированным реактивами (табл. 1 и 4) свидетельствуют о лучшей воспроизводимости при использовании заявленного реактива.
Примеры использования заявленного реактива с граничными концентрациями компонентов представлены в табл. 5 и 6.
Анализ табл. 5 и 6 показывает, что изменения концентраций основных ингредиентов в пределах, обозначенных в настоящей заявке, мало влияют на интенсивность окрашивания. При этом некоторое изменение оптической плотности связано лишь с колебаниями концентраций хромогена (см. табл. 1 и 6). Тем не менее, определение количества глюкозы может производиться с достаточной точностью и при граничных концентрациях хромогена. Изменения количества ферментов, стабилизатора (гидроксиламина гидрохлорида), а также рН реактива в пределах, указанных в заявке, практически не влияют на образование красителя в реакции (табл. 6).
Таким образом, применение предлагаемого реактива дает следующие преимущества:
Длительный период (30-70 мин от начала реакции) постоянного значения оптической плотности при определении глюкозы в биоматериале в широком диапазоне концентраций, что существенно облегчает работу лаборантов.
Возможность проведения анализов в широком температурном диапазоне (от +18о до +37о).
Возможность экспресс-диагностики в течении 5 мин и точного количественного определения содержания глюкозы в биоматериале.
Практическую безопасность при приготовлении и использовании реагентов (в отличие от фенола, о-толидина, о-дианизидина). (56) Инструкция по применению унифицированных клинических лабораторных методов исследования. М. , 1986, с. 87-91.
| название | год | авторы | номер документа |
|---|---|---|---|
| Реагент для определения концентрации глюкозы в сыворотке крови | 1990 |
|
SU1776692A1 |
| ТЕСТ-ПОЛОСКА ДЛЯ ОПРЕДЕЛЕНИЯ ГЛЮКОЗЫ | 1998 |
|
RU2194278C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГАЛАКТОЗЫ В СЫВОРОТКЕ КРОВИ | 1995 |
|
RU2101705C1 |
| СПОСОБ ДЕПРОТЕИНИЗАЦИИ ЦЕЛЬНОЙ КАПИЛЛЯРНОЙ КРОВИ ПРИ ФЕРМЕНТАТИВНОМ ОПРЕДЕЛЕНИИ ГЛЮКОЗЫ | 1990 |
|
RU2018836C1 |
| ОПТИЧЕСКИЙ КАРТРИДЖ | 2012 |
|
RU2496104C1 |
| СПОСОБ ПОЛУЧЕНИЯ СМЕСЕЙ, ИМИТИРУЮЩИХ НОРМАЛЬНУЮ И ПАТОЛОГИЧЕСКУЮ МОЧУ ЧЕЛОВЕКА, ПРИМЕНЯЕМЫХ ДЛЯ ОБУЧЕНИЯ СТУДЕНТОВ ГЛЮКОЗООКСИДАЗНОМУ МЕТОДУ ОПРЕДЕЛЕНИЯ ГЛЮКОЗЫ В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ | 2018 |
|
RU2688922C1 |
| УНИВЕРСАЛЬНАЯ ТЕСТ-ПОЛОСКА ДЛЯ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ ГЛЮКОЗЫ В МОЧЕ, КРОВИ И ДРУГИХ БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ | 1991 |
|
RU2012878C1 |
| АНАЛИТИЧЕСКИЙ ЭЛЕМЕНТ ДЛЯ ОПРЕДЕЛЕНИЯ ГЛЮКОЗЫ В КРОВИ | 1992 |
|
RU2042947C1 |
| НАБОР ДЛЯ ФЕРМЕНТНОГО АНАЛИЗА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1998 |
|
RU2123701C1 |
| Способ определения глюкозы в биологических жидкостях | 1984 |
|
SU1505444A3 |
Использование: медицина, биохимические диагностические исследования, определение глюкозы в биологических жидкостях. Целью изобретения является повышение стабильности реактива, упрощение и ускорение определения глюкозы. Сущность изобретения: диагностический реактив включает в себя в качестве хромогена амидопирин и солянокислый анилин, стабилизатор реактивов гидроксиламин, а также ферменты глюкозооксидазу и пероксидазу в фосфатном буфере. Применение реактива позволяет проводить исследования в широком диапазоне температур (от +18 до +37С). При этом колебания оптической плотности очень незначительны в течение длительного времени (до 70 мин от начала реакции). Реактив обеспечивает возможность как быстрой качественной экспресс-диагностики в течение 5 мин, так и последующего точного количественного определения глюкозы в биоматериале. Количество глюкозооксидазы может быть уменьшено вдвое по сравнению с ранее применявшимися методами. Приготовление и использование реактивов практически безопасно. 6 табл.
РЕАКТИВ ДЛЯ ОПРЕДЕЛЕНИЯ ГЛЮКОЗЫ В БИОЛОГИЧЕСКОЙ ЖИДКОСТИ, содержащий глюкозоксидазу, пероксидазу, фосфорный буфер и хромоген, отличающийся тем, что, с целью повышения стабильности реактива, упрощения и ускорения определения глюкозы, реактив в качестве хромогена содержит раствор амидопирина и солянокислого анилина в этаноле, стабилизированный раствором солянокислого гидроксиламина, взятых в соотношении хромоген: стабилизатор 10 : 1, при следующем соотношении компонентов в реактиве, мас. % :
Амидопирин 0,045 - 0,55
Анилин гидрохлорид 0,0005 - 0,002
Гидроксиламин гидрохлорид 0,00007 - 0,00008
Глюкозооксидаза с активностью 70 - 80 ед/мг 0,007 - 0,009
Пероксидаза с активностью 300 - 400 ед/мг 0,0008 - 0,002
Этанол 95% 0,4 - 0,5
Фосфатный буфер 0,1 - 0,2 М рН 5,8 - 62 До 100%
Авторы
Даты
1994-03-15—Публикация
1991-06-27—Подача