Изобретение относится к способам получения новых цефемовых производных, пригодных в качестве антибактериальных агентов, точнее к способу получения 3-пропенилцефемовых производных.
Известен способ получения производных 3-проценилцефема общей формулы 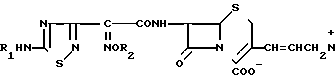

 где R1 - водород или аминозащитная группа; R2 - водород, прямая или разветвленная алкильная группа С1-С4, циклоалкил или циклоалкенил, N+= Q - четвертичная аммониевая группа, предпочтительно замещенная пиридиниогруппа или их фармакологически приемлемых солей, обладающих антибактериальной активностью, заключающийся во взаимодействии соединений формулы H2N
где R1 - водород или аминозащитная группа; R2 - водород, прямая или разветвленная алкильная группа С1-С4, циклоалкил или циклоалкенил, N+= Q - четвертичная аммониевая группа, предпочтительно замещенная пиридиниогруппа или их фармакологически приемлемых солей, обладающих антибактериальной активностью, заключающийся во взаимодействии соединений формулы H2N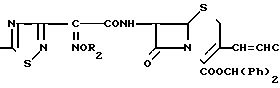 H2J с третичным амином Q= N с последующим удалением защитной группы и выделением целевых соединений (1).
H2J с третичным амином Q= N с последующим удалением защитной группы и выделением целевых соединений (1).
Целью изобретения является получение новых цефемовых соединений, имеющих аммониопропенильную группу в положении 3 и фторзамещенную низшую алкоксииминогруппу или цианозамещенную низшую алкоксииминогруппу в боковой цепи в положении 7, обладающих высокой антибактериальной активностью.
Поставленная цель достигается предлагаемым способом получения производных 3-пропенилцефема общей формулы I H2N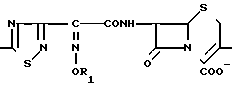 CH= CHCH2A где, когда R1 представляет собой группу CH2F, то A является ациклической аммониевой группой следующей формулы
CH= CHCH2A где, когда R1 представляет собой группу CH2F, то A является ациклической аммониевой группой следующей формулы 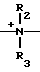 R4 в которой R2, R3, R4 являются одинаковыми или разными и независимо друг от друга представляют собой группу, выбранную из ряда, содержащего низшую алкильную группу, гидроксилзамещенную низшую алкильную группу, карбамоилзамещенную низшую алкильную группу, аминогруппу, (низший алкил) аминокарбонилзамещенную низшую алкильную группу, цианозамещенную низшую алкильную группу гидроксил- и карбамоилзамещенную низшую алкильную группу, гидроксил и гидрокси (низший алкил) аминокарбонилзамещенную низшую алкильную группу, гидроксиаминокарбонилзамещенную низшую алкильную группу, карбомоил (низший алкил) аминокарбонилзамещенную низшую алкильную группу, гидрокси (низший алкил) аминокарбонилзамещенную низшую алкильную группу, аминозамещенную низшую алкильную группу, ди(низший алкил) аминозамещенную низшую алкильную, ди(низший алкил) амино- и гидроксилзамещенную низшую алкильную группу, уреидогруппу, оксозамещенную низшую алкильную группу, (низший алкил) оксизамещенную низшую алкильную группу, ди(низший алкил)аминокарбонилзамещенную низшую алкильную группу, дикарбамоилзамещенную низшую алкильную группу, низшую алкильную группу, замещенную бис(гидрокси (низший алкил)/ аминокарбонильной группой, дигидроксилзамещенную низшую алкильную группу, тригидроксилзамещенную низшую алкильную группу и низшую алкильную группу, замещенную пиразолилом, или имидазолилом или оксадиазолилом или тетрализолилом, или A представляет собой циклическую аммониевую группу, выбранную из групп следующих формул
R4 в которой R2, R3, R4 являются одинаковыми или разными и независимо друг от друга представляют собой группу, выбранную из ряда, содержащего низшую алкильную группу, гидроксилзамещенную низшую алкильную группу, карбамоилзамещенную низшую алкильную группу, аминогруппу, (низший алкил) аминокарбонилзамещенную низшую алкильную группу, цианозамещенную низшую алкильную группу гидроксил- и карбамоилзамещенную низшую алкильную группу, гидроксил и гидрокси (низший алкил) аминокарбонилзамещенную низшую алкильную группу, гидроксиаминокарбонилзамещенную низшую алкильную группу, карбомоил (низший алкил) аминокарбонилзамещенную низшую алкильную группу, гидрокси (низший алкил) аминокарбонилзамещенную низшую алкильную группу, аминозамещенную низшую алкильную группу, ди(низший алкил) аминозамещенную низшую алкильную, ди(низший алкил) амино- и гидроксилзамещенную низшую алкильную группу, уреидогруппу, оксозамещенную низшую алкильную группу, (низший алкил) оксизамещенную низшую алкильную группу, ди(низший алкил)аминокарбонилзамещенную низшую алкильную группу, дикарбамоилзамещенную низшую алкильную группу, низшую алкильную группу, замещенную бис(гидрокси (низший алкил)/ аминокарбонильной группой, дигидроксилзамещенную низшую алкильную группу, тригидроксилзамещенную низшую алкильную группу и низшую алкильную группу, замещенную пиразолилом, или имидазолилом или оксадиазолилом или тетрализолилом, или A представляет собой циклическую аммониевую группу, выбранную из групп следующих формул 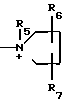
 N__R9
N__R9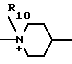 R11
R11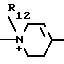 R13
R13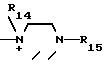
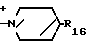
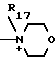
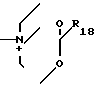

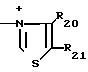

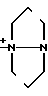
 N
N N
N 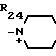 S
S
 где R5 представляет собой низший алкил, карбомоилзамещенный низший алкил, цианозамещенный низший алкил, гидроксилзамещенный низший алкил, аминозамещенный низший алкил, дигидроксилзамещенный низший алкил;
где R5 представляет собой низший алкил, карбомоилзамещенный низший алкил, цианозамещенный низший алкил, гидроксилзамещенный низший алкил, аминозамещенный низший алкил, дигидроксилзамещенный низший алкил;
R6 и R7 независимо друг от друга представляют собой водород, гидроксил, гидроксилзамещенный низший алкил;
R8 - низший алкил, карбомоилзамещенный низший алкил, гидроксилзамещенный низший алкил, уреидозамещенный низший алкил, дигидроксилзамещенный низший алкил;
R9 - водород, гидроксилзамещенный низший алкил, сульфогруппа, формил, карбамоил, сульфамоил, аминозамещенный низший алкил;
R10 - низший алкил, гидроксилзамещенный низший алкил, карбамоилзамещенный низший алкил;
R11 - карбамоил, гидроксил;
R12 - гидроксилзамещенный низший алкил;
R13 - карбамоил, гидроксииминозамещенный низший алкил;
R14 - низший алкил, гидроксилзамещенный низший алкил;
R15 и R16 - карбамоил;
R17 - карбамоилзамещенный низший алкил, уреидозамещенный низший алкил, гидроксилзамещенный низший алкил, дигидроксилзамещенный низший алкил;
R18 - низший алкил;
R19 - карбамоил, аминогруппа, карбоксил, карбамоилзамещенный низший алкил, карбоксилзамещенный низший алкил, морфолинокарбонил, гидрокси(низший алкил) аминокарбонил, бис[гидрокси(низший алкил)] аминокарбонил, сульфогруппа;
R20 - низший алкил;
R21 - гидроксилзамещенный низший алкил;
R22, R23, R24, R25, R26 и R27 - низший алкил, или когда R1представляет собой группу CH2CN, то A представляет собой ациклическую аммониевую группу, вышеприведенной формулы, в которой R2, R3 и R4представляют собой независимо друг от друга низшую алкильную группу, гидроксилзамещенную низшую алкильную группу, гидроксил- и карбамоилзамещенную низшую алкильную группу, карбамоилзамещенную низшую алкильную группу, оксозамещенную низшую алкильную группу и низшую алкильную группу, замещенную оксадиазолилом, или A представляет собой циклическую аммониевую группу одной из следующих формул 
 N__R9
N__R9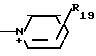


 в которых R5, R8, R22 и R23 означают низший алкил; R6 - гидроксил, R7 - гидроксилзамещенный низший алкил; R9 - сульфамоил; R19 - карбамоил или, когда R1 представляет собой группу CHF2, то A представляет собой ациклическую аммониевую приведенной формулы, в которой R2, R3 и R4независимо друг от друга представляют собой низший алкил, гидроксилзамещенный низший алкил, карбамоилзамещенный низший алкил, или A представляет собой циклическую аммониевую группу одной из следующих формул
в которых R5, R8, R22 и R23 означают низший алкил; R6 - гидроксил, R7 - гидроксилзамещенный низший алкил; R9 - сульфамоил; R19 - карбамоил или, когда R1 представляет собой группу CHF2, то A представляет собой ациклическую аммониевую приведенной формулы, в которой R2, R3 и R4независимо друг от друга представляют собой низший алкил, гидроксилзамещенный низший алкил, карбамоилзамещенный низший алкил, или A представляет собой циклическую аммониевую группу одной из следующих формул 
 или когда R1 преставляет собой группу CH2CF3, то A представляет собой ациклическую аммониевую группу вышеприведенной формулы, в которой R2 и R3 означают низший алкил; R4 - карбамоилзамещенный низший алкил, или их фармакологически приемлемых солей, заключающимся в том, что соединение общей формулы II
или когда R1 преставляет собой группу CH2CF3, то A представляет собой ациклическую аммониевую группу вышеприведенной формулы, в которой R2 и R3 означают низший алкил; R4 - карбамоилзамещенный низший алкил, или их фармакологически приемлемых солей, заключающимся в том, что соединение общей формулы II 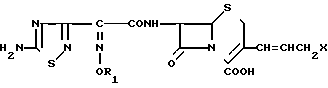 в которой R1 представляет собой группу CH2F или CH2CN или CHF2 или CH2CF3; X представляет собой атом галогена, а амино и/или карбоксильная группа, защищены защитными группами, или его соль подвергают взаимодействию с амином, соответствующим A, в котором функциональные группы защищены защитными группами, или его солью с последующим удалением защитных групп и выделением целевого продукта в свободном виде или в виде фармакологически приемлемой соли.
в которой R1 представляет собой группу CH2F или CH2CN или CHF2 или CH2CF3; X представляет собой атом галогена, а амино и/или карбоксильная группа, защищены защитными группами, или его соль подвергают взаимодействию с амином, соответствующим A, в котором функциональные группы защищены защитными группами, или его солью с последующим удалением защитных групп и выделением целевого продукта в свободном виде или в виде фармакологически приемлемой соли.
В качестве нетоксичных солей соединений формулы I можно упомянуть их фармацевтически приемлемые соли, например, соли щелочных металлов, таких как натрий и калий; аммониевые соли, четвертичные аммониевые соли, такие как тетраэтиламмониевая соль и соли бетаина, соли щелочноземельных металлов, таких как кальций и магний, неорганические кислотные соли, такие как гидрохлориды, гидробромиды, гидроиодиды, сульфаты, карбонаты и бикарбонаты, соли органических кислот, например, ацетаты, малеаты, лактаты и тартраты, органические сульфонаты, например, метансульфонаты, оксиметансульфонаты, оксиэтансульфонаты, тауриновые соли, бензолсульфонаты и толуолсульфонаты, аминокислотные соли, например, соли аргинина, лизина, серина, аспаргиновой и глутаминовой кислот, соли аминов, например, триметиламина, триэтиламина, пиридина, прокаина, пиколина, дициклогексиламина, N, N'-дибензилэтиламина, N-метилглюкамина, диэтаноламина, триэтаноламина, трис(оксиметиламино)метана и фенетилбензиламина и пр.
Каждое из соединений формулы I по данному изобретению может являться син-изомером (Z) или антиизомером (E) в зависимости от стереоконфигурации следующего фрагмента: 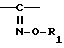 Хотя оба изомера входят в данное изобретение, однако желателен син-изомер из-за его антибактериальной активности.
Хотя оба изомера входят в данное изобретение, однако желателен син-изомер из-за его антибактериальной активности.
Примерами атома галогена X в формуле II служат атомы иода, брома и хлора.
Указанную реакцию можно проводить при -10 до 60оС, предпочтительно при 0-40оС. В качестве растворителя желательно использовать безводный органический растворитель. В качестве подходящих органических растворителей можно указать низшие алкилнитрилы, такие как ацетонитрил и пропионитрил, галогенированные низшие алканы, такие как хлорметан, дихлорметан и хлороформ, простые эфиры, например тетрагидрофуран, диоксан и диэтиловый эфир, такие амиды, как диметилформамид, такие сложные эфиры, как этилацетат, такие кетоны, как ацетон, углеводороды, например, бензол, такие спирты, как метанол и этанол, и сульфоксиды, такие как диметилсульфоксид, а также смешенные растворители.
Удаление защитной группы (групп) можно проводить известными способами в зависимости от типа защитной группы (групп), например, гидролизом или восстановлением.
Можно также использовать обычные соли соединений формул II и аминов и защитные группы для этих соединений, не мешающие описанной реакции.
Примерами защитных групп для аминогруппы могут являться формил, ацетил, хлорацетил, дихлорацетил, фенацетил, тиенил, ацетил, трет-бутоксикарбонил, бензилоксикарбонил, тритил, п-метоксибензил, дифенилметилбензилиденовая группа, п-нитробензилиденовая группа, м-хлорбензилиденовая группа. Как примеры защитных групп для карбокси-группы можно указать п-метоксибензил, п-нитробензил, трет-бутил, метил, 2,2,2-трихлорэтил, дифенилметил, пивалоилоксиметил. Здесь удобно использовать силилирующий агент, такой как N, O-бис(триметилсилил)ацетамид, N-метил-N-(триметилсилил)ацетамид, N-метил-N-(триметилсилил)трифторацетамид или N-(триметилсилил)ацетамид, так как силилирующий агент может защищать одновременно как аминогруппу, так и карбоксильную группу.
Подходящими солями соединений формулы II и амина A являются соли щелочных металлов, например натрия и калия, соли щелочно-земельных металлов, такие как кальций и магний, соли аммония, четвертичные аммониевые соли, такие как соли триэтиламмония и бетаина, соли неорганических кислот, например гидрохлориды, гидробромиды, сульфаты, карбонаты, гидроиодиды и бикарбонаты, соли органических кислот, например ацетаты, трифторацетаты, малеаты, лактаты и тартраты, органические сульфонаты, такие как метансульфонаты, оксиметасульфонаты, оксиэтансульфонаты, тауриновые соли, бензолсульфонаты и толуолсульфонаты, соли аминов, например триметиламина, триэтиламина, пиридина, прокаина, пиколина, дициклогексиламина, N, N-дибензилэтилендиамина, N-метилглюкамина, диэтаноламина, триэтаноламина, трис(оксиметиламина)метана и фенэтилбензиламина, аминокислотные соли, например, соли арганина, аспаргиновой кислоты, лизина, глутаматы, соли серина и глицина и т. д.
Получаемые соединения формулы I обладают сильной антибактериальной активностью по отношению к грамположительным и грамотрицательным бактериям и пригодны как антибактериальные агенты. Соединения используют для лечения заболеваний, вызываемых бактериями.
При использовании соединений формулы I в форме инъекций их можно вводить, как правило, в ежедневной дозе 0,1-10 г порциями от 1 до 4 внутривенно или внутримышечно. Естественно, что доза может увеличиваться или уменьшаться в зависимости от возраста и состояния пациента.
Инъекционные формы можно изготавливать известными способами. Например, каждое соединение, полученное по изобретению, можно получать в форме инъекции растворением его в дистиллированной воде, при необходимости в присутствии изотонического агента, солюбилизатора и/или т. п. Единичная доза может содержаться в форме порошка в ампуле и т. п. , т. е. в форме, требующей растворения перед применением. Эти инъекционные формы растворяют в дистиллированной воде для инъекций, в физиологическом растворе, глюкозной инъекции, аминокислотном инфузионном растворе и т. п. перед введением.
Исходные соединения формулы II, которые являются новыми соединениями получают взаимодействием соединения формулы IV H2N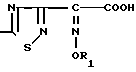 где R1 имеет значения, определенные выше, его реакционноспособного производного соединения, в котором аминогруппа защищена защитной группой или соли соединения с соединением следующей формулы V
где R1 имеет значения, определенные выше, его реакционноспособного производного соединения, в котором аминогруппа защищена защитной группой или соли соединения с соединением следующей формулы V  где X определен выше, или соединения, где карбокси-группа защищена защитной группой, или с его солью, с последующим необязательным удалением защитной группы и/или превращением атома галогена X в атом другого галогена.
где X определен выше, или соединения, где карбокси-группа защищена защитной группой, или с его солью, с последующим необязательным удалением защитной группы и/или превращением атома галогена X в атом другого галогена.
Указанную реакцию можно проводить в обычных реакционных условиях для N-ацилирования. Например, реакцию можно проводить при температуре от -50 до 50оС в инертном растворителе, например, в тетрагидрофуране, этилацетате, ацетоне, N, N-диметилформамиде, ацетонитриле, диоксане или в их смеси.
Примерами реакционноспособных производных кислоты формулы IV могут служить галоиденгидриды, например хлорангидрид, борангидрид и т. п. , симметричные ангидриды, смешанные ангидриды и активированные эфиры, амиды кислот и т. п.
Если в реакции используют свободную кислоту формулы IV или ее соль, то реакцию предпочтительно проводить в присутствии обычного агента конденсации, такого как N, N-дициклогексилкарбодиимид, п-толуолсульфокислота и т. п.
Превращение атома галогена X в другой атом галогена проводят обычным образом. Например, можно получить соединение формулы II, где X является атомом йода, вводя соединение формулы II, где X является атомом хлора, в реакцию с иодидом щелочного металла.
Промежуточные соединения получают способом, указанным на приведенной схеме.
Соединение формулы VII можно получить взаимодействием соединения формулы VI с гелогенфторметаном в инертном растворителе.
Примерами галогенфторметана являются бромфторметан, иодфторметан и т. п.
Реакцию проводят при температуре от -30 до 100оС.
Соединение формулы III можно получать взаимодействием соединений формулы VII с дегидратирующим агентом и в инертном растворителе. Реакцию предпочтительно проводить при комнатной температре и выше. Дегидратирующим агентом может служить оксихлорид фосфора, тионилхлорид и т. п. 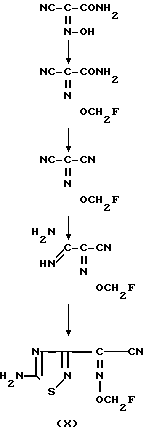

Соединение формулы IX можно получить взаимодействием соединения формулы VIII с аммиаком и/или солью аммония в инертном растворителе, таком как вода, низший спирт, ацетон, хлороформ и пр. Подходящая температура реакции лежит в интервале от -20оС до комнатной температуры. Соль аммония может представлять собой аммоний хлорид, ацетат аммония, сульфат аммония и т. п.
Соединение формулы X можно получить взаимодействием соединения формулы IX с таким галогенирующим агентом, как газообразный бром, хлор и т. п. с последующим взаимодействием полученного галогенида с тиоацианатом щелочного металла, предпочтительно в присутствии основания. Подходящая реакционная температура может лежать в интервале от -20оС до комнатной. В качестве тиоцианата щелочного металла можно использовать тиоцианат калия, натрия и т. п.
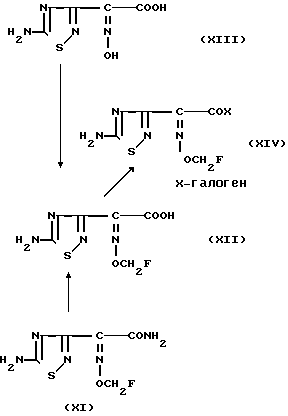
Соединение формулы XI и его производное, в котором аминогруппа защищена защитной группой, или его соль можно получить гидролизом соединения формулы X или его производного, в котором аминогруппа защищена защитной группой, или его соли в присутствии окисляющего агента и основания с последующим необязательным удалением защитной группы.
Реакцию можно проводить при 0-70оС в воде, буферном растворе или в смеси воды и низшего спирта.
В качестве окисляющего агента можно использовать перекись водорода, кислород и пр. , а в качестве основания гидроокись натрия, калия и т. д.
Соединение формулы XII и его производное, в котором аминогруппа защищена защитной группой, или его соль можно получить гидролизом соединения формулы XI и его производного, в котором аминогруппа защищена защитной группой, или его соли в присутствии основания с последующим необязательным удалением защитной группы.
Типы оснований, растворителей, реакционные температуры и пр. могут быть такими же, как описывалось выше для превращения соединения формулы X в соединение формулы XI.
Кроме того, соединение формулы XII и его производное, в котором аминогруппа защищена защитной группой, или его соль можно также получить взаимодействием соединения формулы XIII, где аминогруппа и/или карбокси-группа (группы) защищены защитными группами, с галогенфторметаном с последующим необязательным удалением защитной группы.
В качестве галогенфторметана можно использовать бромфторметан, иодфторметаном, хлорфторметан.
Реакцию можно проводить в инертном растворителе при температуре от -30 до 100оС.
Примерами используемых инертных растворителей могут служить сульфоксиды, такие как диметилсульфоксид и такие амиды, как N, N-диметилацетамид, формамид, гексаметилфосфорилтриамид и такие кетоны, как ацетон, либо смеси этих растворителей.
Соединение формулы XIV и его производное, в котором аминогруппа защищена защитной группой или его соль можно получить реакцией соединения формулы XII или его производного, в котором аминогруппа защищена защитной группой или его соли с галогенирующим агентом.
Примерами галогенирующих агентов являются пятиоксид фосфора, тионилхлорид, тионилбромид, оксихлорид фосфора и т. п
Указанную реакцию можно проводить в инертном растворителе, например, в дихлорметане, тетрагидрофуране, этилацетате, хлороформе или в смешанном растворителе, при температуре от -50 до 50оС.
Эксперимент 1 (Синтез исходного соединения). Этиловый эфир 2-(5-тритиламино-1,2,4-тиадиазол-5-ил)-(Z)-2-фторметоксииминоуксусной кислоты. 
Этиловый эфир 2-(5-тритиламино-1,2,4-тиадиазол-3-ил)-(2-оксииминоуксусной кислоты (60,4 г) растворяют в диметилсульфоксиде (210 мл) и при охлаждении льдом прибавляют карбонат калия (96,48 г). Раствор перемешивают 10 мин. Затем прибавляют бромфторметан (19 г) и раствор перемешивают 3 ч при комнатной температуре. К реакционному раствору прибавляют этилацетат (1 л), раствор промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель отгоняют и к остатку прибавляют этанол (120 мл). Выпавшие кристаллы собирают фильтрованием, промывают этанолом и получают целевой продукт (58,2 г).
Эксперимент 2 (синтез исходного соединения). 2-(5-Тритиламино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоуксусная кислота. 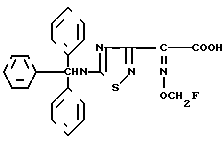
В смешанный раствор, содержащий гидроксид натрия (2,04 г), этанол (146 мл) и воду (29 мл), прибавляют соединение (17,87 г), полученное в эксперименте 1, и раствор кипятят с обратным холодильником при перемешивании 20 мин. Затем раствор концентрируют при пониженном давлении и прибавляют к нему этилацетат (200 мл) и 1 н. хлористоводородную кислоту (77 мл). Этилацетатный слой отделяют, промывают насыщенным раствором соли и затем сушат над безводным сульфатом магния. Растворитель отгоняют и получают кристаллы. Кристаллы растворяют с петролейным эфиром, собирают фильтрованием и получают целевой продукт (16,55 г).
Эксперимент 3 (синтез исходного соединения) п-Метоксибензил-7 β-2-(5-тритиламино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо (-3-)(Z)-3-хлор-1-пропен-1-ил)-3-цефем-4-карбоксилат. 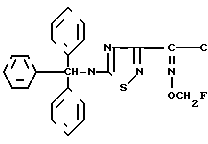 ONH
ONH
Диметилформамид (348 мкл) и тетрагидрофуран (4,1 мл) охлаждают до -10оС и прибавляют к ним оксихлорид фосфора (418 мкл) и при охлаждении на ледяной бане и перемешивании выдерживают 90 мин. К этому раствору прибавляют раствор соединения (1,73 г), полученного в эксперименте 2, в тетрагидрофуране (5,5 мл) при охлаждении до -10оС и полученный раствор перемешивают 90 мин при охлаждении на ледяной бане. Реакционный раствор охлаждают до -20оС и прибавляют к нему смешанный раствор, содержащий гидрохлорид п-метоксибензил-7- β-амино-3-((Z)-3-хлор-1-пропан-1-ил)-3-цефем-4-карбоксилата (1,78 г), N-(триметилсилил)ацетамид (2,95 г), этилацетат (18 мл) и тетрагидрофуран (5,5 мл) и полученный раствор перемешивают 1 ч при -10оС. К реакционному раствору прибавляют этилацетат (100 мл), полученный раствор тщательно промывают водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, после чего сушат над безводным сульфатом магния. Растворитель отгоняют, остаток очищают колоночной хроматографией на силикагеле и получают целевой продукт (2,65 г).
Эксперимент 4 (синтез исходного соединения) п-Метоксибензил-7 β (2)(5-тритиламино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо)- 3-((Е)-3-цефем-4-карбоксилат 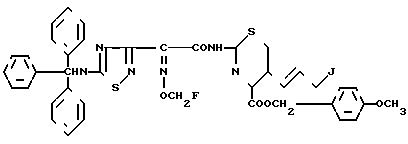
Соединение (10,11 г), полученное в эксперименте 3, растворяют в ацетоне (212 мл) и при охлаждении на ледяной бане прибавляют иодид натрия (9,03 г). Полученный раствор перемешивают 15 мин при охлаждении на ледяной бане и еще 90 мин при комнатной температуре. Растворитель отгоняют и остаток экстрагируют этилацетатом (500 мл). Экстракт промывают насыщенным водным раствором тиосульфата натрия и насыщенным раствором соли, после чего сушат над безводным сульфатом магния. Высушенный экстракт концентрируют при пониженном давлении и прибавляют н-гексан. Полученный осадок собирают фильтрованием и получают целевой продукт (10,92 г).
Эксперимент 5 (синтез исходного соединения, п-метокси-бензил-7 β (2-(5-тритиламино-1,2,4-тиадиазол-3-ил)-(Z)-дифторметоксииминоацетамидо)- 3-((Z)-3-хлор-1-пропен-1-ил)-3-цефем-4-карбоксилат. 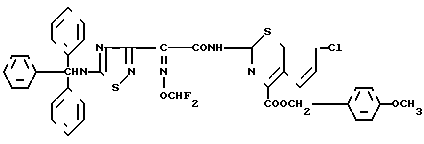
Аналогично эксперименту 3, 2-(5-тритиламино-1,2,4-тиадиазол-3-ил)-(Z)-2-дифторметоксииминоуксусную кислоту (200 г) вводят в реакцию с гидрохлоридом п-метоксибензил-7-β-амино-3-((Z)-3-хлор-1-пропен-1-ил)-3-цефем-4-карбоксилат а (1,795 г) и получают целевой продукт (3,17 г).
Эксперимент 6 (синтез исходного соединения). п-Метоксибензил-7β-/2-/5-тритиламино-1,2,4-тиадиазол-3-ил)-(Z)-2-дифторметок сииминоацетамидо/-3-//E/-3-иод-1-проен-ил/-3-цефем-4-карбоксилат. 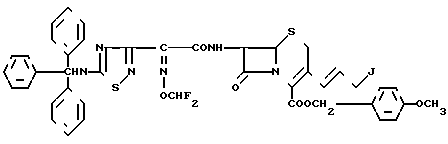
Аналогично эксперименту 4 соединение (3,00 г), полученное в эксперименте 5, вводят в реакцию с иодидом натрия -(2,62 г) и получают целевой продукт (2,92 г).
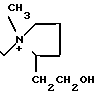
П р и м е р 1.7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо) -3-((Е)-3-(карбамоилметилэтилметиламмоний)-1-пропен-1-ил)-3-цефем-4-карбокси лат. 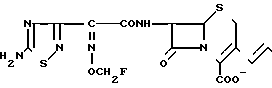

Соединение (550 мг), полученное в эксперименте 4, растворяют в смешанном растворе, содержащем этилацетат (20 мл) и диэтиловый эфир (10 мл), и прибавляют этилметиламиноацетамид (117 мг). Полученный раствор перемешивают 4,5 ч при комнатной температуре. К реакционному раствору добавляют изопропиловый эфир, выпавший осадок собирают фильтрованием, сушат и получают желто-коричневый порошок (400 мг).
Порошок перемешивают в смешанном растворе трифторуксусной кислоты (4,5 мл) и анизола (4 мл) 1 ч при охлаждении на ледяной бане и прибавляют диэтиловый эфир. Полученный осадок собирают фильтрованием и промывают диэтиловым эфиром. Осадок суспендируют в воде (5 мл). Суспензию доводят до pH 5,5-6,5 ацетатом натрия. Нерастворимые соединения удаляют фильтрованием, фильтрат очищают обращенно-фазовой хроматографией и получают целевой продукт (49 мг).
П р и м е р 2. 7β-/2-/5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо)-3-((Е) -3(1-(2-оксиэтил/-4-карбамоил-1-пиперидиний)-1-пропен-1-ил)-3-цефем-4-карбок силат. 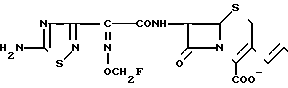

Соединение (700 мг), полученное в эксперименте 4, растворяют в диметилформамиде (3 мл) и прибавляют раствор 1-(2-оксиэтил)-изоникотинацетамида (194 мг) в диметилформамиде (0,5 мл). Раствор перемешивают ночь. Реакционный раствор прибавляют к диэтиловому эфиру (120 мл) и выпавший осадок собирают фильтрованием и получают желтый порошок (680 мг).
К этому порошку прибавляют анизол (4,5 мл) и по каплям, при перемешивании и охлаждении на ледяной бане прибавляют трифторуксусную кислоту в течение 30 мин. После окончания прикапывания смесь перемешивают еще 1,5 ч. К реакционному раствору добавляют изопропиловый эфир (50 мл) и выпавший осадок собирают фильтрованием. Осадок суспендируют в воде (30 мл) и суспензию доводят до pH = 7,0 ацетатом натрия.
Полученные при этом нерастворимые частицы удаляют фильтрованием, фильтрат очищают обращенно-фазовой колоночной хроматографией на силикагеле и получают два типа изомеров целевого соединения.
Изомер (2-1) 21 мг.
Изомер (2-3) 20 мг.
Смесь двух изомеров 1: 1 50 мг. П р и м е р 3. 7β-2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фтормеоксииминоацетамидо)-3-((Е)-3 -(1S-карбамоилэтил/диметиламмоний/-1-пропен-1-ил)-3-цефем-4-карбоксилат (3-1). 

7β-/2-/5-Амино-1/2,4-тиадиазол-3-ил)(Z)-2-фторме оксииминоацетамидо)-3((Е)-3-((1R-карбамоилэтил/диметиламмоний/-1-пропен-1-ил )-3-цефем-4- карбоксилат/3-2/. 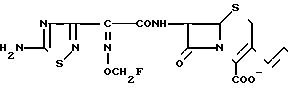
 ONH2 Соединение (600 мг), полученное в эксперименте 4, растворяют в смешанном растворе, содержащем этилацетат (20 мл) и диэтиловый эфир (10 мл) и затем прибавляют 2-диметиламинопропиламид (150 мг). Полученный раствор перемешивают 3 ч при комнатной температуре. К реакционному раствору добавляют изопропиловый эфир, выпавший осадок собирают фильтрованием, сушат и получают желтовато-коричневый порошок (50 мг).
ONH2 Соединение (600 мг), полученное в эксперименте 4, растворяют в смешанном растворе, содержащем этилацетат (20 мл) и диэтиловый эфир (10 мл) и затем прибавляют 2-диметиламинопропиламид (150 мг). Полученный раствор перемешивают 3 ч при комнатной температуре. К реакционному раствору добавляют изопропиловый эфир, выпавший осадок собирают фильтрованием, сушат и получают желтовато-коричневый порошок (50 мг).
Этот порошок перемешивают в смешанном растворе из трифторуксусной кислоты (5,5 мл) и анизола (5 мл) 1 ч на ледяной бане и затем прибавляют диэтиловый эфир. Полученный осадок собирают фильтрованием и промывают диэтиловым эфиром. Осадок суспендируют в воде (5 мл) и суспензию доводят до pH 5,5-6,5 ацетатом натрия. Нерастворимые частицы удаляют фильтрованием, фильтрат очищают обращенно-фазовой колоночной хроматографией на силикагеле и получают следующие целевые продукты: 8 мг (3-1), 7 мг (3-2) и 4 мг смеси (1: 1) (3-1) и (3-2).
П р и м е р 4. 7β-/2-/5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо)-(3-((Е )-3-((2-оксипропил/диметиламмоний)-1-пропен-1-ил)-3-цефем-4-карбоксилат. 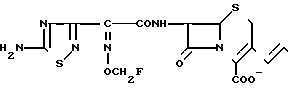
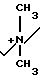
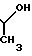
Соединение (550 мг), полученное в эксперименте 4, растворяют в смешанном растворе из этилацетата (20 мл) и серного эфира (10 мл) и затем прибавляют 3-диметиламино-2-пропанол (0,124 мл). Полученный раствор перемешивают при комнатной температуре 1,5 ч. К реакционному раствору прибавляют изопропанол. Выпавший осадок собирают фильтрованием, сушат и получают желто-коричневый порошок (530 мг).
Этот порошок перемешивают в смеси трифторуксусной кислоты (5,5 мл) и анизола (5 мл) 1 ч при охлаждении на ледяной бане. Затем прибавляют серный эфир. Полученный осадок собирают фильтрованием и промывают серным эфиром. Осадок суспендируют в воде (5 мл). Суспензию доводят до pH = 5,5-6,5 ацетатом натрия. Нерастворимые частицы удаляют фильтрованием, фильтрат очищают обращенно-фазовой колоночной хроматографией на силикагеле и получают целевой продукт (70 мг).
П р и м е р 5. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо)-3-((Е) -3-((1R-карбамоил-2-оксиэтил) диметиламмоний)-1-пропен-1-ил) -3-цефем-4-карбоксилат. 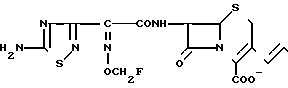
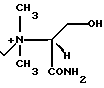
Соединение (1,00 г), полученное в эксперименте 4, растворяют в диметилформамиде (2 мл). Раствор N, N-диметил-D-серинамида получают, растворяя N, N-диметил-D-серинамидотрифторацетат (590 мг) в метаноле (5 мл), прибавляют к нему 1N водный раствор гидроксида натрия (2,4 мл), затем отгоняют растворитель при пониженном давлении и экстрагируют остаток ацетонитрилом (2 мл). Раствор N, N-диметил-D-серинамида прибавляют к раствору соединения, полученного в эксперименте 4, в диметилформамиде при охлаждении на ледяной бане. Полученный раствор перемешивают 30 мин. Реакционный раствор добавляют в серный эфир, полученный осадок собирают фильтрованием и получают желтый порошок (1,1 г).
К этому порошку прибавляют анизол (8 мл) и трифторуксусную кислоту (9 мл) по каплям при перемешивании прибавляют в течение 30 мин при охлаждении на ледяной бане, после чего перемешивают еще 1,5 ч. К реакционному раствору прибавляют серный эфир и выпавший осадок собирают фильтрованием. Осадок суспендируют в воде (10 мл). Суспензию доводят до pH = 7 ацетатом натрия. Нерастворимые соединения удаляют фильтрованием, фильтрат очищают обращенно-фазовой колоночной хроматографией на силикагеле и получают целевой продукт (30 мг).
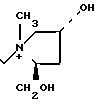
П р и м е р 6. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-(2-фторметоксииминоацетамидо) -3-((Е)-3-(4R-окси-2R-оксиметил-1-метил-1-пирролидиний)-1-пропен-1-ил)-3-цеф ем-4-карбоксилат. 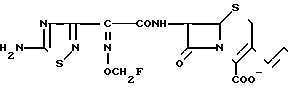
Соединение (700 мг), полученное в эксперименте 4, растворяют в ацетоне (4 мл) и прибавляют раствор N-метил-цис-4-окси D-пролинола (89 мг) в ацетоне (2 мл). Полученный раствор перемешивают ночь. Реакционный раствор прибавляют в серный эфир (100 мл), выпавший осадок собирают фильтрованием и получают желтый порошок (700 мг).
К этому порошку прибавляют анизол (4,6 мл) и трифторуксусную кислоту (5,3 мл) по каплям в течение 30 мин при перемешивании и охлаждении на ледяной бане и перемешивают еще в течение 1,5 ч. К реакционному раствору прибавляют изопропиловый эфир (50 мл). Выпавший осадок собирают фильтрованием. Осадок суспендируют в воде (30 мл) и суспензию доводят до pH 7 ацетатом натрия. Нерастворимые частицы удаляют фильтрованием, фильтрат очищают обращенно-фазовой колоночной хроматографией на силикагеле и получают следующие два типа изомеров (по атому азота пирролидина): изомер (6-1) 27 мг, изомер (6-2) 100 мг.
П р и м е р 7. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо) -3-((Е)-3-(4R-окси-1-/2-оксиэтил/-2S-оксиметил-1-пирролидиний-1-пропен-1-ил) -3-цефем-4-карбоксилат. 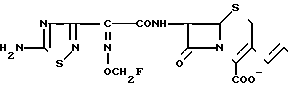

Соединение -(2,0 г), полученное в эксперименте 4, прибавляют к раствору (R)-4-окси-1-(2-оксиэтил)-(S)-2-оксиметилпирролидона (450 мг) в диметилформамиде (5 мл). Результирующий раствор перемешивают ночь. Реакционный раствор добавляют в этилацетат. Выпавший осадок собирают фильтрованием и получают желтый порошок (1,65 г).
К порошку прибавляют анизол (10 мл) и затем по каплям в течение 30 мин при перемешивании и охлаждении на ледяной бане прибавляют трифторуксусную кислоту (11,7 мл), после чего перемешивают еще в течение 1,5 ч. К реакционному раствору прибавляют изопропиловый эфир и выпавший осадок собирают фильтрованием. Осадок суспендируют в воде (4,5 мл) и суспензию доводят до pH = 7 ацетатом натрия. Нерастворимые соединения удаляют фильтрованием. Фильтрат очищают колоночной хроматографией на силикагеле в реверсивной фазе и получают два типа изомеров (по атому азота пирролидина) целевого соединения: изомер (7-1) 96 мг, изомер (7-2) 207 мг.
П р и м е р 8. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо) -3-((Е)-3-(4R-окси-2S-оксиметил-1-метил-1-пирролидиний-1-пропен-1-ил)-3-цефе м-4-карбоксилат. 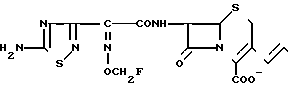
Соединение (700 мг), полученные в эксперименте 4, растворяют в ацетоне (4 мл) и прибавляют раствор N-метил-транс-4-окси-D-пролинола (89 мг) в ацетоне (2 мл), после чего результирующий раствор перемешивают ночь. Реакционный раствор прибавляют к серному эфиру (100 мл), выпавший осадок собирают фильтрованием и получают желтый порошок (700 мг).
К порошку прибавляют анизол (4,5 мл) и по каплям, при перемешивании и охлаждении на ледяной бане, в течение 30 мин прибавляют трифторуксусную кислоту (5,3 мл), после чего смесь перемешивают еще 1,5 ч. К реакционному раствору прибавляют изопропиловый эфир (50 мл) и выпавший осадок собирают фильтрованием. Затем осадок суспендируют в воде (30 мл). Суспензию доводят до pH 7 ацетатом натрия. Нерастворимые частицы удаляют фильтрованием, фильтрат очищают обращеннофазовой колоночной хроматографией на силикагеле и получают целевое соединение (92 мг).
П р и м е р 9. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо)-3-((Е) -3-(1-карбамоилметил-3-окси-1-пирролидиний-1-пропен-1-ил)-3- цефем-4-карбоксилат. 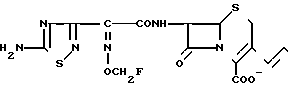

Соединение (1,0 г), полученное в эксперименте 4, растворяют в диметилформамиде (4 мл) и прибавляют раствор N-карбамоилметил-3-оксипирролидина (186 мг) в диметилформамиде (2 мл). Полученный раствор перемешивают ночь. Реакционный раствор прибавляют к серному эфиру (200 мл). Выпавший осадок собирают фильтрованием и получают желтый порошок (970 мг).
К порошку прибавляют анизол, а затем по каплям, при перемешивании и охлаждении на ледяной бане в течение 30 мин прибавляют трифторуксусную кислоту (10,6 мл). Затем смесь перемешивают еще 1,5 ч. К реакционному раствору прибавляют изопропиловый эфир (80 мл) и выпавший осадок собирают фильтрованием. Осадок суспендируют в воде (50 мл). Суспензию доводят до pH 7 ацетатом натрия. Нерастворимые соединения отфильтровывают, фильтрат очищают обращенно-фазовой колоночной хроматографией на силикагеле и получают соответствующие типы изомеров (по атому азота и атому углерода в положении 3 пирролидина, и имеется 4 типа по данным высокого давления жидкостной хроматографии (целевого соединения: изомер (9-1) 71 мг (смесь изомеров двух типов), изомер (9-3) 70 мг (индивидуальное соединение), изомер (9-3) 54 мг (индивидуальное соединение).
П р и м е р 10. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо)-3-((Е) -3-(1-метил-4-сульфо-1-пиперазиний-1-пропен-1-ил)-3-цефем-4-карбоксилат. H2N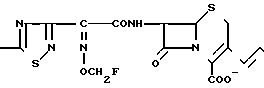
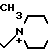 N
N SO3H
SO3H
Соединение (2,0 г), полученное в эксперименте 4, прибавляют к раствору, содержащему сульфат 4-метилпиперазиносульфокислоты (718 мг) N-метил-N-(триметилсилил)трифторацетамид (2 мл) и диметилформамид (6 мл), и полученный раствор перемешивают ночь. К реакционному раствору прибавляют метанол (2 мл) и нерастворимые частицы отфильтровывают. Фильтрат прибавляют к смеси этилацетатал (50 мл) и серного эфира (50 мл), выпавший осадок собирают фильтрованием и получают желтый порошок (1,79 г).
К этому порошку прибавляют анизол (10,9 мл), а затем по каплям, при перемешивании и охлаждении на ледяной бане в течение 30 мин прибавляют трифторуксусную кислоту (12,7 мл). Полученный раствор перемешивают еще 1,5 ч. К реакционному раствору прибавляют изопропиловый эфир (100 мл) и выпавший осадок собирают фильтрованием. Осадок суспендируют в воде (4,5 мл) и суспензию доводят до pH 7 ацетатом натрия. Нерастворимые частицы отфильтровывают, фильтрат очищают обращенно-фазовой колоночной хроматографией на силикагеле и получают целевой продукт (50 мг).
П р и м е р 11. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо)-3-((Е) -3-(1-карбамоилметил-4-окси-1-пиперидиний-1-пропен-1-мл)-3-цефем-4-карбоксил ат. H2N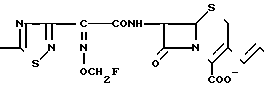
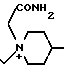 OH
OH
Соединение (1,0 г), полученное в эксперименте 4, растворяют в ацетоне (9 мл) и прибавляют N-карбамоилметил-4-оксипиперидин (206 мг). Раствор перемешивают ночь. Реакционный раствор прибавляют к смеси (100 мл) серного эфира и изопропилового эфира (2: 1), полученный осадок собирают фильтрованием и получают желтый порошок (1,0 г).
К этому порошку прибавляют анизол (9,0 мл), а затем по каплям при перемешивании и охлаждении на ледяной бане, в течение 30 мин прибавляют трифторуксусную кислоту (10,6 мл). Полученный раствор перемешивают еще в течение 1,5 ч. К реакционному раствору добавляют изопропиловый эфир (80 мл) и выпавший осадок собирают фильтрованием. Осадок суспендируют в воде (5 мл) и суспензию доводят до pH 7,0 ацетатом натрия. Нерастворимые частицы отфильтровывают, фильтрат очищают обращенно-фазовой колоночной хроматографией на силикагеле и получают целевой продукт (166 мг).
П р и м е р 12. 7β-(2-(5-Ам но-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо)-3-((Е)-3-(5-аза-1м етил-2/8-диоксабицикло//3,3,1) нона-5-оний)-1-пропен-1-ил)-3-цефем-4-карбоксилат. H2N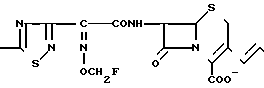

Соединение, полученное в эксперименте 4, растворяют в диметилформамиде (10 мл) и прибавляют при комнатной температуре 5-аза-1-метил-2,8-диоксабицикло(3,3,1)нонан (800 мл). Результирующий раствор перемешивают 20 мин. Реакционный раствор разбавляют этилацетатом (25 мл), раствор прибавляют в серный эфир и получают коричневый осадок (3,85 г).
Осадок растворяют в анизоле (23 мл) и при охлаждении на ледяной бане прибавляют трифторуксусную кислоту (26 мл). Раствор перемешивают при этой же температуре 30 мин. К реакционному раствору прибавляют серный эфир и выпавший осадок собирают фильтрованием. Осадок суспендируют в воде (40 мл) и суспензию доводят до pH 7,0 ацетатом натрия. Нерастворимые частицы отфильтровывают, фильтрат очищают обращенно-фазовой колоночной хроматографией на силикагеле и получают целевой продукт (408 мг).
По методикам, описанным в примерах 1-12, в примерах 13-89 получают следующие соединения (см. табл. 1):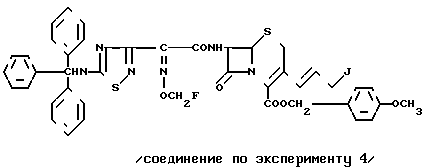
H2N

Может быть образовано множество изомеров из-за строения аммонийной группы в А. Если эти изомеры разделяют, то соответствующие выходы указывают для индивидуальных соответствующих изомеров.
Используют следующие сокращения:
Boc: трет-бутоксикарбонильная группа,
t-Bu: трет-бутильная группа,
Bh: бензгидрильная группа,
Tr: тритильная группа.
П р и м е р 90. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-дифторметоксииминоацетамидо)-3-(( Е)-3-(диметилкарбамоилметиламмоний)-1-пропен-1-ил)-3-цефем -4-карбоксилат. 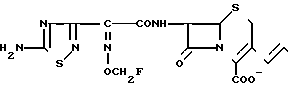
Соединение (500 мг), полученное в эксперименте 6, растворяют в смеси этилацетата (10 мл) и серного эфира (10 мл). К раствору прибавляют диметилглицинамид (160 мг) и перемешивают 30 мин при комнатной температуре. К реакционному раствору прибавляют изопропиловый эфир. Выпавший осадок собирают фильтрованием, сушат и получают желтовато-коричневый порошок (400 мг).
Этот порошок перемешивают при охлаждении на ледяной бане в смеси трифторуксусной кислоты (5 мл) и анизола (4,5 мл) в течение 1 ч. К реакционному раствору добавляют серный эфир, выпавший осадок собирают фильтрованием и промывают серным эфиром. Этот осадок суспендируют в воде (5 мл) и доводят pH суспензии до 5,5-6,5 ацетатом натрия. Нерастворимые частицы отфильтровывают, фильтрат очищают обращенно-фазовой хроматографией на силикагеле и получают целевой продукт (55 мг).
Аналогично примеру 90 получают соединения в следующих примерах 91-93 (см. табл. 2).



 Физические данные полученных соединений приведены в табл. 3. Эксперимент 7 (Синтез исходного соединения):
Физические данные полученных соединений приведены в табл. 3. Эксперимент 7 (Синтез исходного соединения):
п-метоксибензил-7β-/2-(5- тритиламино-1,2,4-тиадиазол-3-ил)-(Z)-2-(2,2,2-трифторэтил)оксииминоацетамид о/-3-/Z-3-хлор-1-пропен-1-ил)-3-цефем-4-карбоксилат: 
Смешанный раствор, состоящий из 0,247 мл диметилформамида в 3 мл тетрагидрофурана, охлаждают до -10оС и прибавляют 0,297 мл оксихлорида фосфора и после этого перемешивают в течение 40 мин при охлаждении на ледяной бане. К полученному раствору прибавляют 4 мл раствора 1,36 г 2-(5-тритиламино-1,2,4-тиадиазол-3-ил)-(Z)-2-(2,2,2-трифторэтил)оксииминоукс уснокислоты в тетрагидрофуране, затем перемешивают еще 1 час при этой же температуре. Полученный в результате реакционный раствор прибавляют к смешанному раствору, состоящему из 1,145 г п-метоксибензил-7 β-амино-3-((Z)-3-хлор-1-пропен-1-ил)-3-цефем-4-карбоксилата гидрохлорида, 2,09 г N-(триметилсилил)ацетатида и 10 мл этилацетата, охлаждают до -20оС, затем повышают температуру до 0оС при перемешивании в течение 1 ч. После прибавления этилацетата к реакционному раствору его промывают водой и сушат над безводным сульфатом натрия. Выпаривают растворитель и остаток очищают хроматографией на колонке с силикагелем, получают 1,43 г целевого продукта.
П р и м е р 94. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо) -3-((Е)-3-(карбамоилметилдиметиламмоний)-1-пропен-1-ил)-3-цефем -4-карбоксилат: 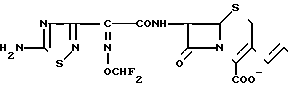
 Растворяют 500 мг соединения, полученного в эксперименте 4, в смешанном растворе, состоящем из 3 мл метанола, и 1 мл диметилформамида, и прибавляют 71,3 мг N, N-диметилглицинамида при охлаждении на ледяной бане, затем перемешивают всю ночь при комнатной температуре. Полученный в результате реакционный раствор прибавляют к смешанному раствору, состоящему из 50 мл этилового эфира и 50 мл этилацетата, отфильтровывают образовавшийся осадок и сушат, получая 382 мг желтого порошка.
Растворяют 500 мг соединения, полученного в эксперименте 4, в смешанном растворе, состоящем из 3 мл метанола, и 1 мл диметилформамида, и прибавляют 71,3 мг N, N-диметилглицинамида при охлаждении на ледяной бане, затем перемешивают всю ночь при комнатной температуре. Полученный в результате реакционный раствор прибавляют к смешанному раствору, состоящему из 50 мл этилового эфира и 50 мл этилацетата, отфильтровывают образовавшийся осадок и сушат, получая 382 мг желтого порошка.
Это соединение прибавляют к смешанному раствору, состоящему из 2,7 мл трифторуксусной кислоты и 2,3 мл анизола, затем перемешивают 2 ч при охлаждении на ледяной бане. Реакционный раствор прибавляют к смешанному раствору, состоящему из 25 мл этилового эфира и 25 мл изопропилового эфира, отфильтровывают образовавшийся осадок и промывают этиловым эфиром. Полученный таким образом осадок суспендируют в 4,5 мл воды, затем устанавливают pH полученной суспензии в интервале 5,5-6,5 с помощью ацетата натрия и отфильтровывают нерастворимые вещества. Фильтрат очищают колоночной хроматографией на силикагеле с обращаемой фазой, получают 95 мг целевого продукта.
П р и м е р 95. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-мл)-(Z)-2-фторметоксииминоацетамидо) -3-((Е)-3(1-метил-4-сульфамоил-1-пиперазиний)-1-пропен-1-ил)-3-цефем-4-карбо ксилат: 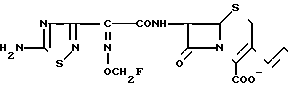

Растворяют 500 мг соединения, полученного в эксперименте 4, в смешанном растворителе, состоящем из 3 мл метанола и 1 мл диметилформамида, прибавляют 116 мг N-сульфамоил-N-метилпиперазина при охлаждении на ледяной бане, а затем перемешивают всю ночь при комнатной температуре. Реакционный раствор прибавляют к смешанному раствору, состоящему из 50 мл этилацетата и 50 мл этилового эфира, отфильтровывают образовавшийся осадок и сушат, получая 402 мг желтого порошка.
Соединение прибавляют к смешанному раствору, состоящему из 2,8 мл трифторуксусной кислоты и 2,5 мл анизола, перемешивают 2 ч при охлаждении на ледяной бане. Реакционный раствор прибавляют к смешанному раствору, состоящему из 25 мл этилового эфира и 25 мл изопропилового эфира, отфильтровывают образовавшийся осадок и промывают его этиловым эфиром. Полученный в результате осадок суспендируют в 4,5 мл воды, затем устанавливают pH в интервале 5,5-6,5 с помощью ацетата натрия, а нерастворимые вещества отфильтровывают, фильтрат очищают хроматографией на колонке с силикагелем с обращаемой фазой, получают 58 мг целевого продукта.
П р и м е р 96. 7β-(2-(5-Амино-1,2,4-тиа иазол-3-ил)-(Z)-2-фтометокси-иминоацетамидо) -3-[(E)-3-((1/3/4-оксадиазол-2-ил)метилдиметиламмоний)- -1-пропен-1-ил)-3-цефем-4-карбоксилат: H2N
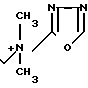
Растворяют 500 мг соединения, полученного в эксперименте 4, в смешанном растворе, состоящем из 1 мл метанола и 4,8 мл этилацетата, прибавляют туда раствор 88,8 мг 2-диметиламинометил-1,3,4-оксадиазола в 1 мл этилацетата при охлаждении на ледяной бане и перемешивают всю ночь при комнатной температуре. Полученный в результате реакционный раствор прибавляют к смешанному раствору, состоящему из 50 мл этилацетата и 50 мл этилового эфира, отфильтровывают образовавшийся осадок и сушат, получая 443 мг желтого порошка.
Соединение прибавляют к смешанному раствору, состоящему из 3,1 мг трифторуксусной кислоты и 2,7 мл анизола, и перемешивают 2 ч при охлаждении на ледяной бане. Полученный реакционный раствор прибавляют к смешанному раствору, состоящему из 25 мл этилового эфира и 25 мл изопропилового эфира, образовавшийся осадок отфильтровывают и промывают этиловым эфиром. Полученный таким образом осадок суспендируют в 4,5 мл воды, затем устанавливают pH полученной в результате суспензии в интервале 5,5-6,5 с помощью ацетата натрия и отфильтровывают нерастворимые вещества. Фильтрат очищают хроматографией на колонке с силикагелем с обращаемой фазой, получают 92 мг целевого продукта.
П р и м е р 97. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо) -3-((Е)-3-(1-метил-4-карбамоил-1-пиперазиний)-1-пропен)-1-ил)-3-цефем-4-карб оксилат: 
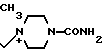
Растворяют 500 мг соединения, полученного в эксперименте 4, в смешанном растворителе, состоящем из 3 мл метанола и 1 мл диметилформамида, прибавляют 100 мг N-метил-N'-карбамоилпиперазина при охлаждении на ледяной бане, а затем перемешивают всю ночь при комнатной температуре. Реакционный раствор прибавляют к смешанному раствору, состоящему из 50 мл этилацетата и 30 мл этилового эфира, образовавшийся осадок отфильтровывают и сушат, получают 425 мг желтого порошка.
Соединение прибавляют к смешанному раствору, состоящему из 3,0 мл трифторуксусной кислоты и 2,6 мл анизола, перемешивают 2 ч при охлаждении на ледяной бане. Реакционный раствор прибавляют к смешанному раствору, состоящему из 25 мл этилового эфира и 25 мл изопропилового спирта, образовавшийся осадок отфильтровывают и промывают этиловым эфиром. Осадок суспендируют в 4,5 мл воды, затем устанавливают pH в интервале 5,5-6,5 с помощью ацетата натрия и отфильтровывают нерастворимые вещества. Фильтрат очищают хроматографией на колонке с силикагелем с обращаемой фазой, получают 107 мг целевого продукта.
П р и м е р 98. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамида) -3-((Е)-3-(1,2-диметил-1-пиразолидиний)-1-пропен-1-ил)-3-цефем-4-карбоксилат (изомеры: A: и B): 
Растворяют 783 мг соединения, полученного в эксперименте 4, в смешанном растворе, состоящем из 1,5 мл метанола и 7,1 мл этилацетата, прибавляют туда 1,5 мл этилацетатного раствора 103 мг N, N'-диметилпиразолидина при охлаждении на ледяной бане и затем перемешивают всю ночь при комнатной температуре. Реакционный раствор прибавляют к смешанному раствору, состоящему из 50 мл этилацетата и 50 мл этилового эфира, отфильтровывают образовавшийся осадок и сушат, получают 631 мг желтого порошка.
Соединение прибавляют к смешанному раствору, состоящему 4,5 мл трифторуксусной кислоты и 3,8 мл анизола, и перемешивают 2 часа при охлаждении на ледяной бане. Реакционный раствор прибавляют к смешанному раствору, состоящему из 25 мл этилового эфира и 25 мл изопропилового эфира, отфильтровывают образовавшийся осадок и промывают его этиловым эфиром. Осадок суспендируют в 4,5 мл воды, затем устанавливают pH полученной в результате суспензии в интервале 5,5-6,5 с помощью ацетата натрия и отфильтровывают нерастворимые соединения. Фильтрат очищают хроматографией на колонне с силикагелем с обращаемой фазой, получают 37 мг целевого изомера А и 27 мг изомера В.
П р и м е р 99. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо)-3-((Е) -3-(1-метил-4-формимидоил-1-пиперазиний)-1-пропен-1-ил)-3-цефем-4-карбоксила т гидрохлорид: H2N
 N
N CH= NH·HCl
CH= NH·HCl
Растворяют 750 мг соединения, полученного в эксперименте 4, в смешанном растворе, состоящем из 4,5 мл метанола и 1,5 мл диметилформамида, прибавляют туда 158 мг N-метил-N'-формимидоилпиперазин гидрохлорида при охлаждении на ледяной бане, затем перемешивают всю ночь при комнатной температуре. Реакционный раствор прибавляют к смешанному раствору, состоящему из 50 мл этилацетата и 30 мл этилового эфира, образовавшийся осадок отфильтровывают и сушат, получают 485 мг желтого порошка.
Соединение прибавляют к смешанному раствору, состоящему из 3,4 мл трифторуксусной кислоты и 3,0 мл анизола, и перемешивают 2 часа при охлаждении на ледяной бане. Реакционный раствор прибавляют к смешанному раствору, состоящему из 25 мл этилового эфира и 25 мл изопропилового эфира и отфильтровывают образовавшийся осадок, промывают его этиловым эфиром. Осадок суспендируют в 4,0 мл воды и отфильтровывают нерастворимые вещества. Фильтрат очищают хроматографией на колонке с силикагелем с обращаемой фазой, получают 58 мг целевого продукта.
Работая по методике примеров 94-99, синтезируют соединения следующих примеров 100-116.
П р и м е р 100. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо)-3-((Е) -3-(1-метил-1-пиперазиний)-1-пропен-1-ил)-3-цефем-4-карбоксилат: 
Вводят в реакцию 750 мг соединения, полученного в эксперименте 4, со 116 мкл N-метилпиперазина, удаляют защищающую группу, получают 16 мг целевого продукта.
П р и м е р 101. 7β-/2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо)-3-((Е) -3-(4-карбоксипипридиний/-1-пропен-1-ил)-3-цефем-4-карбоксилат: 

Вводят в реакцию 750 мг соединения, полученного в эксперименте 4, со 198 мг изоникотиновой кислоты, затем удаляют защищающую группу, получают 243 мг целевого продукта.
П р и м е р 102. 7β-/2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо) -3-((Е)-3-(1-метилпирролидиний/-1-пропен-1-ил)-3-цефем-4-карбоксилат: 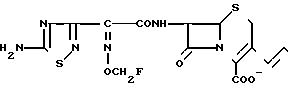
Вводят в реакцию 500 мг соединения, полученного в эксперименте 4, с 55,8 мкл N-метилпирролидина, затем удаляют защищающую группу, получают 21 мг целевого продукта.
П р и м е р 103. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо)-3-((Е) -3-(4-карбамоилпиридиний)-1-пропен-1-ил)-3-цефем-4-карбоксилат: 
Вводят в реакцию 500 мг соединения, полученного в эксперименте 4, со 131 мг 4-карбамоилпиридина, затем удаляют защищающую группу, получают 42 мг целевого продукта.
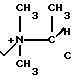
П р и м е р 104. 7β-(2-(5-Амино-1,3,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо) -3-((Е)-3-(триметиламмоний/-1-пропен-1-ил)-3-цефем-4-карбоксилат: H2N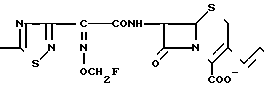
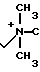 H3
H3
Вводят в реакцию 500 мг соединения, полученного в эксперименте 4, с триметиламином (в виде 57 мг солянокислого триметиламина) затем удаляют защищающую группу, получают 79 мг целевого продукта.
П р и м е р 105. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо) -3-((Е)-3-(1,4-(2,2,2)октан-1-оний-1(пропан-1-ил)-3-цефем-4-карбоксилат: 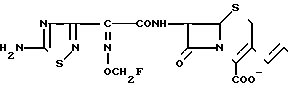
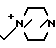
Вводят в реакцию 500 мг соединения, полученного в эксперименте 4, с 72 мг 1,4-диазабицикло (2,2,2)октана, затем удаляют защищающую группу, получают 61 мг целевого продукта.
П р и м е р 106. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамида) -3-((Е)-3(-1,5-диазабицикло(3,3,0)-октан-1-оний(-1-пропен-1-ил)-3-цефем-4-ка рбоксилат: 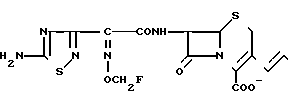
Вводят в реакцию 500 мг соединения, полученного в эксперименте 4, со 120 мг 1,5-диазабицикло(3,3,0)октана, затем удаляют защищающую группу, получают 32 мг целевого продукта.
П р и м е р 107. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамида)-3-((Е) -3-(4-метил-4-тиоморфолин1,1-диоксид-4-оний)-1-пропен-1-ил)-3- цефем-4-карбоксилат: H2N
 S
S
Вводят в реакцию 250 мг соединения, полученного в эксперименте 4, с 52 мг 4-метилтиоформолин-1,1-диоксида, затем удаляют защищающую группу, получают 17 мг целевого продукта.
П р и м е р 108. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил-(Z)-2-фторметоксииминоацетамидо) -3-((Е)-3-(1,4-диметил-1-пиперазиний)-1-пропен-1-ил)-3-цефем-4-карбоксилат: H2N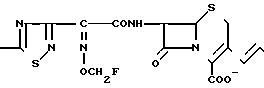
 N
N CH3
CH3
Вводят в реакцию 500 мг соединения, полученного в эксперименте 4, с 94 мкл 1,4-диметилпиперазина, затем удаляют защищающую группу, получают 35 мг целевого продукта.
П р и м е р 109. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидол) -3-((Е)-3-(2-аминоэтил/диметиламмоний)-1-пропен-1-ил)-3-цефем -4-карбоксилат: 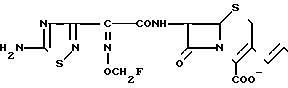
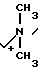
Вводят в реакцию 750 мг соединения, полученного в эксперименте 4, со 115 мкл N, N-диметилэтилендиамина, затем удаляют защищающую группу, получают 15 мг целевого продукта.
П р и м е р 110. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо) -3-((Е)-3-))тетразол-5-ил/метилдиметиламмоний)-1-пропен-1-ил)-3-цефем -4-карбоксилат: H2N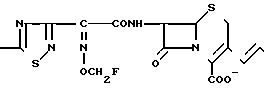
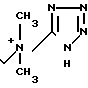
Вводят в реакцию 500 мг соединения, полученного в эксперименте 4, со 150 мг 5-диметиламинометилтетразола, затем удаляют защищающую группу, получают 37 мг целевого продукта.
П р и м е р 111. 7β-/2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо) -3-((Е)-3-(2-сульфопиридиний/-1-пропен-1-ил)-3-цефем-4-карбоксилат: H2N
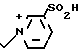
Вводят в реакцию 750 мг соединения, полученного в эксперименте 4, с 384 мг 3-пиридинсульфоновой кислоты, затем удаляют защищающую группу, получают 68 мг целевого продукта.
П р и м е р 112. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо)-3-((Е) -3-((2-диметиламиноэтил)диметиламмоний)-1-пропен-1-ил)-3-цефем -4-карбоксилат: H2N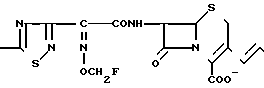


Вводят в реакцию 500 мг соединения, полученного в эксперименте 4, со 105 мкл N, N, N', N'-тетраметилэтилендиамина, затем удаляют защищающую группу, получают 22 мг целевого продукта.
П р и м е р 113. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо) -3-((Е)-3-((2-оксопропил)диметиламмоний)-1-пропен-1-ил)-3-цефем- 4-карбоксилат: 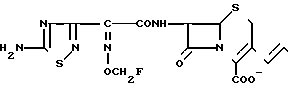
 CH3
CH3
Вводят в реакцию 500 мг соединения, полученного в эксперименте 4, с 80 мкл (диметиламино)ацетона, затем удаляют защищающую группу, получают 60 мг целевого продукта.
П р и м е р 114. 7β-/2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксиаминоацетамидо) -3-((Е)-3-(4-карбамоилхинуклидиний)-1-пропен-1-ил)-3-цефем-4-карбоксилат: H2N
 N
N CONH2
CONH2
Вводят в реакцию 500 мг соединения, полученного в эксперименте 4, со 107,6 мг 4-карбамоилхинуклидина, затем удаляют защищающую группу, получают 77 мг целевого продукта.
П р и м е р 115. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксиимоацетамидо) -3-((Е)-3-(1-метил-2-(2-оксиэтил)пирролидиний)-1-пропен-1-ил)-3-цефем-4-карб оксилат: (изомеры A и B): 
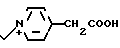
Вводят в реакцию 500 мг соединения, полученного в экперименте 4, с 83,3 мг 1-метил-2-(2-оксиэтил)пирролидина, затем удаляют защищающую группу, получают 24 мг изомера А и 26 мг изомера В.
П р и м е р 116. 7β-/2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо) -3-((Е)-3-(4-карбоксиметилпиридиний)-1-пропен-1-ил)-3-цефем-4-карбоксилат: 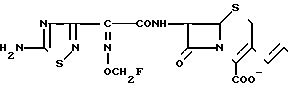
Вводят в реакцию 500 мг соединения, полученного в эксперименте 4, с 280 мг солянокислой 4-пиридилуксусной кислоты, затем удаляют защищающую группу, получают 5 мг целевого соединения.
П р и м е р 117. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо)-3-((Е) -3-(1,4/4-триметил-1-пиперазиний)-1-пропен-1-ил)-3-цефем- 4-карбоксилат иодид: 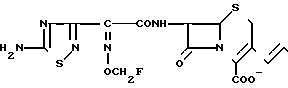
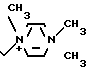 ·J-
·J-
Суспендируют 1,0 г соединения, полученного в эксперименте 4, в 100 мл этилового эфира и прибавляют туда 40 мл раствора 189 мкл 1,4-диметилпиперазина в этилацетате и перемешивают всю ночь. Отфильтровывают образовавшийся осадок и переосаждают его из смеси тетрагидрофуран/этилацетат, затем промывают его этилацетатом, получают 492 мг желтого порошка. Его растворяют в 2 мл дихлорметана и прибавляют 4 мл метилиодида при охлаждении на ледяной бане, затем перемешивают всю ночь при этой же температуре. Выливают реакционный раствор в этилацетат и отфильтровывают образовавшийся осадок, получают 190 мг желто-коричневого порошка.
Это соединение прибавляют к смешанному раствору, состоящему из 1,35 мл трифторуксусной кислоты и 1,15 мл анизола, и перемешивают 2 ч при охлаждении на ледяной бане. Реакционный раствор прибавляют к смешанному раствору, состоящему из 25 мл этилового эфира и 25 мл изопропилового эфира, отфильтровывают образовавшийся осадок и промывают его этиловым эфиром. Полученный в результате осадок суспендируют в 4,5 мл воды и отфильтровывают образовавшийся осадок, промывают его этиловым эфиром. Полученный осадок суспендируют в 4,5 мл воды и отфильтровывают нерастворимые вещества. Фильтрат очищают хроматографией на колонке с силикагелем с обращаемой фазой, получают 23 мг целевого продукта.
П р и м е р 118. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-(2,2,2, трифторэтил) оксииминоацетамидо)-3-//E/-3-/карбамоилметилдиметиламмоний)-1-пропен-1-ил)-3 -цефем-4-карбоксилат. 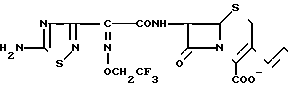
 CONH2
CONH2
Растворяют 1,43 г соединения, полученного в эксперименте 7, в 20 мл ацетона и прибавляют туда 0,927 г иодида натрия при охлаждении на ледяной бане и перемешивают еще 10 мин при этой же температуре и потом 1,5 ч при комнатной температуре. Выпаривают растворитель и после добавления этилацетата к полученному остатку его промывают разбавленным раствором тиосульфата натрия и насыщенным раствором соли, затем сушат над сульфатом натрия. Выпаривают растворитель и растворяют осадок в 40 мл этилацетата. После этого прибавляют 237 мг диметилглицинамида к полученному раствору и перемешивают 1 ч при комнатной температуре. К полученному в результате раствору прибавляют изопропиловый эфир и отфильтровывают образовавшийся осадок, получают 1,07 г желто-коричневого порошка.
Соединение прибавляют к смешанному раствору, состоящему из 8 мл трифторуксусной кислоты и 6 мл анизола и перемешивают 1 час при охлаждении на ледяной бане. К полученному реакционному раствору прибавляют этиловый эфир и отфильтровывают образовавшийся осадок. Этот осадок суспендируют в 10 мл воды, затем устанавливают pH в интервале 5,5-6,5 с помощью ацетата натрия и отфильтровывают нерастворимые вещества. Фильтрат очищают хроматографией на колонке с силикагелем с обращаемой фазой, получают 268 мг целевого продукта.
Физические данные соединений, полученных в эксперименте 7 и примерах 94-118, приведены в табл. 4.
П р и м е р 119. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо) -3-((Е)-3-трис/2-гидроксиэтил/аммонио)-1-пропен-1-ил)-3-цефем- 4-карбоксилат 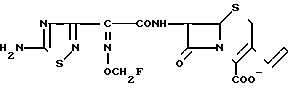

400 мг соединения, полученного в эксперименте 4, растворяли в 4 мл этилацетата и добавляли 96 мг триэтаноламина, растворенного в 4 мл этилацетата. Полученный в результате раствор перемешивают в течение 6 ч при комнатной температуре. К реакционному раствору добавляют 24 мл диизопропилового эфира и полученные в результате осадки собирают фильтрацией. Этот осадок добавляют в 4,5 мл смешанного раствора из трифторуксусной кислоты и анизола (1: 1), охлаждая при этом систему льдом. Полученную смесь в течение полутора часов перемешивают при комнатной температуре. Полученный реакционный раствор добавляют к 18 мл диизопропилового эфира. Полученные в результате осадки собирают фильтрацией и промывают диизопропиловым эфиром. Затем эти осадки суспендируют в 3 мл воды и добавляют ацетат натрия с целью установления pH полученного раствора на значении, равном 6. Нерастворимые вещества удаляют фильтрацией и фильтрат очищают методом обратимо-фазовой хроматографии на колонке с силикагелем, в результате чего получают 17 мг целевого продукта.
П р и м е р 120. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо) -3-((Е)-3-(бис/2-гидроксиэетил/метиламмонио)-1-пропен-1-ил)-3-цефем-4-карбок силат 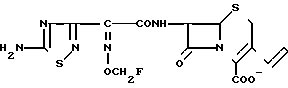

По методике, описанной в примере 119, проводят реакцию между соединением, полученным в эксперименте 4, и 150 мг N-метилдиэтаноламина, после чего осуществляли снятие защитной группы с получением 15 мг целевого соединения. Физические данные соединений примеров 119-120 приведены в табл. 5.
Эксперимент 8 (синтез исходного соединения). 2-(5-Тритиламино-1,2,4-тиадиазол-3-ил)-(Z)-2-цианометоксииминоуксусная кислота: 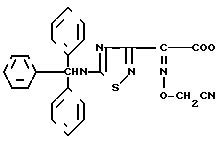 H
H
N-Цианометоксифталимид в количестве 8,00 г суспендируют в 50 мл этанола и при комнатной температуре к полученной суспензии добавляют 1,93 мл гидразин моногидрида. Полученную в результате смесь перемешивают в течение 1 ч и 45 мин. Затем в систему добавляют насыщенный раствор соли и этиловый эфир. Полученную смесь подщелачивают, концентрируют водно-аммиачным раствором и затем экстрагируют этиловым эфиром. Слой этилового эфира промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. Затем растворитель отгоняют.
К остатку добавляют 350 мл метанола и 650 г 2-(5-тритиламино-1,2,4-тиадиазол-3-ил)глиоксалевой кислоты и полученную в результате смесь перемешивают в течение 1 ч при комнатной температуре. После отгонки растворителя остаток растворяют в этилацетате и затем промывают 0,111 мл раствора хлористоводородной кислоты, после чего насыщают рассолом. После сушки органического слоя над безводным сульфатом натрия растворитель отгоняют. В результате получают 7,64 г целевого соединения . Эксперимент 9 (синтез исходного соединения).
п-Метоксибензил 7β-/2-/5-тритиламино-1,2,4-тиадиазол-3-ил)-(Z)-2-цианометоксииминоацетамидо) -3-//Z/-3-хлор-1-пропен-1-ил/-3-цефем-4-карбоксилат 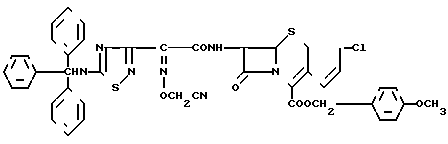
Диметилформамид в количестве 1,51 мл и 18 мл тетрагидрофурана охлаждают до -10оС и добавляют 1,82 мл хлористого фосфорила. Полученную в результате смесь перемешивают в течение 40 мин и охлаждают льдом. Затем в систему добавляют раствор 7,64 г соединения из эксперимента 8 в 24 мл тетрагидрофурана и полученную в результате смесь перемешивают в течение 1 ч при указанной температуре.
Раствор, содержащий 6,00 г п-метоксибензил-7- β -амино-3-((Z)-3-хлор-1-пропен-1-ил)-3-цефем-4-карбоксилат гидрохлорида, 12,8 г N-триметилсилилацетамида и 60 мл этилацетата охлаждают до -25оС. Затем полученную ранее реакционную смесь добавляют к указанному раствору и полученную в результате систему перемешивают в течение 40 мин и в течение этого времени температура повышается до 0оС. Эту реакционную систему экстрагируют этилацетатом и органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. После отгонки растворителя остаток подвергают хроматографической очистке на колонке с силикагелем. В результате получают 7,80 г целевого соединения.
Эксперимент 10 (синтез исходного соединения).
п-Метоксибензил 7- β/2-/5-тритиламино-1,2,4-тиадиазол-3-ил)-(Z)-2-цианометоксииминоацетамидо)-3 -((Е)-3-иод-1-пропен-1-ил)-3-цефем-4-карбоксилат 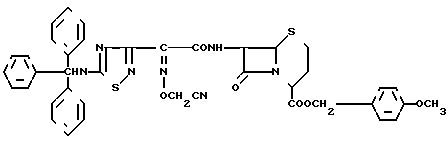
К раствору 7,80 г соединения из эксперимента 9 в 120 мл ацетона добавляют в 6,9 г иодистого натрия при охлаждении системы льдом. Полученную в результате смесь перемешивают в течение 10 мин и затем еще в течение 1,5 ч при комнатной температуре. Отгоняют растворитель и остаток экстрагируют этилацетатом. Экстракт промывают разбавленным водным раствором тиосульфата натрия, затем насыщенным раствором соли и затем сушат над безводным сульфатом натрия. Раствор концентрируют и по каплям добавляют к смеси изопропилового эфира и этилового эфира. Полученный осадок отфильтровывают с получением 6,50 г целевого соединения.
П р и м е р 121. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-цианометоксииминоацетамидо) -3-(Е)-3-((1S-карбамоил-2-гидроксиэтил/-диметиламмонио)-1-пропен-1-ил)-3-цеф ем-4-карбоксилат H2N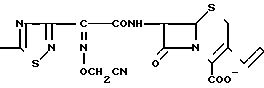
 1,0 г соединения из эксперимента 10 растворяют в 2 мл диметилформамида и при комнатной температуре добавляют 210 мг (1-S-карбамоил-2-гидроксиэтил)диметиламина. Полученную в результате смесь перемешивают в течение 1 ч и затем разбавляют путем добавления в систему 10 мл этилацетата. Полученный в результате раствор по каплям добавляют к 100 мл этилового эфира в результате чего получают 710 мг коричневого осадка.
1,0 г соединения из эксперимента 10 растворяют в 2 мл диметилформамида и при комнатной температуре добавляют 210 мг (1-S-карбамоил-2-гидроксиэтил)диметиламина. Полученную в результате смесь перемешивают в течение 1 ч и затем разбавляют путем добавления в систему 10 мл этилацетата. Полученный в результате раствор по каплям добавляют к 100 мл этилового эфира в результате чего получают 710 мг коричневого осадка.
Этот осадок в течение часа перемешивают в смеси 6 мл анизола и 6,5 мл трифторуксусной кислоты при охлаждении системы льдом. Затем к полученной смеси добавляют этиловый эфир, в результате чего получают 430 мг коричневого остатка. Этот остаток суспендируют в 10 мл воды и pH полученной суспензии устанавливают равным 7,0 с помощью ацетата натрия. После фильтрации нерастворенного вещества фильтрат подвергают обратимо-фазовой хроматографической очистке на колонке с силикагелем, в результате чего получают 50 мг целевого соединения.
П р и м е р 122. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-цианометоксииминоацетамидо)-3-((Е )-3-(1-метил-2R-гидроксиметил-4R-гидрокси-1-пирролидино)-1-пропен-1-ил)-3-це фем-4-карбоксилат H2N
Вещество из эксперимента 10 (1,0 г) растворяют в смеси 10 мл этилацетата и 8 мл этилового эфира. Затем туда добавляют 167 мл N-метил-4R-гидрокси-D-пролинола и полученную в результате смесь перемешивают в течение ночи. Эту реакционную смесь добавляют в 100 мл этилового эфира и полученный таким образом осадок отфильтровывают с образованием 840 мг желтого порошка.
К полученному порошку добавлят 6 мл анизола и в течение 30 мин при охлаждении системы льдом к полученной смеси прикапывают 8 мл трифторуксусной кислоты. Затем полученную смесь перемешивают еще в течение 1,5 ч. В реакционную смесь добавляют 100 мл этилового эфира и образовавшийся в результате этого осадок отфильтровывают и суспендируют в 4 мл воды. pH полученной в результате суспензии устанавливают равным 7,0 с помощью ацетата натрия. После фильтрации нерастворенных веществ фильтрат очищают методом обратимо-фазовой хроматографии на колонке с силикагелем и в результате чего получают 24 мг целевого соединения.
Следующие соединения примеров 123-130 получают тем же методом, что описан в примерах 121 и 122.

В том случае когда в зависимости от аммониевой группы А образовывались изомеры, в табл. 6 приведен выход каждого из изомеров, если он выделен. Физические данные полученных соединений приведены в табл. 7.
П р и м е р 131. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-цианометоксииминоацетамидо) -3-((Е)-3-карбамоилметилдиметиламмоний)-1-пропен-1-ил)-3-цефем-4-карбоксилат H2N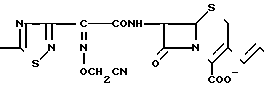
 CONH2
CONH2
Диметилглицинамид (64 мг) добавляют в раствор соединения (390 мг) из эксперимента 10 в этилацетате (15 мл) и полученную смесь перемешивают в течение 1 ч при комнатной температуре. В реакционный раствор добавляют этиловый эфир и образовавшийся осадок отфильтровывают и сушат, в результате чего получают желтовато-коричневый порошок (260 мг).
К этому порошку добавляют смесь трифторуксусной кислоты (2 мл) и анизола (1,5 мл), полученную смесь перемешивают в течение 1 ч при охлаждении системы льдом. К полученному раствору добавляют этиловый эфир и образовавшийся осадок отфильтровывают и промывают этиловым эфиром. Этот осадок суспендируют в воде (5 мл) и pH суспензии устанавливают в интервале 5,5-6,5, после чего отфильтровывают нерастворенное вещество. Фильтрат очищают методом обратимо-фазовой хроматографии в результате чего получают желаемое вещество (37 мг).
П р и м е р 132. 7β-[2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-цианометоксииминоацетамидо] -3-((E)-3-(1-метил-4-сульфамоил-1-пиперазиний)-1-пропен-1-ил)-3-цефем -4-карбоксилат 

Соединение (500 мг) из эксперимента 10 добавляют к смеси дихлорметана (5 мл) и метанола (1 мл) и в полученную смесь добавляют N-сульфамоил-N'-диметилпиперазин (145 мг) и полученную систему перемешивают в течение 4 ч при комнатной температуре. Полученный в результате раствор концентрируют и добавляют этиловый эфир. Полученный осадок отфильтровывают и сушат, в результате чего получают желтовато-коричневый порошок (450 мг).
К этому порошку добавляют смесь трифторуксусной кислоты (3,5 мл) и анизола (3 мл) и полученную смесь перемешивают в течение 1 ч. К полученному в результате раствору добавляют этиловый эфир и образовавшийся осадок отфильтровывают и промывают этиловым эфиром. Этот осадок суспендируют в воде (5 мл) и pH такой суспензии устанавливают равным 5,5-6,5, после чего отфильтровывают нерастворенное вещество. Фильтрат очищают методом обратимо-фазной хроматографии в результате чего получают желаемое вещество (39 мг).
П р и м е р 133. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-цианометоксииминоацетамидо) -3-((Е)-3-(1,4-диазабицикло(2,2,2)-октан-1-оний)-1-пропен-1-ил)-3-цефем-4-ка рбоксилат 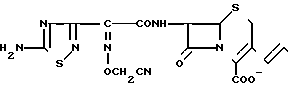
Соединение (500 мг) из эксперимента 10 растворяют в смеси этилацетата (6 мл) и метанола (0,5 мл) и добавляют 1,4-диазабицикло(2,2,2)октан (90 мг) после чего систему перемешивают в течение 20 мин при комнатной температуре. К полученному в результате раствору добавляют этиловый эфир и образовавшийся осадок отфильтровывают и сушат, в результате чего получают желтовато-коричневый порошок (330 мг).
К этому порошку добавляют смесь трифторуксусной кислоты (3 мл) и анизола (2,5 мл) и полученную смесь перемешивают в течение 1 ч при охлаждении системы льдом. К полученному раствору добавляют этиловый эфир и образовавшийся осадок отфильтровывают и промывают этиловым эфиром. Полученный осадок суспендируют в воде (5 мл) и pH суспензии устанавливают равным 5,5-6,5, после чего отфильтровывают нерастворенное вещество. Фильтрат очищают методом обратимо-фазовой хроматографии, в результате чего получают желаемое соединение (48 мг).
Соединения ниже следующих примеров 134-137 были получены тем же способом, что и в примерах 131-133.
П р и м е р 134. 7-β-(-2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-цианометоксииминоацетамидо)-3-( (Е)-3-(4-карбамоилпиридиний)-1-пропен-1-ил)-3-цефем-4-карбоксилат 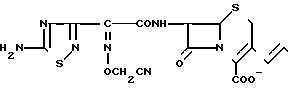

Соединение (600 мг) эксперимента 10 реагировало с 4-карбамоилпиридином (235 мг) и защитную группу удаляли с получением целевого вещества (36 мг).
П р и м е р 135. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-цианометоксииминоацетамидо) -3-[(E)-(1,3/4-оксадиазол-2-ил)метилдиметиламмоний)-1(-пропен-1-ил)-3-цефем- 4-карбоксилат H2N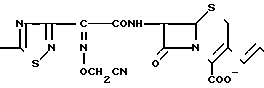
Проводили реакцию между соединением (600 мг) из эксперимента 10 в 2-диметиламинометил-1,3,4-оксадиазолом (163 мг), после чего защитную группу удаляли с образованием желаемого вещества (54 мг).
П р и м е р 136. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-цианометоксииминоацетамидо) -3-(Е)-3-(1,2-диметил-1-пиперазиний)-1(-пропен-1-ил)-3-цефем-4-карбоксилат(и зомеры: А и В) H2N
Проводили реакцию между соединением (510 мг) из эксперимента 10 с 1,2-диметилпиразолидином (0,4 мл) и защитную группу удаляли с образованием желаемого изомера A (20 мг) и желаемого изомера B (20 мг).
П р и м е р 137. 7β-(2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-цианометоксииминоацетамидо) -3-((Е)-3-(1/5-диазабицикло/3/3/0/октан-1-оний-1-пропен-1-ил)-3-цефем-4-карб оксилат 

Проводили реакцию между соединением (600 мг) из эксперимента 10 в 1,5-диазабицикло(3,3,0)октаном (220 мг), после чего защитную группу удаляли с получением желаемого вещества (39 мг). Физические данные соединений примеров 131-137 приведены в табл. 8.
Эксперимент 11 (синтез исходного соединения).
Гидрохлорид хлорангидрида 2-(5-тритиламино-1,2,4-тиадиазол-3-ил-(Z)-2-фторметоксииминоуксусной кислоты 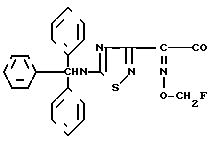 Cl
Cl
Пятихлористый фосфор (395 мг) растворяют в дихлорметане (2,9 мл) и раствор охлаждают до -5оС. К полученному раствору добавляют соединение (627 мг) эксперимента 2 и полученную систему перемешивают в течение 2,5 ч при указанной температуре. Реакционный раствор добавляют к смеси н-гексана (9,4 мл) и н-октана (9,4 мл). Полученное в результате кристаллическое вещество собирают фильтрацией и промывают н-октаном с получением целевого продукта (325 мг).
Температура плавления: 139-140оС (разложение).
Масс-спектр (m/e): M+. . . . 480 (35Cl), 482 (37Cl).
ИК-спектр (см-1, ньюол): 1795, 1780, 1740, 1630
ЯМР-спектр ( δ , ДМСО-d6): 5,79 (2Н, дублет, J-54 Гц), 7,31 (15н, синглет), 10,09 (1Н, синглет).
Эксперимент 12 (синтез исходного соединения).
2(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоуксусная кислота, этиловый эфир 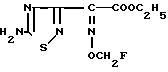
Соединение (2,00 г) из эксперимента 1 перемешивают в течение 30 мин при комнатной температуре в среде трифторуксусной кислоты. Растворитель отгоняют и остаток подвергают хроматографической очистке на колонке с силикагелем с получением целевого продукта (405 мг).
Температура плавления: 172-173оС.
ИК-спектр (см-1, ньюол): 1730, 1615.
ЯМР-спектр ( δ , ДМСО-d6): 1,28 (3Н, триплет, J = 7,0 Гц), 4,34 (2Н, квартет, J = 7,0 Гц), 5,83 (2Н, дублет, J = 54,5 Гц), 8,27 (2Н, широкий синглет).
Эксперимент 13 (синтез исходного соединения).
2-(5-Амино-1,2,3-тиадиазол-3-ил)-(Z)-2-фторметоксииминоуксусная кислота 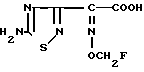
Соединение (200 мг) из эксперимента 12 суспендируют в смеси этанола (6 мл) и воды (2 мл), добавляют 1 н. водный раствор гидроксида натрия (1,75 мл) и полученную смесь перемешивают в течение 1 ч при 60оС. Этанол отгоняют из реакционного раствора и pH раствора устанавливают равным 2 с помощью 1 н. хлористоводородной кислоты. Полученный в результате раствор очищают с помощью "Диа-Ион Р207" (торговое название неионной адсорбционной смолы выпускаемой Митсубиши Кэмикл Индастриез Лтд) с образованием целевого продукта (30 мг).
ИК-спектр (см-1, ньюол): 1720, 1620.
ЯМР-спектр ( δ , ДМСО-d6): 5,74 (2Н, дублет, J = 55 Гц), 8,24 (2Н, широкая).
Эксперимент 14 (синтез исходного соединения).
п-Метоксибензил 7β-/2-(5- тритиламино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамидо)-3-(Z)-3-х лор-1-пропен-1-ил)-3-цефем- 4-карбоксилат: 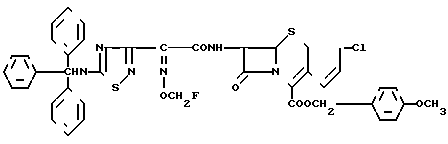
К смеси этилацетата (37 мл), тетрагидрофурана (5 мл) и дихлорметана (15,7 мл) добавляют N-(триметилсилил)ацетамид (8,17 г) и п-метоксибензил 7 β -амино-3-((Z)-3-хлор-1-пропен-1-ил)-3-цефем-4-карбоксилат гидрохлорид (3,33 г) с целью растворения последних веществ. Полученный раствор охлаждают до -20оС, затем добавляют соединение из эксперимента 11 (3,80 г) и полученную смесь перемешивают в течение 1 ч при 10оС. После добавления этилацетата (500 мл) полученную смесь последовательно промывают водой, насыщенным водным раствором бикарбоната натрия, 1 н. хлористоводородной кислотой и насыщенным раствором соли, после чего полученную систему высушивают над безводным сульфатом магния. Растворитель отгоняют, а остаток подвергают хроматографической очистке на колонке с силикагелем с получением целевого продукта (4,33 г).
ИК-спектр и спектр ЯМР полученного в результате продукта соответствовал спектрам, приведенным в эксперименте 3.
Эксперимент 15 (синтез исходного соединения).
2-Циано-2-фторметоксииминоацетамид: NC- -
-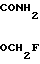
2-Циано-2-гидросииминоацетамид (22,6 г) растворяют в диметилсульфоксиде (100 мл) и в систему добавляют карбонат калия ( 55,2 г), перемешивая раствор при комнатной температуре, после чего полученный раствор дополнительно перемешивают еще в течение 20 мин. Затем к раствору добавляют фторбромметан (27 г), растворенный в диметилформамиде (20 мл) и полученную смесь перемешивают в течение 20 ч при комнатной температуре и затем дают охлаждаться. Реакционный раствор переливают в смесь воды со льдом (1 л) и дважды экстрагируют этилацетатом (150 мл). Органический слой дважды промывают насыщенным раствором соли и сушат, добавляя в систему безводный сульфат магния, после чего отгоняют растворитель. Остаток промывают этиловым эфиром и сушат с получением целевого продукта (14,4 г).
Температура плавления: 124-125оС.
ИК-спектр (см-1, ньюол): 3410, 3290, 3150, 1690, 1590.
Спектр ЯМР ( δ , ДМСО-d6): 5,94 (2Н, дублет, J = 54,0 Гц), 7,85-9,40 (2Н, широкая).
Эксперимент 16 (синтез исходного соединения).
2-Фторметоксииминопропандинитрил: 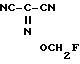
Смесь, содержащая соединение (14,0 г), полученное в эксперименте 15, ацетонитрил (15 мл), хлористый натрий (15 г) и хлористый фосфорил (14 мл) реагировали при нагревании с обратным холодильником в течение 2 ч. К полученной смеси добавляют хлористый фосфорил (5 мл) и системе дают реагировать в течение 2 ч. После охлаждения реакционный раствор добавляют в смесь воды со льдом (200 мл) и смесь перемешивают при комнатной температуре в течение 1 ч. Полученный раствор дважды экстрагируют метиленхлоридом (50 мл). Экстракт промывают 8% -ным водным раствором бикарбоната натрия и насыщенным раствором соли и затем сушат над добавленным в систему безводным сульфатом магния. Растворитель отгоняют. Полученный в результате маслянистый продукт подвергают дистилляции при пониженном давлении с получением бесцветного маслообразного целевого вещества (9,1 г).
Температура кипения: 69-70оС/25 мм Н
Спектр ЯМР ( δ , CДCl3): 5,85 (2Н, дублет, J = 52,0 Гц).
Эксперимент 17 (синтез исходного соединения).
2-Циано-2-фторметоксииминоацетамидин:  C-
C-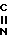 -
-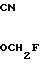
Смешанный раствор, содержащий 28% водного аммиака (50 мл), хлористый аммоний (8 г) и этанол (50 мл), охлаждают до -5оС, после чего, при перемешивании добавляют соединение (9,1 г), полученное в экперименте 16, и затем смесь дополнительно перемешивают при этой же температуре в течение 3 ч. В рекционный раствор добавляют воду (100 мл). Полученный раствор трижды экстрагируют хлористым метиленом (50 мл). После сушки экстракта над безводным сульфатом магния растворитель отгоняют. Остаток промывают этиловым эфиром и сушат с получением целевого продукта (3,4 г).
Часть продукта растворяют в этаноле и при перемешивании прикапывают ледяную уксусную кислоту. Полученные в результате осадки удаляют фильтрацией и промывают этанолом, после чего сушат с образованием ацетата целевого соединения. Полученный продукт имел следующие физические характеристики.
Температура плавления: 125-127оС
ИК-спектр (см-1, ньюол): 3200, 1670, 1570
ЯМР-спектр ( δ , ДМСО-d6): 1,90 (3Н, синглет), 5,95 (2Н, дублет, J = 54,0 Гц), 7,40 (3Н, широкая).
Эксперимент 18 (синтез исходного соединения). 2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Е)-2-фторметоксииминоацетонитрил: 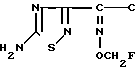 N
N
Соединение (3,0 г), полученное в эксперименте 17, растворяют в метаноле (50 мл) и добавляют триэтиламин (4,2 г). После охлаждения растворов до -6оС прикапывают бром (3,5 г). После этого при температуре (-3)-(-5)оС прикапывают раствор тиоцианата калия (2,1 г) в метаноле и полученный раствор в течение 2 ч перемешивают при такой же температуре. Полученные в результате осадки регенерируют фильтрацией и промывают водой и метанолом. Затем эти осадки перекристаллизовывают из ацетона с получением целевого продукта (3,4 г).
Температура плавления: 236-238оС.
ИК-спектр (см-1, ньюол): 3450, 3250, 3075, 1610, 1520.
ЯМР-спектр (ДМСО-d6): 6,02 (2Н, дублет, J = 54,0 Гц), 8,32 (2Н, широкая).
Эксперимент 19 (синтез исходного соединения).
2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоацетамид: 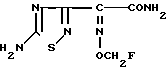
К раствору гидроксида натрия (0,23 г) в воде (18 мл) добавляют 35% -ный раствор пероксида водорода (7,4 мл). При перемешивании при комнатной температуре добавляют соединение (2,0 г), полученное в эксперименте 18. Полученный раствор дополнительно перемешивают в течение 8 ч при 25-30оС. Образовавшиеся осадки выделяют фильтрацией после чего их сушат с получением целевого продукта (1,3 г).
Температура плавления: 210-211оС.
ИК-спектр (см-1, ньюол): 3450, 3260, 3180, 1690, 1610
ЯМР-спектр ( δ , ДМСО-d6): 5,73 (2Н, дублет, J = 55,0 Гц), 7,69 (2Н, широкая), 7,98 (1Н, широкая), 8,10 (1Н, широкая).
Эксперимент 20. 2-(5-Амино-1,2,4-тиадиазол-3-ил)-(Z)-2-фторметоксииминоуксусная кислота: 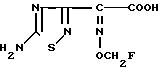
Смесь, содержащую соединение (1,1 г), полученное в эксперименте 19, и 2 н. водный раствор гидроксида натрия (10 мл), перемешивают в течение 5 ч при 50оС. Реакционную смесь охлаждают и с помощью концентрированной хлористоводородной кислоты, устанавливают pH 1,0, после чего смесь трижды экстрагируют этилацетатом (20 мл). После добавления к экстракту безводного сульфата магния и последующей сушки растворитель отгоняют. Остаток промывают изопропиловым эфиром с образованием сырого продукта (0,8 г). Сырой продукт очищают методом обратимо-фазовой хроматографии на колонке с силикагелем с получением целевого продукта (0,4 г).
ИК-спектр и спектр ЯМР полученного продукта были идентичны спектрам продукта из эксперимента 13.
Острую токсичность и антибактериальную активность соединений, полученных согласно изобретению, определяли следующим образом.
Острая токсичность на мышах:
Соединения, полученные согласно изобретению и растворенные в физиологических растворах, дозировали внутривенно пяти самцам мышей разновидности ICP в возрасте 6 недель. В результате этого было установлено, что значения острой токсичности для соединений полученных в следующих примерах во всех случаях превосходили 2 г/кг.
Номера примеров:
1,2-1, 2-2, 3-1, 3-2, 5, 6-1, 6-2, 7-1, 7-2, 9-1, 9-2, 9-3, 10, 11, 12, 13-1, 13-2, 79, 97, 111, 121, 122, 126, 127, 130, и 131.
Антибактериальная активность (MIC):
Значения MIC (мг/мл) определяли методом разбавления на агаре (хемотерапия (Япония), 29, 76-79, 1981). Оставленные на ночь культура бактериальных штаммов в бульоне Мюллера-Хинтона разбавляли до конечной концентрации порядка 106СГУ/мл и по 5 мл каждой бактериальной суспензии наносили на агаровые пластины Мюллера-Хинтона, содержащие двухкратные серийные разбавления антибиотиков. Значения MIC измеряли после инкубирования в течение 18 ч при 37оС.
В качестве контрольных соединений использовали СА (Цефатазимид) и СТМ (сефотиам). Результаты представлены в табл. 9.
Антибактериальная активность (MIC):
Проводили сравнительные испытания на антибактериальную активность между соединениями следующей ниже формулы: 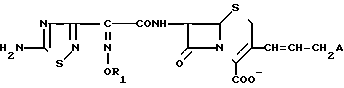 согласно изобретению и соответствующим контрольным соединениям, в которых R1 представляет собой метильную группу. Измерения MIC осуществляли в соответствии с описанным в пункте 2. Полученные результаты представлены в табл. 10. (56) Патент Великобритании N 2157293, кл. С 07 D 501/24, 1985.
согласно изобретению и соответствующим контрольным соединениям, в которых R1 представляет собой метильную группу. Измерения MIC осуществляли в соответствии с описанным в пункте 2. Полученные результаты представлены в табл. 10. (56) Патент Великобритании N 2157293, кл. С 07 D 501/24, 1985.
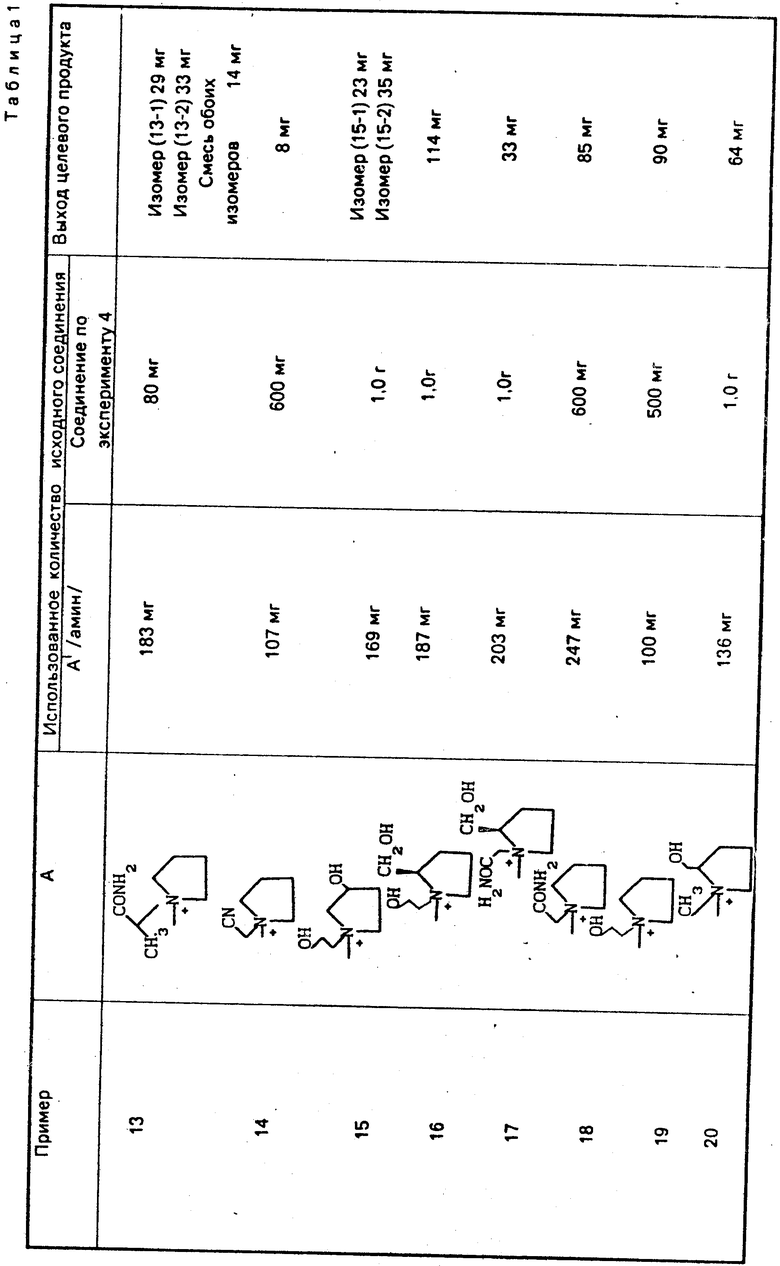
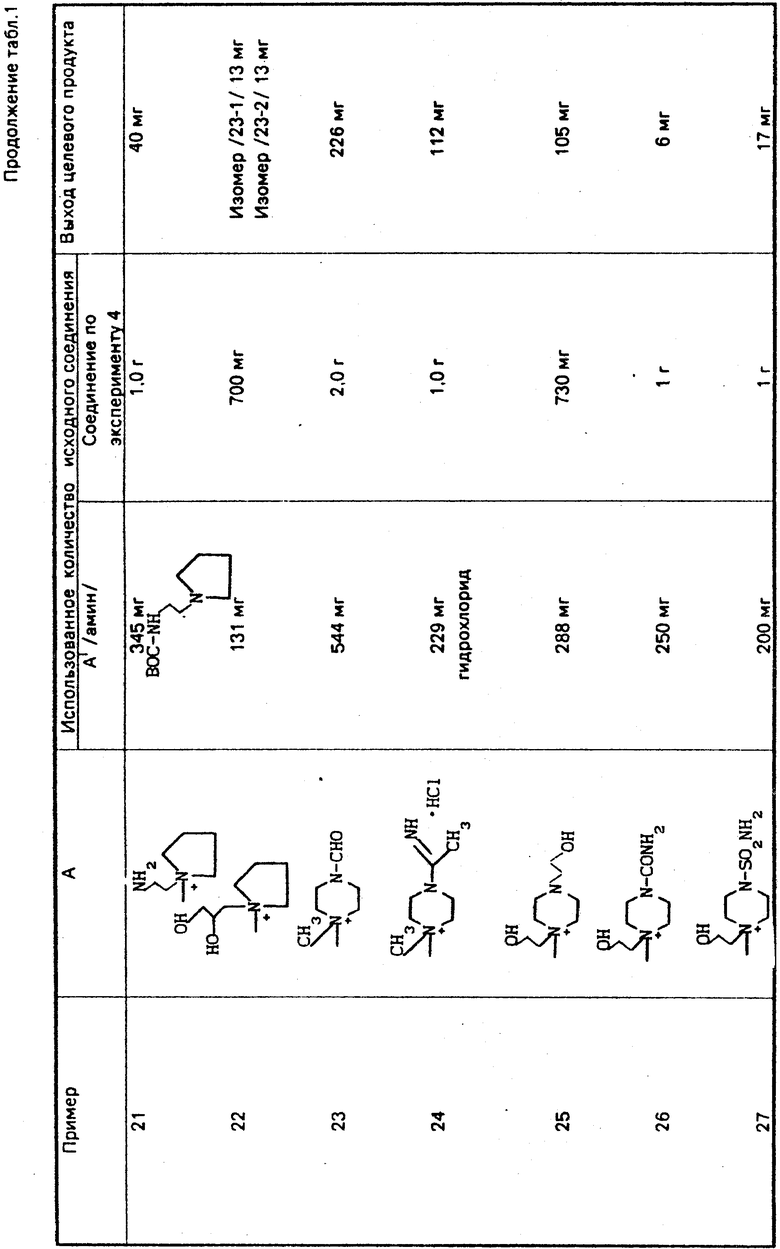
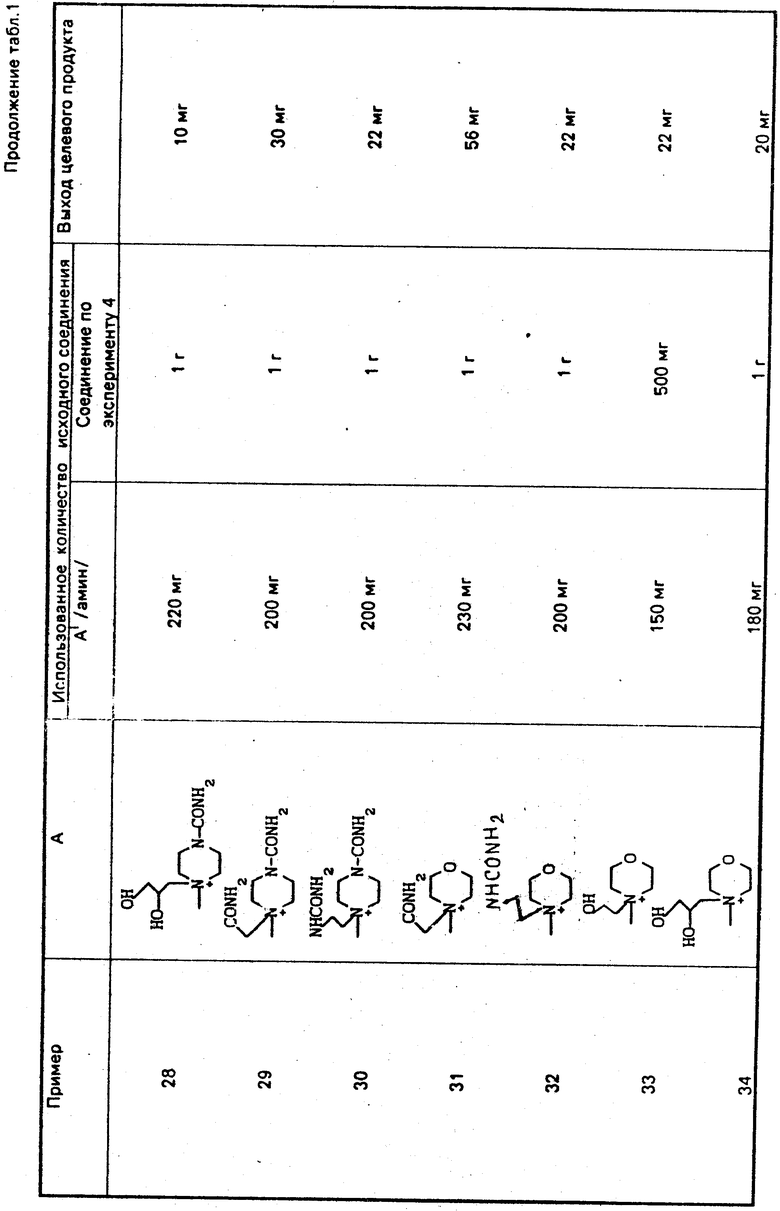


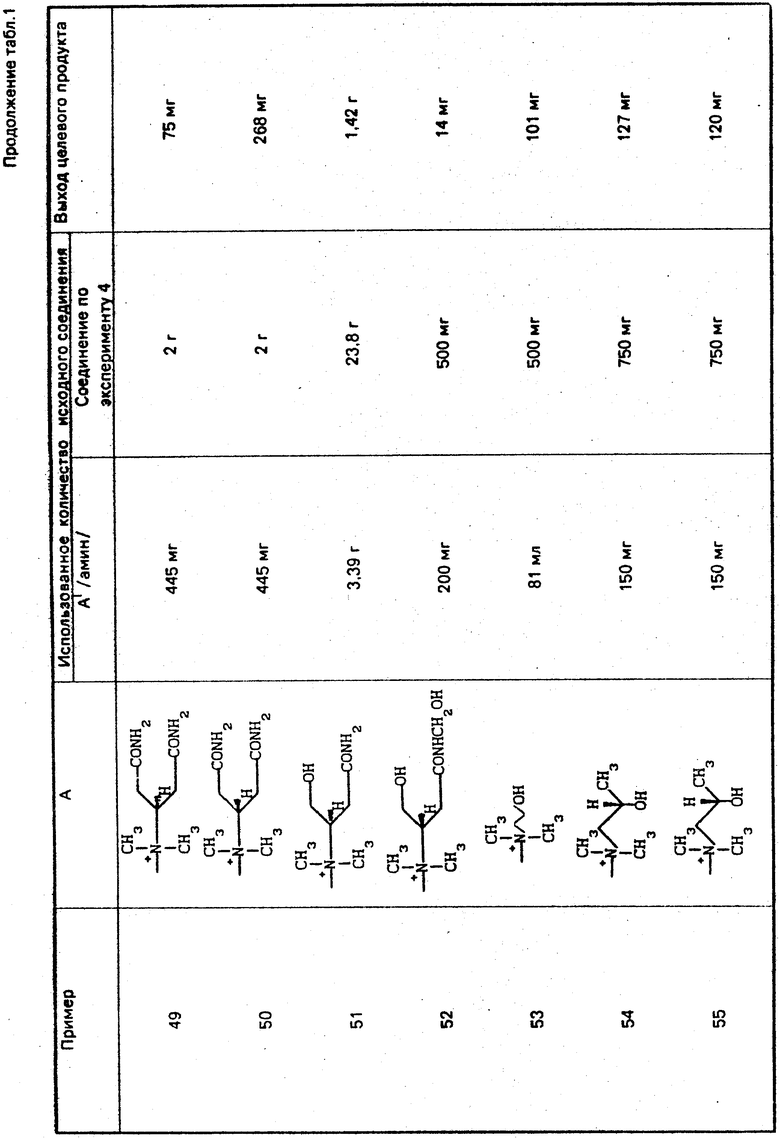

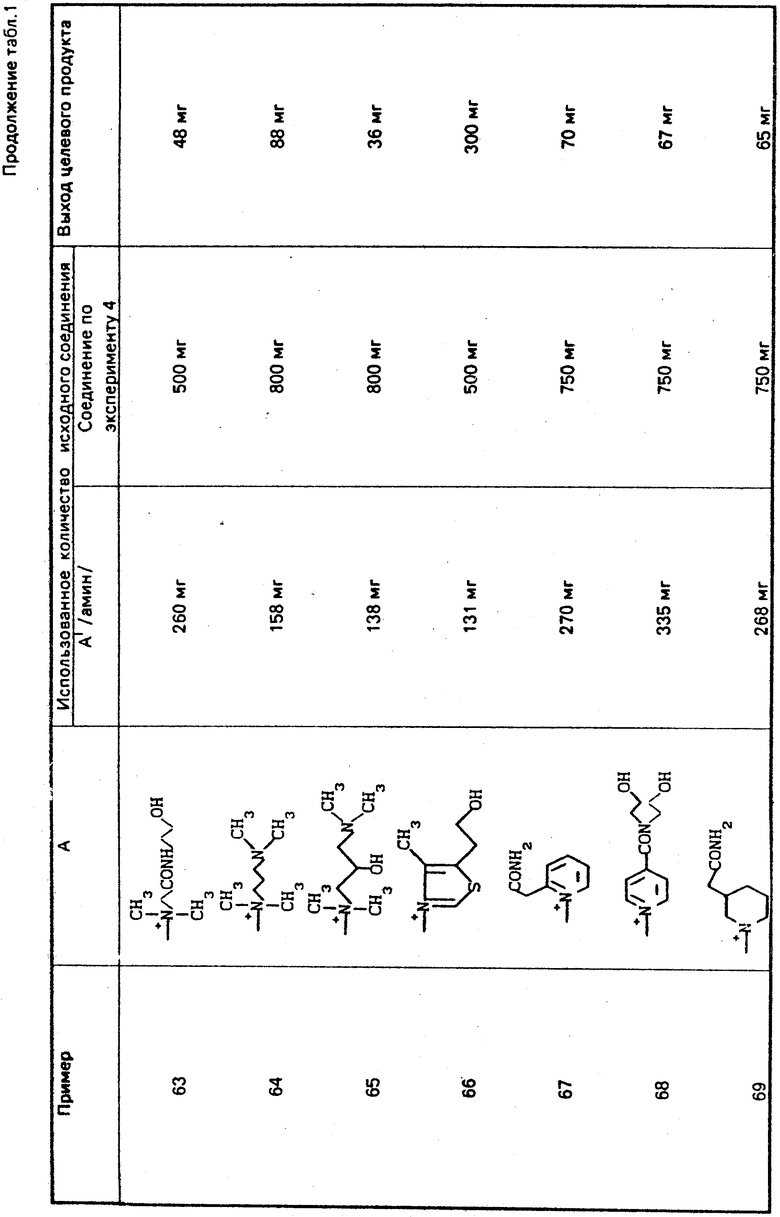
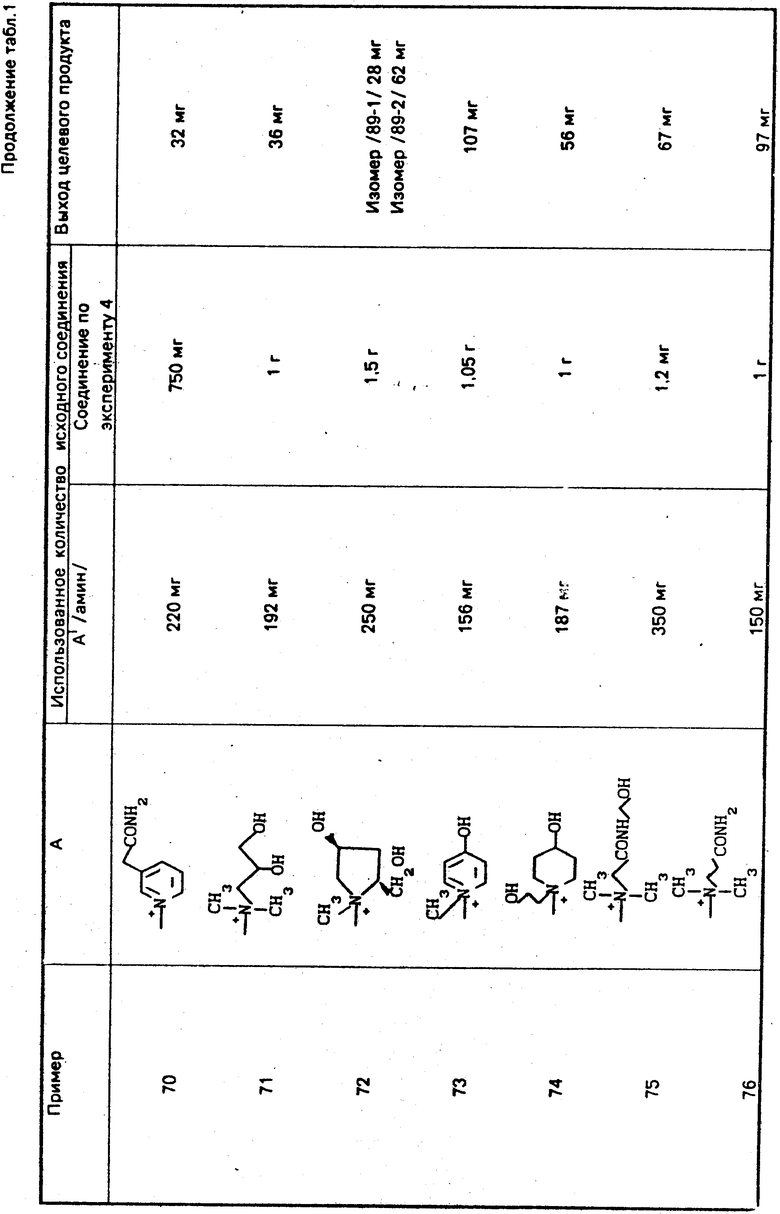
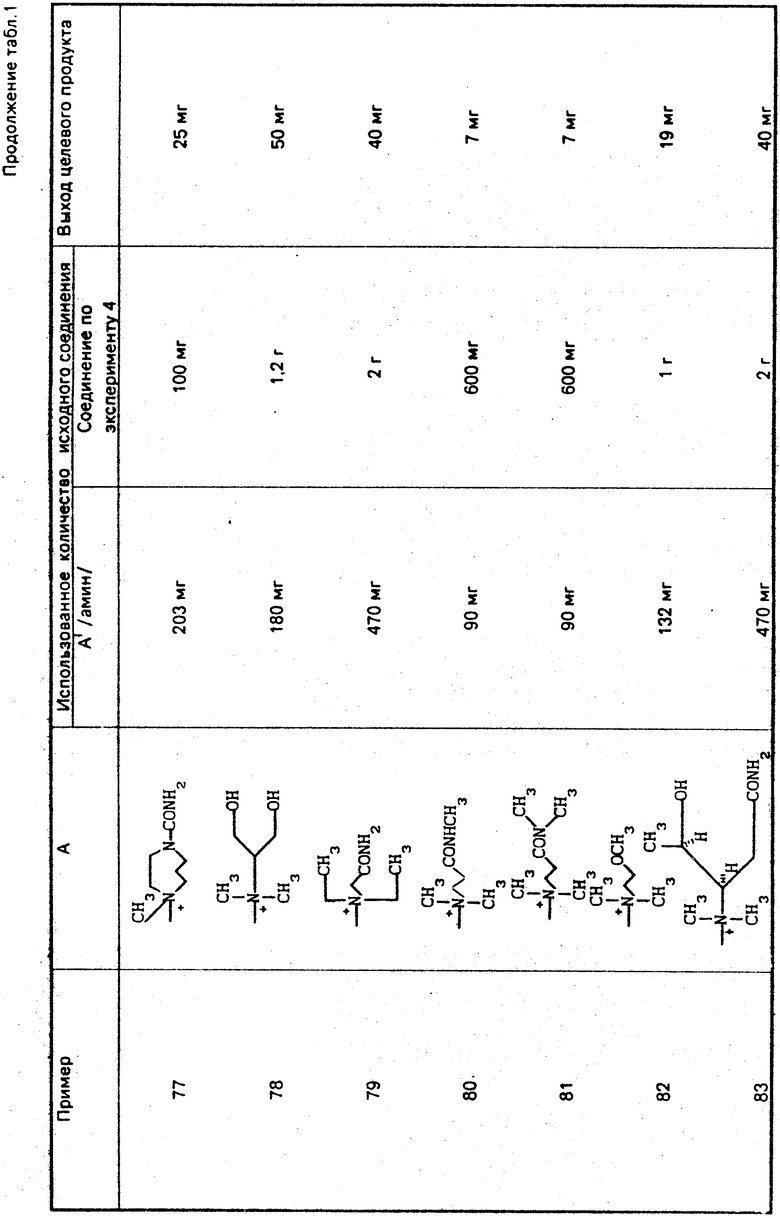
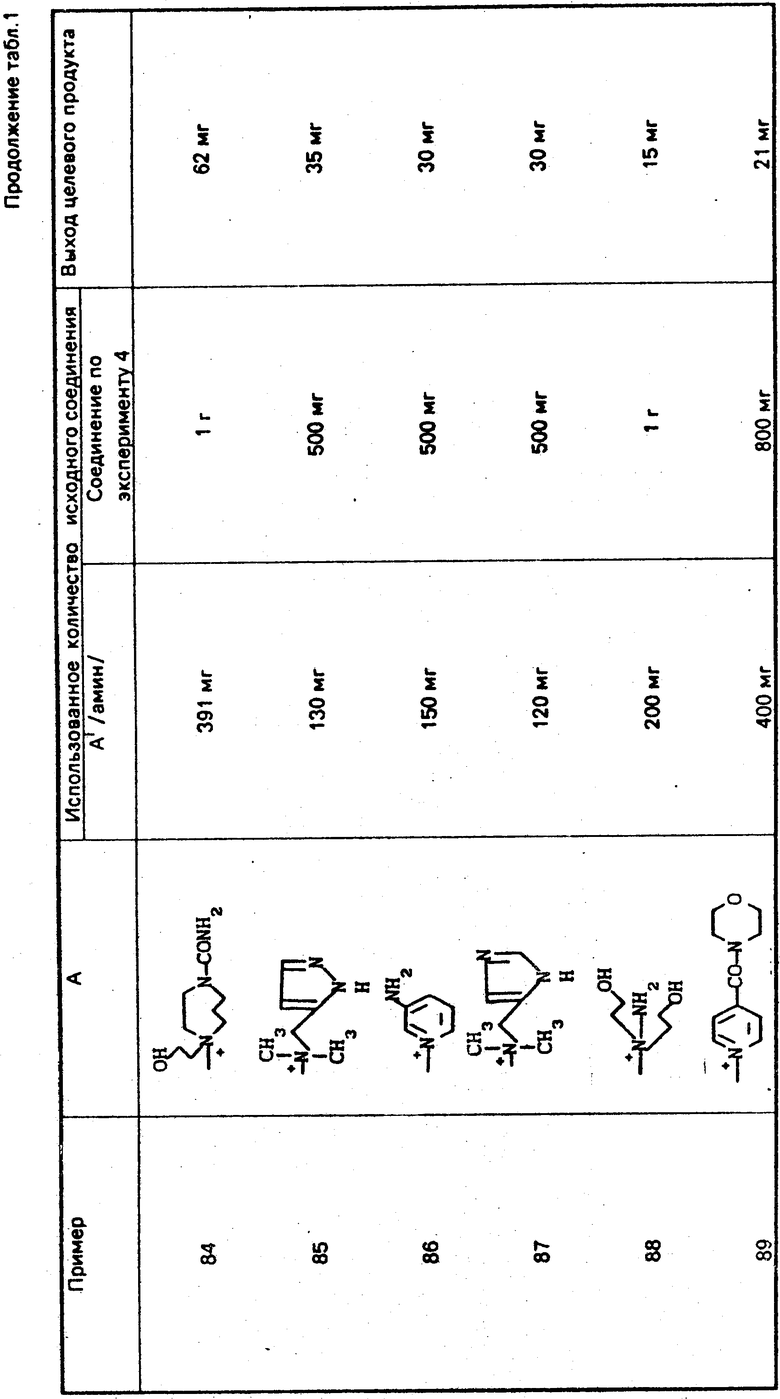
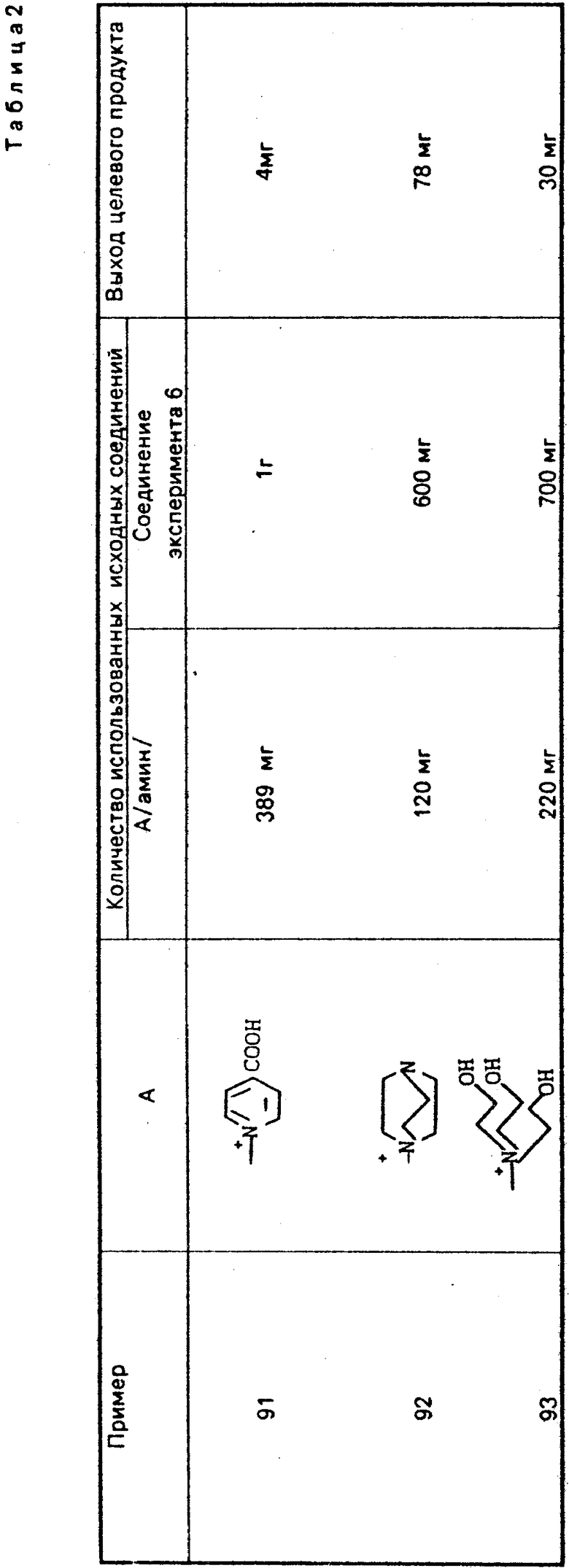








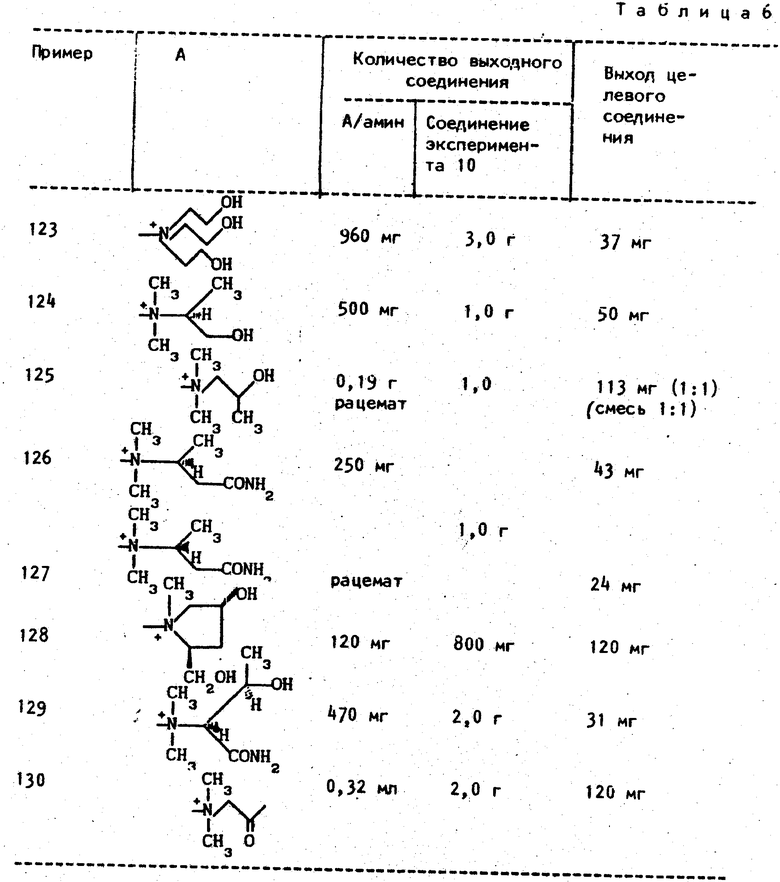



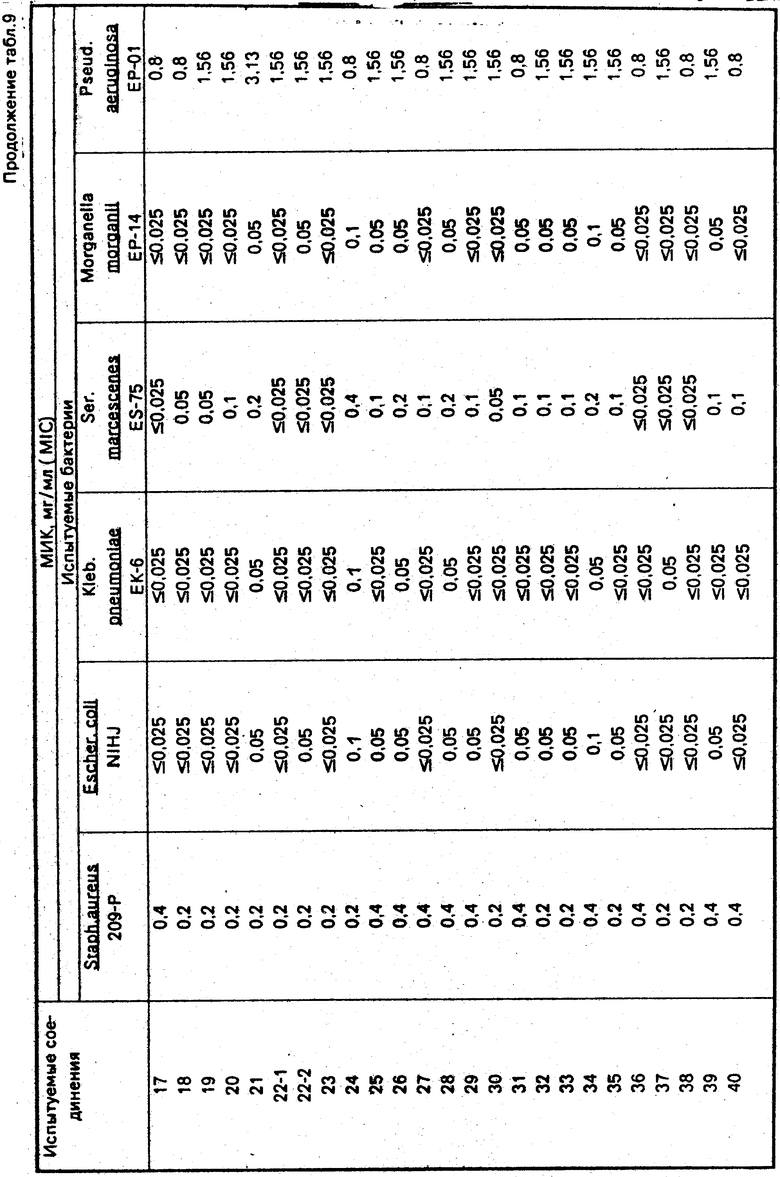
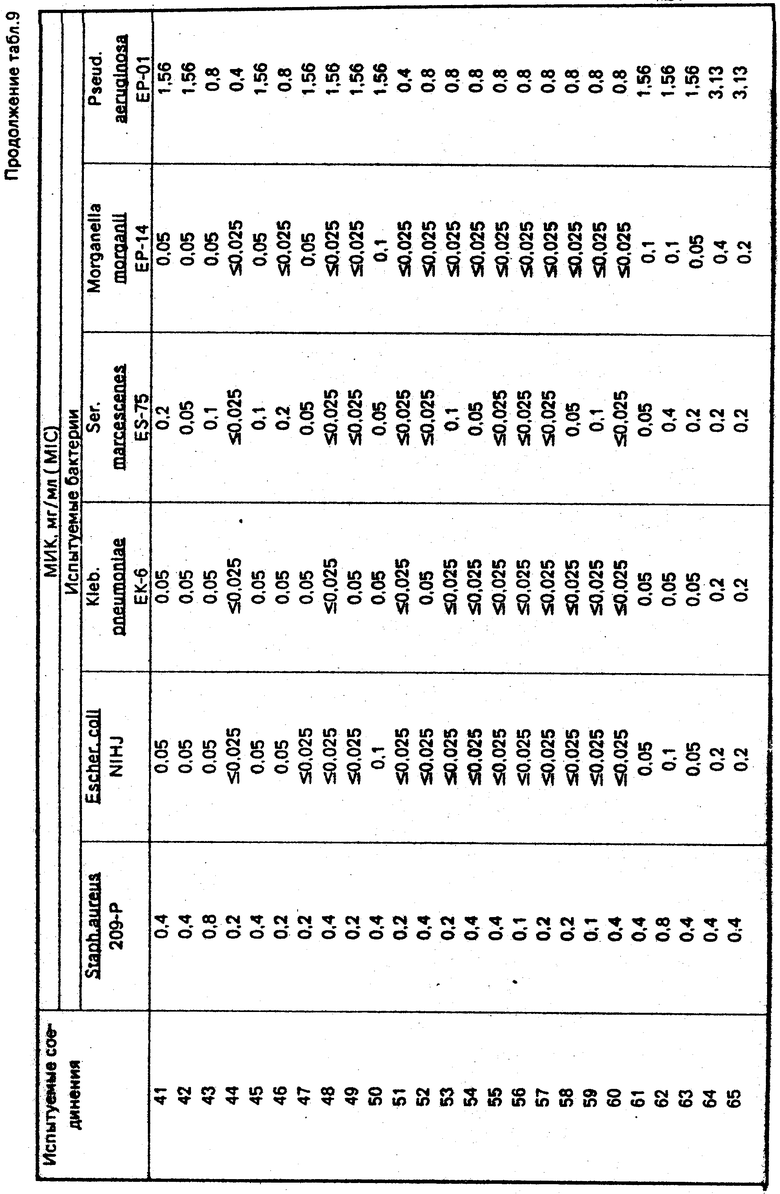
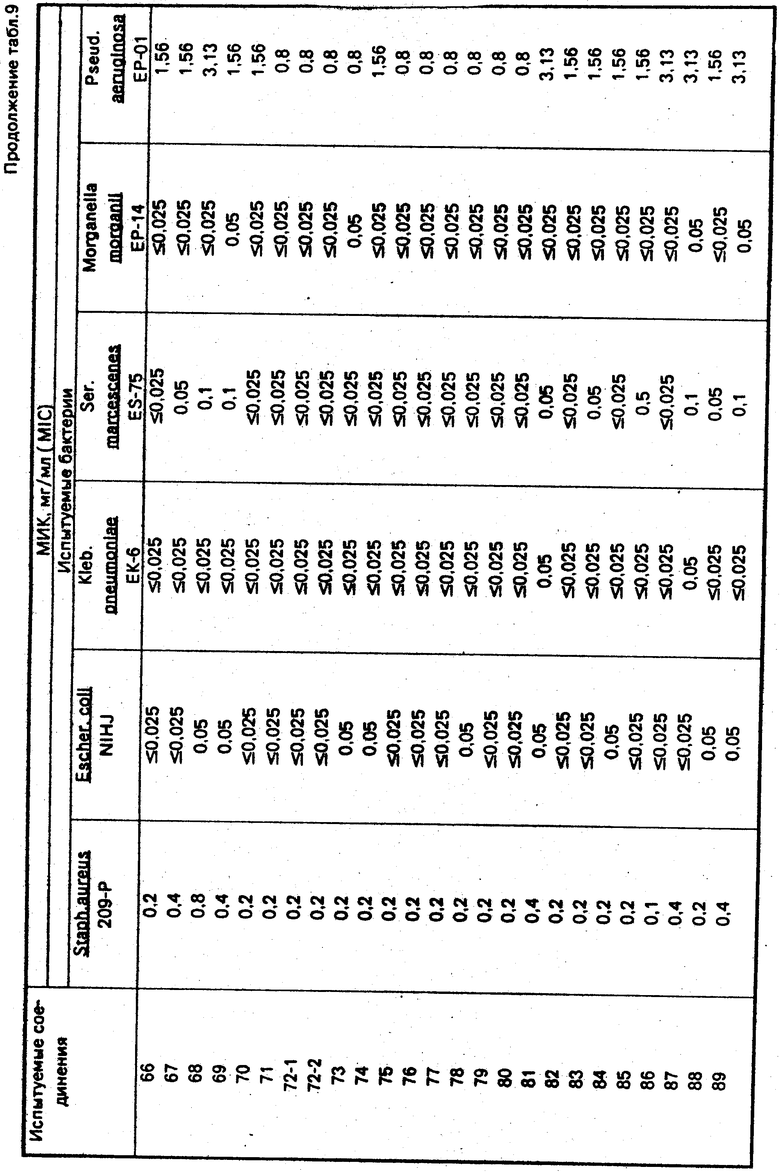
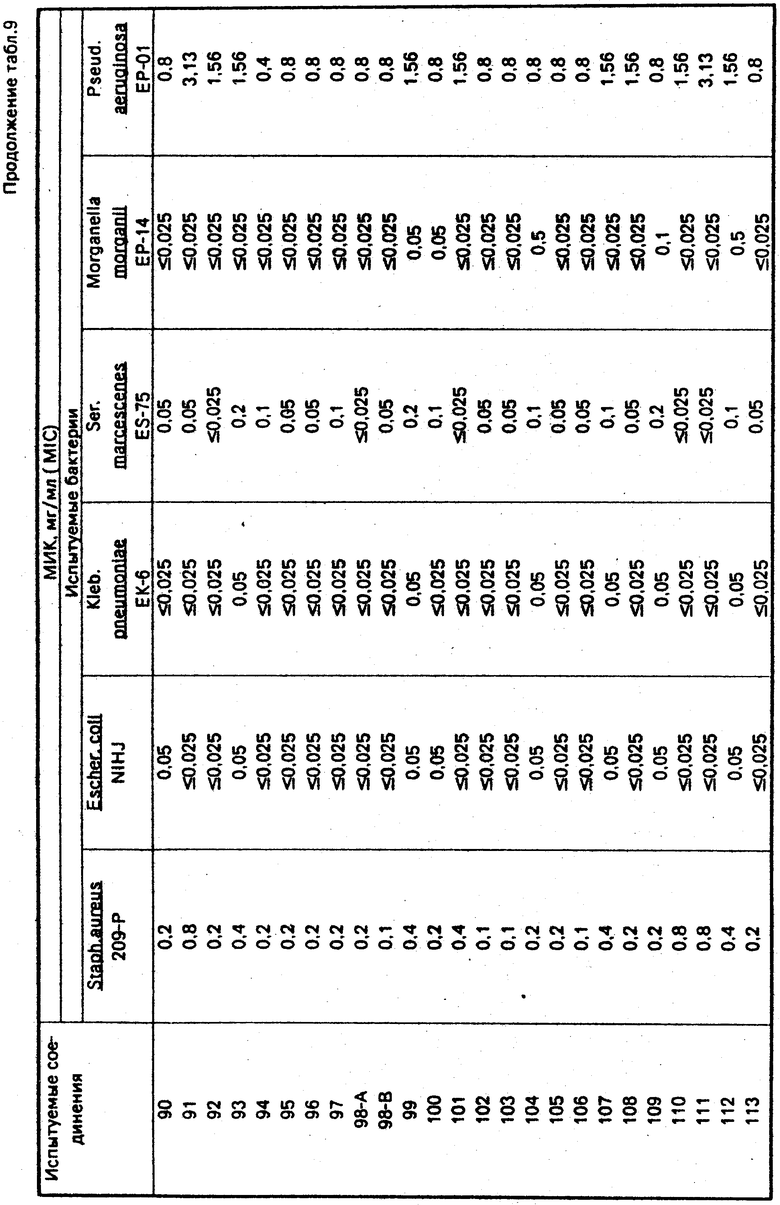
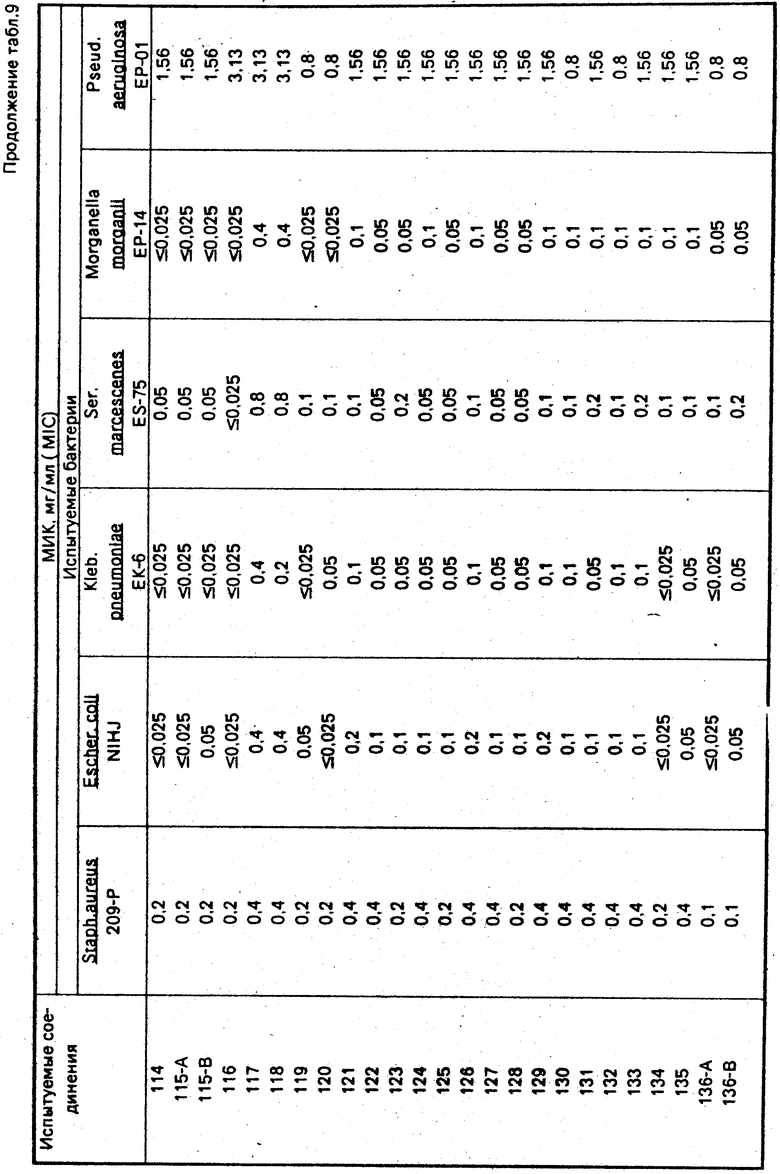

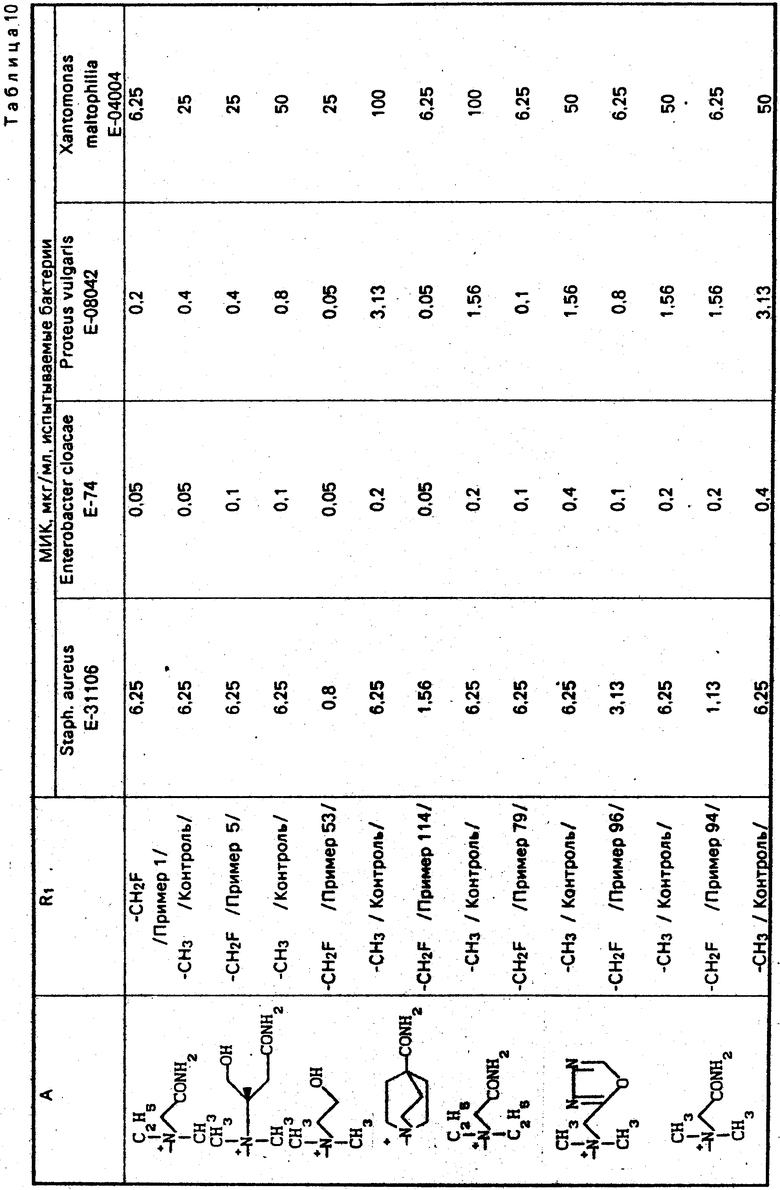
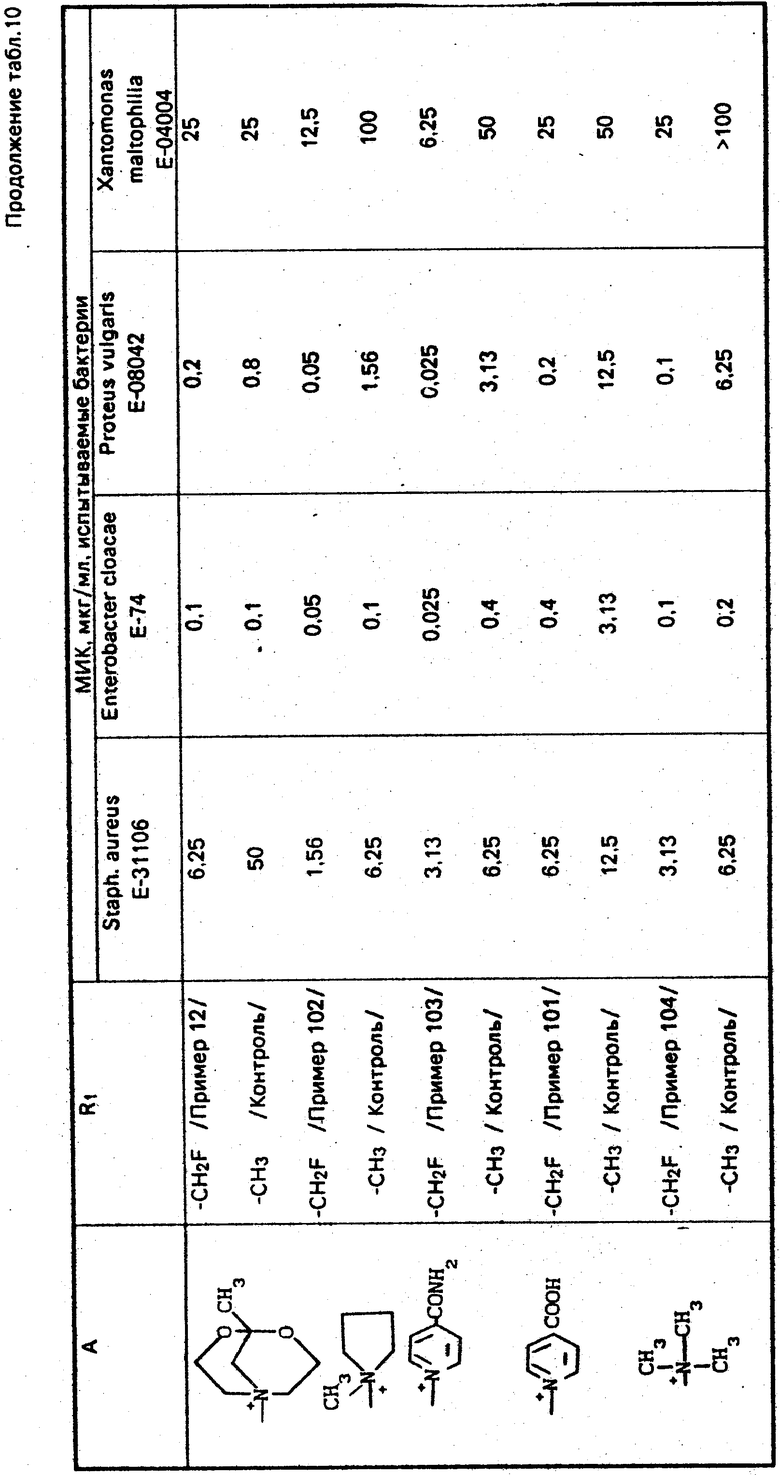
Использование: в фармацевтической промышленности в качестве антибактериальных агентов. Сущность изобретения: получение производных 3-пропенилцефема общей ф-лы I (см. рис. ) при определенных значениях R и А. Реагент 1: соединение ф-лы II (см. рис. ) в которой R представляет собой группу CH2F или CH2CN , или CHF2, или CH2CF3, x - атом галогена, и амино и/или карбоксильная группа защищены защитными группами, или его соль. Реагент 2: амин, соответсвующий А, в котором функциональные группы защищены защитными группами, или его соль. 10 табл.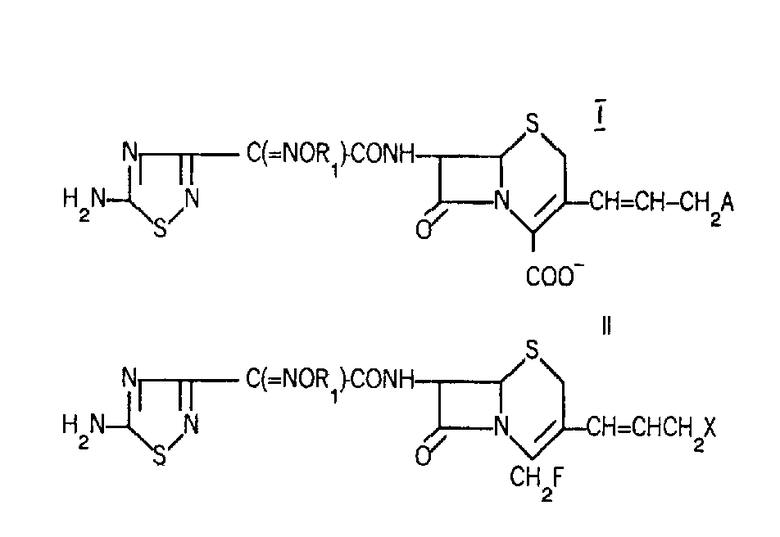
Способ получения производных 3-пропенилцефема общей формулы I
H2N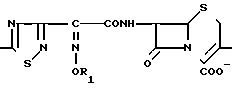 CH= CHCH2A
CH= CHCH2A
где при R1 - группа CH2F А является ациклической аммониевой группой следующей общей формулы II R4
R4
где R2, R3 и R4 - одинаковые или различные, независимо друг от друга представляют собой группу, выбранную из ряда, содержащего низшую алкильную группу, гидроксилзамещенную низшую алкильную группу, карбамоилзамещенную низшую алкильную группу, аминогруппу, (низший алкил)аминокарбонилзамещенную низшую алкильную группу, (низший алкил)карбониламинозамещенную низшую алкильную группу, цианозамещенную низшую алкильную группу, гидроксил- и карбамоилзамещенную низшую алкильную группу, гидроксил- и гидрокси (низший алкил) аминокарбонилзамещенную низшую алкильную группу, гидроксиаминокарбонилзамещенную низшую алкильную группу, карбамоил (низший алкил) аминокарбонилзамещенную низшую алкильную группу, гидрокси (низший алкил) аминокарбонилзамещенную низшую алкильную группу, аминозамещенную низшую алкильную группу, ди(низший алкил) аминозамещенную низшую алкильную группу, ди(низший алкил) амино- и гидроксилзамещенную низшую алкильную группу, уреидогруппу, оксозамещенную низшую алкильную группу, (низший алкил) оксизамещенную низшую алкильную группу, ди(низший алкил) аминокарбонилзамещенную низшую алкильную группу, дикарбамоилзамещенную низшую алкильную группу, низшую алкильную группу, замещенную бис [гидрокси (низший алкил)] аминокарбонильной группой, дигидроксилзамещенную низшую алкильную группу, тригидроксилзамещенную низшую алкильную группу и низшую алкильную группу, замещенную пиразолилом, или имидазолилом, или оксадиазолилом, или тетразолилом, или А представляет собой циклическую аммониевую группу, выбранную из групп следующих общих формул: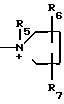
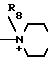 N__R9
N__R9 N__R11
N__R11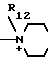 N__R13
N__R13


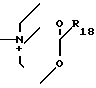
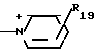
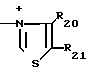
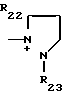
 N
N N
N S
S
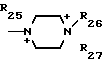
где R5 - низший алкил, карбамоилзамещенный низший алкил, цианозамещенный низший алкил, гидроксилзамещенный низший алкил, аминозамещенный низший алкил, дигидроксилзамещенный низший алкил;
R6 и R7 независимо друг от друга - водород, гидроксил, гидроксилзамещенный низший алкил;
R8 - низший алкил, карбамоилзамещенный низший алкил, гидроксилзамещенный низший алкил, уреидозамещенный низший алкил, дигидроксилзамещенный низший алкил;
R9 - водород, гидроксилзамещенный низший алкил, сульфогруппа, формил, карбамоил, сульфамоил, иминозамещенный низший алкил;
R10 - низший алкил, гидроксилзамещенный низший алкил, карбамоилзамещенный низший алкил;
R11 - карбамоил, гидроксил;
R12 - гидроксилзамещенный низший алкил;
R13 - карбамоил, гидроксииминозамещенный низший алкил;
R14 - низший алкил, гидроксилзамещенный низший алкил;
R15 - карбамоил;
R16 - карбамоил;
R17 - карбамоилзамещенный низший алкил, уреидозамещенный низший алкил, гидроксилзамещенный низший алкил, дигидроксилзамещенный низший алкил;
R18 - низший алкил;
R19 - карбамоил, аминогруппа, карбоксил, карбамоилзамещенный низший алкил, карбоксилзамещенный низший алкил, морфолинокарбонил, гидрокси (низший алкил) аминокарбонил, бис [гидрокси (низший алкил)] аминокарбонил, сульфогруппа;
R20 - низший алкил;
R21 - гидроксилзамещенный низший алкил;
R22, R23, R24, R25, R26 и R27 - низший алкил;
или при R1 - группа CH2CN А представляет собой ациклическую аммониевую группу формулы II, где R2, R3 и R4 представляют собой независимо друг от друга низшую алкильную группу, гидроксилзамещенную низшую алкильную группу, гидроксил- и карбамоилзамещенную низшую алкильную группу, карбамоилзамещенную низшую алкильную группу, оксозамещенную низшую алкильную группу и низшую алкильную группу, замещенную оксадиазолилом, или А представляет собой циклическую аммониевую группу одной из следующих общих формул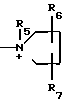
 N__R9
N__R9 ,
, 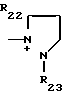
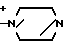
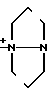
где R5, R8, R22 и R23 - низший алкил;
R6 - гидроксил;
R7 - гидроксилзамещенный низший алкил;
R9 - сульфамоил;
R19 - карбамоил,
или при R1 - группа CHF2 А представляет собой ациклическую аммониевую группу формулы II, где R2, R3 и R4 независимо друг от друга представляют собой низший алкил, гидроксилзамещенный низший алкил, карбамоилзамещенный низший алкил или А представляет собой циклическую аммониевую группу одной из следующих формул:

или при R1 - группа CH2CF3 А представляет собой ациклическую аммониевую группу формулы II, где R2 и R3 - низший алкил, R4 - карбамоилзамещенный низший алкил, или их фармакологически приемлемых солей, отличающийся тем, что соединение общей формулы III
где R1 - группа CH2F, или CH2CN, или CH2CF3, или CHF2;
X - галоген,
и амино- и/или карбоксильная группа защищены защитными группами или его соль подвергают взаимодействию с амином, соответствующим А, в котором функциональные группы защищены защитными группами, или его солью с последующим удалением защитных групп и выделением целевого продукта в свободном виде или в виде фармакологически приемлемой соли.
Приоритет по признакам:
13.10.86 - R1 - CH2CN, R2 и R3 - низший алкил, R4 - карбамоилзамещенный низший алкил, низшая алкильная группа, замещенная оксадиазолилом, А - циклическая аммониевая группа следующих формул: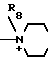 N__R9 ,
N__R9 ,  N
N N ,
N ,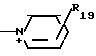 ,
, 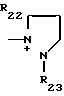

где R8 - низший алкил, R9 - сульфамоил, R19 - карбамоил, R22 и R23 - низший алкил;
06.11.86 - когда R1 - CH2F, то R2 и R3 - низший алкил, R4 - низший алкил, карбамоилзамещенный низший алкил, аминозамещенный низший алкил, ди(низший алкил) аминозамещенный низший алкил, оксозамещенный низкий алкил, оксадиазолилзамещенный низший алкил, тетразолилзамещенный низший алкил, А - циклическая группа одной из следующих формул: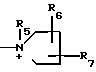 ,
, 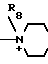 N__R9 ,
N__R9 , ,
,  N
N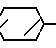 R16 ,
R16 , N
N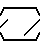 N ,
N ,  ,
,
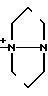
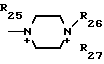
где R5 - низший алкил, R6 - водород, R7 - водород, гидроксилзамещенный низший алкил, R8 - низший алкил, R9 - водород, карбамоил, сульфамоил, иминозамещенный низший алкил, R16 - карбамоил, R19 - карбоксилзамещенный низший алкил, сульфогруппа, карбамоил, карбоксил, R22, R23, R24, R25 и R26 - низший алкил,
когда R1 - CH2F3, то R2 и R3 - низший алкил, R4 - карбамоилзамещенный низший алкил;
03.02.87 - R1 - CH2F2, R2 и R3 - гидрокси (низший) алкил, R4 - алкил, гидрокси (низший) алкил;
03.09.87 - когда R1 - CH2F, то R2, R3 и R4 - одинаковые или разные, независимо друг от друга низший алкил, гидроксилзамещенный низший алкил, (низший алкил) аминокарбонилзамещенная низшая алкильная группа, (низший алкил) карбониламинозамещенная низшая алкильная группа, цианозамещенная низшая алкильная группа, гидроксил- и карбамоилзамещенная низшая алкильная группа, гидроксил- и гидрокси (низший алкил) аминокарбонилзамещенная низшая алкильная группа, гидроксиламинокарбонилзамещенная низшая алкильная группа, карбамоил (низший алкил) аминокарбонилзамещенная низшая алкильная группа, ди (низший алкил) амино- и гидроксилзамещенная низшая алкильная группа, уреидогруппа, (низший алкил) оксизамещенная низшая алкильная группа, ди (низший алкил) аминокарбонилзамещенная низшая алкильная группа, дикарбамоилзамещенная низшая алкильная группа, низшая алкильная группа, замещенная бис [гидрокси (низший алкил)] аминокарбонильной группой, дигидроксилзамещенная низшая алкильная группа, тригидроксилзамещенная низшая алкильная группа, имидазолилзамещенная низшая алкильная группа, пиразолилзамещенная низшая алкильная группа, А - циклическая аминогруппа общих формул ,
,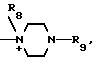
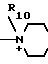 N_R11 ,
N_R11 ,  N__R13 ,
N__R13 ,
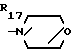
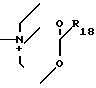 ,
,  ,
,
H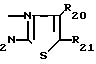
где R5 - низший алкил, карбамоилзамещенный низший алкил, цианозамещенный низший алкил, гидроксилзамещенный низший алкил, аминозамещенный низший алкил, дигидроксилзамещенный низший алкил, R6 и R7 независимо друг от друга - водород, гидроксил, гидроксилзамещенный низший алкил, R8 - низший алкил, карбамоилзамещенный низший алкил, гидроксилзамещенный низший алкил, уреидозамещенный низший алкил, дигидроксилзамещенный низший алкил, R9 - гидроксилзамещенный низший алкил, сульфогруппа, формил, карбамоил, R10 - низший алкил, гидроксилзамещенный низший алкил, карбамоилзамещенный низший алкил, R11- карбамоил, гидроксил, R12 - гидроксилзамещенный низший алкил, R13 - карбамоил, гидроксииминозамещенный низший алкил, R14 - низший алкил, гидроксилзамещенный низший алкил, R15 - карбамоил, R17 - карбамоилзамещенный низший алкил, уреидозамещенный низший алкил, дигидроксилзамещенный низший алкил, R18 - низший алкил, R19 - карбамоил, аминогруппа, карбамоилзамещенный низший алкил, морфолинокарбонил, гидрокси (низший алкил) аминокарбонил, бис [гидрокси (низший алкил)] аминокарбонил, R20 - низший алкил, R21 - гидроксилзамещенный низший алкил, когда R1 - CHF2, то R2, R3 и R4 независимо друг от друга низший алкил, гидроксилзамещенный низший алкил, карбамоилзамещенный низший алкил, А - циклическая аммониевая группа формул ,
, ,
,
07.09.87 - R1 - CH2CN, R2, R3 и R4 - одинаковые и разные, независимо друг от друга - низший алкил, гидроксилзамещенная низшая алкильная группа, гидроксил- и карбамоилзамещенная низшая алкильная группа, оксозамещенная низшая алкильная группа, А - циклическая аммониевая группа формулы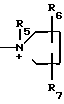
где R5 - низший алкил, R6 - гидроксил, R7 - гидроксилзамещенный низший алкил.
Авторы
Даты
1994-04-15—Публикация
1987-10-12—Подача