антибиотики проявляют активность при меньшей ингибирующей концентрации, чем
аналоги по структуре и действию. 3 с.п. ф- лы, А табл.







Изобретение касается производных цефема, в частности соединений общей ф-лы I и ф-л II и III: К-тгС-С(0) -|-f (I) HJiJUb-o-CM, o.L-,1 J-сн.сн-си,. . .o c-o A- 9(CHJfD4JCW|)-CHI-C(0)-NH,; fCtolNHj, HOH.C, -(Сн,),,)-с((Ч-ни,; - fCMjIj-cf-njfCMjj-ooj-trH .. ™.XS,-OH -KfCHj),-Cf-.H)(OHJ-C(0)NM,; -(T J i Г rf/ Urt , П Г V / I Г CHj-ttOJ-MH, /° CHtc(omHt CH, OH CM,CH .У ; -. CMtC( -o CH(CH, -NfCMjVCH.-CfO (СН,),-С(- Н)(ОН); C(0)NH, (B)(Wl-HH-C c-cp,..MHT:r CH CH-cH,J. 5-0-CH1f0j-Nv :c(0) ОИ N-- С-С|0)-ОН («) .ocMtf l-Nl CHjJj-CI -CfOI-W,;-И -C№)WH,; CHfCHjl-CJO-MM,{HI Соединения ф-лы I обладают антибактериальной активностью, что может быть использовано в медицине, соединение ф-лы II может быть использовано в качестве промежуточного соединения для синтеза производных 3-аммониоп- ропенилцефем-4-карбоксилата, а соединение ф-лы III может быть использовано для синтеза п-ме- токсибензил-7-/ - 2-(5-тритилами- но-1,2,4-тиадиэзол-3-ил) -(Z)-(2- фторметоксииминоацетамидо)-3-(Е)-{3- йод-1-пропен-1-ил }3- цефемкарбоксила- та. Цель - создание новых промежуточных веществ для более активных цефалоспориновых антибиотиков. Синтез соединения ф-лы III ведут гидролизом его этилового эфира в присутствии щелочи при кипячении в водно-этэнольной среде. Синтез соединения ф-лы II ведут иодированием соответствующего хлорида с помощью NaJ в среде ацетона с последующим превращением полученного иодида в целевой продукт ф-лы I, обработкой соответствующим аммонийным соединением (содержащим радикал А). Новые у Ј

Изобретение относится к новым антибиотикам цефемового ряда, а именно к производным 3-аммониопропенилцефемкарбоксилэта, обладающим антибактериальной активностью, а также к новым промежуточным продуктам для их синтеза: к производному 3-йодпропенилцефема и к 2-(5-тритиламино- 1,2.4-тиадиазол-З-ил)- (г)-2-фторметоксиими- ноуксусной кислоте для синтеза производных 3-йодпропенилцефема.
Цель изобретения - создание новых антибиотиков цефалоспоринового ряда, обладающих улучшенной активностью, и промежуточных продуктов для их синтеза.
Эксперимент 1 (синтез исходного соединения). Этиловый эфир 2-{5-тритиламино- 1,2,4-тиадиазол-3-ил)-(1)-2-фторметоксиими- ноуксусной кислоты.
,9
Ч-г-С-СООС,Нъ C-NH-y «, г
OCH2F
Этиловый эфир 2-(5-тритиламимо-1,2,4- тиадиазоп-3-ил)-(2Н2-оксииминоуксусной кислоты (60,4 г) растворяют в диметилсуль- фоксиде (210 мл) и при охлаждении льдом прибавляют карбонат калия (96.48 г). Раствор перемешивают 10 мин. Затем прибавляют бромфторметан (19 г) и раствор перемешивают 3 ч при комнатной температуре. К реакционному раствору прибавляют этилацетат (1 л), раствор промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель отгоняют и к остатку прибавляют эта- нол (120 мл). Выпавшие кристаллы собирают фильтрованием, промывают эта- нолом и получают целевой продукт (58,2 г).
Эксперимент 2 (синтез исходного соединения). 2-(5-Тритиламино-1,2,4-тиадиа- зол-3-ил)-{2)-2-фторме оксииминоуксусная кислота.
О ннЗЬг -соои
гА оснгг
К смешанному раствору, содержащему гидроксид натрия (2,04 г), этанол (146 мл) и воду (29 мл), прибавляют соединение (17,87 г), полученное в эксперименте 1, и
раствор кипятят с обратным холодильником при перемешивании 20 мин. Затем раствор концентрируют при пониженном давлении и прибавляют к нему этилацетат (200 мл) и 1н. хлористоводородную кислоту (77 мм).
Этилацетатный слой отделяют, промывают насыщенным раствором соли и затем сушат над безводным сульфатом магния. Растворитель отгоняют и получают кристаллы. Кристаллы растирают с петролейным эфиром,
собирают фильтрованием и получают целевой продукт (16,55 г).
Эксперимент 3 (синтез исходного соединения). п-Метоксибензил-7-/ (5- тритиламино-1,2,4-тиадиазол-3-ил)-(2)-(2фторметоксииминоацетамидо)-3-(2)-(3-хлор -1-пропен-1-ил)-3- цефем-4-карбоксилат.
-соинQ -jisfX -v l
4-°сҐ coocHj-Q-ocH,
Диметилформамид (348 мкл) и тетрагид- рофуран (4,1 мл) охлаждают до -10°С, прибавляют к ним оксихлорид фосфора (418 мкл) и при охлаждении на ледяной бане и перемешивании выдерживают 90 мин. К этому раствору прибавляют раствор соединения (1,73 г), полученного в эксперименте 2, в тетрагидрофуране (5,5 мл) при охлаждении до -10° и результирующий раствор перемешивают 90 мин при охлаждении на ледяной бане. Реакционный раствор охлаждают до-20°С и прибавляют к нему смешанный раствор, содержащий гидрохлорид п-метоксибензил-7/3 -эмино-3-(Е)-3-хлор-1- пропен-1-ил)-3-цефем-4-карбоксилата (1,78 г), М-(триметилсил)ацетамид (2,95 г), этилацетат (18 мл) и тетрагидрофуран (5.5 мл) и результирующий раствор перемешивают 1 ч при -10°С. К реакционному раствору прибавляют этилацетат (100 мл), результирующий раствор тщательно промывают водой,
насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, после чего сушат над безводным сульфатом
магния. Растворитель отгоняют, остаток очищают колоночной хроматографией на силикэгеле и получают целевой продукт (2,65 г).
Эксперимент 4 (синтез исходного соединения). п-Метоксибензил-7/ (5- тритиламино-1,2,4-тиадиазол-3-ил)-(1)-( 2- фторметоксииминоаметамидо)-3-(Б)-(3- йод-1-пропен-1-ил)-3-цефем-4- карбокси- лэт.
jy 1
COOCHjO-OCHj
Соединение (10,11 г), полученное в эксперименте 3, растворяют в ацетоне (212 мл) и при охлаждении на ледяной бане прибавляют йодид натрия (9,03 г). Результирующий раствор перемешивают 15 мин при охлаждении на ледяной бане и еще 90 мин при комнатной температуре. Растворитель отгоняют и остаток экстрагируют этилацетатом (500 мл). Экстракт промывают насыщенным водным раствором тиосульфата натрия и насыщенным раствором соли, после чего сушат над безводным сульфатом магния. Высушенный экстракт концентрируют при пониженном давлении и прибавляют н-гек- саи. Результирующий осадок собирают фильтрованием и получают целевой продукт (10,92 г).
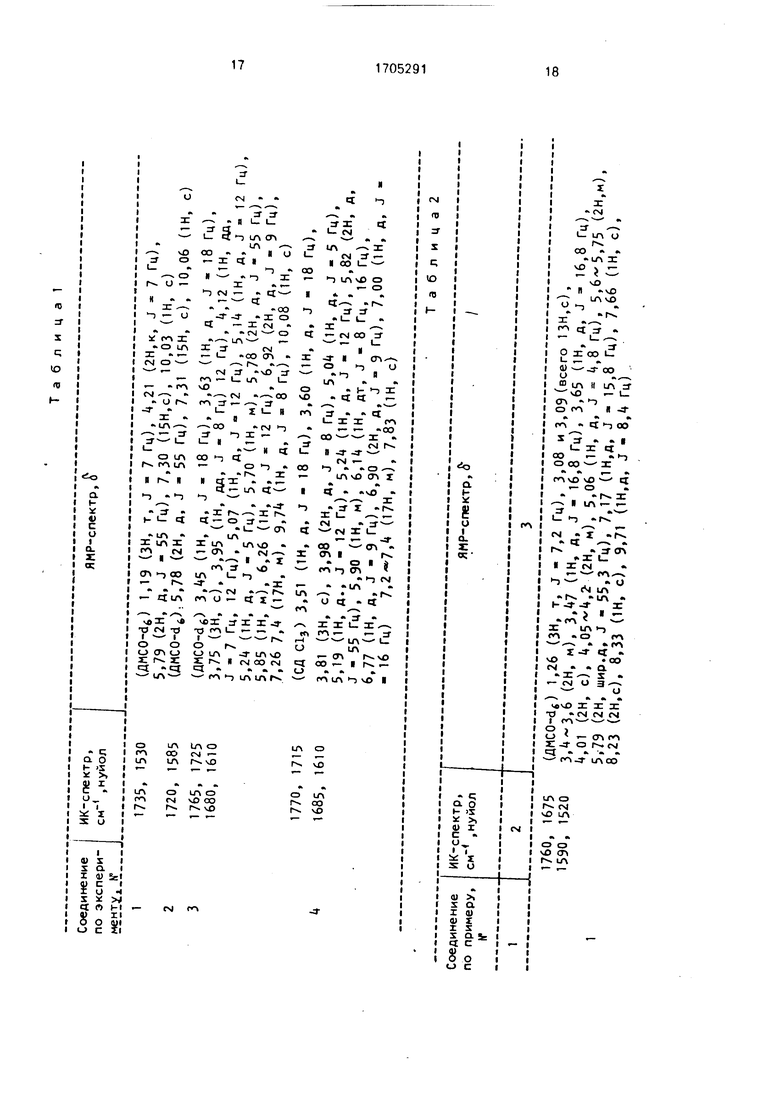
Физико-химические характеристики исходных соединений, полученных по экспериментам 1-4, даны в табл. 1.
Пример 1.7/9 - 2-{5-Амино-1,2,4-тиа- диазол-3-ил)-(2Н2- фторметоксииминоаце- тамидо)-3-{Е)-3-{кэрбамоилметилэтилмети ламмоний)- 1-пропен-1-ил)-3-чефем-4-кар- боксилат,
f-jr-C-CONH- HjNIS N-0-CH,K
О
SCHjCHj |J P C-N CONH2 COO CM,
Соединение (550 мг), полученное в эксперименте 4, растворяют в смешанном растворе, содержащем этилацетат (20 мл) и диэтиловый эфир(10 мл) и прибавляют этил- метиламиноацетамид (117 мг). Результирующий раствор перемешивают 4,5 ч при комнатной температуре. К реакционному раствору добавляют изопропилоеый эфир, выпавший осадок собирают фильтрованием, сушат и получают желто-коричневый порошок (400 мг).
Порошок перемешивают в смешанном растворе трифторуксусной кислоты (4,5 мл) и анизола (4 мл) 1 ч при охлаждении на ледяной бане и прибавляют диэтиловый эфир. Результирующий осадок собирают фильтрованием и промывают дизтиловым эфиром. Осадок суспендируют в воде (5 мл). Суспензию доводят до рН 5,5-6,5 ацетатом натрия. Нерастворимые соединения удаляют фильтрованием, фильтрат очищают обра- щенно-фазовой хроматографией и получают целевой продукт (49 мг).
Пример 2. 7/9 (Б-Амино-.З-тиа- диазол-3-ил)-(2)-2- фторметоксииминоацетамидо-3-(Е)-3/1 -{2-оксиэтил)-4-карбамоил -1 - пиперидиний)-1 -пропен-1 -ил -3-цефем-4- карбоксилат
S ОН N-т-С-СОМН- -1-С s onim
JUk , CONHJ
Н/Ум-оаЦГ 0 foy
Соединение (700 мг). полученное в эксперименте 4, растворяют в диметилформа- миде (3 мл) и прибавляют раствор 1-(2-оксиэтил(-иэонипекотамида (194 мг) в диметилформамиде (0,5 мл). Раствор перемешивают ночь. Реакционный раствор прибавляют к диэтиловому эфиру (120 мл). выпавший осадок собирают фильтрованием и получают желтый порошок (680 мг). К этому порошку прибавляют анизол (4,5 мл) и по каплям, при перемешивании и охлаждении
на ледяной бане прибавляют трифторуксус- ную кислоту в течение 30 мин. После окончания прикалывания смесь перемешивают еще 1,5 ч. К реакционному раствору добавляют изопролиловый эфир (50 мл) и выпавший осадок собирают фильтрованием. Осадок суспендируют в воде (30 мл) и суспензию доводят до рН 7,0 ацетатом натрия. Результирующие нерастворимые частицы удаляют фильтрованием, фильтрат очищают
обращенно-фазовой колоночной хроматографией на силикагеле и получают два типа изомеров целевого соединения. Изомер (2-1) 21 мг. Изомер (2-2) 20 мг.
Смесь двух изомеров 1:1 50 мг.
Пример 3. 7/3 -{2-(5-Амино-1,2.4-ти- адиазол-3-ил )-(2)-2-фторметоксииминоац- етамидо/-3/ ГЕУЗ-/15-карбамоилэтил)ди- метиламмоний(-3-пропен-1 -ил -3-цефем-4карбоксилат (3-1).,- си
:-сом,- -г-А .: 4 ONHl
н.
fH-c-сом.
N T N-OCHjF
7/ -{2-(5-Амино-1,2,4-тиадиаэол-3-ил)- (Zl-2-фторметоксииминоацетамидо (-3- ((Е)-З-) (1Я-карбамоилэтил)диметиламмо- ний/-1-пропен-1-ил}-3-цефем- 4-карбокси- лат (3-2).
-g-C-CONH- N-OCHjF
,оъ
тЛ J
Q -fVfks N CONH,
COO CHj
Соединение (600 мг), полученное в эксперименте 4, растворяют в смешанном растворе, содержащем зтилацетат (20 мл) и диэтиловый эфир (10 мл) и затем прибавляют 2-диметиламинопропиламид (150мг). Результирующий раствор перемешивают 3 ч при комнатной температуре. К реакционному раствору добавляют изопропиловый эфир, результирующий осадок собирают фильтрованием, сушат и получают желтовато-коричневый порошок (50 мг).
Порошок перемешивают в смешанном растворе из трифторуксусной кислоты (5,5 мл) и анизола (5 мл) 1 ч на ледяной бане и затем прибавляют диэтиловый эфир. Результирующий осадок собирают фильтрованием и промывают диэтиловым эфиром. Осадок суспендируют в воде (5 мл) и суспензию доводят до рН 5,5-6,5 ацетатом натрия. Нерастворимые частицы удаляют фильтрованием, фильтрат очищают обращенно-фа- эовой колоночной хроматографией на силикагеле и получают следующие целевые продукты: 8 мг (3-t), 7 мг (3-2) и 4 мг смеси 1:1 (3-1) и (3-2).
Пример 4. 7/9 -{2-{5-Амино-1.2.4-ти- адиазол-3-ил) - (Z) -2-фторметоксииминоац- етамидо( -3-(Е)-3- )1В-кзрбамоил-2-окси- этил(диметиламмоний)-пропен-1-ил -3- це- фем-4-карбоксилат.
HjX
N-т- C-CONH- V K-OCH,F
сн.
-т-ДI J/
он
н
сомнг
Соединение (1,00 г), полученное в эксперименте 4, растворяют в диметилформамиде (2 мл). Раствор N.N-диметил- D-свринамида получают, растворяя М,М-диметил-0-серинамидотрифтораце- тат (590 мг) в метаноле (5 мл), прибавляют к нему 1 н. водный раствор гидроксида
натрия (2,4 мл), затем отгоняют растворитель при пониженном давлении и экстрагируют остаток ацетонитрилом (2 мл). Раствор М,М-диметил-0-серинамида прибавляют к
раствору соединения, полученного в эксперименте 4, в диметилформамиде при охлаждении на ледяной бане. Результирующий раствор перемешивают 30 мин. Реакционный раствор добавляют в серный эфир, ре0 зультирующий осадок собирают фильтрованием и получают желтый порошок (1,1 г).
К этому порошку прибавляют анизол (8 мл) и трифторуксусную кислоту (9 мл) по
5 каплям при перемешивании прибавляют в течение 30 мин при охлаждении на ледяной бане, после чего перемешивают еще 1,5 ч. К реакционному раствору прибавляют серный эфир и выпавший осадок собирают
0 фильтрованием. Осадок суспендируют в воде (10 мл). Суспензию доводят до рН 7 ацетатом натрия. Нерастворимые соединения удаляют фильтрованием, фильтрат очищают обращенно-фазовой колоночной хрома5 тографией на силикагеле и получают целевой продукт (30 мг).
Пример 5, 7/3 (5-Амино-1,2,4-ти- адиазол-3-ил)- (Z )-2-фторметоксииминоац- етамидо( -3-(( Е)-3- )4-окси-2В-оксиметил0 1-метил-1-пирролидиний)-1-пропен-1-ил - З-цефем-4-карбоксилат.
.-CONHH/Jl
-OCH,F
5
s нх
он
FQJObQ
coo сн.
CHjOH
Соединение (700 мг), полученное в экс0 перименте 4, растворяют в ацетоне (4 мл) и прибавляют раствор М-метил-цис-4-окси-0- пролинола (89 мг) в ацетоне (2 мл). Результирующий раствор перемешивают ночь. Реакционный раствор прибавляют в серный
5 эфир (100 мл), выпавший осадок собирают фильтрованием и получают желтый порошок (700 мг).
К этому-порошку прибавляют анизол (4,6 мл) и трифторуксусную кислоту (5,3 мл)
0 по каплям в течение 30 мин при перемешивании и охлаждении на ледяной бане и перемешивают еще в течение 1,5 ч. К реакционному раствору прибавляют изопропиловый эфир (50 мл). Результирующий
5 осадок собирают фильтрованием. Осадок суспекдируют в воде (30 мл) и суспензию доводят до рН 7 ацетатом натрия. Нерастворимые частицы удаляют фильтрованием, фильтрат очищают обращенно-фазовой колоночной хроматографией на силикагеле и
СООполучэют следующие два типа изомеров (по атому азота пирролидина): изомер (5-1) 27 мг; изомер (5-2) 100 мг.
Пример 6. 1ft (5-Амино-1.2.4-ти- эдиазол-3-ил)- (Ј)-2-фторметоксииминоац- етамидо) (-3-) (ЁУЗ-( 4Р-окси-1-)2-оксиэ- тил)-2-оксиметил-1-лирролидинит-1-проп- ен -1- -3-цефем-4-карбоксилэт.
J-TC-CONH- HjN S 14 N-OCHjF
ОН ОН
%
снгон
Соединение (2,0 г), полученное в эксперименте 4, прибавляют к раствору СR)-4-o«- си-1-(2-оксиэтил)-( $)-2-оксиметил-пирро лидона (450 мг) в диметилформамиде (5 мл). Результирующий раствор перемешивают ночь. Реакционный раствор добавляют в этилацетат. Результирующий осадок собирают фильтрованием и получают желтый порошок (1,65 г),
К порошку прибавляют анизол (10 мл) и затем по каплям в течение 30 мин при перемешивании и охлаждении на ледяной бане прибавляют трифторуксусную кислоту (11.7 мл), после чего перемешивают еще в течение 1,5 ч. К реакционному раствору прибав- ляют изопропиловый эфир и результирующий осадок собирают фильтрованием. Осадок суспендируют в воде (4,5 мл) и суспензию доводят до рН 7 ацетатом натрия. Нерастворимые соединения удаляют фильтрованием, фильтрат очищают колоночной хроматографией на силикагеле в реверсивной фазе и получают два типа изомеров (по атому азота пирролидина) целевого соединения: изомер (6-1) 96 мг; изомер (6-2) 207 мг.
Пример 7. 7/3 -{2-(5-Амино-1,2,4-ти- адиазол-3-ил) -)-2-фторметоксииминоац етамидо (-3-)(Е)-3-)1-карбамоилметил- З-окси-1-пиррол ид иний-1-пропен-1-ил -3- цефем-4-карбоксилат.
N-T-C-CONH- H/Jf N-OCH2F CONH,
S CONH, „„
гс А-Ш
(J
COO
Соединение (1,0 г), полученное в эксперименте 4, растворяют в диметилформамиде (4 мл) и прибавляют раствор N-карбэмоил-метил-З-оксипирролидина (186 мг) в диметилформамиде (2 мл). Результирующий раствор перемешивают ночь. Реакционный раствор прибавляют к серному эфиру (200 мл). Результирующий осадок собирают фильтрованием и получают желтый порошок (970 мг),
К порошку прибавляют анизол, а затем по каплям, при перемешивании и охлаждении на ледяной бане в течение 30 мин прибавляют трифторуксусную кислоту (10,6 мл).
Затем смесь перемешивают еще 1,5 ч. К реакционному раствору прибавляют изопропиловый эфир(80 мл)и выпавший осадок собирают фильтрованием. Осадок суспендируют в воде (50 мл). Суспензию доводят
до рН 7 ацетатом натрия. Нерастворимые соединения отфильтровывают, фильтрат очищают обращенно-фазовой колоночной хроматографией на силикагеле и получают соответствующие типы изомеров (по атому
азота и атому углерода в положении 3 пирролидина), имеется 4 типа по данным высокого давления жидкостной хроматографии (целевого соединения: изомер (7-1) 71 мг (смесь изомеров двух типов); изомер (7-2) 70
мг (индивидуальное соединение); изомер (7- 3) 54 мг (индивидуальное соединение).
Пример 8. 7/ -{2-(5-Амино-1,2,4-ти- адиазол-3-ил)-Гг)-2-фторметоксииминоэц- етамидо (-3-) (Е)-3-0-метил-4-сульфо-1пиперазиний)-1-пропен-1-ил -3-цефем-4- карбоксилат
35
:-CONHШ
HjN SN N-OCHjF
;кО-5°зн
COO
Соединение (2,0 г), полученное в эксперименте 4. прибавляют к раствору, содержащему сульфат 4-метилпипе- рази носульфо кис лоты (718 мг), №-метил-Ы-(триметилсилил)трифторэцетамид (2 мл) и диметилформэмид (6 мл), и результирующий раствор перемешивают ночь. К реакционному раствору прибавляют метанол (2 мл) и нерастворимые частицы отфильтровывают. Фильтрат прибавляют к
смеси этилацетата (50 мл) и серного эфира (50 мл), выпавший осадок собирают фильтрованием и получают желтый порошок (1,79 г). К этому порошку прибавляют анизол (10,9 мл), а затем по каплям, при перемешивании
и охлаждении на ледяной бане в течение 30 мин прибавляют трифторуксусную кислоту (12,7 мл). Результирующий раствор перемешивают еще 1,5 ч. К реакционному раствору прибавляют изопропиловый эфир (100 мл) и выпавший осадок собирают фильтрованием. Осадок суспендируют в воде (4,5 мл) и суспензию доводят до рН 7 ацетатом натрия. Нерастворимые частицы отфильтровывают,фильтрат очищают обращенно-фазовой колоночной хроматогра- фией на силикагеле и получают целевой продукт (50 мг).
Пример 9. 1ft (5-Амино-1,2,4-ти- адиаэол-3-ил)-(1)-2-фторметоксииминоац- етамидо (3-){Е)-3-(.1-)карбамоилметил-4- окси-1-пиперидиний-1-пропей-1-ил}-3- це- фем-4-карбоксилат.
HjN
W
-CONH- CCH,F
CONHj
T JuJoCOO
он
Соединение (1,0 г), полученное в эксперименте 4, растворяют в ацетоне (9 мл) и прибавляют М-карбамоилметил-4-оксипи- перидин (206 мг). Раствор перемешивают ночь. Реакционный раствор прибавляют к спеси (100 мл) серного эфира и изопролило- всго эфира(2:1), результирующий осадок собирают фильтрованием и получают желтый порошок (1,0 г).
К этому порошку прибавляют анизол (9,0 мл), а затем по каплям, при перемешивании и охлаждении на ледяной бане в течение 30 мин прибавляют трифторуксусную кислоту (10,6 мл), результирующий раствор перемешивают еще в течение 1,5 ч. К реак- ционному раствору добавляют изопропило- вый эфир (ВО мл) и результирующий осадок собирают фильтрованием. Осадок суспендируют в воде (5 мл) и суспензию доводят до рН 7,0 ацетатом натрия. Нерастворимые ча- стицы отфильтровывают, фильтрат очищают обращенмо-фаэовой колоночной хроматог- рафией на силикагеле и получают целевой продукт (166 мг).
Пример 10. 70 - 2- 5-Амино-1,2,4-ти- адиазол-3-ил)- (Z) -2-фторметоксииминоацет мидо{-3-) (Е.У 3- Ј5-аза- -метил-2,8-диокса- бицикло) 3,3,1 f нона-5-онит)-1 -пропен-1- ил -3-цефем-4-карбоксилат.
N-r-C-CONH«VI.
HjN
-оснгг
COQсн,
Соединение, полученное в эксперименте 4, растворяют в диметилформамиде (10 мл) и прибавляют при комнатной температуре 5-аза-1 -метил-2,8-диоксабици к лр
5
0
5
0
5
(3.3,1)нонан (800 мл). Результирующий раствор перемешивают 20 мин. Реакционный рэс.твор разбавляют этилацетатом (25 мл), раствор прибавляют в серный эфир и получают коричневый осадок (3,85 г).
Осадок растворяют в анизоле (23 мл) и при охлаждении на ледяной бане прибавляют трифторуксусную кислоту (26 мл). Раствор перемешивают при этой же температуре 30 мин. К реакционному раствору прибавляют серный эфир и выпавший осадок собирают фильтрованием. Осадок суспендируют в воде (40 мл) и суспензию доводят до рН 7,0 ацетатом натрия. Нерастворимые частицы отфильтровывают, фильтрат очищают обращенно-фазовой колоночной хроматографией на силикагеле и получают целевой продукт (408 мг).
Пример 11. По методам примеров 1-10 получают, используя 183мг амина и 800 мг соединения по эксперименту 4, соединение формулы
N-r-C-CONH- H2N S Н-ОСНгР
s н/уюнн,
Ду
Wf f f COO
которое выделяют в виде изомера 11-1 (29 мг), изомера 11-2 (33 мг) и смеси изомеров (14мг).
Пример 12. 7ft -(2-(Амино-1.2,4-тиа- диазол-3-ил -Н2)-2фторметоксииминоацет- амидо - 3-(Е}-3-(карбамоилметилдимети- ламмоний -1. пропен- -ил}-3-цефем- 4-ка- боксилат.
5hr-C-CONH- H,NЈf N-OCH,F
тЛ - N --K:ONH,
о - i соо
Растворяют 500 мг соединения, полученного в эксперименте 4. в смешанном растворе, состоящем из 3 мл метанола и 1 мл диметилфермамида, и прибавляют 71,3 мг N.N-диметилглицинамида при охлаждении на ледяной бане, затем перемешивают всю ночь при комнатной температуре. Полученный в результате реакционный раствор прибавляют к смешанному раствору, состоящему из 50 мл этилового эфира и 50 мл этилацетата, отфильтровывают образовавшийся осадок и сушат, получая 382 мг желтого порошка.
Это соединение прибавляют к смешанному раствору, состоящему из 2,7 мл триф- торуксусной кислоты и 2,3 мл анизола, затем
перемешивают 2 ч при охлаждении на ледяной бане. Реакционный раствор прибавляют к смешанному раствору, состоящему из 25 мл этилового эфира и 25 мл изопропило- вого эфира, отфильтровывают образовавшийся осадок и промывают этиловым эфиром, Полученный таким образом осадок суспендируют в 4,5 мл воды, затем устанавливают рН полученной суспензии а интервале от 5,5 до 6,5 с помощью ацетата натрия и отфильтровывают нерастворимые вещества. Фильтрат очищают колоночной хроматог- рзфией на силикагеле с обращаемой фазой, получают 95 мг целевого продукта.
Пример 13. 7/3 -{2-{5-Амино-1.2,4-ти- адиазол-3-ил)-)-2-фторметоксииминоац- етамидо -3-(Е)-3-Ј1 метил 4-карбамоил-1- пиперизиний)-1-пропен-1-ил}-3- цефем-4- карбоксилат.
Ч-т-С-С Н/Г N-C
C-CONHOC1I7F
jXJfU ;O-C°NH,
СОО
Растворяют 500 мг соединения, полученного в эксперименте 4, в смешанном растворителе, состоящем из 3 мл метанола и 1 мл диметилформамида, прибавляют 100 мг М-метил-м -карбэмоилпиперазина при охлаждении на ледяной бане, а затем перемешивают всю ночь при комнатной температуре. Реакционный раствор прибавляют к смешанному раствору, состоящему из 50 мл этилэцетатэ и 30 мл этилового эфира, образовавшийся осадок отфильтровывают и сушат, получают 425 мг желтого порошка.
Соединение прибавляют к смешанному раствору, состоящему из 3,0 мл трифторук- сусной кислоты и 2,6 мл анизола, перемешивают 2 ч при охлаждении на ледяной бане. Реакционный раствор прибавляют к смешанному раствору, состоящему из 25 мл этилового эфира и 25 мл изопропилового спирта, образовавшийся осадок отфильтровывают и промывают этиловым эфиром. Осадок суспендируют в 4,5 мл воды, затем устанавливают рН в интервале от 5,5 до 6,5 с помощью ацетата натрия и отфильтровывают нерастворимые вещества. Фильтрат очищают хроматографией на колонке с си- ликагелем с обращаемой фазой, получают 107 мг целевого продукта.
Пример 14. 7/ -{2-(5-Амино-1,2,4-ти- адиазол-3-ил-(2)-2-фторметоксииминоаце- тамидо -3-(E)-3f (2-оксипропил)димети- ламмоний)- 1-пролен-1 -ил}-3-цефем- 4-кар боксилат.
0
H,N
Л:
-C-CONH- I
N-OCHjF ™зд
,
РЛП-nit
СОО СН
(
Аналогично методике примера 13 вводят в реакцию 500 мг соединения, полученного по эксперименту 4, с 80 мкл (диметиламино)ацетонэ, затем удаляют защитную группу, получают 60 мг целевого продукта.
Пример 15. По методике примеров 1-10 получают, используя 3.39 г амина и 23,8 г соединения по эксперименту 4. 1,42 г соединения формулы
N-CONHOCH,F СН,
,-,+| ОН
TiLA--N-Г-н
о N т .i com
cooсн, :
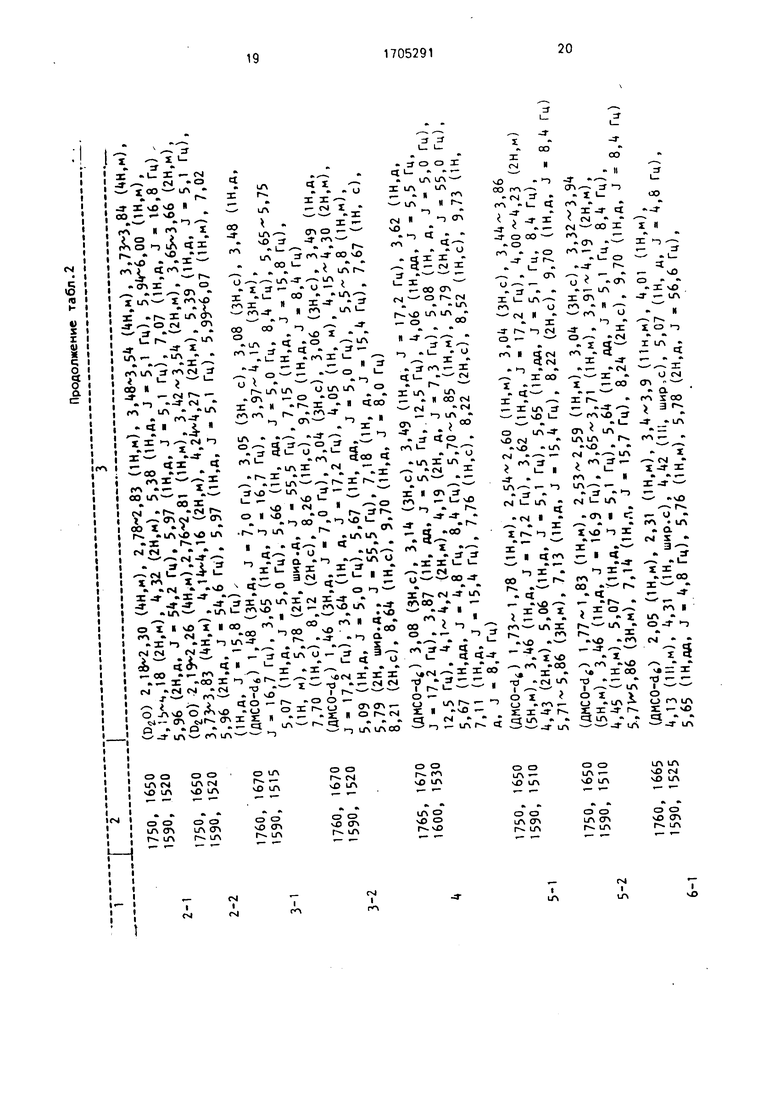
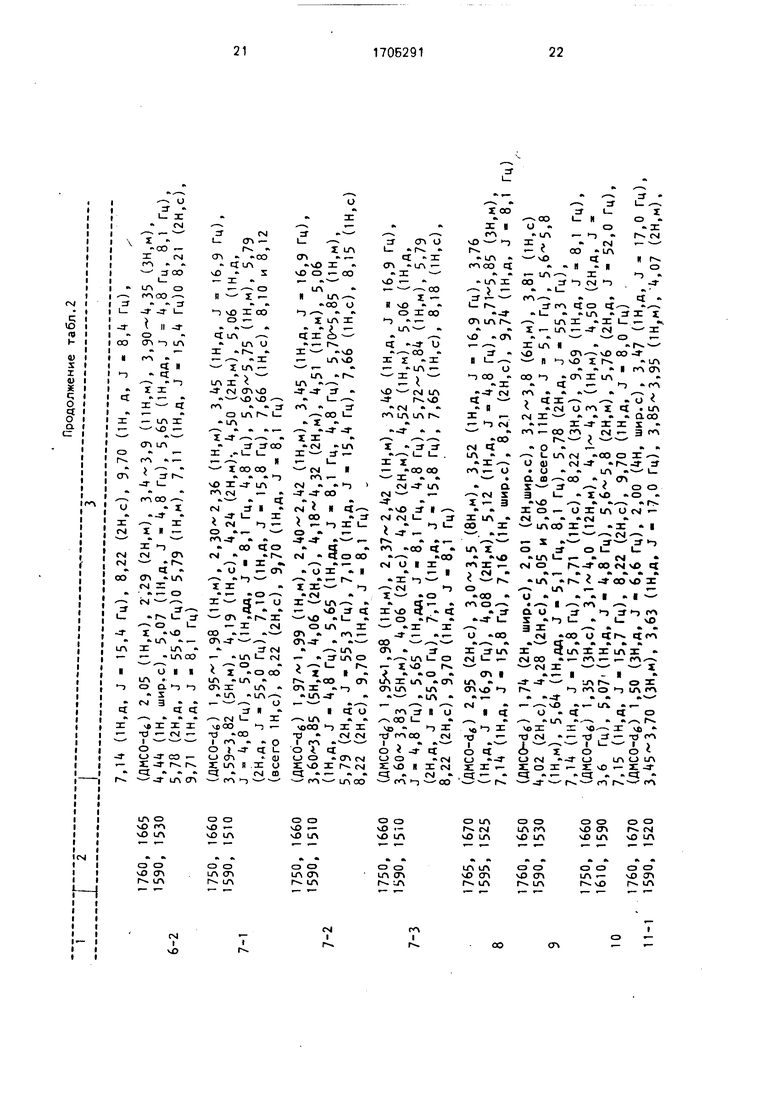
Физико-химические характеристики соединений по примерам 1-15 представлены в табл. 2.
Острую токсичность и антибактериальную активность предлагаемых соединений определяют следующим образом. Острая токсичность на мышах. Предлагаемые соединения, растворенные в физиологических растворах, дозируют внутривенно пяти самцам мышей разновидности ICP в возрасте б недель; В результате этого было установлено, что значения острой токсичности для соединений,
полученных в следующих примерах, во всех случаях превосходили 2 г/кг.
Номера примеров: 1, 2-1,2-2, 3-1,3-2.4, 5-1, 5-2, 6-1, 6-2, 7-1. 7-2, 7-3. 8, 9, 10, 11-1. 11-2, 12, 13, 14, 15.
Антибактериальная активность (МИК).
Значения минимальных ингибирующих концентраций (МИК) определяли методом разбавления на агаре (Хемотерапия (Япония) 29, 76-79, 1981). Оставленные на ночь
культуры бактериальных штаммов в бульоне Мюллера-Хинтона разбавляли до конечной концентрации порядка 10 СРУ/мл и по 5 мл каждой бактериальной суспензии наносили на агаровые пластины Мюллера-Хинтона,
содержащие двухкратные серийные разбавления антибиотиков. Значения МИК измеряли после инкубирования в течение 18 ч при37°С.
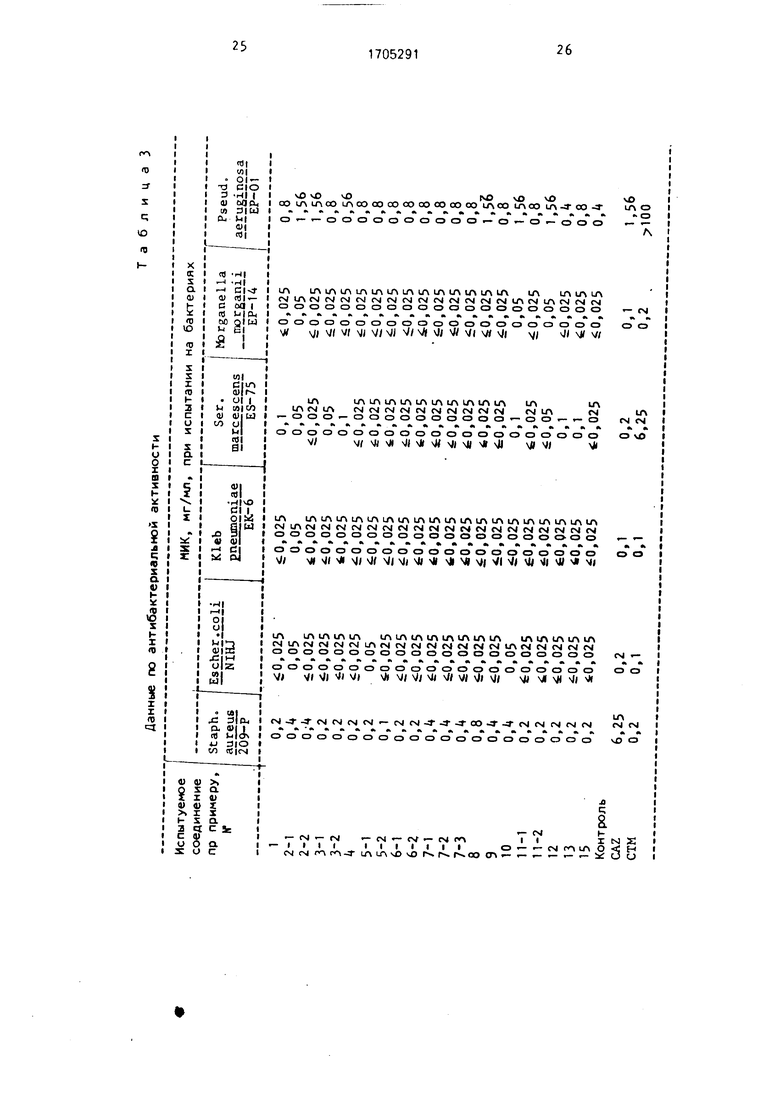
В качестве контрольных соединений использовали CAZ (Цефтазимид) и СТМ (Цефа- таксим), Результаты приведены в табл. 3.
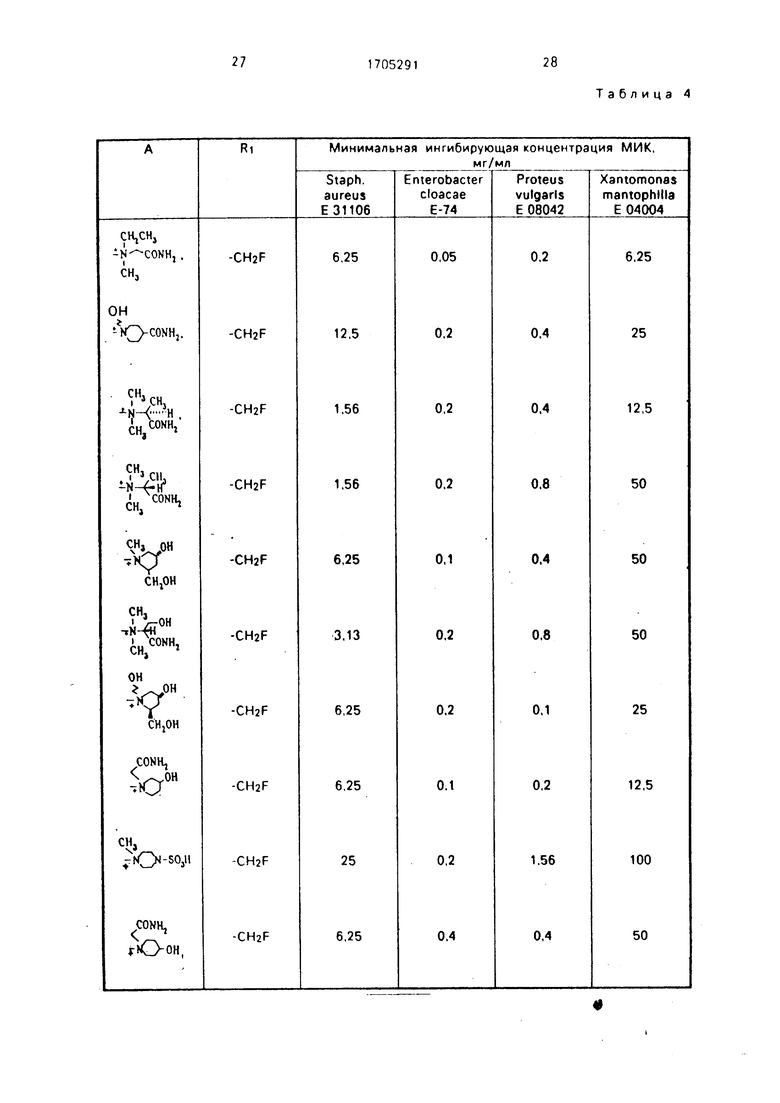
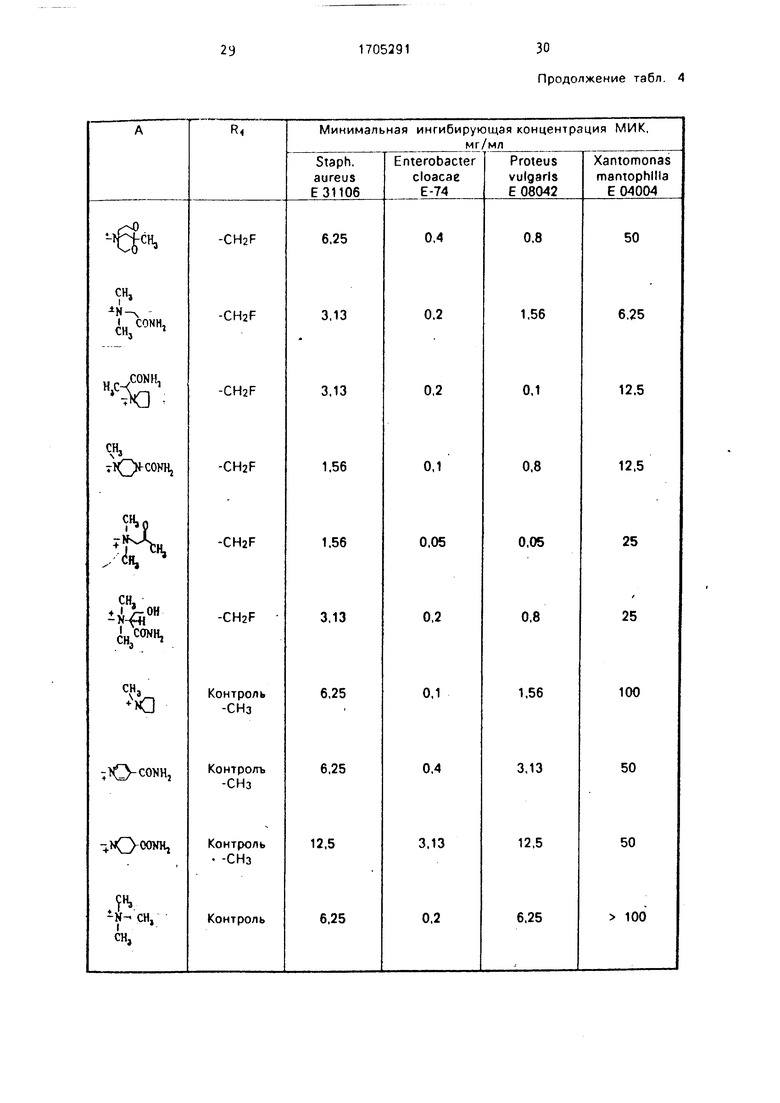
Проводили сравнительные испытания на антибактериальную активность предлагаемых соединений формулы
C-CONH- -Ri
VT-C-CON
,xV й-о-1
сн-снснг-А
СОО
и соответствующих контрольных соединений, в которых RI представляют собой ме- тильную группу. Измерения МИК осуществляли так же, как описано выше, Полученные результаты представлены в табл. 4,
Как следует из табл. 3 и 4, новые антибиотики цефалоспоринового ряда проявляют антибактериальную активность при меньших МИК, чем CAZ и СТМ, а также аналоги по структуре и действию.
Формула изобретения 1. Производные 3-аммониопропенилце- ф«зм-4-карбоксилата общей формулы
W-c-cwH- ,
HjrfV S-OCH,F
. Лг1
g COOCH-CH-CHj-A
обладающие антибактериальной активностью.
О-с-ш- Г
C-CON 1ОСП/
о т5у-сн-сн-сня1 соон
в качестве промежуточного продукта для синтеза производных 3-аммониопропенил- цефем-4-кэрбоксилата.
10
Т Ч-j-C-COOII
O H-Vloav
6 15 в качестве промежуточного продукта для синтеза п-метоксибензил-7 3 -{2-{5-трити- ламино-1,2.4-тиадиазол-3-ил)-(г)- (2-фтор- метоксииминоацетамидо)3-(Е)-{3-йод-1-про- пен-1-ил З- цефемкарбоксилата. 20 Приоритет по признакам:
J 3 25±tf
СИ
CONII
или
30
CHSft
«±
СИ,
50
CONH, ОЦ Ю
или
СН,
+ I 2-ОН
1750, 1650 (D,o) 2,18-2,30 (4н,м), 2,78-2,83 (1Н,м), 3,48-3,54 (4н,м), 3,,84 (4н,м), 1590, 1520 4,1Ь,18 (2Н,м), 4,32 (2Н,м), 5,38 (1Н,д, J - 5,1 Гц), 5,,00 (1Н,м) , 2-15,96 (2Н,д, J - 54,2 Гц). 5,97 ОН,д, J - 5,1 Гц), 7,07 (1Н,д, J - 16,8 Гц) , 1750, 1650 (0,0) 2,19-2,26 (4Н,м),2,76-2,81 (1Н,м), 3,42-3,54 (2Н,м), 3,65-3,66 (2Н,м), 1590, 1520 3,,83 (4н,м), 4,14-4,16 (2Н,м), 1, 24-4,27 (2Н,м), 5,39 ОН.д, J - 5,1 Гц),
2-2- 5,96 (2Н.д, J - 5,6 Гц), 5,97 (1Н,д, J 5,1 Гц), 5,,07 (1Н,м), 7,02
(1Н,д, J - 15,8 Гц),
1760, 1670 (ДМСО-dj 1,48 (ЗН,д, J - 7,0 Гц), 3,05 (ЗН, с), 3,08 (ЗН.с), 3,48 (1Н,д, 1590, 1515 J - 16,7 Гц), 3,65 (1Н,д, J - 16,7 Гц), 3,97-4,15 (ЗН,м),
3-15,07 (1Н,д, J - 5,0 Гц), 5,66 (1Н, дд, J - 5,0 Гц, 8,4 Гц), 5,,75 «
(1Н, м), 5,78 (2Н, шир.д, J - 55,5 Гц), 7,15 (1Н,д, J - 15,8 Гц), 7,70 (1Н,с), 8,12 (2Н,с), 8,26 (1Н,с), 9,70 (1Н,д, J - 8,4 Гц)
1760, 1670 (ДМСО-dJ 1,46 (ЗН,д, J - 7,0 Гц), 3,04 (ЗН,с), 3,06 (ЗН,с), 3,49 (1Н,д, 1590, 1520 J - 17,2 Гц), 3,64 (1Н, д, J - 17,2 Гц), 4,05 (1Н, м), 4,,30 (2Н,м), 3-25,09 Он,A, J - 5,0 Гц), 5,67 (1Н, дд, J - 5,0 Гц), 5,5-5,8 (1Н,м),
5,79 (2Н, шир.д., J - 55,5 Гц), 7,18 (1Н, д, J - 15,4 Гц), 7,67 Он, с), 8,21 (2Н,с), 8,64 (1Н,с), 9,70 (1Н,д, J - 8,0 Гц)
1765, 1670 (ДМСО-dJ 3,08 (ЗН.с), 3,14 (ЗН.с), 3,49 ОН.д, J 17,2 Гц), 3,62 (1Н.д, 1600, 1530 J - 17,2 Гц), 3,87 ОН, дд, J - 5,5 Гц,.12,5 Гц), 4,06 (1Н,дд, J - 5,5 Гц, 412,5 Гц). 4,1-4,2 (2Н,м), 4,19 (2Н, д, J - 7,3 Гц), 5,08 ОН, д, J - 5,0 Гц)
5,67 (1Н,дд, J - 4,8 Гц, 8,4 Гц), 5,70-5,85 Он.м), 5,79 (2Н,д, J - 55,0 Гц) 7,11 ОН.д, J - 15,4 Гц), 7,76 ОН,с), 8,22 (2Н,с), 8,52 (1Н,с), 9,73 Он, д, J - 8,4 Гц)
1750, 1650 (ДМСО-dJ 1,73-1,78 (1Н,м), 2,54-2,60 (1Н,м), 3,04 (ЗН.с), 3,44-3 86 1590, 15Ю (5Н,м), 3,46 (1Н,д, J - 17,2 Гц), 3,62 (1Н,д, J - 17,2 Гц), 4,00-4,23 (2Н,м)
M iv-« f / ,ij- i,/u in,m/, i.,.,ou ип.му, J,UH VJn.c;, J,44-3,00 (5Н,м), 3,46 (1Н,д, J - 17,2 Гц), 3,62 (1Н,д, J - 17,2 Гц), 4,00-4,23 (2Н,м) 4,43 (2Н,м), 5,06 (1Н,д, J - 5,1 Гц), 5,65 Он.дд, J - 5,1 Гц, 8,4 Гц), 5,71-5,86 (ЗН.м), 7,13 Он.д, J - 15,4 Гц), 8,22 (2Н,с), 9,70 (1Н,д, j - 8,
о
U1
ю о
(flMCO-de) 1,77-1,83 Он.м), 2,,59 Он.м), 3,04 (ЗН,с), 3,,94 (5Н,м), 3,46 (1Н,д, J - 16,9 Гц), 3,65-3,71 Он.м), 3,,19 (2Н,м), 4,45 (1Н,м), 5,07 (1Н,д, J - 5,1 Гц), 5,64 (1Н, дд, J 5,1 Гц, 8,4 Гц) 5.,7W5,86 (ЗН.м), 7,14 ОН,л, J - 15,7 Гц), 8,24 (2Н,с), 9,70 Он.д, j 8,.
1590 1510 (г Л ч ; - о
5-2 4,
1760,1665(flMCO-d6) 2,05 1Н,м), 2,31 (1Н,м), 3,4-3,9 (Пн.м), 4,01 (1Н,м),
1590,15254,13 ОН,м), 4,31 (1Н, шир.с), 4,42 (111, шир.с), 5,07 (1Н, д, J 4,8 Гц)
6-15,65 Он,дд, j - 4,8 Гц), 5,76 (1Н,м), 5,78 (2Н,Д, j « 56,6 Гц),
(ДМСО-dJ 1,73-1,78 (1Н,м), 2,54-2,60 (1Н,м), 3,04 (ЗН.с), 3,44-3 86 (5Н,м), 3,46 (1Н,д, J - 17,2 Гц), 3,62 (1Н,д, J - 17,2 Гц), 4,00-4,23 (2Н,м)
M iv-« f / ,ij- i,/u in,m/, i.,.,ou ип.му, J,UH VJn.c;, J,44-3,00 (5Н,м), 3,46 (1Н,д, J - 17,2 Гц), 3,62 (1Н,д, J - 17,2 Гц), 4,00-4,23 (2Н,м) 4,43 (2Н,м), 5,06 (1Н,д, J - 5,1 Гц), 5,65 Он.дд, J - 5,1 Гц, 8,4 Гц), 5,71-5,86 (ЗН.м), 7,13 Он.д, J - 15,4 Гц), 8,22 (2Н,с), 9,70 (1Н,д, j - 8,
(flMCO-de) 1,77-1,83 Он.м), 2,,59 Он.м), 3,04 (ЗН,с), 3,,94 (5Н,м), 3,46 (1Н,д, J - 16,9 Гц), 3,65-3,71 Он.м), 3,,19 (2Н,м), 4,45 (1Н,м), 5,07 (1Н,д, J - 5,1 Гц), 5,64 (1Н, дд, J 5,1 Гц, 8,4 Гц) 5.,7W5,86 (ЗН.м), 7,14 ОН,л, J - 15,7 Гц), 8,24 (2Н,с), 9,70 Он.д, j 8,.
(г Л ч ; -
4,
(flMCO-d6) 2,05 1Н,м), 2,31 (1Н,м), 3,4-3,9 (Пн.м), 4,01 (1Н,м),
Продолжение табл.2
i:;: ;::::::;j;;;;;;;;:;;;;;;;;;;;;;;;;;;::;;;:;;5;;;;;;;;;;;;;;;;;;;;;;
7,14 (1Н,д, J - 15,4 Гц), 8,22 (2Н,с), 9,70 (1Н, д, J - 8,4 Гц),
j
1760, 1665 (ДМСО-dJ 2,05 (1Н,м), 2,29 (2Н,м), 3,,9 (ПН,м), 3,90-4,35 (ЗН.м), 1590, 1530 4,44 (1Н, шир.с), 5,07 (1Н,д, J - 4,8 Гц), 5,65 (1Н,дд, J 4,8 Гц, 8,1 Гц),
6-25,78 (2Н,д, J - 55,6 Гц)0 5,79 (1Н.м), 7,11 (1Н,д, J - 15,4 Гц)0 8,21 (2Н,с),
9,71 (1Н.д, J - 8,1 Гц)
1750, 1660 (ДМСО-cU) 1,95-1,98 (1Н.м), 2,30-2,36 (1Н,м), 3,45 (1Н,д, J - 16,9 Гц), 1590, 15Ю 3,59-3,82 (5Н,м), 4,19 (1Н,с), 4,24 (2Н,м)-, 4,50 (2Н,м), 5,06 (1Н,д,
7-1J - 4,8 Гц), 5,05 Он,дд, J - 8,1 Гц, 4,8 Гц), 5,69-5,75 (1Н,м), 5,79
(2Н,д, J - 55,0 Гц), 7,10 (1Н,д, J - 15,8 Гц), 7,66 (1Н,с), 8,10 и 8,12 (всего 1Н,с), 8,22 (2Н,с), 9,70 (1Н,д, J 8,1 Гц)
1750, 1660 (ДМСО-аб) 1,,99 ОН,м), 2,40-2,42 (1Н,м), 3,45 ОН,д, J - 16,9 Гц), 1590, 1510 3,,85 (5Н,н), 4,06 (2Н,с), 4,18-4,32 (2Н,м), 4,51 (1Н,м), 5,06 7-2(1Н,д, J - 4,8 Гц), 5,65 (1Н,дд, J - 8,1 Гц, 4,8 Гц), 5,,85 Он.м),
5,79 (2Н,д, J - 55,3 Гц), 7,10 (1Н,д, J - 15,4 Гц), 7,66 Он,с), 8,15 ОН,с) 8,22 (2Н,с), 9,70 (1Н,д, J - 8,1 Гц) ,
1750, 1660 (ДМСО-dg) 1,,98 (1Н,м), 2,37-2,42 (1Н,м), 3,46 (1Н,д, J - 16,9 Гц),о 1590, 1510 3,60-3,83 (5Н,м), 4,06 (2Н,с), 4,26 (2Н,м), 4,52 (1Н,м), 5,06 ОН,д. % 7-3 J - 4,8 Гц), 5,65 Он.дд, J - 8,1 Гц, 4,8 Гц), 5,72-5,84 (1Н,м), 5,79
(2Н,д, J - 55,0 Гц), 7,Ю (1Н,д, J - 15,8 Гц), 7,65 ОН,с), 8,18 (1Н,с), 8,22 (2Н,с), 9,70 (1Н,д, J - 8,1 Гц)
1765,1670(ДМСО-dj 2,95 (2Н,с), 3,,5 (8н,м), 3,52 (1Н,д, J - 16,9 Гц), 3,76
1595,1525Он,д, J - 16,9 Гц), 4,08 (2Н,м), 5,12 (1Н,д, J - 4,8 Гц), 5,71-5,85 (ЗН,м),
87,14 (1Н,д, J - 15,8 Гц), 7,16 (1Н, шир.с), 8,21 (2Н,с), 9,74 (1Н,д, J - 8,1 Гц)
1760, 1650(ДМСО-dg) 1,74 (2Н, шир.с), 2,01 (2Н,шир.с), 3,2-3,8 (6Н,м), 3,81 (1Н,с)
1590, 15304,02 (2Н,с), 4,28 (2Н,с), 5,05 и 5,06 (всего 11Н,д, J 5,1 Гц), 5,6-5,8 ю
9ОН,м), 5,64 (1Н,дд, J - 5,1 Гц, 8,1 Гц), 5,78 (2Н,д, J - 55,3 Гц),
7,14 (1Н,д, J - 15,8 Гц), 7,71 (1Н,с), 8,22 (ЗН,с), 9,69 (1Н,д, J - 8,1 Гц), 1750, 1660(ДМСО- 16) 1,35 (ЗК,с), 3,1-4,0 (12Н,м), 4,1-4,3 (1Н,м), 4,50 (2Н,д, J - 1610, 15903,6 Гц), 5,07 (1Н,д, J - 4,8 Гц), 5,6-5,8 (2Н,м), 5,76 (2Н,д, J - 52,0 Гц), Ю7,15 (1Н,д, J - 15,7 Гц), 8,22 (2Н,с), 9,70 (1Н,д, J - 8,0 Гц)
, 1760, 1670{ДМСО-dg) 1,50 (ЗН,д, J - 6,6 Гц), 2,00 (4Н, шир.с), 3,47 (1Н,д, J - 17,0 Гц),
11-1 1590, 15203,45-3,70 (ЗН,м), 3,63 (1Н,д, J - 17,0 Гц), 3,85-3,95 (1Н,м), 4,07 (2Н,м),
ю
4, (1Н,м), 5,07 (1Н,д, J - 4,8 Гц), 5,65 (1Н, дд, J - 4,8 Гц, 8,0 Гц), 5,7-5,8 (1Н,м), 5,78 (2Н,д, J - 55,0 Гц), 7,16 (1Н,д, J - 15,8 Гц), 7.69 (1Н,с), 8,23 (2Н,с), 8,36 ОН,с), 9,71 (1Н,д, J - 8,0 Гц) 1765, 1680 (ДМСО-dg) 1,49 (ЗН,д, J - 6,6 Гц), 2,00 (4Н, шир.с), 3,47 (1Н,д, J - 17,0 Гц), 11-2 1600, 1525 3,5-3,70 (ЗН.м), 3,59 (1Н,д, J - 17,0 Гц), 3,,9 (1Н,м)„ 4,07 (2Н,м),
4,25-4,35 ОН,м), 5,07 (1Н,д, J - 5,0 Гц), 5,Ьб (1Н,дд, J - 5,0 Гц, 8,4 Гц), 5,70-5,85 ОН,м), 5,78 (2Н,д, J - 55,0 Гц), 7,16 (1Н,д, J - 15.4 Гц), 7,69 ОН,с), 8,22 (2Н,с), 8,50 Он,с), 9,70 (1Н,д, J - 8,4 Гц)
1760, 1670 (ДМСО-de) 3,14 (ЗН,с), 3,15 (ЗН.с), 3,47 (1Н,д, J - 17 Гц), 3,65 (1Н,д, 1590 J - 17 Гц), 4,02 (2Н,с), 4,16 (2Н,д, J - 8 Гц), 5,Об (1Н,д, J - 5 Гц), 5,65
12ОН.АД, J - 5 Гц), 8 Гц), 5,60 (1Н,м), 5,80 (2Н,д, J - 55 Гц), 7,16 (1Н,д,
J - 15 Гц), 7,64 (1Н,с), 8,19 ОН,с), 8,22 (2Н,с), 9,70 (1Н,д, J - 8 Гц) 1765. 1650 (AMCO-d6) 3,01 (ЗН,с), 3,15-3,4 (4Н,м), 3,4-3.55 (ЗН.м), 3,67 (1Н,д, J - 16 Гц), Ј
13 1590 3,7-3,8 (2Н,м), 4,11 (2Н,м), 5,07 (1Н,д, J - 5 Гц), 5,66 (1Н, дд,§
J - 5 Гц, 8 Гц), 5,70 (1Н,м), 5,78 (2Н,д, J - 55 Гц), 6,27 (2Н,с), 7,19 - (1Н,д, J - 16 Гц), 8,20 (2И,с), 8.20 (2Н,с), 9,70 (1Н,д, J - 8 Гц) 1760, 1665 (ДМСО-dJ 2,17 (ЗН,с), 3,09 (ЗН.с), 3,10 (ЗН.с), 3,45 (1Н,д, J - 17 Гц),
14 1595 3,63Д1П,Д, J - 17 Гц), 4,10 (2Н,д, J - 8 Гц), 4,48 (2Н,с), 5,Об (1Н,д,
J - 5 Гц), 5,64 Он.дд, J - 5 Гц, 8 Гц), 5,68 (1Н, дт, J - 8 Гц, 16 Гц), 5,79 (2Н,д, J - 55 Гц), 7,12 (1Н,д, J - 16 Гц), 8,22 (2Н,с), 9,70 (1Н, J - 8 Гц)
1765, 1680 (ДМСО-dJ 3,07 (ЗН.с), 3,14 (ЗН,с), 3,47 Он.д, J - 16,9 Гц), 3,67 Он,д, 1590, 1525 J - 16,у Гц), 3.86 (1Н,дд, J - 5,9 Гц, 12,1 Гц), 4,01 (1Н,т, J - 5,9 Гц),
154,08 ОН,дд, J - 5,9 Гц, 12,1 Гц), 1,8 (2Н,м), 5,07 (1Н,д, J - 5,1 Гц),
5,67 Он.дд, J - 5,1 Гц, 8,1 Гц), 5,76 (1Н,м), 5.78 (2Н,д, J - 55,2 Гц), 7,13 OH,A,.J - 15,8 Гц), 7,76 (1Н,с), 8,22 (2Н,с), 8,33 Он.с), 9,70 (1Н,д, J - 8,1 Гц)
Таблица 4
Продолжение табл. 4
| ПНЕВМАТИЧЕСКАЯ ТРАМБОВКА | 1999 |
|
RU2157293C1 |
| кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| опублик | |||
| Приспособление для установки двигателя в топках с получающими возвратно-поступательное перемещение колосниками | 1917 |
|
SU1985A1 |
Авторы
Даты
1992-01-15—Публикация
1988-03-03—Подача