Изобретение относится к новым производным глутаминовой кислоты, обладающим ценными ингибирующими свойствами на ферменте, использующим фолиевую кислоту или ее метаболиты в качестве субстратов и находящим применение в медицине, а также к способу их получения.
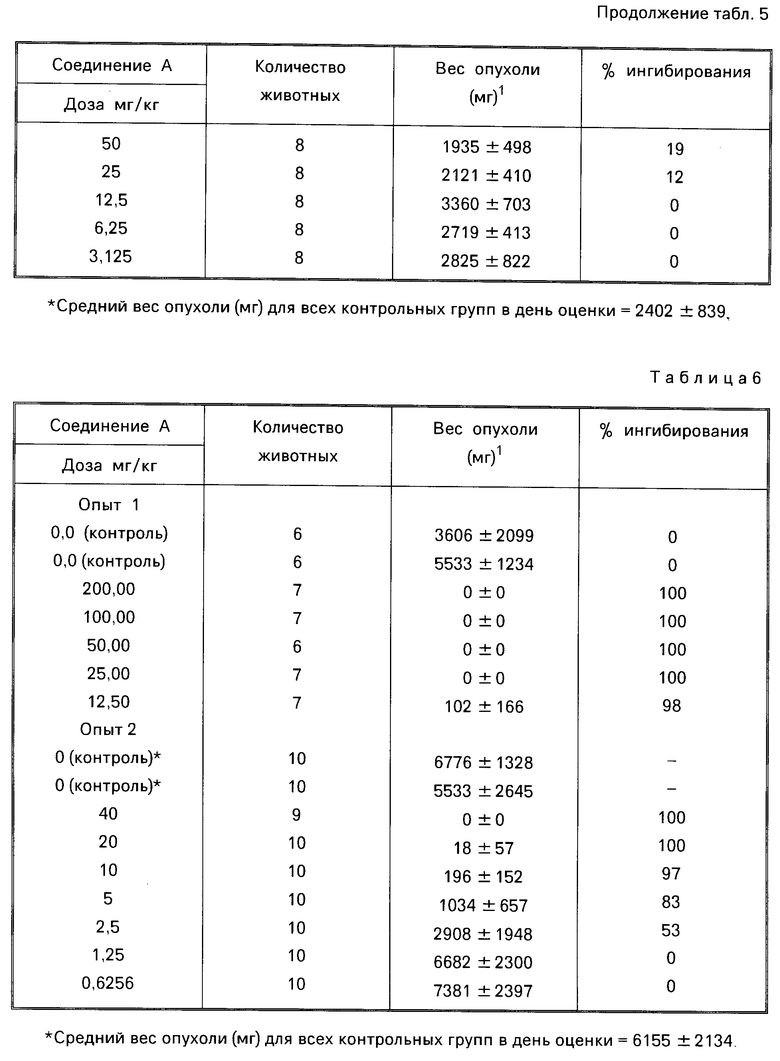
Более конкретно настоящее изобретение касается производных N-(пирроло/2,3-d/пиримидин-3-илацил)-L-глутаминовой кислоты общей формулы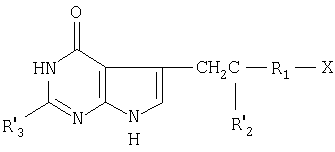 (I) где R1-1,4-фенилен, незамещенный или замещенный хлором или фтором, тиендиил, фурандиил, циклогександиил или С2-С4-алкандиил;
(I) где R1-1,4-фенилен, незамещенный или замещенный хлором или фтором, тиендиил, фурандиил, циклогександиил или С2-С4-алкандиил;
R2 водород, метил или гидроксиметил;
R3 водород, С1-С6-алкил или аминогруппа;
* S-конфигурация помеченного атома углерода, или их таутомеров или фармацевтически приемлемых солей.
Способ получения производных N-(пирроло/2,3-d/пиримидин-3-илацил)-L-глута-миновой кислоты общей формулы (I) или ее таутомера, или их фармацевтически приемлемой соли заключается в том, что соединение общей формулы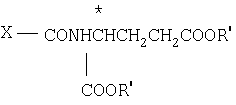 (II) где Х-СOOR' или -CONH
(II) где Х-СOOR' или -CONH CH2COOR′;
CH2COOR′;
Z водород или Z вместе с R2' углерод-углеродная смесь;
R2 водород или защитная группа для карбоксила;
R1 и * имеют указанные значения;
R2' независимо от Z водород, метил, гидроксиметил или защищенный гидроксиметил;
R3' водород, С1-С6-алкил, аминогруппа или низшая алканоиламиногруппа,
подвергают каталитической гидрогенизации, полученное соединение общей формулы (III) где R1, R2', R3' и * имеют указанные значения, а Х СOOR',
(III) где R1, R2', R3' и * имеют указанные значения, а Х СOOR',
вводят в реакцию с защищенной глутаминовой кислотой для получения соединения где X-CONH CH2COOR′ и подвергают кислотному или щелочному гидролизу, либо тому и другому для превращения R' карбоксизащищенная группа в водород или соль, R2'- защищенный гидроксиметил в гидроксиметил, R3' алканоиламиногруппа в аминогруппу.
CH2COOR′ и подвергают кислотному или щелочному гидролизу, либо тому и другому для превращения R' карбоксизащищенная группа в водород или соль, R2'- защищенный гидроксиметил в гидроксиметил, R3' алканоиламиногруппа в аминогруппу.
Предпочтительно получение соединения формулы (I), где R' незамещенный 1,4-фенилен; R2 водород; R3 водород, метил или аминогруппа, щелочным гидролизом соединения формулы (II), где R2' C1 C6-алкил.
Предпочтительно получение N-{ 4-[2-(4-гидрокси-6-аминопирроло/2,3-d/пиримид- ин-3-ил)этил]бензоил} -L-глутаминовой кислоты или ее фармацевтически приемлемой соли из диалкил-N-4-[2-(4-гидрокси-6-аминопирроло/2,3-d/пиримидин-3-ил)этил]бе- нзоил} -L-глутамината.
П р и м е р 1. 3-Йод-4-гидрокси-6-пивалоиламинопирроло/2,3-d/ пиримидин.
Смесь 3 г (0,02 ммоль) 4-гидрокси-6-аминопирроло/2,3-d/-пиримидина и 8,4 г (0,07 ммоль) пивалоил хлорида в 40 мл пиридина перемешивают 30 мин при 80-90оС. Затем смесь упаривают досуха и остаток растворяют в 30 мл метанола. Добавление 10% -ого водного аммиака дает 4,2 г (89%) 4-гидрокси-6-пивало-иламинопирроло/2,3-d/пири- мидина, который может быть очищен хроматографией на силикагеле с использованием в качестве элюента 8%-ного метанола в метиленхлориде.
Тпл. 295оС, ПМР (d6-ДМСО) (δ) 1,20 (с, 9Н), 6,37 (д, J=3,4 Гц, 1Н), 6,92 (д, J=3,4 Гц, 1Н) 10,78 (с, 1Н), 11,56 (с, 1Н) 11,82 (с,1Н).
Вычислено, С 56,40; Н 6,02, N 23,92.
С11Н14N4O2.
Найдено: С 56,16; Н 6,01; N 23,67.
К смеси 4,7 г (20 ммоль) 4-гидрокси-6-пивалоиламинопирроло (2,3-d)пиримидина в 20 мл диметилформамида добавляют 9,9 г (44 моль) N-йодосукцинамида. Смесь перемешивают при комнатной температуре в темноте 18 ч. Большую часть диметилформамида удаляют упариванием, и остаток суспензии выливают в 300 мл воды. Полученное твердое вещество собирают фильтрацией и сушат в вакууме над фосфорным ангидридом (Р2О5) и получают 2,4-дийод-4-гидрокси-6-пивалоиламинопирроло (2,3-d) пиримидин, который очищают хроматографией на силикагеле, используя в качестве элюента 2,5%-ный метанол в метиленхлориде.
Т.пл. >290оС.
ПМР (d6 ДМСО) (δ), 1,18 (с, 9Н), 10,85 (с, 1Н), 11,85 (с, 1Н), 12,42 (с, 1Н).
Вычислено, С 27,18; Н 2,49; N 11,53; J 52,22.
С11Н12N4O2J2.
Найдено, С 27,51; Н 2,51; N 11,27; J 52,02.
Аналогично используя 4-гидрокси-6-метилпирроло(2,3-d)пиримидин и 4-гидроксипирроло(2,3-d)пиримидин (7-деазагипок- сантин), соответственно получают 2,3-дийод-4-гидрокси-6-метилпирроло /2,3-d/пиримидин и 2,3-дийод-4-гидроксипирроло/ 2,3-d/пиримидин. Т.пл.> 205оС (соединение теряет йод).
ПМР (d6-ДМСО) (δ), 7,79 (с, 1Н), 11,93 (с, 1Н), 12,74 (с. 1Н).
К смеси 4,86 г 2,3-дийод-4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидина в 100 мл ледяной уксусной кислоты и 25 мл воды добавляют 1,3 г (200 ммоль) порошка цинка. Смесь перемешивают при комнатной температуре 18 ч, разбавляют 500 мл воды и охлаждают. Твердое вещество отделяют фильтрацией и сушат в вакууме над фосфорным ангидридом (Р2О5), получают 2-йод-4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин, который может быть очищен хроматографией на силикагеле, используя в качестве элюента 2,5%-ный метанол в метиленхлориде. Т.пл. >240оС.
ПМР (d6-ДМСО) (δ), 1,20 (с, 9Н), 7,12 (д, J=1,8 Гц, 1Н), 10,82 (с, 1Н), 11,79 (с, 1Н), 11,89 (с, 1Н).
Вычислено, С 36,69, Н 3,64, N 15,56, J 35,24.
С11H13N4O2J.
Найдено, С 36,91, Н 3,58, N 15,65, J 35,56.
Аналогичным способом из 2,9-дийод-4-гидрокси-6-метилпирроло /2,3-d/пиримидина и 2,3-дийод-4-гидроксипир- роло/2,3-d/пиримидина соответственно получают 3-йод-4-гидрокси-6-метилпирроло/2,3-d/ пиримидин и 3-йод-4-гидроксипирроло/2,3-d/пиримидин.
Тпл > 245оС (соединение теряет йод).
ПМР (d6-ДМСО) (δ) 7,20 (д, J=2,2 Гц, 1Н), 7,82 (д, J=2,8 Гц, 1Н), 11,85 (д, J=1,1 Гц, 1Н), 12,17 (с, 1Н).
П р и м е р 2. Диметил-N-[4-(4-гидрокси-6-пивалоиламинопирроло [2,3-d/пиримидин-3-илэтинил)бензоил]-L-глутамат.
К смеси 3,6 г (10 моль) хорошо высушенного 3-йод-4-гидрокси-6-пивалоиламинопирроло/2,3-d/пиримидина в 40 мл диметилформамида добавляют 4 г (13,19 ммоль) диметил-N-(4-этинилбензоил)-L-глутамата, 0,38 г йодида меди (1), 3 мл триэтиламина и 1 г тетракис (трифенилфос- фин)палладия. Эту смесь перемешивают при комнатной температуре 2 ч, а затем выливают в 500 мл воды. Собирают твердое вещество фильтрацией, сушат на воздухе, после этого нагревают с обратным холодильником в 200 мл метанола. Смесь охлаждают и собирают твердое вещество фильтрацией, растворяют в 2 л 10%-ного метанола в метиленхлориде и хроматографируют. Начальные черные полосы вновь хроматографируют, и соединенные бесцветные полосы из первой и второй процедур упаривают и получают 3,5 г диметил -N-[4-(4-гидрокси-6-пивалоиламинопирроло/2,3-d/ пиримидин-3- илэтинил)бензоил /-L-глутамат, который может быть очищен перекристаллизацией из 50%-ного метанола в метиленхлориде. Т.пл. 280-285оС.
ПМР (d6-ДМСО) (δ), 1,21 (с, 9Н), 1,96-2,15 (м, 2Н), 2,44 (т, J=7,5 Гц, 2Н), 3,56 (с, 3Н), 3,62 (с, 3Н), 4,40-4,45 (м, 1Н), 7,43 (с, 1Н), 7,53 (д, J= 8,4 Гц, 2Н), 7,87 (д, J=8,4 Гц, 2Н), 8,82 (д, J=7,4 Гц, 1Н), 10,95 (с, 1Н), 11,95 (с, 1Н).
Вычислено, С 60,56, Н 5,46, N 13,08.
С27Н29N5O7.
Найдено, С 60,55, Н 5,46, N 12,89.
Аналогично используя эквивалентные количества диметил-N-(пент-4-иноил)-L-глутамата, диметил-N-(гепт-6-еноил)-L- глутамата и диметил-N-(гекс-5-иноил)-L-глута- мата, получают диметил-N-(5-(4-гидрокси-6-пивалоиламинопирроло(2,3-d)пиримидин-3-ил) -4-ино- ил)-L-глутамат, диметил-N-(7-(4-гидрокси-6-пивалоиламинопирроло/2,3-d/ пиримидин-3-ил)гепт-6-еноил/-L-глутамат и N-/6-(4-гид- рокси-6-пивалоиламинопирроло/2,3-d/ пиримидин-3-ил) гекс-5-иноил/-L-глутамат.
Диметил-N-(гекс-5-иноил)-L-глутамат может быть получен путем реакции хлорида гекс-5-иноивой кислоты (полученного воздей- ствием хлоридатионила на гекс-5-иноивую кислоту) с диметилом-L-глутаматом в присутствии акцептора кислоты, такого как триэталамин. Гекс-5-иноивая кислота в свою очередь может быть получена щелочным гидролизом 5-цианопент-1-иена.
П р и м е р 3. Диэтил-N-[4-{1-гидрокси-3-(4-гидрокси-6-аминопирроло /2,3-d/ пиримидин-3-ил)проп-2-ил}бензоил]-L-глутамат.
Смесь 14,6 г 3-йод-4-гидрокси-6-пивалоиламинопирроло/2,3-d/ пиримидина, 7,7 г 2-(2-пропинилокси)тетрагидропирана, 798 мл (10%) хлорида палладия, 2,36 г (20% ) трифенилфосфина, 428 мг одновалентного йодида меди, 45 мл триэтиламина и 700 мл ацетонитрила кипятят с обратным холодильником в азоте 12 ч. Затем к горячей реакционной смеси добавляют 3,2 г (2-пропинилокси) тетрагидрофурана и продолжают кипячение с обратным холодильником еще 12 ч. Далее растворитель удаляют при пониженном давлении и остаток фильтруют через силикагель с использованием 2%-ного метанола в метиленхлориде. Этот фильтрат концентрируют и хроматографируют на силикагеле, используя в качестве элюента смесь этилацетата и гексана в соотношении 20:1, и получают 3-(3-тетрагидропир-2-илоксипроп-1-ин-1-ил)-4-гидрокси-6- пивалоиламинопирроло(2,3-d)пиримидин, который далее очищают перекристаллизацией из этилацетата.
Смесь 2 г 3-(3-тетрагидропир-2-илоксипроп-1-ин-1-ил)-4 -гидрокси-6-пивалоиламинопирроло(2,3-d)пиримидина, 40 мл метанола, 20 мл хлороформа, 40 мл 5% -ного палладия на сульфате бария и 40 мг синтетического хинолина перемешивают при давлении водорода в 1 атм 40 мин. Затем удаляют упариванием растворитель и остаток разбавляют метиленхлоридом. Раствор фильтруют через силикагель с использованием 2%-ного метанола в метиленхлориде для удаления катализатора и затем фильтрат концентрируют, получают масло, которое после добавления эфира дает 3-(3-тетрагидропир-2-илоксипроп-1-ен-1-ил)- 4-гидрокси-6-пивалоиламинопирроло (2,3-d)пиримидин, который может быть очищен колоночной хроматографией, используя в качестве элюента этилацетат с последующей перекристаллизацией из этилацетата.
Смесь, содержащую 3,48 г 3-(3-тетрагидропир-2-илоксипроп-1-ен-1-ил)-4-гидро- кси-6-пивалоиламинопирроло (2,3-d)пиримидина, 3,12 г (1,2 эквив) диэтил-N-(4-йодбензоил)глутамата, 546 мг (20%) трис-(2-метилфенил)форсфина, 201 мг (10%) ацетата палладия и 85,5 мг (5%) йодида одновалентной меди в 15 мл триэтиламина и 240 мл ацетонитрила кипятят с обратным холодильником в атмосфере азота. Через 12 ч добавляют 1,17 г диэтил-N-(4-йодбензоил)глутамата и смесь опять кипятят с обратным холодильником в азоте еще 12 ч. Затем смесь концентрируют при пониженном давлении и остаток хроматографируют на силикагеле, используя смесь этилацетата и гексана в соотношении 20:1 в качестве элюента. Концентрат растворяют в смеси этилацетата и эфира в соотношении 1: 5, и этот раствор помещают в морозильник на 15 ч. Собирают фильтрацией твердое вещество, промывают холодным этилацетатом и сушат, получают диэтил-N-(4-(1-тетрагидропир-2-илокси-3)-4-гидрокси-6-пивалоилами- нопирроло) (2,3-d)пиримидин-3-ил)про-2-ен-2-ил(бензоил)глутамат.
П р и м е р 4. Диметил-N-[/5-(4-гидрокси-6-пивалоиламинопирроло) 2,3-d-пиримидин-3-ил)этинил/тиен-2-илкарбонил]-L-глу- тамат.
Смесь 2,0 г 3-йод-4-гидрокси-6-пивалоиламинопирроло/2,3-d/пиримидина, 1,2 г триметилсилилацетилена, 0,1 г хлорида палладия, 0,23 г трифенилфосфина, 0,06 г йодида одновалентной меди и 2,6 г триэтиламина в 100 мл ацетонитрила нагревают в запаянном сосуде 1,5 ч при 50оС и затем кипятят с обратным холодильником 3 ч. Растворитель удаляют при пониженном давлении, осадок растирают в порошок со смесью этилацетата и гексана в соотношении 1:1 и отфильтровывают. Полученное таким образом твердое вещество растворяют в метиленхлориде, и этот раствор пропускают через силикагель, используя 1%-ный метанол в метиленхлориде. Элюент концентрируют и получают 3-триметилсилилэтинил-4-гидрокси-6-пивало- иламинопирроло/2,3-d/ пиримидин.
К раствору 1,5 г 3-триметилсилилэтинил-4-гидрокси-6-пивалоиламинопирроло/2,3-d/ пиримидина в 100 мл безводного тетрагидрофурана, охлажденного до 0оС, добавляют в атмосфере азота 4,74 мл 1М фторида тетрабутиламмония в безводном тетрагидрофуране. Через 5 мин реакционную смесь доводят до комнатной температуры и затем перемешивают 2 ч. Растворитель удаляют при пониженном давлении, и остаток очищают хроматографией на силикагеле, что дает 3-этинил-4-гидрокси-6-пивалоиламинопирроло/2,3-d/пи- римидин.
Смесь 1,70 г 3-этинил-4-гидрокси-6-пивалоиламинопирроло/2,3-d/ пиримидина, 2,30 г диметил-N-(5-бромтиен-2-илкарбонил)-L-глутамата, 44 мг хлорида палладия, 130 мг трифенилфосфина, 25 г йодида одновалентной меди и 1,13 мл триэтиламина в 30 мл ацетонитрила кипятят с обратным холодильником 3 ч и затем охлаждают до комнатной температуры. Растворитель удаляют при пониженном давлении, и остаток хроматографируют на колонне (фирмы Вотерс 500), элюируя смесью метанола и метиленхлорида в соотношении 1:19, что дает диметил-N-[/5-(4-гидрокси-6-пивалоиламинопир- роло/2,3-d/ пиримидин-3-ил)этинил/тиен-2-илкарбонил]-L-глутамат.
Заменяя на эквивалентное количество диэтил-N-/4-бромтиен-2-илкарбонил/-L-глу тамата и диэтил N-/5 -бромтиен-3-илкарбонил/-L-глутамата в указанном процессе соответственно получают диэтил-N-[4-(4-гид- рокси-6-пивалоиламинопирроло/2,3-d/пи- римидин-3 -илэтинил)тиен-2-илкарбонил]-L-глутамат и диэтил-N-[5-(4-гидрокси-6-пивалоиламинопирроло/2,3-d/ пиримидин- 3-илэтинил)тиен-3-илкарбонил]-L-глутамат.
Таким же образом могут быть получены диэтил-N-[4-(4-гидрокси-6- пивалоиламинопирроло/2,3-d/пиримидин-3-илэтинил)фур- -2-илкарбонил] -L-глутамат и диэтил-N-[5-(4-гидрокси-6-пивалоиламинопирроло/2,3-d/ пиримидин -3-илэтинил)фур-3-илкарбонил] -L-глутамат из диэтил N-(4-бромфур-2-илкарбонил)-L-глутамата и диэтил-N-(5-бром- фур-3-илкарбонил)-L-глутамата соответственно.
Аналогично из диметил N-(2-фтор-4-йодобензоил)-L-глутамата и N-(3-фтор-4-иодобензоил)-L-глутамата получают диметил-N-[2-фтор-4-(4-гидрокси-6-пивало- иламинопирроло/2,3-d/ пиримидин-3-илэтинил)бензоил]-L-глутамат и диметил-N-[3-фтор-4-(4-гидрокси-6-пивалоиламинопирро- ло/2,3-d/ пиримидин-3-илэтинил)бензоил]-L-глутамат.
П р и м е р 5. Диметил-N-[4-(4-гидроксипирроло/2,3-d/пиримидин -3-илэтинил)бензоил]-L-глутамат.
Реакцией 3-йод-4-гидроксипирроло/2,3-d/пиримидина в диметил-N- (4-этинилбензоил)-L-глутаматом способом, указанным в примере 2, получают диметил-N-[4-(4-гидроксипирроло/2,3-d/пиримидин -3- илэтинил)бензоил]-L-глутамат, который очищают хроматографией на силикагеле.
Т.пл. 106оС (разл.).
ПМР (d6-ДМСО) (δ) 1,98-2,15 (м, 2Н), 2,45 (т, J=7,5 Гц, 2Н), 3,57 (с, 3Н), 3,64 (с, 3Н), 4,40-4,45 (м, 1Н), 7,51 (д, J=2,5 Гц, 1Н), 7,55 (д, J=8,2 Гц, 2Н), 7,87 (с, 1Н), 7,90 (д, J=8,2 Гц, 1Н), 11,97 (д, J=3,7 Гц, 1Н), 12,31 (с, 1Н).
Аналогично замещая на эквивалентное количество метил-4- этинилбензоата, 4-этинилтолуола, 4-этинилбензола, 4-этинилхлорбензола, 4-этинилфторбензола, 3-этинилфторбензола и 1-метокси-4-этинилбензола в способе примера 2, получают метил-4-(4-гидрокси-6-пивалоиламинопирро-ло/2,3-d/пиримидин -3-илэтинил)бензоат, 3-(4-метилфенил)этинил-4-гидрокси-6-пива- лоиламинопирроло/2,3-d/ пиримидин, 3-фенилэтинил-4-гидрокси-6-пивалоаминоп-ирроло/2,3-d/пиримидин, 3-(4-хлорфенил)этинил-4-гидрокси-6-пивалоиламиноп- ирроло/2,3-d/ пиримидин, 3-(4-фторфенил)этинил-4-гидрокси-6-пивалоиламиноп- ирроло /2,3-d/пиримидин, 3-(3-фторфенил)этинил-4-гидрокси-6-пивалоиламиноп- ирроло/2,3-d/ пиримидин и 3-(4-метоксифенил)этинил-4-гидрокси-6-пивалоаминопир- роло/2,4-d/ пиримидин.
Использование 3-йод-4-гидроксипирроло/2,3-d/пиримидина вместо 3-йод-4-гидрокси-6-пивалоиламинопирроло/2,3-d/пи- римидина с метил-4-этинилбензоатом, 4-этинилтолуолом, 4-этинилхлорбензолом, 4-этинилфторбензолом, 3-этинилфторбен- золом и 1-метокси-4-этинилбензолом дает соответственно метил-4-(4-гидроксипирроло/2,3-d/пиримидин-3-илэтинил)-бензоат, 3-(4-метилфенил)этинил-4-гидроксипирроло /2,3-d/пиримидин, 3-фенилэтинил-4-гидроксипирроло/2,3-d/пиримидин, 3-(4-хлорфенил) этинил-4-гидроксипирроло/2,3- d/пиримидин, 3-(4-фторфенил)этинил -4-гидроксипирроло/2,3-d/пиримидин, 3-(4-меткосифенил)этинил-4- гидроксипирроло/ 2,3-d/пиримидина.
10 г 3-йод-4-гидрокси-6-метилпирроло/2,3-d/пиримидина вводят в реакцию с 2,19 г 80% масляной дисперсии гидрида натрия и 75 мл сухого диметилформамида. Через 30 мин добавляют 6,02 г хлорметилпивалата. Эту смесь перемешивают 3 ч, выливают в воду и нейтрализуют уксусной кислотой. Твердое вещество подвергают хроматографии на силикагеле, используя ацетон-метиленхлорид в качестве элюента и сначала получают 3-йод-4-гидрокси-1,5-бис-(пивалоилокси)-1-метилпирроло/2,3-d/ пиримидин с Т.пл. 155оС, а затем 3-йод-4-гид- рокси-5-пивалоилокси-6-метилпирроло/2,3-d/пиримидин с Т.пл. 236оС.
Использование 3-йод-4-гидрокси-5-пивалоилокси-6-метилпирроло/2,3-d/пирими- дина в способе примера 2 дает диметил-N-[4-(4-гидрокси-5-пивалоилокси -6-метилпирроло/2,3-d/пиримидин-3-илэтилен) бензоил]-L-глутамат с Т. пл. 196оС.
Вычислено, С 61,70, Н 5,71, N 9,92.
С29Н32N4O8.
Найдено, С 61,90, Н 5,71, N 9,95.
Использование 3-йод-4-гидрокси-5-пивалоилокси-6-метилпирроло/2,3-d/пирими- дина вместо 3-йод-4-гидрокси-6-пивалоиламинопирроло/2,3-d/пиримидина с метил-4-этилбензоатом, 4-этинилтолуолом, 4-эти- нилбензолом, 3-этинилфторбензолом и 1-метокси-4-этинил-бензолом дает метил-4-(4-гидрокси-5-пивалоилокси-6-метилпирро- ло/2,3-d/пиримидин- 3-илэтинил) бензоат, 3-(4-метилфенил)этинил-4-гидрокси-5-пива- лоилокси-6-метилпирроло/2,3-d/ пиримидин, 3-фенилэтинил-4-гидрокси-5-пивалоилокси-6-метилпирроло/2,3-d/ пиримидин, 3-(4-хлорфенил)этинил-4- гидрокси-5-пивалоилокси-6- метилпирроло /2,3-d/пиримидин, 3-(4-фторфенил)этинил-4-гидрокси-5- пивалоилокси-6-метилпирроло /2,3-d/пиримидин и 3-(4-метоксифенил)этинил-4-гидрокси-5-пивалоилокси-6-метилпирроло /2,3-d/пиримидин.
П р и м е р 6. Диметил-N-{4-/2-(4-гидрокси-6-пивалоиламинопирроло/2,3-d/пири- мидин -3-ил)этил/бензоил}-L-глутамат.
Смесь 1,0 г диметил-N-/4-(4-гидрокси-6-пивалоиламинопирроло/2,3-d/пиримидин -3-илэтинил)бензоил/-L-глутамат с 250 мл 50%-ного метанола в метиленхлориде и 0,8 г 3%-ного палладия на угле гидрируют при давлении 50 ф/дюйм в течение 3 ч, профильтровывают и концентрируют при пониженном давлении. Собирают твердое вещество фильтрацией, сушат и получают 0,72 г диметил-N-{ 4-/2-(4-гидрокси-6-пивалоиламино-пирроло/2,3-d/ пиримидин-3-ил)этил/бензоил}-L-глутамат. Т.пл. 247оС.
ПМР (d6-ДМСО) (δ) 1,21 (с, 9Н), 1,90-2,12 (м, 2Н), 2,42 (т, J 7,4 Гц, 2Н), 2,92 (т, J=4 Гц, 2Н), 2,97 (т, J 4 Гц, 2Н), 3,55 (с, 3Н), 3,61 (с, 3Н), 4,38-4,45 (м, 1Н), 6,61 (с, 1Н), 7,27 (д, J=8,2 Гц, 2Н), 7,75 (д, J=8,2 Гц, 2Н), 8,64 (д, J=7,4 Гц, 1Н), 10,75 (с, 1Н), 11,22 (с, 1Н3).
Вычислено, С 60,10, Н 6,17, N 12,98.
С27Н33N5O7.
Найдено, С 59,94, Н 6,15, N 12,72.
П р и м е р 7. Диметил-N-{5-/2-(4-гидрокси-6-пивалоиламинопирроло/2,3-d/пири- мидин-3-ил) этил/тиен-2-илкарбонил}-L-глутамат.
Гидрированием в условиях примера 6 диметил-N-/5-(4-гидрокси-6-пивалоилами-нопирроло/2,3-d/пиримидин -3-ил) этинил/тиен-2-илкарбонил-L-гутамата получают диметил-N-{ 5 -/2-(4-гидрокси-6-пива- лоиламинопирроло/2,3-d/пиримидин-3-ил) этил/ тиен-2-карбонил}-L-глутамат.
Аналогично гидрируют в условиях примера 6 следующие соединения:
а) диметил-N-/2-фтор-4-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-илэтинил)бензоил/-L-глутамат;
б) диметил-N-/3-фтор-4-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-илэтинил)бензоил/-L-глутамат;
в) диметил-N-/4-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-илэтинил)тиен-2-илкарбонил/-L-глутамат;
г) диэтил-N-/5-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-илэтинил)тиен-3-илкарбонил/-L-глутамат;
д) диметил-N-/5-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-ил)пент-4-илоил/-L-глутамат;
е) диметил-N-/7-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-ил)гепт-6-еноил/-L-глутамат;
ж) диметил-N/6-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-ил)гекс-5-иноил/-L-глутамат;
з) метил-4-(4-гидрокси-6-пивалоаминопирроло /2,3-d/пиримидин-3-илэтинил)бензоат;
и) 3-(4-метифенил)этинил-4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин;
к) 3-фенилэтинил-4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин;
л) 3-(4-хлорфенил)этинил-4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин;
м) 3-(4-фторфенил)этинил-4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин;
н) 3-(3-фторфенил)этинил-4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин;
о) 3-(4-метоксифенил)этил-4-гидрокси-5-пивалоиламинопирроло /2,3-d/пиримидин;
п) метил-4 (4-гидрокси-5-пивалоилокси-6-метилпирроло /2,3-d/пиримидин-3-илэтинил)бензоат;
р) 3-(4-метилфенил)этинил-4-гидрокси-5-пивалоилокси-6-метилпирроло /2,3-d/пиримидин;
с) 3-фенилэтинил-4-гидрокси-5-пивалоилокси-6-метилпирроло /2,3-d/пиримидин;
т) 3-(4-хлорфенил)этинил-4-гидрокси-5-пивалоилокси-6-метилпирроло /2,3-d/пиримидин;
у) 3-(4-фторфенил)этинил-4-гидрокси-5-пивалоилокси-6-метилпирроло /2,3-d/пиримидин;
ф) 3-(4-метоксифенил)этинил-4-гидрокси-5-пивалоилокси-6-метилпирроло /2,3-d/пиримидин;
х) метил-4-(4-гидроксипирроло/2,3-d/пиримидин-3-илэтинил)-бензоат;
ц) 3-(4-метилфенил)этинил-4-гидроксипирроло /2,3-d/пиримидин;
ч) 3-фенилэтинил-4-гидроксипирроло/2,3-d/пиримидин;
ш) 3-(4-хлорфенил)этинил-4-гидроксипирроло/2,3-d/пиримидин;
щ) 3-(4-(фторфенил)этинил-4-гидроксипирроло/2,3-d/пиримидин;
э) 3-(4-метоксифенил)этинил-4-гидроксипирроло/2,3-d/пиримидин,
и получают:
а) диметил-N-[2-фтор-4 (4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-илэтил)бензоил]-L-глутамат;
б) диметил N-[3-фтор-4-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-илэтил)бензоил]-L-глутамат;
в) диэтил-N-/4-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-илэтил)тиен-2-илкарбонил/-L-глутамат;
г) диэтил-N-/5-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-илэтил/тиен-3-илкарбонил/-L-глутамат;
д) диметил-N-/5-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-ил)пентил/-L-глутамат;
е) диметил-N-/7-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-ил)гептил/-L-глутамат;
ж) диметил-N-/6-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-ил)гексил/-L-глутамат;
з) метил-4-/2-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-ил)этил/бензоат;
и) 3-/2-(4-метилфенил)этил/-4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин;
к) 3-(2-фенилэтил)-4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин;
л) 3-/2-(4-хлорфенил)этил/-4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин;
м) 3-/2-(4-фторфенил)этил/-4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин;
н) 3-/2-(3-фторфенил)этил/-4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин;
о) 3-/2-(4-метоксифенил)этил/-4-гидрокси-6-пивалоаминопирроло /2,3-d/пиримидин;
п) метил-4-/2-(4-гидрокси-6-метилпирроло/2,3-d/пиримидин -3-ил)этил/бензоат;
р) 3-/2-(4-метилфенил)этил/-4-гидрокси-5-пивалоилокси-6-метилпирроло /2,3-d/пиримидин;
с) 3-/2-(4-хлорфенил)этил/-4-гидрокси-5-пивалоилокси-6-метилпирроло /2,3-d/пиримидин;
т) 3-/2-(4-фторфенил)этил/-4-гидрокси-5-пивалоилокси-6-метилпирроло /2,3-d/пиримидин;
у) 3-/2-(4-метоксифенил)этил/-4-гидрокси-5-пивалоилокси -6-метилпирроло/2,3-d/пиримидин;
ф) метил-4-/2-(4-гидроксипирроло/2,3-d/пиримидин-3-ил) этил/бензоат;
х) 3-/2-(4-метилфенил)этил/-4-гидроксипирроло/2,3-d/пиримидин;
ц) 3-(2-фенилэтил)-4-гидроксипирролом/2,3-d/пиримидин;
ч) 3-/2-(4-хлорфенил)этил/-4-гидроксипирроло/2,3-d/пиримидин;
ш) 3-/2-(4-фторфенил)этил/4-гидроксипирроло/2,3-d/пиримидин;
щ) 3-/2-(4-метоксифенил)этил/-4-гидроксипироло/2,3-d/пиримидин;
э) 3-/2-(4-метоксифенил)этил/-4-гидроксипирроло/2,3-d/пиримидин.
П р и м е р 8. Диэтил-N-[4-/1-(тетрагидропир-2-илокси)-3-/4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-ил/бензоил]-L-глутамат.
Раствор 1,16 г диэтил-N-[4-/1-(тетрагидропир-2-илокси)-3-(4-гидрокси-6-пивалоам- инопирроло /2,3-d/пиримидин-3-ил) проп-2-ен-2-ил/бензоил-L-глутамата и 174 мл (20%) аморфного оксида платины (IV) в 150 мл ледяной уксусной кислоты гидрируют в течение 10 ч при давлении 50 ф/дюйм. Полученную смесь разбавляют 50 мл метанола и фильтруют через целит. Фильтрат концентрируют и разбавляют этилацетатом. Полученное после 15 ч охлаждения твердое вещество собирают фильтрацией, промывают холодным этилацетатом, сушат и получают диэтил-N-{ 4-[1-(тетрагидропир-2-илок- си)-3-(4-гидрокси-6-пивалоамино-пирроло /2,3-d/пиримидин-3-ил)проп-2-ил]бензоил} -L-глутамат.
П р и м е р 9. Диметил-N-{4-[2-(4-гидроксипирроло/2,3-d/пиримидин -3-ил)этил] бензоил}-L-глутамат.
Смесь 1,1 г диметил-N-[4-(4-гидроксипирроло/2,3-d/ пиримидин-3-илэтинил)бензоил] -L-глутамата, 100 мл 50%-ного метанола в метиленхлориде и 0,8 г 3% -ного палладия на угле гидрируют при 50 ф/дюйм в течение 24 ч, фильтруют и концентрируют при пониженном давлении. К остатку добавляют эфир и собирают фильтрацией твердое вещество, сушат и получают 0,67 г диметил-N-{4-[2-(4-гидроксиаминопирроло/2,3-d/пиримидин-3-ил)этил] бензоил}-L-глутамата.
Т.пл. 170-172оС.
ПМР (d6 ДМСО) (δ) 1,94-2,14 (м, 2Н), 2,44 (т, J=7,4 Гц, 2Н), 2,93-3,03 (м, 2Н), 3,57 (с, 3Н), 3,63 (с, 3Н), 4,40-4,70 (м, 1Н), 6,71 (с, 1Н), 7,29 (д, J= 8,2 Гц, 2Н), 7,77 (м, 3Н), 8,66 (д, J=7,4, 1Н), 11,52 (с, 1Н), 11,71 (с, 1Н).
Аналогично из диметил N-[4-(4-гидрокси-5-пивалоилокси-6-метилпирроло/2,3-d/пиримидин-3- илэтилин)бензоил]-L-глутамата получают таким же способом диметил-N-{ 4-[2-(4-гидрокси-5-пивалоилокси-6-метилпирроло /2,3-d/пиримидин-3-ил)этил]бензоил}-L-глутамат.
П р и м е р 10. N-{4-/2-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-ил)этил/бензоил} -L-глутаминовая кислота.
Смесь 1,5 г N-{4- /2-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин -3-ил)этил/бензоил} -L-глутамата с 10 мл 1 N гидроокиси натрия перемешивают три дня при комнатной температуре для получения натриевой соли N-{4-/2-(4-гидрокси-6-аминопирроло /2,3-d/пиримидин-3-ил)этил/ бензоил} -L-глутаминовой кислоты. Полученное твердое вещество выделяют фильтрацией, перекристаллизовывают из 50% метанола в метиленхлориде, что дает 0,8 г (67%).
N-{ 4-/2-(4-гидрокси-6-аминопирроло/2, 3-d/пиримидин-3-ил) этил/бензоил} -L-глутаминовой кислоты.
ПМР (d6 ДМCO) (δ) 1,80-2,00 (м, 2Н), 2,10-2,30 (м, 2Н), 2,20 (м, 2Н), 2,89-2,93 (м, 2Н), 4,13-4,19 (м, 2Н), 6,25 (д, J 1,3 Гц, 1Н), 7,23 (д, J 8,1 Гц, 2Н), 7,69 (д, J 8,1 Гц, 2Н), 8,13 (д, J 6,7 Гц, 1Н), 10,55 (с, 1Н).
П р и м е р 11. Диэтил-N-{4-/1-гидрокси-3-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/ пиримидин-3-ил)проп-2-ил/бензоил}-глутамат.
Раствор 0,94 г диэтил N-{4-/1-(тетрагидропир-2-илокси)-3-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-ил)проп-2-ил/бензоил}глутамата в 40 мл 0,1 N метанольного раствора хлористого водорода перемешивают 2 ч при комнатной температуре. Реакционную смесь нейтрализуют раствором 205 мг карбоната натрия в 10 мл воды, и большую часть метанола удаляют упариванием при пониженном давлении. 100 мл метиленхлорида добавляют к раствору, и последний промывают дважды 20 мл воды, сушат безводным сульфатом магния и концентрируют. Остаток растирают в порошок со смесью этилацетата и эфира в соотношении 1:2, фильтруют и сушат, что дает диэтил-N-{4-[1-гидрокси-3-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-ил)проп-2-ил]бензоил}-L-глутамат.
П р и м е р 12. N-{4-[1-Гидрокси-3-(4-гидрокси-6-аминопирроло /2,3-d/пиримидин-3-ил)проп-2-ил]бензоил}глутаминовая кислота.
Раствор 0,3 г диэтил-N-{4-[1-гидрокси-3-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-ил)проп-2-ил] бензоил} глутамата в 9 мл 1 н. водной гидроокиси натрия перемешивают в азоте при комнатной температуре 12 ч. Реакционную смесь подкисляют до рН 4 с помощью 1 н. хлористоводородной кислоты и фильтруют. Полученное твердое вещество промывают водой (5 мл) и холодным этанолом (5 мл), сушат и получают N-{4-[1-гидрокси-3-(4-гидрокси-6-аминопирроло/2,3-d/ пиримидин-3-ил)проп-2-ил]бензоил} глутаминую кислоту.
Аналогично из диметил-N-{2-фтор-4-[2-(4-гидрокси-6- пивалоиламинопирроло/2,3-d/пиримидин-3-ил)этил] бензоил} -L-глута- мата и диметил-N-{3-фтор-4-[2-(4-гидрокси-6- пивалоиламинопирроло/2,3-d/-пиримидин-3-ил)этил] бензоил} -L-глутамата соответственно получают указанным способом N-{2-фтор-4-[2-(4-гидрокси-6-аминопирроло/2,3-d/пиримидин-3-ил) этил]бен- зоил}-L-глутаминовую кислоту с Т.пл.230оС (вспенивание), > 300оС (разложение) и N-{3-фтор-4-/2-(4-гидрокси -6-аминопирроло/2,3-d/пиримидин-3-ил)этил/бензоил} -L-глутаминовую кислоту с Т.пл. 300оС (разложение).
Аналогичным образом получают из диэтил-N-{4-/2-(4-гидрокси-пивалоиламинопи- рроло/2,3-d/ пиримидин-3-ил) этил/тиен-2-илкарбонил}-L-глутамата, диэтил -N-{ 5-/2-(4-гидрокси-6-пивалоиламинопирроло/2,3-d/пиримидин -3-ил) этил/тиен-3-илкарбонил} -L-глутамата, диметил-N-5-/2-/4/гидрокси-6-пивалоиламинопирроло/2,3-d/ пи- римидин-3-ил/этил/фур-2-илкарбонил}-L- глутамата, диметил-N-5-/2- (4-гидрокси-6-пивалоиламинопирроло/2,3-d/пиримидин -3-ил)этил/тиен-2-илкарбонил} -L-глутамата соединения N-{4-/2(4-гидрокси-6-аминопирроло/2,3-d/пиримидин-3-ил)этил/тиен- 2-илкарбонил} -L-глутаминовую кислоту, N-{5-/2-(4-гидрокси-6 -аминопирроло/2,3-d/пиримидин-3-ил)этил/тиен-3- илкарбо- нил}-L-глутаминовую кислоту, N-{5-/2-(4-гидрокси-6-аминопирроло/2,3-d/пиримид- ин-3-ил) этил/фур-2-илкарбонил}-L-глутаминовую кислоту, Т.пл. 200-203оС и N-{5-/2-(4-гидрокси-6-аминопирроло/2,3-d)пирими- дин-3-ил)этил /тиен-2-илкарбонил}-L-глутаминовую кислоту с Т.пл. 241-243оС.
Аналогично получают из диметил-N-/5-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-ил)пентаноил/-L-глутама- та, диметил-N-/7-(4-гидрокси-6-пивалоиламинопирроло /2,3-d/пиримидин-3-ил)гептаноил/-L-глутамата и диметил -N-/6- (4-гидрокси-6-пивалоиламинопирроло/2,3-d/ пиримидин-3-ил)гексаноил /-L-глутамата соответственно N-/5-(4-гид- рокси-6-аминопирроло/2,3-d/пиримидин- -3-ил/пентаноил/-L-глутаминовую кислоту, N-/7-(4-гидрокси-6-аминопирроло/2,3-d/пи-римидин-3-ил) гептаноил/-L-глутаминовую кислоту и N-/6-(4-гидрокси-6-аминопирроло/2,3-d/пиримидин-3- ил)гексаноил-L-глутаминовую кислоту.
П р и м е р 13. N-{4-/2-(4-гидроксипирроло/2,3-d/пиримидин -3-ил) этил/бензоил}-L-глутаминовая кислота.
Смесь 0,5 г диметил -N-{4-/2-(4-гидроксипирроло/2,3-d/пиримидин -3-ил)этил/ бензоил}-L-глутамата и 3 мл 1 N гидроокиси натрия перемешивают при комнатной температуре три дня для получения натриевой соли N-{4-/2-(4-гидрокси-6-аминопирроло/2,3-d/ пиримидин-3-ил)этил/бензоил} -L-глутаминовой кислоты. Затем ее нейтрализуют хлористоводородной кислотой. Образующееся твердое вещество собирают фильтрацией и перекристалли- зовывают из водного метанола и получают 0,35 г (75%) N-{4-/2-(4-гидроксипирроло /2,3-d/пиримидин-3-ил)этил/бензоил}-L- глутаминовой кислоты.
ПМР (d6 ДМСО) (δ) 1,88-2,12 (м, 2Н), 2,33 (т, J 7,3 Гц, 2Н), 2,97 (м, 5Н), 4,33 (4,40 м, 1Н), 6,70 (д, J 1,2 Гц, 1Н), 7,28 (д, J 7,0 Гц, 2Н), 7,76 (м, 3Н), 8,50 (д, J 7,6 Гц, 1Н), 11,48 (с, 1Н), 11,67 (с, 1Н), 12,40 (шп).
Аналогично из диметил-N-{4-/2(4-гидрокси-5-пивалоилокси-6-метилпирроло /2,3-d/пиримидин-3-ил)этил/бензоил} -L- глутамата получают вышеуказанным способом, сначала натриевую соль N-{4-/2-(4-гидрокси-6-метилпирроло/2,3-d/пиримидин-3-ил/этил/бензоил} -L-глутаминовой кислоты, которая при нейтрализации ледяной уксусной кислотой дает N-{4-[2-(4-гидрок- си-6-метилпирроло/2,3-d/ пиримидин-3-ил)этил]бензоил}-L-глутаминовую кислоту.
Аналогично из метил-4-[2-(4-гидрокси-6-пивалоилокси-6-метиламинопирроло/2,3-d/ пиримидин-3-ил)этил] бензоата, 3-[2-(4-метилфенил)этил]-4-гидрокси-6-пивалоила- минопирроло/2,3-d/ пиримидина, 3-(2-фенилэтил)-4-гидрокси-6-пивалоиламинопир- роло/2,3-d/ пиримидина, 3-[2-(4-хлорфенил)этил]-4-гидрокси-6- пивалоиламинопирроло/2,3-d/пиримидина, 3-[2-(4-фторфе- нил)этил] 4-гидрокси-6-пивалоаминопирроло/2,3-d/пиримидина, 3-[2-(3-фторфенил)этил]-4-гидрокси-6-пивалоиламинопир- роло /2,3-d/пиримидина, 3-[2-(4-метоксифенил)эфир] -4-гидрокси-6-пивалоиламинопи- рроло /2,3-d/пиримидина и метил-4-[2-(4-гидрокси-6-пивалоилметилпирроло /2,3-d/пиримидин-3-ил)этил] бензоата соответственно получают 4-[2-(4-гидрокси-6-метилпирроло/2,3-d/пиримидин-3-ил) этил] бензойную кислоту, 3-(4-метилфенил)этил-4-гидрокси-6-аминопирроло/2,3-d/пиримидин, 3-(2-фенилэтил)-4-гидрокси-6-аминопирроло/2,3-d/пиримидин, 3-[2-(4-хлорфенил)этил] -4-гидрокси-6-аминопирро- ло/2,3-d/пиримидин, 3-[2-(4-фторфенил)этил] -4-гидрокси-6-аминопирроло/2,3-d/пиримидин, 3-[2-(3-фторфенил)этил] -4-гидрокси-6-аминопирроло/2,3-d/пиримид- ин, т.пл. 295-298оС, 3-[2-(4-метоксифенил)этил]-4-гидрокси-6-аминопирроло/2,3-d/пиримидин, т. пл. 280-284оС, 4-[2-(4-гидрокси-6-аминопирроло/2,3-d/пиримидин-3-ил)этил]бензойную кислоту, Т.пл.>300оС.
П р и м е р 14. Антиметаболическая активность. Антиметаболическую активность изучали сравнительно со следующими соединениями:


Каждое соединение растворялось в 100% диметилсульфоксиде. Разбавление каждого соединения проводилось для получения опытных концентраций.
Ингибирующая активность соединений оценивалась следующим образом.
Получение клеточного материала.
Лимфобластомные лейкозные клетки человека выращивались в RPМI 1640 среде (МАВi о) с добавлением 10% диализированной эмбриональной бычьей сыворотки (Cibco) при 37оС при высокой влажности и пропускании смеси, содержащей 95% воздуха и 5% СО2. Клетки росли в статической суспензии (Т-колба, Corning) в фазе, обеспечивающей концентрацию 3-7 х 105клеток/мл.
Процедура. 1) 10 мкл раствора испытуемого соединения помещают в ячейку. Эту операцию повторяют для каждой испытуемой концентрации соединений.
2) 500 мкл бессывороточной среды добавляют в каждую ячейку.
3) На магнитную мешалку помещают стерильную колбу, содержащую RPMI 1640 среду с 10% диализированной бычьей сыворотки, 16 мМ Гепес 8 мМ Морс-буфера в расчете на 3 х 104 клеток/мл. Использовали перистальтический насос Витона для подачи 1,5 мл этой суспензии клеток в каждую ячейку. Конечное количество поданного в каждую ячейку составило 2,0 мл при концентрации 4,8 х 104 клеток/ячейку.
4) Ячейки инкубировали при 37оС во влажном инкубаторе (95% воздуха, 5% СО2) в течение 72 ч.
5) После инкубации делают замеры каждой ячейки с помощью счетчика частиц L ВI Coulter и определяют IC50 (концентрация, ингибирующая 50% роста клеток).
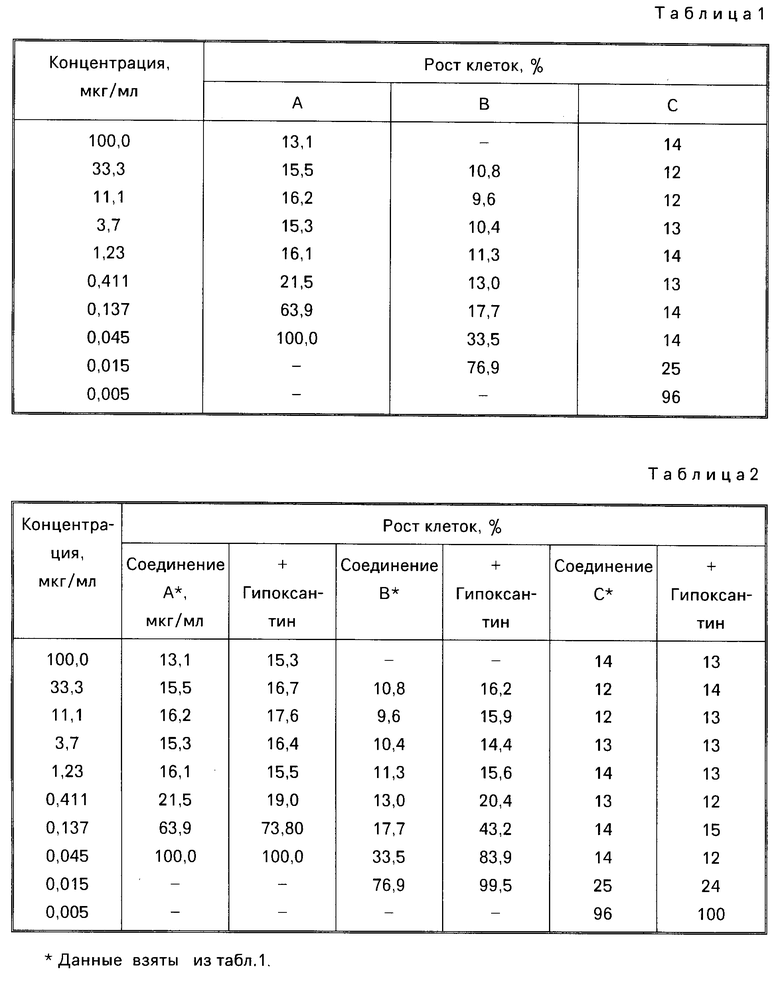
Результаты этого опыта представлены в табл.1.
Каждое из соединенией А, В и С проявило in vitro ингибирующую активность против лимфобластомных лейкозных человеческих клеток. Относительная общая ингибирующая концентрация (IC50) in vitro этих соединений следующая:
Соединение А 0,2 мкг/мл
Соединение В: 0,03 мкг/мл
Соединение С: 0,007 мкг/мл
Все соединения проявили ингибирующую активность. При сравнении in vitro соединение С было самым активным.
Обратное изучение.
Механизм действия каждого соединения был определен с помощью дальнейших опытов, использующих так называемое обратное изучение. Эти опыты выявили соединение, которое одно или вместе воздействовали на конкретную точку ингибирования энзима.
а) Гипоксантин будет менять ингибирующее действие соединения, если функции соединения в качестве ингибитора синтеза пурина de novo. Наличие гипоксантина таким образом позволяет клеткам обходить синтез пурина.
б) Тимидин будет менять ингибирующее действие соединения, если его функциями являются функции определенного ингибитора синтетазы тимидина.
в) Гипоксантин и тимидин если соединение определено в (а), не является ингибитором синтеза пурина, и в (б) не является ингибитором синтетазы, тимидилата, то тогда обратное изучение, использующее гипоксантин и тимидин в комбинации, определит, может ли соединение давать ингибирование в двух направлениях. Если эта комбинация меняет ингибирующее действие соединения, то скорее всего соединение действует как ингибитор восстановления диигидрофолата (участвующий как в биосинтезе пурина так и пиримидина).
П р о ц е д у р а. В каждом случае следовали основному процессу, указанному выше, с изменением в том, что 250 мкл обратного соединения (или каждого обратного соединения пункта (б)) были добавлены к опытным ячейкам и количество среды без сыворотки, добавляемой к каждой опытной ячейке, уменьшали или полностью заменяли в (б) тем же количеством. Обратные соединения получали как 8-х растворы фосфата с соляным буферным раствором (стерильно профильтрован через 0,2М акродисковый фильтр) таким образом, что 250 мкл раствор давал конечную концентрацию 100 мкМ гипоксантина и/или 5 мкМ тимидина.
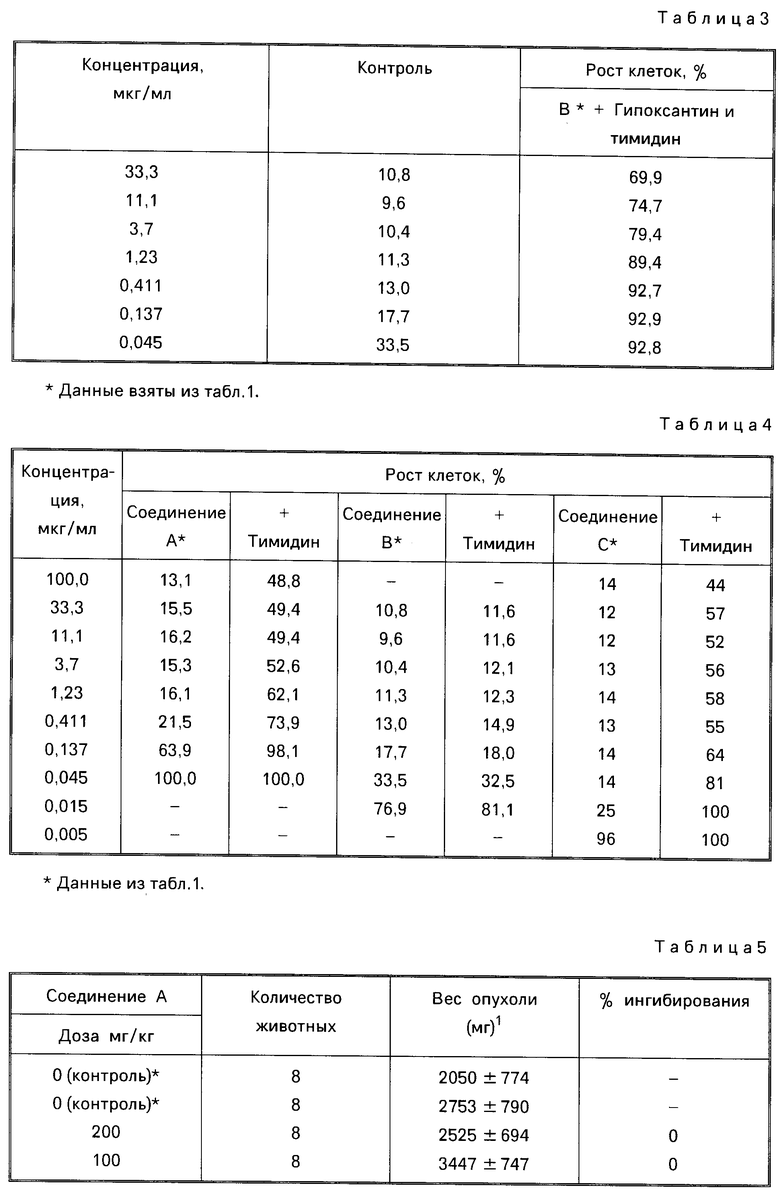
Результаты опытов представлены в табл.2.
(а) Гипоксантин (100 мкМ)
(б) Гипоксантин (100 мкМ) и тимидин (5 мкМ);
Соединение В было далее проверено для определения вторичной ингибирующей активности.
(в) Тимидин (5 мкМ).
Анализ активности in vivo.
Соединения А и С были проверены далее на противоопухольную активность in vivo.
Мыши женского пола были заражены опухолевыми клетками. Лечение испытуемыми соединениями началось на следующий день после заражения. Лечение включало назначение восьми доз в день (внутрибрюшинно) соединения либо А, либо В в течение восьми последующих дней. Размер опухоли был измерен на следующий день после окончания лечения для определения ингибиторного влияния испытуемых соединений на рост опухоли.
1. Среднее ± стандартное отклонение.
1. Среднее стандартное отклонение.
Соединение С обладает явным ингибирующим действием in vivo на рост опухоли со 100% -ным ингибированием при таких малых дозах как 20 мг/кг и более 50%-ным ингибированием при дозах по крайней мере 2,5 мг/кг.
Соединение В действует по другому механизму, чем соединения А и С, а именно ингибированием DHFR, а не ТiS, in vitro соединения А и С ингибируют ТiS. Соединение С более активное, чем соединение А, по крайней мере в 25 раз. in vivo соединение А является неактивным как противоопухольное вещество. Соединение С высокоактивное in vivo при борьбе с опухолями.
Представительными величинами ингибирования против культур ССРF СЕМ клеток для типичных соединений являются следующие:
Соединение ИК50 (мкм/мл)
4-{2-/4-гидроксиаминопирроло/2,3-d/пиримидин-
3-ил/этил}бензойная кислота > 20,00
N-{4-2-/4-гидрокси-6-аминопирроло/2,3-d/пиримидин-
-3-ил/этил}бензоил-L-глутаминая кислота 0,004
3-{2-/4-метоксифенил/этил} 4-гидрокси-6-амино-
пирроло/2,3-d/пиримидин > 20,00
N-{2-фтор-4-2-/4-гидрокси-6-аминопирроло/2,3-d/
пиримидин-3-ил/этил}бензоил-L-глутаминовая кислота 0,008
N-{3-фтор-4-[2-/4-гидрокси-6-аминопирроло/2,3-d/
пиримидин-3-ил/этил]бензоил}-L-глутаминовая кислота 0,019
3-{2-/3-фторфенил/этил}-4-гидрокси-6-аминопирроло
/2,3-d/пиримидин > 20,00
N-{5-[2-/4-гидрокси-6-аминопирроло/2,3-d/ пиримидин-
3-ил/этил]тиен-2-илкарбонил]-L- глутаминовая кислота 0,025
N-{5-[2-/4-гидрокси-6-аминопирроло/2,3-d/пиримидин-
3-ил/этил] фур-2-илкарбонил}-L-глутаминовая кислота > 20,00
N-{4-[2-/4-гидрокси-6-метилпирроло/2,3-d/ пиримидин-
3-ил/этил]бензоил}-L-глутаминовая кислота 0,0084
N-{4-[2-/4-гидроксипирроло/2,3-d/пиримидин-3- ил/этил]
бензоил}-L-глутаминовая кислота 1,20
Цитотоксичность этих соединений не меняется при добавлении гипоксантина или АICA, предпочтительно, что они ингибируют пути биосинтеза пурина de novo, но меняются тимидином, указывая, что главной целью является синтез тимидилата. Цитотоксичность также меняется добавлением лейковорина, указывая, что цитотоксичность вызвана антагонизмом механизма, относящегося к соли фолиевой кислоты.
Использование: в медицине, так как обладает свойствами ингибитора на ферменты, использующие фолиевую кислоту или метаболиты в качестве субстратов. Сущность изобретения: производные N-(пирроло-/2,3-d/ пиримидин-3-илацил) глутаминовой кислоты общей формулы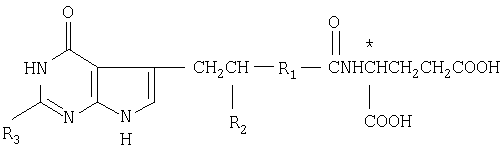
где R1 - 1,4-фенилен, незамещенный или замещенный хлором или фтором, тиендиил, фурандиил, циклогександиил или C2 -C4-алкандиил; R2 - водород, метил или гидроксиметил; R3 - водород, C1 -C6-алкил или аминогруппа; * - S-конфигурация помеченного атома углерода, или их таутомеры или фармацевтически приемлемые соли. Реагент 1: соединение формулы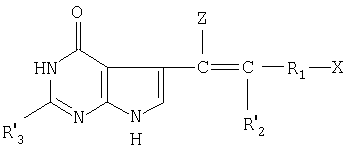
где X-COOR′ или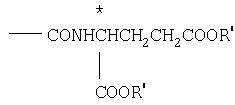
Z - водород или Z вместе с 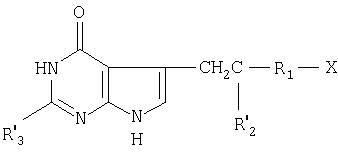 - углерод - углеродная связь; R′ - водород или защитная группа для карбоксила; R1 и * имеют вышеуказанные значения;
- углерод - углеродная связь; R′ - водород или защитная группа для карбоксила; R1 и * имеют вышеуказанные значения; 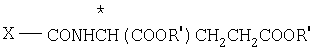 - независимо от Z - водород, метил, гидроксиметил или защищенный гидроксилитил ;
- независимо от Z - водород, метил, гидроксиметил или защищенный гидроксилитил ;  водород, C1 -C6-алкил, аминогруппа или низшая алканоиламиногруппа, которое подвергают каталитической гидрогенизации с получением соединения формулы
водород, C1 -C6-алкил, аминогруппа или низшая алканоиламиногруппа, которое подвергают каталитической гидрогенизации с получением соединения формулы
где  имеют указанные значения; X-COOR′, которое вводят в реакцию с защитной глутаминовой кислотой, получая соединение, где
имеют указанные значения; X-COOR′, которое вводят в реакцию с защитной глутаминовой кислотой, получая соединение, где
подвергают кислотному или щелочному гидролизу, либо тому и другому, для превращения R′ - карбоксизащищенная группа в водород или соль,  - защищенный гидроксиметил в гидроксиметил,
- защищенный гидроксиметил в гидроксиметил, 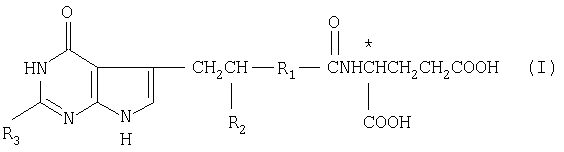 - алканоиламиногруппа в аминогруппу. 2 с. и 2 з.п. ф-лы, 6 табл.
- алканоиламиногруппа в аминогруппу. 2 с. и 2 з.п. ф-лы, 6 табл.

где X-COOR′
Z - водород или Z вместе с  - углерод-углеродная связь;
- углерод-углеродная связь;
R′ - водород или защитная группа для карбоксила;
R1 и * имеют указанные значения; - независимо от Z водород, метил, гидроксиметил или защищенный гидроксиметил;
- независимо от Z водород, метил, гидроксиметил или защищенный гидроксиметил; - водород, C1 - C6-алкил, аминогруппа или низшая алканоиламиногруппа,
- водород, C1 - C6-алкил, аминогруппа или низшая алканоиламиногруппа,
полученное соединение общей формулы III
где  имеют указанные значения;
имеют указанные значения;
X-COOR′, где R′ имеет указанные значения,
вводят в реакцию с защищенной глутаминовой кислотой для получения соединения, где
подвергают кислотному или щелочному гидролизу, либо и тому и другому, для превращения R′- карбоксизащищенная группа - в водород, или соль  защищенный гидроксиметил - в гидроксиметил,
защищенный гидроксиметил - в гидроксиметил,  алканоиламиногруппа - в аминогруппу.
алканоиламиногруппа - в аминогруппу.
где R1 - 1,4-фенилен, незамещенный или замещенный хлором или фтором, тиендиил, фурандиил, циклогександиил или C2 - C4-алкандиил;
R2 - водород, метил или гидроксиметил;
R3 - водород, C1 - C6-алкил или аминогруппа;
* - S-конфигурация помеченного атома углерода,
или их таутомера, или фармацевтически приемлемых солей, отличающийся тем, что подвергают каталитической гидрогенизации соединение общей формулы II
R3 - водород, метил или аминогруппа, щелочная гидролизом соединения, где R
где R1 - 1,4-фенилен, незамещенный или замещенный хлором или фтором, тиендиил, фурандиил, циклогександиил, или C2 - C4-алкандиил;
R2 - водород, метил или гидроксиметил;
R3 - водород, C1 - C6-алкил или аминогруппа;
* - S-конфигурация помеченного атома углерода,
или таутомеры, или фармацевтически приемлемые соли.
Приоритет по признакам:
08.02.90 при R1 - фенил, R3 - аминогруппа;
24.05.90 при R1 - тиендиил или фурандиил, R3 - амино;
24.05.90 при R1 - тиендиил, фурандиил, фенилен, циклогександиил или алкандиил, R3 - водород, алкил.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Патент США N 4818819, кл.544-279, опубл | |||
| Механизм для сообщения поршню рабочего цилиндра возвратно-поступательного движения | 1918 |
|
SU1989A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Патент США N 4684563, кл.428-207, опубл | |||
| Механизм для сообщения поршню рабочего цилиндра возвратно-поступательного движения | 1918 |
|
SU1989A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Патент США N 4882334, кл | |||
| СПОСОБ ПОЛУЧЕНИЯ ПРОДУКТОВ КОНДЕНСАЦИИ ФЕНОЛОВ С ФОРМАЛЬДЕГИДОМ | 1925 |
|
SU514A1 |
| Механизм для сообщения поршню рабочего цилиндра возвратно-поступательного движения | 1918 |
|
SU1989A1 |
Авторы
Даты
1996-03-27—Публикация
1991-02-07—Подача