Изобретение относится к катализаторам окисления соединений закисного железа в кислой среде.
Предлагаемая каталитическая композиция может применяться в гидрометаллургии цветных и редких металлов для окисления примесей Fe(+2) до Fe(+3) в кислой среде с последующим удалением Fe(+3) в виде легкофильтруемых осадков гидроксидов, а также для регенерации Fе(+3) в растворах выщелачивания с целью их повторного использования. Поскольку в гидрометаллургических процессах имеют дело с растворами, содержащими большие количества солей, то данная каталитическая композиция разрабатывалась с учетом высокого солевого фона раствора и все испытания проводили с использованием так называемого "отработанного электролита". Последний представляет собой раствор ZnSO4 в H2SO4, используемый в циклическом процессе переработки цинкового кека на свинцово-цинковом комбинате г.Усть-Каменогорска.
Проблема состоит в том, что реакция окисления Fe(+2) кислородом в кислых средах в мягких условиях протекает очень медленно и для ее ускорения требуется высокая температура и давление. Решением проблемы ускорения реакции в мягких условиях может стать использование каталитического метода.
Известны в настоящее время катализаторы либо не обладают достаточно высокой активностью (например, активированный уголь [1] ), либо включают растворимые компоненты, трудно отделимые от раствора (соли Cu(+2) [2], Co(+2) [3], оксиды азота и нитриты щелочных металлов [4, 5]. Последние являются наиболее близкими по составу к предлагаемому нами катализатору [5]. Нитриты щелочных металлов проявляют высокую каталитическую активность, но сами окисляются под действием кислорода до нитратов, вследствие чего обладают ограниченной производительностью (Производительность определяется как количество Fe(+2), прореагировавшего до полной дезактивации катализатора, отнесенное к количеству введенного нитрита натрия). При данной исходной концентрации Fe(+2), чем более высокой конверсии последнего предполагается достичь в реакции, тем большее количество нитрита необходимо вводить в систему, и соответственно тем большая концентрация нитрата создается в растворе после реакции. Присутствие большого количества нитрата нежелательно, поскольку может отрицательно сказываться на проведении дальнейших операций с раствором (например, электролиза основного компонента ZnSO4).
Целью изобретения является увеличение производительности нитритного катализатора, т.е. увеличение конверсии Fe(+2) в данном растворе при неизменном количестве NaNO2 (либо, наоборот, снижение количества NaNO2, необходимого для достижения определенной конверсии Fe(+2)).
Для достижения поставленной цели предлагается вводить в реакционную смесь в качестве модификаторов углеродные материалы, обладающие высокой степенью кристалличности(*) (степень кристалличности определяется как массовая доля графитоподобной фазы в образце углеродного материала), в количестве 8-40 мас.ч. на 1 мас.ч. NaNO2. Количество катализатора (смеси NaNO2 с углеродным материалом в отношении 1:8-40) зависит от исходного состава раствора, подвергаемого окислению, в частности, от концентрации Fe(+2). Для раствора FeSO4 концентрации 0,4 моль/л в отработанном электролите (водный раствор H2SO4, рН О, содержащий 15 г/л ZnSO4), который по составу близок к промышленным растворам, предлагается использовать катализатор следующего состава: 0,24 г/л NaNO2 и 2-10 г/л углеродного материала.
Отличительным признаком предлагаемой каталитической композиции является наличие в ее составе углеродных материалов, у которых степень кристалличности изменялась в пределах 0,4-0,7. Эти материалы способны работать в качестве модификаторов нитритного катализатора без предварительной обработки поверхности какими-либо соединениями. В условиях реакции их поверхность претерпевает дополнительную активацию, так, что в каждом следующем цикле работы модификатора активность системы не только не уменьшается, но может увеличиваться.
Действие модификаторов предположительно может быть объяснено адсорбцией нитрит-ионов или оксидов азота на поверхности углеродных материалов, что ведет к замедлению окисления каталитически активных нитрит-ионов до нитрат-ионов. В результате увеличивается конверсия Fe(+2), по сравнению с конверсией, достигаемой при том же количестве NaNO2, но в отсутствие модификатора. Кроме того, анионы NO-2 остаются на поверхности модификатора по окончании реакции и сохраняют активность в следующем цикле. Эффективность модификаторов связана со свойствами углеродных материалов, а именно зависит от степени кристалличности: чем выше степень кристалличности, тем более высокая конверсия достигается в присутствии этого материала.
Углеродные материалы, обладающие указанными выше свойствами, в сочетании с нитритом натрия до сих пор не использовались в качестве катализаторов окисления железа.
Активность каталитической композиции оценивалась по конверсии Fe(+2)/Fe(+3), достигаемой за 1 ч. Эксперименты проводились в термостатированном встряхиваемом реакторе объемом 150 мл при 50оС. В реактор помещали навеску углеродного материала, заливали 10 мл раствора FeSO4 в отработанном электролите (15 г/л ZnSO4, рН О, H2SO4). После того, как раствор термостатировался, реактор продували кислородом, присоединяли к бюретке, заполненной О2, и устанавливали атмосферное давление. Через инжектор с помощью шприца в реактор водили раствор NaNO2 и немедленно начинали интенсивное перемешивание жидкой фазы. Через 1 ч раствор отделяли от углеродного материала фильтрованием и титровали 0,1 н. раствором перманганата калия. Конверсию Fe(+2) определяли по изменению концентрации Fe(+2), в сравнении с исходной. Углеродный материал затем мог быть использован во 2-м, 3-м и т.д. циклах, которые проводили аналогично первому.
Изобретение иллюстрируется следующими примерами.
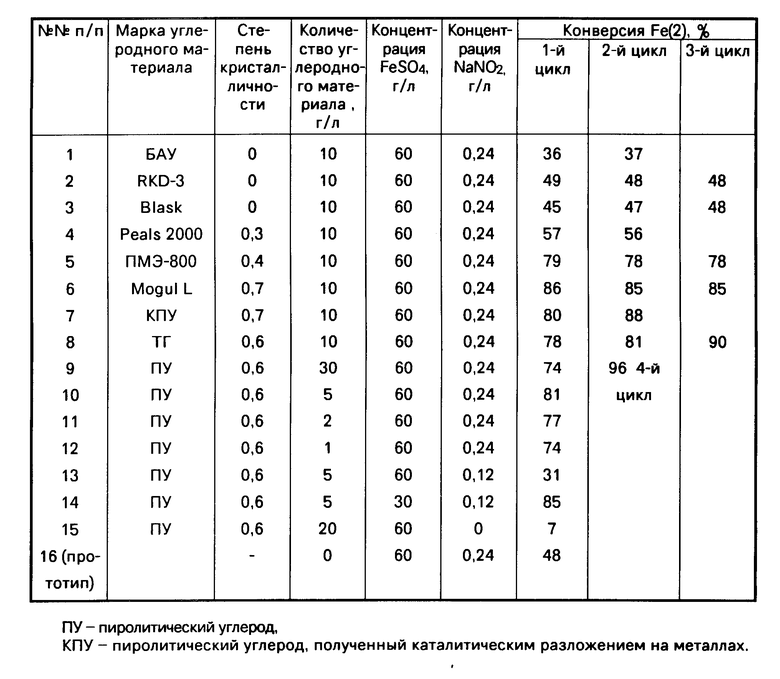
П р и м е р 1. В реактор помещали 0,1 г углеродного материала RKD-3, 10 мл раствора FeSO4 (60 г/л) в отработанном электролите и вводили NaNO2 в количестве 0,24 г/л. Реакцию проводили при 50оС и атмосферном давлении О2 в течение 1 ч (1-й цикл). Затем углеродный материал отделяли и повторяли с ним всю процедуру (2-й, 3-й циклы). Конверсия Fe(+2) в 1-м, 2-м, 3-м циклах составила соответственно 49, 48 и 48%.
Остальные примеры даны в таблице. Все опыты проводили при 50оС и атмосферном давлении О2 в течение 1 ч каждый цикл. Реакционный раствор, помимо FeSO4, содержал 15 г/л ZnSO4 и серную кислоту, рН О. Концентрация FeSO4 и состав каталитической композиции указаны в таблице для каждого опыта.
В примерах 1-8 даны результаты испытания нитритных каталитических систем в присутствии углеродных материалов. Значительный модифицирующий эффект достигается при использовании углеродных материалов, обладающих высокой степенью кристалличности: примеры 5-8. Примеры 5-8, в сравнении с 15-16, показывают, что каталитический эффект предлагаемой композиции выше суммарного эффекта NaNO2 и углеродного материала, использованных отдельно. В примерах 5 и 6 активность каталитических систем практически не уменьшается при использовании модификаторов последовательно в нескольких циклах, а использованные в примерах 7-8 углеродные материалы показали способность дополнительно активироваться в условиях реакции: в примере 8 конверсия в 3 и 4 циклах увеличивается соответственно на 12 и 18%, в сравнении с первым.
Примеры 8-12 показывают влияние количества углеродного материала на конверсию Fe(+2). Оптимальное соотношение компонентов каталитической композиции составляет 8-40 мас.ч. углеродного материала на 1 ч. NaNO2. В таблице даны запредельные примеры, ограничивающие количество углеродного материала (примеры 9 и 12). В примере 8 описана каталитическая композиция, по составу близкая к оптимальной. При начальной концентрации FeSO4 60 г/л и введении 0,24 г/л NaNO2 в 1-м, 2-м, 3-м, 4-м циклах достигается конверсия соответственно 78, 81, 90, 96%.
Из сравнения примеров 8, 13 и 14 следует, что количество катализатора следует выбирать в зависимости от исходной концентpации FeSO4 в растворе и от конверсии Fe(+2), которую предполагается достичь.
Предлагаемую каталитическую композицию сравнивали с прототипом. Для сравнения в таблице приведен пример 16, в котором в качестве катализатора использовали нитрит натрия без добавок. Сравнение примеров 8 и 16 показывает, что использование модификатора ПУ дает увеличение конверсии на 30-48% (в абсолютной шкале), по сравнению с прототипом. Отметим, что в каждом следующем цикле использования предлагаемого модификатора достигается большая, чем в предыдущем, конверсия Fe(+2).
| название | год | авторы | номер документа |
|---|---|---|---|
| КАТАЛИЗАТОР И СПОСОБ ГИДРОДЕХЛОРИРОВАНИЯ ХЛОРАРОМАТИЧЕСКИХ СОЕДИНЕНИЙ | 2002 |
|
RU2214864C1 |
| СПОСОБ ОЧИСТКИ ОТХОДЯЩИХ ГАЗОВ ОТ ОКИСЛОВ АЗОТА | 1987 |
|
RU2089269C1 |
| ПОРИСТЫЙ КОМПОЗИЦИОННЫЙ МАТЕРИАЛ | 1996 |
|
RU2103056C1 |
| КОМПОЗИТНЫЙ УГЛЕРОДСОДЕРЖАЩИЙ НОСИТЕЛЬ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1999 |
|
RU2160631C1 |
| МЕТАЛЛУГЛЕРОДНЫЙ КАТАЛИЗАТОР | 1994 |
|
RU2096083C1 |
| СПОСОБ ЖИДКОФАЗНОГО ДЕХЛОРИРОВАНИЯ ХЛОРАРОМАТИЧЕСКИХ СОЕДИНЕНИЙ | 1996 |
|
RU2100338C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЦИКЛОГЕКСАНОНА ИЗ БЕНЗОЛА | 2002 |
|
RU2205819C1 |
| Катализатор жидкофазного селективного гидрирования ацетиленовых углеводородов и способ его получения | 2020 |
|
RU2738233C1 |
| КАТАЛИТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЕЕ ПРИГОТОВЛЕНИЯ И СПОСОБ ОЧИСТКИ ТЕРЕФТАЛЕВОЙ КИСЛОТЫ | 1999 |
|
RU2146172C1 |
| СПОСОБ ПЕРЕРАБОТКИ МЕТАНА (ВАРИАНТЫ) | 1997 |
|
RU2135441C1 |
Сущность изобретения: каталитическая композиция содержит, мас.ч.: нитрит натрия 1, углеродный материал 8 - 40. Углеродный материал имеет высокую степень кристалличности 0,4 - 0,7. 1 табл.
КАТАЛИТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ОКИСЛЕНИЯ СОЕДИНЕНИЙ ЗАКИСНОГО ЖЕЛЕЗА кислородом, включающая нитрит натрия и модификатор, отличающаяся тем, что в качестве модификатора она содержит углеродный материал со степенью кристалличности 0,4 - 0,7, при следующем соотношении компонентов, мас.ч.:
Нитрит натрия 1
Углеродный материал со степенью кристалличности 0,4 - 0,7 8 - 40
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Способ окисления соединений закисного железа | 1975 |
|
SU532574A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
1994-11-15—Публикация
1992-04-27—Подача