Изобретение относится к новым производным бензимидазола, способу их получения, а также к их применению в качестве лекарств.
Соединения, являющиеся предметом настоящего изобретения, отвечают общей формуле:
R N
N N
N (CH2)
(CH2) N
N где - R1 и R2 одинаковые или разные, представляют атом водорода, галоген, низший радикал алкил, радикал гидрокси, радикал алкокси, радикал карбоалкокси,радикал арил или замещенный радикал арил, n может иметь значения 0 или 1, m может иметь значения 2-4, X, Y, Z и W, одинаковые или разные и образующие часть другого ароматического или неароматического цикла, представляют атом азота или атом углерода, связанный с атомом водорода, с галогеном или с другим радикалом-алкил, арил, карбоксиалкил, карбоксильным, гидроксил, алкилгидрокси, сульфо- и алкилсульфо.
где - R1 и R2 одинаковые или разные, представляют атом водорода, галоген, низший радикал алкил, радикал гидрокси, радикал алкокси, радикал карбоалкокси,радикал арил или замещенный радикал арил, n может иметь значения 0 или 1, m может иметь значения 2-4, X, Y, Z и W, одинаковые или разные и образующие часть другого ароматического или неароматического цикла, представляют атом азота или атом углерода, связанный с атомом водорода, с галогеном или с другим радикалом-алкил, арил, карбоксиалкил, карбоксильным, гидроксил, алкилгидрокси, сульфо- и алкилсульфо.
Известны производные бензимидазола с различными биологическими активностями, как, например, болеутоляющая и противовоспалительная активность (Japan Kokai 75, 126, 682), антисекреторная гастрическая активность (европейские патенты NN 246126 и 5129); противогистаминная активность (J, Jilek et al., Coll ect. Czech. Chem. Commun., 1988, 53, 870-83; патент США N 4200641; Drugs of the Future, УП; 10-1. 1982; R.Iemura et al., Y.Med. Chem. , 1986, 29, 1178-1183; R. Iemura et al., J.Heteroxycyclic. Chem., 1987, 24, 31-37). Соединения, являющиеся предметом настоящего изобретения, являются новыми производными бензимидазола, а конкретно 1-(2-этоксиэтил)-2-(алкилпиперазинилалкилазол)бензи- мидазол. Эти новые производные обладают очень хорошей противогистаминной активностью и они не оказывают побочных эффектов на центральную нервную систему.
Новые производные общей формулы 1 могут быть получены, согласно изобретению, по одному из следующих методов:
Метод А. Путем реакции соединения общей формулы IIa:
R N
N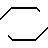 N
N (CH2)m-A
(CH2)m-A
или же IIb:
R N
N где R1, R2, n и m имеют вышеприведенные значения, а А представляет галоген или "уходящую группу", выбранную среди тозилокси или мезилокси, с соединением общей формулы III:
где R1, R2, n и m имеют вышеприведенные значения, а А представляет галоген или "уходящую группу", выбранную среди тозилокси или мезилокси, с соединением общей формулы III:
HN в которой Х, Y, Z и W имеют вышеприведенные значения.
в которой Х, Y, Z и W имеют вышеприведенные значения.
Реакцию проводят в присутствии растворителя, например, диметилсульфоксид, диметилформамид, спирты, углеводороды, ароматические или неароматический, эфиры, такие как диоксан или дифениловый эфир, или смеси этих растворителей. Эту реакцию, преимущественно, проводят в присутствии такого основания, как гидроокиси, карбонаты или бикарбонаты щелочных металлов, или же смеси этих оснований. Можно применять также гидриды щелочных металлов. Наиболее пригодны температуры между температурой окружающей среды и температурой кипения растворителя, а время реакции составляет 1-24 ч.
Метод В. Путем реакции соединения общей формулы IIa, в которой А представляет радикал - NH2, с 2,5-диметокситетрагидрофураном.
Реакцию проводят в присутствии растворителя, например, уксусная кислота, вода, спирты, кетоны или смеси этих растворителей. Наиболее подходящие температуры колеблятся между температурой окружающей среды и температурой кипения, растворителя, а время реакции составляет от нескольких минут до 24 ч.
Метод С. Путем реакции соединения общей формулы IV:
R N
N NH где R1, R2 и n имеют указанные значения, с соединением общей формулы V
NH где R1, R2 и n имеют указанные значения, с соединением общей формулы V
B-(CH2) N
N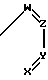 где Х, Y, Z, W и m имеют вышеприведенные значения, а В представляет галоген или "уходящую группу", выбранную среди тозилокси или мезилокси.
где Х, Y, Z, W и m имеют вышеприведенные значения, а В представляет галоген или "уходящую группу", выбранную среди тозилокси или мезилокси.
Реакцию проводят в присутствии растворителя, например, диметилсульфоксид, диметилформамид, спирты, углеводороды, ароматические или неароматические, эфиры, такие как диоксан или дифениловый эфир, или смеси этих растворителей. Эту реакцию, преимущественно, проводят в присутствии такого основания, как гидроокиси, карбонаты или бикарбонаты щелочных металлов, или смеси этих оснований. Наиболее подходящие температуры колеблятся между температурой окружающей среды и температурой кипения растворителя, а время реакции составляет 1-24 ч.
В нижеприведенных примерах показано получение новых производных согласно изобретению.
Метод А.
П р и м е р 1. Получение 1-(2-этоксиэтил)-2-{4-[4-(4-бромпиразол-1-ил) бутил] пиперазин-1-ил-метил} бензимидазола.
а) Бромид 1-(2-этоксиэтил)-2-(8-метилаза-5-азониаспиродекан)бензимидазола.
Кипятят в течение 16 ч, смесь 1,5 г (5,21 ммоль) 1-(2-этоксиэтил)-2-(1-пиперазинил)бензимидазола, 1,41 г (6,5 ммоль) 1-4-дибромбутана и 0,72 г (5,2 ммоль) карбоната калия в 50 мл хлороформа. Охлаждают, фильтруют и выпаривают. Растворяют осадок в этиловом эфире и получают 2,1 г бромида 1-(2-этоксиэтил)-2-(8-метилаза-5- азониаспиро декан)бензимидазола, гигроскопическое твердое, которое используют в этом виде, без дополнительной очистки.
1Н-ЯМР (CDCl3): δ 1,05 (t, 3H); 2,25 (m, 4H); 3,25-4,15 (m,18Н); 4,45 (t, 2Н); 7,27 (m, 3H); 7,60 (m, 1H).
б) 1-(2-Этоксиэтил)-2-{ 4-[4-(4-бромпиразол-1-ил) бутил] пиперазин-1-ил-метил} бензимидазол.
Нагревают до кипения в течение 12 ч смесь 2,3 г (5,44 ммоль) бромида 1-(2-этоксиэтил)-2-(8-метилаза-5-азониаспиро декан/бензимидазола, 0,92 г (6,28 ммоль) 4-бром-1-Н-пиразола, 1,38 г (0,01 моль) карбоната калия и 30 мл диметилформамида. Охлаждают, фильтруют и выпаривают фильтрат досуха. Осадок обрабатывают хлороформом и промывают водой. Органическую фазу высушивают с Na2SO4, фильтруют и выпаривают. Полученное масло очищают на хроматографической колонке двуокиси кремния (элюат: хлороформ-метанол 95:5).
Таким образом, получают 0,78 г соединения в жидком виде.
Спектроскопические данные для его идентификации приведены в табл. 1 и 2.
П р и м е р 2. Получение 1-(2-этоксиэтил)-2-{4-[4-(4-бромпиразол-1-ил-бутил] пиперазинил} бензимидазола.
а) Бромид 1-(2-этоксиэтил)-2-(8-аза-5-азониаспиро декан)бензимидазола.
Получают тем же способом, что и в примере 1а.
1Н-ЯМР (CDCl3): δ 1,08 (t, 3H); 2,37 (m, 4Н); 3,42 (q, 2H); 3,7-4,15 (m, 14H); 4,32 (t, 2H); 7,27 (m, 3Н); 7,60 (m, 1Н).
б) 1-(2-Этоксиэтил)-2-{ 4-[4-(4-бромпиразол-1-ил) бутил] пиперазинил} бензимидазол.
Получают по тому же методу, что и в примере 1б.
Соль с малеиновой кислотой получают в этаноле, а ее точка плавления составляет 137-139оС. Спектроскопические данные для идентификации приведены в табл. 1 и 2.
П р и м е р 3. Получение 1-(2-этоксиэтил)-2-{4-[4-(1-имидазол) бутил] пиперазин-1-ил-метил} бензимидазола.
Получают как показано в примерах 1а и 1б. Спектроскопические данные для его идентификации приведены в табл. 1 и 2.
П р и м е р 4. Получение 1-(2-этоксиэтил)-2-{4-[4-(1,2,4-триазол-1-ил) бутил] пиперазин-1-ил-метил} бензимидазола.
Получают также как в примерах 1а и 1б.
Спектроскопические данные для его идентификации приведены в табл. 1 и 2.
П р и м е р 5. Получение 1-(2-этоксиэтил)-2-{4-[4-(4-сульфопиразол-1-ил) бутил] пиперазин-1-ил-метил} бензимидазола.
Получают так, как показано в примерах 1а и 1б.
Спектроскопические данные для его идентификации приведены в табл. 1 и 2.
П р и м е р 6. Получение 1-(2-этоксиэтил)-2-{4-[4-(4-карбоксипиразол-1-ил/бутил] пиперазин-1-ил-метил} бензимидазола.
Согласно способу по примерам 1а и 1б получают неочищенный 1-(2-этоксиэтил)-2-{ 4-[4-(4-этилоксикарбонил-пиразол-1-ил) бутил] пиперазин-1-ил-метил} бензимидазол, который очищают на хроматографической колонке двуокиси кремния (элюант: хлороформ-метанол 95:5).
1Н-ЯМР (CDCl3): δ 1,12 (t, 3Н); 1,45 (m, 5Н); 1,90 (m, 2Н); 2,44 (m, 10Н); 3,41 (q, 2H); 3,60-3,86 (m, 4Н); 4,0-4,3 (m, 4Н); 4,50 (t, 2H); 7,28 (m, 3Н); 7,75 (m, 1Н); 7,8 (s, 2Н).
ИК (пленка): 1715, 1560, 1470, 1225, 1120, 1040, 750 см-1.
Соль с малеиновой кислотой получают в этаноле, а ее точка плавления составляет 114-117оС.
Предварительно полученный сложный эфир гидролизуют путем обработки раствора в этаноле в течение 3 ч при температуре окружающей среды 10%-ным едким натром. Выпаривают спирт, а водный раствор нейтрализуют уксусной кислотой. Выпаривают досуха, а кислоту экстрагируют из осадка путем выпаривания дихлорметаном.
Таким образом, получают соответствующую кислоту, спектроскопические данные которой, для ее идентификации, приводят в табл. 1 и 2.
П р и м е р 7. Получение 1-(2-этоксиэтил)-2-{4-[4-(1-пиразолил)бутил] пиперазин-1-ил-метил} бензимидазола.
Получают так, как показано в примерах 1а и 1б.
Соль с малеиновой кислотой получают в этаноле с точкой плавления 112-116оС. Спектроскопические данные для идентификации приводятся в табл. 1 и 2.
П р и м е р 9. Получение 1-(2-этоксиэтил)-2-{4-[4-(4-карбоксипиразол-1-ил/бутил] пиперазин-1-ил} бензимидазола.
По способу, показанному в примерах 2а и 2б, получают неочищенный 1-(2-этоксиэтил)-2-{ 4-[4-(4-этилоксикарбонил-пиразол-1-ил) бутил] пиперазин-1-ил} бензимидазол, который очищают на хроматографической колонке двуокиси кремния (элюант: хлороформ-метанол 95:5).
1Н-ЯМР (CDCl3): δ 1,1 (t, 3H); 1,3 (t, 3H), 1,8 (m, 4H); 2,15-2, 7 (m, 6Н), 3,25 (m, 6Н), 3,7 (t, 2Н), 3,8-4,3 (m, 6Н), 7,2 (m, 3Н); 7,5 (m, 1Н); 7,8 (s, 2Н). ИК (КВr): 2950, 1715, 1220, 1125, 760 см-1.
Предварительно полученный сложный эфир гидролизуют путем обработки раствора в этаноле в течение 15 ч при температуре окружающей среды 10%-ным едким натром. Выпаривают спирт, а водный раствор нейтрализуют хлористоводородной кислотой. Выпаривают досуха, а кислоту экстрагируют из осадка путем выпаривания хлороформом.
Таким образом, получают соответствующую кислоту, которую растворяют с этиловым эфиром. Соединение кристаллизуют в этом растворителе с точкой плавления 145-150оС.
Спектроскопические данные для идентификации в табл. 1 и 2.
П р и м е р 10. Получение 1-(2-этоксиэтил)-2-{4-[4-(4,5-дихлоримидазол-1-ил) бутил] пиперазин-1-ил-метил} бензимидазола.
Получают так, как показано в примерах 1а и 1б.
Соль с фумаровой кислотой получают в этаноле с точкой плавления 123-130оС. Спектроскопические данные для идентификации приводят в табл. 1 и 2.
Метод В.
П р и м е р 8. Получение 1-(2-этоксиэтил)-2-{4-[4-(1-пирролил) бутил] пиперазин-1-ил-метил} бензимидазола.
а) 1-(2-Этоксиэтил)2-{4-(4-аминобутил)пиперазин-1-ил-метил} бензимидазол.
Кипятят в течение 3 ч смесь 6,4 г (22 ммоль) 1-(2-этоксиэтил)-2-(1-метилпиперазинил)бензимидазола, 6,26 г (22 ммоль) N-(4-бромбутил)фталимида, 4,55 г (33 ммоль) карбоната калия и 4,62 г (30 ммоль) иодида натрия в 100 мл метилэтилкетона. Охлаждают, фильтруют и выпаривают фильтрат досуха. Обрабатывают осадок хлороформом и водой, органическую фазу высушивают с Na2SO4, фильтруют и выпаривают в вакууме. Полученное масло очищают на хроматографической колонке двуокиси кремния (элюант : хлороформметанол 95: 5). Таким образом, получают 8,47 г 1-(2-этоксиэтил)-2-{4-(4-N-фталимидо-бутил)пиперазин-1-ил-метил} бензимидазола.
1Н-ЯМР (CDCl3): δ 1,1 (t, 3H); 2.6 (m, 4Н); 2,45 (m, 10Н) 3,3 (q, 2H); 3,5-3,8 (m, 6Н), 4,4 (t, 2H), 7,15 (m, 4Н); 7,55 (m, 4Н).
Нагревают при кипячении в течение 2 ч раствор 8,46 г (17,3 ммоль) ранее полученного соединения и 1,73 г (34,6 ммоль) гидрата гидразина в 150 мл этанола. Охлаждают, фильтруют, промывают этанолом и выпаривают фильтрат досуха в вакууме. Обрабатывают осадок хлороформом и промывают водой, высушивают, выпаривают и получают 4,35 г 1-(2-этоксиэтил)-2-этоксиэтил)-2-{ 4-(4-аминобутил)пиперазин-1-ил-метил} бензимидазола, который используют без другой очистки.
1Н-ЯМР (CDCl3): δ 1,1 (t, 3H), 1,45 (m, 4Н), 1,75 (s, 2H); 2,05-2,75 (m, 12Н), 3,35 (q, 2H), 3,6-3,9 (m, 4Н), 4,45 (t, 2H); 7,20 (m, 3Н), 7,6 (m, 1Н).
б) 1-(2-Этоксиэтил)-2-{ 4-[4-(1-пирролил)бутил] пиперазин-1-ил-метил} бензимидазол.
Нагревают при кипячении в течение 20 мин раствор 2 г (5,57 ммоль) 1-(2-этоксиэтил)-2-{ 4-(4-аминобутил)-пиперазин-1-ил- метил} бензимидазола и 0,735 г (5,57 ммоль) 2,5-диметокситетрагидрофурана в 20 мл уксусной кислоты. Охлаждают, выливают в ледяную воду, нейтрализуют с NaHCO3 и экстрагируют хлороформом. Высушивают с Na2SO4 и выпаривают досуха в вакууме. Таким образом, получают 2,75 г неочищенного соединения, которое очищают на хроматографической колонке двуокиси кремния (элюант: хлороформ - метанол 94: 6).
Соль с фумаровой кислотой получают в этиловом этанолэфире с точкой плавления 138-142оС.
Спектроскопические данные для идентификации приводят в табл. 1 и 2.
Метод С.
П р и м е р 6. Получение 1-(2-этоксиэтил)-2-{4-[4-(4-карбоксипиразол-1-ил) бутил] пиперазин-1-ил-метил} бензимидазола.
Кипятят в течение 4 ч. смесь 5 г (17,36 ммоль) 1-(2-этоксиэтил)-2-(1-метилпиперазинил)бензимидазола, 4,77 г (17,36 ммоль) 1-(4-бромбутил)-4-пиразолкарбоксилатэти-ла, 3,60 (26 ммоль) карбоната калия и 3,52 г (23,5 ммоль) иодида натрия в 100 мл метилэтилкетона. Охлаждают, фильтруют и выпаривают досуха.
Обрабатывают осадок хлороформом и водой, высушивают органическую фазу с Na2SO4, фильтруют и выпаривают в вакууме. Полученное неочищенное соединение очищают на хроматографической колонке двуокиси кремния (элюант: хлороформ-метанол 95: 5) и, таким образом, получают 4,85 г 1-(2-этоксиэтил)-2-{ 4-[4-(4-этилоксикарбонилпи- разол-1-ил) бутил] пиперазин-1-ил-метил} бензимидазола.
Спектроскопические данные соединения являются такими же, что и уже приведенные в примере 6 по методу А.
Этот сложный эфир гидролизуют подобно методу, показанному в примере 6 метода А, и получают кислоту с такими же спектроскопическими данными, что и данные приведенные в табл. 1 и 2.
П р и м е р 8. Получение 1-(2-этоксиэтил)-2-{4-[4-(1-пирролил/бутил] пиперазин-1-ил-метил} бензимидазола.
Получают так, как показано в предыдущем примере и получают соединение, соль которого с фумаровой кислотой имеет точку плавления 137-142оС.
Спектроскопические данные для идентификации являются теми же, что и представленные в табл. 1 и 2.
Фармакологическая активность.
Продукты, являющиеся предметом настоящего изобретения, являются сильнодействующими противогистаминными соединениями, которые отличаются тем, что они являются свободными от депрессирующего эффекта в противоположность большинству известных противогистаминных соединений.
Противогистаминная активность in vivo.
Противогистаминная активность исследовалась путем определения защиты от гибели, причиняемой продуктом 48/80 на крысах. Это исследование проводилось по технологии, описанной в C.J. E. Niemegeers et cols. (Arch. int. Pharmacodyn. , 234, 164-176 (1978). Продукты, являющиеся предметом настоящего изобретения, вводят крысам внутрипарантеральным путем. По истечении 60 мин вводят соединение 48/80 (0,5 мг/кг, i.v.). Защитная активность проявляется как выживание крыс в течение 4 ч после введения i.v. соединения 48/80.
Исследуют активность продуктов с несколькими дозами с целью определения дозы, способной защитить 50% животных (ДЕ-50).
Ниже приводится противогистаминная активность некоторых продуктов. Эту активность сравнивают с активностью дифенгидрамина, являющегося контрольным противогистаминным соединением. Большинство продуктов являются более активными, чем дифенгидрамин, учитывая, что их ДЕ-50 является намного ниже.
Противогистаминная активность in vivo:
Защита от смерти, вызванной соединением 48/80 Пример ДЕ-50 (мг/кг, i, р)
1 0,09
2 2,7
3 0,13
4 0,036
5 2,6
6 0,064
7 0,02
8 0,02
9 0,84
10 0,66 Дифенгидрамин 5,4
Успокаивающий эффект: 1/ Тест Ирвина.
Для изучения отсутствия успокаивающего эффекта продуктов их вводят крысам внутрипарантеральным путем и наблюдают за поведением животных в соответствии с нормами, описанными в тесте Ирвина (Наука, 136, 123-128 (1962)).
Раs. : Пассивность, успокоение, прострация. Количественная оценка от 0 до 3 . Ее проводят через 1,2 и 3 ч после обработки.
Аtax.: Атаксия, оценивают нарушения координации при передвижении. Оценивают от 0 до 3. Оценивают через 1, 2 и 3 ч после обработки.
В табл. 3 приводят результаты изучения успокаивающего эффекта некоторых продуктов, являющихся предметом настоящего изобретения. Эту активность сравнивают с активностью дифенгидрамина, являющегося контрольным противогистаминным соединением. Продукты, являющиеся предметом настоящего изобретения, показывают очень слабый успокаивающий эффект в противоположность дифенгидрамину, который оказывается токсичным при дозе 80 мг/кг, i,р. по причине депрессивных эффектов SNC.
Успокаивающий эффект: 2. Стимулирование времени сна, наведенного пентобарбиталом.
Изучение стимулирования времени сна в результате введения пентобарбитала выполняют по методу, описанному в Z.E. Allen et cols. (Arz. Forsch. 24, (6), 1974). Исследованные продукты вводят оральным путем. Часом позже вводят пентобарбитал натрия (35 мг/кг) и определяют время задержки пробуждения животных. Сравнивают время сна с группой контрольных животных, обработанных только пентобарбиталом натрия.
С целью дополнения исследований, которые доказывают отсутствие депрессирующего эффекта продуктов, являющихся предметом настоящего изобретения, в этом тесте сравнивают активность одного из наиболее сильнодействующих продуктов с наименьшим успокаивающим эффектом (пример 7) с контрольным противогистаминным соединением, дифенгидрамином. В табл. 4 приводятся результаты этого испытания с использованием соединения по примеру 7 и дифенгидрамина. Очевидно, что дифенгидрамин потенциализирует в значительной степени время сна при дозе 20 мг/кг, в то время как соединения по примеру 7 не потенциализирует время сна, наведенное пентобарбиталом, даже при максимально испытанной дозе в 320 мг/кг.
Успокаивающий эффект: 2) Стимулирование времени сна, наведенного пентобарбиталом.
Ниже, в качестве примера, приводится отдельная галеновая форма производных, являющихся предметом настоящего изобретения.
Таблетки.
Формула для таблетки
Соединение по примеру 7, мг 10,00 Лактоза, мг 54,00 Кукурузный крахмал, мг 26,60
Микрокристаллическая целлюлоза, мг 18,00 Поливинилпирролидон, мг 6,00 Кроскармелоза натрия, мг 3,60
Коллоидальная кремне- вая двуокись, мг 0,60 Стеарат магния, мг 1,20
________
120,00




Использование: в медицине, в частности в качестве соединения с антигистаминной активностью. Сущность изобретения: продукт - производные бензимидазола ф-лы I, где R1 и R2 - равные или различные, представляют H, галоген, низший алкил, гидрокси-, алкокси-, карбалкоксигруппа, не- или замещенный арил; n = 0-1; m = 2-4; X, Y, Z и W - равные или разные и также образующие - часть другого ароматического или неароматического цикла, представляют азот или углерод, связанный с галогеном, или таким радикалом, как алкил, арил, карбоксиалкил, карбоалкокси-, сульфо- или алкилсульфогруппа. 4 табл.
Производные бензимидазола общей формулы
R (CH2)n
(CH2)n N
N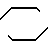 N
N (CH2)
(CH2)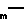 N
N
где R1 и R2 - одинаковые или различные, водород, галоген, низший алкил, гидрокси-, алкокси-, карбалкоксигруппа, арил или замещенный арил;
n=0-1;
m=2-4;
X, Y, Z и W - одинаковые или различные, образующие часть другого ароматического или неароматического цикла, азот или углерод, связанный с водородом, галогеном или с таким радикалом, как алкил, арил, карбоксилкил, карбоалкоксил, гидроксил, алкилгидроксисульфо- или алкилсульфогруппа,
обладающие антигистаминной активностью.
| J | |||
| Med | |||
| Chem., 1986, 29, c.1178-1183. |
Авторы
Даты
1994-12-15—Публикация
1991-07-25—Подача