Изобретение относится к новым производным бензимидазола, способу их получения, а также к фармацевтической композиции, на основе бензамидинов.
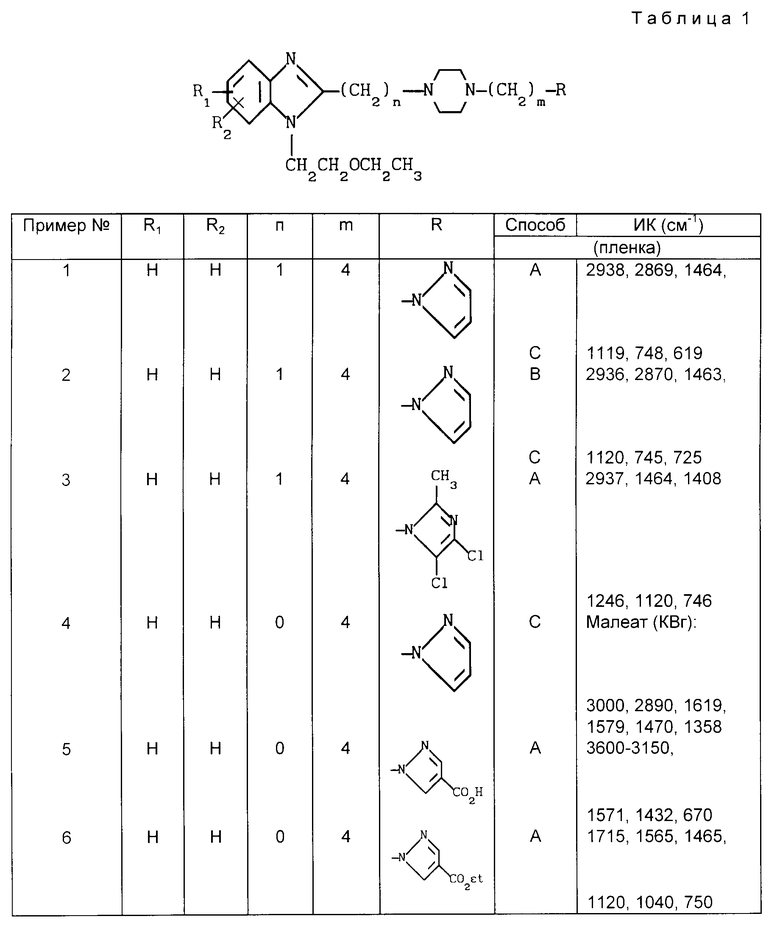
Более конкретно, соединения, составляющие предмет настоящего изобретения, отвечают общей формуле I: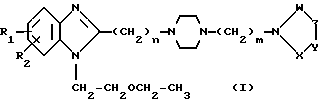
в которой R1 и R2, одинаковые или разные, обозначают атом водорода, галоген, низший алкильный радикал, гидроксильный радикал, алкоксирадикал, алкилкарбоксилатный радикал, арильный или замещенный арильный радикал,
n может иметь значения 0 или 1,
m может иметь значения 2-4,
X, Y, Z и W, одинаковые или разные, образующие часть другого цикла, ароматического или неароматического, обозначают атом азота или атом углерода, связанный с атомом водорода, галогеном, или с другим алкильным, арильным, карбоксиалькильным, карбоксильным, гидроксильным, алкилоксильным, сульфоновым или алкилсульфоновым радикалом.
В научной литературе известны производные бензимидазола с различными биологическими активностями, например анальгетическая и противовоспалительная активности (Japan Kokai 75, 126, 682), желудочная антисекреторная активность (европейский патент 246126 и европейский патент 5129); антигистаминная активность (J. Jilek и др. Collect, Czech. Chem.Commun, 1988, 53, 870-83; патент США 4200641; Drugs of the Future, VII, 10-1, 1982; R. Iemura и др. J.Med. Chem, 1986, 29, 1178-1183, R. Iemura и др. J.Heteroxycyclic. Chem. 1987, 24, 31-37; заявка на патент Франции FR 90/095631). Соединения, составляющие предмет настоящего изобретения, являются новыми производными бензимидазола, конкретно 1-(2-этоксиэтил)-2{ ω-[w-(азол-1-ил)алкил] гексагидро-1,4 диазепин-1-ил-алкил}бензимидазолы, которые будут называться в данном изобретении как 1-(2-этоксиэтил)-2-{w -[w -(азол-1-ил)алкил]гомопиперазин-1-ил-алкил} бензимидазолы. Эти новые производные обладают очень хорошей антигистаминовой активностью и не оказывают вторичных эффектов на центральную нервную систему.
Новые производные общей формулы I могут быть получены, согласно изобретению, любым из следующих способов:
Способ А путем взаимодействия соединения общей формулы IIа: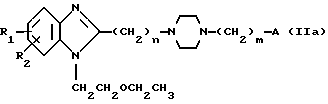
или IIб: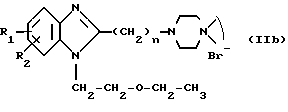
в которых R1, R2, n и m имеют вышеуказанные значения, а А обозначает атом галогена или "отщепляемую" группу, выбираемую среди тозилокси или мезилокси, с соединением общей формулы III: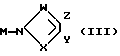
в которой X, Y, Z и W имеют вышеуказанные значения.
Реакция осуществляется в присутствии адекватного растворителя, например, диметилсульфоксида, диметилформамида; спиртов; углеводородов, ароматических или нет; простых эфиров, таких как диоксан или дифениловый эфир, или смесей этих растворителей. Эта реакция предпочтительно осуществляется в присутствии основания такого, как гидроксиды, карбонаты или бикарбонаты щелочных металлов, или смеси этих оснований. Можно также использовать гидриды щелочных металлов.
Наиболее адекватные температуры колеблются от комнатной до температуры кипения с обратным холодильником растворителя и время реакции составляет 1-24 часа.
Способ Б путем взаимодействия соединения общей формулы IIа, в которой А обозначает радикал -NH2 с 2,5-диметокситетрагидрофураном.
Реакция осуществляется в присутствии адекватного растворителя, например уксусной кислоты, воды, спиртов, кетонов или смесей этих растворителей. Наиболее адекватные температуры колеблются от комнатной до температуры кипения с обратным холодильником растворителя и время реакции составляет от нескольких минут до 24 часов.
Способ В путем реакции соединения общей формулы IV: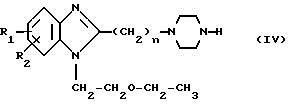
в которой R1, R2 и n имеют вышеуказанные значения, с соединением общей формулы V: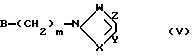
где X, Y, Z, W и m имеют вышеуказанные значения, а В обозначает атом галогена или "отщепляемую" группу, выбираемую среди тозилокси или мезилокси.
Реакция осуществляется в присутствии адекватного растворителя, например диметилсульфоксида; диметилформамида; спиртов; углеводородов, ароматических или нет; простых эфиров, таких как диоксан или дифениловый эфир, или смесей этих растворителей. Эта реакция предпочтительно осуществляется в присутствии основания, такого как гидроксиды, карбонаты или бикарбонаты щелочных металлов, или смеси этих оснований. Наиболее адекватные температуры колеблются от комнатной до температуры кипения с обратным холодильником растворителя, а время составляет 1-24 часа.
В следующих примерах показано получение новых производных согласно изобретению. Нижеприведенные примеры, данные в качестве иллюстрации, однако никоим образом не должны ограничивать объема охраны изобретения.
Способ А.
Пример 1. Получение 1-/2 этоксиэтил/-2-{4-[4-(пиразол-1-ил)- бутил]гомопиперазин-1-ил-метил}бензимидазол.
а) 1-(2-этоксиэтил)-2-(4-бензил-1H-гомопиперазин-1-ил-метил)бензимидазол.
К суспензии 2,04 г (46,7 ммоль) NaH (55% в минеральном масле) медленно добавляют раствор 13,6 г (42,5 ммоль) 1H-2-(4-бензил-1H-гомопиперазин-1-ил-метил)бензимидазола в 20 мл диметилформамида /ДМФ/.
Нагревают при 60-70oC в течение 1 часа и затем добавляют раствор 5,1 г /46,7 ммоль/ 1-хлор-2-этоксиэтана в 5 мл ДМФ.
Выдерживают при перемешивании в тех же условиях в течение 5 часов. Выливают воду и экстрагируют этилацетатом, промывают водой, органическую фазу сушат над Na2SO4, отфильтровывают и выпаривают. Полученное масло очищают на хроматографической колонке с диоксидом кремния. Элюируя смесью хлороформа с метаном в соотношении 99:1 получают 5,65 г (50%) 1-(2-этоксиэтил)-2-(4-бензил-1H- гомопиперазин-1-ил-метил)бензимидазола и с помощью смеси хлороформа с метанолом (97: 3) рекуперируют 4,3 г (32%) исходного, непрореагировавшего продукта.
IH-ЯМР /CDCl3/: δ 1,12 /т. 3H/; 1,79 /м.2H/; 2,69 /м.8H/; 3,41 /к.2H/; 3,63/с.2H/; 3,76/т.2H/; 3,98 /с.2H/; 4,55/т.2H/; 7,25/м.8H/; 7,7/м.1H/.
б) 1-(2-Этоксиэтил)-2-(гомопиперазин-1-ил-метил)бензимидазол.
Нагревают при 60oC раствор 5,94 г (15,15 ммоль) 1-(2-этоксиэтил)-2-(4-бензил-1H-гомопиперазин-1-ил-метил) бензимидазола в 80 мл 80%-ной уксусной кислоты вместе с 4,02 г Pd/C, 5%-ный, /содержание воды 50%/ в атмосфере водорода под давлением 5 атм. в течение 16 часов. Отфильтровывают и выпаривают досуха. Обрабатывают остаток хлороформом и промывают 20%-ным раствором NaOH водой и сушат над сульфатом натрия, отфильтровывают и выпаривают.
Получают 3,65 г (80% ) 1-(2-этоксиэтил)-2-(гомопиперазин-1-ил-метил)бензимидазола.
1H-ЯМР /CDCl3/: d 1,12 /т.3H/; 1,78 /м.2H/; 2,28 /с. уширенный, 1H/; 2,74-3,05 /м.8H/; 3,41 /к.2H/; 3,76 /т.2H/; 4,02 /с.2H/; 4,56/т.2H/; 4,25/м. 3H/; 7,7/м.1H/.
ИК-спектр/пленка/: 3312, 1463, 1119, 744 см-1.
в) Бромид 1-(2-этоксиэтил)-2-(8-метилаза-5-азониаспиро/4,6/ундекан)бензимидазола.
Кипятят с обратным холодильником в течение 16 часов смесь 4 г (13,24 ммоль) 1-(2-этоксиэтил)-2-(гомопиперазин-1-ил-метил) бензимидазола, 3,29 г /15,23 ммоль/ 1,4-дибромбутана и 2,5 г /18,1 ммоль/ карбоната калия в 40 мл хлороформа. Охлаждают, отфильтровывают и выпаривают. Остаток растирают в диэтиловом эфире и получают 5,6 г /97%/ твердого гигроскопичного вещества, которое используют таким, какое есть, без другой очистки.
1H-ЯМР /CDCl3/: d 1,06 /т.3H/; 2,24 /м. 6H/; 2,96-3,51 /м.8H/; 3,72-3,90 /м.8H/; 4,15 /с.2H/; 4,53/т. 2H/; 7,30 /м.3H/; 7,74 /м.1H/.
г) 1-(2-Этоксиэтил)-2-{ 4-/4-(пиразол-1-ил)бутил/гомопиперазин-1-ил-метил}бензимидазол.
Кипятят с обратным холодильником в течение 16 часов смесь 3 г /6,86 ммоль/ бромида 1-(2-этоксиэтил)-2-(8-метилаза-5-азониаспиро/4,6/ундекан)бензимидазола, 0,56 г /8,24 ммоль/ пиразола, 1,8 г карбоната калия и 30 мл диметилформамида. Охлаждают, отфильтровывают и фильтрат выпаривают досуха. Остаток обрабатывают хлороформом и промывают водой. Органическую фазу сушат над сульфатом натрия, отфильтровывают и выпаривают. Получающееся масло очищают на хроматографической колонке с диоксидом кремния /элюирующее средство хлороформ-метанол 9:1/. Таким образом получают 1, 40 г /48%/ 1-(2-этоксиэтил)-2-{4-[4-(пиразол-1-ил)бутил]гомопиперазин-1-ил-метил} бензимидазола в виде масла.
Спектральные данные для его идентификации представлены в таблицах 1 и 2.
Пример 3. Получение 1-(2-этоксиэтил)-2-{4-[4-(4,5-дихлор-2- метил-имидазол-1-ил)бутил]гомопиперазин-1-ил-метил}бензимидазола.
Получение осуществляют совершенно аналогичным образом, как и таковое, представленное в примере 1, получая выход 36%
Спектральные данные для его идентификации представлены в таблицах 1 и 2.
Пример 5. Получение 1-(2-этоксиэтил)-2-{ 4-[4-(4-карбоксипиразол- 1-ил)бутил]гомопиперазин-1-ил}бензимидазола.
а) Бромид 1-(2-этоксиэтил)-2-(8-аза-5-азониаспиро/4,6/ундекан)бензимидазола.
Получение осуществляют тем же способом, что и таковой, описанный в примере 1в, получая выход 97%
1H-ЯМР /CDCl3/: d 1,09 /т. 3H/; 1,9-2,4 /м. 6H/; 3,42/к. 2H/; 3,82 /т. 2H/; 3,9-4 1 /м.12H/; 4,26 /т. 2H/; 7,20 /м. 3H/; 7,50 /м. 1H/.
б) 1-(2-Этоксиэтил)-2-{4-[4-(4-этилоксикарбонилпиразол-1-ил)бутил]гомопиперазин-1-ил}бензимидазол.
Получение осуществляют таким же способом, что и таковой, описанный в примере 1г, и получают сырой продукт, который очищают на хроматографической колонке с диоксидом кремния /элюирующее средство: хлороформ-метанол 95:5/. Выход: 35%
1H-ЯМР -/CDCl3/: d 1,13/т. 3H/; 1,33/т.3H/; 1,93/м.6H/; 2,6/т. 2H/; 2,8/м. 4H/; 3,35-3,83/м.8H/; 4,07-4,4/м.6H/; 7,1-7,25 /м.3H/; 7,5/м. 1H/; 7,85/с. 2H/.
Вышеполученный сложный эфир гидролизуют путем обработки 10%-ным раствором гидроксида натрия в течение 15 часов при комнатной температуре в этанольном растворе. Спирт выпаривают и водный раствор нейтрализуют соляной кислотой. Выпаривают досуха и кислоту экстрагируют из остатка путем настаивания с изопропанолом. Выход 87% Т.пл. выше 300oC.
Спектральные данные для его идентификации представлены в таблицах 1 и 2.
Способ Б.
Пример 2. Получение 1-(2-этоксиэтил)-2-{4-[4-(пиррол-1-ил)бутил]гомопиперазин-1-ил-метил}бензимидазола.
В течение 25 минут кипятят с обратным холодильником раствор 2,98 г /8 ммоль/ 1-(2-этоксиэтил)-2-{4-/4-аминобутил/гомопиперазин-1-ил-метил}бензимидазола и 1,06 г /8 ммоль/ 2,5-диметокситетрагидрофурана в 30 мл уксусной кислоты. Охлаждают, выливают в ледяную воду, нейтрализуют с помощью NaHCO3 и экстрагируют хлороформом. Сушат над сульфатом натрия и выпаривают под вакуумом досуха. Таким образом получают 3,2 г сырого соединения, которое очищают на хроматографической колонке с диоксидом кремния /элюирующее средство: хлороформ-метанол 92:8/. Выход: 51%
Спектральные данные соединения такие же, как и представленные в примере 2 способа В.
Способ В.
Пример 2: Получение 1-(2-этоксиэтил)-2-{4-[4-(пиррол-1-ил)бутил]гомопиперазин-1-ил-метил}бензимидазола.
В течение 16 часов кипятят с обратным холодильником смесь 2,42 г /8 ммоль/ 1-(2-этоксиэтил)-2-(гомопиперазин-1-ил-метил)бензимидазола, 1,39 г /8,8 ммоль/ 1-(4-хлорбутил)пиррола, 1,65 г /12 ммоль/ карбоната калия и 1,65 г /11 ммоль/ иодида натрия в 40 мл метилэтилкетона.
Охлаждают, отфильтровывают и фильтрат выпаривают досуха. Остаток обрабатывают хлороформом и промывают водой, сушат, отфильтровывают и выпаривают над вакуумом. Полученное сырое вещество очищают на хроматографической колонке с диоксидом кремния (элюирующее средство: хлороформ-метанол 92:8) и получают 1,9 г /56%/ 1-(2-этоксиэтил)-2-{4-[4-(пиррол-1-ил)бутил]гомопиперазин-1-ил-метил}бензимидазола.
Спектральные данные для его идентификации представлены в таблицах 1 и 2.
Пример 4. Получение 1-(2-этоксиэтил)-2-{4-[4-(пиразол-1-ил)- бутил]гомопиперазин-1-ил}бензимидазола.
Получение осуществляют таким же образом, как и таковой, описанный в предыдущем примере, и получают соединение с выходом 49% соль которого с малеиновой кислотой имеет т.пл. 102-105oC.
Фармакологическая активность.
Продукты, являющиеся предметом настоящего изобретения, обладают антигистаминной активностью, которая характеризуется фактом отсутствия седативных эффектов, в противоположность большинству известных антигистаминных препаратов.
Антигистаминная активность "ин виво".
Антигистаминную активность изучали путем определения защиты по отношению к смертности, вызванной продуктом 48/80, у крысы. Этот опыт реализовали следуя способу, описанному C. J.E.Niemegeere и сотр./Arch. int. Pharmacodyn, 234, 164-176, 1978/.
Продукты, являющиеся предметом настоящего изобретения, вводятся интраперитонеально крысам. Спустя 60 минут вводят соединение 48/80 (0,5 мг/кг, внутривенно). Защитную активность определяют как выживание крыс спустя 4 часа после внутривенной инъекции 48/80.
Активность продуктов изучают на нескольких дозах с целью определения дозы, способной защищать 50% животных /ЭД50/.
Затем показывают антигистаминную активность продукта примера 1. Эту активность сравнивают с таковой Дифенгидрамина, стандартного антигистаминного средства.
Антигистаминная активность "ин виво".
Защита от гибели, вызываемой 48/80.
Пример ЭД50 /мг/кг, интраперитонеально/.
1 0,04
Дифенгидрамин 5,4
Седативный эффект: 1/ Тест Ирвина.
Для изучения отсутствия седативного эффекта продуктов, являющихся предметом настоящего изобретения, их вводят интраперитонеально крысам и наблюдают за поведением животных, согласно нормам, описанным в тесте С. Ирвина /Science, 136, 123-128/1962//.
Ниже представлен результат, полученный для продукта примера 1 в двух оценках, которые отражают седативный эффект.
Pas: пассивность, успокоение, прострация. Количественная оценка от 0 до 3. Их реализуют спустя 1,2 и 3 часа после обработки.
Atax. атаксия; оценивают изменения координации в локомоции.
Их оценивают как величины 1,3. Их реализуют спустя 1,2 и 3 часа после обработки.
Ниже резюмируют результаты изучения седативного эффекта продукта примера 1 настоящего изобретения в качестве примера. Эту активность сравнивают с таковой Дифенгидрамина, стандартного антигистаминного средства. Этот продукт показывает очень слабый седативный эффект в противоположность Дифенгидрамину, который оказался токсичным в дозе 80 мг/кг интраперитонеально, по причине депрессорных эффектов SNC.
Изучение потенциации времени сна, вызываемого пентобарбиталом, было реализовано по методу, описанному I, E. Allen и сотр. /Arz. Forsch. 24/6/, 1974/. Изучаемые продукты вводились орально. Спустя час вводили пентобарбитал натрия /35 мг/кг, подкожно/ и определяли время, в течение которого животные запаздывают пробуждаться. Время сна сравнивают с таковым группы контрольных животных, обработанных только пентобарбиталом натрия.
С целью дополнения исследований, которые показывают отсутствие седативного эффекта продуктов согласно изобретению, в этом тесте сравнивают активность одного из продуктов /пример 1/ с антигистаминным стандартным средством Дифенгидрамином. Ниже представлены результаты этого опыта с соединением примера 1 и Дифенгидрамином.
Видно, что Дифенгидрамин значительно потенциализирует время сна в дозе 20 мг/кг, тогда как соединение примера 1 не потенциализирует время сна, вызванного пентобарбиталом даже в дозе 160 мг/кг, которая представляет собой максимальную испытуемую дозу (см. табл.4).
Ниже показана, в качестве примера, частная галеновая форма производных согласно настоящему изобретению.
Таблетки, мг.
Соединение примера 1 10,00
Лактоза 54,00
Кукурузный крахмал 26,60
Микрокристаллическая целлюлоза 18,00
Поливинилпирролидон 6,00
Кроскармеллоза натрия 3,60
Коллоидальный диоксид кремния 0,60
Стеарат магния 1,20
Итого 120,00
Использование: в качестве препаратов, обладающих антигистаминовой активностью. Сущность изобретения: соединения I, способ их получения взаимодействием IIа или IIб с III или IV с V. Фармацевтическая композиция содержит в качестве активного вещества соединения I, указанные в описании. 3 с. и 2 з.п. ф-лы. 4 табл.
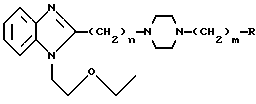
где n 0 или 1;
m 2 4;
R незамещенный или замещенный метилом, одним или двумя атомами галогена или карбоксильным радикалом пятичленный гетероцикл, содержащий в качестве гетероатома один или два атома азота,
или их соли, проявляющие антигистаминную активность.
1-/2-этоксиэтил/-2-/4-/4-/пиразол-1-ил/-бутил/ -гомопиперазин-1-ил-метил/-бензимидазол;
1-/2-этоксиэтил/-2-/4 -/4-/пиррол-1-ил/-бутил/-гомопиперазин-1-ил-метил/-бензимидазол;
-1-/2-этоксиэтил/-2-/4-/4-/4,5-дихлор-2-метилимидазол-1-ил/ -бутил/-гомопиперазин-1-ил/-бензимидазол;
-1-/2-этоксиэтил/-2-/4 -/4-/пиразол-1-ил/-бутил/-гомопиперазин-1-ил/-бензимидазол;
-1-/2-этоксиэтил/-2-/4-/4-/4-карбоксипиразол-1-ил/-бутил/ -гомопиперазин-1-/ил/-бензимидазол.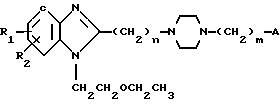
или соединение общей формулы IIб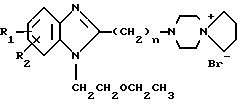
где R1, R2, n и m имеют указанные значения;
A атом галогена или пригодная отщепляемая группа, выбираемая среди тозилокси или мезилокси,
подвергают взаимодействию с соединением общей формулы III
где R вместе с атомом азота образует незамещенный или замещенный метилом, одним или двумя атомами галогена или карбоксильным радикалом пятичленный гетероцикл, содержащий в качестве гетероатома один или два атома азота.
где n 0 или 1,
с соединением общей формулы V
B (CH2)m R,
где m 2 4;
R незамещенный или замещенный метилом, одним или двумя атомами галогена или карбоксильным радикалом, пятичленный гетероцикл, содержащий в качестве гетероатома один или два атома азота; B атом галогена или отщепляемая группа, выбираемая из тозилокси или мезилокси.
| WO, заявка, 87/05510, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1997-12-20—Публикация
1992-04-01—Подача