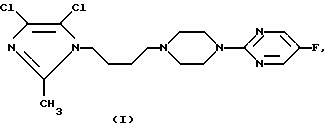
Изобретение относится к новому соединению 2-{4-[4-[4,5-дихлор-2-метилимидазол-1-ил)бутил] -1-пиперазинил} -5-фторпиримидин формулы I, его получению и применению в терапии, а также к его физиологически приемлемым солям, к способам их получения и к их применению в качестве лекарственного средства, используемого в терапии человека и/или ветеринарной терапии, а также к фармацевтическим композициям, которые их содержат,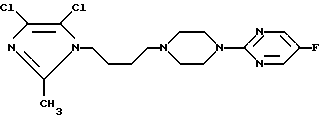 (I)
(I)
В патентах ЕР 382 637 и ЕР 497 659, полученных заявителем, описаны различные производные пиримидинил-пиперазинил-алкил-азолов, обладающие анксиолитическими и/или транквилизирующими свойствами. Несмотря на то, что патент ЕР 382 637 содержит сведения о производных пиримидинил-пиперазинил-алкил-азолов, замещенных в положении 5 пиримидина атомом галогена, приведены описания лишь двух примеров соединений этого типа, и в обоих случаях речь идет об атоме брома.
Теперь заявитель обнаружил, что в результате введения атома фтора в качестве заместителя пиримидина в положении 5 и в том особом случае, когда азол является имидазолом, тризамещенным метильной группой в положении 2 и двумя атомами хлора в положениях 4 и 5, образуется соединение, представляющее собой предмет настоящего патента и обладающее некоторыми интересными биологическими свойствами, придающими ему особое значение с точки зрения применения в терапии человека и/или ветеринарной терапии. В частности, соединение, являющееся предметом настоящего патента, представляет интерес в качестве противорвотного средства, средства против морской болезни (тошноты, вызванной движением), антидепрессанта, анксиолитического средства, ингибитора секреции кислоты в желудке и средства против обсессивно-компульсивных заболеваний, используемого также при приступах паники и при апноэ во время сна, наблюдаемых у млекопитающих, включая человека.
Соединение 2-{ 4-[4-[4,5-дихлор-2-метилимидазол-1-ил)бутил]-1-пиперазинил}-5-фторпиримидин, а также его физиологически приемлемые соли по изобретению можно получить при помощи нижеописанного способа:
а) в результате реакции 8-(5-фтор-2-пиримидинил)-8-аза-5-азониаспиро[4,5] декана с 4,5-дихлор-2-метил-1Н-имидазолом в присутствии карбоната калия и в таком биполярном апротонном растворителе, как диметилформамид. Температура реакции может составлять от 70oС до температуры кипения растворителя, а время реакции колеблется между 3 и 48 часами
б) путем реакции 5-фтор-2-(пиперазин-1-ил)пиримидина с 1-(4-хлорбутил)-4,5-дихлор-2-метил-1Н-имидазолом в присутствии карбоната калия и в таком биполярном апротонном растворителе, как диметилформамид. Температура реакции может составлять от 70oС до температуры кипения растворителя, а время реакции составляет от 3 до 48 часов. Эта реакция также может производиться в условиях фазового перехода с использованием водного раствора гидроксида натрия, толуола и такого катализатора, как бромистый тетрабутиламмоний. В этих условиях температура реакции может составлять от 50 до 90oС, а время реакции составляет от 12 до 72 часов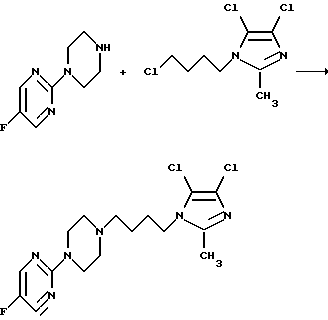
с) путем реакции 2-{4-[4-4,5-дихлор-2-метилимидазол-1-ил) бутил]пиперазин-1-ил}-5-фторпиримидина и какой-либо физиологически приемлемой кислоты, такой, например, как лимонная кислота, в таком соответствующем растворителе, как этанол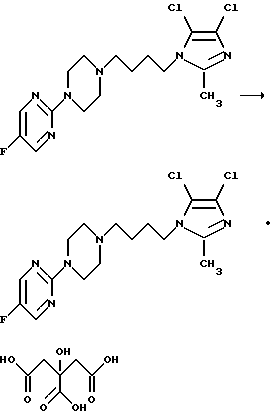
В следующих примерах приводится описание получения нового соединения, представляющего собой предмет изобретения, а также его физиологически приемлемых солей. Также описаны некоторые типы биологического действия и формы применения. Нижеприведенные примеры даны просто в качестве иллюстрации, не имея при этом ограничительного характера.
Пример 1
Получение 2-{4-[4-[4,5-дихлор-2-метилимидазол-1-ил)бутил]-1-пиперазин-1-ил}-5-фторпиримидина
Смесь 3,17 г (0,01 моль) 8-(5-фтор-2-пиримидинил)-8-аза-5-азониаспиро[4,5] декана, 2,26 г (0,015 моль) 4,5-дихлор-2-метил-1Н-имидазола и 76 г (0,02 моль) карбоната калия в 80 мл диметилформамида нагревают в течение 12 часов с обратным холодильником. Затем производят выпаривание досуха, полученный неочищенный продукт вновь растворяют в хлороформе и несколько раз промывают в воде. Органическую фазу просушивают и выпаривают, затем полученный неочищенный продукт очищают хроматографией на колонке силикагеля. В результате получают 3,3 г (выход продукта 85%) 2-{4-[4-[4,5-дихлор-2-метилимидазол-1-ил)бутил]-1-пиперазин-1-ил}-5-фторпиримидина в форме масла.
IR(пленка), см-1: 2944, 1610, 1555, 1503, 1449, 1402, 1361, 1243, 786.
ЯМР-Н (CDCl3, 300 MHz), δ: 1,54 (m, 2H), 1,73 (m, 2Н), 2,34 (s, 3H), 2,38 (m, 2H), 2,43 (m, 4H), 3,74 (m, 4H), 3,85 (m, 2H), 8,15 (s, 2H),
Пример 2
Получение 2-{4-[4-[4,5-дихлор-2-метилимидазол-1-ил)бутил]пиперазин-1-ил} -5-фторпиримидина
Смесь 3,5 г (0,02 моль) 5-фтор-2-(пиперазин-1-ил)пиримидина, 6,04 г (0,025 моль) 1-(4-хлорбутил)-4,5-дихлор-2-метил-1Н-имидазола и 4,14 г (0,03 моль) карбоната калия в 200 мл диметилформамида нагревают в течение 12 часов с обратным холодильником. Затем производят выпаривание досуха, полученный неочищенный продукт заново растворяют в хлороформе и несколько раз промывают водой. Органическую фазу просушивают и выпаривают, затем полученный неочищенный продукт очищают хроматографией на колонке силикагеля. В результате получают 6,4 г (выход продукта 83%) 2-{4-[4-[4,5-дихлор-2-метилимидазол-1-ил)бутил]пиперазин-1-ил}-5-фторпиримидина в форме масла.
IR (пленка), см-1: 2944, 1610, 1555, 1503, 1449, 1402, 1361, 1243, 786.
ЯМР-Н (СDС13, 300 MHz), δ: 1,54 (m, 2H), 1,73 (m, 2H), 2,34 (s, 3Н), 2,38 (m, 2H), 2,43 (ш, 4Н), 3,74 (m, 4H), 3,85 (m, 2Н), 8,15 (s, 2H).
Пример 3
Получение цитрата 2-{4-[4-[4,5-дихлор-2-метилимидазол-1-ил)бутил]пиперазин-1-ил}-5-фторпиримидина
В раствор 2 г (5,2 моль) 2-{4-[4-[4,5-дихлор-2-метилимидазол-1-ил)бутил] пиперазин-1-ил)-5-фторпиримидина в абсолютном этаноле добавляют 1,1 г (5,2 ммоль) моногидратной лимонной кислоты. По прошествии определенного времени 2,72 г (выход продукта 91%) цитрата 2-{4-[4-[4,5-дихлор-2-метилимидазол-1-ил)бутил] пиперазин-1-ил} -5-фторпиримидина осаждается в форме твердого вещества с температурой кипения 151-153oС.
IR(KBR), см1: 3780-2270 (bb), 1707, 1616, 1482, 1429, 1375, 1244, 1214.
ЯМР-Н (ДMSO-d6, 300 MHz), δ: 1,53 (m, 2H), 1,66 (m, 2H), 2,33 (s, 3H), 2,53-2,74 (а.с., 10Н), 3,75 (m, 4H), 3,94 (t, J=7,2 Hz, 2H), 8,46 (s, 2H).
Противорвотное действие
Полученные соединения по изобретению были изучены с точки зрения действия, производимого ими на ощущение тошноты у хорька, в соответствии со способом, описанным Costall и др. в Neuropharmacology, 1986, 25, 959-961.
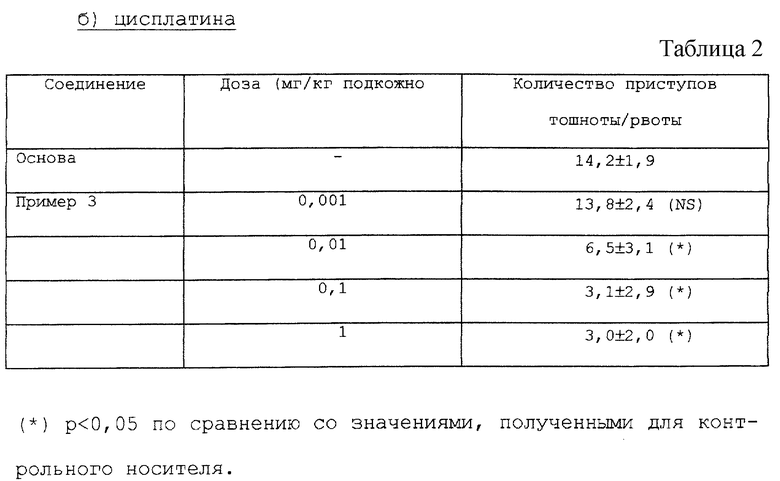
Хорьков обоих полов (0,7-1,4 кг) размещают в индивидуальном порядке при температуре 21±1oС и кормят обычным образом. Затем в качестве предварительной обработки им вводят подкожно приведенное в примере соединение или носитель - за 15 минут до получения ими сернокислой меди (CuSO4•5Н2О; 100 мг/кг внутрижелудочно) или цисплатины (10 мг/кг внутривенно (внутрияремно) жесткой иглой)). Животных наблюдают в начале рвоты, затем в течение 30 минут (сернокислая медь) или 240 минут (цисплатина). Рвота характеризуется ритмичными сокращениями брюшных мышц как связанными с исторжением твердых и жидких продуктов (рвота), так и не связанными с прохождением их через рот (тошнота). Количество эпизодов и приступов тошноты или рвоты регистрируют.
Соединение, указанное в примере 3, способно изменять тошноту, вызванную сульфатом меди, и оказывать противодействие тошноте, вызванной цисплатиной (см. табл. 1 и 2).
Изучение транспортной болезни на землеройках (Suncus Murinus)
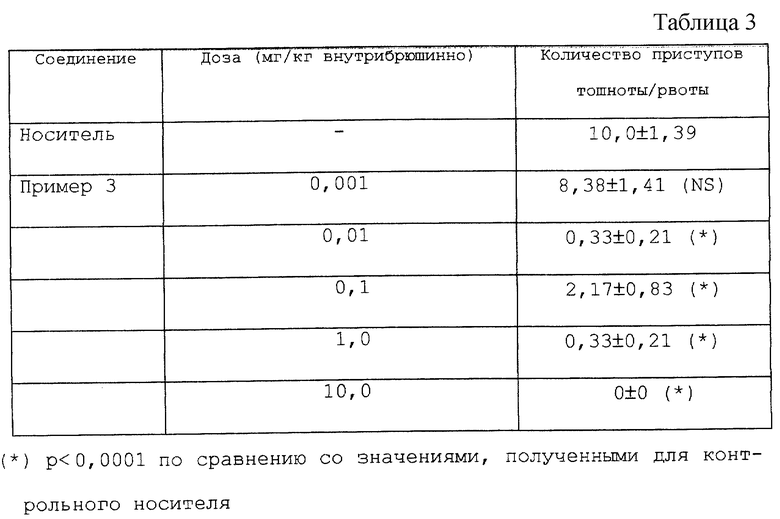
Проводится изучение соединения, приведенного в примере 3, с точки зрения его действия на приступы транспортной болезни (головокружение), вызываемой у Suncus Murinus в соответствии со способом, описанным N.Matsuki и др. в "Mechanisms и control of emesis", John Libbey Emotex, 1992, 233, 323-329).
Самцов Suncus Murinus весом 58-72 г размещают группами по 3, оставляя им свободный доступ к твердой пище и воде. За час до начала опыта в их клетку подается корм для кошек. В начале опыта животные подвергаются обработке испытываемым продуктом внутрибрюшинно. По истечении 30 минут их индивидуально размещают в ящиках для опытов (15 х 15 х 10 см). Ящики (оснащенные несколькими колесами) связаны с двигателем, который перемещает их вперед и назад с такой частотой, которая вызывает у животных приступы тошноты (транспортную болезнь). Частота эта равна 1 герц с амплитудой перемещения 4 см. Животных оставляют в опытных ящиках в течение 30 минут для адаптации к ним, а затем начинают активно двигать клетки в течение 20 минут так, чтобы определить наличие или отсутствие тошноты (без выхода продукта из пищеварительного аппарата) и рвоты (с выходом продукта из пищеварительного аппарата).
Соединение, описанное в примере 3, определенно подавляет возникновение тошноты, вызванной движением (транспортная болезнь), ослабляя как тошноту, так и рвоту при введении доз от 0,01 мг до 10 мг на кг внутрибрюшинно (см. табл. 3)
Анксиолитическое и антидепрессивное действие
Анксиолитическое и антидепрессивное действие доказывается сродством, которое новые соединения представляют для рецепторов серотонина 5НТ 1А (D.A. GLitz, Drugs, 1991, 41, 11), а также посредством опыта, касающегося реакции обусловленного уклонения (J.S.New и в J.Med.Chem., 1986, 29, 1476).
а) Связь с рецептором серотонина 5НТ 1А
Используют гомогенизат гиппокампа крысы в соответствии с вариантом способа S. J. Peroutka (Neurochem, 1986, 47, 529). В качестве радиокоордината используют [3H]-8-OH-DPAT, для измерения неспецифического объединения используют серотонин. Инкубационный период составляет 15 минут при температуре 37oС. Радиоокординат, объединенный с протеином, отделяют путем фильтрации с использованием фильтров из стекловолокна и определяют радиоактивность, удержанную фильтром, путем жидкостной сцинтилляции. Константу ингибирования (Ki, nM) рассчитывают путем анализа нелинейной регрессии с использованием программы EBDA/LIGAND (Munson и Rodbard, Analytical Biochemistry, 1980, 107, 220).
Соединение, указанное в примере 3: Ki=19,4 nM.
б) тест реакции обусловленного уклонения (С.А.R.)
В этом опыте используют крыс Wistar, самцов, весом 200 г, обученных прыжкам через барьер в клетке Letica (ссылки LI 910 и LI 2700) уклонения и выхода (shuttle box), в течение 30 секунд, следующих за их помещением в клетку.
Продукты с анксиолитическим или антидепрессивным действием ликвидируют реакцию обусловленного уклонения.
Обучение: первый день, 11 опытов с перерывом в 3 минуты. 30-ти секундный электрошок в области лап (5 мкА, 0,1 с, 10 с). Второй и третий дни: два ежедневных опыта, проводимых только на отобранных крысах {некоторые из оценок, относящихся к первому дню (за исключением первого опыта) >14}. День опыта: группы, составленные из отобранных крыс. Пероральное введение продукта или носителя за 45 минут до начала исследования.
Соединение, указанное в примере 3: DE50=9,7 мг/кг, перорально.
Действие, ингибирующее секрецию кислоты в желудке
Это действие определяют по способу Shay (H.Shay и др. Gastroenterology, 1945, 5, 43; Visscher и в J.Pharmac. Exp. Ther., 1954, 110, 188).
В этом опыте используют крыс Wistar, самцов, весом от 200 до 250 г, которых содержат натощак до дня, предшествующего проведению опыта, со свободным доступом к воде. Используют группы, состоящие из 4 животных минимум каждая.
При помощи этилового эфира крысам проводят анестезию, производят лапаротомию и перевязывают привратник, а затем осуществляют брюшной надрез. Продукт вводят внутрь двенадцатиперстной кишки, после чего зашивают вышеуказанный брюшной надрез. Доза, вводимая при первом опыте, составляет 40 мг/кг, а затем определяют медианную эффективную дозу (DE50). Используемым носителем является 5% (вес/объем) гуммиарабик в бидистиллированной воде.
Через два часа после перевязывания привратника крыс усыпляют путем длительной анестезии, осуществляемой при помощи этилового эфира, после чего измеряют объем желудочного сока и определяют общую кислотность посредством рН-метра, оснащенного автоматической бюреткой. Для каждого продукта и для каждой испытываемой дозы определяют процент ингибирования секреции кислоты в желудке по отношению к контрольной группе.
Соединение, указанное в примере 3: DE50=1,9 мг/кг (введение внутрь двенадцатиперстной кишки).
Суточная доза препарата в медицине человека и ветеринарной медицине составляет от 1 до 500 мг продукта, который можно вводить в один или несколько приемов. Композиции приготовляются в таких совместимых с используемым путем введения формах, как, например, таблетки, драже, капсулы, суппозитории, растворы или суспензии. Эти композиции получают согласно известным способам, содержание в них действующего вещества составляет от 1 до 60% от веса композиции, тогда как соответствующая фармацевтическая основа, совместимая с действующим веществом и с физической формой композиции, составляет от 40 до 99% от веса этой композиции. В качестве примера приведена формула трех галеновых форм, которые содержат продукт по изобретению.
Пример 4 состава, используемого для таблеток
Пример 3 - 5 мг
Лактоза - 60 мг
Кристаллическая целлюлоза - 25 мг
Повидон К 90 - 5 мг
Предварительно желатинизированный крахмал - 3 мг
Коллоидный диоксид кремния - 1 мг
Стеарат магния - 1 мг
Общий вес - 100 мг
Пример 5 состава, используемого для капсул
Пример 3 - 10 мг
Полиоксиэтиленовый глицерид - 135 мг
Бегенат глицерина - 5 мг
Эксципиент - 150 мг
Пример 6 состава, используемого для инъекций
Пример 3 - 4 мг - 8 мг
Хлорид натрия - 15 мг - 30 мг
Вода для инъекций q. s. p. - 2 мл - 4 млн

Изобретение относится к новому 2-{4-[4-(4,5-дихлор-2-метилимидазол-1-ил)бутил]-1-пиперазинил}-5-фторпиримидину формулы I (см. в тексте описания), а также к его физиологически приемлемым солям, в частности к цитрату, способам их получения и фармацевтической композиции. Соединения формулы I могут использовать для получения лекарственного средства, предназначенного для лечения головокружения, транспортной болезни (тошноты), депрессии, тревожного состояния, секреции кислоты в желудке, обсессивных или компульсивных расстройств, приступов паники и апноэ во время сна. Соединение формулы I получают реакцией 8-(5-фтор-2-пиримидинил)-8-аза-5-азониаспиро-[4,5] декана с 4-дихлор-2-метил-1Н-имидазолом в присутствии карбоната калия в таком биполярном апротонном растворителе, как диметилформамид, при температуре реакции от 70oС до температуры кипения растворителя, в течение 3-48 ч либо реакцией 5-фтор-2-(пиперазин-1-ил)пиримидина с 1-(4-хлорбутил-4,5-дихлор-2-метил-1Н-имидазолом в вышеуказанных условиях или в условиях фазового перехода, используя водный раствор гидроксида натрия, толуола и такой катализатор, как бромистый тетрабутиламмоний, при температуре от 50 - 90oС, в течение 12 - 72 ч. Предлагаемая фармацевтическая композиция содержит помимо фармацевтически приемлемой основы соединение формулы I, а также его физиологически приемлемые соли. 5 с. и 2 з.п. ф-лы, 3 табл.
а также его физиологически приемлемые соли,
2. Соединение по п.1, представляющее собой цитрат 2-{4-[4-(4,5-дихлор-2-метилимидазол-1-ил)бутил]пиперазинил}-5-фторпиримидина.
| Устройство для установки малогабаритного дискового аккумулятора в электроаппарат | 1974 |
|
SU497659A1 |
| US 5128343 A, 07.07.1992 | |||
| О П И САН НЕ ИЗОБРЕТЕНИЯ382637 | 0 |
|
SU382637A1 |
| ЕР 655248 А1, 31.05.1995 | |||
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЕ АНТИГИСТАМИННОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2024519C1 |
Авторы
Даты
2002-10-20—Публикация
1998-05-28—Подача