Изобретение относится к конденсированному имидазольному соединению и его фармакологически приемлемым солям, которые обладают отличной активностью как лекарства. Более конкретно, настоящее изобретение относится к новому дифенилметановому производному и его фармакологически приемлемым солям, полезным в качестве терапевтического агента для гипертензии и/или терапевтического агента при заболеваниях сердца.
Предпосылки изобретения и уровень техники.
Примерно 20% всех японцев, а именно около 20 млн или более японцев страдает от гипертензии, а гипертензия является серьезным фактором риска различных заболеваний мозга, заболеваний сердца и т.п. На практике для лечения гипертензии сейчас используют в клинике тиазидные гипотензивные диуретические агенты, β-блокаторы, антагонисты кальция, АСЕ-ингибиторы и т.п.
Однако происхождение и патология гипертензии очень различны и трудно удовлетворительно контролировать все типы гипертензии при использовании только одного лекарства. Кроме того, относительно безопасности, β-блокаторы вызывают сердечную депрессию и бронхиальную активацию как побочные эффекты, а диуретические агенты вызывают такие побочные эффекты, как гиперурисемия, аномальный метаболизм сахаров и аномальный метаболизм жиров, тогда как АСЕ-ингибитор вызывает в качестве побочного эффекта кашель.
В описанных выше условиях желательно иметь различные типы хороших гипотензивных агентов, которые проявляют свои эффекты через различные механизмы.
Авторами проведены экстенсивные и интенсивные исследования с соединением, обладающим активностью непептидного антагониста ангиотензина 11, в течение ряда лет и в результате обнаружили, что следующее производное дифенилметана обладает отличной активностью.
Примеры имидазольного соединения, обладающего активностью антагониста ангиотензина 11, предложенного на данном уровне техники, включают известные соединения, кроме того, производные 4,5,6,7-тетрагидро-1Н-имидазоло/4,5-c/пиридин-6- карбоновой кислоты. Любое из этих соединений отличается от соединений настоящего изобретения, которые будут описаны здесь ниже, по структуре.
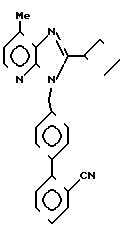
Данное изобретение относится к новым производным дифенилметилимидазола общей формулы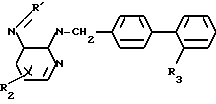 где R1 - циклоалкил;
где R1 - циклоалкил;
R2 - алкил С1-С6;
R3-COOH или 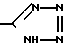 , или их фармацевтически-приемлемым солям.
, или их фармацевтически-приемлемым солям.
Эффект соединений настоящего изобретения теперь будет описан более детально с помощью следующих примеров фармакологических экспериментов.
Примеры фармакологичеспких экспериментов
1. Экспериментальный метод
(1) Антагонизм контрактуре ангиотензина 11 при использовании полоски аорты кролика
Анестезируют пентобарбиталом натрия самцов новозеландского белого кролика, имеющих массу 2-3 кг, и удаляют торокальную аорту. Из нее готовят спиральный препарат аорты, имеющий ширину 1,5-2 мм и длину 15-20 мм и суспендируют в сосуде Магнуса, вместимостью 10 мл, содержащем бикарбонатный раствор Кребса (бикарбонатный раствор Кребса (мМ): NaCl 118,4; KCl 4,7; CaCl2 2,0; MgSO4 ˙ 7H2O 1,2; NaHCO3 25,0; KH2PO4 1,2; глюкоза 11,1). Прибавляют туда 10-5 М индометацина для снятия влияния простагландинов. Выдерживают раствор Кребса при 37оС и барботируют 95% О2-5% СО2. Прикладывают к полоске начальное напряжение 1 г и оставляют полоску на 1 ч. Затем прибавляют 50 мМ KCl, чтобы вызвать контрактуру. После стабилизации контрактуры полоску промывают. Дважды повторяют описанную выше процедуру и вторую контрактуру принимают за 100% контрактуры.
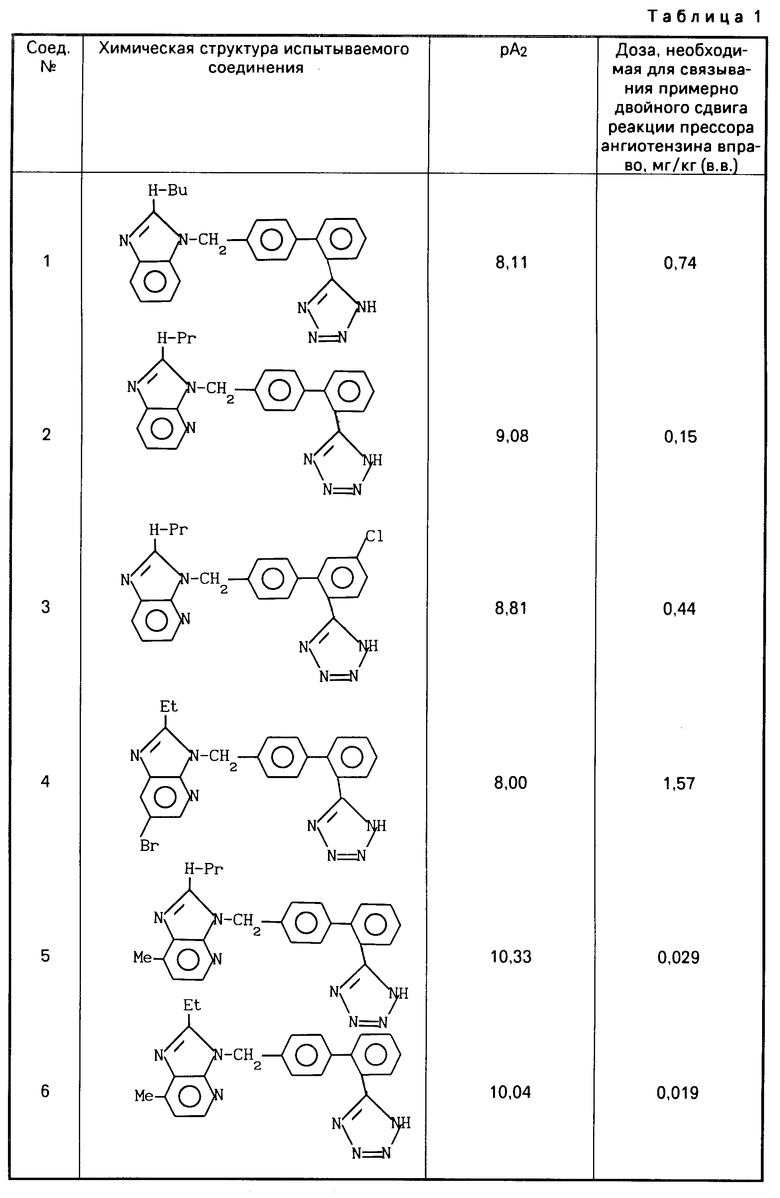
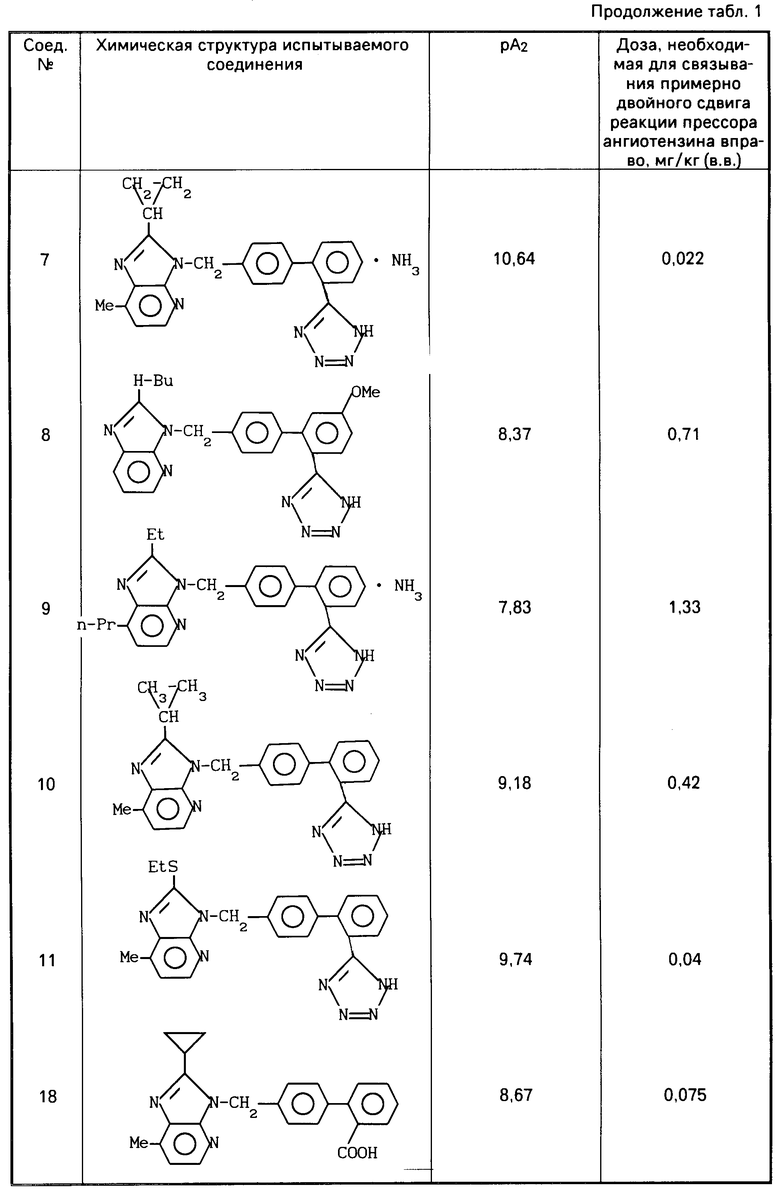
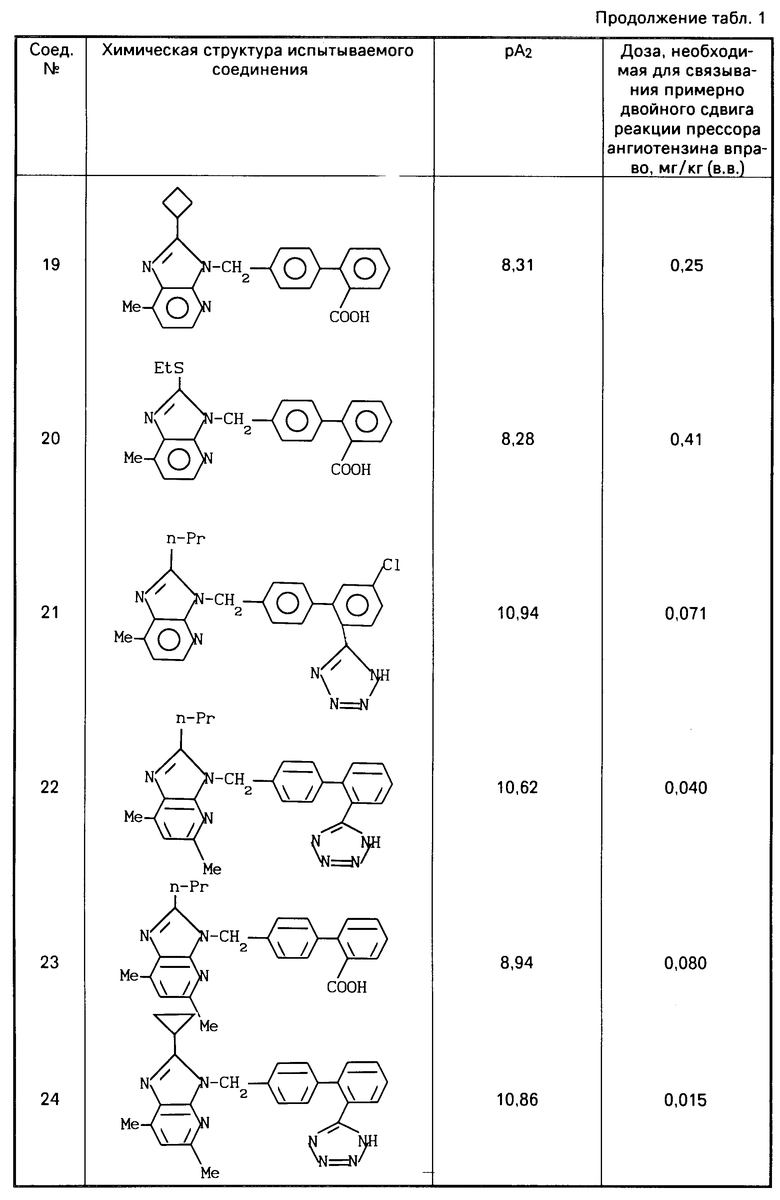
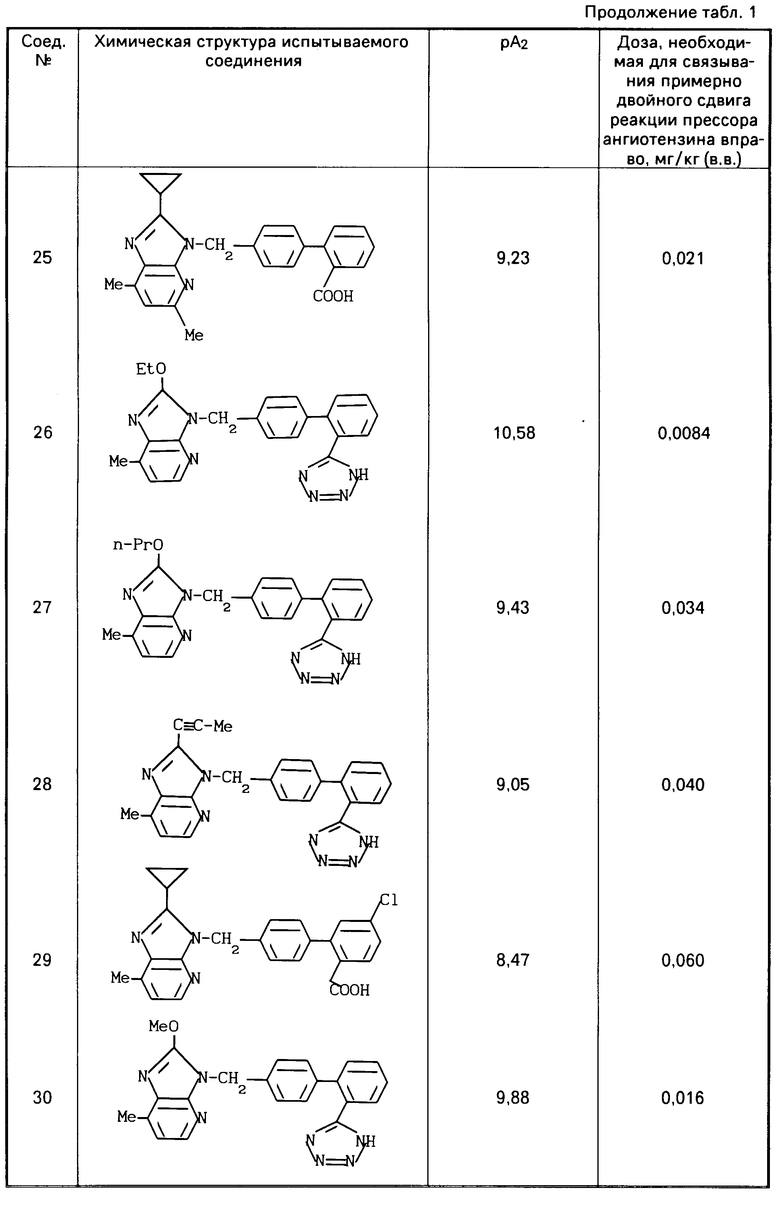
После этого аккумулятивно прибавляют ангиотензин 11 от 10-10 до 3,10-6, чтобы получить кривую доза-реакция. При изучении антагонистической активности антагониста ангиотензина 11 прибавляют испытуемое соединение в концентрации 10-6-10-9 М за 40 мин до прибавления 10-10 М ангиотензина, чтобы наблюдать сдвиг кривой доза-реакция вправо. Регистрируют контракцию на многоточечном самописце (R-10, производится фирмой "Рика Денки Когио Ко.", Лтд) через усилитель (АР620G или АР621G производится фирмой "Нихон Коден Корп. "), используя изометрический пьезоэлектрический преобразователь (ТВ611Т, производится фирмой "Нихон Коден Коп."). Мощность антагониста ангиотензина 11 определяется вычислением отрицательного логарифма (-log) величины концентрации рА2 (а именно, концентрации конкурирующего антагониста, которое делает отношение дозы активного агента 2) по уравнению Шилда. Результаты приведены в табл.1.
2) Ингибирование прессора реакции ангиотензина 11 на анестезированной крысе (Вистар Киото), имеющей блокированные ганглии
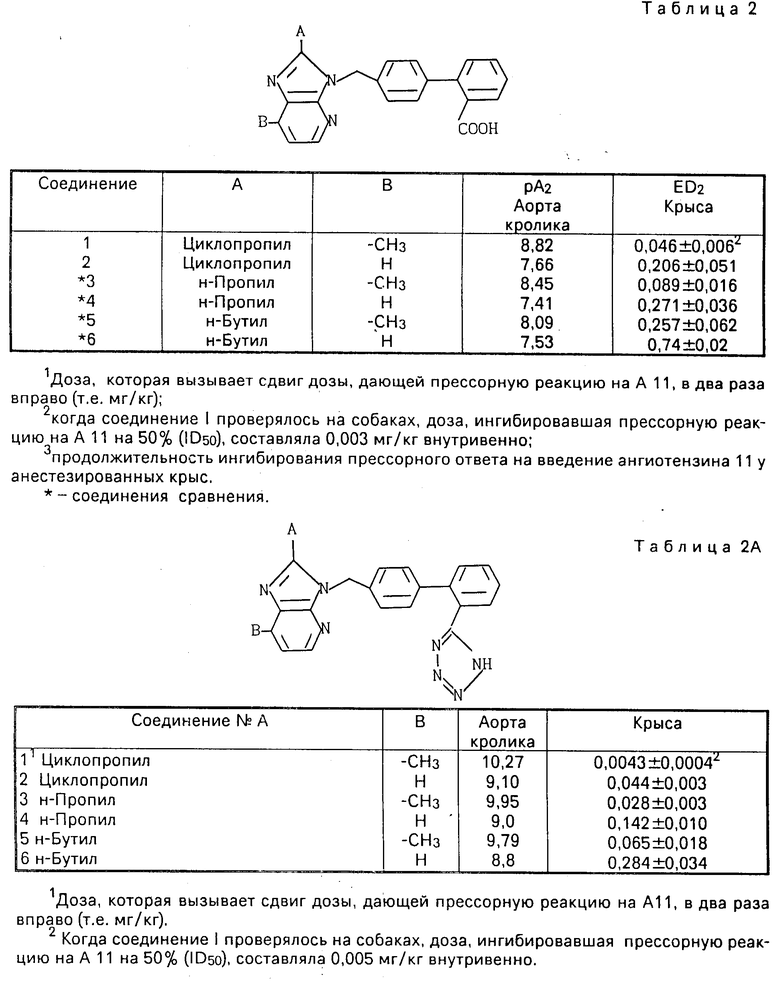
Анестезируют 9-25-недельных самцов крыс Вистар Киото (Чарльз Ривер Джапан) интраперитонеально 50 мг/кг пентобарбитала натрия и канюлируют сонную артерию и яремную вену. Канюля сонной артерии соединена с пеьзоэлектрическим преобразователем (ТР-200Т), регистрация осуществляется системой нескольких самописцев (RM-6000, производится фирмой "Нихон Коден Корп.") через усилитель (АР-601G, производится фирмой Нихон Коден Корп.") и измерительную панель среднего давления крови ("Нихон Коден Корп."), используя интеграфию колебаний пульса. Вводят внутривенно 10 мг/кг пентолиния через яремную канюлю, чтобы осуществить блокаду ганглий. После стабилизации кровяного давления аккумулятивно вводят внутривенно 0,003-0,1 или 0,3 мкг/кг ангиотензина 11 через такие интервалы времени, чтобы реакция прессора при каждой дозе практически восстановилась (2-3 мин), в результате получают кривую доза-реакция. Затем вводят внутривенно 0,1-10 мг/кг испытываемого соединения и снова вводят внутривенно 0,03-1 мкг/кг ангиотензина 11 через 3 мин после введения испытываемого соединения, чтобы определить скорость сдвига кривой доза-реакция прессора вправо: Доза (С = ЕД50мг/кг, в.в.), необходимая для связывания примерно двойного сдвига кривой доза-реакция прессора вправо, была определена из дозы антагониста (А, мг/кг, в.в.) и описанной выше скорости сдвига (В).
C =  (мг/кг, в.в.)
(мг/кг, в.в.)
Результаты приведены в табл.1.
2. Экспериментальные результаты
Результаты фармакологических экспериментов (1) и (2) на соединениях настоящего изобретения (испытываемые соединения) приведены в табл.1 и табл.2 и 2а.
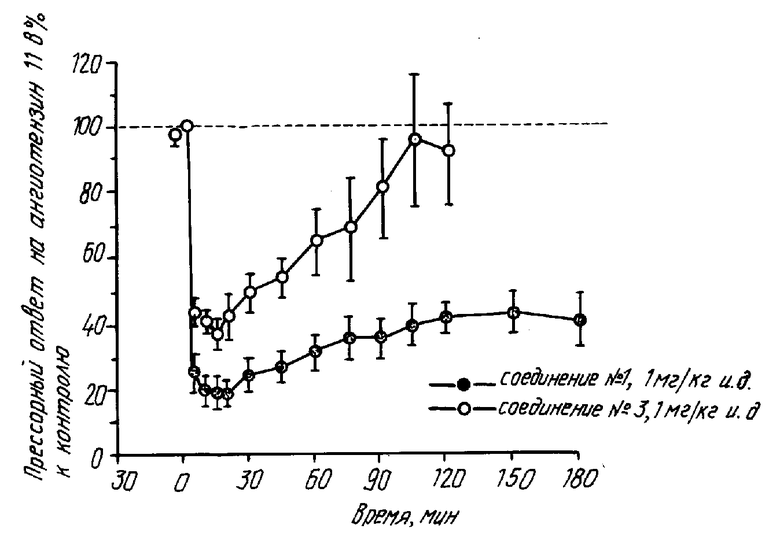
В этом эксперименте использовалась почти такая же методика, как описано в известном патенте, за исключением того, что в двенадцатиперстную кишку вводился катетер. Соединение N 1 или 3 (1 мг/кг) вводилось интрадуоденально (и.д.) и определялась продолжительность ингибирования прессорного ответа на внутривенное введение 0,1 мкг/кг ангиотензина 11. Результаты представлены на чертеже.
Соединение 1 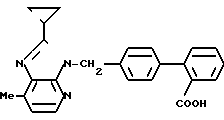
Соединение 3 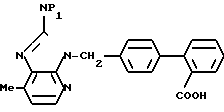
Из приведенных выше примеров фармакологических экспериментов видно, что соединения настоящего изобретения обладают отличным антагонизмом к ангиотензину 11.
Далее, соединения NN 1, 2, 5 и 6, приведенные в описанной выше табл.1, суспендируют в 0,5% МС (метилцеллюлоза) и вводят суспензию орально 8-недельным самцам крыс SD (Спраг Дайли) (4 крысы на группу) в дозе 100 мг/кг/день в течение 7 дн. Крыс наблюдали еще 24 ч после последнего введения лекарства. В результате во всех группах не наблюдалось смертности при введении описанных выше соединений (соединения NN 1, 2, 5 и 6).
Следовательно, благодаря антагонизму к ангиотензину 11 соединения настоящего изобретения являются полезными для лечения и профилактики гипертензии, полезными для лечения и профилактики сердечной недостаточности и полезными для лечения и профилактики других заболеваний, для которых полезен антагонизм ангиотензина. Кроме того, они являются полезными в качестве терапевтических и профилактических агентов для гипертензии, такой как основная, тенальная, реноваскулярная или злокачественная, и также в качестве терапевтических и профилактических агентов при сердечной недостаточности. Кроме того, как указывалось ранее, соединения настоящего изобретения обладают безопасностью, которая придает настоящему изобретению высокую ценность.
При использовании соединений настоящего изобретения в качестве лекарств они могут быть введены орально или парентерально. Доза соединения настоящего изобретения будет меняться в зависимости от симптомов, возраста, пола, массы и различия в чувствительности пациента, способа введения, времени и интервалов введения, и свойств, рецептуры и вида фармацевтических препаратов; и вида активных ингредиентов и т.п.; так что не имеется конкретного ограничения дозы.
В случае орального введения соединения настоящего изобретения обычно вводят в дозе примерно 1-1000 мг, предпочтительно 5-500 мг на взрослого пациента в день за одну-три порции. В случае инъекций доза обычно составляет примерно 1-3000 мкг/кг, предпочтительно примерно 3-1000 мкг/кг.
При приготовлении твердого препарата для орального введения активный ингредиент смешивают с носителем и, при необходимости, связующим, дезынтегратором, смазкой, красителем, корригирующим средством и т.п., затем готовят таблетки, покрытые таблетки, гранулы, порошки и капсулы по традиционной методике.
Примеры носителей включают лактозу, кукурузный крахмал, сахарозу, глюкозу, сорбит, кристаллическую целлюлозу и диоксид кремния. Примеры связующих включают поливиниловый спирт, простой поливиниловый эфир, этилцеллюлозу, метилцеллюлозу, камедь, трагакант, желатину, шеллак, оксипропилцеллюлозу, оксипропилметилцеллюлозу, цитрат кальция, декстрин и пектин. Примеры смазок включают стеарат магния, тальк, полиэтиленгликоль, оксид кремния и гидрированное растительное масло. В качестве красителя может быть использован любой краситель, добавка которого в лекарственные препараты официально разрешена. Примеры корригирующих средств включают порошок какао, ментол, ароматический порошок, мента-порошок, борнеол и порошок коры коричного дерева. Разумеется, что на эти таблетки и гранулы может быть нанесено сахарное покрытие, желатиновое покрытие и, при необходимости, другое подходящее покрытие.
При изготовлении препаратов для инъекций к активному ингредиенту добавляют модификатор рН, буферный агент, суспендирующий агент, солюбилизирующий агент, стабилизатор, тонизирующий агент консервант и т.п., следуя приготовлению внутривенных, подкожных и внутримышечных инъекций в соответствии с традиционной процедурой. В этом случае эти препараты могут быть лиофилизированы по традиционной методике.
Примеры суспендирующих агентов включают метилцеллюлозу, Полисорбат 80, оксиэтилцеллюлозу, гуммиарабик, порошкообразный трагакант, натрийкарбоксиметилцеллюлозу и полиоксиэтиленсорбитанмонолаурат.
Примеры солюбилизирующих агентов включают полиоксиэтиленгидрированное касторовое масло, Полисорбат 80, никотинамид, полиоксиэтиленсорбитанмонолаурат, Макроголь и этиловые эфиры жирных кислот касторового масла.
Примеры стабилизаторов включают сульфит натрия, метансульфит натрия и эфир, а примеры консерванта включают метил-п-оксибензоат, этил-п-оксибензоат, сорбиновую кислоту, фенол, крезол и хлоркрезол.
Ниже будут описаны типичные соединения настоящего изобретения с помощью следующих примеров. Необходимо подчеркнуть, что данное изобретение не ограничивается только ими.
Кроме примеров, будут приведены примеры приготовлений для получения исходных материалов для получения целевых соединений настоящего изобретения.
В химических структурных формулах Ме означает метильную группу, Et-этильную группу, н-Pr-н-пропил, а н-Bu-н-бутил.
П р и м е р 1. Получение 2-циклопропил-7-метил-3Н-имидазоло/4,5-b/пиридина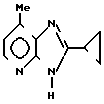
Прибавляют 30 мл циклопропанкарбоновой кислоты и 70 мл 85%-ной фосфорной кислоты к 15 г 2,3-диамино-4-метилпиридина и перемешивают смесь при внутренней температуре 130оС в течение 12 ч. Реакционную смесь охлаждают, выливают в раствор 140 г гидроксида калия в 420 мл воды, затем экстрагируют хлороформом. Экстракт сушат над безводным сульфатом магния и концентрируют. Остаток очищают хроматографией на колонке (хлороформ/этанол = =97:3). Выход составляет 14,1 г продукт; перекристаллизовывают из этилацетата-изопропилового эфира, получают целевое соединение в чистом виде, т.пл. 203-204оС.
ЯМР-спектр (90 МГц, CDCl3, величина δ: 8,16 (д, 1Н, J = 5 Гц), 7,00 (д, 1Н, J = 5 Гц), 2,68 (с, 3Н), 2,50-2,10 (м, 1Н), 1,40-1,12 (м, 4Н).
ЯМР-спектр (400 МГц, CDCl3, величина δ): 6,84 (1Н, с), 2,66 (3Н, с), 2,58 (3Н, с), 2,21-2,15 (1Н, м), 1,26-1,22 (2Н, м), 1,12-0,07 (2Н, м).
ЯМР-спектр (90 МГц, CDCl3, величина δ): 8,16 (д, 1Н, J = 5 Гц), 7,80-7,08 (м, 8Н), 7,00 (д, 1Н, J = 5 Гц), 5,52 (с, 2Н), 2,86 (т, 2Н, J = 6 Гц), 1,96-1,16 (м, 4Н), 0,92 (т, 3Н, J = 6 Гц).
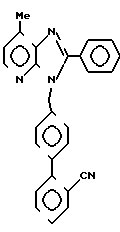
ЯМР-спектр (90 МГц, CDCl3, величина δ): 8,23 (д, 1Н, J = 5 Гц), 7,80-6,99 (м, 14Н), 5,60 (с, 2Н), 2,76 (с, 3Н).
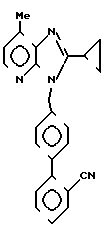
ЯМР-спектр (90 МГц, CDCl3, величина δ): 8,12 (д, 1Н, J = 5 Гц), 7,80-7,10 (м, 8Н), 6,94 (д,1Н, J = 5 Гц), 5,62 (с, 2Н), 2,64 (с, 3Н), 2,36-2,14 (м, 14Н), 1,40-0,90 (м, 4Н).
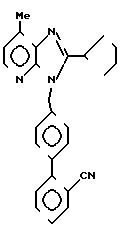
ЯМР-спектр (90 МГц, CDCl3, величина δ): 8,16 (д, 1Н, J = 5 Гц), 7,80-7,06 (м, 8Н), 6,98 (д, 1Н, J = 5 Гц), 5,56 (с, 2Н), 3,44-2,90 (м, 1Н), 2,70 (с, 3Н), 2,40-1,40 (м, 8Н).
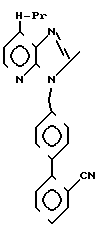
ЯМР-спектр (90 МГц, CDCl3, величина δ): 8,22 (д, 1Н, J = 5 Гц), 7,80-7,12 (м, 8Н), 7,03 (д, 1Н, J = 5 Гц), 5,54 (с, 2Н), 3,08 (т, 2Н, J = =6 Гц), 2,89 (кв, 2Н, J = 6 Гц), 2,10-1,70 (м, 2Н), 1,38 (т, 3Н, J = 6 Гц), 1,06 (т, 3Н, J = 6 Гц).
ЯМР-спектр (90 МГц, CDCl3, величина δ): 8,18 (д, 1Н, J = 5 Гц), 7,80-6,94 (м, 9Н), 5,48 (с, 2Н), 3,80-3,40 (м, 1Н), 2,74 (с, 3Н), 2,66-1,88 (м, 6Н).
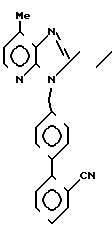
П р и м е р 2. 2-Циклопропил-3-{(2'-метоксикарбонилдифенил-4-ил) метил} 7-метил-3Н-имидазо[4,5-b]пиридин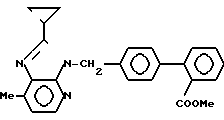
Прибавляют по каплям 1,64 г 2-циклопропил-7-метил-3Н-имидазо[4,5-b] пириди- на, растворенного в 30 мл диметилформамида, к 400 мг гидрида натрия. Смесь перемешивают 30 мин при комнатной температуре и прибавляют в смесь 3,1 г метил-2-(4-бромметилфенил)бензоата, растворенного в 20 мл диметилформамида. Смесь перемешивают 10 мин, затем охлаждают и прибавляют в смесь водный раствор хлорида аммония. Смесь экстрагируют этилацетатом. Экстракт дважды промывают водой, сушат над безводным сульфатом магния и затем концентрируют. Остаток хроматографируют на колонке (хлороформ:этанол = 99:1). Первый элюированный изомер является целевым соединением (выход, 1,32 г).
ЯМР-спектр (90 МГц, CDCl3, величина δ): 8,16 (д, 1Н, J = 5 Гц), 7,85-7,63 (м, 1Н), 7,56-7,10 (м, 1Н), 7,22 (с, 4Н), 6,98 (д, 1Н, J = 5 Гц), 5,62 (с, 2Н), 3,60 (с, 3Н), 2,64 (с, 3Н), 2,10-1,80 (м, 1Н), 1,30-0,82 (м, 4Н).
2-Оксиметил-3-[(2'-метоксикарбонилди- фенил-4-ил)метил] -7-метил-3Н- имидазо[4,5-b]пиридин.
Прибавляют медленно по каплям 50 мл (50 ммоль) дихлорметанового раствора 1М трехбромистого бора к 100 мл дихлорметанового раствора 3,3 г (8,2 ммоль) 3-[(2'-метоксикарбонилдифенил-4-ил) метил]-2-метокси-7-метил-3Н-имидазо[4,5-b] пиридина при перемешивании и охлаждении льдом. Смесь затем перемешивают 12 ч при комнатной температуре. К полученной смеси прибавляют по каплям метанол при перемешивании и охлаждении льдом, растворитель отгоняют в вакууме. Остаток смешивают с водой и нейтрализуют бикарбонатом натрия. Его слегка подкисляют уксусной кислотой и декантируют для удаления воды. К остатку прибавляют метанол и отгоняют при пониженном давлении. Остаток перекристаллизовывают из этанола-изопропилового эфира, получают 2,4 г целевого соединения.
Следующее соединение получают согласно способу, описанному выше.
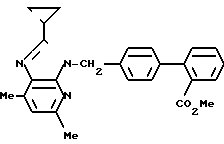
ЯМР-спектр (400 МГц, CDCl3, величина δ): 7,80 (1Н, дд, J = 8 Гц, 1Гц), 7,50 (1Н, тд, J = 8 Гц, 1 Гц), 7,39 (1Н, тд, J = 8 Гц, 1 Гц), 7,31 (1Н, дд, J = 8 Гц, 1 Гц), 7,24 (2Н, д, J = 8 Гц), 7,21 (2Н, д, J = 8 Гц), 6,87 (1Н, с), 5,60 (2Н, с), 3,60 (3Н, с), 2,58 (6Н, с), 1,94-1,87 (1Н, м), 1,19-1,15 (2Н, м), 1,02-0,97 (2Н, м).
П р и м е р 5. 3-{(2'-Карбоксидифенил-4-ил)метил}-2-циклопропил-7-метил-3-имида- зо [4,5-b]пиридин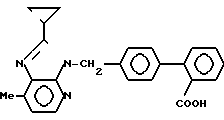
Прибавляют 40 мл этанола и 20 мл 10%-ного водного раствора гидроксида натрия к 1,32 г 2-циклопропил-3-{2'-метоксикарбонилбифенил-4-ил/метил}-7-метил-3Н- имидазо[4,5-b]пиридина и смесь кипятят с обратным холодильником в течение 2 ч. Реакционную смесь концентрируют до 30 мл, охлаждают и нейтрализуют 2н. соляной кислоты и уксусной кислотой, отфильтровывают выпавшие кристаллы и перекристаллизовывают из водного раствора этанола. Выход составляет 1,03 г.
Т.пл. 221-224оС.
ЯМР-спектр (90 МГц, ДМСО-d6, величина δ): 8,12 (д, 1Н, J = 5 Гц), 7,75-7,20 (м, 4Н), 7,26 (с, 4Н), 7,04 (д, 1Н, J = 5 Гц), 5,63 (с, 2Н), 2,50 (с, 3Н), 2,50-2,05 (м, 1Н), 1,24-0,90 (м, 4Н).
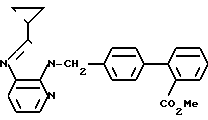
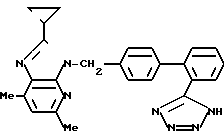
ЯМР-спектр (400 МГц, ДМСО-d6, величина δ): 7,67 (1Н, тд, J = 8 Гц, 1 Гц), 7,65 (1Н, д, J = 8 Гц), 7,57 (1Н, тд, J = 8 Гц, 1 Гц), 7,52 (1Н, д, J = 8 Гц), 7,12 (2Н, д, J = 8 Гц), 7,05 (2Н, д, J = 8 Гц), 6,92 (1Н, с), 5,54 (2Н, с), 2,49 (3Н, с), 2,44 (3Н, с), 2,17-2,11 (1Н, м), 0,99-0,95 (4Н, м).
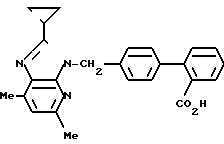
ЯМР-спектр, δ: 8,33 (дд, 1Н, J = 1 Гц, 5 Гц), 7,95 (дд, 1Н, J = 1 Гц, 8 Гц), 7,82 (дд, 1Н, J = 1 Гц, 8 Гц), 7,52 (тд, 1Н, J = 8 Гц, 1 Гц), 7,41 (тд, 1Н, J = 8 Гц, 1 Гц), 7,33 (дд, 1Н, J = 1 Гц, 8 Гц), 7,27 (с, 4Н), 7,21 (дд, 1Н, J = 5 Гц, 8 Гц), 5,67 (с, 2Н), 3,63 (с, 3Н), 2,06-1,96 (м, 1Н), 1,28-1,21 (м, 2Н), 1,11-1,04 (м, 2Н).
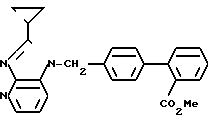
ЯМР-спектр (400 МГц, CDCl3, величина δ): 8,46 (дд, 1Н, J = 1 Гц, 5 Гц), 7,84 (дд, 1Н, J = 1 Гц, 8 Гц), 7,55-7,49 (м, 2Н), 7,41 (тд, 1Н, J = 8 Гц, 1 Гц), 7,31 (дд, 1Н, J = 1 Гц, 8 Гц), 7,28 (д, 2Н, J = 8 Гц), 7,15 (д, 2Н, J = 8 Гц), 7,09 (дд, 1Н, J = 5 Гц, 8 Гц), 5,51 (с, 2Н), 3,64 (с, 3Н), 2,07-1,95 (м, 2Н), 1,43-1,35 (м, 2Н), 1,16-1,08 (м, 2Н).
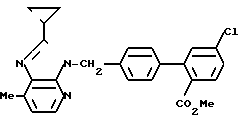
ЯМР-спектр (400 МГц, CDCl3, величина δ): 8,19 (д, 1Н, J = 5 Гц), 7,70 (д, 1Н, J = 8 Гц), 7,37 (дд, 1Н, J = 2 Гц, 8 Гц), 7,31 (д, 1Н, J = =2 Гц), 7,25-7,20 (м, 4Н), 7,01 (д, 1Н, J = 5 Гц), 5,63 (с, 2Н), 3,61 (с, 3Н), 2,65 (с, 3Н), 2,00-1,92 (м, 1Н), 1,24-1,17 (м, 2Н), 1,08-1,00 (м, 2Н).
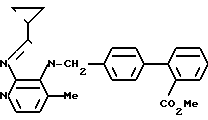
ЯМР-спектр (400 МГц, CDCl3, величина δ): 8,30 (д, 1Н, J = 5 Гц), 7,83 (дд, 1Н, J = 1 Гц, 8 Гц), 7,52 (тд, 1Н, J = 8 Гц, 1Гц), 7,41 (тд, 1Н, J = 8 Гц, 1 Гц), 7,32 (дд, 1Н, J = 1 Гц, 8 Гц), 7,27 (дд, 2Н, J = 8 Гц), 7,02 (д, 2Н, J = 8 Гц), 6,83 (д, 1Н, J = 5 Гц), 5,71 (с, 2Н), 3,63 (с, 2Н), 2,48 (с, 3Н), 1,98-1,89 (м, 1Н), 1,39-1,32 (м, 2Н), 1,11-1,03 (м, 2Н).
Т.пл. 235-238оС.
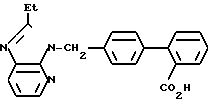
ЯМР-спектр (400 МГц, ДМСО-d6, величина δ): 8,32 (дд, 1Н, J = 1 Гц, 8 Гц), 8,20 (дд, 1Н, J = 1 Гц, 8 Гц), 7,70 (дд, 1Н, J = 1 Гц, 8 Гц), 7,54 (тд, 1Н, J = 8 Гц, 1 Гц), 7,44 (тд, 1Н, J = 8 Гц, 1Гц), 7,34 (дд, 1Н, J = 1 Гц, 8 Гц), 7,30-7,24 (м, 3Н), 7,20 (д, 2Н), 5,56 (с, 2Н), 2,89 (кв, 2Н, J = 8 Гц), 1,29 (т, 3Н, J = 8 Гц).
Т.пл. 246,5-248,5оС.
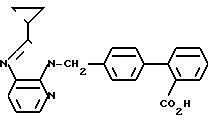
ЯМР-спектр (400 МГц, ДМСО-d6, величина δ): 8,27 (дд, 1Н, J = 1 Гц, 5 Гц), 7,92 (дд, 1Н, J = 1 Гц, 8 Гц), 7,71 (дд, 1Н, J = 1 Гц, 8 Гц), 7,54 (тд, 1Н, J = 8 Гц, 1 Гц), 7,49 (тд, 1Н, J = =8 Гц, 1Гц), 7,34 (дд, 1Н, J = 1 Гц, 8 Гц), 7,29 (с, 4Н), 7,23 (дд, 1Н, J = 5 Гц, 8 Гц), 5,67 (с, 2Н), 2,37-2,19 (м, 1Н), 1,13-1,02 (м, 4Н).
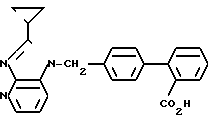
Т.пл. 227-229оС.
ЯМР-спектр (400 МГц, ДМСО-d6, величина δ): 8,31 (дд, 1Н, J = 1 Гц, 5 Гц), 7,94 (дд, 1Н, J = 1 Гц, 8 Гц), 7,71 (дд, 1Н, J = 1 Гц, 8 Гц), 7,54 (тд, 1Н, J = 8 Гц, 1 Гц), 7,43 (тд, 1Н, J = =8 Гц, 1 Гц), 7,34 (дд, 1Н, J = 1 Гц, 8 Гц), 7,31 (д, 2Н, J = 8 Гц), 7,24 (д, 2Н, J = 8 Гц), 7,17 (дд, 1Н, J = 5 Гц, 8 Гц), 5,69 (с, 2Н), 2,41-2,33 (м, 1Н), 1,19-1,06 (м, 4Н).
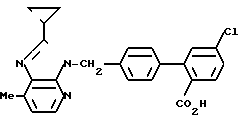
Т.пл. 256-259оС.
ЯМР-спектр (400 МГц, ДМСО-d6, величина δ): 8,13 (д, 1Н, J = 5 Гц), 7,74 (д, 1Н, J = =8 Гц), 7,51 (дд, 1Н, J = 2 Гц, 8 Гц), 7,40 (д, 1Н, J = 2 Гц), 7,31 (д, 2Н, J = 8 Гц), 7,27 (д, 2Н, J = 8 Гц), 7,05 (д, 1Н, J = 5 Гц), 5,65 (с, 2Н).
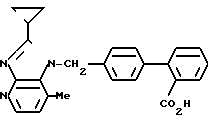
ЯМР-спектр (400 МГц, ДМСО-d6, величина δ): 8,16 (д, 1Н, J = 5 Гц), 7,70 (д, 1Н, J = =8 Гц), 7,54 (т, 2Н, J = 8 Гц), 7,43 (т, 1Н, J = 8 Гц), 7,35 (д, 1Н, J = 8 Гц), 7,32 (д, 2Н, J = 8 Гц), 7,02 (д, 2Н, J = 8 Гц), 6,90 (д, 1Н, J = 5 Гц), 5,83 (с, 2Н), 2,44 (с, 2Н), 2,31-2,23 (м, 1Н), 1,15-1,02 (м, 4Н).
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ПРОИЗВОДНЫЕ 2,4-ДИОКСОПИРРОЛИДИНА И 2,4-ДИОКСОТЕТРАГИДРОФУРАНА И ЛЕКАРСТВЕННЫЕ СРЕДСТВА, СОДЕРЖАЩИЕ ИХ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 1997 |
|
RU2179976C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПИРАЗОЛПИРИДИНОВОГО ПРОИЗВОДНОГО ИЛИ ЕГО СОЛИ | 1990 |
|
RU2007403C1 |
| ПРОИЗВОДНЫЕ БУТЕНОВОЙ ИЛИ ПРОПЕНОВОЙ КИСЛОТЫ | 1992 |
|
RU2041871C1 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛО [1,5-А] ПИРИДИНА, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2069662C1 |
| ПРОИЗВОДНОЕ АМИНОБЕНЗОЙНОЙ КИСЛОТЫ ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ | 1993 |
|
RU2067979C1 |
| ПРОИЗВОДНЫЕ ПИРИДИНА | 1992 |
|
RU2035461C1 |
| СОЕДИНЕНИЯ N, N-ЗАМЕЩЕННОГО ЦИКЛИЧЕСКОГО АМИНА | 1999 |
|
RU2232156C2 |
| ПИПЕРИДИНОВОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ НАТРИЕВЫХ КАНАЛОВ И КАЛИЕВЫХ КАНАЛОВ | 2001 |
|
RU2259365C2 |
| ПРОИЗВОДНЫЕ ГЛИЦЕРИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1989 |
|
RU2040521C1 |
| СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ПРЕДОТВРАЩЕНИЯ ГИБЕЛИ НЕРВНЫХ КЛЕТОК, СПОСОБ ПРОФИЛАКТИКИ | 2001 |
|
RU2230060C2 |
Используется в медицине, так как продукт обладает фармакологической активностью (гипертензивная активность). Сущность: новые производные дифенилметилимидазола общей формулы 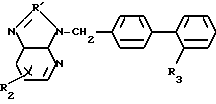 , где R1 - циклоалкил, R2 C1-C6 -алкил, R3 -COOH или
, где R1 - циклоалкил, R2 C1-C6 -алкил, R3 -COOH или  , или их фармацевтически приемлемые соли. 2 табл. 1 рис.
, или их фармацевтически приемлемые соли. 2 табл. 1 рис.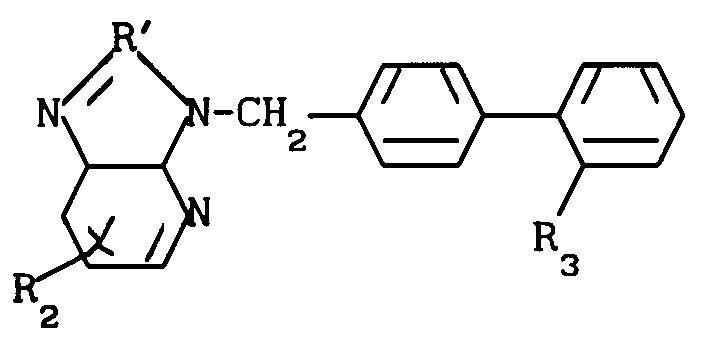
Производные дифенилметилимидазола общей формулы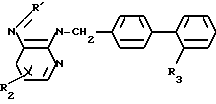
где R1 - циклоалкил;
R2 - C1-C6-алкил;
R3 - COOH или 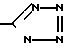
или их фармацевтически приемлемые соли.
Приоритет по признакам:
29.09.89 при
R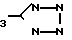
27.12.89 при R3 - COOH.
| СПОСОБ СУШКИ СУЛЬФАТА АММОНИЯ | 0 |
|
SU240683A1 |
Авторы
Даты
1994-12-15—Публикация
1990-09-28—Подача