Область техники
Настоящее изобретение относится к новому соединению, полезному в качестве антагониста кальция, к его соли и гидрату, а также к способу получения указанного соединения и фармацевтической композиции, содержащей указанное вещество; в особенности, данное изобретение относится к новому соединению, которое является нейронизбирательным антагонистом кальция, в частности новое соединение обладает ингибирующей активностью в отношении кальциевого канала P/Q-типа и/или N-типа и т.д.
Предпосылки изобретения
Кровоизлияние в мозг ежегодно диагностируется в Японии у 1,4 миллиона или более человек, и по оценкам затраты на лечение данного заболевания составляют примерно два миллиарда йен. Смертность от кровоизлияния в мозг занимает второе место после онкологических заболеваний, и к тому же кровоизлияние в мозг является главной причиной того, что люди (пациенты) оказываются прикованными к постели, страдая от серьезных вторичных заболеваний. Отличительной особенностью лечения кровоизлияния в мозг является необходимость быстрого реагирования на острой стадии заболевания, причем от эффективности лечения на данной стадии зависит сохранение жизни и жизненных функций пациента, а также предупреждение возникновения вторичных заболеваний.
В качестве лекарственных средств для улучшения кровотока рекомендовано несколько препаратов, таких как озагрел-натрий (ингибитор тромбоксан-синтазы), аргатробан (антитромбин), используемый в качестве средства для лечения хронической окклюзии артерий, t-PA (алтеплаза: активатор тканевого плазминогена, который необходимо вводить в первые 3 часа после кровоизлияния), являющийся тромболитическим средством, и другие. Однако современные методы лечения, описанные в публикациях (1)-(6), являются весьма сложными и зависят от субъективной оценки специалиста на основании его знаний и опыта. А именно, в случае инфаркта головного мозга вследствие образования тромба необходимо сначала проверить функцию дыхательных органов, измерить кровяное давление и произвести переливание крови (1). Необходимо периодически измерять содержание газа в крови и кровяное давление (2). На острой стадии заболевания имеет место высокое кровяное давление, но при отсутствии осложнений на сердце и почки лечение, направленное на снижение кровяного давления, не проводят (3). Затем в случае, если в компьютерной томографии не наблюдается диапазон слабого поглощения в начале острой стадии заболевания, следует использовать тромболитическое средство "урокиназу" (4). В случае противопоказания к применению указанных средств или по истечении 24 часов после кровоизлияния, нуждающемуся субъекту вводят "озагрел-натрий" или "аргатробан". Однако аргатробан противопоказан в случае инфаркта лакуны (5). Для предотвращения развития отека мозга необходимо ввести требуемую дозу "глицерина" или "маннита" (6).
Кроме того, лечебное действие до сих пор использовавшихся лекарственных средств является неудовлетворительным, при этом часто существует опасность усиления кровотечения вследствие фармакологического действия таких средств. Поэтому правильно применять указанные средства могут только высококвалифицированные врачи-специалисты.
С другой стороны, в научной литературе имеются сведения о том, что соединения, обладающие ингибирующим действием в отношении кальциевых каналов М-типа или P/Q-типа, можно использовать в качестве средства, препятствующего гибели нервных клеток или защищающего нервные клетки головного мозга, средства для лечения или подавления симптомов (улучшения состояния) в случае нервных заболеваний, острого ишемического инсульта, травмы головы, болезни Альцгеймера, метаболического расстройства кровообращения головного мозга, нарушения функции головного мозга или болевого синдрома, в качестве антиспазматического средства, средства для лечения или подавления симптомов при шизофрении, средства для профилактики, лечения или подавления состояния в случае мигрени, эпилепсии, маниакально-депрессивного психоза, нервных дегенеративных заболеваний (болезнь Паркинсона, болезнь Альцгеймера, боковой амиотрофический склероз, болезнь Хантингтона), ишемии головного мозга, эпилепсии, травмы головы, слабоумия, вызванного СПИДом, отека мозга, состояния страха (генерализованное состояние страха) и диабетической невропатии, а также средства для профилактики, лечения или подавления симптомов отека мозга, состояния страха, шизофрении, диабетической невропатии и мигрени.
(1) Острый ишемический инсульт: Annj. Rev. Physiol., 52, 543-559, 1990.
(2) Травма головы: SCRIP, №2203, 24, 1997.
(3) Ишемия - гибель нервных клеток головного мозга: Advances in Pharmacology, 22, 271-297, 1991.
(4) Болезнь Альцгеймера: Trends in Neuroscience, 16, 409, 1993.
(5) Метаболическое расстройство кровообращения головного мозга: Nichiyakurishi, 85, 323-328, 1985.
(6) Нарушение функции головного мозга: Acta Neurol. Scand., 78:2, 14-200, 1998.
(7) Аналгетик: Drug of the Future, 23(2), 152-160, 1998.
(8) Ишемия головного мозга, мигрень, эпилепсия, маниакально-депрессивный психоз: Casopis Lekau Ceskych., 130 (22-23), 625-630, 1991.
(9) Нервные дегенеративные заболевания (болезнь Паркинсона, болезнь Альцгеймера, боковой амиотрофический склероз, болезнь Хантингтона), ишемия головного мозга, эпилепсия, травма головы и слабоумие, вызванное СПИДом: Revista de Neurologia, 24 (134), 1199-1209, 1996.
(10) Отек мозга: Brain Research, 776, 140-145, 1997.
(11) Состояние страха (генерализованное состояние страха), шизофрения: Jyunkanseigyo (Circulation Control), 14 (2), 139-145, 1993.
(12) Диабетическая невропатия: Shinkeinaika (Neurological Medicine), 50, 423-428, 1999.
(13) Мигрень: Neurology, 50 (4), 1105-1110, 1998.
Описание изобретения
С учетом вышеизложенного авторы настоящего изобретения всесторонне исследовали возможность создания препарата, который обладает превосходным эффектом в лечении и уменьшении интенсивности симптомов острого ишемического инсульта головного мозга, для которого не известен подходящий препарат, и который является безопасным, так как не вызывает кровоизлияния, целенаправленно воздействуя на нейроночувствительный антагонист потенциалзависимого кальциевого канала, воздействующий непосредственно на нервные клетки, и препятствует дальнейшему развитию инфаркта. В результате выполненных исследований авторы настоящего изобретения синтезировали новое азотсодержащее соединение формулы (I), его соль и гидрат и затем неожиданно установили, что данные соединения, их соли или гидраты эффективно препятствуют гибели нервных клеток и защищают нервные клетки головного мозга благодаря антагонизму в отношении кальциевого канала P/Q-типа или N-типа, при этом они в значительно меньшей степени вызывают инфаркт клеток, характеризуются более низкой токсичностью и являются превосходными по безопасности в сравнении с известными анатагонистами кальция.
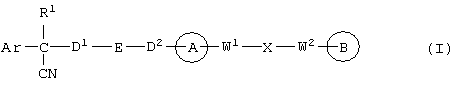
В указанной формуле Аr означает (1) C6-14 ароматическую углеводородную циклическую группу, которая может быть замещена, (2) 5-14-членную ароматическую гетероциклическую группу, которая может быть замещена, (3) C1-6 алкильную группу, замещенную C6-14 ароматической углеводородной циклической группой, которая может быть замещена, или (4) C1-6 алкильную группу, замещенную 5-14-членной ароматической гетероциклической группой, которая может быть замещена; кольцо А означает пиперазиновое кольцо, гомопиперазиновое кольцо, пиперидиновое кольцо, гомопиперидиновое кольцо, пирролидиновое кольцо или диазабицикло[2,2,1]гептановое кольцо, которое может быть соответственно замещено; кольцо В означает (1) С3-14 углеводородное кольцо, которое может быть замещено, или (2) 5-14-членное гетероциклическое кольцо, которое может быть замещено; Е означает (1) простую связь, группу формулы (2) -СО- или (3) -СН(ОН)-; Х означает (1) прямую связь, (2) атом кислорода, (3) атом серы, (4) C1-6 алкиленовую цепь, которая может быть замещена, группу формулы (5) -NR2- (где R2 означает атом водорода или C1-6 алкильную группу, С3-8 циклоалкильную группу, низшую ацильную группу или C1-6 алкилсульфонильную группу, которая может быть замещена), (6) -СО-, (7) -COO-, (8) -ООС-, (9) -CONR3- (где R3 означает атом водорода или C1-6 алкильную группу, которая может быть замещена), (10) -NR4CO- (где R4 означает атом водорода или C1-6 алкильную группу, которая может быть замещена), (11) -SO-, (12) -SO2-, (13) -SONR5- (где R5 означает атом водорода или C1-6 алкильную группу, которая может быть замещена), (14) -NR6SO- (где R6 означает атом водорода или C1-6 алкильную группу, которая может быть замещена), (15) -SO2NR7- (где R7 означает атом водорода или C1-6 алкильную группу, которая может быть замещена), (16) -NR8SO2- (где R8 означает атом водорода или C1-6 алкильную группу, которая может быть замещена), (17) >C=N-OR9 (где R9 означает атом водорода или C1-6 алкильную группу, которая может быть замещена), (18) -NR10W3-O- (где R10 означает атом водорода или C1-6 алкильную группу, С3-8 циклоалкильную группу, низшую ацильную группу или C1-6 алкилсульфонильную группу, которая может быть замещена, и W3 означает C1-6 алкиленовую группу, которая может быть замещена), (19) -NH-CO-NH-, (20) -NH-CS-NH-, (21) -C(=NR15)NR16- (где R15 и R16 имеют одинаковые или разные значения и представляют атом водорода, нитрильную группу, C1-6 алкильную группу, С2-6 алкенильную группу, С3-8 циклоалкильную группу или С3-8 циклоалкенильную группу), (22) -NHC(=NH)-, (23) -O-CO-S-, (24) -S-CO-O-, (25) -ОСОО-, (26) -NHCOO-, (27) -OCONH-, (28) -CO(CH2)mO- (где m означает 0 или целое число от 1 до 6), (29) -СНОН- или (30) -СНОН(СН2)nО- (где n означает 0 или целое число от 1 до 6); R1 означает (1) атом водорода, (2) атом галогена, (3) гидроксильную группу, (4) C1-6 алкильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы, (5) С2-6 алкенильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы, (6) C2-6 алкинильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы, (7) С3-8 циклоалкильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы, (9) C1-6 алкокси-С1-6 алкильную группу, (10) амино-C1-6 алкильную группу, в которой атом азота может быть замещен, (11) группу формулы -N(R11)R12- (где R11 и R12 имеют одинаковые или разные значения и представляют атом водорода или C1-6 алкильную группу), (12) аралкильную группу, (13) морфолинильную группу, (14) тиоморфолинильную группу, (15) пиперидильную группу, (16) пирролидинильную группу или (17) пиперазинильную группу; и D1, D2, W1 и W2 имеют одинаковые или разные значения и представляют (1) простую связь или (2) C1-6 алкиленовую цепь, которая может быть замещена; при условии, что из приведенного выше определения исключены 1-[4-циано-5-метил-4-(2-циано-5-тиенил)гексил]-4-[2-(4-фторфенокси)этил]пиперазин; 1-[4-циано-5-метил-4-(2-циано-5-тиенил)гексил]-4-[2-(3-фторфенокси)этил]пиперазин и 1-[4-циано-5-метил-4-(2-тиенил)гексил]-4-[2-(3-фторфенокси)этил]пиперазин.
Первым объектом настоящего изобретения является 1) соединение вышеуказанной формулы (I), его соль или гидрат, где 2) Аr может означать С6-14 ароматическое углеводородное кольцо или 5-14-членное ароматическое гетероциклическое кольцо, которое может быть замещено, 3) Аr может означать тиофеновое кольцо или бензольное кольцо, которое может быть замещено, 4) Аr может означать С6-14 ароматическое углеводородное кольцо или 5-14-членное ароматическое гетероциклическое кольцо, которое может быть замещено одной или несколькими группами, выбираемыми из нитрильной группы и атома галогена, 5) Аr может означать тиофеновое кольцо или бензольное кольцо, которое может быть замещено одной или несколькими группами, выбираемыми из нитрильной группы и атома галогена соответственно, 6) кольцо А может быть пиперазиновым кольцом, гомопиперазиновым кольцом или пиперидиновым кольцом, 7) кольцо А может быть пиперазиновым кольцом, 8) кольцо А может быть пиперазиновым кольцом, гомопиперазиновым кольцом или пиперидиновым кольцом, которое может быть замещено одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена, цианогруппы, C1-6 алкильной группы, которая может быть замещена, C2-6 алкенильной группы, которая может быть замещена, С2-6 алкинильной группы, которая может быть замещена, C1-6 алкоксильной группы, которая может быть замещена, С2-6 алкенилоксигруппы, которая может быть замещена, C1-6 алкилкарбонильной группы, которая может быть замещена, С2-6 алкенилкарбонильной группы, которая может быть замещена, C1-6 алкоксикарбонильной группы, которая может быть замещена, и C2-6 алкенилоксикарбонильной группы, которая может быть замещена, 9) кольцо В может означать С6-14 ароматическое углеводородное кольцо или 5-14-членное ароматическое гетероциклическое кольцо, которое может быть замещено, 10) кольцо В может означать бензол, тиофен, пиридин, 1,4-бензодиоксан, индол, бензотиазол, бензоксазол, бензимидазол, 2-кето-1-бензимидазол, тиазол, оксазол, изоксазол, 1,2,4-оксадиазол, инданон, бензофуран, хинолин, 1,2,3,4-тетрагидрохинолин, нафталин или 1,2,3,4-тетрагидронафталин, который может быть замещен, 11) кольцо В может означать С6-14 ароматическое углеводородное кольцо или 5-14-членное ароматическое гетероциклическое кольцо, которое может быть замещено одной или несколькими группами, выбираемыми соответственно из атома галогена, нитрильной группы, C1-6 алкильной группы, низшей ацильной группы, C1-6 алкилсульфонильной группы и аралкильной группы, 12) D1 и D имеют одинаковые или разные значения и могут означать (1) простую связь или (2) C1-6 алкиленовую цепь, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена, нитрильной группы, C1-6 алкильной группы, С2-6 алкенильной группы и C1-6 алкоксильной группы, 13) Е может означать простую связь, 14) D1 и D2 могут означать C1-6 алкиленовую цепь и Е может означать простую связь, 15) частичная структура -D1-E-D2- может означать C1-4 алкиленовую группу, 16) W1 и W2 могут иметь одинаковые или разные значения и представлять (1) простую связь или (2) C1-6 алкиленовую цепь, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена, нитрильной группы, C1-6 алкилоксигруппы и С2-6 алкенилоксигруппы, 17) W1 может означать (1) простую связь или (2) C1-6 алкиленовую цепь, которая может быть замещена одной или несколькими группами, выбираемыми из (i) нитрильной группы, (ii) C1-6 алкильной группы, которая может быть замещена одной или несколькими группами, выбираемыми из C1-6 алкоксильной группы и С2-6 алкенилоксигруппы, и (iii) С2-6 алкенильной группы; и W2 может означать простую связь, 18) W1 и W2 могут иметь одинаковые или разные значения, и каждый из них представляет C1-6 алкиленовую цепь, замещенную одной или несколькими группами, выбираемыми из C1-6 алкильной группы и С2-6 алкенильной группы, кроме того, вышеуказанные C1-6 алкильная группа и/или С2-6 алкенильная группа могут быть связаны друг с другом с образованием кольца либо C1-6 алкильная группа или С2-6 алкенильная группа может быть связана с кольцом В или Х с образованием кольца, 19) Х может означать (1) простую связь, (2) атом кислорода, группу формулы (3) -NR2- (где R2 означает атом водорода, C1-6 алкильную группу, С3-8 циклоалкильную группу, низшую ацильную группу или C1-6 алкилсульфонильную группу, которая может быть замещена), (4) -NR10-W3-O- (где R10 означает атом водорода, C1-6 алкильную группу, С3-8 циклоалкильную группу, низшую ацильную группу или C1-6 алкилсульфонильную группу, которая может быть замещена; и W3 означает C1-6 алкиленовую группу, которая может быть замещена) или (5) -NH-SO2-, 20) X может означать (1) атом кислорода, группу формулы (2) -NR2- (где R2 означает атом водорода, C1-6 алкильную группу, С3-8 циклоалкильную группу, низшую ацильную группу или C1-6 алкилсульфонильную группу, которая может быть замещена) или (3) -NH-SO2-, 21) частичная структура -W1-X-W2- может означать C1-6 алкиленовую группу, которая может быть замещена, 22) W1 означает C1-6 алкиленовую цепь, которая может быть замещена; W2 означает простую связь; и Х означает кислород или группу формулы -NR2- (где R2 имеет указанные выше значения), 23) W1 может быть замещен одной любой или несколькими любыми группами, выбираемыми из (1) нитрильной группы, (2) C1-6 алкильной группы, которая может быть замещена C1-6 алкилоксигруппой или С2-6 алкенилоксигруппой, и (3) C2-6 алкенильной группы; и R2 может означать C1-6 алкильную группу, которая может быть замещена, 24) R1 может означать C1-6 алкильную группу, 25) R1 может означать метильную группу, этильную группу, н-пропильную группу или изопропильную группу, 26) соединение вышеуказанной формулы 1) является соединением формулы:
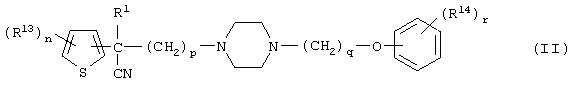
где R1 имеет указанные выше значения; R13 и R14 имеют одинаковые или разные значения и представляют (1) атом водорода, (2) атом галогена, (3) гидроксильную группу, (4) меркаптогруппу, 5) C1-6 алкильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы и атома галогена, (6) C1-6 алкоксильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и C1-6 алкоксикарбонильной группы, (7) нитрогруппу, (8) аминогруппу, которая может быть замещена, (9) цианогруппу, (10) карбоксильную группу, (11) C1-6 алкоксикарбонильную группу, (12) C1-6 тиоалкоксильную группу, (13) C1-6 алкилсульфонильную группу, (14) низшую ацильную группу, (15) С6-14 ароматическую углеводородную циклическую группу, которая может быть замещена, (16) 5-14-членную ароматическую гетероциклическую группу, которая может быть необязательно замещена, (17) арилоксигруппу или (18) аралкилоксигруппу либо (19) сами элементы R13 или R14 могут быть связаны друг с другом с образованием (i) алифатического кольца, которое может быть замещено, (ii) гетероциклического кольца, которое может быть замещено, или (iii) алкилендиоксигруппы; n означает 0 или целое число от 1 до 3; р означает целое число от 1 до 6; q означает целое число от 1 до 6 и r означает 0 или целое число от 1 до 5; при условии, что из приведенного выше определения исключены 1-[4-циано-5-метил-4-(2-циано-5-тиенил)гексил]-4-[2-(4-фторфенокси)этил]пиперазин; 1-[4-циано-5-метил-4-(2-циано-5-тиенил)гексил]-4-[2-(3-фторфенокси)этил]пиперазин и 1-[4-циано-5-метил-4-(2-тиенил)гексил]-4-[2-(3-фторфенокси)этил]пиперазин; 27) соединение вышеуказанной формулы 1) является соединением формулы:
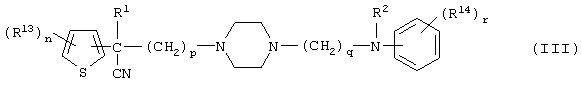
где R1 и R2 имеют указанные выше значения; R13 и R14 имеют одинаковые или разные значения и представляют (1) атом водорода, (2) атом галогена, (3) гидроксильную группу, (4) меркаптогруппу, (5) C1-6 алкильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы и атома галогена, (6) C1-6 алкоксильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и C1-6 алкоксикарбонильной группы, (7) нитрогруппу, (8) аминогруппу, которая может быть замещена, (9) цианогруппу, (10) карбоксильную группу, (11) C1-6 алкоксикарбонильную группу, (12) C1-6 тиоалкоксильную группу, (13) C1-6 алкилсульфонильную группу, (14) низшую ацильную группу, (15) С6-14 ароматическую углеводородную циклическую группу, которая может быть замещена, (16) 5-14-членную ароматическую гетероциклическую группу, которая может быть замещена, (17) арилоксигруппу, (18) аралкилоксигруппу или (19) сами элементы R13 или R14 могут быть связаны друг с другом с образованием (i) алифатического кольца, которое может быть замещено, (ii) гетероциклического кольца, которое может быть замещено, или (iii) алкилендиоксигруппы; n означает 0 или целое число от 1 до 3; р означает целое число от 1 до 6; q означает целое число от 1 до 6; r означает 0 или целое число от 1 до 5, и 28) соединение вышеуказанной формулы 1) является любым соединением, выбираемым из группы, включающей
4-[(4-циано-5-метил-4-фенил)гексил]-N-(4-фторфенил)-N’-(2-метилпропил)-1(2Н)-пиразинкарбоксиимидамид;
1-изопропил-4-[4-(1-изобутил-1H-бензо[d]имидaзoл-2-ил)пиперазино]-1-фенилбутилцианид;
1-[4-циано-5-метил-4-(5-циано-2-тиенил)гексил]-4-[2-(3-цианофенокси)этил]пиперазин;
1-[4-циано-5-метил-4-(2-тиенил)гексил]-4-[2-(3-цианофенокси)этил]пиперазин;
1-[4-циано-5-метил-4-(5-циано-2-тиенил)гексил]-4-[3-(5-циано-2-тиенил)пропил]пиперазин;
1-[4-циано-5-метил-4-(3-тиенил)гексил]-4-[2-(3-цианофенокси)этил]пиперазин;
1-{4-циано-5-метил-4-[4-(2-циано)тиенил]гексил}-4-[2-(3-цианофенокси)этил]пиперазин;
1-[(4-циано-5-метил-4-фенил)гексил]-4-[(2-бензоксазолил)амино]пиперидин;
1-[4-циано-4-(5-циано-2-тиенил)-5-метилгексил]-(3S)-3-[N-(2-цианоэтил)-N-бензиламино]пирролидин;
1-[4-циано-4-(5-циано-2-тиенил)-5-метилгексил]-(3R)-3-[N-(2-цианоэтил)-N-бензиламино]пирролидин;
1-[(4-циано-5-метил-4-фенил)гексил]-4-(бензотиазолил]пиперазин;
1-[(4-циано-5-метил-4-фенил)гексил]-4-[2-(6-метокси)бензотиазолил]пиперазин;
1-[(4-циано-5-метил-4-фенил)гексил]-4-(2-бензоксазолил)пиперазин;
1-[(4-циано-5-метил-4-фенил)гексил]-4-(2-хинолинил)пиперазин;
4-[4-(1-метил-1Н-бензо[d]имидазол-2-ил)-1,4-диазепан-1-ил]-1-изопропил-1-фенилбутилцианид;
4-[4-(1-этил-1Н-бензо[d]имидазол-2-ил)-1,4-диазепан-1-ил]-1-изопропил-1-фенилбутилцианид;
этил-4-(4-циано-5-метил-4-фенилгексил)-1-[2-(4-фторфенокси)этил]-2-пиперазинкарбоксилат;
1-[(2-оксо-1,2-дигидро-3-хинолил)метил]-4-[(4-циано-5-метил-4-фенил)гексил]пиперидин;
4-[(4-циано-5-метил-4-фенил)гексил]-1-{[2-(метансульфониламино)фенил]метил}пиперазин;
4-[(4-циано-5-метил-4-фенил)гексил]-1-{[2-(метансульфониламино)фенил]метил}пиперидин;
{1-[4-циано-5-метил-5-(2-тионил)гексил]пиперазинил}амид (S)-3-фенил-2-аминопропановой кислоты;
4-[4-(4-фенилпиперидинил)пиперидинил]-1-изопропил-1-фенилбутилцианид;
4-[4-(4-циано-4-фенилпиперидинил)пиперидинил]-1-изопропил-1-фенилбутилцианид и
4-[4-(4-бензилпиперидинил)пиперидинил]-1-изопропил-1-фенилбутилцианид.
Вторым объектом настоящего изобретения является 29) фармацевтическая композиция, содержащая соединение формулы:
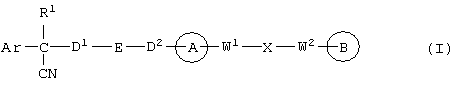
где Аr означает (1) С6-14 ароматическую углеводородную циклическую группу, которая может быть замещена, (2) 5-14-членную ароматическую гетероциклическую группу, которая может быть замещена, (3) C1-6 алкильную группу, замещенную С6-14 ароматической углеводородной циклической группой, которая может быть замещена, или (4) C1-6 алкильную группу, замещенную 5-14-членной ароматической гетероциклической группой, которая может быть замещена; кольцо А представляет соответственно пиперазиновое кольцо, гомопиперазиновое кольцо, пиперидиновое кольцо, гомопиперидиновое кольцо, пирролидиновое кольцо или диазабицикло[2,2,1]гептановое кольцо, которое может быть замещено; кольцо В представляет (1) С3-14 углеводородное кольцо, которое может быть замещено, или (2) 5-14-членное гетероциклическое кольцо, которое может быть замещено; Е означает (1) простую связь, группу формулы (2) -СО- или (3) -СН(ОН); Х означает (1) простую связь, (2) атом кислорода, (3) атом серы, (4) C1-6 алкиленовую цепь, которая может быть замещена, группу формулы (5) -NR2- (где R2 означает атом водорода или C1-6 алкильную группу, С3-8 циклоалкильную группу, низшую ацильную группу или C1-6 алкилсульфонильную группу, которая может быть замещена), (6) -СО-, (7) -COO-, (8) -ООС-, (9) -CONR3- (где R3 означает атом водорода или C1-6 алкильную группу, которая может быть замещена), (10) -NR4CO- (где R4 означает атом водорода или C1-6 алкильную группу, которая может быть замещена), (11) -SO-, (12) -SO2-, (13) -SONR5- (где R5 означает атом водорода или C1-6 алкильную группу, которая может быть замещена), (14) -NR6SO- (где R6 означает атом водорода или C1-6 алкильную группу, которая может быть замещена), (15) -SO2NR7 (где R7 означает атом водорода или C1-6 алкильную группу, которая может быть замещена), (16) -NR8SO2- (где R8 означает атом водорода или C1-6 алкильную группу, которая может быть замещена), (17) >C=N-OR9 (где R9 означает атом водорода или C1-6 алкильную группу, которая может быть замещена), (18) -NR10W3-O- (где R10 означает атом водорода или C1-6 алкильную группу, С3-8 циклоалкильную группу, низшую ацильную группу или C1-6 алкилсульфонильную группу, которая может быть замещена, и W3 означает C1-6 алкиленовую группу, которая может быть замещена), (19) -NH-CO-NH-, (20) -NH-CS-NH-, (21) -С (=NR15)NR16- (где R15 и R16 имеют одинаковые или разные значения и представляют атом водорода, нитрильную группу, C1-6 алкильную группу, С2-6 алкенильную группу, С3-8 циклоалкильную группу или С3-8 циклоалкенильную группу), (22) -NHC(=NH)-, (23) -O-CO-S-, (24) -S-CO-O-, (25) -ОСОО-, (26) -NHCOO-, (27) -OCONH-, (28) -СО(СН2)mО- (где m означает 0 или целое число от 1 до 6), (29) -СНОН- или (30) -СНОН(СН2)nО- (где n означает 0 или целое число от 1 до 6); R1 означает (1) атом водорода, (2) атом галогена, (3) гидроксильную группу, (4) C1-6 алкильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы, (5) С2-6 алкенильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы, (6) С2-6 алкинильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы, (7) С3-8 циклоалкильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы, (9) C1-6 алкокси-C1-6 алкильную группу, (10) амино-C1-6 алкильную группу, в которой атом азота может быть замещен, (11) группу формулы -N(R11)R12- (где R11 и R12 имеют одинаковые или разные значения и представляют атом водорода или C1-6 алкильную группу), (12) аралкильную группу, (13) морфолинильную группу, (14) тиоморфолинильную группу, (15) пиперидильную группу, (16) пирролидинильную группу или (17) пиперазинильную группу; и D1, D2, W1 и W2 имеют одинаковые или разные значения и представляют (1) простую связь или (2) C1-6 алкиленовую цепь, которая может быть замещена; при условии, что из приведенного выше определения исключены 1-[4-циано-5-метил-4-(2-циано-5-тиенил)гексил]-4-[2-(4-фторфенокси)этил]пиперазин; 1-[4-циано-5-метил-4-(2-циано-5-тиенил)гексил]-4-[2-(3-фторфенокси)этил]пиперазин и 1-[4-циано-5-метил-4-(2-тиенил)гексил]-4-[2-(3-фторфенокси)этил]пиперазин; его соль или гидрат, причем вышеуказанная композиция 29) может быть 30) антагонистом кальция, 31) нейронизбирательным антагонистом кальция, 32) ингибитором кальциевого канала P/Q-типа и/или N-типа, 33) средством для лечения, профилактики и подавления симптомов заболевания, восприимчивого к ингибированию кальциевого канала P/Q-типа и N-типа, 34) средством, препятствующим гибели нервных клеток и защищающим нервные клетки головного мозга, 35) средством для лечения, профилактики или подавления симптомов нервного заболевания, такого как 36) острый ишемический инсульт, кровоизлияние в мозг, инфаркт головного мозга, травма головы, гибель нервных клеток головного мозга, болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Хантингтона, метаболическое расстройство кровообращения головного мозга, нарушение функции головного мозга, болевой синдром, спазмы, шизофрения, мигрень, эпилепсия, маниакально-депрессивный синдром, дегенеративные нервные заболевания, ишемия головного мозга, слабоумие, вызванное СПИДом, отек мозга, состояние страха, диабетическая невропатия, слабоумие вследствие поражения сосудов головного мозга и рассеянный склероз, и 37) аналгетиком.
Настоящее изобретение относится к способу профилактики, лечения или подавления симптомов заболения, при котором эффективен антагонизм в отношении кальция, нейронизбирательный антагонизм в отношении кальция или ингибирующее действие в отношении кальциевого канала P/Q-типа и/или N-типа, путем введения пациенту фармакологически эффективного количества соединения формулы (I), его соли или гидрата.
Настоящее изобретение относится к способу профилактики, лечения или подавления симптомов нервного заболевания или болевого синдрома.
Кроме того, настоящее изобретение относится к применению соединения формулы (I), его соли или гидрата для получения антагониста кальция, нейронизбирательного антагониста кальция, ингибитора кальциевого канала P/Q-типа и/или N-типа, средства для лечения, профилактики или подавления симптомов заболевания, восприимчивого к ингибирующему действию в отношении кальциевого канала P/Q-типа и/или N-типа, и средства, препятствующего гибели нервных клеток или защищающего нервные клетки головного мозга.
Кроме того, настоящее изобретение относится к применению соединения формулы (I), его соли или гидрата для изготовления средства, предназначенного для лечения, профилактики или подавления симптомов нервных заболеваний, или аналгетика.
Нервное заболевание является любым из заболеваний, выбранных из таких, как острый ишемический инсульт, кровоизлияние в мозг, инфаркт головного мозга, травма головы, гибель нервных клеток головного мозга, болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Хантингтона, метаболическое расстройство кровообращения головного мозга, нарушение функции головного мозга, болевой синдром, спазмы, шизофрения, мигрень, эпилепсия, маниакально-депрессивный синдром, дегенеративные нервные заболевания, ишемия головного мозга, слабоумие, вызванное СПИДом, отек мозга, состояние страха, диабетическая невропатия, слабоумие вследствие поражения сосудов головного мозга и рассеянный склероз.
Ниже приведены значения символов и терминов, использованных в описании изобретения к настоящей заявке, и дано подробное описание настоящего изобретения.
Для удобства описания в рассматриваемой заявке структурная формула соединения представляет конкретный изомер, но в объем настоящего изобретения входят все геометрические изомеры, которые существуют в рамках структуры данного соединения, оптические изомеры на основе асимметричного атома углерода, стереоизомеры, таутомеры и тому подобные, а также смеси изомеров. Настоящее изобретение не ограничивается представленными для удобства формулами и может включать любые изомеры и их смеси. Поэтому соединения по настоящему изобретению могут включать оптически активные и рацемические формы, имеющие в молекуле асимметричный атом углерода, но не ограничиваются указанными формами. Кроме того, соединения по настоящему изобретению характеризуются наличием кристаллического полиморфизма, но не ограничиваются указанными формами, причем данные соединения могут существовать в кристаллической форме в виде отдельных кристаллов или смеси кристаллов и могут представлять гидрат, в дополнение к ангидриду. Так называемый метаболит, который образуется в результате разложения in vivo соединений по настоящему изобретению, также входит в объем настоящего изобретения.
Термин "и/или" в описании изобретения к настоящей заявке включает как значение "и", так и значение "или". Например, "А и/или В" имеет два значения "А и В" и "А или В", причем может быть использовано любое из указанных значений.
Термин "нервное заболевание" в описании изобретения к настоящей заявке главным образом означает острый ишемический инсульт, кровоизлияние в мозг, инфаркт головного мозга, травму головы, гибель нервных клеток головного мозга, болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Хантингтона, метаболическое расстройство кровообращения головного мозга, нарушение функции головного мозга, болевой синдром, спазмы, шизофрению, мигрень, эпилепсию, маниакально-депрессивный синдром, дегенеративные нервные заболевания, ишемию головного мозга, слабоумие, вызванное СПИДом, отек мозга, состояние страха, диабетическую невропатию, слабоумие вследствие поражения сосудов головного мозга и рассеянный склероз.
Термин "аналгетик" в описании изобретения к настоящей заявке означает лекарственное средство, которое ослабляет или успокаивает боль, изменяя восприятие стимуляции болевых рецепторов и не вызывая при этом наркотического оглушения и бессознательного состояния.
Термин "атом галогена" в описании изобретения к настоящей заявке означает такие атомы, как атом фтора, атом хлора, атом брома и атом иода, предпочтительно атом фтора, атом хлора и атом брома, более предпочтительно атом фтора и атом хлора.
Термин "C1-6 алкильная группа" в описании изобретения к настоящей заявке означает алкильную группу, имеющую 1-6 атомов углерода, и предпочтительные примеры такой группы включают алкильные группы с линейной или разветвленной цепью, такие как метильная, этильная, н-пропильная, изопропильная, н-бутильная, изобутильная, втор-бутильная, трет-бутильная, н-пентильная, 1,1-диметилпропильная, 1,2-диметилпропильная, 2,2-диметилпропильная, 1-этилпропильная, 2-этилпропильная, н-гексильная, 1-метил-2-этилпропильная, 1-этил-2-метилпропильная, 1,1,2-триметилпропильная, 1-пропилпропильная, 1-метилбутильная, 2-метилбутильная, 1,1-диметилбутильная, 1,2-диметилбутильная, 2,2-диметилбутильная, 1,3-диметилбутильная, 2,3-диметилбутильная, 2-этилбутильная, 2-метилпентильная и 3-метилпентильная группы.
Термин "C2-6 алкенильная группа" в описании изобретения к настоящей заявке означает алкенильную группу, имеющую 2-6 атомов углерода, предпочтительно с линейной или разветвленной цепью, такую как винильная, аллильная, 1-пропенильная, 2-пропенильная, изопропенильная, 2-метил-1-пропенильная, 3-метил-1-пропенильная, 2-метил-2-пропенильная, 3-метил-2-пропенильная, 1-бутенильная, 2-бутенильная, 3-бутенильная, 1-пентенильная, 1-гексенильная, 1,3-гексадиенильная и 1,6-гексадиенильная группа.
Термин "С2-6 алкинильная группа" в описании изобретения к настоящей заявке означает алкинильную группу, имеющую 2-6 атомов углерода, предпочтительно с линейной или разветвленной цепью, такую как этинильная, 1-пропинильная, 2-пропинильная, 1-бутинильная, 2-бутинильная, 3-бутинильная, 3-метил-1-пропинильная, 1-этинил-2-пропинильная, 2-мeтил-3-пропинильная 1-пентинильная, 1-гексинильная, 1,3-гексадиинильная и 1,6-гексадиинильная группа.
Термин "C1-6 алкоксильная группа" в описании изобретения к настоящей заявке означает "C1-6 алкилоксигруппу", в которой атом кислорода связан с группой, имеющей значения, указанные выше для C1-6 алкильной группы, и предпочтительными примерами таких групп являются метокси, этокси, н-пропокси, изопропокси, втор-пропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, н-пентилокси, изопентилокси, втор-пентилокси, н-гексилокси, изогексилокси, 1,1-диметилпропилокси, 1,2-диметилпропокси, 2,2-диметилпропилокси, 2-этилпропокси, 1-метил-2-этилпропокси, 1-этил-2-метилпропокси, 1,1,2-триметилпропокси, 1,1-диметилбутокси, 1,2-диметилбутокси, 2,2-диметилбутокси, 2,3-диметилбутилокси, 1,3-диметилбутилокси, 2-этилбутокси, 1,3-диметилбутокси, 2-метилпентокси, 3-метилпентокси, гексилокси и другие группы.
Термин "C1-6 алкенилоксигруппа" в описании изобретения к настоящей заявке означает группу, в которой атом кислорода связан с группой, имеющей значения, указанные выше для C1-6 алкенильной группы, и предпочтительными примерами таких групп являются винилокси, аллилокси, 1-пропенилокси, 2-пропенилокси, изопропенилокси, 2-метил-1-пропенилокси, 3-метил-1-пропенилокси, 2-метил-2-пропенилокси, 3-метил-2-пропенилокси, 1-бутенилокси, 2-бутенилокси, 3-бутенилокси, 1-пентенилокси, 1-гексенилокси, 1,3-гексадиенилокси, 1,6-гексадиенилокси и другие группы.
Термин "С3-8 циклоалкильная группа" в описании изобретения к настоящей заявке означает циклоалкильную группу, в которой кольцо образовано 3-8 атомами углерода, и предпочтительными примерами таких групп являются циклопропильная, циклобутильная, циклопентильная, циклогексильная, циклогептильная, циклооктильная и другие группы. Кроме того, термин "С3-8 циклоалкан" в описании изобретения к настоящей заявке означает кольцо (циклическое соединение), соответствующее вышеуказанной С3-8 циклоалкильной группе.
Термин "С3-8 циклоалкенильная группа" в описании изобретения к настоящей заявке означает С3-8 циклоалкенильную группу, в которой кольцо образовано 3-8 атомами углерода, и примерами таких групп являются группы формулы:
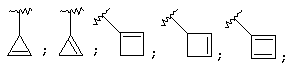
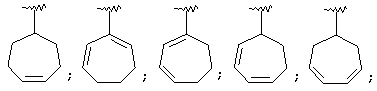
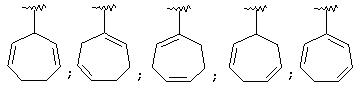
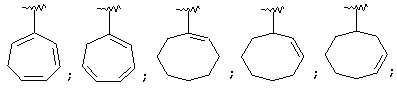
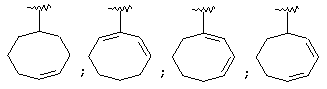
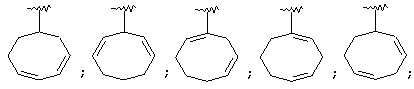
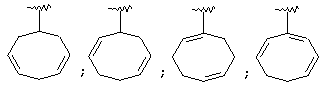
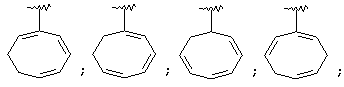
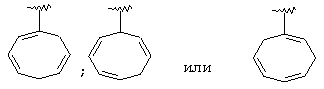
Термин "ароматическая циклическая группа" в описании изобретения к настоящей заявке означает С6-14 ароматическую углеводородную циклическую группу или 5-14-членную ароматическую гетероциклическую группу.
(1) Примеры вышеуказанной "С6-14 ароматической углероводородной циклической группы" включают моноциклические, дициклические или трициклические С6-14 ароматические углеводородные группы, такие как фенильная, инденильная, 1-нафтильная, 2-нафтильная, азуленильная, гепталенильная, бифенильная, индатенильная, аценафтильная, флуоренильная, феналенильная, фенантренильная, антраценильная, циклопентациклооктенильная, бензоциклооктенильная и подобные группы.
(2) Примеры "5-14-членной ароматической гетероциклической группы" включают моноциклическое, дициклическое или трициклическое 5-14-членное ароматическое гетероциклическое кольцо, содержащее один или несколько гетероатомов, выбираемых из атомов азота, серы и кислорода, и представляют, например:
(i) ароматические гетероциклические кольца, содержащие азот, такие как пирролильная, пиридильная, пиридазинильная, пиримидинильная, пиразинильная, триазолильная, тетразолильная, бензотриазолильная, пиразолильная, имидазолильная, бензимидазолильная индолильная, изоиндолильная, индолизинильная, пуринильная, индазолильная, хинолильная, изохинолильная, хинолизильная, фталазильная, нафтилидинильная, хиноксалильная, хиназолинильная, циннолинильная, птеридинильная, имидазотриазинильная, пиразинопиридазинильная, акридинильная, фенантридинильная, карбазолильная, карбазолинильная, перимидинильная, фенантролинильная, фенацинильная, имидазопиридинильная, имидазопиримидинильная и пиразолопиридинильная группы;
(ii) ароматические гетероциклические кольца, содержащие серу, такие как тиенильная и бензотиенильная группы;
(iii) ароматические гетероциклические кольца, содержащие кислород, такие как фурильная, пиранильная, циклопентапиранильная, бензофуранильная и изобензофуранильная группы, и
(iv) ароматические гетероциклические кольца, содержащие 2 или более разных гетероатомов, выбираемых из атомов азота, серы и кислорода, такие как тиазолильная, изотиазолильная, бензотиазолильная, бензотиадиазолильная, фенотиазинильная, изоксазолильная, фуразанильная, феноксазинильная, оксазолильная, бензоксазолильная, оксадиазолильная, пиразолооксазолильная, имидазотиазолильная, тиенофуранильная, фуропирролильная, пиридоксазинильная группы.
Термин "С3-14 углеводородное кольцо" в описании изобретения к настоящей заявке означает С3-8 циклоалкан, С3-8 циклоалкен или С6-14 ароматическое углеводородное кольцо, имеющие значения, указанные выше для С3-8 циклоалкана, С3-8 циклоалкена и С6-14 ароматического углеводородного кольца.
Термин "5-14-членное гетероциклическое кольцо" в описании изобретения к настоящей заявке означает 5-14-членное гетероциклическое кольцо, содержащее один или несколько гетероатомов, выбираемых из атомов азота, серы и кислорода, причем данное определение включает ароматические гетероциклические кольца и неароматические гетероциклические кольца. В данном случае (1) указанное "5-14-членное ароматическое гетероциклическое кольцо" имеет значения, приведенные выше для 5-14-членного ароматического гетероциклического кольца. Кроме того, (2) предпочтительное "5-14-членное неароматическое гетероциклическое кольцо" включает такие 5-14-членные неароматические гетероциклические кольца, как пирролидиновое, пирролиновое, пиперидиновое, пиперазиновое, имидазолиновое, пиразолидиновое, имидазолидиновое, морфолиновое, тетрагидрофурановое, тетрагидропирановое, азиридиновое, оксирановое, оксатиорановое, пиридоновое и другие кольца, и конденсированные кольца, такие как фталимидное, сукцинимидное и другие кольца.
Термин "углеводородная группа" в описании изобретения к настоящей заявке означает C1-6 алкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С3-8 циклоалкильную группу, С3-8 циклоалкенильную группу или С6-14 ароматическую углеводородную циклическую группу, которые имеют указанные выше значения.
Значения Аr
В соединении вышеуказанной формулы (I) по настоящему изобретению Аr означает (1) С6-14 ароматическую углеводородную циклическую группу, которая может быть замещена, (2) 5-14-членную ароматическую гетероциклическую группу, которая может быть замещена, (3) C1-6 алкильную группу, замещенную С6-14 ароматической углеводородной циклической группой, которая может быть замещена, или (4) C1-6 алкильную группу, замещенную 5-14-членной ароматической гетероциклической группой, которая может быть замещена.
Примерами вышеуказанной "С6-14 ароматической углеводородной циклической группы" предпочтительно являются фенильная, пенталенильная, инденильная, нафтильная, 1,2,3,4-тетрагидронафтильная, азуленильная, гепталенильная, бензоциклооктенильная, тетранильная, фенантренильная и другие группы, более предпочтительно фенильная, нафтильная и другие группы.
Предпочтительными примерами "5-14-членной ароматической гетероциклической группы" являются пирролильная, пиридильная, пиридазинильная, пиримидинильная, пиразинильная, триазолильная, тетразолильная, бензотриазолильная, пиразолильная, имидазолильная, бензимидазолильная, индолильная, изоиндолильная, индолизинильная, пуринильная, индазолильная, хинолильная, изохинолильная, хинолизильная, фталазильная, нафтилидинильная, хиноксалильная, хиназолинильная, циннолинильная, птеридинильная, имидазотриазинильная, пиразинопиридазинильная, акридинильная, фенантридинильная, карбазолильная, карбазолинильная, перимидинильная, фенантролинильная, фенацинильная, имидазопиридинильная, имидазопиримидинильная пиразолопиридинильная, тиенильная, бензотиенильная, фурильная, пиранильная, циклопентапиранильная, бензофуранильная, изобензофуранильная, тиазолильная, изотиазолильная, бензотиазолильная, бензотиадиазолильная, фенотиазинильная, изоксазолильная, фуразанильная, феноксазинильная, оксазолильная, бензоксазолильная, оксадиазолильная, пиразолооксазолильная, имидазотиазолильная, тиенофуранильная, флопирролильная, пиридоксазинильная и другие группы, более предпочтительны тиенильная, пиридильная и другие группы и наиболее предпочтительна тиенильная группа.
Когда Аr означает "необязательно замещенную С6-14 ароматическую углеводородную циклическую группу" или "необязательно замещенную 5-14-членную ароматическую гетероциклическую группу", примерами "заместителей" являются (i) гидроксильная группа, (ii) атом галогена (например, атом фтора, хлора, брома и иода), (iii) нитрильная группа, (iv) C1-6 алкильная группа (предпочтительно метильная, этильная, н-пропильная, изопропильная, н-бутильная, изобутильная, втор-бутильная, трет-бутильная, н-пентильная, 1,1-диметилпропильная, 1,2-диметилпропильная, 2,2-диметилпропильная, 1-этилпропильная, 2-этилпропильная, н-гексильная, 1-метил-2-этилпропильная, 1-этил-2-метилпропильная, 1,1,2-триметилпропильная, 1-пропилпропильная, 1-метилбутильная, 2-метилбутильная, 1,1-диметилбутильная, 1,2-диметилбутильная, 2,2-диметилбутильная, 1,3-диметилбутильная, 2,3-диметилбутильная, 2-этилбутильная, 2-метилпентильная, 3-метилпентильная и другие группы), (v) С2-6 алкенильная группа (предпочтительно винильная, аллильная, 1-пропенильная, 2-пропенильная, изопропенильная, 2-метил-1-пропенильная, 3-метил-1-пропенильная, 2-метил-2-пропенильная, 3-метил-2-пропенильная, 1-бутенильная, 2-бутенильная, 3-бутенильная, 1-пентенильная, 1-гексенильная, 1,3-гексадиенильная, 1,6-гексадиенильная и другие группы), (vi) C2-6 алкинильная группа (предпочтительно этинильная, 1-пропинильная, 2-пропинильная, 1-бутинильная, 2-бутинильная, 3-бутинильная, 3-метил-1-пропинильная, 1-этинил-2-пропинильная, 2-метил-3-пропинильная, 1-пентинильная, 1-гексинильная, 1,3-гексадиинильная, 1,6-гексадиинильная и другие группы), (vii) C1-6 алкоксильная группа (предпочтительно метокси, этокси, н-пропокси, изопропокси, втор-пропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, н-пентилокси, изопентилокси, втор-пентилокси, н-гексилокси, изогексилокси, 1,1-диметилпропилокси, 1,2-диметилпропокси, 2,2-диметилпропилокси, 2-этилпропокси, 1-метил-2-этилпропокси, 1-этил-2-метилпропокси, 1,1,2-триметилпропокси, 1,1-диметилбутокси, 1,2-диметилбутокси, 2,2-диметилбутокси, 2,3-диметилбутилокси, 1,3-диметилбутилокси, 2-этилбутокси, 1,3-диметилбутокси, 2-метилпентокси, 3-метилпентокси, гексилокси и другие группы), (viii) C1-6 алкилтиогруппа (предпочтительно метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио, изобутилтио, втор-бутилтио, трет-бутилтио, н-пентилтио, 1,1-диметилпропилтио, 1,2-диметилпропилтио, 2,2-диметилпропилтио, 1-этилпропилтио, 2-этилпропилтио, н-гексилтио, 1-метил-2-этилпропилтио, 1-этил-2-метилпропилтио, 1,1,2-триметилпропилтио, 1-пропилпропилтио, 1-метилбутилтио, 2-метилбутилтио, 1,1-диметилбутилтио, 1,2-диметилбутилтио, 2,2-диметилбутилтио, 1,3-диметилбутилтио, 2,3-диметилбутилтио, 2-этилбутилтио, 2-метилпентилтио, 3-метилпентилтио и другие группы), (ix) C1-6 алкоксикарбонильная группа, (х) гидроксил-C1-6 алкильная группа, (xi) галогензамещенная C1-6 алкильная группа, (xii) гидроксиимино-C1-6 алкильная группа, (xiii) нитрогруппа, (xiv) аминогруппа, в которой атом азота может быть замещен, (xv) карбамоильная группа, в которой атом азота может быть замещен, (xvi) сульфамоильная группа, в которой атом азота может быть замещен, (xvii) низшая ацильная группа, (xviii) ароматическая ацильная группа, (xix) C1-6 алкилсульфонильная группа, такая как метилсульфонильная и другие группы, при этом "заместитель" предпочтительно представляет (а) гидроксильную группу, (b) атом галогена, (с) нитрильную группу, (d) C1-6 алкильную группу, (е) C1-6 алкилсульфонильную группу, (f) C1-6 алкоксильную группу, (g) C1-6 алкилтиогруппу и т.д., более предпочтительно нитрильную группу или атом галогена (например, атом фтора и т.д.).
Примеры более предпочтительной "С6-14 ароматической углеводородной циклической группы, которая может быть замещена" или "5-14-членной ароматической гетероциклической группы, которая может быть замещена" в определении Аr включают тиофеновое, пиридиновое, бензольное или нафталиновое кольцо, которое может быть замещено одной или несколькими группами, выбираемыми из атома галогена и цианогруппы. Наиболее предпочтительным примером является тиофеновое кольцо, которое может быть замещено одной или несколькими группами, выбираемыми из атома галогена и цианогруппы, а именно кольцо формулы:
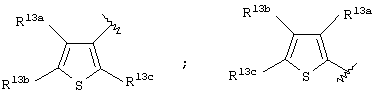
где R13a, R13b и R13c имеют одинаковые или разные значения и представляют атом водорода, атом галогена или цианогруппу.
В тех случаях, когда в соединении формулы (I) по настоящему изобретению Аr означает "C1-6 алкильную группу, замещенную С6-14 ароматической углеводородной циклической группой, которая может быть замещена", или "C1-6 алкильную группу, замещенную 5-14-членной ароматической гетероциклической группой, которая может быть замещена", "С6-14 ароматическая углеводородная циклическая группа, которая может быть замещена", или "5-14-членная ароматическая гетероциклическая группа, которая может быть замещена", имеют значения, указанные выше для С6-14 ароматической углеводородной циклической группы, которая может быть замещена, или для 5-14-членной ароматической гетероциклической группы, которая может быть замещена соответственно. C1-6 алкильная группа, замещенная такими группами, означает C1-6 алкильную группу, замещенную вышеуказанными группами. В данном случае предпочтительными примерами "C1-6 алкильной группы" являются метильная, этильная, н-пропильная, изопропильная, н-бутильная, изобутильная, втор-бутильная, трет-бутильная, н-пентильная, 1,1-диметилпропильная, 1,2-диметилпропильная, 2,2-диметилпропильная, 1-этилпропильная, 2-этилпропильная, н-гексильная, 1-метил-2-этилпропильная, 1-этил-2-метилпропильная, 1,1,2-триметилпропильная, 1-пропилпропильная, 1-метилбутильная, 2-метилбутильная, 1,1-диметилбутильная, 1,2-диметилбутильная, 2,2-диметилбутильная, 1,3-диметилбутильная, 2,3-диметилбутильная, 2-этилбутильная, 2-метилпентильная, 3-метилпентильная и другие группы. Предпочтительными примерами "C1-6 алкильной группы, замещенной ароматической группой, которая может быть замещена", являются бензильная, фенетильная, фенилпропильная, нафтилметильная, нафтилэтильная, нафтилпропильная, пиридилметильная, пиразинилметильная, пиримидинилметильная, пирролилметильная, имидазолилметильная, пиразолилметильная, хинолилметильная, изохинолилметильная, фурфурильная, тиенилметильная, тиазолилметильная и другие группы, которые могут быть необязательно замещены одной или несколькими группами, выбираемыми из нитрильной группы, атома галогена (например, атома фтора, хлора, брома, иода и т.д.) и подобных групп.
Предпочтительными примерами "C1-6 алкоксикарбонильной группы" в определении Аr являются метоксикарбонильная, этоксикарбонильная, н-пропоксикарбонильная, изопропоксикарбонильная, втор-пропоксикарбонильная, н-бутоксикарбонильная, изобутоксикарбонильная, втор-бутоксикарбонилкарбонильная, трет-бутоксикарбонилкарбонильная, н-пентилоксикарбонильная, изопентилоксикарбонильная, втор-пентилоксикарбонильная, трет-пентилоксикарбонильная, н-гексилоксикарбонильная, изогексилоксикарбонильная, 1,2-диметилпропоксикарбонильная, 2-этилпропоксикарбонильная, 1-метил-2-этилпропоксикарбонильная, 1-этил-2-этилпропоксикарбонильная, 1,1,2-триметилпропоксикарбонильная, 1,1-диметилбутоксикарбонильная, 2,2-диметилбутоксикарбонильная, 2-этилбутоксикарбонильная, 1,3-диметилбутоксикарбонильная, 2-метилпентилоксикарбонильная, 3-метилпентилоксикарбонильная и другие группы.
Предпочтительными примерами вышеуказанной "гидрокси-C1-6 алкильной группы" являются C1-6 алкильные группы с линейной или разветвленной цепью, такие как гидроксиметильная, 1-гидроксиэтильная, 2-гидроксиэтильная, 3-гидрокси-н-пропильная, гидроксиизопропильная, гидрокси-втор-пропильная, гидрокси-н-бутильная, гидроксиизобутильная, гидрокси-втор-бутильная, гидрокси-трет-бутильная, гидрокси-н-пентильная, гидроксиизопентильная, гидрокси-н-гексильная и гидроксиизогексильная группы.
Вышеуказанная "галогензамещенная C1-6 алкильная группа" представляет группу, в которой один или несколько одинаковых или разных атомов галогена связаны с "C1-6 алкильной группой", имеющей указанные выше значения, и предпочтительными примерами такой группы являются фторметильная, дифторметильная, трифторметильная, хлорметильная, 1-фторэтильная, 2-фторэтильная, 1,1-дифторэтильная, 1,2-дифторэтильная, 2,2-дифторэтильная, 2,2,2-трифторэтильная и другие группы.
Вышеуказанная "гидроксиимино-C1-6 алкильная группа" представляет группу, в которой гидроксииминогруппа связана с группой, имеющей значения, указанные выше для C1-6 алкильной группы.
"Аминогруппа, в которой атом азота может быть необязательно замещен" означает аминогруппу формулы -N(R15)R16- (где R15 и R16 имеют одинаковые или разные значения и представляют (1) атом водорода, (2) C1-6 алкильную группу, C1-6 алкенильную группу или C1-6 алкинильную группу, которая может быть замещена соответственно одной или несколькими группами, выбираемыми из атома галогена, С3-8 циклоалкильной группы, С3-8 циклоалкенильной группы и C1-6 алкоксильной группы, (3) С3-8 циклоалкильную группу или С3-8 циклоалкенильную группу, которая может быть замещена атомом галогена, (4) карбонильную группу, замещенную любой группой, выбираемой соответственно из C1-6 алкильной группы, C1-6 алкенильной группы, C1-6 алкинильной группы, С3-8 циклоалкильной группы, С3-8 циклоалкенильной группы, C1-6 алкоксильной группы, С6-14 ароматической углеводородной циклической группы, 5-14-членной ароматической гетероциклической группы и 5-14-членной неароматической гетероциклической группы, которая может быть замещена атомом галогена, (5) карбамоильную группу, замещенную любой группой, выбираемой из C1-6 алкильной группы, C1-6 алкенильной группы, C1-6 алкинильной группы, C6-14 ароматической углеводородной циклической группы и 5-14-членной ароматической гетероциклической группы, (6) сульфонильную группу, замещенную любой группой, выбираемой из C1-6 алкильной группы, C1-6 алкенильной группы и C1-6 алкинильной группы, либо (7) R15 и R16 могут быть связаны друг с другом с образованием 3-10-членной неароматической гетероциклической группы, содержащей атом азота, к которому они присоединены, причем указанная гетероциклическая группа может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена, C1-6 алкоксильной группы и т.д.).
Примерами предпочтительной аминогруппы являются незамещенная аминогруппа, метиламиногруппа, диметиламиногруппа, этиламиногруппа, диэтиламиногруппа, метилэтиламиногруппа, ацетамидная (СН3СОNН-) группа, пропиоамидная, метансульфонамидная, этансульфонамидная, пирролидинильная, пиразолинильная, пиперидинильная, пиперазинильная, 4-морфолинильная, 4-тиоморфолинильная и другие группы. Более предпочтительным примером "аминогруппы, которая может быть замещена" является аминогруппа, которая может быть замещена одной или двумя группами, выбираемыми из C1-6 алкильной группы, С2-6 алкенильной группы, С2-6 алкинильной группы, С3-8 циклоалкильной группы и С3-8 циклоалкенильной группы.
Вышеуказанная "карбамоильная группа, в которой атом азота может быть замещен" представляет карбамоильную группу, в которой атом азота может быть замещен группой, выбираемой из C1-6 алкильной группы, С2-6 алкенильной группы, С2-6 алкинильной группы, С3-8 циклоалкильной группы и С3-8 циклоалкенильной группы. Карбамоильная группа представляет также группу, в которой атом азота является частью циклического амина. Предпочтительными примерами "карбамоильной группы, в которой атом азота может быть замещен", являются незамещенная карбамоильная группа, N-метилкарбамоильная группа, N,N-диметилкарбамоильная группа, N-этилкарбамоильная группа, N,N-диэтилкарбамоильная группа, N-метил-N-этилкарбамоильная группа, 1-пирролидинилкарбонильная группа, 1-пиразолинилкарбонильная группа, 1-пиперидилкарбонильная группа, 1-пиперазинилкарбонильная группа, 4-морфолинилкарбонильная группа, 4-тиоморфолинилкарбонильная и другие группы.
Вышеуказанная "сульфамоильная группа, в которой атом азота может быть замещен" представляет сульфамоильную группу, в которой атом азота может быть необязательно замещен группой, выбираемой из C1-6 алкильной группы, С2-6 алкенильной группы, С2-6 алкинильной группы, С3-8 циклоалкильной группы, С3-8 циклоалкенильной и других групп. Сульфамоильная группа представляет также группу, в которой атом азота является частью циклического амина. Предпочтительными примерами "сульфамоильной группы, в которой атом азота может быть замещен", являются незамещенная сульфамоильная группа (-SO2NH2), N-метилсульфамоильная группа (-SO2NHСН3), N,N-диметилсульфамоильная группа (-SO2N(СН3)2), N-этилсульфамоильная группа (-SO2NHC2H5), N,N-диэтилсульфамоильная группа (-SO2N(С2Н5)2), N-метил-N-этилсульфамоильная группа (-SO2N(СН3)С2Н5), 1-пирролидинилсульфонильная группа, 1-пиразолинилсульфонильная группа, 1-пиперидилсульфонильная группа, 1-пиперазинилсульфонильная группа, 4-морфолинилсульфонильная группа, 4-тиоморфолинилсульфонильная группа и т.д.
Вышеуказанная "низшая ацильная группа" представляет ацильную группу с линейной или разветвленной цепью, полученную из жирной кислоты с 1-6 атомами углерода, и предпочтительными примерами указанной группы являются формильная, ацетильная, пропионильная, бутирильная, изобутирильная, валерильная, изовалерильная, пивалоильная, гексаноильная и другие группы.
Значения кольца А
В соединении вышеуказанной формулы (I) по настоящему изобретению кольцо А является любым кольцом, выбираемым из пиперазинового кольца, гомопиперазинового кольца, пиперидинового кольца, гомопиперидинового кольца, пирролидинового кольца и диазабицикло[2,2,1]гептанового кольца. Примеры кольца А предпочтительно включают пиперазиновое кольцо, гомопиперазиновое кольцо, пиперидиновое кольцо, гомопиперидиновое кольцо, пирролидиновое кольцо, более предпочтительно пиперидиновое кольцо, пиперазиновое кольцо и наиболее предпочтительно пиперазиновое кольцо. Когда кольцо А означает пиперазиновое кольцо, пиперидиновое кольцо, пирролидиновое кольцо или диазабицикло[2,2,1]гептановое кольцо, предпочтительной является структура формулы:
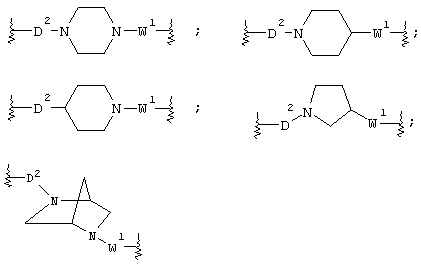
в которой к кольцу А присоединены связывающие цепи D2 и W1, и более предпочтительная структура имеет формулу:
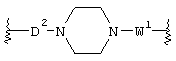
Значения кольца В
В соединении вышеуказанной формулы (I) по настоящему изобретению кольцо В представляет (1) С3-14 углеводородное кольцо, которое может быть замещено, или (2) 5-14-членное гетероциклическое кольцо, которое может быть замещено.
(1) "С3-14 углеводородное кольцо" в определении кольца В означает С3-8 циклоалкан, С3-8 циклоалкен или C6-14 ароматическое углеводородное кольцо. Когда кольцо В представляет "С3-8 циклоалкан", примеры такого кольца предпочтительно включают 3-8-членные циклоалканы, такие как циклопропан, циклобутан, циклопентан, циклогексан, циклогептан и т.д., и более предпочтительно циклопропан, циклобутан, циклопентан, циклогексан и другие. Когда кольцо В представляет "С3-8 циклоалкен", примеры такого кольца включают 3-8-членные циклоалкены, такие как циклопропен, циклобутен, циклопентен, циклогексен и циклогептен, а также неароматическое ненасыщенное углеводородное кольцо, в котором углерод-углеродная двойная связь ароматического углеводородного кольца является частично насыщенной. Более предпочтительными являются циклопропен, циклобутен, циклопентен, циклогексен и т.д. Когда кольцо В представляет "С6-14 ароматическое углеводородное кольцо", таким кольцом предпочтительно является бензольное кольцо, пенталеновое кольцо, инденовое кольцо, нафталиновое кольцо, 1,2,3,4-тетрагидронафталиновое кольцо, азуленовое кольцо, гепталеновое кольцо, бензоциклооктеновое кольцо, фенантреновое кольцо и другие, причем кольцо С3-8 циклоалкана, конденсированное с ароматическим углеводородным кольцом, и кольцо С3-8 циклоалкена, конденсированное с ароматическим углеводородным кольцом, также входят в определение "С6-14 ароматического углеводородного кольца".
(2) "5-14-Членное гетероциклическое кольцо" в определении кольца В означает 5-14-членное неароматическое гетероциклическое кольцо или 5-14-членное ароматическое гетероциклическое кольцо. Когда кольцо В представляет "5-14-членное неароматическое гетероциклическое кольцо", таким кольцом предпочтительно является пирролидиновое кольцо, пирролиновое кольцо, пиперазиновое кольцо, имидазолиновое кольцо, пиразолидиновое кольцо, имидазолидиновое кольцо, морфолиновое кольцо, тетрагидропирановое кольцо, азиридиновое кольцо, оксирановое кольцо, фталимидное кольцо, сукцинимидное кольцо и т.д. Когда кольцо В представляет "5-14-членное ароматическое гетероциклическое кольцо", предпочтительным кольцом является пиррольное кольцо, пиридиновое кольцо, пиридазиновое кольцо, пиримидиновое кольцо, пиразиновое кольцо, пиразольное кольцо, имидазольное кольцо, индольное кольцо, изоиндолильное кольцо, индолизиновое кольцо, пуриновое кольцо, индазольное кольцо, хинолиновое кольцо, изохинолиновое кольцо, хинолизиновое кольцо, фталазиновое кольцо, нафтилидиновое кольцо, хиноксалиновое кольцо, хиназолиновое кольцо, бензимидазольное кольцо, циннолиновое кольцо, птеридиновое кольцо, имидазотриазиновое кольцо, пиразинопиридазиновое кольцо, акридиновое кольцо, фенантридиновое кольцо, карбазольное кольцо, карбазолиновое кольцо, перимидиновое кольцо, фенантролиновое кольцо, фенациновое кольцо, тиофеновое кольцо, бензотиофеновое кольцо, фурановое кольцо, пирановое кольцо, циклопентапирановое кольцо, бензофурановое кольцо, изобензофурановое кольцо, тиазольное кольцо, изотиазольное кольцо, бензотиадиазольное кольцо, бензотиазольное кольцо, фенотиазиновое кольцо, изоксазольное кольцо, фуразановое кольцо, феноксазиновое кольцо, пиразолооксазольное кольцо, имидазотиазольное кольцо, тиенофурановое кольцо, фуропиррольное кольцо, пиридоксазиновое кольцо, 1,4-бензодиоксановое кольцо, бензоксазольное кольцо, 2-кето-1-имидазольное кольцо, оксазольное кольцо, 1,2,4-оксадиазольное кольцо, инданоновое кольцо, 1,2,3,4-тетрагидрохинолиновое кольцо и т.д.
Примеры "заместителя" "С3-14 углеводородного кольца, которое может быть замещено" или "5-14-членного гетероциклического кольца, которое может быть замещено" в кольце В включают одну или несколько групп, выбираемых из (1) гидроксильной группы, (2) атома галогена (например, атома фтора, хлора, брома, иода и других), (3) нитрильной группы, (4) C1-6 алкильной группы, которая может быть замещена (например, C1-6 алкильной группы, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена, нитрильной группы, гидроксииминогруппы и других), (5) С2-6 алкенильной группы, которая может быть замещена (например, С2-6 алкенильной группы, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена, нитрильной группы, гидроксииминогруппы и других), (6) C1-6 алкоксильной группы, которая может быть замещена (например, C1-6 алкоксильной группы, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена, нитрильной группы, гидроксииминогруппы и других), (7) C1-6 алкилтиогруппы, которая может быть замещена, (8) C1-6 алкоксикарбонильной группы, (9) нитрогруппы, (10) аминогруппы, в которой атом азота может быть замещен, (11) карбамоильной группы, в которой атом азота может быть замещен, (12) сульфамоильной группы, в которой атом азота может быть замещен, (13) низшей ацильной группы, (14) ароматической ацильной группы, (15) C1-6 алкилсульфонильной группы (например, метилсульфонильной группы, этилсульфонильной группы и других), (16) С6-14 ароматической углеводородной циклической группы, (17) 5-14-членной ароматической гетероциклической группы и (18) аралкильной группы (например, бензильной группы, фенетильной группы и других), причем предпочтительной группой является (i) гидроксильная группа, (ii) атом галогена (например, атом фтора, хлора, брома и другие), (iii) нитрильная группа, (iv) C1-6 алкильная группа (например, метильная, этильная, н-пропильная, изопропильная, н-бутильная, изобутильная, трет-бутильная и другие группы), (v) C6-14 ароматическая углеводородная циклическая группа, (vi) 5-14-членная ароматическая гетероциклическая группа и т.д., более предпочтительной является нитрильная группа, атом фтора, атом хлора и другие.
Наиболее предпочтительным кольцом В является соответственно C6-14 ароматическое углеводородное кольцо или 5-14-членное ароматическое гетероциклическое кольцо, которое может быть замещено. Типичные примеры включают бензольное кольцо, тиофеновое кольцо, пиридиновое кольцо, 1,4-бензодиоксановое кольцо, индольное кольцо, бензотиазольное кольцо, бензоксазольное кольцо, бензимидазольное кольцо, 2-кето-1-имидазольное кольцо, тиазольное кольцо, оксазольное кольцо, изоксазольное кольцо, 1,2,4-оксадиазольное кольцо, инданоновое кольцо, бензофурановое кольцо, хинолиновое кольцо, 1,2,3,4-тетрагидрохинолиновое кольцо, нафталиновое кольцо, 1,2,3,4-тетрагидронафталиновое кольцо и другие, которые могут быть замещены одной или несколькими группами, выбираемыми из нитрильной группы, атома галогена (например, атома фтора, хлора, брома и других), С6-14 ароматической углеводородной циклической группы (например, фенильной, нафтильной и других групп), 5-14-членной ароматической гетероциклической группы (например, пиридильной, тиенильной, фурильной и других групп), C1-6 алкильной группы (например, метильной, этильной, н-пропильной, изопропильной, изобутильной и других групп), низшей ацильной группы и C1-6 алкилсульфонильной группы (например, метилсульфонильной, этилсульфонильной и других групп).
Значения Е
В соединении вышеуказанной формулы (I) по настоящему изобретению связывающая цепь Е представляет простую связь, группы формулы -СО- или -СН(ОН)-. Наиболее предпочтительным значением Е является простая связь.
Значения Х
В соединении вышеуказанной формулы (I) по настоящему изобретению связывающая цепь Х представляет (1) простую связь, (2) атом кислорода, (3) атом серы, (4) C1-6 алкиленовую цепь, которая может быть замещена, группу формулы (5) -NR2- (где R2 означает атом водорода или C1-6 алкильную группу, С3-8 циклоалкильную группу, низшую ацильную группу или C1-6 алкилсульфонильную группу, которая может быть замещена), (6) -СО-, (7) -COO-, (8) -ООС-, (9) -CONR3- (где R3 означает атом водорода или C1-6 алкильную группу, которая может быть замещена), (10) -NR4CO- (где R4 означает атом водорода или C1-6 алкильную группу, которая может быть необязательно замещена), (11) -SO-, (12) -SO2-, (13) -SONR5- (где R5 означает атом водорода или C1-6 алкильную группу, которая может быть замещена), (14) -NR6SO- (где R6 означает атом водорода или C1-6 алкильную группу, которая может быть замещена), (15) -SO2NR7- (где R7 означает атом водорода или C1-6 алкильную группу, которая может быть замещена), (16) -NR8SO2- (где R8 означает атом водорода или C1-6 алкильную группу, которая может быть замещена), (17) >C=N-OR9 (где R9 означает атом водорода или C1-6 алкильную группу, которая может быть замещена), (18) -NR10W3-O-(где R10 означает атом водорода, C1-6 алкильную группу, С3-8 циклоалкильную группу, низшую ацильную группу или C1-6 алкилсульфонильную группу, которая может быть замещена; и W3 означает C1-6 алкиленовую группу, которая может быть замещена), (19) -NH-CO-NH-, (20) -NH-CS-NH-, (21) -С (=NR15) NR16- (где R15 и R16 имеют одинаковые или разные значения и представляют атом водорода, нитрильную группу, C1-6 алкильную группу, С2-6 алкенильную группу, С3-8 циклоалкильную группу или С3-8 циклоалкенильную группу), (22) -NHC(=NH)-, (23) -O-CO-S-, (24) -S-CO-O-, (25) -ОСОО-, (26) -NHCOO-, (27) -OCONH-, (28) -СО(СН2)mО- (где m означает 0 или целое число от 1 до 6), (29) -СНОН- или (30) -СНОН(СН2)nО- (где n означает 0 или целое число от 1 до 6).
Когда Х представляет "C1-6 алкиленовую цепь, которая может быть замещена", термин "C1-6 алкиленовая цепь" означает цепь, полученную из C1-6 алкана с линейной или разветвленной цепью, и примеры таких групп включают метилен, этилен, этилиден, триметилен, изопропилиден, пропилен, тетраметилен, 1,2-бутилен, 1,3-бутилен, 2,3-бутилен, изобутилен и т.д.
В определении Х наиболее предпочтительным примером "C1-6 алкильной группы, которая может быть замещена", обозначенной R2-R10, является C1-6 алкильная группа (например, метильная, этильная, н-пропильная, изопропильная и другие группы), которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена (например, атома фтора, хлора, брома, йода и других), нитрильной группы, нитрогруппы, C1-6 алкоксильной группы (например, метокси, этокси, н-пропокси, изопропокси и других групп) и т.д.
В определении Х предпочтительными примерами "С3-8 циклоалкильной группы", обозначенной R2 и R10, являются циклопропанильная, циклобутанильная, циклопентанильная, циклогексанильная, циклогептанильная и другие группы, причем указанная группа более предпочтительно является циклопропанильной, циклобутанильной, циклопентанильной, циклогексанильной и другими группами.
В определении Х предпочтительными примерами "низшей ацильной группы", обозначенной R2 и R10, являются формильная, ацетильная, пропионильная, бутирильная, изобутирильная, валерильная, изовалерильная, пивалоильная, гексаноильная и другие группы.
В определении Х предпочтительными примерами "C1-6 алкилсульфонильной группы", обозначенной R2 и R10, являются метилсульфонильная, этилсульфонильная, н-пропилсульфонильная, изопропилсульфонильная, втор-пропилсульфонильная, н-бутилсульфонильная, изобутилсульфонильная, втор-бутилсульфонильная, трет-бутилсульфонильная, н-пентилсульфонильная, изопентилсульфонильная, втор-пентилсульфонильная, трет-пентилсульфонильная, н-гексилсульфонильная, изогексилсульфонильная, 1,2-диметилпропилсульфонильная, 2-этилпропилсульфонильная, 1-метил-2-этилпропилсульфонильная, 1-этил-2-метилпропилсульфонильная, 1,1,2-триметилпропилсульфонильная, 1,1,2-триметилпропилсульфонильная, 1,1-диметилбутилсульфонильная, 2,2-диметилбутилсульфонильная, 2-этилбутилсульфонильная, 1,3-диметилбутилсульфонильная, 2-метилпентилсульфонильная, 3-метилпентилсульфонильная и другие группы.
R15 и R16 в определении Х имеют одинаковые или разные значения и представляют атом водорода, нитрильную группу, C1-6 алкильную группу, С2-6 алкенильную группу, С3-8 циклоалкильную группу или С3-8 циклоалкиленовую группу. Предпочтительные группы для обоих радикалов имеют одинаковые или разные значения и представляют атом водорода, нитрильную, метильную, этильную, н-пропильную, изопропильную, циклопропильную, циклопентильную, циклогексильную и другие группы. Более предпочтительно R15 означает нитрильную, этильную, н-пропильную, изопропильную или циклогексильную группу и R16 означает атом водорода. Наиболее предпочтительной группой формулы -С(=NR15)NRl6- является цепь, выраженная формулой -C(=NCN)NH-.
Значения соответствующих групп, приведенных в определении X, описаны выше. (1) Предпочтительными значениями Х являются простая связь, атом кислорода, атом серы, C1-6 алкиленовая цепь, которая может быть замещена, группа формулы -NR2- (где R2 означает атом водорода, C1-6 алкильную группу, С3-8 циклоалкильную группу, низшую ацильную группу или C1-6 алкилсульфонильную группу, которая может быть замещена), -СО-, -NR10-W3-O- (где R10 означает атом водорода, C1-6 алкильную группу, С3-8 циклоалкильную группу, низшую ацильную группу или C1-6 алкилсульфонильную группу, которая может быть замещена, и W3 означает C1-6 алкиленовую группу, которая может быть замещена) и -NH-SO2-. (2) Более предпочтительными значениями Х являются атом кислорода, C1-6 алкиленовая цепь, которая может быть замещена, группа формулы -NR2- (где R2 означает атом водорода, C1-6 алкильную группу, С3-8 циклоалкильную группу, низшую ацильную группу или C1-6 алкилсульфонильную группу, которая может быть замещена), -СО-, -NR10-W3-О- (где R10 означает атом водорода или C1-6 алкильную группу, С3-8 циклоалкильную группу, низшую ацильную группу или C1-6 алкилсульфонильную группу, которая может быть замещена; и W3 означает C1-6 алкиленовую группу, которая может быть замещена) и -NH-SO2-. (3) Еще более предпочтительными значениями Х являются атом кислорода, C1-6 алкиленовая цепь, которая может быть замещена, группа формулы -NR2- (где R2 означает атом водорода, C1-6 алкильную группу, С3-8 циклоалкильную группу, низшую ацильную группу или C1-6 алкилсульфонильную группу, которая может быть замещена), -СО- и -NH-SO2-. (4) Наиболее предпочтительным значением Х является атом кислорода или группа формулы -NR2- (где R2 означает атом водорода, C1-6 алкильную группу, С3-8 циклоалкильную группу, низшую ацильную группу или C1-6 алкилсульфонильную группу, которая может быть замещена).
Значения R1
Группа, обозначенная как R1 в приведенной выше формуле (I), представляет (1) атом водорода, (2) атом галогена, (3) гидроксильную группу, (4) C1-6 алкильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы, (5) С2-6 алкенильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы, (6) С2-6 алкинильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы, (7) С3-8 циклоалкильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы, (9) C1-6 алкокси-C1-6 алкильную группу, (10) амино-C1-6 алкильную группу, в которой атом азота может быть замещен, (11) группу формулы -N(R11)R12- (где R11 и R12 имеют одинаковые или разные значения и представляют атом водорода или C1-6 алкильную группу), (12) аралкильную группу, (13) морфолинильную группу, (14) тиоморфолинильную группу, (15) пиперидильную группу, (16) пирролидинильную группу или (17) пиперазинильную группу.
Вышеуказанный "атом галогена" предпочтительно означает атом фтора, хлора и брома, более предпочтительно атом фтора и атом хлора.
"C1-6 алкильная группа" в определении R1 предпочтительно включает метильную, этильную, н-пропильную, изопропильную, н-бутильную, изобутильную, втор-бутильную, трет-бутильную и другие группы, более предпочтительно метильную, этильную, н-пропильную и изопропильную группу, еще предпочтительнее н-пропильную и изопропильную группу и наиболее предпочтительно изопропильную группу.
"С2-6 алкенильная группа" в определении R1 предпочтительно включает винильную, аллильную, 1-пропенильную, изопропенильную, 1-бутен-1-ильную, 1-бутен-2-ильную, 1-бутен-3-ильную, 2-бутен-1-ильную, 2-бутен-2-ильную и другие группы, более предпочтительно винильную, аллильную, изопропенильную и другие группы.
Предпочтительными примерами "С2-6 алкинильной группы" в определении R1 являются этинильная, 1-пропинильная, 2-пропинильная, бутинильная, пентинильная, гексинильная и другие группы.
Предпочтительными примерами "С3-8 циклоалкильной группы" в определении R1 являются циклопропанильная, циклобутанильная, циклопентанильная, циклогексанильная и другие группы.
Предпочтительными примерами "C1-6 алкокси-C1-6 алкильной группы" в определении R1 являются C1-6 алкильная группа, замещенная группой, имеющей значения, указанные выше для C1-6 алкоксильной группы, и предпочтительной группой является метоксиметильная, этоксиметильная, 1-метоксиэтильная, 2-метоксиэтильная, 1-этоксиэтильная, 2-метокси-н-пропильная, 3-метокси-н-пропильная, 2-(н-пропокси)этильная и другие группы.
Предпочтительными примерами "C1-6 алкильной группы, замещенной нитрильной группой" в определении R1 являются цианометильная, 2-цианоэтильная, 3-циано-н-пропильная, 2-цианоизопропильная, 2-циано-н-бутильная, 2-циано-втор-бутильная, 2-циано-трет-бутильная, 2-циано-н-пентильная, 3-циано-н-гексильная и другие группы.
Предпочтительными примерами "амино-C1-6 алкильной группы, в которой атом азота может быть замещен" в определении R1 являются аминометильная, метиламинометильная, диметиламинометильная, этиламинометильная, диэтиламинометильная, метилэтиламинометильная, ацетамидометильная, пирролидинилметильная, 2-пиразолинилэтильная, 1-пиперидилэтильная, пиперазинилметильная и другие группы.
Предпочтительными примерами "аралкильной группы" в определении R1 являются бензильная, фенетильная, фенилпропильная, нафтилметильная, нафтилэтильная, нафтилпропильная и другие группы.
Значения соответствующих групп, приведенных выше в определении R1, описаны выше и предпочтительными значениями R1 являются атом водорода, атом галогена, гидроксильная группа, C1-6алкильная группа, C2-6 алкенильная группа, С2-6 алкинильная группа, С3-8 циклоалкильная группа, гидроксил-C1-6алкильная группа, C1-6 алкокси-C1-6 алкильная группа, циано-C1-6 алкильная группа и C1-6 алкильная группа, замещенная атомом галогена. Более предпочтительными значениями R1 являются атом галогена, гидроксильная группа, C1-6 алкильная группа, C2-6 алкенильная группа и C2-6 алкинильная группа, еще более предпочтительным значением R1 является C1-6 алкильная группа (в частности, метильная, этильная, н-пропильная, изопропильная группы).
Значения D1, D2, W1 и W2
В соединении вышеуказанной формулы (I) по настоящему изобретению D1, D2, W1 и W2 имеют одинаковые или разные значения и соответственно представляют (1) простую связь или (2) необязательно замещенную C1-6 алкиленовую цепь.
Предпочтительными значениями "C1-6 алкиленовой цепи" в вышеуказанной "C1-6 алкиленовой цепи, которая может быть замещена" являются метиленовая, этиленовая, этилиденовая, триметиленовая, изопропилиденовая, пропиленовая, тетраметиленовая, 1,2-бутиленовая, 1,3-бутиленовая, 2,3-бутиленовая, изобутиленовая и другие цепи.
Далее, цепь, асимметричная в отношении левой и правой ориентации, также входит в указанные определения C1-6 алкиленовых цепей, но в этом случае направление образования связи не ограничено, и в определение "C1-6 алкиленовой цепи" входят оба направления образования связи.
Предпочтительным "заместителем" в вышеуказанной "C1-6 алкиленовой цепи, которая может быть замещена" является (i) гидроксильная группа, (ii) атом галогена (например, атом фтора, хлора, брома, иода и другие), (iii) нитрильная группа, (iv) C1-6 алкильная группа (например, метильная, этильная, н-пропильная, изопропильная, н-бутильная, трет-бутильная и другие группы), (v) C2-6 алкенильная группа (например, винильная, аллильная, 1-пропенильная, 2-пропенильная, изопропенильная, 2-метил-1-пропенильная, 3-метил-1-пропенильная, 2-метил-2-пропенильная и другие группы), (vi) C1-6 алкоксильная группа (например, метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси и другие группы) и т.д.
Далее, когда "заместителем" является C1-6 алкильная группа и/или C2-6 алкенильная группа, указанные заместители могут быть связаны друг с другом с образованием 5-14-членного кольца, и в случае W1 и W2 указанные заместители могут быть связаны с кольцом В или Х с образованием 5-14-членного кольца.
В предпочтительном случае D1, D2, W1 и W2 имеют одинаковые или разные значения и представляют (1) простую связь или (2) метиленовую, этиленовую, этилиденовую, триметиленовую, изопропилиденовую, пропиленовую, тетраметиленовую, 1,2-бутиленовую, 1,3-бутиленовую, 2,3-бутиленовую, изобутиленовую и другие цепи, которые могут быть соответственно замещены одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы.
Выше описаны соответствующие значения Е, X, D1, D2, W1 и W2. Предпочтительными значениями частичной структуры -D1-E-D2- являются этиленовая цепь (-СН2-СН2-), этилиденовая цепь (-СН(СН3)-), триметиленовая цепь (-(СН2)3-), изопропилиденовая цепь (-СН(СН3)2), пропиленовая цепь (-СН(СН3)СН2-), тетраметиленовая цепь (-(СН2)4), 1,2-бутиленовая цепь (-СН(С2Н5)СН2-), 1,3-бутиленовая цепь (-СН(СН3)СН2СН2-), 2,3-бутиленовая цепь (-СН(СН3)СН(СН3)-), изобутиленовая цепь (-СН(СН3)3СН2-) и другие. Более предпочтительными значениями являются триметиленовая цепь (-(СН2)3-), изопропилиденовая цепь (-СН(СН3)2-), пропиленовая цепь (-СН(СН3)СН2-), тетраметиленовая цепь (-(СН2)4-), 1,2-бутиленовая цепь (-СН(С2Н5)СН2-) и другие, особенно предпочтительные значения включают тетраметиленовую цепь (-(СН2)3-) и другие. Предпочтительными значениями частичной структуры -W1-X-W2- являются простая связь и цепь формулы -СН2-СН2-O-, -CH2-CH2-NR2, -(СН2)3-O- или -(CH2)3-NR2-.
Варианты соединения вышеуказанной формулы (I) по настоящему изобретению не имеют конкретных ограничений, и специалист в данной области может легко объединить группы, приведенные выше в определениях Аr, кольца А, кольца В, Е, X, R1, D1, D2, W1 и W2, и получить все соединения, входящие в объем данного изобретения. К более предпочтительным вариантам относится случай, когда Аr означает необязательно замещенную 5-14-членную ароматическую гетероциклическую группу; кольцо А означает пиперазиновое кольцо, пиперидиновое кольцо или пирролидиновое кольцо; кольцо В означает C6-14 ароматическую углеводородную группу или 5-14-членную ароматическую гетероциклическую группу, которая может быть замещена; Е означает простую связь; Х означает простую связь, атом кислорода, необязательно замещенную C1-6 алкиленовую группу или группу формулы -NR2- (где R2 имеет указанные выше значения). К другому предпочтительному варианту относится соединение формулы:
или
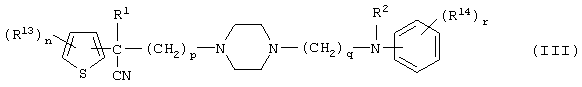
(где соответствующие символы имеют указанные выше значения), его соль или гидрат.
Соединения, полученные в описанных ниже примерах, относятся к предпочтительным вариантам осуществления настоящего изобретения, ниже приведены типичные соединения:
4-[(4-циано-5-метил-4-фенил)гексил]-N-(4-фторфенил)-N’-(2-метилпропил)-1(2Н)-пиразинкарбоксиимидамид;
1-изопропил-4-[4-(1-изобутил-1N-бензо[d]имидазол-2-ил)пиперазино]-1-фенилбутилцианид;
1-[4-циано-5-метил-4-(5-циано-2-тиенил)гексил]-4-[2-(3-цианофенокси)этил]пиперазин;
1-[4-циано-5-метил-4-(2-тиенил)гексил]-4-[2-(3-цианофенокси) этил]пиперазин;
1-[4-циано-5-метил-4-(5-циано-2-тиенил)гексил]-4-[3-(5-циано-2-тиенил)пропил]пиперазин;
1-[4-циано-5-метил-4-(3-тиенил)гексил]-4-[2-(3-цианофенокси)этил]пиперазин;
1-{4-циано-5-метил-4-[4-(2-циано)тиенил]гексил}-4-[2-(3-цианофенокси)этил]пиперазин;
1-[(4-циано-5-метил-4-фенил)гексил]-4-[(2-бензоксазолил)амино]пиперидин;
1-[4-циано-4-(5-циано-2-тиенил)-5-метилгексил]-(3S)-3-[N-(2-цианоэтил)-N-бензиламино]пирролидин;
1-[4-циано-4-(5-циано-2-тиенил)-5-метилгексил]-(3R)-3-[N-(2-цианоэтил)-N-бензиламино]пирролидин;
1-[(4-циано-5-метил-4-фенил)гексил]-4-(бензотиазолил)пиперазин;
1-[(4-циано-5-метил-4-фенил)гексил]-4-[2-(6-метокси)бензотиазолил]пиперазин;
1-[(4-циано-5-метил-4-фенил)гексил]-4-(2-бензоксазолил)пиперазин;
1-[(4-циано-5-метил-4-фенил)гексил]-4-(2-хинолинил)пиперазин;
4-[4-(1-метил-1Н-бензо[d]имидазол-2-ил)-1,4-диазепан-1-ил]-1-изопропил-1-фенилбутилцианид;
4-[4-(1-этил-1Н-бензо[d]имидазол-2-ил)-1,4-диазепан-1-ил]-1-изопропил-1-фенилбутилцианид;
этил-4-(4-циано-5-метил-4-фенилгексил)-1-[2-(4-фторфенокси)этил]-2-пиперазинкарбоксилат;
1-[(2-оксо-1,2-дигидро-3-хинолил)метил]-4-[(4-циано-5-метил-4-фенил)гексил]пиперидин;
4-[(4-циано-5-метил-4-фенил)гексил]-1-{[[2-метансульфониламино]фенил]метил}пиперазин;
4-[(4-циано-5-метил-4-фенил)гексил]-1-{[[2-метансульфониламино]фенил]метил}пиперидин;
{1-[4-циано-5-метил-5-(2-тионил)гексил]пиперазинил}амид (S)-3-фенил-2-аминопропановой кислоты;
4-[4-(4-фенилпиперидинил)пиперидинил]-1-изопропил-1-фенилбутилцианид;
4-[4-(4-циано-4-фенилпиперидинил)пиперидинил]-1-изопропил-1-фенилбутилцианид и
4-[4-(4-бензилпиперидинил)пиперидинил]-1-изопропил-1-фенилбутилцианид.
Соединение вышеуказанной формулы (I) по настоящему изобретению, его соль или гидрат можно получить известными способами изготовления или способами, описанными в данной заявке. В качестве известных способов получения указываются, например, способ получения, описанный в JP-A 2000-169462 (способ получения, описанный в абзацах "0054"-"0065" публикации), и способ получения, описанный в JP-A 2000-12207, 2000-12208 и 2000-12209.
Исходные соединения, используемые для получения соединения (I), могут быть в форме соли или гидрата и не имеют каких-либо ограничений, если только такая форма соединения не препятствует взаимодействию. При получении соединения (I) по настоящему изобретению в свободной форме его можно превратить известным способом в соль, образуемую соединением (I). Разные изомеры (например, геометрический изомер, оптические изомеры на основе асимметричного атома азота, стереоизомеры, таутомеры и тому подобные), получаемые для соединения (I) по настоящему изобретению, можно очистить и выделить обычными методами разделения (например, перекристаллизацией, методом на основе соли диастереомера, методом ферментативного разделения, разными хроматографическими методами и тому подобными).
Термин "соль" в описании изобретения к настоящей заявке не имеет каких-либо конкретных ограничений, если только она образована с соединением по настоящему изобретению и приемлема в фармакологическом отношении; такой солью предпочтительно является соль галогенводородной кислоты (например, гидрофторид, гидрохлорид, гидробромид, гидроиодид и тому подобные), соль неорганической кислоты (например, сульфат, нитрат, перхлорат, фосфат, карбонат, бикарбонат и тому подобные), соль органической карбоновой кислоты (например, соль уксусной кислоты, соль трифторуксусной кислоты, соль щавелевой кислоты, соль малеиновой кислоты, соль винной кислоты, соль фумаровой кислоты, соль лимонной кислоты и тому подобные), соль органической сульфоновой кислоты (например, метансульфонат, трифторметансульфонат, этансульфонат, бензолсульфонат, толуолсульфонат, камфорсульфонат и тому подобные), соль аминокислоты (например, соль аспарагиновой кислоты, соль глутаминовой кислоты и тому подобные), соль четвертичного аммония, соль щелочного металла (например, соль натрия, соль калия и тому подобные), соль щелочно-земельного металла (например, соль магния, соль кальция и тому подобные) и другие. Более предпочтительными являются гидрохлорид, соль щавелевой кислоты, соль трифторуксусной кислоты и тому подобные.
Соединение вышеуказанной формулы (I), его соль или гидрат можно изготовить в виде лекарственных препаратов, к которым относятся таблетки, порошки, гранулы, мелкие гранулы, таблетки с покрытием, капсулы, сиропы, пастилки, аэрозоли, суппозитории, инъекционные растворы, пасты, глазные мази, глазные капли, капли в нос, ушные капли, припарки, лосьоны и тому подобные. При изготовлении лекарственных препаратов обычно используют наполнители, связывающие вещества, дезинтеграторы, смазывающие вещества, красители, ароматизаторы и при необходимости стабилизаторы, эмульгаторы, ускорители всасывания, поверхностно-активные вещества, регуляторы рН, антисептики, антиоксиданты и тому подобные. Ингредиенты, обычно используемые в качестве исходных веществ в фармацевтических препаратах, можно ввести в составы обычными способами. В качестве таких ингредиентов можно привести, например, животные и растительные масла, такие как соевое масло, твердый жир и синтетический глицерид; углеводороды, такие как жидкий парафин, сквалан и твердый парафин; сложноэфирные масла, такие как октилдодецилмиристат и изопропилмиристат; высшие спирты, такие как цетостеариловый спирт и бегеновый спирт; силиконовые смолы; силиконовые масла; поверхностно-активные вещества, такие как сложный эфир жирной кислоты и полиоксиэтилена, сложный эфир жирной кислоты и сорбитана, сложный эфир жирной кислоты и глицерина, сложный эфир жирной кислоты и полиоксиэтиленсорбитана, отвержденное полиоксиэтиленом касторовое масло и блок-сополимер полиоксиэтилена и полиоксипропилена; водорастворимые полимеры, такие как гидроксиэтилцеллюлоза, полиакриловая кислота, карбоксивиниловый полимер, полиэтиленгликоль, поли(винилпирролидон) и метилцеллюлоза; низшие спирты, такие как этанол и изопропанол; многоатомные спирты, такие как глицерин, пропиленгликоль, дипропиленгликоль и сорбит; сахара, такие как глюкоза и декстроза; неорганические порошки, такие как кремниевый ангидрид, алюмосиликат магния и силикат алюминия; очищенную воду и тому подобное. В качестве наполнителей обычно используют лактозу, кукурузный крахмал, белый сахар, декстрозу, маннит, сорбит, кристаллическую целлюлозу, диоксид кремния и тому подобные; в качестве связывающих веществ используют поливиниловый спирт, поливинилэфир, метилцеллюлозу, этилцеллюлозу, аравийскую камедь, трагакант, желатин, шеллак, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилпирролидон, блок-сополимер полипропиленгликоля и полиоксиэтилена, меглумин, цитрат кальция, декстрин, пектин и тому подобные; в качестве дезинтеграторов используют крахмал, агар, порошкованный желатин, кристаллическую целлюлозу, карбонат кальция, бикарбонат натрия, цитрат кальция, декстрин, пектин, кальцийкарбоксиметилцеллюлозу и тому подобные; в качестве смазывающих веществ используют стеарат магния, тальк, полиэтиленгликоль, диоксид кремния, отвержденное растительное масло и тому подобные; в качестве красителей используют любые пигменты, пригодные для введения в фармацевтические композиции; в качестве ароматизаторов используют порошок какао, ментол, ароматический порошок, масло перечной мяты, борнеол, коричный порошок и тому подобные; в качестве антиоксидантов используют аскорбиновую кислоту, α-токоферол и подобные вещества, которые признаны годными для введения в фармацевтические композиции.
Например, (1) препараты для перорального введения получают в виде порошков, мелких гранул, крупных гранул, таблеток, таблеток с покрытием, капсул и т.д. известным способом, смешивая соединение по настоящему изобретению, его соль или гидрат с наполнителями и добавляя, при необходимости, связывающие вещества, дезинтеграторы, смазывающие вещества, красители, ароматизаторы и т.д. (2) При изготовлении таблеток и гранул на них наносят покрытие из сахара и желатина и, при необходимости, дополнительное подходящее покрытие. (3) При изготовлении сиропов, инъекционных растворов, глазных капель и подобных составов используют регуляторы рН, растворяющие вещества, средства для получения изотонического раствора и тому подобные и, при необходимости, добавляют вещества, способствующие растворению, стабилизаторы, буферы, суспендирующие средства, антиоксиданты и тому подобные, после чего получают желаемую композицию известным способом. В случае препаратов для инъекций их можно получить сушкой вымораживанием и использовать для внутривенных, подкожных и внутримышечных инъекций. Предпочтительными примерами суспендирующих агентов являются метилцеллюлоза, полисорбат 80, гидроксиэтилцеллюлоза, аравийская камедь, порошкованный трагакант, натрийкарбоксиметилцеллюлоза, монолаурат полиоксиэтиленсорбитана и тому подобные; предпочтительными примерами растворяющих веществ являются отвержденное полиоксиэтиленом касторовое масло, полисорбат 80, никотинамид, монолаурат полиоксиэтиленсорбитана и тому подобные; предпочтительными примерами стабилизаторов являются сульфит натрия, метасульфит натрия, диэтиловый эфир и тому подобные; предпочтительными примерами консервантов являются метил-п-оксибензоат, этил-п-оксибензоат, сорбиновая кислота, фенол, крезол, хлоркрезол и тому подобные. (4) При изготовлении препаратов для наружного применения не предусмотрено никаких ограничений, и такие препараты могут быть получены обычным способом. В качестве исходных веществ для основного лекарственного средства можно использовать различные вещества, обычно применяемые в фармакологии, квазилекарственные средства, косметические средства и тому подобные. Например, в фармацевтическую композицию можно добавлять такие исходные вещества, как животные и растительные масла, минеральное масло, эфирное масло, воски, высшие спирты, жирные кислоты, силиконовое масло, поверхностно-активные вещества, фосфатиды, спирты, многоатомные спирты, водорастворимые полимеры, минералы класса глин, очищенную воду и подобные вещества. В зависимости от предъявляемых требований может быть добавлен регулятор рН, антиоксидант, хелатообразователь, антисептик и фунгицид, краситель, ароматизатор и подобные вещества. Кроме того, при необходимости в фармацевтическую композицию можно вводить ингредиенты, оказывающие дифференциальное отвлекающее действие, средства, ускоряющие кровоток, антибактериальные средства, противовоспалительные средства, активаторы клеток, витамины, аминокислоты, увлажнители, кератолитические средства и тому подобные. Доза фармацевтических средств по настоящему изобретению может изменяться в зависимости от тяжести симптомов, возраста, пола, массы тела, способа введения, типа соли, разной восприимчивости к лекарственному средству, способа воздействия, но для взрослого человека при пероральном введении однократная или многократная доза обычно составляет от около 30 мкг до 1000 мг в сутки, предпочтительно от 100 мкг до 500 мг и более предпочтительно от 100 мкг до 100 мг. Для введения в виде инъекций однократная или многократная доза фармацевтического препарата составляет примерно 1-3000 мкг/кг, предпочтительно 3-1000 мкг/кг.
Соединение вышеуказанной формулы (I) по настоящему изобретению, его соль или гидрат полезны в качестве антагонистов кальция, в частности нейронизбирательных антагонистов кальция. Соединение по настоящему изобретению является новым соединением, ингибирующим кальциевый канал P/Q-типа и N-типа, и может быть использовано в качестве средства для лечения или профилактики заболевания, восприимчивого к ингибированию кальциевого канала P/Q-типа и N-типа. Кроме того, соединение формулы (I) по настоящему изобретению, его соль или гидрат оказывают крайне незначительное воздействие на клетки по сравнению с известными антагонистами и являются безопасными антагонистами кальция с пониженной токсичностью. Таким образом, соединение по настоящему изобретению, его соль или гидрат является полезными в качестве веществ, препятствующих гибели нервных клеток и уменьшающих раздражение нервных клеток головного мозга, средств для лечения или профилактики нервных заболеваний и аналгетиков. В частности, указанные соединения пригодны в качестве средств для лечения, профилактики или подавления симптомов острого ишемического инсульта, кровоизлияния в мозг, инфаркта головного мозга, травмы головы, гибели нервных клеток головного мозга, болезни Альцгеймера, болезни Паркинсона, бокового амиотрофического склероза, болезни Хантингтона, метаболического расстройства кровообращения головного мозга, нарушения функции головного мозга, болевого синдрома, спазмов, шизофрении, мигрени, эпилепсии, маниакально-депрессивного синдрома, дегенеративных нервных заболеваний, ишемии головного мозга, слабоумия, вызванного СПИДом, отека мозга, состояния страха, диабетической невропатии, слабоумия вследствие поражения сосудов головного мозга, рассеянного склероза и т.д.
Краткое описание чертежей
На фиг.1 показан график ВЭЖХ, полученный в справочном примере 97.
На фиг.2 показан график ВЭЖХ, полученный в справочных примерах 100 и 101; спектр №1, изображенный на данном графике, получен в справочном примере 100 и спектр №2 получен в справочном примере 101.
На фиг.3 показан график ВЭЖХ, полученный в справочном примере 103.
ПРИМЕРЫ
Описанные ниже примеры являются предпочтительными вариантами осуществления настоящего изобретения, но приведенные справочные примеры, (рабочие) примеры (способы получения фармацевтически приемлемой соли или гидрата и фармацевтической композиции, содержащей указанные вещества) и испытательные примеры носят только иллюстративный характер, и соединения по настоящему изобретению не ограничиваются рассмотренными примерами. Специалисты в данной области могут вносить разные изменения не только в нижеследующие примеры, но и в объем, охватываемый притязаниями в настоящей заявке на патент с целью максимально широкого осуществления данного изобретения, при этом все подобные изменения входят в объем формулы изобретения, представленной в описании изобретения к настоящей заявке на патент.
Символ Z, использованный в справочных или рабочих примерах, означает бензилоксикарбонильную группу и ВЭЖХ означает высокоэффективную жидкостную хроматографию.
Справочный пример 1
2-[(4-Циано-5-метил-4-фенил)гексил]-5-бензил-2,5-диазабицикло[2,2,1]гептан
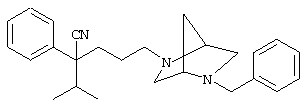
Указанное в заголовке соединение получают в виде бледно-коричневого масла способом, описанным в примере 15 (15%).
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,04-1,16 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,45-1,57 (м, 1Н), 1,64 (дд, J=9,6 Гц, J=33,6 Гц, 2Н), 1,94 (дт, J=4,4 Гц, J=12,4 Гц, 1Н), 2,07-2,23 (м, 2Н), 2,30-2,38 (м, 1Н), 2,50-2,71 (м, 5Н), 3,19 (д, J=14 Гц, 2Н), 3,66 (кв, J=14 Гц, 2Н), 7,19-7,40 (м, 10Н).
Справочный пример 2
3-Метил-2-(2-нафтил)бутиронитрил
3,00 г (17,9 ммоль) 2-нафтилацетонитрила растворяют в 10 мл диметилсульфоксида и поочередно добавляют 2,43 г (19,7 ммоль) 2-бромпропана, 330 мг (0,90 ммоль, катализатор) иодида тетра-н-бутиламмония и 10 мл 50% гидроксида калия. После окончания реакции добавляют насыщенный раствор соли и смесь экстрагируют эфиром. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 150 г силикагеля (этилацетат:гексан = 1:10), получая при этом 2,42 г (11,6 ммоль, 64,6%) указанного в заголовке соединения в виде желтого масла.
1Н-ЯМР (400 МГц, CDCl3) δ 1,07 (д, J=6,8 Гц, 3Н), 1,11 (д, J=6,8 Гц, 3Н), 2,10-2,30 (м, 1Н), 3,84 (д, J=3,84 Гц, 1Н), 7,38 (дд, J=1,8 Гц, 8,6 Гц, 1Н), 7,48-7,55 (м, 2Н), 7,79-7,88 (м, 4Н).
Справочный пример 3
4-Циано-5-метил-4-(2-нафтил)гексанол
1,00 г (4,78 ммоль) 3-метил-2-(2-нафтил)бутиронитрила растворяют в 20 мл диметилформамида, добавляют 191 мг (4,78 ммоль, 60 мас.%) гидрида натрия и нагревают смесь. Через 30 минут смесь охлаждают до комнатной температуры и добавляют 0,93 мл (4,00 ммоль) (3-бромпропокси)-трет-бутилдиметилсилана. После окончания реакции добавляют насыщенный раствор соли и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 50 г силикагеля (этилацетат:гексан = 1:18) и получают 1,40 г смеси целевого продукта, исходного вещества и загрязняющих примесей. Полученную смесь используют при осуществлении следующей реакции без очистки. А именно, 1,40 г вышеуказанного неочищенного 4-циано-5-метил-5-(2-нафтил)гексанокси-трет-бутилдиметилсилана растворяют в 20 мл тетрагидрофурана и добавляют 5 мл (5 ммоль) фторида тетрааммония. После окончания реакции добавляют насыщенный раствор соли и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида аммония и насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 50 г силикагеля (этилацетат:гексан = 1:4), получая при этом 590 мг (2,21 ммоль, 46,2%, 2 стадии) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 0,80 (д, J=6,8 Гц, 3Н), 1,10-1,30 (м, 1Н), 1,27 (д, J=6,8 Гц, 3Н), 1,57-1,69 (м, 1Н), 2,02-2,12 (м, 1Н), 2,20-2,37 (м, 1Н), 3,58 (т, J=6,2 Гц, 2Н), 3,78 (дд, J=2,0 Гц, 8,4 Гц, 1Н), 7,48-7,56 (м, 2Н), 7,84-7,91 (м, 3Н), 7,95 (шир.д-с, 1Н).
Справочный пример 4
1-[(4-Циано-5-метил-4-фенил)гексил]-3-трет-бутоксикарбониламинопирролидин
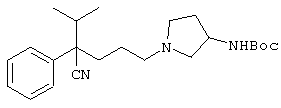
2,76 г (8,44 ммоль) 4-циано-5-метил-4-фенилгексилиодида растворяют в 50,0 мл ацетонитрила, добавляют 1,29 мл (9,28 ммоль) триэтиламина и 1,88 г (10,1 ммоль) 3-трет-бутоксикарбониламинопирролидина и нагревают смесь до 60°С. После окончания реакции смесь распределяют между этилацетатом и насыщенным раствором соли. Органический слой сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 50 г силикагеля Cromatorex NH (этилацетат:гексан = 2:1), получая при этом 2,97 г (7,76 ммоль, 91,3%) указанного в заголовке соединения в виде бледно-желтого сиропа.
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,21 (д, J=6,8 Гц, 3Н), 1,05-1,25 (м, 1Н), 1,43 (с, 9Н), 1,50-1,65 (м, 2Н), 1,88-2,00 (м, 1Н), 2,00-2,28 (м, 4Н), 2,28-2,60 (м, 4Н), 2,65-2,70 (м, 1Н), 4,05-4,20 (шир.д-с, 1Н), 4,82-4,95 (шир.д-с, 1Н), 7,26-7,59 (м, 5Н).
Справочный пример 5
1-[(4-Циано-5-метил-4-фенил)гексил]-3-аминопирролидин
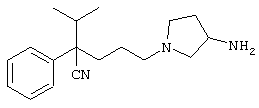
2,36 г (6,12 ммоль) 1-[(4-циано-5-метил-4-фенил)гексил]-3-трет-бутоксикарбониламинопирролидина растворяют в смешанном растворе 5 мл тетрагидрофурана и 10 мл метанола и добавляют 4 н. раствор хлороводорода в этилацетате. После окончания реакции смесь подщелачивают 2 н. водным раствором гидроксида натрия и экстрагируют хлороформом. Органический слой сушат над сульфатом магния и упаривают, получая при этом 1,66 г (5,82 ммоль, 95,1%, оранжевый сироп) сырого продукта.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,4 Гц, 3Н), 1,20 (д, J=6,8 Гц, 3Н), 1,08-1,24 (м, 1Н), 1,42-1,62 (м, 2Н), 1,84-2,00 (м, 3Н), 2,08-2,28 (м, 4Н), 2,32-2,48 (м, 3Н), 2,58-2,67 (м, 2Н), 3,42-3,51 (м, 1Н), 7,26-7,40 (м, 5Н).
Справочный пример 6
1-[(4-Циано-5-метил-4-фенил)гексил]-3-[N-(2-цианоэтил)амино]пирролидин
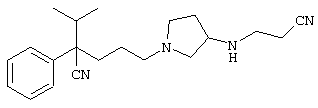
700 мг (2,45 ммоль) 1-[(4-циано-5-метил-4-фенил)гексил]-3-аминопирролидина растворяют в 15 мл метанола, добавляют 0,19 мл (2,85 ммоль) акрилонитрила и нагревают смесь с обратным холодильником. После окончания реакции смесь упаривают и получают сырой продукт. Сырой продукт обрабатывают 20 г силикагеля Cromatorex NH (этилацетат, 100%), получая при этом 775 мг (2,29 ммоль, 93,5%) указанного в заголовке соединения в виде оранжевого сиропа.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,07-1,24 (м, 1Н), 1,20 (д, J=6,4 Гц, 3Н), 1,08-1,24 (м, 1Н), 1,46-1,62 (м, 2Н), 1,86-1,96 (м, 1Н), 2,04-2,24 (м, 4Н), 2,28-2,46 (м, 4Н), 2,46-2,62 (м, 2Н), 2,49 (т, J=6,8 Гц, 2Н), 2,85 (т, J=6,8 Гц, 2Н), 3,22-3,30 (м, 1Н), 7,26-7,40 (м, 5Н).
Справочный пример 7
3-Фторфеноксиацетальдегид
2,00 г (17,8 ммоль) м-фторфенола растворяют в 50 мл диметилформамида, поочередно добавляют 785 мг (19,6 ммоль, 60 мас.%, минерал) гидрида натрия и 3,21 мл (21,3 ммоль) диэтилацеталя бромацетальдегида и нагревают смесь до 60°С. После окончания реакции добавляют насыщенный раствор соли и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 105 г силикагеля Cromatorex NH (этилацетат:гексан = 1:40), получая при этом 3,17 г (13,9 ммоль, 78,1%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,25 (т, J=7,0 Гц, 6Н), 3,55-3,82 (м, 4Н), 3,99 (д, J=5,0 Гц, 2Н), 4,82 (т, J=5,0 Гц, 1Н), 6,61-6,72 (м, 3Н), 7,17-7,25 (м, 1Н).
1,68 г (7,38 ммоль) полученного выше ацеталя растворяют в 30 мл ацетона и 20 мл 2,5 н. раствора хлористоводородной кислоты и смесь нагревают. После окончания реакции смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая при этом 800 мг сырого продукта, который содержит приведенное ниже целевое соединение. Сырой продукт подвергают вышеуказанной реакции без очистки.
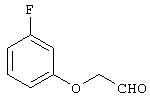
Справочный пример 8
1-Бензил-3-[N-(2-цианоэтил)амино]пирролидин
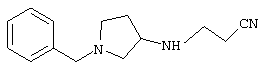
4,00 г (22,7 ммоль) 1-бензил-3-аминопирролидина растворяют в 70 мл метанола, добавляют 1,49 мл (22,7 ммоль) акрилонитрила и нагревают смесь до 70°С. После окончания реакции реакционный раствор упаривают и полученный сырой продукт обрабатывают 100 г силикагеля Cromatorex NH (этилацетат, 100%), получая при этом 4,60 г (20,1 ммоль, 88,4%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, СDСl3) δ 1,54-1,66 (м, 1H), 2,10-2,22 (м, 1Н), 2,40-2,60 (м, 2Н), 2,49 (т, J=6,8 Гц, 2Н), 2,67-2,78 (м, 2Н), 2,86 (т, J=6,8 Гц, 2Н), 3,30-3,38 (м, 1Н), 3,57-3,73 (м, 2Н), 7,22-7,36 (м, 5Н).
Справочный пример 9
1-Бензил-3-[N-(2-цианоэтил)-N-{2-(4-цианофенокси)этил}амино]пирролидин
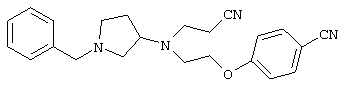
2,03 г (8,87 ммоль) 1-бензил-3-[(N-(2-цианоэтил)амино]пирролидина растворяют в 50 мл дихлорэтана и поочередно добавляют 1,30 г (8,06 ммоль) отдельно синтезированного 4-цианофеноксиацетальдегида, 1,02 мл (17,7 ммоль) уксусной кислоты и 2,56 г (12,1 ммоль) триацетоксиборогидрида натрия. После окончания реакции смесь подщелачивают до основной реакции 2 н. водным раствором гидроксида натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 250 г силикагеля Cromatorex NH (этилацетат:гексан = 2:3), получая при этом 2,39 г (6,38 ммоль, 79,2%) указанного в заголовке соединения в виде желтого сиропа.
1H-ЯМР (400 МГц, CDCl3) δ 1,70-1,84 (м, 1Н), 2,03-2,14 (м, 1H), 2,40-2,54 (м, 1Н), 2,47 (т, J=6,8 Гц, 2Н), 2,55-2,68 (м, 2Н), 2,76-2,88 (м, 1H), 2,91-3,09 (м, 4Н), 3,48-3,68 (м, 2Н), 3,64-3,74 (м, 1H), 4,03 (т, J=5,6 Гц, 2Н), 6,9 (т, J=9,2 Гц, 2Н), 7,24-7,40 (м, 5Н), 7,57 (т, J=9,2 Гц, 2Н).
Справочный пример 10
3-[N-(2-Цианоэтил)-N-{2-(4-цианофенокси)этил}амино]пирролидин
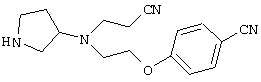
1-Бензил-3-[(N-(2-цианоэтил)-N-{2-(4-цианофенокси)этил}амино]пирролидин растворяют в дихлорэтане, добавляют АсеСl (0,84 мл, 7,66 ммоль) и нагревают смесь с обратным холодильником. Примерно через один час добавляют AceCl (0,12 мл) и продолжают нагревать смесь. После окончания реакции смесь упаривают. К остатку добавляют 30 мл метанола и затем нагревают с обратным холодильником. Через один час реакционный раствор упаривают. Остаток экстрагируют 2 н. раствором хлористоводородной кислоты, промывают эфиром и доводят до рН 11-12, добавляя 2 н. водный раствор гидроксида натрия. Смесь экстрагируют этилацетатом, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 50 г силикагеля Cromatorex NH (этилацетат:метанол 1:0-3:1), получая при этом 1,12 г (3,93 ммоль, 61,6%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,64-1,76 (м, 1H), 1,94-2,06 (м, 1H), 2,52 (т, J=6,8 Гц, 2Н), 2,56-2,70 (м, 2Н), 2,77-2,86 (м, 1H), 2,91-3,20 (м, 5Н), 3,36-3,51 (м, 1H), 4,08 (т, J=5,6 Гц, 2Н), 6,96 (т, J=9,2 Гц, 2Н), 7,60 (т, J=9,2 Гц, 2Н).
Справочный пример 11
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(метоксикарбонил)метил]пиперазин
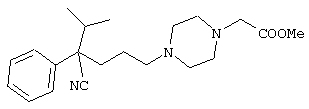
1,00 г (3,50 ммоль) 1-[(4-циано-5-метил-4-фенил)гексил]пиперазина и 0,54 мл (3,85 ммоль) триэтиламина растворяют в 25 мл тетрагидрофурана. При охлаждении льдом по каплям добавляют 0,35 мл (3,85 ммоль) метилбромацетата. После окончания реакции добавляют насыщенный раствор соли и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 50 г силикагеля Cromatorex NH (этилацетат:гексан = 1:2), получая при этом 1,22 г (3,41 ммоль, 97,5%) указанного в заголовке соединения в виде оранжевого масла.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,05-1,20 (м, 1Н), 1,20 (д, J=6,4 Гц, 3Н), 1,48-1,64 (м, 1Н), 1,84-1,93 (м, 1Н), 2,06-2,18 (м, 2Н), 2,24-2,31 (м, 2Н), 2,31-2,46 (м, 4Н), 2,46-2,60 (м, 4Н), 3,19 (с, 2Н), 3,71 (с, 3Н), 7,24-7,39 (м, 5Н).
Справочный пример 12
3-Фторбензамидоксим
К 200 мл раствора 10,0 г (82,6 ммоль) 3-фторбензцианида в этаноле добавляют 8,61 г (124 ммоль) гидрохлорида гидроксиламина и 22,8 г (165 ммоль) карбоната калия и нагревают смесь с обратным холодильником. После окончания реакции смесь упаривают. К остатку добавляют насыщенный раствор соли и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 100 г силикагеля (этилацетат:гексан = 1:2-1:4), получая при этом 8,00 г (51,9 ммоль, 62,8%) указанного в заголовке соединения в виде желтого твердого вещества.
1H-ЯМР (400 МГц, СDСl3) δ 4,75-4,85 (м, 2Н), 7,09-7,59 (м, 4Н).
Справочный пример 13
N-Z-4-Пиперидинэтанол
4,70 г (36,4 ммоль) 4-пиперидинэтанола и 10,0 г (72,8 ммоль) карбоната калия растворяют в эфире (50 мл) и воде (50 мл). При охлаждении льдом ZCl (4,44 мл, 25,0 ммоль) растворяют в 30 мл эфира и полученный раствор по каплям добавляют к реакционной смеси. Физические свойства получающегося в результате указанного в заголовке соединения приведены ниже. После окончания реакции добавляют насыщенный раствор соли и смесь экстрагируют простым эфиром. Органический слой промывают насыщенным раствором соли и насыщенным водным раствором хлорида аммония, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 100 г силикагеля (этилацетат:гексан = 1:2), получая при этом 5,48 г (20,8 ммоль, 57,2%) указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, СDСl3) δ 1,05-1,25 (м, 2Н), 1,40-1,75 (м, 5Н), 2,70-2,85 (м, 2Н), 3,71 (т, J=6,59 Гц, 2Н), 4,10-4,25 (м, 2Н), 5,12 (с, 2Н), 7,28-7,39 (м, 5Н).
Справочный пример 14
1-Бензилоксикарбонил-4-[2-(4-фторфенокси)этил]пиперидин
2,00 г (7,60 ммоль) N-Z-4-пиперидинэтанола, 1,70 г (15,2 ммоль) 4-фторфенола и 2,39 г (9,12 ммоль) трифенилфосфина растворяют в 50 мл тетрагидрофурана и смесь охлаждают льдом. Через 10 минут по каплям добавляют 1,44 мл (9,12 ммоль) диэтилазокарбоксилата и затем перемешивают смесь при комнатной температуре. После окончания реакции добавляют насыщенный раствор соли и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 100 г силикагеля (этилацетат:гексан = 1:3), получая при этом 2,19 г (6,12 ммоль, 80,6%) указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, СDСl3) δ 1,10-1,30 (м, 2Н), 1,65-1,80 (м, 5Н), 2,70-2,90 (м, 2Н), 3,96 (т, J=6,0 Гц, 2Н), 4,10-4,28 (м, 2Н), 5,13 (с, 2Н), 6,79-6,84 (м, 2Н), 6,93-6,99 (м, 2Н), 7,28-7,38 (м, 5Н).
Справочный пример 15
4-[2-(4-Фторфенокси)этил]пиперидин
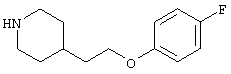
2,19 г (6,12 ммоль) 1-бензилоксикарбонил-4-[2-(4-фторфенокси) этил]пиперидина растворяют в 40 мл метанола, добавляют 300 мг 10% палладия на угле и заменяют атмосферу водородом. После окончания реакции смесь фильтруют и фильтрат упаривают, получая сырой продукт. Сырой продукт обрабатывают 50 г силикагеля Cromatorex NH (этилацетат:гексан = 1:3 - этилацетат:метанол = 6:1), получая при этом 1,30 г (5,82 ммоль, 95,1%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, СDСl3) δ 1,10-1,23 (м, 2Н), 1,60-1,77 (м, 5Н), 2,59 (дт, J=2,4 Гц, 12,2 Гц, 2Н), 3,96 (т, J=6,0 Гц, 2Н), 4,10-4,28 (м, 2Н), 5,13 (с, 2Н), 6,79-6,85 (м, 2Н), 6,92-6,99 (м, 2Н).
Справочный пример 16
1-Бензил-4-гидроксипропил-1,2,5,6-тетрагидропиридин
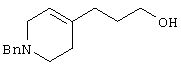
5,00 г (36,4 ммоль) 3-пиридинпропанола растворяют в 150 мл ацетонитрила, добавляют 4,55 мл (38,3 ммоль) бензилбромида и нагревают смесь при 70°С. Через 2 часа нагревание прекращают и смесь упаривают. Остаток растворяют в 100 мл метанола и смесь охлаждают до 0°С. Затем к смеси добавляют 4,12 г (109 ммоль) борогидрида натрия. После окончания реакции добавляют 50 мл воды и смесь упаривают. Остаток распределяют между этилацетатом и насыщенным раствором соли. Органический слой сушат над сульфатом магния и смесь упаривают, получая сырой продукт. Сырой продукт обрабатывают 150 г силикагеля Cromatorex NH (этилацетат:гексан = 1:6-1:1), получая при этом 6,48 г (28,0 ммоль, 77,0%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,65-1,74 (м, 2Н), 2,02-2,13 (м, 4Н), 2,55 (т, J=6,0 Гц, 2Н), 2,93-2,98 (м, 2Н), 3,57 (с, 2Н), 3,64 (т, J=6,4 Гц, 2Н), 5,38-5,42 (м, 1Н), 7,22-7,37 (м, 5Н).
Справочный пример 17
1-Бензил-4-гидроксипропилпиперидин
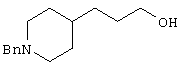
6,48 г 1-бензил-4-гидроксипропил-1,2,5,6-тетрагидропиридина растворяют в 60 мл метанола, добавляют 88 мг PtO2 и заменяют атмосферу водородом. После окончания реакции смесь фильтруют и фильтрат упаривают, получая при этом 4,50 г (19,3 ммоль, 68,9%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, СDСl3) δ 1,16-1,33 (м, 5Н), 1,33-1,41 (шир.д-с, 1Н), 1,53-1,74 (м, 4Н), 1,87-1,98 (м, 2Н), 2,83-2,90 (м, 2Н), 3,48 (с, 2Н), 3,62 (т, J=6,4 Гц, 2Н), 7,16-7,27 (м, 5Н).
Справочный пример 18
1-Бензил-4-метансульфонилоксипропилпиперидин
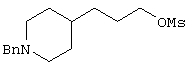
2,58 г (11,1 ммоль) 1-бензил-4-гидроксипропилпиперидина и 3,26 мл (23,4 ммоль) триэтиламина растворяют в 50 мл тетрагидрофурана и по каплям добавляют 1,67 мл (21,6 ммоль) метансульфонилхлорида. После окончания реакции смесь распределяют между этилацетатом и насыщенным раствором соли. Органический слой сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 50 г силикагеля Cromatorex NH (этилацетат:гексан = 1:1), получая при этом 2,90 г (9,31 ммоль, 83,9%) указанного в заголовке соединения в виде желтого масла. Физико-химические данные целевого соединения приведены ниже.
1H-ЯМР (400 МГц, СDСl3) δ 1,18-1,37 (м, 5Н), 1,58-1,68 (м, 2Н), 1,71-1,80 (м, 2Н), 1,88-1,97 (м, 2Н), 2,84-2,90 (м, 2Н), 3,00 (с, 3Н), 3,48 (с, 2Н), 4,21 (т, J=6,8 Гц, 2Н), 7,13-7,32 (м, 5Н).
Справочный пример 19
4-[(4-Циано-5-метил-4-фенил)гексил]пиперидин
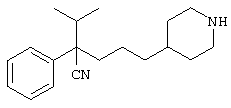
2,43 г (6,49 ммоль) 1-бензил-4-[(4-циано-5-метил-4-фенил) гексил]пиперидина растворяют в 30 мл 1,2-дихлорэтана, добавляют 0,85 мл (7,79 ммоль) АсеСl и нагревают смесь с обратным холодильником. Через 45 минут смесь упаривают. Затем добавляют 30 мл метанола и снова нагревают смесь с обратным холодильником. После окончания реакции смесь упаривают, экстрагируют водой и промывают эфиром. Полученный водный слой подщелачивают и распределяют смесь между этилацетатом и насыщенным раствором соли. Органический слой сушат над сульфатом магния и упаривают, получая при этом 1,62 г (5,69 ммоль, 87,7%) желтого сырого продукта. Физико-химические данные указанного в заголовке соединения приведены ниже.
1H-ЯМР (400 МГц, СDСl3) δ 0,77 (д, J=6,8 Гц, 3Н), 0,86-1,04 (м, 3Н), 1,07-1,28 (м, 3Н), 1,19 (д, J=6,4 Гц, 3Н), 1,29-1,44 (м, 1Н), 1,48-1,58 (м, 2Н), 1,74-1,85 (м, 1Н), 2,04-2,14 (м, 2Н), 2,49 (дт, J=2,4 Гц, 12,0 Гц, 2Н), 2,95-3,02 (м, 2Н), 7,26-7,40 (м, 5Н).
Справочный пример 20
3-Циано-3-(2-тиенил)пропанол
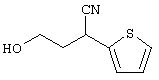
В атмосфере азота борогидрид натрия (650 мг) добавляют на бане со льдом к раствору (25 мл) тиофен-2-ацетонитрила (1 г) и (3-бромпропокси)-трет-бутилдиметилсилана (2,06 г) в ДМФА. Через 20 минут органический слой отделяют, добавляя насыщенный водный раствор хлорида аммония, и к нему добавляют этилацетат. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и смесь упаривают. Образовавшийся остаток растворяют в ацетонитриле (20 мл), добавляют 1 М раствор фторида тетрабутиламмония в тетрагидрофуране (9,7 мл) и смесь перемешивают при комнатной температуре. Через 18 часов органический слой отделяют, добавляя воду и этилацетат. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над сульфатом магния. Осушитель отфильтровывают и смесь упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (система гексан:этилацетат), получая при этом указанное в заголовке соединение в виде красного масла (637 мг, 43%).
1H-ЯМР (400 МГц, СDСl3) δ 2,08-2,16 (м, 1Н), 3,08 (т, J=7,0 Гц, 2Н), 3,75 (т, J=7,0 Гц, 2Н), 4,15-4,20 (м, 1Н), 7,14 (дд, J=3,8 Гц, 4,8 Гц, 1Н), 7,65 (дд, J=0,8 Гц, 4,8 Гц, 1Н), 7,75 (дд, J=0,8 Гц, 3,8 Гц, 1Н).
Справочный пример 21
2-[(3-Циано-3-фенил)пропил]-1,3-диоксолан
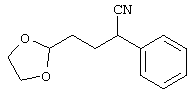
В атмосфере азота амид натрия (1,11 г) добавляют к раствору (25 мл) фенилацетонитрила (3 г) в тетрагидрофуране. Через 30 минут к реакционному раствору через капельную воронку добавляют раствор (25 мл) 2-(2-бромэтил)-1,3-диоксолана (4,64 г) в тетрагидрофуране. Смесь перемешивают в течение 2 часов, добавляют к ней насыщенный водный раствор хлорида аммония и этилацетат, чтобы отделить органический слой. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и смесь упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (система гексан:этилацетат), получая при этом указанное в заголовке соединение (3,47 г, 62%).
1H-ЯМР (400 МГц, СDСl3) δ 1,75-1,90 (м, 2Н), 1,95-2,10 (м, 2Н), 3,80-4,00 (м, 5Н), 4,91 (т, J=4,4 Гц, 1Н), 7,30-7,42 (м, 5Н).
Справочный пример 22
Этил-4-метил-3-фенилпентаноат
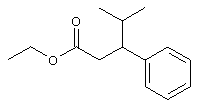
В атмосфере азота этилтриметилсилилэтилацетат (5,19 г) добавляют при -78°С к раствору (1,5 М раствор, 21,6 мл) диизопропиламида лития в тетрагидрофуране (100 мл). Через 20 минут добавляют раствор (10 мл) изобутирофенона (4,0 г) в тетрагидрофуране и оставляют смесь нагреваться до комнатной температуры. После перемешивания в течение 18 часов добавляют моногидрат бисульфата натрия (0,6 г) и продолжают перемешивать. Через 10 минут отделяют органический слой, добавляя 0,2 н. раствор хлористоводородной кислоты (250 мл) и этилацетат (200 мл). Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и смесь упаривают. 756 мг из полученного сырого продукта (7,9 г) растворяют в метаноле (5 мл), добавляют каталитическое количество 10% палладия на угле (9,5 мг) и смесь перемешивают в атмосфере водорода. Через 4 часа катализатор отфильтровывают и фильтрат концентрируют. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (система гексан:этилацетат), получая при этом указанное в заголовке соединение в виде бесцветного масла (350 мг).
1H-ЯМР (400 МГц, СDСl3) δ 0,75 (д, J=6,4 Гц, 3Н), 0,95 (д, J=6,8 Гц, 3Н), 1,06 (т, J=7,2 Гц, 3Н), 1,80-1,90 (м, 1Н), 2,58 (дд, J=10 Гц, 15,2 Гц, 1Н), 2,77 (дд, J=5,6 Гц, 15,2 Гц, 1Н), 2,84-2,91 (м, 1Н), 7,12-7,29 (м, 5Н).
Справочный пример 23
4-Метил-3-фенилпентанол
В атмосфере азота этил-4-метилпентаноат (350 мг) растворяют в тетрагидрофуране (10 мл) при -78°С, добавляют раствор алюмогидрида лития в тетрагидрофуране (1,0 М, 1,58 мл) и смесь перемешивают. Смесь оставляют нагреваться до комнатной температуры при перемешивании, через 1,5 часа поочередно добавляют воду (0,05 мл), 2 н. водный раствор гидроксида натрия (0,05 мл) и воду (0,15 мл), после чего смесь перемешивают. Затем к смеси добавляют диэтиловый эфир, затем образовавшиеся нерастворимые вещества отфильтровывают и фильтрат упаривают. Полученный остаток очищают хроматографией на колонке с силикагелем (система гексан:этилацетат), получая при этом указанное в заголовке соединение в виде бесцветного масла (257 мг, 42%, 2 стадии).
1H-ЯМР (400 МГц, СDСl3) δ 0,73 (д, J=6,8 Гц, 3Н), 0,97 (д, J=6,4 Гц, 3Н), 1,78-1,88 (м, 2Н), 2,04-2,14 (м, 1Н), 2,36-2,46 (м, 1Н), 3,34-3,54 (м, 2Н), 7,20-7,16 (м, 2Н), 7,17-7,22 (м, 1Н), 7,25-7,31 (м, 2Н).
Справочный пример 24
4-Метил-3-фенилпентановая кислота
В атмосфере азота гидрид натрия (60%, 1,2 г) добавляют при 0°С к раствору (30 мл) трет-бутилдиэтилфосфоноацетата (4,9 г) в тетрагидрофуране. Смесь оставляют нагреваться до комнатной температуры в течение 10 минут и перемешивают. Через 1 час добавляют раствор (10 мл) изобутирофенона (4,0 г) в тетрагидрофуране. Смесь перемешивают в течение 13 часов и отделяют органический слой, добавляя воду и этилацетат. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и смесь упаривают. 5,48 г из полученного сырого продукта (6,1 г) растворяют в метаноле (30 мл), добавляют каталитическое количество 10% палладия на угле (250 мг) и подвергают смесь взаимодействию под давлением водорода (3,9 кг/см2). Через 1,3 часа катализатор отфильтровывают и фильтрат концентрируют. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (система гексан:этилацетат). Полученный продукт (3,0 г) растворяют в ацетоне (50 мл) и 5 н. растворе хлористоводородной кислоты (20 мл) и смесь перемешивают в течение 3 часов при нагревании с обратным холодильником. Раствор упаривают, получая при этом указанное в заголовке соединение в виде красновато-желтого масла (1,96 г, 58% по 3 стадиям).
1H-ЯМР (400 МГц, СDСl3) δ 0,75 (д, J=6,8 Гц, 3Н), 0,94 (д, J=6,8 Гц, 3Н), 1,80-1,91 (м, 1Н), 2,62 (дд, J=10,0 Гц, 15,6 Гц, 1Н), 2,80 (дд, J=5,6 Гц, 15,6 Гц, 1Н), 2,82-2,91 (м, 1Н), 7,11-7,16 (м, 2Н), 7,13-7,22 (м, 1Н), 7,23-7,29 (м, 2Н).
Справочный пример 25
N-Метил-N-метокси-4-метил-3-фенилпентанамид
В атмосфере азота раствор диэтилцианофосфоната (1,97 г) и триэтиламина (1,63 мл) в диметилформамиде добавляют при 0°С к раствору (24 мл) 4-метил-3-фенилпентановой кислоты (1,96 г), гидрохлорида N,О-диметилгидроксиамина (1,18 г) и триэтиламина (1,63 мл) в тетрагидрофуране. Через 19 часов органический слой отделяют, добавляя диэтиловый эфир и насыщенный водный раствор хлорида аммония. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и смесь упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (система гексан:этилацетат), получая при этом указанное в заголовке соединение (1,13 г, 47%).
1H-ЯМР (400 МГц, СDСl3) δ 0,76 (д, J=6,6 Гц, 3Н), 0,97 (д, J=6,6 Гц, 3Н), 1,84-1,96 (м, 1Н), 2,74-2,86 (м, 2Н), 2,97-3,05 (м, 1Н), 3,06 (с, 3Н), 3,57 (с, 3Н), 7,15-7,21 (м, 3Н), 7,24-7,29 (м, 2Н).
Справочный пример 26
4-Метил-3-фенилпентанал
В атмосфере азота N-метил-N-метокси-4-метил-3-фенилпентанамид (215 мг) растворяют в тетрагидрофуране (9,1 мл) при -78°С и добавляют раствор гидрида диизобутилалюминия в толуоле (1,5 М, 1,2 мл). Через один час к реакционной системе добавляют метанол (3 мл) и после прекращения пенообразования смесь оставляют нагреваться до комнатной температуры при непрерывном перемешивании. Органический слой отделяют, добавляя к смеси диэтиловый эфир, воду и 1 н. водный раствор хлористоводородной кислоты. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и смесь упаривают, получая при этом указанное в заголовке соединение в виде бесцветного масла (200 мг). Полученное соединение используют при осуществлении следующей реакции без очистки.
1H-ЯМР (400 МГц, СDСl3) δ 0,77 (д, J=6,6 Гц, 3H), 0,95 д, J=6,8 Гц, 3Н), 1,82-1,92 (м, 1Н), 2,70-2,84 (м, 2Н), 2,90-2,98 (м, 1Н), 7,13-7,32 (м, 5Н), 9,59-9,61 (м, 1Н).
Справочный пример 27
4-Метил-3-фенилгексаналь
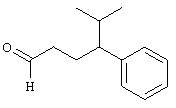
В атмосфере азота раствор н-бутиллития в тетрагидрофуране (1,53 М, 1,2 мл) добавляют к раствору хлорида (метоксиметил)трифенилфосфония (627 мг) в тетрагидрофуране при -78°С, после чего температуру смеси повышают до 0°С. Через 20 минут наружную температуру понижают до -78°С и добавляют 4-метил-3-фенилпентаналь (200 мг) вместе с тетрагидрофураном (4 мл). Смесь оставляют нагреваться до комнатной температуры в течение 45 минут и продолжают перемешивать еще 20 минут. Органический слой отделяют, добавляя к смеси диэтиловый эфир и насыщенный водный раствор хлорида аммония. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и смесь упаривают, получая при этом указанное в заголовке соединение в виде бесцветного масла (200 мг). Полученное соединение растворяют в изопропаноле (2 мл) и воде (2 мл), добавляют п-толуолсульфоновую кислоту (6 мг) и реакционную смесь подвергают взаимодействию в течение 8,5 часов при нагревании с обратным холодильником. Органический слой отделяют, добавляя к смеси диэтиловый эфир и насыщенный водный раствор хлорида аммония. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и смесь упаривают. Остаток очищают хроматографией на колонке с силикагелем NH (система гексан:этилацетат), получая при этом указанное в заголовке соединение в виде бесцветного масла (103 мг, 59%, 3 стадии).
1H-ЯМР (400 МГц, СDСl3) δ 0,72 (д, J=6,8 Гц, 3Н), 0,99 (д, J=6,6 Гц, 3Н), 1,76-1,90 (м, 2Н), 2,12-2,28 (м, 4Н), 7,07-7,10 (м, 2Н), 7,18-7,22 (м, 1Н), 7,26-7,35 (м, 2Н), 9,63-9,65 (м, 1Н).
Справочный пример 28
1-[(2-Винил-2-(4-фторфенокси)этил]пиперазин
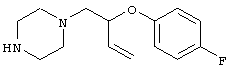
Указанное в заголовке соединение синтезируют способом по примеру 104, описанному в JP-A 11-206862.
1H-ЯМР (400 МГц, СDСl3) δ 2,50-2,60 (м, 4Н), 2,59 (дд, J=4,0 Гц, 13,6 Гц, 1Н), 2,77 (дд, J=7,5 Гц, 13,6 Гц, 1Н), 2,86-2,90 (м, 4Н), 4,70-4,76 (м, 1Н), 5,22 (шир.д, J=10,6 Гц, 1Н), 5,27 (шир.д, J=17,2 Гц, 1Н), 5,87 (ддд, J=5,7 Гц, 10,6 Гц, 17,2 Гц, 1Н), 6,82-6,89 (м, 2Н), 6,89-6,97 (м, 2Н).
Справочный пример 29
Диметилацеталь 4-бром-2-тиофенкарбальдегида
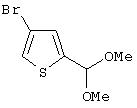
(90%) 4-бром-2-тиофенкарбальдегид (10,0 г) растворяют в метаноле (50 мл) и добавляют ионообменную смолу Amberlite IR120B (5 г). Смесь нагревают с обратным холодильником в течение 10 часов, оставляют охлаждаться до комнатной температуры и затем отфильтровывают ионообменную смолу. Фильтрат упаривают и образовавшийся остаток очищают хроматографией на колонке с силикагелем (NH) (гексан), получая при этом указанное в заголовке соединение в виде бледно-желтого масла (8,93 г, 72%).
1H-ЯМР (400 МГц, СDСl3) δ 3,36 (с, 6Н), 5,59 (д, J=0,8 Гц, 1Н), 7,00 (дд, J=0,8 Гц, J=1,6 Гц, 1Н), 7,20 (д, J=1,6 Гц, 1Н).
Справочный пример 30
3-Циано-5-тиофенкарбальдегид
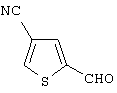
Способ 1
Диметилацеталь 4-бром-2-тиофенкарбальдегида (6,82 г) растворяют в ДМФА (50 мл) и добавляют цианид меди (4,29 г). Смесь нагревают с обратным холодильником в течение 3 часов, охлаждают до комнатной температуры и добавляют этилацетат. Затем смесь промывают водным раствором аммиака, водой, 0,1 н. водным раствором хлористоводородной кислоты и насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают, получая масло. Остаток растворяют в 80% водном растворе уксусной кислоты (100 мл) и перемешивают смесь при 0°С в течение одного часа. Затем смесь промывают насыщенным раствором соли. Реакционную смесь оставляют охлаждаться до комнатной температуры и затем добавляют этилацетат. Смесь промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (система: гексан/этилацетат) и перекристаллизовывают из этилацетата/гексана, получая при этом указанное в заголовке соединение в виде бледных желтовато-белых кристаллов (2,44 г, 62%).
Способ 2
4-Бром-2-тиофенкарбальдегид (5,00 г) растворяют в ДМФА (40 мл) и добавляют цианид меди (3,52 г). Смесь нагревают с обратным холодильником в течение 3 часов и оставляют охлаждаться до комнатной температуры, затем добавляют этилацетат. Смесь промывают водным раствором аммиака, водой, 0,1 н. водным раствором хлористоводородной кислоты и затем насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (система: гексан/этилацетат) и перекристаллизовывают из этилацетата/гексана, получая при этом указанное в заголовке соединение в виде бледных желтовато-белых кристаллов (2,30 г, 71%).
Физико-химические данные указанного в заголовке соединения приведены ниже.
1H-ЯМР (400 МГц, СDСl3) δ 7,94 (д, J=1,2 Гц, 1Н), 8,27 (д, J=1,2 Гц, 1H), 9,95 (д, J=1,2 Гц, 1Н).
Справочный пример 31
3-Циано-5-(1-гидрокси-2-метилпропил)тиофен
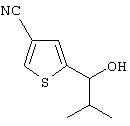
3-Циано-5-тиофенкарбальдегид (2,00 г) растворяют в безводном эфире (100 мл) и безводном тетрагидрофуране (ТГФ) (20 мл) и добавляют раствор (10,9 мл) (2,0 М) хлорида изопропилмагния в эфире. Смесь перемешивают при 0°С в течение 2 часов и добавляют этилацетат. Смесь промывают насыщенным водным раствором хлорида аммония и насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (система: гексан/этилацетат), получая при этом указанное в заголовке соединение в виде бледно-желтого масла (1,25 г, 47%).
1H-ЯМР (400 МГц, СDСl3) δ 0,91 (д, J=6,8 Гц, 3Н), 1,00 (д, J=6,8 Гц, 3Н), 1,99 (секст, J=6,8 Гц, 1Н), 2,42 (д, J=4 Гц, 1Н), 4,68 (дд, J=4 Гц, J=6 Гц, 1Н), 7,08-7,10 (м, 1Н), 7,85 (д, J=1,6 Гц, 1Н).
Справочный пример 32
3-Циано-5-(1-оксо-2-метилпропил)тиофен
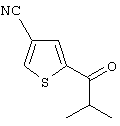
Оксалилхлорид (0,70 мл) растворяют в метиленхлориде (10 мл) и охлаждают смесь до температуры от -60 до -50°С. К смеси добавляют диметилсульфоксид (0,57 мл) и перемешивают смесь в течение 2 минут. Затем добавляют раствор (6 мл) 3-циано-5-(1-гидрокси-2-метилпропил)тиофена (1,21 г) в метиленхлориде при температуре от -60 до -50°С и перемешивают смесь в течение 15 минут. Затем к смеси добавляют триэтиламин (4,65 мл) и оставляют нагреваться до комнатной температуры. Затем добавляют этилацетат и смесь промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают. Образовавшийся остаток перекристаллизовывают из этанола, получая при этом указанное в заголовке соединение в виде бледных желтовато-белых кристаллов (0,59 г). Фильтрат очищают хроматографией на колонке с силикагелем (система: гексан/этилацетат), получая при этом указанное в заголовке соединение (0,41 г, общий выход 1,00 г, 84%).
1H-ЯМР (400 МГц, СDСl3) δ 1,27 (д, J=6,8 Гц, 6Н), 3,36 (квин, J=6,8 Гц, 1Н), 7,86 (д, J=1,2 Гц, 1Н), 8,18 (д, J=0,8 Гц, 1Н).
Справочный пример 33
[1-Циано-1-(3-циано-5-тиенил)-2-метилпропил]диэтилфосфат
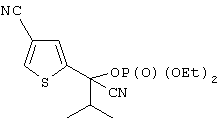
3-Циано-5-(1-оксо-2-метилпропил)тиофен (0,90 г) растворяют в ТГФ (50 мл) и добавляют 30,1 мл раствора (0,5 М) цианида лития и (90%) диэтилцианофосфоната (2,29 мл) в ДМФА. Смесь перемешивают при комнатной температуре в течение 30 минут и добавляют этилацетат и гексан. Затем смесь промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (система: гексан/этилцетат), получая при этом указанное в заголовке соединение в виде бледно-желтого масла (1,72 г, количественный выход).
1H-ЯМР (400 МГц, СDСl3) δ 0,96 (д, J=6,8 Гц, 3Н), 1,27-1,34 (м, 9Н), 2,49 (квин, J=6,8 Гц, 1Н), 4,00-4,21 (м, 4Н), 7,56 (д, J=1,2 Гц, 1Н), 8,04 (д, J=1,6 Гц, 1Н).
Справочный пример 34
3-Циано-5-(1-циано-2-метилпропил)тиофен
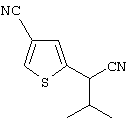
[1-Циано-1-(3-циано-5-тиенил)-2-метилпропил]диэтилфосфат (45 мг) растворяют в этилацетате (5 мл), добавляют (10%) палладий на угле (20 мг) и смесь гидрируют при комнатной температуре и нормальном давлении в течение 2 часов. Катализатор отфильтровывают и фильтрат упаривают. Образовавшийся остаток очищают препаративной тонкослойной хроматографией на колонке с силикагелем (система: гексан/этилацетат), получая при этом указанное в заголовке соединение в виде бледно-желтого масла (22 мг, 88%).
1H-ЯМР (400 МГц, СDСl3) δ 1,09 (д, J=6,8 Гц, 3Н), 1,14 (д, J=6,8 Гц, 3Н), 2,20 (секст, J=6,8 Гц, 1Н), 3,96 (д, J=6,8 Гц, 1H), 7,26 (с, 1Н), 7,91 (д, J=1,6 Гц, 1Н).
Справочный пример 35
Этил-4-циано-4-(3-циано-5-тиенил)-5-метилгексанат
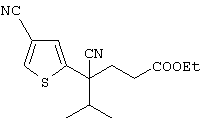
трет-Бутоксид калия (35 мг) суспендируют в ДМФА (5 мл) и добавляют раствор (5 мл) 3-циано-5-(1-циано-2-метилпропил)тиофена (0,60 г) в ДМФА. Смесь перемешивают при комнатной температуре в течение 3,5 часов и добавляют этилацетат. Затем смесь промывают насыщенным водным раствором хлорида аммония и затем насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (система: гексан/этилацетат), получая при этом указанное в заголовке соединение в виде бледно-желтого масла (0,55 г, 60%).
1H-ЯМР (400 МГц, СDСl3) δ 0,94 (д, J=6,8 Гц, 3Н), 1,23 (д, J=6,8 Гц, 3Н), 1,24 (т, J=6,8 Гц, 3Н), 2,04-2,15 (м, 3Н), 2,45-2,60 (м, 2Н), 4,04-4,17 (м, 2Н), 7,30 (д, J=1,2 Гц, 1H), 7,93 (д, J=1,6 Гц, 1H).
Справочный пример 36
4-Циано-4-(3-циано-5-тиенил)-5-метилгексанол
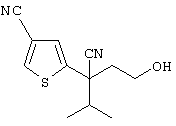
Этил-4-циано-4-(3-циано-5-тиенил)-5-метилгексанат (0,55 г) растворяют в ТГФ (10 мл), добавляют борогидрид лития (46 мг) и смесь нагревают с обратным холодильником в течение 1,5 часов. После охлаждения до комнатной температуры добавляют 1 н. водный раствор хлористоводородной кислоты и воду при 0°С и смесь экстрагируют этилацетатом. Затем смесь промывают насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (система: гексан/этилацетат), получая при этом указанное в заголовке соединение в виде бледно-желтого масла (1,25 г, 47%). Катализатор отфильтровывают и фильтрат упаривают. Образовавшийся остаток очищают препаративной тонкослойной хроматографией на колонке с силикагелем (система: гексан/этилацетат), получая при этом указанное в заголовке соединение в виде бледно-желтого масла (0,39 г, 83%).
1H-ЯМР (400 МГц, СDСl3) δ 0,93 (д, J=6,8 Гц, 3Н), 1,21 (д, J=6,8 Гц, 3Н), 1,19-1,41 (м, 1Н), 1,45-1,70 (м, 1Н), 1,65-1,77 (м, 1Н), 1,88 (дт, J=4 Гц, J=13,2 Гц, 1Н), 2,09 (квин, J=6,8 Гц, 3Н), 2,30 (дт, J=4 Гц, J=12,4 Гц, 1Н), 3,66 (т, J=6,4 Гц, 2Н), 7,30 (д, J=1,2 Гц, 1Н), 7,92 (с, 1Н).
Справочный пример 37
N-(2-Цианоэтил)-N-(2-иодэтил)анилин
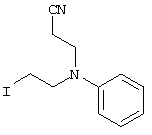
2,00 г (10,5 ммоль) N-(2-цианоэтил)-N-(2-гидроксиэтил)анилина растворяют в 60,0 мл ацетонитрила и к раствору поочередно добавляют 2,20 мл (15,8 ммоль) триэтиламина и 0,90 мл (11,6 ммоль) мезилхлорида. После окончания реакции добавляют насыщенный раствор соли и целевой продукт экстрагируют эфиром. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают, получая сырой продукт. Сырой продукт растворяют в ацетоне и добавляют 12,0 г (80,1 ммоль) иодида натрия. После окончания реакции добавляют насыщенный раствор соли и целевой продукт экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают и получают сырой продукт. Сырой продукт обрабатывают силикагелем (элюирование этилацетатом:гексаном = 1:3), получая при этом 2,78 г (9,26 ммоль, 88,2%) указанного в заголовке соединения в виде желтого сиропа.
1H-ЯМР (400 МГц, СDСl3) δ 2,62 (т, J=7,0 Гц, 2Н), 3,26 (т, J=8,0 Гц, 2Н), 3,71-3,81 (м, 4Н), 6,66-6,72 (м, 2Н), 6,81-6,86 (м, 1Н), 7,25-7,32 (м, 2Н).
Справочный пример 38
1-{2-[N-(2-Цианоэтил)анилино]этил}пиперазин
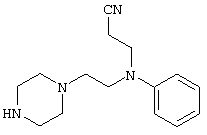
2,78 г (9,26 ммоль) вышеуказанного иодида растворяют в 50,0 мл ацетонитрила, поочередно добавляют 2,5 г (13,4 ммоль) 1-трет-бутоксикарбонилпиперазина и 1,29 мл (13,4 ммоль) триэтиламина и смесь нагревают до 60°С. После окончания реакции добавляют насыщенный раствор соли и целевой продукт экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают и получают сырой продукт. Сырой продукт растворяют в 40 мл метанола и добавляют 30 мл 4 н. раствора хлороводорода в этилацетате. После окончания реакции добавляют воду и 10 мл 5 н. раствора НСl и промывают смесь этилацетатом. рН водного слоя доводят до 11, добавляют 5 н. водный раствор гидроксида натрия и затем целевой продукт экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния и растворитель выпаривают, получая при этом 1,81 г (7,01 ммоль, 75,7%) указанного в заголовке соединения в виде желтого сиропа, являющегося неочищенным продуктом.
1H-ЯМР (400 МГц, СDСl3) δ 2,00-2,10 (шир.д-с, 1Н), 2,45-2,58 (м, 4Н), 2,54 (т, J=6,8 Гц, 2Н), 2,69 (т, J=7,2 Гц, 2Н), 2,92 (т, J=5,0 Гц, 4Н), 3,51 (т, J=6,8 Гц, 2Н), 3,71 (т, J=7,2 Гц, 2Н), 6,65-6,72 (м, 2Н), 6,73-6,79 (м, 1Н), 7,22-7,29 (м, 2Н).
Справочный пример 39
3-(1,3-Диоксолан-2-ил)тиофен
20,3 г (181 ммоль) 3-тиофенальдегида, 50 мл этиленгликоля и 2,00 г (7,96 ммоль) PPTS растворяют в 230 мл толуола и дегидратируют в аппарате Дина-Старка. После окончания реакции смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают и получают сырой продукт. Сырой продукт обрабатывают силикагелем (этилацетат:гексан = 1:10), получая при этом 12,1 г (77,3 ммоль, 86,7%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, СDСl3) δ 3,97-4,15 (м, 4Н), 5,91 (с, 2Н), 7,16 (ддд, J=0,4 Гц, 1,2 Гц, 5,2 Гц, 1Н), 7,32 (дд, J=2,8 Гц, 5,2 Гц, 1Н), 7,42 (ддд, J=0,4 Гц, 1,2 Гц, 2,8 Гц, 1Н).
Справочный пример 40
3-(1,3-Диоксолан-2-ил)-2-тиофенкарбальдегид
5,00 г (32,0 ммоль) 3-(1,3-диоксолан-2-ил)тиофена растворяют в 100 мл ТГФ. К полученной смеси по каплям добавляют 24,5 мл (1,5 моль/л) н-бутиллития. Смесь перемешивают в течение 0,5 часа, охлаждают до -70°С, добавляют 3,10 мл (40,0 ммоль) ДМФА и переносят смесь на баню со льдом. Затем смесь перемешивают в течение примерно 2 часов, добавляют насыщенный водный раствор хлорида аммония и экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают и получают сырой продукт. Сырой продукт обрабатывают силикагелем (этилацетат:гексан = 1:2), получая при этом 3,68 г (20,0 ммоль, 62,4%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 3,97-4,15 (м, 4Н), 5,91 (с, 2Н), 7,16 (ддд, J=0,4 Гц, 1,2 Гц, 5,2 Гц, 1Н), 7,32 (дд, J=2,8 Гц, 5,2 Гц, 1Н), 7,42 (ддд, J=0,4 Гц, 1,2 Гц, 2,8 Гц, 1Н).
Справочный пример 41
3-(1,3-Диоксолан-2-ил)-2-тиофенацетонитрил
20 мл раствора 4,49 г (40,0 ммоль) трет-бутоксида калия в ТГФ охлаждают до температуры от -45 до -30°С и поочередно добавляют 20 мл раствора 3,90 г (20,0 ммоль) реагента TOSmic в ТГФ и 20 мл раствора 3,68 г (20,0 ммоль) 3-(1,3-диоксолан-2-ил)-2-тиофенкарбальдегида в ТГФ. Через 40 минут добавляют 60 мл метанола при -15°С. Смесь нагревают с обратным холодильником в течение 15 минут, добавляют насыщенный водный раствор хлорида аммония и экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают и получают сырой продукт. Сырой продукт обрабатывают силикагелем Cromatorex NH (этилацетат:гексан = 1:4), получая при этом 1,43 г (7,32 ммоль, 36,6%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 4,00-4,15 (м, 4Н), 4,04 (с, 2Н), 5,91 (с, 1Н), 7,06 (д, J=5,6 Гц, 2Н), 7,21 (д, J=5,6 Гц, 2Н).
Справочный пример 42
2-[3-(1,3-Диоксолан-2-ил)-2-тиенил]-4-метилбутиронитрил
1,43 г (7,32 ммоль) 3-(1,3-диоксолан-2-ил)-2-тиофенацетонитрила растворяют в 2 мл диметилсульфоксида и поочередно добавляют 1,08 г (8,78 ммоль) 2-бромпропана, 100 мг (катализатор) иодида тетра-н-бутиламмония и 3 мл 50% гидроксида калия. Через 25 минут добавляют 300 мг 2-бромпропана, затем через 50 минут добавляют 1 мл 50% гидроксида калия и 2 мл ДМСО. После окончания реакции добавляют насыщенный раствор соли и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 100 г силикагеля (этилацетат:гексан = 1:8), получая при этом 853 мг (3,59 ммоль, 49,1%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,03 (д, J=6,8 Гц, 3Н), 1,19 (д, J=6,4 Гц, 3Н), 2,17-2,27 (м, 1Н), 3,97-4,13 (м, 4Н), 4,31 (д, J=8,0 Гц, 1Н), 7,06 (д, J=5,2 Гц, 2Н), 7,24 (д, J=5,2 Гц, 2Н).
Справочный пример 43
2-(3-Формил-2-тиенил)-4-метилбутиронитрил
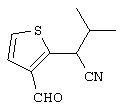
2,16 г (9,10 ммоль) 2-[3-(1,3-диоксолан-2-ил)-2-тиенил]-4-метилбутиронитрила растворяют в 40 мл ацетона, добавляют 115 мл 5 н. раствора НСl и нагревают смесь при 70°С в течение 3 минут. После окончания реакции добавляют насыщенный раствор соли и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 75 г силикагеля (этилацетат:гексан = 1:2), получая при этом 1,66 г (8,58 ммоль, 94,3%) указанного в заголовке соединения в виде коричневого масла.
1H-ЯМР (400 МГц, СDСl3) δ 1,12 (д, J=6,8 Гц, 3Н), 1,14 (д, J=6,8 Гц, 3Н), 2,18-2,29 (м, 1Н), 4,97 (д, J=6,4 Гц, 1Н), 7,34 (д, J=5,2 Гц, 2Н), 7,44 (д, J=5,2 Гц, 2Н), 10,01 (с, 1Н).
Справочный пример 44
2-(3-Циано-2-тиенил)-4-метилбутиронитрил
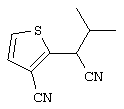
1,66 г (8,58 ммоль) 2-(3-формил-2-тиенил)-4-метилбутиронитрила растворяют в 40 мл этанола, добавляют 10 мл водного раствора, содержащего 894 мг (12,9 ммоль) гидрохлорида гидроксиламина и 1,41 г (17,2 ммоль) ацетата натрия и нагревают смесь при 80°С. После окончания реакции добавляют насыщенный раствор соли и целевой продукт экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают и получают сырой оксим. Оксим растворяют в 50 мл диметилформамида и добавляют 5,56 г (34,3 ммоль) карбодиимидазола. Затем смесь нагревают при 60°С и через 50 минут добавляют 2,40 мл (17,2 ммоль) триэтиламина. После окончания реакции к охлаждаемой смеси добавляют насыщенный раствор соли и целевой продукт экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают и получают сырой продукт. Сырой продукт обрабатывают силикагелем (элюирование этилацетатом:гексаном = 1:9), получая при этом 1,07 мг (5,47 ммоль, 63,7%) указанного в заголовке соединения в виде оранжевого масла.
1H-ЯМР (400 МГц, СDСl3) δ 1,10 (д, J=6,8 Гц, 3Н), 1,19 (д, J=6,8 Гц, 3Н), 2,27-2,38 (м, 1Н), 4,20 (д, J=7,2 Гц, 1Н), 7,22 (д, J=5,6 Гц, 2Н), 7,40 (д, J=5,6 Гц, 2Н).
Справочный пример 45
Этил-4-циано-5-метил-4-(3-циано-2-тиенил)гексанолят
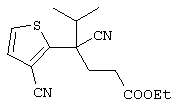
1,07 г (5,47 ммоль) 2-(3-циано-2-тиенил)-4-метилбутиронитрила и 0,71 мл (6,56 ммоль) этилакрилата растворяют в 30 мл тетрагидрофурана. К полученному раствору понемногу добавляют 123 мг (1,09 ммоль, катализатор) трет-бутоксида калия при комнатной температуре. После окончания реакции поочередно добавляют насыщенный раствор соли, насыщенный водный раствор хлорида аммония и 2 н. раствор НСl и целевой продукт экстрагируют этилацетатом. Органический слой промывают дважды насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают и получают сырой продукт. Сырой продукт обрабатывают силикагелем (элюирование этилацетатом:гексаном = 1:9), получая при этом 904 мг (3,11 ммоль, 56,9%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, СDСl3) δ 0,94 (д, J=6,8 Гц, 3Н), 1,24 (т, J=7,2 Гц, 3Н), 1,29 (д, J=6,4 Гц, 3H), 2,04-2,26 (м, 1Н), 2,46-2,74 (м, 4Н), 4,07-4,16 (м, 2Н), 7,29 (д, J=5,3 Гц, 2Н), 7,31 (д, J=5,3 Гц, 2Н).
Справочный пример 46
4-Циано-5-метил-4-(3-циано-2-тиенил)гексанол
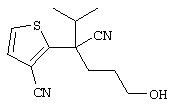
500 мг (1,72 ммоль) этил-4-циано-5-метил-4-(3-циано-2-тиенил)гексанолята растворяют в 10 мл ТГФ, добавляют 37,5 мг (1,72 ммоль) борогидрида лития и смесь нагревают с обратным холодильником. Через 1 час 20 минут нагревание прекращают и при охлаждении льдом добавляют 2 н. раствор НСl. Смесь экстрагируют этилацетатом, экстракт поочередно промывают насыщенным раствором соли и водой и сушат над безводным сульфатом магния. Растворитель выпаривают и получают сырой продукт. Сырой продукт обрабатывают силикагелем (элюирование этилацетатом:гексаном = 35:65), получая при этом 244 мг (0,98 ммоль, 57,1%) указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 0,94 (д, J=6,4 Гц, 3Н), 1,26 (д, J=6,8 Гц, 3Н), 1,24-1,39 (м, 1Н), 1,68-1,82 (м, 1Н), 2,28-2,48 (м, 2Н), 2,59-2,70 (м, 1Н), 3,64-3,72 (м, 2Н), 7,28-7,29 (м, 2Н).
Справочный пример 47
4-Циано-5-метил-4-(3-циано-2-тиенил)гексилиодид
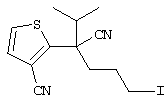
244 мг (0,98 ммоль) 4-циано-5-метил-4-(3-циано-2-тиенил)гексанола растворяют в 10 мл ацетонитрила и 0,16 мл (1,18 ммоль) триэтиламина и добаваляют 83,6 мкл (1,08 ммоль) мезилхлорида. Примерно через 5 минут добавляют 1,47 г (9,80 ммоль) иодида натрия. После окончания реакции добавляют насыщенный раствор соли и этилацетат, этилацетатный слой промывают водным раствором тиосульфата натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают силикагелем (элюирование этилацетатом:гексаном = 1:10), получая при этом 334 мг (0,93 ммоль, 95,1%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 0,93 (д, J=6,8 Гц, 3Н), 1,27 (д, J=6,8 Гц, 3Н), 1,49-1,62 (м, 1Н), 1,98-2,10 (м, 1Н), 2,27-2,36 (м, 1Н), 2,42-2,52 (м, 1Н), 2,60-2,71 (м, 1Н), 3,12-3,22 (м, 2Н), 7,29-7,31 (м, 2Н).
Справочный пример 48
4-Циано-5-метил-4-(5-циано-2-тиенил)гексилиодид
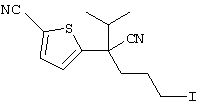
1,05 г (4,23 ммоль) 4-циано-5-метил-4-(5-циано-2-тиенил)гексанола растворяют в 40 мл ацетонитрила и 0,80 мл (5,71 ммоль) триэтиламина. К полученной смеси добавляют 0,39 мл (5,07 ммоль) мезилхлорида. Примерно через 10 минут добавляют 6,34 г (42,3 ммоль) иодида натрия. После окончания реакции добавляют насыщенный раствор соли и этилацетат. Этилацетатный слой промывают водным раствором тиосульфата натрия и насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают силикагелем (элюирование этилацетатом:гексаном = 1:2), получая при этом 1,39 г (3,88 ммоль, 91,7%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, СDСl3) δ 0,93 (д, J=6,8 Гц, 3Н), 1,27 (д, J=6,8 Гц, 3Н), 1,49-1,62 (м, 1Н), 1,98-2,10 (м, 1Н), 2,27-2,36 (м, 1Н), 2,42-2,52 (м, 1Н), 2,60-2,71 (м, 1Н), 3,12-3,22 (м, 2Н), 7,29-7,31 (м, 2Н).
Справочный пример 49
Метил-3-(5-бром-2-тиенил)пропаноат
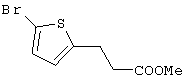
3,50 г (20,6 ммоль) метил-3-(2-тиенил)пропаноата, синтезированного способом, описанным в журнале J.Med.Chem., 1992, 35(21), 3870, растворяют в 20 мл ДМФА, добавляют 3,85 г (21,6 ммоль) NBS, растворенного в 10 мл ДМФА, и смесь нагревают при 80°С. Через 2 часа добавляют насыщенный раствор соли и смесь экстрагируют эфиром. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают силикагелем (этилацетат:гексан = 1:9), получая при этом 4,62 г (18,6 ммоль, 90,1%) указанного в заголовке соединения в виде бледно-желтого масла.
1H-ЯМР (400 МГц, СDСl3) δ 2,65 (т, J=7,4 Гц, 2Н), 3,08 (т, J=7,4 Гц, 2Н), 3,69 (с, 3Н), 6,58 (д, J=3,6 Гц, 1Н), 6,85 (д, J=3,6 Гц, 1Н).
Справочный пример 50
Метил-3-(5-циано-2-тиенил)пропаноат
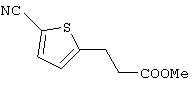
4,62 г (18,6 ммоль) метил-3-(5-бром-2-тиенил)пропаноата, 1,75 г (14,9 ммоль) Zn(CN)2 и 516 мг (0,93 ммоль) DPPF суспендируют в растворе 100 мл ДМФ и 1 мл воды, добавляют 341 мг (0,37 ммоль) Рd2dbа3 и смесь нагревают при 120°С. Через 2 часа смесь охлаждают и экстрагируют эфиром. Органический слой промывают насыщенным раствором соли и 2 н. раствором НСl, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают силикагелем (этилацетат:гексан = 1:9), получая при этом 2,96 г (18,6 ммоль, 100%) указанного в заголовке соединения в виде зеленого масла.
1H-ЯМР (400 МГц, CDCl3) δ 2,71 (т, J=7,4 Гц, 2Н), 3,19 (т, J=7,4 Гц, 2Н), 3,71 (с, 3Н), 6,85 (д, J=3,6 Гц, 1Н), 7,46 (д, J=3,6 Гц, 1Н).
Справочный пример 51
3-(2-Тиенил)пропанол
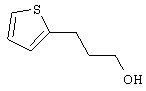
1,32 г (7,75 ммоль) метил-3-(2-тиенил)пропаноата растворяют в 50 мл ТГФ. Смесь охлаждают до -20°С и добавляют 6,00 мл LiAlH4 (1,0 М раствор). После окончания реакции смесь гасят водой и 5 н. раствором NaOH и фильтруют через целит. Фильтрат концентрируют и полученный сырой продукт обрабатывают силикагелем (этилацетат:гексан = 1:1), получая при этом 1,05 г (7,38 ммоль, 95,2%) указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 1,29 (т, J=6,0 Гц, 1Н), 1,90-2,00 (м, 2Н), 2,95 (т, J=7,6 Гц, 2Н), 3,72 (кв, J=6,0 Гц, 2Н), 6,80-6,83 (м, 1H), 6,91-6,94 (м, 1Н), 7,11-7,14 (м, 1Н).
Справочный пример 52
3-(5-Циано-2-тиенил)пропанол
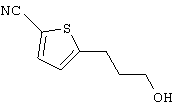
2,96 г (18,6 ммоль) метил-3-(5-циано-2-тиенил)пропаноата растворяют в 100 мл ТГФ, добавляют 450 мг (18,6 ммоль) борогидрида лития и смесь нагревают с обратным холодильником. Через один час нагревание прекращают и при охлаждении льдом к смеси добавляют 2 н. раствор НС1. Смесь экстрагируют этилацетатом, экстракт поочередно промывают насыщенным раствором соли и водой и сушат над безводным сульфатом магния. Растворитель выпаривают и получают сырой продукт. Сырой продукт обрабатывают силикагелем (элюирование этилацетатом:гексаном, от 25:75 до 50:50), получая при этом 1,37 г (8,19 ммоль, 44,0%) указанного в заголовке соединения в виде зеленого масла.
1H-ЯМР (400 МГц, СDСl3) δ 1,32-1,37 (м, 1Н), 1,90-2,00 (м, 2Н), 2,99 (т, J=7,6 Гц, 2Н), 3,68-3,76 (м, 2Н), 6,84 (д, J=3,6 Гц, 1Н), 7,47 (д, J=3,6 Гц, 1Н).
Справочный пример 53
трет-Бутил-4-[3-(2-тиенил)пропил]-1-пиперазинкарбоксилат
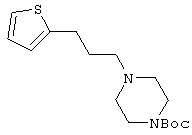
1,05 г (7,38 ммоль) 3-(2-тиенил)пропанола растворяют в 60 мл ацетонитрила и добавляют к раствору 2,58 мл (18,5 ммоль) триэтиламина и 0,63 мл (8,12 ммоль) мезилхлорида. Через 25 минут добавляют 2,07 г (11,1 ммоль) трет-бутил-1-пиперазинкарбоксилата, 3,32 г (22,7 ммоль) иодида натрия и 6 мл воды и нагревают смесь до 60°С. После окончания реакции добавляют насыщенный раствор соли и целевой продукт экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают и получают сырой продукт. Сырой продукт обрабатывают силикагелем Cromatorex NH (элюирование этилацетатом:гексаном = 2:8), получая при этом 1,94 г (6,25 ммоль, 84,7%) указанного в заголовке соединения в виде бледно-желтого масла.
1H-ЯМР (400 МГц, СDСl3) δ 1,46 (с, 9Н), 1,83-1,91 (м, 2Н), 2,35-2,42 (м, 2Н), 2,87 (т, J=7,6 Гц, 2Н), 3,40-3,46 (м, 4Н), 6,77-6,80 (м, 1Н), 6,91 (дд, J=3,2 Гц, 5,2 Гц, 1Н), 7,11 (дд, J=1,2 Гц, 5,2 Гц, 1Н).
Справочный пример 54
трет-Бутил-4-[3-(5-циано-2-тиенил)пропил]-1-пиперазинкарбоксилат
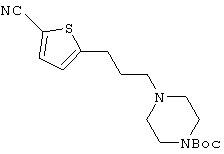
Указанное в заголовке соединение синтезируют аналогично способу получения трет-бутил-4-[3-(2-тиенил)пропил]-1-пиперазинкарбоксилата по справочному примеру 53 (выход 74,2%).
1H-ЯМР (400 МГц, СDСl3) δ 1,46 (с, 9Н), 1,83-1,91 (м, 2Н), 2,34-2,41 (м, 6Н), 2,91 (т, J=7,6 Гц, 2Н), 3,41-3,46 (м, 4Н), 6,81 (д, J=4,0 Гц, 1Н), 7,46 (д, J=4,0 Гц, 1Н).
Справочный пример 55
1-[3-(2-Тиенил)пропил]пиперазин
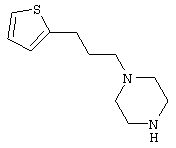
1,94 г (6,25 ммоль) трет-бутил-4-[3-(2-тиенил)пропил]-1-пиперазинкарбоксилата растворяют в 20 мл метанола и добавляют 15 мл 4 н. раствора хлороводорода в этилацетате. После окончания реакции смесь упаривают. Остаток доводят до рН 11, добавляя 2 н. водный раствор гидроксида натрия, целевой продукт экстрагируют хлороформом и сушат над безводным сульфатом магния. Растворитель выпаривают, получая при этом 1,23 г (5,85 ммоль, 93,6%) указанного в заголовке соединения в виде желтого масла, являющегося неочищенным продуктом.
1H-ЯМР (400 МГц, СDСl3) δ 1,84-1,92 (м, 2Н), 2,35-2,48 (м, 6Н), 2,83-2,93 (м, 6Н), 6,77-6,80 (м, 1Н), 6,91 (дд, J=3,2 Гц, 5,2 Гц, 1Н), 7,11 (дд, J=1,2 Гц, 5,2 Гц, 1Н).
Справочный пример 56
1-[3-(5-Циано-2-тиенил)пропил]пиперазин
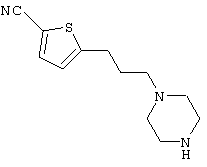
Указанное в заголовке соединение синтезируют аналогично способу получения 1-[3-(2-тиенил)пропил]пиперазина по справочному примеру 55 (выход 96,0%).
1H-ЯМР (400 МГц, СDСl3) δ 1,83-1,91 (м, 2Н), 2,33-2,44 (м, 6Н), 2,87-2,94 (м, 6Н), 6,81 (д, J=4,0 Гц, 1Н), 7,46 (д, J=4,0 Гц, 1Н).
Справочный пример 57
2-(Хлорметил)бензоксазол
Указанное в заголовке соединение получают способом, описанным в SYNTHETIC COMMUNICATION, 19(16), 2921-2924 (1989) (выход количественный).
1H-ЯМР (400 МГц, СDСl3) δ 4,77 (с, 2Н), 7,34-7,43 (м, 2Н), 7,54-7,58 (м, 1Н), 7,73-7,77 (м, 1Н).
Справочный пример 58
Бензил-4-[(2-бензоксазоил)метил]-1-пиперазинкарбоксилат
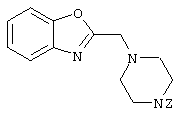
2,00 г (11,9 ммоль) 2-(хлорметил)бензоксазола растворяют в 50 мл ацетонитрила, добавляют 1,66 мл (11,9 ммоль) триэтиламина и 3,15 г (14,3 ммоль) бензил-1-пиперазинкарбоксилата и смесь перемешивают при 80°С. Через 2 часа реакционный раствор концентрируют, добавляют насыщенный раствор соли и целевой продукт экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают и получают сырой продукт. Сырой продукт обрабатывают силикагелем Cromatorex NH (этилцетат:гексан = 25:75), получая при этом 3,57 г (10,2 ммоль, 85,7%) указанного в заголовке соединения в виде желтого сиропа.
1H-ЯМР (400 МГц, СDСl3) δ 2,56-2,68 (шир. д-с, 4Н), 3,56-3,62 (м, 4Н), 3,89 (с, 2Н), 5,12 (с, 2Н), 7,28-7,37 (м, 7Н), 7,52-7,55 (м, 1Н), 7,70-7,74 (м, 1Н).
Справочный пример 59
1-[(2-Бензоксазоил)метил]пиперазин
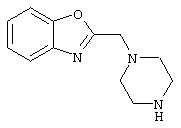
3,57 г (10,2 ммоль) бензил-4-[(2-бензоксазоил)метил]-1-пиперазинкарбоксилата растворяют в 50 мл метанола и добавляют 400 мг 10% Pd-C. Атмосферу заменяют водородом и смесь перемешивают. После окончания реакции реакционный раствор фильтруют и упаривают, получая при этом 2,15 г (9,89 ммоль, 97,0%) указанного в заголовке соединения в виде желтого масла, являющегося неочищенным продуктом.
1H-ЯМР (400 МГц, СDСl3) δ 2,56-2,66 (м, 4Н), 2,96-2,98 (м, 4Н), 3,87 (с, 2Н), 7,31-7,36 (м, 2Н), 7,51-7,56 (м, 1Н), 7,69-7,74 (м, 1Н).
Справочный пример 60
2-(Хлорметил)-5-цианобензоксазол
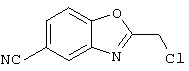
Указанное в заголовке соединение синтезируют способом, описанным в SYNTHETIC COMMUNICATION, 19(16), 2921-2924 (1989) (выход 79,8%).
1H-ЯМР (400 МГц, СDСl3) δ 4,78 (с, 2Н), 7,66-7,73 (м, 2Н), 8,08-8,10 (м, 1Н).
Справочный пример 61
Бензил-4-[{2-(5-цианобензоксазоил)}метил]-1-пиперазинкарбоксилат
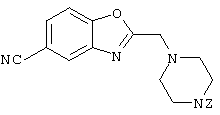
Указанное в заголовке соединение синтезируют аналогично способу получения бензил-4-[(2-бензоксазоил)метил]-1-пиперазинкарбоксилата по справочному примеру 58 (выход 85,6%).
1H-ЯМР (400 МГц, СDСl3) δ 2,57-2,70 (шир.д-с, 4Н), 3,56- 3,63 (м, 4Н), 3,92 (с, 2Н), 5,13 (с, 2Н), 7,30-7,38 (м, 5Н), 7,62-7,68 (м, 2Н), 8,04-8,05 (м, 1Н).
Справочный пример 62
1-[{2-(5-Цианобензоксазоил)}метил]пиперазин
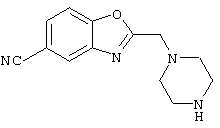
Указанное в заголовке соединение синтезируют способом, описанным в справочном примере 59 (выход 58,0%).
1H-ЯМР (400 МГц, СDСl3) δ 2,59-2,66 (м, 4Н), 2,93-3,00 (м, 4Н), 3,90 (с, 2Н), 7,62-7,67 (м, 2Н), 8,03-8,05 (м, 1Н).
Справочный пример 63
Этил-4-циано-5-метил-4-(3-тиенил)гексаноат
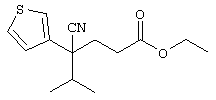
3-Метил-2-(3-тиенил)бутаннитрил (6,23 г), полученный при использовании 3-тиенилацетонитрила в качестве исходного вещества способом по примеру 114, описанному в JP-A 11-206862, и этилакрилат (4,53 г) растворяют в диметилформамиде (15 мл) и при комнатной температуре добавляют к раствору трет-бутоксида калия (423 мг) в растворе диметилформамида (60 мл). Смесь перемешивают в течение 5 часов и отделяют органический слой, добавляя насыщенный водный раствор хлорида аммония и диэтиловый эфир. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и фильтрат упаривают. Остаток очищают хроматографией на колонке с силикагелем (система: гексан/этилацетат), получая при этом указанное в заголовке соединение в виде желтого масла (6,66 г, 67%).
1H-ЯМР (400 МГц, СDСl3) δ 0,85 (д, J=6,8 Гц, 3Н), 1,19 (д, J=6,8 Гц, 3Н), 1,22 (т, J=7,2 Гц, 3Н), 2,00-2,18 (м, 3Н), 2,38-2,50 (м, 2Н), 4,02-4,14 (м, 2Н), 6,94 (дд, J=1,4 Гц, 5,0 Гц, 1Н), 7,29 (дд, J=1,4 Гц, 2,8 Гц, 1Н), 7,37 (дд, J=2,9 Гц, 5,0 Гц, 1Н).
Справочный пример 64
4-Циано-5-метил-4-(3-тиенил)гексанол
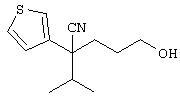
Раствор (35 мл) этил-4-циано-5-метил-4-(3-тиенил)гексаноата (6,66 г) в тетрагидрофуране добавляют по каплям к раствору (50 мл) алюмогидрида лития (686 мг) в тетрагидрофуране. Смесь перемешивают в течение 2 часов, добавляют 2 н. водный раствор NaOH и воду и фильтруют образовавшийся осадок. Полученный фильтрат упаривают и остаток очищают хроматографией на колонке с силикагелем (система этилацетат/гексан), получая при этом указанное в заголовке соединение в виде желтого масла (5,30 г, 95%).
1H-ЯМР (400 МГц, СDСl3) δ 0,85 (д, J=6,8 Гц, 3Н), 1,17 (д, J=6,6 Гц, 3Н), 1,18-1,22 (м, 1Н), 1,22-1,36 (м, 1Н), 1,56-1,72 (м, 1Н), 1,90 (ддд, J=4,6 Гц, 12,1 Гц, 13,4 Гц, 1Н), 2,04-2,12 (м, 1Н), 2,14-2,22 (м, 1Н), 3,58-3,65 (м, 2Н), 6,95 (дд, J=1,5 Гц, 5,1 Гц, 1Н), 7,28 (дд, J=1,5 Гц, 3,0 Гц, 1Н), 7,35 (дд, J=3,0 Гц, 5,1 Гц, 1Н).
Справочный пример 65
1-Иод-4-циано-5-метил-4-(3-тиенил)гексан
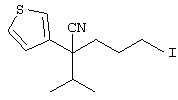
В атмосфере азота метансульфонилхлорид (0,20 мл) добавляют к раствору (9,0 мл) 4-циано-5-метил-4-(3-тиенил)гексанола (400 мг) и триэтиламина (0,75 мл) в ацетонитриле при комнатной температуре и полученную смесь перемешивают. Через 2 часа добавляют воду и этилацетат и отделяют органический слой. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и фильтрат упаривают. Образовавшийся остаток растворяют в ацетоне (18 мл), добавляют иодид натрия (2,68 г) и смесь перемешивают при 40°С в течение 2 часов. Органический слой отделяют, добавляя воду и этилацетат. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и фильтрат упаривают, получая указанное в заголовке соединение в виде желтого масла (670 мг).
1H-ЯМР (400 МГц, СDСl3) δ 0,85 (д, J=6,8 Гц, 3Н), 1,18 (д, J=6,6 Гц, 3Н), 1,46-1,60 (м, 1Н), 1,86-2,00 (м, 1Н), 2,02-2,20 (м, 2Н), 3,05-3,20 (м, 2Н), 6,95 (дд, J=1,2 Гц, 5,2 Гц, 1Н), 7,28 (дд, J=1,2 Гц, 2,8 Гц, 1Н), 7,37 (дд, J=2,8 Гц, 5,2 Гц, 1Н).
Справочный пример 66
Этил-4-циано-5-метил-4-[4-(2-циано)тиенил]гексаноат
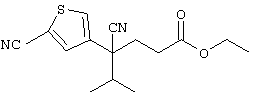
В атмосфере азота этил-4-циано-5-метил-4-(3-тиенил)гексаноат (1,8 г) растворяют в диметилформамиде (7 мл) и по каплям добавляют раствор N-бромсукцинимида (1,33 г) в диметилформамиде (7 мл) при комнатной температуре в течение 30 минут. Смесь перемешивают при 50°С в течение 4,5 часов и органический слой отделяют, добавляя воду и диэтиловый эфир. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и фильтрат упаривают, получая 4-циано-5-метил-4-[4-(2-бром)тиенил]гексаноат (2,42 г) в виде желтого масла. Полученное бромсодержащее соединение (2,42 г) растворяют в растворе цианида цинка (637 мг) и 1,1’-бис(дифенилфосфино)ферроцена (188 мг) в смеси диметилформамида (17 мл) и воды (0,17 мл) в атмосфере азота. Добавляют комплекс палладия и дибензилиденацетона (124 мг). После троекратной замены атмосферы азотом смесь перемешивают при 120°С в течение 5 часов. Органический слой отделяют, добавляя воду, диэтиловый эфир и водный раствор аммиака. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и фильтрат упаривают. Остаток очищают хроматографией на колонке с силикагелем (система гексан:этилацетат), получая при этом указанное в заголовке соединение в виде желтого масла (338 мг, 17%, 2 стадии). (Справочная литература: Р.Е.Maligres et al., "Tetrahedron 40 (1999), 8193-8195").
1H-ЯМР (400 МГц, СDСl3) δ 0,86 (д, J=6,8 Гц, 3Н), 1,20 (д, J=6,4 Гц, 3Н), 1,23 (т, J=7,2 Гц, 3H), 1,95-2,15 (м, 3Н), 2,40-2,53 (м, 2Н), 4,04-4,14 (м, 2Н), 7,48 (д, J=1,6 Гц, 1Н), 7,58 (д, J=1,6 Гц, 1Н).
Справочный пример 67
4-Циано-5-метил-4-(2-циано-4-тиенил)гексанол
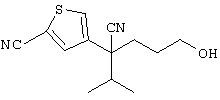
Указанное в заголовке соединение получают в виде желтого масла вышеуказанным способом восстановления LiBH4 (30%).
1H-ЯМР (400 МГц, СDСl3) δ 0,86 (д, J=6,8 Гц, 3Н), 1,18 (д, J=6,8 Гц, 3Н), 1,20-1,33 (м, 1Н), 1,60-1,72 (м, 1Н), 1,86-1,96 (м, 1Н), 2,00-2,12 (м, 1Н), 2,16-2,26 (м, 1Н), 3,60-3,68 (м, 2Н), 7,48 (д, J=1,6 Гц, 1Н), 7,57 (д, J=1,6 Гц, 1Н).
Справочный пример 68
1-Иод-4-циано-5-метил-4-[4-(2-циано)тиенил]гексан
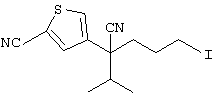
Указанное в заголовке соединение синтезируют в виде желтого масла способами, описанными в справочных примерах 63, 64 и 65 (91%).
1H-ЯМР (400 МГц, СDСl3) δ 0,86 (д, J=6,8 Гц, 3Н), 1,19 (д, J=6,8 Гц, 3Н), 1,20-1,30 (м, 1Н), 1,40-1,55 (м, 1Н), 1,90-2,00 (м, 1Н), 2,00-2,12 (м, 1Н), 2,16-2,26 (м, 1Н), 3,06-3,17 (м, 1Н), 3,17-3,23 (м, 1Н), 7,48 (д, J=1,6 Гц, 1Н), 7,57 (д, J=1,6 Гц, 1Н).
Справочный пример 69
2-(2-Циано-4-фторфенокси)этилпиперазин
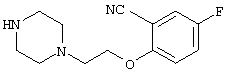
В атмосфере азота трет-бутоксид калия (869 мг) добавляют к раствору (10 мл) бензил-4-(2-гидроксиэтил)-1-пиперазинкарбоксилата (1,86 г) в тетрагидрофуране на бане со льдом. Реакционную систему перемешивают в течение одного часа, переносят на баню со смесью сухого льда с метанолом и через 10 минут добавляют раствор 2,5-дифторбензонитрила (1,09 г) в тетрагидрофуране (5 мл). Реакционную систему перемешивают в течение 2 часов, позволяя ей нагреваться до комнатной температуры, затем добавляют насыщенный водный раствор хлорида аммония и диэтиловый эфир и отделяют органический слой. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и фильтрат упаривают. Остаток очищают хроматографией на колонке с силикагелем (система гексан:этилацетат) и получают бесцветное масло, являющееся промежуточным веществом (1,10 г, 46%). Промежуточное вещество (1,10 г) растворяют в метаноле (10 мл), добавляют 10% палладий на угле (100 мг) и смесь перемешивают при комнатной температуре в атмосфере водорода. Через 1,5 часа катализатор реакции фильтруют через целит и фильтрат упаривают. Указанное в заголовке соединение (647 мг, 80%) используют при осуществлении следующей реакции без очистки.
Свободное соединение:
1H-ЯМР (400 МГц, СDСl3) δ 2,55-2,63 (м, 4Н), 2,87 (т, J=5,7 Гц, 2Н), 2,89-2,92 (м, 4Н), 4,19 (т, J=5,7 Гц, 2Н), 6,93 (дд, J=4 Гц, 8,8 Гц, 1Н), 7,21-7,29 (м, 2Н).
Справочный пример 70
4-Циано-5-метил-4-[4-(2,5-дибром)тиенил]гексанол
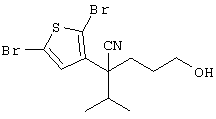
В атмосфере азота 4-циано-5-метил-4-(3-тиенил)гексанол (500 мг) растворяют в диметилформамиде (5 мл) и добавляют N-бромсукцинимид (1,0 г) при комнатной температуре. Смесь перемешивают при 100°С в течение одного часа, добавляют воду и диэтиловый эфир, и отделяют органический слой. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и фильтрат упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (система гексан:этилацетат), получая при этом указанное в заголовке соединение в виде желтого масла (670 мг, 78%).
1H-ЯМР (400 МГц, СDСl3) δ 0,92 (д, J=6,8 Гц, 3Н), 1,18 (д, J=6,8 Гц, 3Н), 1,31-1,44 (м, 1Н), 1,60-1,74 (м, 1Н), 2,08 (ддд, J=4,3 Гц, 12,1 Гц, 13,6 Гц, 1Н), 2,43 (ддд, J=4,6 Гц, 12,3 Гц, 13,6 Гц, 1Н), 2,59 (септ, J=6,8 Гц, 2Н), 7,05 (с, 1Н).
Справочный пример 71
2-(4-Метилсульфонилфенокси)этилпиперазин
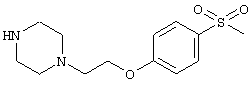
В атмосфере азота 4-(метилтио)фенол (4,2 г) и бромэтанол (5,6 г) растворяют в растворе диметилформамида (60 мл), добавляют карбонат калия (12,4 г) и, перемешивая, нагревают смесь при 100°С. Через 3 часа смесь охлаждают до комнатной температуры и отделяют органический слой, добавляя диэтиловый эфир и воду. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и смесь упаривают. Остаток очищают хроматографией на колонке с силикагелем (система: гексан/этилацетат), получая при этом (4-метилтиофенокси)этанол (3,55 г, 64%) в виде белых кристаллов. Продукт (1,0 г) растворяют в дихлорметане (50 мл), смесь охлаждают на бане со смесью сухого льда с метанолом, добавляют мета-хлорпербензойную кислоту (3,6 г) и смесь перемешивают. Реакционную смесь оставляют охлаждаться до комнатной температуры на 2 часа и затем добавляют 1 н. водный раствор бикарбоната натрия и 1 н. раствор Na2S2O3. Смесь перемешивают, экстрагируют дихлорметаном и сушат над безводным сульфатом магния. Осушитель отфильтровывают и смесь упаривают. Остаток растворяют в ацетонитриле (18 мл), добавляют триэтиламин (2,3 мл) и метансульфонилхлорид (0,5 мл) и перемешивают смесь при комнатной температуре. Через 1,5 часа добавляют иодид натрия (4,9 г) и трет-бутил-1-пиперазинкарбоксилат (1,2 г) и, перемешивая, нагревают смесь при 60°С. Реакционную смесь перемешивают в течение 4,5 часов и отделяют органический слой, добавляя этилацетат и воду. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и смесь упаривают. Остаток очищают хроматографией на колонке с силикагелем (система: гексан/этилацетат), получая при этом трет-бутил-2-(4-метилтиофенокси)этил-1-пиперазинкарбоксилат (1,15 г) в виде белых кристаллов. Продукт (1,15 г) растворяют в метаноле (10 мл) и полученный раствор добавляют к 4 н. раствору хлористоводородной кислоты в этилацетате (30 мл) на бане со льдом. Смесь перемешивают при комнатной температуре в течение ночи, образовавшиеся белые кристаллы собирают фильтрованием и промывают диэтиловым эфиром. К кристаллам добавляют 1 н. водный раствор гидроксида натрия и дихлорметан и отделяют органический слой. Полученный органический слой упаривают, получая при этом указанное в заголовке соединение в виде желтого масла (820 мг, 53%, 3 стадии).
1H-ЯМР (400 МГц, СDСl3) δ 2,52-2,60 (м, 4Н), 2,83 (т, J=5,8 Гц, 2Н), 2,93 (шир.т, J=4,8 Гц, 4Н), 3,03 (с, 3Н), 4,18 (т, J=5,8 Гц, 2Н), 7,03 (шир.д, J=9,0 Гц, 2Н), 7,86 (шир.д, J=9,0 Гц, 2Н).
Справочный пример 72
2-(3-Ацетилфенокси)этилпиперазин
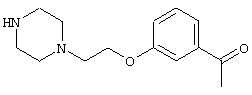
В атмосфере азота 3-гидроксиацетофенон (4,1 г) и бромированный этанол (5,6 г) растворяют в растворе диметилформамида (60 мл), добавляют карбонат калия (12,4 г) и, перемешивая, нагревают смесь при 100°С. Через 3 часа смесь охлаждают до комнатной температуры и отделяют органический слой, добавляя воду и диэтиловый эфир. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и смесь упаривают. Остаток очищают хроматографией на колонке с силикагелем (система: гексан/этилацетат), получая (3-ацетилфенокси)этанол (3,28 г, 61%) в виде белых кристаллов. Продукт (977 мг) растворяют в ацетонитриле (18 мл), добавляют триэтиламин (2,3 мл) и метансульфонилхлорид (0,5 мл) и смесь перемешивают при комнатной температуре. Через 1,5 часа добавляют иодид натрия (4,9 г) и трет-бутил-1-пиперазинкарбоксилат (1,2 г) и, перемешивая, нагревают смесь при 60°С. Реакционную смесь перемешивают в течение 4,5 часов и отделяют органический слой, добавляя воду и этилацетат. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и смесь упаривают. Остаток очищают хроматографией на колонке с силикагелем (система: гексан/этилацетат), получая трет-бутил-2-(3-ацетилфенокси)этил-1-пиперазинкарбоксилат (1,33 г) в виде желтого масла. Продукт (1,33 г) растворяют в метаноле (10 мл) и раствор добавляют к 4 н. раствору хлористоводородной кислоты в этилацетате (30 мл). Смесь перемешивают при комнатной температуре в течение ночи, образовавшиеся белые кристаллы собирают фильтрованием и промывают диэтиловым эфиром. Органический слой отделяют, добавляя к кристаллам 1 н. водный раствор гидроксида натрия и дихлорметан. Полученный органический слой упаривают, получая при этом указанное в заголовке соединение (830 мг, 62%, 2 стадии) в виде желтого масла.
1H-ЯМР (400 МГц, СDСl3) δ 2,52-2,60 (м, 4Н), 2,60 (с, 3Н), 2,82 (т, J=5,8 Гц, 2Н), 3,93 (шир.т, J=4,9 Гц, 4Н), 4,16 (т, J=5,8 Гц, 2Н), 7,12 (ддд, J=1,1 Гц, 2,6 Гц, 8,2 Гц, 1Н), 7,34-7,40 (м, 1Н), 7,50 (дд, J=1,5 Гц, 2,6 Гц, 1Н), 7,54 (ддд, J=1,1 Гц, 1,5 Гц, 7,5 Гц, 1Н).
Справочный пример 73
1-[4-Циано-5-метил-4-(2-тиенил)гексил]пиперазин
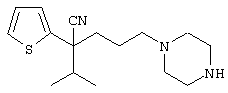
трет-Бутил-1-пиперазинкарбоксилат (540 мг) добавляют к раствору (11 мл) 1-иод-4-циано-5-метил-4-(2-тиенил)гексана (744 мг) и триэтиламина (0,93 мл), синтезированного по примеру 84, в ацетонитриле и смесь перемешивают при 50°С в течение 5 часов в атмосфере азота. Реакционный раствор упаривают и сырой продукт очищают хроматографией на колонке с силикагелем (система: гексан/этилацетат), получая бесцветное масло (705 мг, 81%). Полученный продукт (705 мг) растворяют в метаноле (5 мл), добавляют 4 н. раствор хлористоводородной кислоты в этилацетате (15 мл) и смесь перемешивают в течение 10 часов. К смеси добавляют диэтиловый эфир и этилацетат и перемешивают на бане со льдом. Гидрохлорид указанного в заголовке соединения собирают фильтрованием (белые кристаллы, 490 мг, 75%). Полученный гидрохлорид экстрагируют дихлорметаном и насыщенным водным раствором бикарбоната натрия, превращают в свободное соединение и используют при осуществлении следующей реакции.
Гидрохлорид:
1H-ЯМР (400 МГц, СDСl3) δ 0,82 (д, J=6,8 Гц, 3Н), 1,10 (д, J=6,6 Гц, 3Н), 1,30-1,55 (м, 1Н), 1,60-1,83 (м, 1Н), 1,83-2,00 (м, 1H), 2,22-2,30 (м, 2Н), 3,00-3,80 (м, 10Н), 7,07 (дд, J=5,1 Гц, 3,5 Гц, 1Н), 7,11 (дд, J=3,5 Гц, 1,3 Гц, 1Н), 7,59 (дд, J=5,1 Гц, 1,3 Гц, 1Н), 9,30-9,70 (м, 2Н).
ESI-MC (m/е): 292 (М+Н).
Справочный пример 74
1-[3-Циано-4-метил-3-(2-тиенил)пентил]пиперазин
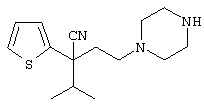
Указанное в заголовке соединение синтезируют способом по справочному примеру 73.
Свободное соединение:
1H-ЯМР (400 МГц, СDСl3) δ 0,91 (д, J=6,6 Гц, 3Н), 1,19 (д, J=6,8 Гц, 3Н), 1,50-1,60 (м, 1Н), 1,88-1,98 (м, 1Н), 2,20-2,18 (м, 2Н), 2,28-2,52 (м, 6Н), 2,83-2,90 (м, 4Н), 6,94-6,98 (м, 1Н), 7,10-7,13 (м, 1Н), 7,25-7,30 (м, 1Н).
Справочный пример 75
4-(1,4-Диазепан-1-ил)-1-изопропил-1-фенилбутилцианид
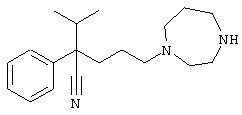
Указанное в заголовке соединение синтезируют из трет-бутил-1-гомопиперазинкарбоксилата способом по справочному примеру 73.
Свободное соединение:
1H-ЯМР (400 МГц, СDСl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,02-1,20 (м, 1Н), 1,20 (д, J=6,6 Гц, 3H), 1,44-1,62 (м, 1Н), 1,64-1,74 (м, 2Н), 1,85-1,95 (м, 1Н), 2,06-2,20 (м, 2Н), 2,36-2,48 (м, 2Н), 2,50-2,59 (м, 4Н), 2,80-2,86 (м, 2Н), 2,89 (т, J=6,1 Гц, 2Н), 7,25-7,34 (м, 1Н), 7,36-7,40 (м, 4Н).
Справочный пример 76
1-(Винилсульфонил)пиперидин
1H-ЯМР (400 МГц, СDСl3) δ 1,47-1,60 (м, 2Н), 1,60-1,70 (м, 4Н), 3,07-3,18 (м, 4Н), 5,99 (д, J=9,9 Гц, 1Н), 6,20 (д, J=16,7 Гц, 1Н), 6,41 (дд, J=16,7 Гц, 9,9 Гц, 1Н).
Справочный пример 77
1,2,3,4-Тетрагидро-1-хинолинилвинилсульфон
1H-ЯМР (400 МГц, СDСl3) δ 1,95-2,05 (м, 2Н), 2,81 (т, J=6,8 Гц, 2Н), 3,75-3,85 (м, 2Н), 5,91 (д, J=10,4 Гц, 1Н), 6,23 (д, J=16,4 Гц, 1Н), 6,46 (дд, J=16,4 Гц, 10,4 Гц, 1Н), 7,00-7,20 (м, 3Н), 7,65 (д, J=8,4 Гц, 1Н).
Справочный пример 78
5-(2,5-Дигидро-1Н-1-пирролил)-2-изопропил-5-оксо-2-(2-тиенил)пентаннитрил
В атмосфере азота диэтилцианофосфонат (618 мг) добавляют при комнатной температуре к раствору (15 мл) 3-пирролина (262 мг) и 4-циано-4-(2-тиенил)-5-метилгексановой кислоты (692 мг) в тетрагидрофуране и смесь перемешивают в течение ночи. Затем реакционный раствор упаривают и сырой продукт очищают хроматографией на колонке с силикагелем (система: гексан/этилацетат), получая при этом указанное в заголовке соединение в виде желтого масла (440 мг).
1H-ЯМР (400 МГц, СDСl3) δ 0,92 (д, J=6,8 Гц, 3Н), 1,22 (д, J=6,6 Гц, 3Н), 2,00-2,30 (м, 3H), 2,40-2,60 (м, 2Н), 4,00-4,30 (м, 4Н), 5,70-5,80 (м, 1Н), 5,80-5,90 (м, 1Н), 6,87-7,00 (м, 1Н), 7,15 (м, 1Н), 7,23-7,26 (м, 1Н).
Физико-химические данные нижеследующих соединений включают значения ЯМР, измеренные для свободного соединения, и значения ESI-MC, измеренные для гидрохлорида. Гидрохлорид получают способом, описанным в JP-A 11-206862.
Справочный пример 79
1-[4-Циано-4-(5-циано-2-тиенил)-5-метилгексил]-(3R)-3-трет-бутоксикарбониламинопирролидин
867 мг (3,49 ммоль) 4-циано-4-(5-циано-2-тиенил)-5-метилгексанола растворяют в 20 мл ацетонитрила. Добавляют 0,58 мл (1,20 экв.) триэтиламина и 0,30 мл (1,10 экв.) мезилхлорида. Через 10 минут добавляют насыщенный раствор соли и целевой продукт экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают и получают сырой продукт. Продукт растворяют в 30 мл ацетонитрила, добавляют 1,57 г (3,00 экв.) иодида натрия, 0,54 мл (1,10 экв.) триэтиламина и 845 мг (4,54 ммоль) (3R)-3-трет-бутоксикарбониламинопирролидина и смесь нагревают при 60°С. После окончания реакции добавляют насыщенный раствор соли и целевой продукт экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают и получают сырой продукт. Сырой продукт обрабатывают 100 г силикагеля Cromatorex NH (этилацетат:гексан = 25-35% этилацетата), получая при этом 1,34 г (3,21 ммоль, 92,0%) указанного в заголовке соединения в виде желтого масла. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, СDСl3) δ 0,92 (д, J=6,4 Гц, 3Н), 1,21 (д, J=6,8 Гц, 3Н), 1,17-1,30 (м, 1Н), 1,44 (с, 9Н), 1,50-1,70 (м, 1Н), 1,72-1,84 (м, 1Н), 2,00-2,12 (м, 1Н), 2,15-2,30 (м, 3Н), 2,31-2,49 (м, 4Н), 2,49-2,55 (м, 1Н), 2,62-2,75 (м, 1Н), 4,07-4,20 (м, 1Н), 4,70-4,82 (шир.д-с, 1Н, 7,15 (д, J=3,6 Гц, 1Н), 7,52 (д, J=3,6 Гц, 1Н).
Справочный пример 80
1-[4-Циано-4-(5-циано-2-тиенил)-5-метилгексил]-(3R)-3-аминопирролидин
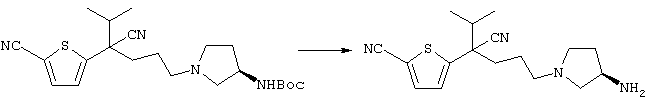
1-[4-Циано-4-(5-циано-2-тиенил)-5-метилгексил]-(3R)-3-трет-бутоксикарбониламинопирролидин (1,34 г, 3,21 ммоль), полученный в справочном примере 79, растворяют в 10 мл метанола и добавляют 10 мл 4 н. раствора хлористоводородной кислоты в этилацетате. После окончания реакции смесь подщелачивают 5 н. раствором гидроксида натрия и экстрагируют хлороформом. Органический слой сушат над сульфатом магния и упаривают, получая при этом 998 мг (3,15 ммоль, 99,5%, красное масло) сырого продукта. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, СDСl3) δ 0,92 (д, J=6,8 Гц, 3Н), 1,21 (д, J=6,4 Гц, 3Н), 1,18-1,32 (м, 1Н), 1,39-1,71 (м, 2Н), 1,75-1,85 (м, 1Н), 2,01-2,19 (м, 2Н), 2,19-2,29 (м, 2Н), 2,32-2,41 (м, 2Н), 2,42-2,51 (м, 1Н), 2,57-2,66 (м, 2Н), 3,45-3,52 (м, 1Н), 7,15 (д, J=3,6 Гц, 1Н), 7,52 (д, J=3,6 Гц, 1Н).
Справочный пример 81
Получение 1-[4-циано-4-(5-циано-2-тиенил)-5-метилгексил]-(3R)-3-[N-(2-цианоэтил)амино]пирролидина
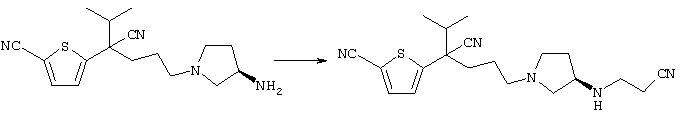
998 мг (3,15 ммоль) 1-[4-циано-4-(5-циано-2-тиенил)-5-метилгексил]-(3R)-3-аминопирролидина, полученного в справочном примере 80, растворяют в 25 мл метанола, добавляют 0,26 мл (3,94 ммоль) акрилонитрила и реакционный раствор нагревают с обратным холодильником. После окончания реакции смесь упаривают и получают сырой продукт. Сырой продукт обрабатывают 5 г силикагеля Cromatorex NH (100% этилцетата), получая при этом 1,01 г (2,73 ммоль, 86,7%) указанного в заголовке соединения в виде оранжевого масла. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, СDСl3) δ 0,92 (д, J=6,4 Гц, 3Н), 1,21 (д, J=6,4 Гц, 3Н), 1,20-1,31 (м, 1Н), 1,48-1,71 (м, 2Н), 1,76-1,86 (м, 1Н), 2,02-2,15 (м, 2Н), 2,18-2,29 (м, 1Н), 2,30-2,39 (м, 3H), 2,43-2,56 (м, 4Н), 2,56-2,64 (м, 1Н), 2,86 (т, J=6,4 Гц, 2Н), 3,25-3,33 (м, 1Н), 7,16 (д, J=4,0 Гц, 1Н), 7,52 (д, J=4,0 Гц, 1Н).
Справочный пример 82
1-[4-Циано-4-(5-циано-2-тиенил)-5-метилгексил]пиперазин
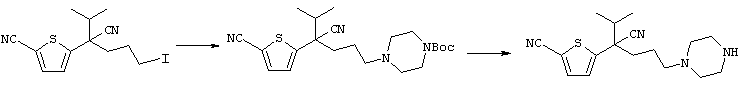
1-[4-Циано-4-(5-циано-2-тиенил)-5-метилгексил]-4-(трет-бутоксикарбонил)пиперазин синтезируют из 4-циано-4-(5-циано-2-тиенил)-5-метилгексилиодида и трет-бутил-1-пиперазинкарбоксилата способом по примеру 77. Указанное в заголовке соединение получают, снимая защиту с Вос-группы способом, описанным в справочном примере 79. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, СDСl3) δ 0,92 (д, J=6,4 Гц, 3Н), 1,21 (д, J=6,8 Гц, 3Н), 1,20-1,32 (м, 1Н), 1,59-1,83 (м, 2Н), 2,01-2,11-1,80 (м, 1Н), 2,17-2,40 (м, 7Н), 2,80-2,92 (м, 4Н), 7,15 (д, J=4,0 Гц, 1Н), 5,71 (д, J=4,0 Гц, 1Н).
Справочный пример 83
1-[4-Циано-5-метил-4-(4-фторфенил)гексил]пиперазин
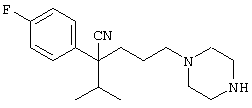
Указанное в заголовке соединение синтезируют способом по справочному примеру 73.
Свободное соединение:
1H-ЯМР (400 МГц, СDСl3) δ 0,77 (д, J=6, 8 Гц, 3Н), 1,08-1,17 (м, 1Н), 1,19 (д, J=6,6 Гц, 3H), 1,52-1,62 (м, 1Н), 1,81-1,89 (м, 1Н), 2,04-2,18 (м, 2Н), 2,22-2,29 (м, 6Н), 2,83-2,87 (м, 4Н), 7,04-7,08 (м, 2Н), 7,32-7,36 (м, 2Н).
Справочный пример 84
1-[4-Циано-5-метил-4-(3-фторфенил)гексил]пиперазин
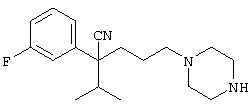
Указанное в заголовке соединение синтезируют способом по справочному примеру 73.
Свободное соединение:
1H-ЯМР (400 МГц, СDСl3) δ 0,79 (д, J=6,6 Гц, 3Н), 0,81-1,19 (м, 1Н), 1,21 (д, J=6,6 Гц, 3Н), 1,54-1,59 (м, 1Н), 1,81-1,89 (м, 1Н), 2,05-2,29 (м, 8Н), 2,83-2,87 (м, 4Н), 6,97-7,03 (м, 1Н), 7,06-7,10 (м, 1Н), 7,17-7,20 (м, 1Н), 7,32-7,37 (м, 1Н).
Справочный пример 85
1-[4-Циано-5-метил-4-(2-фторфенил)гексил]пиперазин
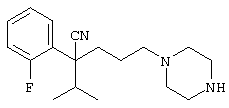
Указанное в заголовке соединение синтезируют способом по справочному примеру 73.
Свободное соединение:
1H-ЯМР (400 МГц, СDСl3) δ 0,80 (д, J=6,8 Гц, 3Н), 1,10-1,16 (м, 1Н), 1,22 (д, J=6,6 Гц, 3Н), 1,55-1,64 (м, 1Н), 2,03-2,11 (м, 1Н), 2,17-2,34 (м, 7Н), 2,43-2,50 (м, 1Н), 2,80-2,87 (м, 4Н), 7,01-7,06 (м, 1Н), 7,13-7,17 (м, 1Н), 7,26-7,34 (м, 1Н), 7,56-7,61 (м, 1Н).
Справочный пример 86
1-[4-Циано-5-метил-4-(2-толил)гексил]пиперазин
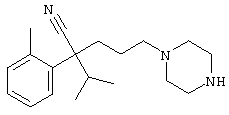
Указанное в заголовке соединение получают в виде бесцветного масла способом по справочному примеру 73.
1H-ЯМР (400 МГц, СDСl3) δ 0,86 (д, J=6,8 Гц, 3Н), 1,10-1,24 (м, 1Н), 1,18 (д, J=6,8 Гц, 3Н), 1,50-1,64 (м, 1Н), 2,02-2,14 (м, 1Н), 2,14-2,30 (м, 1Н), 2,20-2,40 (м, 6Н), 2,36-2,54 (м, 1Н), 2,50 (с, 3Н), 2,78-2,90 (м, 4Н), 7,10-7,24 (м, 3Н), 7,46-7,56 (м, 1Н).
Справочный пример 87
1-[4-Циано-5-метил-4-(2-метоксифенил)гексил]пиперазин
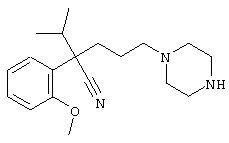
Указанное в заголовке соединение получают в виде бесцветного масла способом по справочному примеру 73.
1H-ЯМР (400 МГц, СDСl3) δ 0,75 (д, J=6,4 Гц, 3Н), 1,00-1,20 (м, 1Н), 1,18 (д, J=6,8 Гц, 3Н), 1,45-1,60 (м, 1Н), 1,90-2,00 (м, 1Н), 2,20-2,40 (м, 6Н), 2,35-2,50 (м, 1Н), 2,65-2,75 (м, 1Н), 2,75-2,90 (м, 4Н), 3,80 (с, 3Н), 6,87 (д, J=8,4 Гц, 1Н), 6,95 (т, J=7,6 Гц, 1Н), 7,24-7,32 (м, 1Н), 7,55 (д, J=7,6 Гц, 1Н).
Справочный пример 88
1-[4-Циано-5-метил-4-(2-хлорфенил)гексил]пиперазин
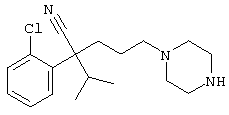
Указанное в заголовке соединение получают в виде бесцветного масла способом по справочному примеру 73.
1H-ЯМР (400 МГц, СDСl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,02-1,18 (м, 1Н), 1,23 (д, J=6,8 Гц, 3Н), 1,45-1,60 (м, 1Н), 1,95-2,10 (м, 1Н), 2,20-2,40 (м, 6Н), 2,64-2,76 (м, 1Н), 2,80-2,90 (м, 4Н), 2,88-3,02 (м, 1Н), 7,22-7,32 (м, 2Н), 7,34-7,40 (м, 1Н), 7,71-7,77 (м, 1Н).
Справочный пример 89
1-Бензил-4-[3-[1-(4-фторфенил)циклогексил]-1-оксопропил]пиперазин
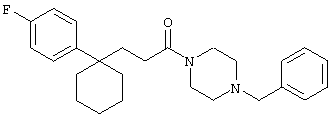
Метил-4-фторфенилацетат (10,0 г) растворяют в тетрагидрофуране (150 мл) и при охлаждении льдом добавляют 60% гидрид натрия (5,95 г). Смесь перемешивают при охлаждении льдом 10 минут и в течение одного часа по каплям добавляют 1,5-дибромпентан (11,3 мл). Затем смесь перемешивают в течение ночи при комнатной температуре, добавляют смесь воды со льдом и экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (система н-гексан/этилацетат), получая при этом 7,37 г (53%) масла.
Полученное выше масло (7,37 г) растворяют в тетрагидрофуране (100 мл) и по каплям добавляют 1,0 М раствор (18,7 мл) алюмогидрида лития в диэтиловом эфире при температуре от -50 до -40°С. Смесь перемешивают при указанной температуре в течение 20 минут и при охлаждении льдом добавляют воду, 5 н. водный раствор гидроксида натрия и дополнительное количество воды. Нерастворимые вещества отфильтровывают через целит и фильтрат упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (система н-гексан/этилацетат), получая при этом 3,43 г (53%) масла.
Оксалилхлорид (1,05 мл) растворяют в метиленхлориде (25 мл) и по каплям добавляют раствор (5 мл) диметилсульфоксида (0,85 мл) в метиленхлориде при температуре от -60 до -50°С. Смесь перемешивают 2 минуты и в течение 5 минут по каплям добавляют раствор (10 мл) полученного выше масла (2,08 г) в метиленхлориде. Затем смесь перемешивают 15 минут при указанной температуре и добавляют триэтиламин (6,96 мл). Реакционную смесь продолжают перемешивать еще 5 минут и оставляют нагреваться до комнатной температуры. Смесь промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают, получая при этом 1,91 г (93%) масла.
60% гидрид натрия (0,55 г) суспендируют в тетрагидрофуране (10 мл) и при охлаждении льдом по каплям добавляют триэтилфосфоноацетат (2,73 мл) в тетрагидрофуране (5 мл). Смесь перемешивают 15 минут при охлаждении льдом и по каплям добавляют раствор (15 мл) полученного выше масла (1,89 г) в тетрагидрофуране. Реакционную смесь перемешивают 15 минут при указанной температуре и продолжают перемешивать еще один час при комнатной температуре. К смеси добавляют насыщенный водный раствор хлорида аммония и экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (система н-гексан/этилацетат), получая при этом 2,07 г (82%) масла.
Полученное выше масло (1,02 г) растворяют в этаноле (20 мл), добавляют 10% палладий на угле (0,2 г) и гидрируют при комнатной температуре и нормальном давлении в течение 30 минут. Катализатор отфильтровывают и фильтрат упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (система н-гексан/этилацетат), получая при этом 0,97 г (94%) масла.
Полученное выше масло (9,03 г) растворяют в этаноле (50 мл) и добавляют 2 н. водный раствор гидроксида натрия (50 мл). Смесь нагревают с обратным холодильником в течение 2 часов, охлаждают до комнатной температуры и упаривают. Образовавшийся остаток суспендируют в этилацетате и смесь доводят до рН 2, добавляя 5 н. раствор хлористоводородной кислоты. Смесь сушат над безводным сульфатом магния и упаривают. Образовавшийся остаток перекристаллизовывают из этилацетата/н-гексана, получая при этом 6,45 г (79%) белых кристаллов.
1-Бензилпиперазин (2,82 г) растворяют в N,N-диметилформамиде (40 мл) и добавляют полученные выше кристаллы (4,0 г) и 1-гидроксибензотриазол (2,16 г). При охлаждении льдом по каплям добавляют раствор (30 мл) 1,3-дициклогексилкарбодиимида (3,63 г) в N,N-диметилформамиде. Смесь перемешивают в течение ночи при комнатной температуре, нерастворимые вещества отфильтровывают и фильтрат экстрагируют этилацетатом и 1 н. раствором хлористоводородной кислоты. Экстракт промывают 2 н. водным раствором гидроксида натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (система н-гексан/этилацетат), получая при этом 6,23 г (95%) указанного в заголовке соединения в виде масла.
1H-ЯМР (400 МГц, СDСl3) δ 1,29-1,50 (м, 4Н), 1,50-1,63 (м, 4Н), 1,80-1,94 (м, 4Н), 1,99-2,07 (м, 2Н), 2,27 (т, J=4,8 Гц, 2Н), 2,34 (т, J=4,8 Гц, 2Н), 3,10 (т, J=4,8 Гц, 2Н), 3,47 (с, 2Н), 3,54 (т, J=4,8 Гц, 2Н), 6,96-7,02 (м, 2Н), 7,22-7,34 (м, 7Н).
ESI-MC: 409 (МН+).
Справочный пример 90
1-Бензил-4-[3-[1-(4-фторфенил)циклогексил]пропил]пиперазин
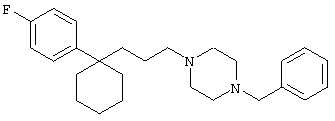
1-Бензил-4-[3-[1-(4-фторфенил)циклогексил]-1-оксопропил]пиперазин (5,90 г) растворяют в тетрагидрофуране (100 мл) и при охлаждении льдом добавляют 80% алюмогидрид лития (1,03 г). Смесь нагревают с обратным холодильником в течение 1,5 часов и оставляют охлаждаться до комнатной температуры. При охлаждении льдом к смеси добавляют воду, 1 н. водный раствор гидроксида натрия и дополнительное количество воды и нерастворимые вещества отфильтровывают. Фильтрат упаривают и образовавшийся остаток перекристаллизовывают из этанола, получая при этом 4,48 г (79%) указанного в заголовке соединения в виде белых кристаллов.
1H-ЯМР (400 МГц, СDСl3) δ 1,06-1,15 (м, 2Н), 1,28-1,58 (м, 12Н), 1,98-2,06 (м, 2Н), 2,14 (т, J=8 Гц, 2Н), 2,20-2,54 (м, 8Н), 3,47 (с, 2Н), 6,93-7,00 (м, 2Н), 7,20-7,32 (м, 7Н).
ESI-MC: 395 (МН+).
Справочный пример 91
4-[3-[1-(4-Фторфенил)циклогексил]пропил]пиперазин
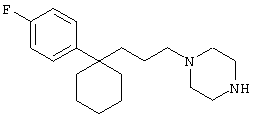
1-Бензил-4-[3-[1-(4-фторфенил)циклогексил]пропил]пиперазин (4,0 г) растворяют в метаноле (100 мл), добавляют 20% гидроксид палладия на угле (0,4 г) и полученную смесь гидрируют при комнатной температуре и нормальном давлении в течение 6 часов. Катализатор отфильтровывают и фильтрат упаривают, получая при этом 3,09 г указанного в заголовке соединения в виде масла (количественный выход).
1H-ЯМР (400 МГц, СDСl3) δ 1,07-1,17 (м, 2Н), 1,28-1,60 (м, 10Н), 1,75 (шир.с, 1Н), 1,99-2,07 (м, 2Н), 2,12 (т, J=8 Гц, 2Н), 2,25 (шир.с, 4Н), 2,82 (т, J=4,8 Гц, 2Н), 6,94-7,01 (м, 2Н), 7,21-7,27 (м, 2Н).
ESI-MC: 305 (МН+).
Справочный пример 92
Этил-4-(4-циано-5-метил-4-фенилгексил)-2-пиперазинкарбоксилат
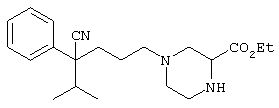
Этил-1-бензил-4-(4-циано-5-метил-4-фенилгексил)-2-пиперазинкарбоксилат (857 мг) растворяют в этаноле (15 мл) и добавляют 770 мг 10% Pd-C. Атмосферу заменяют водородом и смесь перемешивают. После окончания реакции раствор упаривают, получая при этом 639 мг (93%) указанного в заголовке соединения в виде сырого продукта.
Свободное соединение:
1H-ЯМР (400 МГц, СDСl3) δ 0,77 (д, J=6,6 Гц, 3Н), 1,08-1,16 (м, 1Н), 1,20 (д, J=6,6 Гц, 3H), 1,22-1,29 (м, 3Н), 1,53-1,64 (м, 1Н), 1,86-1,95 (м, 1Н), 2,05-2,33 (м, 6Н), 2,41-2,49 (м, 1H), 2,74-2,83 (м, 2Н), 2,97-3,04 (м, 1Н), 3,47-3,52 (м, 1Н), 4,14-4,21 (м, 2Н), 7,26-7,31 (м, 1Н), 7,34-7,39 (м, 4Н).
Справочный пример 93
Этил-4-[2-(4-фторфенокси)этил]-2-пиперазинкарбоксилат
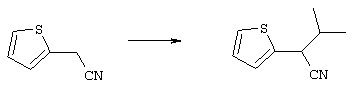
Этил-1-бензил-4-[2-(4-фторфенокси)этил]-2-пиперазинкарбоксилат (977 мг), синтезированный способом, описанным в нижеследующем примере 241, растворяют в этаноле (15 мл) и добавляют 210 мг 10% Pd-C. Атмосферу заменяют водородом и смесь перемешивают. После окончания реакции раствор упаривают, получая при этом 752 мг (100%) указанного в заголовке соединения в виде сырого продукта.
Свободное соединение:
1H-ЯМР (400 МГц, СDСl3) δ 1,24-1,28 (м, 3Н), 2,33-2,34 (м, 1Н), 2,48-2,50 (м, 1H), 2,72-2,91 (м, 4Н), 3,04-3,10 (м, 2Н), 3,56-3,59 (м, 1Н), 4,04-4,08 (м, 2Н), 4,16-4,22 (м, 2Н), 6,82-6,86 (м, 2Н), 6,94-6,99 (м, 2Н).
Промежуточные соединения, используемые для получения соединений по настоящему изобретению, могут быть также получены в виде оптически активных промежуточных соединений известными способами и их модификациями, а также, например, нижеследующими способами.
Справочный пример 94
3-Метил-2-(2-тиенил)бутаннитрил
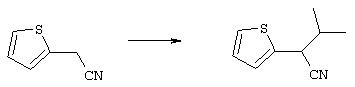
47,6 г (0,39 моль) 2-тиофенацетонитрила и 57,0 г (0,46 моль) 2-бромпропана растворяют в 100 мл ДМСО и к полученному раствору по каплям добавляют 50% водный раствор КОН. После окончания реакции добавляют воду и смесь экстрагируют толуолом. Реакционную смесь промывают насыщенным раствором соли и насыщенным водным раствором хлорида аммония, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт перегоняют при пониженном давлении (2-3 мм Нg, 132-137°С), получая при этом 46,4 г (0,28 моль, 72,7%) указанного в заголовке соединения в виде бесцветного масла. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, СDСl3) δ 1,08 (д, J=6,8 Гц, 3Н), 1,12 (д, J=6,8 Гц, 3Н), 2,14-2,24 (м, 1Н), 3,95 (д, J=6,0 Гц, 1Н), 6,99 (дд, J=4,0 Гц, 5,20 Гц, 1Н), 7,05-7,08 (м, 1Н), 7,27 (дд, J=1,2 Гц, 5,2 Гц, 1Н).
Справочный пример 95
Этил-4-циано-5-метил-4-(2-тиенил)гексанолят
1,49 г (13,3 ммоль, катализатор) трет-бутоксида калия растворяют в 120 мл ДМФА и смешанный раствор 43,9 г (0,27 моль) 3-метил-2-(2-тиенил)бутаннитрила и 30,2 мл (0,28 моль) этилакрилата понемному добавляют к полученному раствору при комнатной температуре. (В случае неполного растворения исходного вещества добавляют дополнительное количество этилакрилата и трет-бутоксида калия). Во время добавления происходит экзотермическая реакция. После окончания реакции поочередно добавляют 100 мл насыщенного раствора соли и 200 мл насыщенного водного раствора хлорида аммония и целевой продукт экстрагируют 500 мл гексана. Органический слой промывают 400 мл насыщенного раствора соли и сушат над безводным сульфатом магния. Растворитель выпаривают и получают 67,0 г сырого продукта в виде желтого масла, являющегося сложным эфиром (этил-4-циано-5-метил-4-(2-тиенил)гексанолят). Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, СDСl3) δ 0,92 (д, J=6,8 Гц, 3Н), 1,22 (д, J=7,1 Гц, 3Н), 1,23 (т, J=7,1 Гц, 3Н), 2,01-2,19 (м, 3Н), 2,41-2,58 (м, 2Н), 4,01-4,15 (м, 2Н), 6,96 (дд, J=3,6 Гц, 5,1 Гц, 1Н), 7,12 (дд, J=1,2 Гц, 3,6 Гц, 1Н), 7,99 (дд, J=1,2 Гц, 5,1 Гц, 1Н).
Справочный пример 96
Соль циклогексиламина d1-4-циано-4-(2-тиенил)-5-метилгексановой кислоты
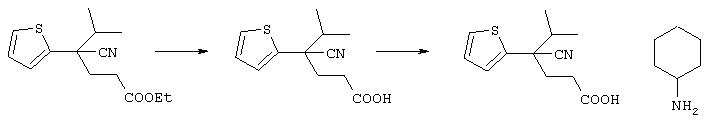
67,0 г полученного выше сложного эфира растворяют в 500 мл тетрагидрофурана, добавляют к раствору 200 мл 5 н. раствора NaOH и 50 мл этанола и перемешивают смесь. После окончания реакции раствор упаривают. Водный слой, содержащий целевой продукт, 4 раза промывают 200 мл толуола. Затем рН доводят до 1-2, добавляя 320 мл 5 н. раствора НСl, и целевой продукт экстрагируют 750 мл толуола. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают, получая 55,6 г (желтое масло) сырой карбоновой кислоты. Карбоновую кислоту растворяют в 150 мл толуола и добавляют 22,5 г (0,23 моль) циклогексиламина. Образовавшиеся белые кристаллы собирают фильтрованием, получая при этом 55,6 г (0,17 моль) указанного в заголовке соединения. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, СDСl3) δ 0,92 (д, J=6,8 Гц, 3Н), 1,20 (д, J=6,4 Гц, 3Н), 1,20-1,40 (м, 6Н), 1,57-1,67 (м, 1Н), 1,72-1,81 (м, 2Н), 1,92-2,11 (м, 3Н), 2,30-2,42 (м, 1Н), 2,44-2,54 (м, 1Н), 2,85-2,96 (м, 1Н), 6,95 (дд, J=3,2 Гц, 5,2 Гц, 1Н), 7,11 (дд, J=1,2 Гц, 3,2 Гц, 1Н), 7,25-7,28 (м, 1Н).
Справочный пример 97
Соль (S)-1-(4-метилфенил)этиламина 4-циано-4-(2-тенил)-5-метилгексановой кислоты
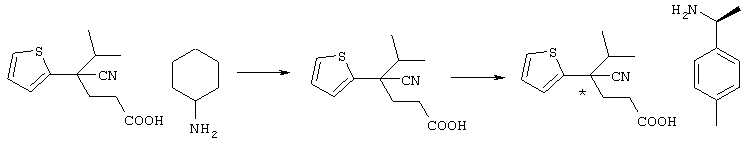
55 г (0,16 моль) соли циклогексиламина d1-4-циано-4-(2-тиенил)-5-метилгексановой кислоты суспендируют в 100 мл 5 н. раствора НСl и 50 мл воды и смесь экстрагируют 300 мл толуола. Экстракт промывают 2 н. раствором НСl и насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают и получают 38,7 г сырой карбоновой кислоты. 38,7 г сырой d1-4-циано-4-(2-тиенил)-5-метилгексановой кислоты растворяют в 120 мл толуола. К раствору карбоновой кислоты добавляют раствор 18,8 г (0,14 моль, 0,85 экв.) (S)-1-(4-метилфенил)этиламина в 40 мл толуола. Затем к смеси добавляют кристаллы (6 мг) ранее полученного указанного в заголовке соединения и смесь оставляют охлаждаться. Полученную диастереомерную соль (соль 1) собирают фильтрованием. Соль 1 растворяют при нагревании в 250 мл толуола и, перемешивая, охлаждают смесь до комнатной температуры. Полученную диастереомерную соль (соль 2: оптическая чистота 90,5%, исключая ошибки) собирают фильтрованием, получая при этом 21,3 г (57,2 ммоль, 35,1%) (оптическая чистота 90,5%, исключая ошибки) указанного в заголовке соединения.
Пример 2
dl-4-Циано-4-(2-тиенил)-5-метилгексановую кислоту (96,6 ммоль) превращают в соль вышеуказанным способом разделения и кристаллизуют, после чего дважды выполняют перекристаллизацию, получая при этом 14,5 г (38,9 ммоль, 40,3%) (оптическая чистота 95%, исключая ошибки) указанного в заголовке соединения. Физико-химические данные соединения приведены ниже. Кроме того, далее представлены условия анализа ВЭЖХ и данные анализа (график ВЭЖХ) показаны на фиг.1.
1H-ЯМР (400 МГц, СDСl3) δ 0,91 (д, J=6,8 Гц, 3Н), 1,19 (д, J=6,4 Гц, 3Н), 1,42 (д, J=6,8 Гц, 3Н), 1,95-2,11 (м, 3Н), 2,33 (с, 3Н), 2,30-2,50 (м, 2Н), 3,74 (шир.д-с, 3Н), 6,95 (дд, J=3,6 Гц, 5,2 Гц, 1H), 7,10 (дд, J=1,2 Гц, 3,6 Гц, 1Н), 7,14 (д, J=8,4 Гц, 2Н), 7,21 (д, J=8,4 Гц, 2Н), 7,25-7,29 (м, 1H).
Условия выполнения анализа ВЭЖХ:
Колонка: Daicel Chemical Industries, Ltd. CHIRALCEL OJ, 4, 6×250 мм.
Подвижная фаза: 20% (В).
(A) Смешанный раствор н-гексана/трифторуксусной кислоты (1000:1).
(B) Смешанный раствор н-гексана/изопропанола/трифторуксусной кислоты (500:500:1).
Скорость потока: 0,5 мл/мин.
Детектор: УФ 231 нм.
Время удерживания: 15,5 мин.
Справочный пример 98
Соль (S)-1-фенилэтиламина 4-циано-4-(2-тиенил)-5-метилгексановой кислоты
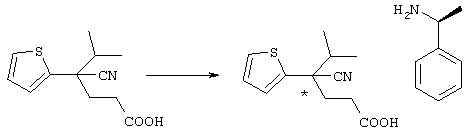
Оптически активную соль (S)-1-фенилэтиламина 4-циано-4-(2-тиенил)-5-метилгексановой кислоты (107,7 г, 39%) (белые кристаллы, оптическая чистота 96,9%, исключая ошибки) можно также получить, обрабатывая dl-4-циaнo-4-(2-тиенил)-5-метилгексановую кислоту (168,8 г) (S)-1-фенилэтиламином (67,4 г) и толуолом (990 мл) способом по справочному примеру 97. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, СD3OD) δ 0,94 (д, J=7 Гц, 3Н), 1,23 (д, J=7 Гц, 3Н), 1,65 (д, J=7 Гц, 3Н), 2,02 (ддд, J=15 Гц, 12 Гц, 4 Гц, 1Н), 2,14 (ддд, J=14 Гц, 12 Гц, 4 Гц, 1Н), 2,18 (кв кв, J=7 Гц, 7 Гц, 1Н), 2,33 (ддд, J=15 Гц, 12 Гц, 4 Гц, 1Н), 2,52 (ддд, J=14 Гц, 12 Гц, 4 Гц, 1Н), 4,44 (кв, J=7 Гц, 1Н), 7,04 (дд, J=5 Гц, 3 Гц, 1Н), 7,14 (дд, J=3 Гц, 1 Гц, 1Н), 7,44 (дд, J=5 Гц, 1 Гц, 1Н), 7,40-7,50 (м, 5Н).
ESI-MC (m/z): 135, 177, 195, 273 (М+).
Температура плавления 136-144°С.
Условия выполнения анализа ВЭЖХ:
Колонка: Daicel Chemical Industries, Ltd. (Токио) CHIRALCEL OJ.
Подвижная фаза: 10% (В).
(A) н-гексан/трифторуксусная кислота (1000:1).
(B) н-гексан/2-пропанол/трифторуксусная кислота (500:500:1).
Скорость потока: 0,5 мл/мин.
Детектор: УФ 231 нм.
Время удерживания: 26,2 мин.
Справочный пример 99
Соль (R)-1-фенилэтиламина 4-циано-4-(2-тиенил)-5-метилгексановой кислоты
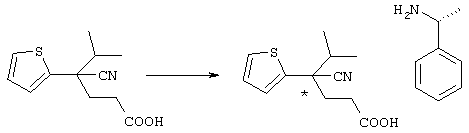
Указанное в заголовке соединение получают в виде белых кристаллов способом по справочному примеру 98, используя (R)-1-фенилэтиламин и dl-4-циaно-4-(2-тиенил)-5-метилгексановую кислоту.
Температура плавления 136-144°С.
Условия выполнения анализа ВЭЖХ:
Колонка: Daicel Chemical Industries, Ltd. (Токио) CHIRALCEL OJ.
Подвижная фаза: 10% (В).
(A) н-гексан/трифторуксусная кислота (1000:1).
(B) н-гексан/2-пропанол/трифторуксусная кислота (500:500:1).
Скорость потока: 0,5 мл/мин.
Детектор: УФ 231 нм.
Время удерживания: 19,9 мин.
Справочный пример 100
Соль (S)-1-(4-метилфенил)этиламина 4-циано-4-(3-тиенил)-5-метилгексановой кислоты
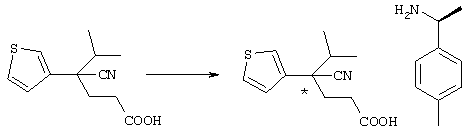
5,6 г (оптическая чистота 86,7%, исключая ошибки) указанного в заголовке соединения получают в виде белых кристаллов из dl-4-циано-4-(3-тиенил)-5-метилгексановой кислоты (11,4 г) и (S)-1-(4-метилфенил)этиламина (5,45 г) способом по справочным примерам 96 и 97. Физико-химические данные соединения приведены ниже. Кроме того, далее представлены условия выполнения анализа ВЭЖХ и данные анализа (график ВЭЖХ) показаны на фиг.2.
Свободное соединение: 4-циано-4-(3-тиенил)-5-метилгексановая кислота
1H-ЯМР (400 МГц, СDСl3) δ 0,85 (д, J=6, 8 Гц, 3Н), 1,19 (д, J=6,6 Гц, 3Н), 2,02-2,18 (м, 3Н), 2,38-2,58 (м, 2Н), 6,94 (дд, J=3,1 Гц, 1,5 Гц, 1Н), 7,30 (дд, J=3,1 Гц, 1,5 Гц, 1Н), 7,38 (дд, J=5,1 Гц, 3,1 Гц, 1Н).
Соль: соль (S)-1-(4-метилфенил)этиламина 4-циано-4-(3-тиенил)-5-метилгексановой кислоты
1H-ЯМР (400 МГц, СDСl3) δ 0,83 (д, J=6,8 Гц, 3H), 1,15 (д, J=6,6 Гц, 3Н), 1,42 (д, J=6,6 Гц, 3Н), 1,80-2,10 (м, 3Н), 2,27-2,42 (м, 2Н), 2,33 (с, 3Н), 4,14 (кв, J=6,8 Гц, 1Н), 6,91 (дд, J=5,1 Гц, 1,5 Гц, 1Н), 7,13 (шир.д, J=8,0 Гц, 2Н), 7,20 (шир.д, J=8,0 Гц, 2Н), 7,24 (дд, J=3,1 Гц, 1,5 Гц, 1Н), 7,33 (дд, J=5,1 Гц, 3,1 Гц, 1Н).
Температура плавления 140-143°С.
Условия выполнения анализа ВЭЖХ:
Колонка: Daicel Chemical Industries, Ltd. (Токио) CHIRALCEL OJ.
Подвижная фаза: гексан:IРА:ТФУ (900:100:1)
Скорость потока: 0,5 мл/мин.
Детектор: УФ 235 нм.
Время удерживания: 15,7 мин.
Справочный пример 101
Оптически активная 4-циано-4-(3-тиенил)-5-метилгексановая кислота
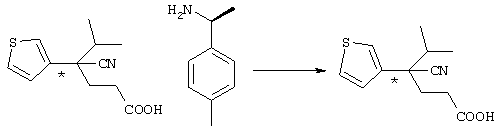
Указанное в заголовке свободное соединение (3,94 г) получают, обрабатывая соль (S)-1-(4-метилфенил)этиламина 4-циано-4-(3-тиенил)-5-метилгексановой кислоты (5,6 г) водным раствором хлористоводородной кислоты способом по справочному примеру 97. Физико-химические данные соединения приведены ниже. Кроме того, далее представлены условия выполнения анализа ВЭЖХ, и данные анализа (график ВЭЖХ) показаны на фиг.2.
1H-ЯМР (400 МГц, СDСl3) δ 0,85 (д, J=6,8 Гц, 3Н), 1,19 (д, J=6,6 Гц, 3Н), 2,02-2,18 (м, 3Н), 2,38-2,58 (м, 2Н), 6,94 (дд, J=3,1 Гц, 1,5 Гц, 1Н), 7,30 (дд, J=3,1 Гц, 1,5 Гц, 1Н), 7,38 (дд, J=5,1 Гц, 3,1 Гц, 1Н).
Справочный пример 102
Соль (R)-1-(4-метилфенил)этиламина 4-циано-4-(3-тиенил)-5-метилгексановой кислоты
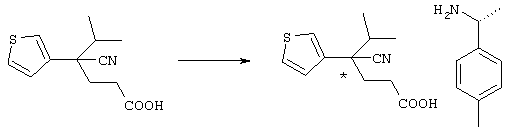
Указанное в заголовке соединение (35%, оптическая чистота 88,5%, исключая ошибки) получают в виде белых кристаллов способом по примеру 97, используя (R)-1-(4-метилфенил)этиламин и d1-4-циано-4-(3-тиенил)-5-метилгексановую кислоту.
Температура плавления 140-143°С.
Условия выполнения анализа ВЭЖХ:
Колонка: Daicel Chemical Industries, Ltd. (Токио) CHIRALCEL OJ.
Подвижная фаза: гексан: IРА: ТФУ (900:100:1).
Скорость потока: 0,5 мл/мин.
Детектор: УФ 235 нм.
Время удерживания: 12,8 мин.
Справочный пример 103
Соль (R)-1-(4-метилфенил)этиламина 4-циано-4-(2-тиенил)-5-метилгексановой кислоты
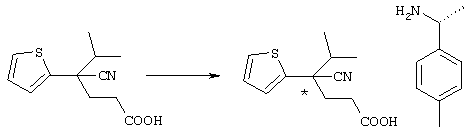
Указанное в заголовке соединение получают способом по справочному примеру 97, используя (R)-1-(4-метилфенил)этиламин и dl-4-циано-4-(2-тиенил)-5-метилгексановую кислоту. Условия выполнения анализа ВЭЖХ представлены ниже, и данные анализа (график ВЭЖХ) показаны на фиг.3.
Условия выполнения анализа ВЭЖХ:
Колонка: Daicel Chemical Industries, Ltd. CHIRALCEL OJ, 4,6×250 мм.
Подвижная фаза: 20% (В).
(A) Смешанный раствор н-гексана/трифторуксусной кислоты (1000:1).
(B) Смешанный раствор н-гексана/изопропанола/трифторуксусной кислоты (500:500:1).
Скорость потока: 0,5 мл/мин.
Детектор: УФ 231 нм.
Время удерживания: 12,8 мин.
Справочный пример 104
4-Циано-4-(2-тиенил)-5-метилгексанол (оптически активное соединение)
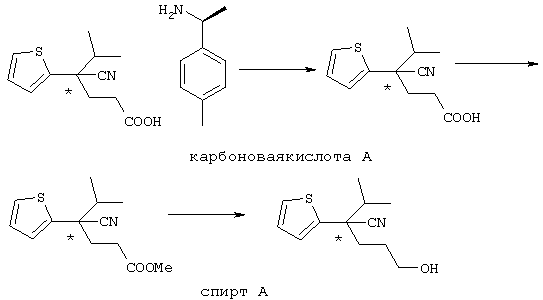
Соль (S)-1-(4-метилфенил)этиламина 4-циано-4-(2-тиенил)-5-метилгексановой кислоты, полученную в справочном примере 97, превращают в свободную карбоновую кислоту способом по справочному примеру 97. 8,31 г (35,0 ммоль) полученного соединения растворяют в 140 мл тетрагидрофурана, пипеткой Пастера добавляют 3 капли N,N-диметилфорамида и смесь охлаждают льдом. К реакционному раствору по каплям добавляют 3,5 мл (40,3 ммоль) оксалилхлорида, нагревают до комнатной температуры и перемешивают в течение 1,5 часов. Растворитель выпаривают, добавляют 80 мл тетрагидрофурана и раствор снова охлаждают льдом. К раствору добавляют 75 мл метанола и 6,10 мл (43,8 ммоль) триэтиламина и, перемешивая, оставляют нагреваться до комнатной температуры. После окончания реакции раствор экстрагируют этилацетатом. Экстракт промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушат над сульфатом магния. Растворитель выпаривают и полученный сырой продукт очищают хроматографией на колонке с силикагелем (система: гексан/этилацетат), получая при этом 8,0 г (31,8 ммоль, 90,9%) сложного метилового эфира. 8,00 г (31,8 ммоль, 90,9%) сложного эфира растворяют в 50 мл тетрагидрофурана. Раствор добавляют по каплям к суспензии 845 мг (22,3 ммоль) алюмогидрида лития в ТГФ, охлажденной до наружной температуры от -50 до -40°С, и нагревают до наружной температуры -20°С в течение 0,5 часа. После окончания реакции раствор снова охлаждают, поочередно добавляют 0,9 мл воды, 0,9 мл 5 н. раствора NaOH и 2,70 мл воды и фильтруют через целит. Фильтрат упаривают и полученный сырой продукт очищают хроматографией на колонке с силикагелем (система н-гексан/этилацетат), получая при этом 6,60 г (29,6 ммоль, 93,1%) указанного в заголовке соединения в виде бесцветного масла. Физико-химические данные соединения приведены ниже.
Карбоновая кислота А:
1H-ЯМР (400 МГц, СDСl3) δ 0,93 (д, J=6,8 Гц, 3Н), 1,21 (д, J=6,4 Гц, 3Н), 2,01-2,23 (м, 3Н), 2,47-2,58 (м, 2Н), 6,97 (дд, J=3,6 Гц, 5,2 Гц, 1Н), 7,12 (дд, J=1,2 Гц, 3,6 Гц, 1Н), 7,29 (дд, J=1,2 Гц, 5,2 Гц, 1Н).
Сложный метиловый эфир, полученный из карбоновой кислоты А:
1H-ЯМР (400 МГц, СDСl3) δ 0,92 (д, J=6,8 Гц, 3Н), 1,22 (д, J=6,4 Гц, 3Н), 2,03-2,20 (м, 3Н), 2,43-2,58 (м, 2Н), 3,64 (с, 3H), 6,96 (дд, J=3,6 Гц, 5,2 Гц, 1Н), 7,12 (дд, J=1,2 Гц, 3,6 Гц, 1Н), 7,29 (дд, J=1,2 Гц, 5,2 Гц, 1Н).
Спирт А:
1H-ЯМР (400 МГц, СDСl3) δ 0,92 (д, J=6,8 Гц, 3Н), 1,19 (д, J=6,8 Гц, 3Н), 1,33-1,46 (м, 1Н), 1,65-1,77 (м, 1Н), 1,80-1,90 (м, 1Н), 2,08 (септ, J=6,8 Гц, 1Н), 2,27 (ддд, J=4,4 Гц, 12,0 Гц, 13,2 Гц, 1Н), 3,63 (шир.д-с, 2Н), 6,96 (дд, J=3,6 Гц, 5,2 Гц, 1Н), 7,11-7,14 (м, 1Н), 7,27 (дд, J=1,2 Гц, 5,2 Гц, 1Н).
Справочный пример 105
4-Циано-4-(5-циано-2-тиенил)-5-метилгексанол (оптически активное соединение)
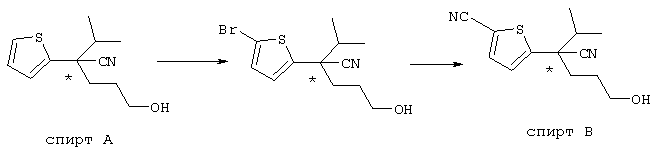
Бромирование и последующее цианирование осуществляют способом по примеру 80, используя в качестве исходного вещества спирт А, полученный в справочном примере 104. В частности, оптически активный 4-циано-4-(5-бром-2-тиенил)-5-метилгексанол синтезируют бромированием и затем без очистки подвергают цианированию, получая при этом указанное в заголовке соединение с выходом 77,9%. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, СDСl3) δ 0,94 (д, J=6,59 Гц, 3Н), 1,22 (д, J=6,78 Гц, 3Н), 1,28-1,42 (м, 1Н), 1,66-1,78 (м, 1Н), 1,83-1,93 (м, 1Н), 2,03-2,16 (м, 1Н), 2,32 (ддд, J=4,40 Гц, 12,4 Гц, 13,2 Гц, 1Н), 3,58-3,74 (м, 2Н), 7,16 (д, J=3,60 Гц, 1Н), 7,52 (д, J=3,60 Гц, 1Н).
Пример 1
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[2-(3-ацетилфенокси)этил]пиперазин
Указанное в заголовке соединение синтезируют способом по примеру 86-5), описанному в JP-A 11-206862.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,05-1,20 (м, 1Н), 1,20 (д, J=6,6 Гц, 3Н), 1,50-1,60 (м, 1Н), 1,80-1,95 (м, 1Н), 2,05-2,20 (м, 2Н), 2,25-2,35 (м, 2Н), 2,35-2,48 (м, 4Н), 2,48-2,65 (м, 4Н), 2,59 (с, 3Н), 2,81 (т, J=5,8 Гц, 2Н), 4,13 (т, J=5,8 Гц, 2Н), 7,08-7,13 (м, 1Н), 7,26-7,32 (м, 1Н), 7,34-7,40 (м, 5Н), 7,46-7,50 (м, 1Н), 7,52-7,56 (м, 1Н).
Затем свободное соединение обрабатывают способом по примеру 20, описанному в JP-A 11-206862, и получают гидрохлорид указанного в заголовке соединения.
ESI-MC: 448 (МН+).
Пример 2
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(1-бензил-2-пирролидин) метил]пиперазин
В ацетонитриле (3 мл) растворяют 1-бензил-2-пирролидинм.етанол (83 мг) и добавляют триэтиламин (0,18 мл) и мезилхлорид (0,037 мл). Смесь перемешивают при комнатной температуре в течение одного часа и добавляют раствор (3 мл) 1-[(4-циано-5-метил-4-фенил)гексил]пиперазина (124 мг) в ацетонитриле. Смесь нагревают с обратным холодильником в течение 3 часов и оставляют охлаждаться до комнатной температуры. К смеси добавляют этилацетат и промывают водой и насыщенным раствором соли. Смесь сушат над безводным сульфатом магния и упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (NH) (система: гексан/этилацетат), получая при этом указанное в заголовке соединение в виде бледно-желтого масла (58 мг, 29%). Затем свободное соединение превращают в гидрохлорид известным способом, получая таким образом гидрохлорид указанного в заголовке соединения.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,05-1,18 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,49-1,73 (м, 4Н), 1,83-2,00 (м, 3Н), 2,07-2,18 (м, 2Н), 2,20-2,64 (м, 13Н), 2,87-2,93 (м, 1Н), 3,23 (д, J=12,8 Гц, 1Н), 4,19 (д, J=12,8 Гц, 1Н), 7,19-7,39 (м, 10Н).
Гидрохлорид:
ESI-MC: 459 (МН+).
Пример 3
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(2-бензофуранил)метил] пиперазин
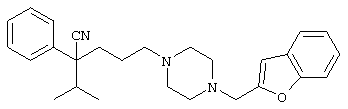
В 1,2-дихлорэтане (6 мл) растворяют 1-[(4-циано-5-метил-4-фенил)гексил]пиперазин (0,19 г) и добавляют бензофуран-2-карбальдегид (0,11 г), уксусную кислоту (0,095 мл) и триацетоксиборогидрид натрия. Смесь перемешивают в течение 3 часов при комнатной температуре, добавляют этилацетат и промывают водой и насыщенным раствором соли. Реакционную смесь сушат над безводным сульфатом магния и упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (NH) (система: гексан/этилацетат), получая при этом указанное в заголовке соединение в виде бледно-желтого масла (0,28 г, количественный выход). Затем свободное соединение превращают в гидрохлорид обычным способом, получая таким образом гидрохлорид указанного в заголовке соединения.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,76 (д, J=6,8 Гц, 3Н), 1,05-1,18 (м, 1Н), 1,19 (д, J=6,8 Гц, 3Н), 1,48-1,60 (м, 1Н), 1,87 (дт, J=4,4 Гц, J=12 Гц, 1Н), 2,07-2,17 (м, 2Н), 2,27 (т, J=7,2 Гц, 2Н), 2,38 (шир.с, 4Н), 2,52 (шир.с, 4Н), 3,66 (с, 2Н), 6,57 (с, 1Н), 7,17-7,30 (м, 3Н), 7,32-7,37 (м, 4Н), 7,44-7,53 (м, 2Н).
Гидрохлорид:
ESI-MC: 416 (МН+).
Пример 4
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(1-метил-2-бензимидазолил)метил]пиперазин
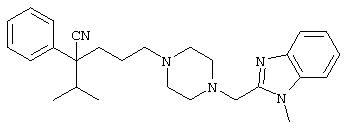
Указанное в заголовке соединение получают в виде бледно-желтого масла способом по примеру 3 (86%). Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,05-1,18 (м, 1Н), 1,19 (д, J=6,8 Гц, 3Н), 1,47-1,60 (м, 1Н), 1,90 (дт, J=4,4 Гц, J=12,4 Гц, 1Н), 2,05-2,38 (м, 8Н), 2,50 (шир.с, 4Н), 3,79 (с, 2Н), 3,84 (с, 3Н), 7,21-7,40 (м, 8Н), 7,71-7,75 (м, 1Н).
Гидрохлорид:
ESI-MC: 430 (МН+).
Пример 5
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(3-индолил)метил]пиперазин
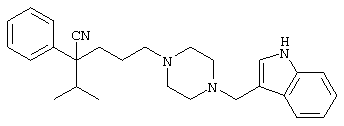
Указанное в заголовке соединение получают в виде бледно-желтого масла способом по примеру 3 (76%). Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,76 (д, J=6,8 Гц, 3Н), 1,04-1,18 (м, 1Н), 1,18 (д, J=6,8 Гц, 3Н), 1,47-1,60 (м, 1Н), 1,86 (дт, J=4,4 Гц, J=12,4 Гц, 1Н), 2,03-2,16 (м, 2Н), 2,22-2,32 (м, 2Н), 2,33 (шир.с, 4Н), 2,49 (шир.с, 4Н), 3,70 (с, 2Н), 7,05-7,20 (м, 4Н), 7,23-7,48 (м, 5Н), 7,70 (д, J=6,8 Гц, 1Н), 8,25-8,40 (м, 1Н).
Гидрохлорид:
ESI-MC: 415 (МН+).
Пример 6
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(2-хинолинил)метил]пиперазин
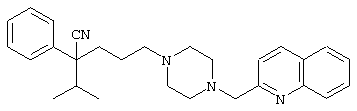
Указанное в заголовке соединение получают в виде бледно-желтого масла способом по примеру 3 (62%). Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,06-1,18 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,50-1,62 (м, 1Н), 1,90 (дт, J=4,4 Гц, J=12 Гц, 1Н), 2,07-2,18 (м, 2Н), 2,24-2,35 (м, 2Н), 2,38 (шир.с, 4Н), 2,54 (шир.с, 4Н), 3,82 (с, 2Н), 7,24-7,30 (м, 1Н), 7,32-7,38 (м, 4Н), 7,51 (д, J=8 Гц, 1Н), 7,60 (д, J=8,4 Гц, 1Н), 7,66-7,72 (м, 1Н), 7,79 (д, J=8 Гц, 1Н), 8,06 (д, J=8,4 Гц, 1Н), 8,10 (д, J=8,4 Гц, 1Н).
Гидрохлорид:
ESI-MC: 427 (МН+).
Пример 7
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(4-фенил-3-пиридил)метил]пиперазин
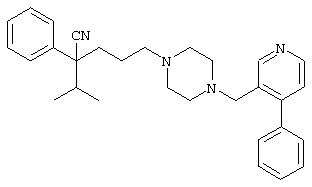
Указанное в заголовке соединение получают в виде бледно-желтого масла способом по примеру 3 (47%). Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,76 (д, J=6,8 Гц, 3Н), 1,04-1,18 (м, 1Н), 1,19 (д, J=6,8 Гц, 3Н), 1,47-1,59 (м, 1Н), 1,87 (дт, J=4 Гц, J=12 Гц, 1Н), 2,06-2,34 (м, 8Н), 2,34 (шир.с, 4Н), 3,39 (с, 2Н), 7,18 (д, J=4,8 Гц, 1Н), 7,25-7,46 (м, 10Н), 8,52 (д, J=4,8 Гц, 1Н), 8,63 (с, 1Н).
Гидрохлорид:
ESI-MC: 427 (МН+).
Пример 8
1-[(4-Циано-5-метил-4-фенил)гексил]-4-(1,2,3,4-тетрагидро-2-нафтоил)пиперазин
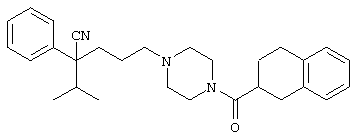
1-[(4-Циано-5-метил-4-фенил)гексил]пиперазин (150 мг) растворяют в N,N-диметилформамиде (5 мл). К смеси добавляют 1-гидроксибензотриазол (71 мг), 1,2,3,4-тетрагидро-2-нафтеновую кислоту (93 мг) и раствор (2 мл) дициклогексилкарбодиимида (120 мг) в N,N-диметилформамиде. Смесь перемешивают в течение ночи при комнатной температуре, нерастворимые вещества отфильтровывают и добавляют к фильтрату этилацетат. Затем добавляют небольшое количество 1 н. раствора хлористоводородной кислоты и смесь перемешивают. Реакционную смесь промывают насыщенным водным раствором карбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (NH) (система н-гексан/этилацетат), получая при этом указанное в заголовке соединение в виде бледно-желтого масла (220 мг, 94%). Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,04-1,20 (м, 1Н), 1,21 (д, J=6,8 Гц, 3Н), 1,50-1,63 (м, 1Н), 1,86-2,04 (м, 3Н), 2,09-2,23 (м, 2Н), 2,24-2,36 (м, 6Н), 2,75-2,94 (м, 4Н), 3,03-3,12 (м, 1Н), 3,49 (т, J=4,8 Гц, 2Н), 3,56-3,68 (м, 2Н), 7,06-7,13 (м, 4Н), 7,27-7,40 (м, 5Н).
Гидрохлорид:
ESI-MC: 444 (МН+).
Пример 9
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(1,2,3,4-тетрагидро-2-нафтил)метил]пиперазин
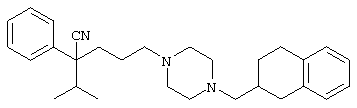
В тетрагидрофуране (5 мл) растворяют 1-[(4-циано-5-метил-4-фенил)гексил]-4-(1,2,3,4-тетрагидро-2-нафтоил)пиперазин (150 мг) и при охлаждении льдом добавляют 1,0 М раствор комплекса борана в тетрагидрофуране (1,35 мл). Смесь перемешивают при комнатной температуре в течение 5 часов и упаривают. К остатку добавляют метанол (5 мл) и 2 н. раствор хлористоводородной кислоты (5 мл) и перемешивают при 80°С в течение одного часа. Смесь оставляют охлаждаться до комнатной температуры и упаривают. К смеси добавляют этилацетат и промывают насыщенным водным раствором карбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают. Образовавшийся остаток очищают препаративной тонкослойной хроматографией на колонке с силикагелем (метиленхлорид/метанол), получая при этом указанное в заголовке соединение в виде бледно-желтого масла (72 мг, 50%). Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,04-1,20 (м, 2Н), 1,20 (д, J=6,8 Гц, 3Н), 1,29-1,43 (м, 2Н), 1,51-1,63 (м, 2Н), 1,65-1,73 (м, 1Н), 1,90 (дт, J=4,4 Гц, J=12 Гц, 1Н), 1,90-2,00 (м, 4Н), 2,08-2,19 (м, 2Н), 2,25-2,48 (м, 7Н), 2,77-2,92 (м, 3Н), 7,04-7,10 (м, 4Н), 7,26-7,48 (м, 5Н).
Гидрохлорид:
ESI-MC: 430 (МН+).
Пример 10
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[2-(1,4-бензодиоксаноил)]пиперазин
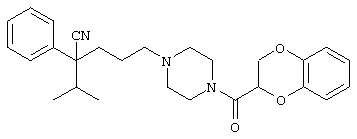
Указанное в заголовке соединение получают в виде бледно-желтого масла способом по примеру 8 (86%). Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,08-1,20 (м, 1Н), 1,21 (д, J=6,8 Гц, 3Н), 1,51-1,63 (м, 1Н), 1,92 (дт, J=4,4 Гц, J=12 Гц, 1Н), 2,09-2,23 (м, 2Н), 2,25-2,40 (м, 6Н), 3,49-3,57 (м, 2Н), 3,63-3,76 (м, 2Н), 4,30 (дд, J=8 Гц, J=12 Гц, 1Н), 4,46 (дд, J=2,8 Гц, J=12 Гц, 1Н), 4,79 (дд, J=2,8 Гц, J=8 Гц, 1Н), 6,83-6,91 (м, 4Н), 7,27-7,40 (м, 5Н).
Гидрохлорид:
ESI-MC: 448 (МН+).
Пример 11
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[2-(1,4-бензодиоксанил)метил]пиперазин
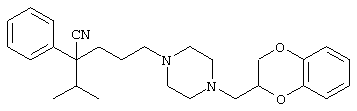
Указанное в заголовке соединение получают в виде бледно-желтого масла способом по примеру 9 (56%). Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,16-1,20 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,50-1,62 (м, 1Н), 1,89 (дт, J=4,4 Гц, J=12,8 Гц, 1Н), 2,08-2,19 (м, 2Н), 2,24-2,34 (м, 2Н), 2,36 (шир.с, 4Н), 2,52 (шир.с, 4Н), 2,61 (ддд, J=5,6 Гц, J=13,2 Гц, J=40,4 Гц, 2Н), 3,96 (дд, J=7,6 Гц, J=11,6 Гц, 1Н), 4,24-4,31 (м, 2Н), 6,79-6,89 (м, 4Н), 7,26-7,39 (м, 5Н).
Гидрохлорид:
ESI-MC: 434 (МН+).
Пример 12
1-[(4-Циано-5-метил-4-фенил)гексил]-4-(1-метил-2-индолоил)пиперазин
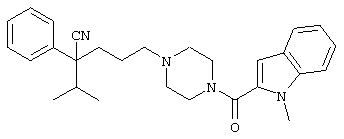
Указанное в заголовке соединение получают в виде бледно-желтого масла способом по примеру 8 (82%). Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,08-1,20 (м, 1Н), 1,21 (д, J=6,8 Гц, 3Н), 1,50-1,62 (м, 1Н), 1,87-1,97 (м, 1Н), 2,08-2,22 (м, 2Н), 2,28-2,38 (м, 6Н), 3,72 (шир.с, 4Н), 3,81 (с, 3H), 6,56 (с, 1Н), 7,10-7,16 (м, 1Н), 7,25-7,39 (м, 7Н), 7,61 (д, J=8 Гц, 1Н).
Гидрохлорид:
ESI-MC: 443 (МН+).
Пример 13
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(1-метил-2-индолил)метил]пиперазин
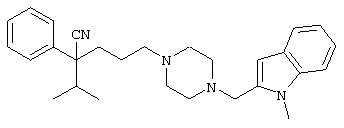
Указанное в заголовке соединение получают в виде бледно-желтого масла способом по примеру 9 (40%). Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,06-1,20 (м, 1Н), 1,19 (д, J=6,8 Гц, 3Н), 1,49-1,62 (м, 1Н), 1,89 (дт, J=4,4 Гц, J=12 Гц, 1Н), 2,07-2,17 (м, 2Н), 2,21-2,37 (м, 6Н), 2,44 (шир.с, 4Н), 3,60 (с, 2Н), 3,76 (с, 3Н), 6,34 (с, 1Н), 7,07 (т, J=8 Гц, 1Н), 7,18 (т, J=8 Гц, 1Н), 7,25-7,38 (м, 6Н), 7,54 (д, J=8 Гц, 1Н).
Гидрохлорид:
ESI-MC: 429 (МН+).
Пример 14
2-[(4-Циано-5-метил-4-фенил)гексил]-5-[2-(4-фторфенокси)этил]-2,5-диазабицикло[2,2,1]гептан
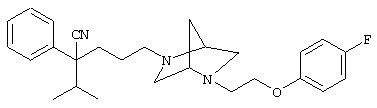
В метаноле (5 мл) растворяют 2-[(4-циано-5-метил-4-фенил)гексил]-5-бензил-2,5-диазабицикло[2,2,1]гептан (37 мг). К смеси добавляют 20% гидроксид палладия на угле (10 мг) и гидрируют при комнатной температуре и нормальном давлении в течение 8 часов. Катализатор отфильтровывают и фильтрат упаривают, получая остаток в виде бледно-желтого масла (29 мг). Остаток растворяют в N,N-диметилформамиде (3 мл) и добавляют раствор (2 мл) триэтиламина (0,027 мл) и 2-(4-фторфенокси)этилбромида (25 мг) в N,N-диметилформамиде.
Раствор перемешивают в течение ночи при 50°С и оставляют охлаждаться до комнатной температуры. К смеси добавляют этилацетат и промывают водой и насыщенным раствором соли. Реакционную смесь сушат над безводным сульфатом магния и упаривают. Образовавшийся остаток очищают препаративной тонкослойной хроматографией на колонке с силикагелем (метиленхлорид/метанол), получая при этом указанное в заголовке соединение в виде бледно-желтого масла (20 мг, 48%). Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,06-1,20 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,45-1,57 (м, 1Н), 1,66-1,73 (м, 2Н), 1,95 (дт, J=4,4 Гц, J=12 Гц, 1Н), 2,11 (квин, J=6,8 Гц, 1Н), 2,14-2,23 (м, 1Н), 2,32-2,40 (м, 1Н), 2,51-2,61 (м, 2Н), 2,63-2,81 (м, 3Н), 2,91 (д,квин, J=6 Гц, J=40,4 Гц, 2Н), 3,21 (с, 1Н), 3,36 (с, 1Н), 3,94-4,03 (м, 2Н), 6,79-6,85 (м, 2Н), 6,92-7,00 (м, 2Н), 7,26-7,40 (м, 5Н).
Гидрохлорид:
ESI-MC: 436 (МН+).
Пример 15
8-[(4-Циано-5-метил-4-фенил)гексил]-1-фенил-1,3,8-триазаспиро[4,5]декан-4-он
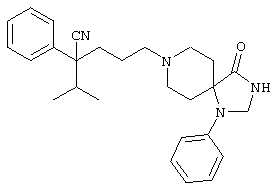
В ацетонитриле (6 мл) растворяют 4-циано-5-метил-4-фенилгексанол (120 мг) и добавляют триэтиламин (0,23 мл) и мезилхлорид (0,051 мл) при комнатной температуре. Смесь перемешивают при комнатной температуре в течение одного часа и добавляют раствор (3 мл) 1-фенил-1,3,8-триазаспиро[4,5]декан-4-она (140 мг) в ацетонитриле. Полученный раствор нагревают с обратным холодильником в течение 2,5 часов и оставляют охлаждаться до комнатной температуры. Затем к смеси добавляют этилацетат и промывают водой и насыщенным раствором соли. Реакционную смесь сушат над безводным сульфатом магния и упаривают. Образовавшийся остаток очищают препаративной тонкослойной хроматографией на колонке с силикагелем (система: гексан/этилацетат), получая при этом указанное в заголовке соединение в виде бледно-желтого масла (61 мг, 26%). Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,79 (д, J=6,4 Гц, 3Н), 1,22 (д, J=6,4 Гц, 3Н), 1,26 (т, J=7,2 Гц, 2Н), 1,55-1,73 (м, 3Н), 1,94-2,05 (м, 1Н), 2,08-2,25 (м, 2Н), 2,38-2,52 (м, 2Н), 2,60-2,90 (м, 6Н), 4,72 (с, 2Н), 6,85 (т, J=7,2 Гц, 1Н), 6,90 (д, J=8 Гц, 2Н), 7,24-7,31 (м, 2Н), 7,33-7,41 (м, 4Н), 7,62 (шир.с, 1Н).
Гидрохлорид:
ESI-MC: 431 (МН+).
Пример 16
1-[(4-Циано-5-метил-4-фенил)гексил]-4-(2-кето-1-бензимидазолинил)пиперидин
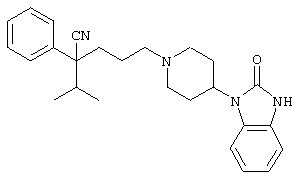
Указанное в заголовке соединение получают в виде бледно-желтого масла способом по примеру 15 (23%). Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,79 (д, J=6,8 Гц, 3Н), 1,11-1,34 (м, 2Н), 1,23 (д, J=6,8 Гц, 3Н), 1,55-1,67 (м, 1Н), 1,73-1,82 (м, 2Н), 1,90-2,05 (м, 2Н), 2,08-2,23 (м, 3H), 2,30-2,52 (м, 4Н), 2,88-3,02 (м, 2Н), 4,28-4,38 (м, 1Н), 7,00-7,07 (м, 2Н), 7,09-7,13 (м, 1Н), 7,22-7,32 (м, 2Н), 7,33-7,43 (м, 4Н), 10,12-10,30 (м, 4Н).
Гидрохлорид:
ESI-MC: 417 (МН+).
Пример 17
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(2-бензоксазолил)амино]пиперидин
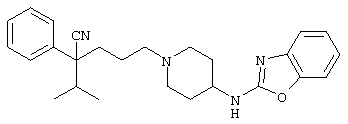
Указанное в заголовке соединение получают в виде бледно-желтого масла способом по примеру 15 (30%). Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,08-1,19 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,47-1,62 (м, 3Н), 1,75-1,83 (м, 1Н), 1,89 (дт, J=4,4 Гц, J=13,6 Гц, 1Н), 2,00 (шир.т, J=12,4 Гц, 1Н), 2,04-2,20 (м, 4Н), 2,25-2,31 (м, 2Н), 2,72 (шир.т, J=11,6 Гц, 2Н), 3,69-3,80 (м, 1Н), 4,92-5,02 (м, 1Н), 6,99-7,05 (м, 1Н), 7,13-7,17 (м, 1Н), 7,20-7,25 (м, 1Н), 7,25-7,32 (м, 1Н), 7,33-7,40 (м, 5Н).
Гидрохлорид:
ESI-MC: 417 (МН+).
Пример 18
1-[(4-Циано-5-метил-4-фенил)гексил]-4-(2-бензотиазолил)аминопиперидин
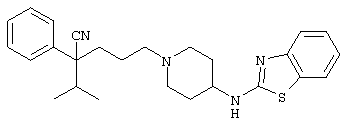
Указанное в заголовке соединение получают в виде бледно-желтого масла способом по примеру 15 (52%). Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,06-1,20 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,46-1,62 (м, 3Н), 1,77 (шир.с, 1Н), 1,85-1,94 (м, 1Н), 1,96-2,05 (м, 1Н), 2,05-2,18 (м, 4Н), 2,25-2,32 (м, 2Н), 2,70 (шир.т, J=12,4 Гц, 2Н), 3,56-3,66 (м, 1Н), 5,24 (шир.д, J=6,8 Гц, 1Н), 7,04-7,09 (м, 1Н), 7,25-7,32 (м, 2Н), 7,33-7,39 (м, 4Н), 7,50-7,58 (м, 2Н).
Гидрохлорид:
ESI-MC: 433 (МН+).
Пример 19
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(2-бензотиазолил)(метил)амино]пиперидин
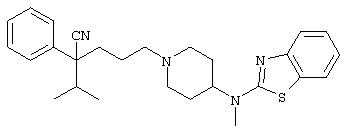
Указанное в заголовке соединение получают в виде бледно-желтого масла способом по примеру 15 (30%). Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,08-1,20 (м, 1Н), 1,21 (д, J=6,8 Гц, 3Н), 1,51-1,64 (м, 1Н), 1,74-2,20 (м, 9Н), 2,30 (т, J=7,2 Гц, 2Н), 2,82-2,93 (м, 2Н), 3,05 (с, 3Н), 3,94-4,05 (м, 1Н), 7,01-7,06 (м, 1Н), 7,24-7,33 (м, 2Н), 7,34-7,40 (м, 4Н), 7,51-7,59 (м, 2Н).
Гидрохлорид:
ESI-MC: 447 (МН+).
Пример 20
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(2-бензотиазолил)(2-пропил)амино]пиперидин
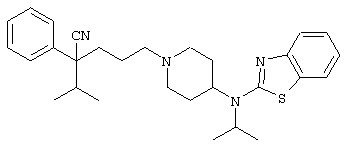
В N,N-диметилформамиде (3 мл) растворяют 1-[(4-циано-5-метил-4-фенил)гексил]-4-[(2-бензотиазолил)амино]пиперидин (50 мг), синтезированный в примере 18, и добавляют 60% гидрид натрия (7 мг). Реакционную смесь перемешивают при 50°С в течение одного часа и добавляют 2-бромпропан (0,012 мл). Смесь продолжают перемешивать при 50°С в течение ночи и добавляют дополнительное количество 2-бромпропана (0,012 мл). Затем смесь перемешивают при 50°С еще 6 часов и добавляют дополнительное количество 60% гидрида натрия (7 мг). Раствор продолжают перемешивать при 50°С в течение ночи и оставляют охлаждаться до комнатной температуры. К смеси добавляют этилацетат и промывают водой и насыщенным раствором соли. Реакционную смесь сушат над безводным сульфатом магния и упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (NH) (система: гексан/этилацетат), получая при этом указанное в заголовке соединение в виде бледно-желтого масла (31 мг, 57%). Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,4 Гц, 3Н), 1,08-1,20 (м, 1Н), 1,20 (д, J=6,4 Гц, 3Н), 1,50 (д, J=6,8 Гц, 6Н), 1,69-2,34 (м, 13Н), 2,63-2,74 (м, 2Н), 2,81-2,90 (м, 1Н), 6,86-6,91 (м, 1Н), 6,96-7,02 (м, 1Н), 7,11-7,16 (м, 1Н), 7,25-7,32 (м, 2Н), 7,33-7,41 (м, 4Н).
Гидрохлорид:
ESI-MC: 475 (МН+).
Пример 21
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(1-метил-2-бензимидазолил)амино]пиперидин
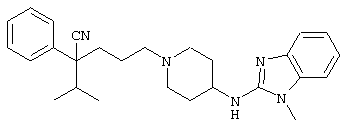
Указанное в заголовке соединение получают в виде бледно-желтого масла способом по примеру 15 (12%). Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,06-1,20 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,42-1,61 (м, 3Н), 1,84-1,93 (м, 1Н), 1,98-2,20 (м, 6Н), 2,27 (т, J=7,2 Гц, 2Н), 2,69-2,76 (м, 2Н), 3,45 (с, 3Н), 3,86-4,01 (м, 2Н), 7,01-7,12 (м, 3Н), 7,26-7,31 (м, 1Н), 7,33-7,39 (м, 4Н), 7,45 (д, J=7,6Гц, 1H).
Гидрохлорид:
ESI-MC: 430 (МН+).
Пример 22
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[[1-(2-пропил)-2-бензимидазолил]амино]пиперидин
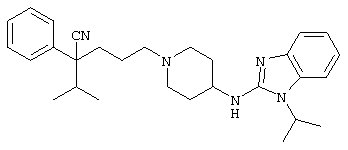
Указанное в заголовке соединение получают в виде бледно-желтого масла способом по примеру 15 (54%). Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,08-1,20 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,40-1,55 (м, 3Н), 1,57 (д, J=6,8 Гц, 6Н), 1,85-1,93 (м, 2Н), 2,02-2,20 (м, 5Н), 2,28 (т, J=7,2 Гц, 2Н), 2,67-2,75 (м, 2Н), 3,85-4,00 (м, 2Н), 4,33 (квин, J=6,8 Гц, 1Н), 6,97-7,10 (м, 2Н), 7,20-7,32 (м, 2Н), 7,34-7,39 (м, 4Н), 7,46-7,48 (м, 1Н).
Гидрохлорид:
ESI-MC: 458 (МН+).
Пример 23
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(5,6-диметокси-1-инданон)-2-ил]метилпиперидин
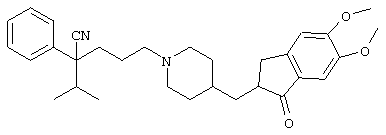
Указанное в заголовке соединение получают в виде бледно-желтого масла способом по примеру 15 (30%). Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,08-1,36 (м, 4Н), 1,20 (д, J=6,8 Гц, 3Н), 1,38-1,95 (м, 8Н), 2,08-2,18 (м, 2Н), 2,18-2,32 (м, 2Н), 2,65-2,83 (м, 4Н), 3,22 (дд, J=8 Гц, J=17,6 Гц, 1Н), 3,90 (с, 3Н), 3,96 (с, 3Н), 6,86 (с, 1Н), 7,16 (с, 1Н), 7,26-7,41 (м, 5Н).
Гидрохлорид:
ESI-MC: 489 (MH+).
Пример 24
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[[2-(4-фторфенокси)этил](2-цианоэтил)амино]пиперидин
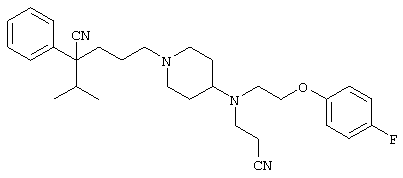
Указанное в заголовке соединение получают в виде бледно-желтого масла (21%) способом, описанным в нижеследующем примере 35. Гидрохлорид указанного в заголовке свободного соединения получают обычным способом.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,06-1,18 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,42-1,61 (м, 3Н), 1,66-1,80 (м, 3Н), 1,83-1,92 (м, 2Н), 2,08-2,17 (м, 2Н), 2,19-2,32 (м, 2Н), 2,43-2,53 (м, 1Н), 2,44 (т, J=6,8 Гц, 2Н), 2,78-2,94 (м, 6Н), 3,92 (т, J=6 Гц, 2Н), 6,79-6,85 (м, 2Н), 6,94-7,00 (м, 2Н), 7,27-7,39 (м, 5Н).
Гидрохлорид:
ESI-MC: 491 (MH+).
Пример 25
1-[4-Циано-5-метил-4-(2-нафтил)гексил]-4-[2-(4-фторфенокси)этил]пиперазин
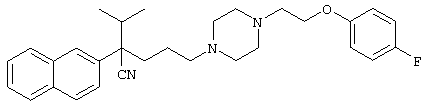
В ацетонитриле (5 мл) растворяют 310 мг (1,16 ммоль) 4-циано-5-метил-4-(2-нафтил)гексанола и добавляют 190 мкл (1,36 ммоль) триэтиламина и 105 мкл (1,36 ммоль) мезилхлорида. После окончания мезилирования к реакционной смеси добавляют 1,11 г (7,38 ммоль) иодида натрия, 255 мг (1,85 ммоль) карбоната калия, 414 мг (1,85 ммоль) 1-[2-(4-фторфенокси)этил]пиперазина, 5 мл диметилформамида и 1 мл воды и нагревают до 60°С. После окончания реакции к смеси добавляют насыщенный раствор соли и целевой продукт экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают и получают сырой продукт. Сырой продукт обрабатывают силикагелем (NH) (элюирование этилацетатом/гексаном, 2/3), получая при этом 384 мг (0,81 ммоль, 69,9%) указанного в заголовке соединения в виде желтого сиропа.
1H-ЯМР (400 МГц, CDCl3) δ 0,79 (д, J=6,8 Гц, 3Н), 1,05-1,15 (м, 1Н), 1,26 (д, J=6,8 Гц, 3Н), 1,50-1,65 (м, 1Н), 1,93-2,05 (м, 1Н), 2,18-2,60 (м, 12Н), 2,75 (т, J=5,8 Гц, 1Н), 4,02 (т, J=5,8 Гц, 2Н), 6,78-6,83 (м, 2Н), 6,91-6,97 (м, 2Н), 7,36 (дд, J=2,0 Гц, 8,8 Гц, 1Н), 7,48-7,54 (м, 2Н), 7,81-7,88 (м, 3Н), 7,94 (шир.д-с, 1Н).
ESI-MC: 474 (М+Н+).
Пример 26
1-[4-Циано-5-метил-4-(1-нафтил)гексил]-4-[2-(4-фторфенокси)этил]пиперазин
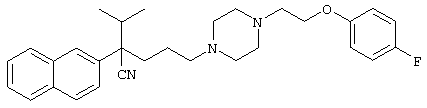
Указанное в заголовке соединение получают в виде бесцветного масла способом по примеру 25 (выход 57,8%).
1H-ЯМР (400 МГц, CDCl3) δ 0,70-0,90 (м, 3Н), 0,95-1,10 (м, 1Н), 1,20-1,40 (м, 4Н), 1,50-1,65 (м, 1Н), 1,93-2,05 (м, 1Н), 2,10-2,56 (м, 10Н), 2,56-2,70 (м, 1Н), 2,73 (т, J=5,8 Гц, 1Н), 2,90-3,00 (м, 1Н), 4,01 (т, J=5,8 Гц, 2Н), 6,78-6,83 (м, 2Н), 6,91-6,97 (м, 2Н), 7,40-7,50 (м, 3Н), 7,78-7,92 (м, 3Н), 8,22-8,31 (шир.д-с, 1Н).
ESI-MC: 474 (М+Н+).
Пример 27
1-[4-Циано-5-метил-4-(2-пиридил)гексил]-4-[2-(4-фторфенокси)этил]пиперазин
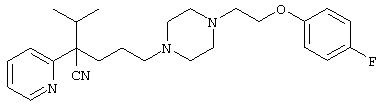
4-Циано-5-метил-4-(2-пиридил)гексанол, синтезированный способом по примеру 25, окисляют SO3-пиридином обычным способом. Полученный сырой альдегид подвергают гидроаминированию описанным ниже способом по примеру 42 и синтезируют таким образом целевое соединение в виде бесцветного масла (выход 69,1%).
1H-ЯМР (400 МГц, CDCl3) δ 0,74 (д, J=6,8 Гц, 3Н), 0,90-1,10 (м, 1Н), 1,20 (д, J=6,4 Гц, 3Н), 1,24-1,30 (м, 1Н), 1,53-1,66 (м, 1Н), 2,03-2,23 (м, 2Н), 2,24-2,74 (м, 10Н), 2,81 (т, J=5,4 Гц, 2Н), 4,06 (т, J=5,4 Гц, 2Н), 6,79-6,85 (м, 2Н), 6,92-6,98 (м, 2Н), 7,21 (ддд, J=1,2 Гц, 4,8 Гц, 8,0 Гц, 1Н), 7,57 (дт, J=1,2 Гц, 8,0 Гц, 1H), 7,69 (дт, J=2,0 Гц, 8,0 Гц, 1Н), 8,58-8,62 (м, 1H).
ESI-MC: 425 (M+H+).
Пример 28
1-[4-Циано-5-метил-4-(4-пиридил)гексил]-4-[2-(4-фторфенокси)этил]пиперазин
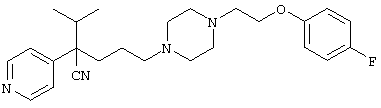
Указанное в заголовке соединение получают в виде желтого масла способом по примеру 25 (выход 70%).
1H-ЯМР (400 МГц, CDCl3) δ 0,79 (д, J=6,8 Гц, 3Н), 1,00-1,20 (м, 1H), 1,22 (д, J=6,4 Гц, 3Н), 1,50-1,64 (м, 1H), 1,85-2,00 (м, 1H), 2,08-2,25 (м, 2Н), 2,26-2,75 (м, 10Н), 2,82 (т, J=5,4 Гц, 2Н), 4,07 (т, J=5,4 Гц, 2Н), 6,79-6,85 (м, 2Н), 6,92-6,98 (м, 2Н), 7,31 (дд, J=1,6 Гц, 4,4 Гц, 2Н), 8,63 (дд, J=1,6 Гц, 4,4 Гц, 2Н).
ESI-MC: 425 (M+H+).
Пример 29
1-[(4-Циано-5-метил-4-фенил)гексил]-4-фенилпиперазин
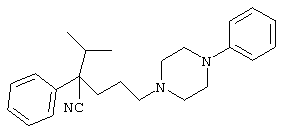
В ацетонитриле (2 мл) растворяют 100 мг (0,30 ммоль) 4-циано-5-метил-5-фенилгексилиодида. К полученной смеси добавляют 55 мг (0,36 ммоль) карбоната калия и 60 мг (0,36 ммоль) фенилпиперазина и нагревают до 60°С. После окончания реакции раствор распределяют между этилацетатом и насыщенным раствором соли. Органический слой сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 2 г силикагеля Chromatorex NH (этилацетат/гексан, 1/5), получая при этом 137 мг (количественный выход) указанного в заголовке соединения в виде бесцветного сиропа. Физико-химические данные указанного в заголовке соединения приведены ниже.
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,4 Гц, 3Н), 1,08-1,26 (м, 1Н), 1,21 (д, J=6,8 Гц, 3Н), 1,52-1,66 (м, 1Н), 1,88-1,98 (м, 1Н), 2,08-2,23 (м, 2Н), 2,28-2,37 (м, 2Н), 2,42-2,52 (м, 4Н), 3,10-3,20 (м, 4Н), 6,82-6,86 (м, 1Н), 6,88-6,92 (м, 2Н), 7,22-7,32 (м, 4Н), 7,34-7,40 (м, 3Н).
ESI-MC: 362 (М+Н+).
Пример 30
1-[(4-Циано-5-метил-4-фенил)гексил]-4-(2-фенилэтил)пиперазин
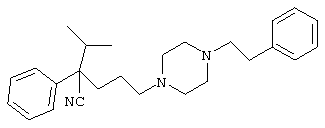
Указанное в заголовке соединение синтезируют способом по примеру 29, используя 1-(2-фенилэтил)пиперазин (выход 100%, бесцветное масло).
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,4 Гц, 3Н), 1,08-1,20 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,50-1,63 (м, 1Н), 1,84-1,93 (м, 1Н), 2,07-2,19 (м, 2Н), 2,24-2,60 (м, 12Н), 2,74-2,82 (м, 2Н), 7,16-7,21 (м, 3Н), 7,24-7,31 (м, 3Н), 7,35-7,38 (м, 4Н).
ESI-MC: 390 (М+Н+).
Пример 31
1-[(4-Циано-5-метил-4-фенил)гексил]-4-(3-фенилпропил)пиперазин
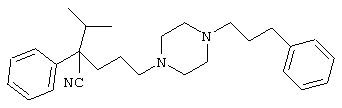
Указанное в заголовке соединение синтезируют способом по примеру 29, используя 1-(3-фенилпропил)пиперазин (выход 100%, бесцветное масло).
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,04-1,20 (м, 1Н), 1,20 (д, J=6,4 Гц, 3Н), 1,50-1,62 (м, 1Н), 1,74-1,92 (м, 3Н), 2,06-2,18 (м, 2Н), 2,20-2,50 (м, 12Н), 2,61 (т, J=7,6 Гц, 2Н), 7,14-7,19 (м, 3Н), 7,23-7,31 (м, 3Н), 7,34-7,37 (м, 4Н).
ESI-MC: 404 (М+Н+).
Пример 32
1-[(4-Циано-5-метил-4-фенил)гексил]-3-[N-(2-цианоэтил)-N-{2-(3-фторфенокси)этил}амино]пирролидин
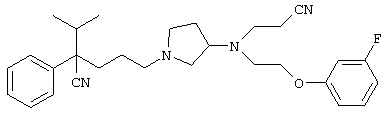
В дихлорметане (7 мл) растворяют 250 мг (0,74 ммоль) 1-[(4-циано-5-метил-4-фенил)гексил]-3-[N-(2-цианоэтил)амино]пирролидин и поочередно добавляют 171 мг (1,11 ммоль) отдельно синтезированного 3-фторфеноксиацетальдегида, 0,08 мл (1,48 ммоль) уксусной кислоты и 235 мг (1,11 ммоль) триацетоксиборогидрида натрия. После окончания реакции раствор подщелачивают 2 н. раствором гидроксида натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 25 г силикагеля Chromatorex NH (этилацетат/гексан, 1/3), получая при этом 290 мг (0,61 ммоль, 82,2%) указанного в заголовке соединения в виде бесцветного сиропа.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,05-1,25 (м, Н), 1,20 (д, J=6,8 Гц, 3Н), 1,47-1,80 (м, 2Н), 1,85-2,28 (м, 4Н), 2,29-2,70 (м, 6Н), 2,48 (т, J=6,8 Гц, 2Н), 2,90-3,25 (м, 4Н), 3,40-3,55 (м, 1Н), 3,98 (т, J=5,6 Гц, 2Н), 6,56-6,62 (м, 1Н), 6,63-6,90 (м, 3Н), 7,18-7,25 (м, 1Н), 7,26-7,40 (м, 5Н).
ESI-MC: 477 (М+Н+).
Пример 33
1-[(4-Циано-5-метил-4-фенил)гексил]-3-[N-(2-цианоэтил)-N-{2-(3-цианофенокси)этил}амино]пирролидин
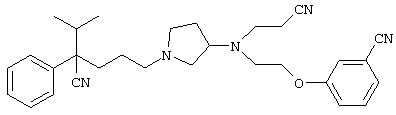
В дихлорметане (7 мл) растворяют 250 мг (0,74 ммоль) 1-[(4-циано-5-метил-4-фенил)гексил]-3-[N-(2-цианоэтил)амино]пирролидина и поочередно добавляют 179 мг (1,11 ммоль) 3-цианофеноксиацетальдегида, синтезированного отдельно аналогично способу получения 3-фторфеноксиацетальдегида, 0,08 мл (1,48 ммоль) уксусной кислоты и 235 мг (1,11 ммоль) триацетоксиборогидрида натрия. После окончания реакции раствор подщелачивают 2 н. раствором гидроксида натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 25 г силикагеля Cromatorex NH (этилацетат/гексан, 1/3), получая при этом 318 мг (0,66 ммоль, 88,9%) указанного в заголовке соединения в виде бесцветного сиропа.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,05-1,25 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,47-1,80 (м, 2Н), 1,85-2,28 (м, 4Н), 2,29-2,72 (м, 6Н), 2,48 (т, J=6,8 Гц, 2Н), 2,90-3,05 (м, 4Н), 3,42-3,55 (м, 1Н), 4,01 (т, J=5,6 Гц, 2Н), 7,11-7,15 (м, 2Н), 7,23-7,40 (м, 7Н).
ESI-MC: 484 (М+Н+).
Пример 34
1-[(4-Циано-5-метил-4-фенил)гексил]-3-[N-(2-цианоэтил)-N-{2-(2-цианофенокси)этил}амино]пирролидин
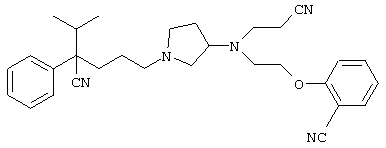
В дихлорметане (7 мл) растворяют 263 мг (0,78 ммоль) 1-[(4-циано-5-метил-4-фенил)гексил]-3-[N-(2-цианоэтил)амино]пирролидина и поочередно добавляют 251 мг (1,56 ммоль) отдельно синтезированного 3-цианофеноксиацетальдегида, 0,09 мл (1,56 ммоль) уксусной кислоты и 247 мг (1,17 ммоль) триацетоксиборогидрида натрия. После окончания реакции раствор подщелачивают 2 н. раствором гидроксида натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 25 г силикагеля Cromatorex NH (этилацетат/гексан, 1/3), получая при этом 311 мг (0,64 ммоль, 82,4%) указанного в заголовке соединения в виде желтого сиропа.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,05-1,25 (м, 1Н), 1,19 (д, J=6,4 Гц, 3Н), 1,45-1,80 (м, 2Н), 1,85-2,16 (м, 3Н), 2,16-2,70 (м, 7Н), 2,54 (т, J=6,8 Гц, 2Н), 2,90-3,12 (м, 4Н), 3,45-3,60 (м, 1Н), 4,11 (т, J=6,8 Гц, 2Н), 6,40-7,04 (м, 2Н), 7,26-7,40 (м, 5Н), 7,50-7,58 (м, 2Н).
ESI-MC: 484 (М+Н+).
Пример 35
1-[(4-Циано-5-метил-4-фенил)гексил]-3-[N-(2-цианоэтил)-N-{2-(4-цианофенокси)этил}амино]пирролидин
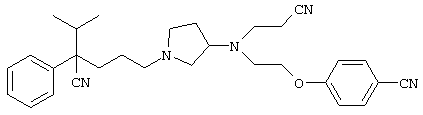
В ацетонитриле (5,00 мл) растворяют 217 мг (1,00 ммоль) 4-циано-5-метил-5-фенилгексилгексанола и полученный раствор охлаждают до 0°С. К смеси добавляют 320 мкл (2,30 экв.) триэтиламина и 85 мкл (1,10 экв.) мезилхлорида и нагревают до комнатной температуры. Через 15 минут добавляют 450 мг (3,00 экв.) иодида натрия и 370 мг (1,30 ммоль) 3-[N-(2-цианоэтил)-N-{2-(4-цианофенокси)этил}амино]пирролидина и нагревают смесь до 60°С. После окончания реакции к смеси добавляют насыщенный раствор соли и целевой продукт экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают и получают сырой продукт. Сырой продукт обрабатывают 37 г силикагеля Cromatorex NH (этилацетат/гексан, 1/1), получая при этом 316 мг (0,65 ммоль, 65%) указанного в заголовке соединения в виде желтого сиропа.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,10-1,25 (м, 1Н), 1,19 (д, J=6,4 Гц, 3Н), 1,48-1,63 (м, 1Н), 1,65-1,77 (м, 1Н), 1,78-1,97 (м, 1Н), 1,98-2,17 (м, 2Н), 2,19-2,30 (м, 1Н), 2,30-2,73 (м, 6Н), 2,48 (т, J=6,8 Гц, 2Н), 2,90-3,07 (м, 4Н), 3,43-3,56 (м, 1Н), 4,04 (т, J=5,8 Гц, 2Н), 6,94 (д, J=9,2 Гц, 2Н), 7,27-7,34 (м, 1Н), 7,34-7,40 (м, 4Н), 7,59 (д, J=9,2 Гц, 2Н).
ESI-MC: 484 (М+Н+).
Пример 36
1-[((4-Циано-5-метил-4-(2-тиенил))гексил]-3-[N-(2-цианоэтил)-N-{2-(4-цианофенокси)этил}амино]пирролидин
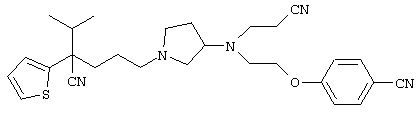
Указанное в заголовке соединение синтезируют способом по примеру 35, используя 4-циано-5-метил-5-(2-тиенил)гексанол (выход 38%, бледно-желтый сироп).
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,8 Гц, 3Н), 1,18 (д, J=6,4 Гц, 3Н), 1,25-1,40 (м, 1Н), 1,55-1,85 (м, 2Н), 1,98-2,12 (м, 3Н), 2,18-2,78 (м, 7Н), 2,48 (т, J=6,8 Гц, 2Н), 2,90-3,10 (м, 4Н), 3,44-3,58 (м, 1Н), 4,05 (т, J=5,6 Гц, 2Н), 6,92-6,98 (м, 3Н), 7,10-7,13 (м, 1Н), 7,25-7,29 (м, 1Н), 7,59 (д, J=8,8 Гц, 2Н).
ESI-MC: 490 (М+Н+).
Пример 37
1-[(4-Циано-5-метил-4-(2-тиенил))гексил]-3-[N-(2-цианоэтил)-N-{2-(3-цианофенокси)этил}амино]пирролидин
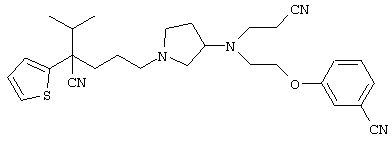
Указанное в заголовке соединение синтезируют способом по примеру 35, используя 4-циано-5-метил-5-(2-тиенил)гексанол и 3-цианофеноксиацетальдегид (выход 98%, бледно-желтый сироп).
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,4 Гц, 3Н), 1,18 (д, J=6,4 Гц, 3Н), 1,28-1,45 (м, 1Н), 1,58-1,90 (м, 2Н), 2,00-2,15 (м, 3Н), 2,20-2,31 (м, 1Н), 2,32-2,80 (м, 6Н), 2,49 (т, J=6,8 Гц, 2Н), 2,90-3,08 (м, 4Н), 3,47-3,62 (м, 1Н), 4,02 (т, J=5,6 Гц, 2Н), 6,96 (дд, J=5,2 Гц, 3,6 Гц, 1Н), 7,11-7,16 (м, 3Н), 7,24-7,29 (м, 2Н), 7,38 (дд, J=7,8 Гц, 9,0 Гц, 1Н).
ESI-MC: 490 (М+Н+).
Пример 38
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(6-фенилпиридин-3-ил)метил]пиперазин
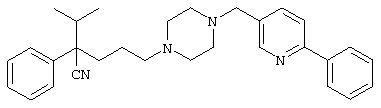
(6-Фенилпиридин-3-ил)метанол (185 мг, 1,00 ммоль) и триэтиламин (0,29 мл) растворяют в 5 мл ацетонитрила и по каплям добавляют 85,1 мкл (1,10 ммоль) метансульфонилхлорида. После исчезновения исходного вещества, подтвержденного данными тонкослойной хроматографии, к реакционному раствору при комнатной температуре добавляют 340 мг (1,19 ммоль) 1-[(4-циано-5-метил-4-фенил)гексил]пиперазина, после чего поочередно добавляют 899 мг иодида натрия, 5 мл диметилформамида и 1 мл воды. Затем смесь нагревают до 80°С. После окончания реакции к смеси добавляют насыщенный раствор соли и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 50 г силикагеля Cromatorex NH (этилацетат/гексан, 1/2), получая при этом 300 мг (0,66 ммоль, 66,3%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,06-1,26 (м, 1Н), 1,20 (д, J=6,4 Гц, 3Н), 1,48-1,64 (м, 1Н), 1,84-1,97 (м, 1Н), 2,06-2,22 (м, 2Н), 2,23-2,60 (м, 10Н), 3,54 (с, 2Н), 7,24-7,32 (т, 1Н), 7,32-7,43 (м, 5Н), 7,43-7,50 (м, 2Н), 7,66-7,74 (м, 2Н), 7,95-7,99 (м, 2Н), 8,58 (шир. д-с, 1Н).
ESI-MC: 453 (М+Н+).
Пример 39
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(5-фенилизоксазол-3-ил)метил]пиперазин
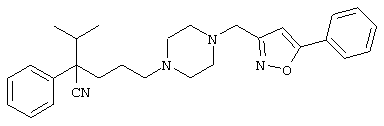
(5-Фенилизоксазол-3-ил)метанол (61,3 мг, 0,35 ммоль) и триэтиламин (0,10 мл) растворяют в 3 мл ацетонитрила и по каплям добавляют 27,1 мкл (0,35 ммоль) метансульфонилхлорида. После исчезновения исходного вещества, подтвержденного данными тонкослойной хроматографии, к реакционному раствору при комнатной температуре добавляют 100 мг (0,35 ммоль) 1-[(4-циано-5-метил-4-фенил)гексил]пиперазина, после чего поочередно добавляют 262 мг иодида натрия и 2 мл диметилформамида. Затем смесь нагревают до 70°С. После окончания реакции к смеси добавляют насыщенный раствор соли и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 15 г силикагеля Cromatorex NH (этилацетат/гексан, 2/3), получая при этом 45 мг (0,10 ммоль, 29,0%) указанного в заголовке соединения в виде желтого сиропа.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,06-1,26 (м, 1Н), 1,20 (д, J=6,4 Гц, 3Н), 1,48-1,64 (м, 1Н), 1,86-1,98 (м, 1Н), 2,06-2,20 (м, 2Н), 2,25-2,70 (м, 10Н), 3,63 (с, 2Н), 6,54 (с, 1H), 7,24-7,32 (м, 1Н), 7,32-7,39 (м, 4Н), 7,39-7,49 (м, 3Н), 7,74-7,79 (м, 2Н).
ESI-MC: 443 (М+Н+).
Пример 40
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(2-фенилтиазол-4-ил)метил]пиперазин
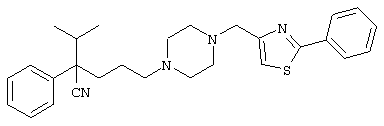
(2-Фенилтиазол-4-ил)метанол (66,9 мг, 0,35 ммоль) и 0,10 мл триэтиламина растворяют в 3 мл ацетонитрила и по каплям добавляют 27,1 мкл (0,35 ммоль) метансульфонилхлорида. После исчезновения исходного вещества, подтвержденного данными тонкослойной хроматографии, к реакционному раствору при комнатной температуре добавляют 100 мг (0,35 ммоль) 1-[(4-циано-5-метил-4-фенил)гексил]пиперазина. Затем к полученной смеси добавляют 262 мг иодида натрия, 2 мл диметилформамида и 2 мл ацетонитрила и нагревают до 70°С. После окончания реакции к смеси добавляют насыщенный раствор соли и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 15 г силикагеля Cromatorex NH (этилацетат/гексан, 1/2), получая при этом 63 мг (0,14 ммоль, 40,0%) указанного в заголовке соединения в виде бесцветного сиропа.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,05-1,25 (м, 1Н), 1,20 (д, J=6,4 Гц, 3Н), 1,48-1,64 (м, 1Н), 1,82-1,98 (м, 1Н), 2,05-2,22 (м, 2Н), 2,23-2,80 (м, 10Н), 3,74 (с, 2Н), 7,13 (с, 1Н), 7,25-7,32 (м, 1Н), 7,32-7,39 (м, 4Н), 7,39-7,45 (м, 3Н), 7,91-7,75 (м, 2Н).
ESI-MC: 459 (М+Н+).
Пример 41
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(2-фенилоксазол-4-ил)метил]пиперазин
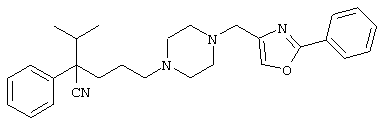
(2-Фенилоксазол-4-ил) метанол (61,3 мг, 0,35 ммоль) и 0,10 мл триэтиламина растворяют в 3 мл ацетонитрила и по каплям добавляют 27,1 мкл (0,35 ммоль) метансульфонилхлорида. После исчезновения исходного вещества, подтвержденного данными тонкослойной хроматографии, к реакционному раствору при комнатной температуре добавляют 100 мг (0,35 ммоль) 1-[(4-циано-5-метил-4-фенил)гексил]пиперазина. Затем к смеси добавляют 262 мг иодида натрия и 2 мл диметилформамида и нагревают до 70°С. После окончания реакции к смеси добавляют насыщенный раствор соли и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 15 г силикагеля Cromatorex NH (этилацетат/гексан, 2/3), получая при этом 41 мг (0,09 ммоль, 26,5%) указанного в заголовке соединения в виде бесцветного сиропа.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,07-1,24 (м, 1H), 1,19 (д, J=6,8 Гц, 3Н), 1,49-1,64 (м, 1Н), 1,84-1,96 (м, 1H), 2,06-2,20 (м, 2Н), 2,26-2,74 (м, 10Н), 3,54 (с, 2Н), 7,24-7,32 (м, 1H), 7,32-7,39 (м, 4Н), 7,41-7,46 (м, 3Н), 7,58 (с, 1H), 8,01-8,06 (м, 2Н).
ESI-MC: 443 (М+Н+).
В приведенных выше примерах (6-фенилпиридин-3-ил)метанол и (5-фенилизоксазол-3-ил)метанол синтезируют способом, описанным в журнале Med. Chem., 1998, 41, 2390-2410, (2-фенилоксазол-4-ил)метанол синтезируют способом, описанным в журнале Оrg. Chem., 1996, 61, 6496-6497, и (2-фенилтиазол-4-ил)метанол синтезируют способом, описанным в журнале Bull. Chem. Soc. Jpn., 71, 1391-1396 (1998).
Пример 42
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[2-(4-фенил-2-оксо-3-оксазолидинил)этил]пиперазин
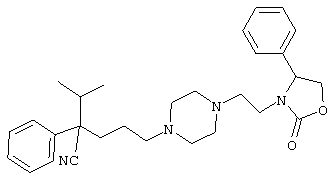
5 мл диметилацеталя 2-(4-фенил-2-оксо-3-оксазолидинил)ацетальдегида растворяют в 5 мл ацетона, добавляют 6 мл 2,5 н. раствора хлористоводородной кислоты и смесь нагревают. После окончания реакции смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая 300 мг сырого продукта, являющегося 2-(4-фенил-2-оксо-3-оксазолидинил)ацетальдегидом. Сырой продукт используют при осуществлении следующей реакции без очистки. А именно, 2-(4-фенил-2-оксо-3-оксазолидинил)ацетальдегид растворяют в 5 мл дихлорэтана и поочередно добавляют 300 мг (1,46 ммоль) полученного выше 2-(4-фенил-2-оксо-3-оксазолидинил)ацетальдегида, 0,11 мл (2,00 ммоль) уксусной кислоты и 318 мг (1,50 ммоль) триацетоксиборогидрида натрия. После окончания реакции раствор подщелачивают 2 н. раствором гидроксида натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 50 г силикагеля Cromatorex NH (этилацетат/гексан, 1/1), получая при этом 477 мг (0,94 ммоль, 94,2%) указанного в заголовке соединения в виде бесцветного сиропа.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,08-1,22 (м, 1Н), 1,20 (д, J=6,4 Гц, 3Н), 1,48-1,63 (м, 1Н), 1,85-1,96 (м, 1Н), 2,06-2,18 (м, 2Н), 2,20-2,52 (м, 12Н), 2,84 (дт, J=6,4 Гц, 14,4 Гц, 1Н), 3,57 (дт, J=6,4 Гц, 14,4 Гц, 1Н), 4,05 (дд, J=7,6 Гц, 8,8 Гц, 1Н), 4,61 (т, J=8,8 Гц, 1Н), 4,90-4,98 (м, 1Н), 7,25-7,32 (м, 2Н), 7,34-7,43 (м, 8Н).
ESI-MC: 475 (М+Н+).
Пример 43
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(3-фенил-2-оксо-5-оксазолидинил)метил]пиперазин
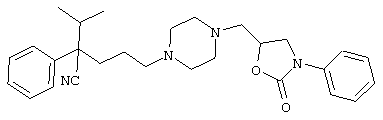
5-(Гидроксиметил)-3-фенил-2-оксооксазолидин синтезируют способом, описанным в журнале J.Med.Chem., 989, 673-1681. 5-(Гидроксиметил)-3-фенил-2-оксооксазолидин (1,00 ммоль, 193 мг) и 0,29 мл триэтиламина растворяют в 5 мл ацетонитрила и по каплям добавляют 85,1 мкл (1,10 ммоль) метансульфонилхлорида. После исчезновения исходного вещества, подтвержденного данными тонкослойной хроматографии, к реакционному раствору при комнатной температуре добавляют 340 мг (1,19 ммоль) 1-[(4-циано-5-метил-4-фенил)гексил]пиперазина, после чего поочередно добавляют 899 мг иодида натрия, 5 мл диметилформамида и 1 мл воды. Затем смесь нагревают до 60°С. После окончания реакции к смеси добавляют насыщенный раствор соли и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 50 г силикагеля Cromatorex NH (этилацетат/гексан, 1/1), получая при этом 110 мг (0,24 ммоль, 23,9%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,10-1,25 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,50-1,65 (м, 1Н), 1,86-2,03 (м, 1Н), 2,05-2,22 (м, 2Н), 2,22-2,80 (м, 12Н), 3,75-3,82 (м, 1Н), 4,06 (т, J=8,8 Гц, 1Н), 4,70-4,80 (м, 1Н), 7,11-7,16 (м, 1Н), 7,27-7,33 (м, 1Н), 7,33-7,40 (м, 6Н), 7,51-7,56 (м, 2Н).
ESI-MC: 461 (М+Н+).
Пример 44
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(5-фенил-1,2,4-оксадиазол-3-ил)метил]пиперазин
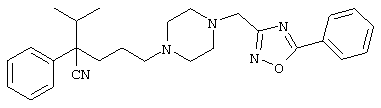
В тетрагидрофуране (3 мл) растворяют 95,3 мг (0,70 ммоль) бензамидоксима и молекулярное сито 4 ангстрем (400 мг). К смеси сначала добавляют 32 мг (0,8 ммоль) гидрида натрия и затем еще 20 мг и нагревают до 60°С. Через 10 минут добавляют 3 мл раствора 500 мг (1,40 ммоль) 1-[(4-циано-5-метил-4-фенил)гексил]-4-[(метоксикарбонил)метил]пиперазина в тетрагидрофуране и нагревают смесь с обратным холодильником. После окончания реакции к смеси добавляют насыщенный раствор соли и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт очищают препаративной хроматографией (этилацетат: 10%) и затем обрабатывают 25 г силикагеля Cromatorex NH (этилацетат/гексан, 3:5), получая при этом 127 мг (0,29 ммоль, 40,9%) указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,4 Гц, 3Н), 1,04-1,20 (м, 1Н), 1,19 (д, J=6,4 Гц, 3Н), 1,45-1,60 (м, 1Н), 1,80-1,92 (м, 1Н), 2,05-2,18 (м, 2Н), 2,22-2,31 (м, 2Н), 2,31-2,50 (м, 4Н), 2,55-2,70 (м, 4Н), 3,90 (с, 2Н), 4,06 (т, J=8,8 Гц, 1Н), 4,70-4,80 (м, 1Н), 7,25-7,32 (м, 1Н), 7,33-7,37 (м, 4Н), 7,45-7,51 (м, 3Н), 8,06-8,10 (м, 2Н).
ESI-MC: 444 (М+Н+).
Пример 45
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(5-(3-фторфенил)-1,2,4-оксадиазол-3-ил)метил]пиперазин
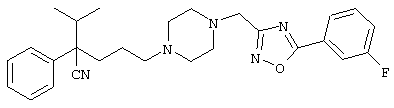
Указанное в заголовке соединение синтезируют, используя 3-фторбензамидоксим, аналогично способу получения 1-[(4-циано-5-метил-4-фенил)гексил]-4-[(5-фенил-1,2,4-оксадиазол-3-ил)метил]пиперазина по примеру 44 (выход 26%, бледно-желтый сироп).
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,06-1,22 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,50-1,62 (м, 1Н), 1,83-1,96 (м, 1Н), 2,05-2,20 (м, 2Н), 2,20-2,54 (м, 6Н), 2,55-2,76 (м, 4Н), 3,90 (с, 2Н), 4,06 (т, J=8,8 Гц, 1Н), 4,70-4,80 (м, 1Н), 7,17-7,25 (м, 1Н), 7,25-7,32 (м, 1Н), 7,32-7,38 (м, 4Н), 7,42-7,48 (м, 1Н), 7,77-7,82 (м, 1Н), 7,86-7,90 (м, 1Н).
ESI-MC: 462 (М+Н+).
Пример 46
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(2-(4-фторфенокси)этил]пиперидин
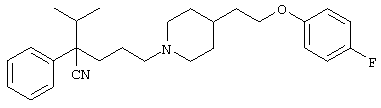
В ацетонитриле (2 мл) растворяют 100 мг (0,30 ммоль) 4-циано-5-метил-4-фенилгексилиодида. К смеси добавляют 55 мг (0,36 ммоль) карбоната натрия и 80 мг (0,36 ммоль) 4-[(2-(4-фторфенокси)этил]пиперидина и нагревают до 60°С. После окончания реакции смесь распределяют между этилацетатом и насыщенным раствором соли. Органический слой сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 40 г силикагеля Cromatorex NH (этилацетат/гексан, 1:5), получая при этом 120 мг (0,28 ммоль, 94,7%) указанного в заголовке соединения в виде бесцветного сиропа. Физико-химические данные указанного в заголовке соединения приведены ниже.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,05-1,24 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,22-1,32 (м, 2Н), 1,42-1,80 (м, 7Н), 1,81-1,92 (м, 2Н), 2,07-2,18 (м, 2Н), 2,20-2,28 (м, 2Н), 2,70-2,80 (м, 2Н), 3,93 (т, J=6,8 Гц, 2Н), 6,78-6,83 (м, 2Н), 6,92-6,98 (м, 2Н), 7,25-7,38 (м, 5Н).
ESI-MC: 423 (М+Н+).
Пример 47
1-Бензил-4-[(4-циано-5-метил-4-фенил)гексил]пиперидин
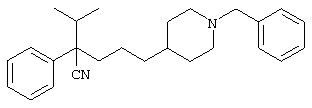
В ДМФА (70 мл) растворяют 2,39 г (15,0 ммоль) 3-метил-2-фенилпентаннитрила. К смеси добавляют 600 мг (60 мас.%, 15,0 ммоль) гидрида натрия и нагревают до 60°С. Через 30 минут реакционный раствор охлаждают до комнатной температуры, добавляют 2,90 г (9,31 ммоль) 1-бензил-4-метансульфонилоксипропилпиперидина, растворенного в 10 мл ДМФ, и смесь снова нагревают. После окончания реакции смесь распределяют между этилацетатом и насыщенным раствором соли. Органический слой сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 100 г силикагеля (этилацетат/гексан, от 1/100 до 1/0), получая при этом 2,57 г (6,86 ммоль, 73,7%) указанного в заголовке соединения в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 0,85-0,98 (м, 1Н), 1,06-1,26 (м, 6Н), 1,18 (д, J=6,4 Гц, 3Н), 1,30-1,44 (м, 1Н), 1,44-1,56 (м, 2Н), 1,74-1,90 (м, 3Н), 2,03-2,15 (м, 2Н), 2,76-2,86 (м, 2Н), 3,44 (с, 2Н), 7,20-7,38 (м, 10Н).
Пример 48
1-[(2-(4-Фторфенокси)этил]-4-[(4-циано-5-метил-4-фенил)гексил]пиперидин
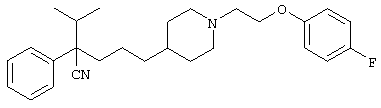
В ацетонитриле (5 мл) растворяют 200 мг (0,70 ммоль) 4-[(4-циано-5-метил-4-фенил)гексил]пиперидина. К смеси добавляют 69 мг (0,50 ммоль) карбоната калия и 110 мг (0,50 ммоль) 4-фторфеноксиэтилбромида и нагревают до 60°С. После окончания реакции смесь распределяют между этилацетатом и насыщенным раствором соли. Органический слой сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 40 г силикагеля Cromatorex NH (этилацетат/гексан, 1/7), получая при этом 160 мг (0,38 ммоль, 76,0%) указанного в заголовке соединения в виде бесцветного сиропа. Физико-хиимические данные соединения приведены ниже.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 0,85-0,98 (м, 1Н), 1,10-1,30 (м, 5Н), 1,19 (д, J=6,8 Гц, 3Н), 1,30-1,43 (м, 1Н), 1,50-1,66 (м, 2Н), 1,74-1,85 (м, 1Н), 1,92-2,03 (м, 2Н), 2,05-2,14 (м, 2Н), 2,72 (т, J=6,0 Гц, 2Н), 2,88-2,95 (м, 2Н), 4,03 (т, J=6,0 Гц, 2Н), 6,79-6,84 (м, 2Н), 6,92-6,98 (м, 2Н), 7,26-7,38 (м, 5Н).
ESI-MC: 423 (М+Н+).
Пример 49
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[3-циано-3-(2-тиенил) пропил]пиперазин
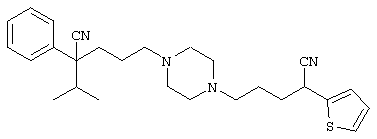
Указанное в заголовке свободное соединение получают в виде желтого масла из 3-циано-3-(2-тиенил)пропанола (114 мг) и 1-[(4-циано-5-метил-4-фенил)гексил]пиперазина (90 мг) (см. формулу 86 в JP-A 10-280103) (63 мг, 22%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,05-1,20 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,50-1,73 (м, 2Н), 1,82-1,95 (м, 2Н), 1,95-2,08 (м, 2Н), 2,08-2,18 (м, 2Н), 2,20-2,45 (м, 10Н), 4,10-4,15 (м, 1Н), 6,90-6,99 (м, 1Н), 7,04-7,06 (м, 1Н), 7,26-7,30 (м, 1Н), 7,35-7,40 (м, 5Н).
63 мг полученного выше указанного в заголовке свободного соединения обрабатывают обычным способом и получают 60 мг гидрохлорида.
Гидрохлорид:
ESI-MC: 449 (МН+).
Пример 50
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(4-циано-4-(4’-фторфенил)бутил]пиперазин
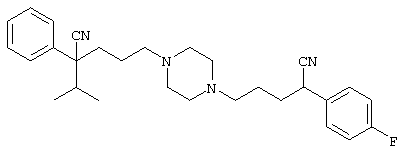
2-[(3-Циано-3-фенил)пропил]-1,3-диоксолан (1,77 г) растворяют в 2 н. растворе НСl (15 мл) в тетрагидрофуране (15 мл). Смесь перемешивают при комнатной температуре в течение 13 часов, добавляют 2 н. раствор NaOH (15 мл) и этилацетат и отделяют органический слой. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и смесь упаривают. 99 мг из образовавшегося остатка (5-оксо-2-фенилпропаннитрила), 1-[(4-циано-5-метил-4-фенил)гексил]пиперазин (99 мг) и уксусную кислоту (0,1 мл) растворяют в дихлорметане (3,5 мл) и добавляют триацетоксиборогидрид натрия (147 мг). Смесь перемешивают при комнатной температуре в течение 18 часов 30 минут, нейтрализуют, добавляя насыщенный водный раствор бикарбоната натрия, и экстрагируют дихлорметаном. Полученный органический слой сушат над безводным сульфатом магния. Осушитель отфильтровывают и смесь упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем NH (система: гексан/этилацетат), получая при этом указанное в заголовке соединение (136 мг, 88%, выход вычислен в расчете на 1-[(4-циано-5-метил-4-фенил)гексил]пиперазин).
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,04-1,19 (м, 1Н), 1,19 (д, J=6,8 Гц, 3Н), 1,50-1,70 (м, 3Н), 1,80-2,00 (м, 3Н), 2,08-2,20 (м, 2Н), 2,20-2,45 (м, 12Н), 3,80-3,88 (м, 1Н), 7,25-7,40 (м, 9Н).
136 мг полученного выше указанного в заголовке свободного соединения обрабатывают обычным способом и получают 141 мг гидрохлорида.
Гидрохлорид:
ESI-MC: 461 (МН+).
Пример 51
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[4-гидроксим-4-(4’-фторфенил)бутил]пиперазин
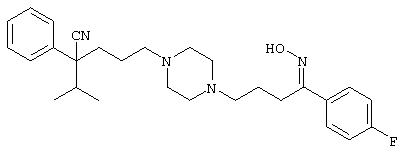
Раствор (10 мл) 1-[(4-циано-5-метил-4-фенил)гексил]пиперазина (100 мг), 4-хлор-4’-фторбутирофенона (91 мг) и триэтиламина (0,1 мл) в ацетонитриле перемешивают, нагревая с обратным холодильником. Через 6 часов реакционный раствор охлаждают до комнатной температуры и отделяют органический слой, добавляя воду и этилацетат. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и фильтрат упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (система метанол/этилацетат) и получают 1-[(4-циано-5-метил-4-фенил)гексил]-4-[4-(4-фторфенил)бутан-1-он]пиперазин, являющийся предшественником требуемого соединения (56 мг). 27 мг продукта растворяют в этаноле (2 мл), добавляют хлорид гидроксиаммония (8,3 мг) и ацетат натрия (9,8 мг) и смесь перемешивают, нагревая с обратным холодильником. Через 2 часа раствор охлаждают до комнатной температуры и отделяют органический слой, добавляя воду и этилацетат. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и фильтрат упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (система метанол/этилацетат), получая при этом указанное в заголовке соединение в виде бесцветного масла (17 мг).
1H-ЯМР (400 МГц, CDCl3) δ 0,76 (д, J=6,8 Гц, 3Н), 1,06-1,20 (м, 1Н), 1,18 (д, J=6,8 Гц, 3Н), 1,50-1,62 (м, 1Н), 1,75-1,82 (м, 2Н), 1,82-1,92 (м, 1Н), 2,05-2,20 (м, 2Н), 2,22-2,55 (м, 12Н), 2,72-2,78 (м, 2Н), 6,99-7,05 (м, 2Н), 7,25-7,30 (м, 1Н), 7,31-7,36 (м, 4Н), 7,58-7,62 (м, 2Н).
17 мг полученного выше указанного в заголовке свободного соединения обрабатывают обычным способом и получают 14 мг гидрохлорида.
Гидрохлорид:
ESI-MC: 465 (МН+).
Пример 52
1-[(4-Циано-5-метил-4-фенил)гексил]-4-(4-метил-3-фенилпентан)пиперазин
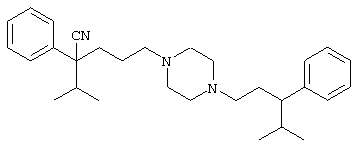
Указанное в заголовке соединение получают в виде бледно-желтого масла способом по примеру 49 (85 мг, 60%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,71 (д, J=6,6 Гц, 3Н), 0,76 (д, J=6,8 Гц, 3Н), 0,92 (д, J=6,8 Гц, 3Н), 1,03-1,16 (м, 2Н), 1,18 (д, J=6,8 Гц, 3Н), 1,46-1,60 (м, 3Н), 1,70-2,16 (м, 6Н), 2,18-2,42 (м, 10Н), 7,07-7,13 (м, 2Н), 7,14-7,18 (м, 1Н), 7,20-7,32 (м, 4Н), 7,33-7,36 (м, 4Н).
Гидрохлорид (80 мг) указанного в заголовке соединения получают, обрабатывая свободное соединение способом по примеру 1.
Гидрохлорид:
ESI-MC: 446 (МН+).
Пример 53
1-[(4-Циано-5-метил-4-фенил)гексил]-4-(4-метил-3-фенилгексан)пиперазин
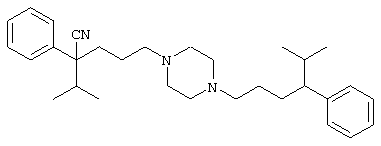
Указанное в заголовке соединение получают способом по примеру 1, описанному в JP-A 11-206862 (150 мг, выход 94%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,69 (д, J=6,86 Гц, 3Н), 0,76 (д, J=6,8 Гц, 3Н), 0,92 (д, J=6,6 Гц, 3Н), 1,03-1,16 (м, 2Н), 1,19 (д, J=6,6 Гц, 3Н), 1,18-1,28 (м, 2Н), 1,65-1,90 (м, 4Н), 2,05-2,14 (м, 3Н), 2,14-2,44 (м, 10Н), 7,07-7,13 (м, 2Н), 7,14-7,18 (м, 1Н), 7,20-7,32 (м, 3Н), 7,33-7,36 (м, 4Н).
Гидрохлорид получают, обрабатывая указанное в заголовке свободное соединение способом по примеру 1.
Гидрохлорид:
ESI-MC: 460 (МН+).
Пример 54
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[2-(4-фторфенокси)бутен-3-ил]пиперазин
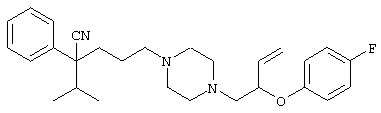
Указанное в заголовке соединение получают в виде бледно-желтого масла (183 мг, 38%) способом по примеру 104, описанному в JP-A 11-206862.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,04-1,19 (м, 1Н), 1,19 (д, J=6,6 Гц, 3Н), 1,50-1,64 (м, 1Н), 1,82-1,92 (м, 1Н), 2,06-2,18 (м, 2Н), 2,22-2,28 (м, 2Н), 2,28-2,40 (м, 4Н), 2,48-2,64 (м, 5Н), 2,75 (дд, J=7,7 Гц, 13,4 Гц, 1Н), 4,65-4,73 (м, 1Н), 5,20 (д, J=10,6 Гц, 1Н), 5,25 (д, J=17,4 Гц, 1Н), 5,85 (ддд, J=5,8 Гц, 10,6 Гц, 17,4 Гц, 1Н), 6,81-6,88 (м, 2Н), 6,88-6,97 (м, 2Н), 7,25-7,31 (м, 1Н), 7,32-7,40 (м, 4Н).
Гидрохлорид получают, обрабатывая указанное в заголовке свободное соединение способом по примеру 1.
Гидрохлорид:
ESI-MC: 450 (МН+).
Пример 55
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[3-аллилокси-2-(4-фторфенокси)пропил]пиперазин
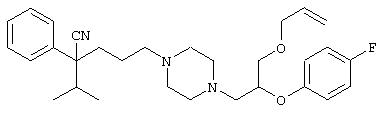
Указанное в заголовке соединение получают в виде бесцветного масла (67 мг, 62%) способом по примеру 104, описанным в JP-A 11-206862.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,05-1,18 (м, 1Н), 1,19 (д, J=6,4 Гц, 3Н), 1,48-1,66 (м, 1Н), 1,48 (дт, J=4,4 Гц, 12,4 Гц, 1Н), 2,06-2,18 (м, 2Н), 2,22-2,40 (м, 6Н), 2,44-2,54 (м, 1H), 2,68-2,74 (м, 2Н), 2,93-3,00 (м, 1Н), 3,95-3,98 (м, 2Н), 4,06 (д, J=5,2 Гц, 2Н), 5,16 (шир.д, J=10,4 Гц, 1Н), 5,24 (дд, J=1,6 Гц, 17,2 Гц, 1Н), 5,81-5,92 (м, 1H), 6,80-6,97 (м, 4Н), 7,24-7,33 (м, 1Н), 7,34-7,39 (м, 4Н).
Гидрохлорид получают, обрабатывая указанное в заголовке свободное соединение способом по примеру 1.
Гидрохлорид:
ESI-MC: 494 (МН+).
Пример 56
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[3-(н-пропанокси)-2-(4-фторфенокси)пропил]пиперазин
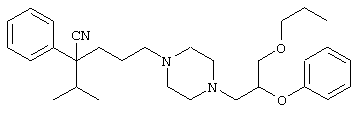
В атмосфере водорода 1-[(4-циано-5-метил-4-фенил)гексил]-4-[3-аллилокси-2-(4-фторфенокси)пропил]пиперазин (85 мг) растворяют в этаноле (3,5 мл) при комнатной температуре. К смеси добавляют 10% палладий на угле (10 мг) и перемешивают. Через 3 часа 20 минут палладий на угле отделяют фильтрованием и фильтрат упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем NH (система: гексан/этилацетат), получая при этом указанное в заголовке соединение (34 мг, 40%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,6 Гц, 3Н), 0,88 (дт, J=2,7 Гц, 7,2 Гц, 3Н), 1,05-1,20 (м, 1Н), 1,19 (д, J=6,6 Гц, 3Н), 1,50-1,60 (м, 4Н), 1,82-1,92 (м, 1Н), 2,05-2,20 (м, 3Н), 2,20-2,60 (м, 9Н), 2,66-2,78 (м, 2Н), 3,31-3,41 (м, 2Н), 3,61 (д, J=5,5 Гц, 1Н), 4,06 (д, J=5,1 Гц, 1Н), 6,81-6,98 (м, 4Н), 7,25-7,32 (м, 1Н), 7,32-7,40 (м, 4Н).
Гидрохлорид получают, обрабатывая указанное в заголовке свободное соединение способом по примеру 1.
Гидрохлорид:
ESI-MC: 496 (МН+).
Пример 57
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[3-гидрокси-2-(4-фторфенокси)пропил]пиперазин
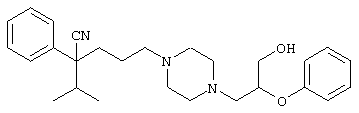
В тетрагидрофуране (5 мл) растворяют 1-[(4-циано-5-метил-4-фенил)гексил]-4-[3-аллилокси-2-(4-фторфенокси)пропил]пиперазин (125 мг) и добавляют борогидрид натрия (14,4 мг) и затем раствор иода (64 мг) в тетрагидрофуране (2 мл). Смесь перемешивают в течение одного часа и отделяют органический слой, добавляя этилацетат и воду. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и фильтрат упаривают. Остаток очищают хроматографией на колонке с силикагелем NH (система: гексан/этилацетат), получая при этом указанное в заголовке соединение в виде бледно-желтого масла (70 мг, 61%). Гидрохлорид получают, обрабатывая указанное в заголовке свободное соединение способом по примеру 1.
Гидрохлорид:
ESI-MC: 436 (MH+).
Пример 58
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[2-(1,2,3,4-тетрагидрохинолил)этил]пиперазин
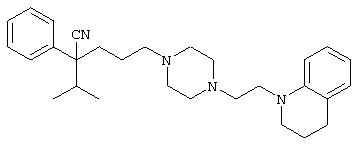
Указанное в заголовке соединение получают из 1,2,3,4-тетрагидрохинолина способом по примеру 89, описанным в JP-A 11-206862 (34%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,05-1,20 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,50-1,66 (м, 1Н), 1,85-1,98 (м, 2Н), 2,05-2,20 (м, 2Н), 2,24-2,56 (м, 1Н), 2,73 (шир.т, J=6,4 Гц, 2Н), 3,29 (шир.т, J=5,6 Гц, 3Н), 3,36-3,41 (м, 2Н), 3,39 (шир.т, J=7,8 Гц, 2Н), 3,45-3,52 (м, 2Н), 6,52-6,59 (м, 2Н), 6,90-6,94 (м, 1Н), 7,00-7,15 (м, 1Н), 7,26-7,32 (м, 1Н), 7,34-7,38 (м, 4Н).
Гидрохлорид получают, обрабатывая указанное в заголовке свободное соединение способом по примеру 1.
Гидрохлорид:
ESI-MC: 445 (MH+).
Пример 59
4-[(4-Циано-5-метил-4-фенил)гексил]-N-(4-фторфенил)-N’-(2-метилпропил)-1(2Н)-пиразинкарбоксиимидамид
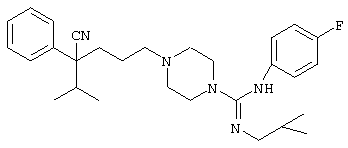
В атмосфере азота к раствору 1-(фторфенил)-3-изобутилмочевины (300 мг), трифенилфосфина (561 мг) и триэтиламина (0,3 мл) в дихлорметане (10 мл) добавляют раствор четырехбромистого углерода (948 мг) в дихлорметане (4 мл). Через 45 минут реакционный раствор охлаждают до комнатной температуры и отделяют органический слой, добавляя воду и дихлорметан. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и фильтрат упаривают. Образовавшийся остаток сразу же очищают хроматографией на колонке с силикагелем NH (система: гексан/этилацетат), получая при этом карбодиимид в виде бесцветного маслянистого промежуточного соединения. Карбодиимид и 1-[(4-циано-5-метил-4-фенил)гексил]пиперазин (100 мг) растворяют в 2-пропаноле (10 мл) и перемешивают, нагревая с обратным холодильником. Через 2 часа растворитель выпаривают и образовавшийся остаток очищают хроматографией на колонке с силикагелем NH (система: гексан/этилацетат), получая при этом указанное в заголовке соединение в виде бесцветного твердого вещества (174 мг, 25%, 2 стадии).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 0,88-0,91 (м, 6Н), 1,05-1,18 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,50-1,65 (м, 2Н), 1,67-1,80 (м, 2Н), 1,88-1,98 (м, 1Н), 2,06-2,20 (м, 2Н), 2,22-2,36 (м, 4Н), 2,79 (шир.д, J=6,8 Гц, 1Н), 3,05 (дд, J=6,0 Гц, 6,8 Гц, 1Н), 3,14-3,20 (м, 1Н), 4,82-4,91 (м, 1Н), 6,52-6,58 (м, 1H), 6,72-6,78 (м, 1Н), 6,91-7,04 (м, 3Н), 7,22-7,31 (м, 4Н), 7,35-7,38 (м, 3Н).
Гидрохлорид получают, обрабатывая указанное в заголовке свободное соединение способом по примеру 1.
Гидрохлорид:
ESI-MC: 478 (МН+).
Пример 60
4-[(4-Циано-5-метил-4-фенил)гексил]-N-(4-фторбензил)-N’-(2-метилпропил)-1(2Н)-пиразинкарбоксиимидамид
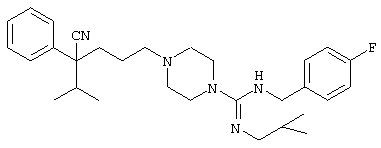
Указанное в заголовке соединение получают в виде бесцветного масла способом по примеру 59 (62%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 0,80-0,88 (м, 6Н), 1,05-1,18 (м, 1Н), 1,20 (д, J=6,4 Гц, 3Н), 1,43-1,60 (м, 1Н), 1,84-1,95 (м, 1Н), 2,05-2,20 (м, 2Н), 2,25-2,40 (м, 6Н), 2,87-2,95 (м, 2Н), 3,22-3,38 (м, 4Н), 3,49 (с, 2Н), 4,35-4,45 (м, 2Н), 7,02-7,09 (м, 2Н), 7,27-7,34 (м, 3Н), 7,34-7,41 (м, 4Н).
Гидрохлорид получают, обрабатывая указанное в заголовке свободное соединение способом по примеру 1.
Гидрохлорид:
ESI-MC: 492 (МН+).
Пример 61
4-[(4-Циано-5-метил-4-фенил)гексил]-N,N’-дициклогексилпиразинкарбоксиимидамид
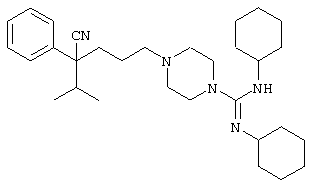
Указанное в заголовке соединение получают в виде бесцветного масла способом по примеру 59 (62%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,04-1,46 (м, 9Н), 1,21 (д, J=6,8 Гц, 3Н), 1,46-1,74 (м, 6Н), 1,74-1,86 (м, 6Н), 1,86-1,98 (м, 2Н), 2,07-2,22 (м, 2Н), 2,24-2,40 (м, 6Н), 3,05-3,16 (м, 2Н), 3,23-3,32 (м, 4Н), 3,41-3,52 (м, 1Н), 7,28-7,34 (м, 1Н), 7,35-7,42 (м, 4Н).
Гидрохлорид получают, обрабатывая указанное в заголовке свободное соединение способом по примеру 1.
Гидрохлорид:
ESI-MC: 492 (МН+).
Пример 62
N-Циано-4-[(4-циано-5-метил-4-фенил)гексил]-N’-[(4-фторфенокси)этил]пиразинкарбоксиимидамид
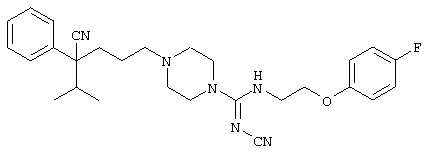
В атмосфере азота N-циано-N’-этил-(4-фторфенокси)-O-фенилизомочевину (168 мг) и 1-[(4-циано-5-метил-4-фенил)гексил]пиперазин (100 мг) растворяют в 2-пропаноле (5 мл) и смесь перемешивают, нагревая с обратным холодильником. Через 24 часа растворитель выпаривают и образовавшийся остаток очищают хроматографией на колонке с силикагелем (система: гексан/этилацетат), получая при этом указанное в заголовке соединение в виде бесцветного твердого вещества (98 мг, 71%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,6 Гц, 3Н), 1,08 (д, J=6,6 Гц, 3Н), 1,20-1,34 (м, 1Н), 1,50-1,70 (м, 1Н), 1,92 (ддд, J=4,9 Гц, 11,6 Гц, 13,6 Гц, 1Н), 2,05-2,23 (м, 2Н), 2,24-2,38 (м, 6Н), 3,43-3,50 (м, 2Н), 3,78-3,82 (м, 2Н), 4,04-4,09 (м, 2Н), 5,00-5,05 (м, 1Н), 6,80-6,85 (м, 2Н), 6,92-7,01 (м, 2Н), 7,27-7,32 (м, 1Н), 7,34-7,39 (м, 4Н).
Гидрохлорид получают, обрабатывая указанное в заголовке свободное соединение способом по примеру 1.
Гидрохлорид:
ESI-MC: 491 (МН+).
Пример 63
(2-Тиенил)-[(4-циано-5-метил-4-фенил)гексилпиперазино]метанимин
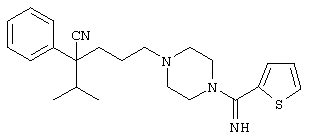
Указанное в заголовке соединение получают в виде бесцветного масла способом по примеру 62 (62%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,05-1,20 (м, 1Н), 1,20 (д, J=6,6 Гц, 3Н), 1,50-1,64 (м, 1Н), 1,88-2,08 (м, 1Н), 2,08-2,22 (м, 2Н), 2,28-2,38 (м, 6Н), 3,32-3,44 (м, 4Н), 7,00 (дд, J=3,6 Гц, 5,2 Гц, 1Н), 7,14 (дд, J=1,2 Гц, 3,6 Гц, 1Н), 7,26-7,32 (м, 1Н), 7,34 (дд, J=1,2 Гц, 5,2 Гц, 1Н), 7,35-7,39 (м, 4Н).
Гидрохлорид указанного в заголовке соединения получают, обрабатывая свободное соединение способом по примеру 1.
Гидрохлорид:
ESI-MC: 345 (МН+).
Пример 64
1-Изопропил-4-[4-изобутил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-фенилбутилцианид
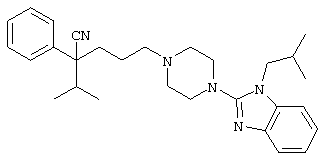
2-Хлор-1-изобутил-1Н-бензо[d]имидазол (4 г) и 1-[(4-циано-5-метил-4-гексил]пиперазин (5 г) растворяют в тетрагидрофуране (10 мл) и перемешивают на масляной бане при 150°С в течение 6 часов в открытой системе. Продукт реакции очищают силикагелем NH (система этилацетат/гексан), получая при этом указанное в заголовке соединение в виде коричневого масла (6,8 г, 85%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 0,83 (д, J=6,8 Гц, 3Н), 0,84 (д, J=6,4 Гц, 3Н), 1,20-1,35 (м, 1Н), 1,21 (д, J=6,8 Гц, 3Н), 1,52-1,67 (м, 1Н), 1,95-2,07 (м, 1Н), 2,08-2,23 (м, 1Н), 2,23-2,43 (м, 4Н), 2,43-2,50 (м, 4Н), 3,21-3,25 (м, 4Н), 3,80 (д, J=7,6 Гц, 2Н), 7,08-7,64 (м, 9Н).
Гидрохлорид получают, обрабатывая указанное в заголовке свободное соединение способом по примеру 1.
Гидрохлорид:
ESI-MC: 458 (МН+).
Пример 65
Бис-1,4-[(4-циано-5-метил-4-фенил)гексил]пиперазин
В атмосфере азота тионилхлорид (4 мл) добавляют к (4-циано-5-метил-4-фенил)гексанолу (2,33 г) при охлаждении льдом и, перемешивая, нагревают с обратным холодильником. Через 2 часа смесь упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем (система: гексан/этилацетат), получая (4-циано-5-метил-4-фенил)гексилхлорид (2,35 г, 93%) в виде желтого масла. Полученный хлорид (454 мг), [(4-циано-5-метил-4-фенил)гексил]пиперазин (166 мг) и иодид натрия (289 мг) растворяют в ацетонитриле (5 мл) и, перемешивая, нагревают раствор с обратным холодильником. Через 2 часа смесь охлаждают до комнатной температуры и отделяют органический слой, добавляя этилацетат и воду. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают и смесь упаривают. Остаток очищают хроматографией на колонке с силикагелем NH (гексан/этилацетат), получая при этом указанное в заголовке соединение в виде бледно-желтого масла (213 мг, 23%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,02-1,16 (м, 2Н), 1,19 (д, J=6,8 Гц, 6Н), 1,46-1,60 (м, 2Н), 1,80-1,92 (м, 2Н), 2,40-2,17 (м, 4Н), 2,17-2,36 (м, 12Н), 7,23-7,31 (м, 2Н), 7,33-7,37 (м, 8Н).
Гидрохлорид получают, обрабатывая указанное в заголовке свободное соединение способом по примеру 1.
Гидрохлорид:
ESI-MC: 485 (MH+).
Пример 66
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[(3-циано-4-метил-3-фенил)пентил]пиперазин
Указанное в заголовке соединение получают в виде бледно-желтого масла способом по примеру 65 (выход 52%).
1H-ЯМР (400 МГц, CDCl3) δ 0,76 (д, J=6,8 Гц, 3Н), 0,765 (д, J=6,4 Гц, 3Н), 1,00-1,18 (м, 1Н), 1,18 (д, J=6,4 Гц, 3Н), 1,19 (д, J=6,8 Гц, 3Н), 1,44-1,60 (м, 1Н), 1,80-2,00 (м, 4Н), 2,00-2,18 (м, 4Н), 2,18-2,44 (м, 10Н), 7,26-7,32 (м, 2Н), 7,33-7,40 (м, 8Н).
Гидрохлорид указанного в заголовке соединения получают, обрабатывая свободное соединение способом по примеру 1.
Гидрохлорид:
ESI-MC: 471 (МН+).
Пример 67
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[2-(1’,2’-метилендиоксифенил)этил]пиперидин
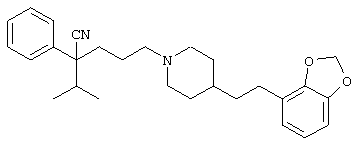
Указанное в заголовке соединение получают способом по примеру 49 (выход 51%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,10-1,30 (м, 3Н), 1,20 (д, J=6,4 Гц, 3Н), 1,48-1,76 (м, 7Н), 1,80-1,94 (м, 2Н), 2,06-2,18 (м, 2Н), 2,18-2,28 (м, 2Н), 2,53-2,60 (м, 2Н), 2,70-2,80 (м, 2Н), 5,92 (с, 2Н), 6,82-6,70 (м, 2Н), 6,70-6,78 (м, 1Н), 7,26-7,40 (м, 5Н).
Гидрохлорид получают, обрабатывая указанное в заголовке свободное соединение способом по примеру 1.
Гидрохлорид:
ESI-MC: 433 (МН+).
Пример 68
1-[(4-Циано-4-(3-циано-5-тиенил)-5-метилгексил]-4-[2-(4-цианофенокси)этил]пиперазин
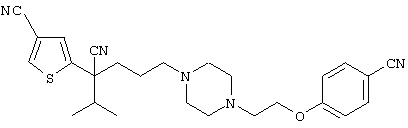
В ацетонитриле (5 мл) растворяют 4-циано-4-(3-циано-5-тиенил)-5-метилгексанол (0,13 г). К смеси добавляют триэтиламин (0,21 мл) и мезилхлорид (0,048 мл) и перемешивают при комнатной температуре в течение одного часа. К реакционной смеси добавляют воду, экстрагируют этилацетатом и промывают насыщенным раствором соли. Смесь сушат над безводным сульфатом магния и упаривают, получая бледно-желтое масло. Полученное масло растворяют в ДМФА (2 мл) и добавляют раствор (4 мл) 1-[2-(4-цианофенокси)этил]пиперазина (0,14 г), триэтиламина (0,21 мл) и иодида натрия (0,15 г) в ДМФА. Смесь перемешивают при 60°С в течение ночи, добавляют этилацетат и промывают водой и насыщенным раствором соли. Затем смесь сушат над безводным сульфатом магния, растворитель выпаривают и образовавшийся остаток очищают хроматографией на колонке с силикагелем NH (система: гексан/этилацетат), получая при этом указанное в заголовке соединение в виде бледно-желтого масла (0,09 г, 33%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,92 (д, J=6,8 Гц, 3Н), 1,20 (д, J=6,8 Гц, 3Н), 1,21-1,31 (м, 1Н), 1,60-1,73 (м, 1Н), 1,77 (дт, J=4 Гц, 13,2 Гц, 1Н), 2,06 (квин, J=6,8 Гц, 1Н), 2,20 (дт, J=4 Гц, 13,2 Гц, 1H), 2,33 (т, J=7,6 Гц, 2Н), 2,42 (шир.с, 4Н), 2,58 (шир.с, 4Н), 2,82 (т, J=5,6 Гц, 2Н), 4,13 (т, J=5,6 Гц, 2Н), 6,95 (д, J=8,8 Гц, 2Н), 7,28 (д, J=1,2 Гц, 1Н), 7,58 (д, J=8,8 Гц, 2Н), 7,90 (д, J=1,2 Гц, 1Н).
Гидрохлорид получают, обрабатывая указанное в заголовке свободное соединение обычным способом.
Гидрохлорид:
ESI-MC: 462 (МН+).
Пример 69
1-[(4-Циано-4-(3-циано-5-тиенил)-5-метилгексил]-4-[2-(3-цианофенокси)этил]пиперазин
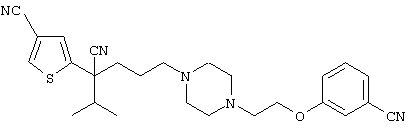
Указанное в заголовке соединение получают в виде бледно-желтого масла (0,15 г, 58%) из 4-циано-4-(З-циано-5-тиенил)-5-метилгексанола и 1-[2-(3-цианофенокси)этил]пиперазина способом по примеру 68.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,93 (д, J=6,8 Гц, 3Н), 1,21 (д, J=6,8 Гц, 3Н), 1,22-1,32 (м, 1Н), 1,60-1,73 (м, 1Н), 1,79 (дт, J=4 Гц, 12,4 Гц, 1Н), 2,07 (квин, J=6,8 Гц, 1Н), 2,21 (дт, J=4 Гц, 12,4 Гц, 1Н), 2,34 (т, J=7,2 Гц, 2Н), 2,43 (шир.с, 4Н), 2,59 (шир.с, 4Н), 2,82 (т, J=5,6 Гц, 2Н), 4,11 (т, J=5,6 Гц, 2Н), 7,12-7,40 (м, 5Н), 7,91 (с, 1Н).
Гидрохлорид получают, обрабатывая указанное в заголовке свободное соединение обычным способом.
ESI-MC: 462 (MH+).
Пример 70
1-[(4-Циано-5-метил-4-(5-циано-2-тиенил)гексил]-4-[2-(3-цианофенокси)этил]пиперазин
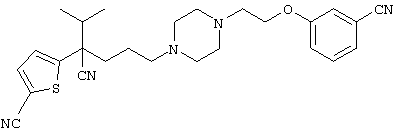
В ацетонитриле (10,0 мл) растворяют 400 мг (1,61 ммоль) 4-циано-5-метил-4-(5-циано-2-тиенил)гексанола и охлаждают смесь до 0°С. К смеси добавляют 0,26 мл (1,85 ммоль) триэтиламина и 0,14 мл (1,77 ммоль) мезилхлорида и нагревают до комнатной температуры. Через 20 минут добавляют простой эфир и насыщенный раствор соли. Эфирный слой промывают насыщенным водным раствором бикарбоната натрия и сушат над безводным сульфатом магния. Растворитель выпаривают и получают сырой продукт. Половину количества (примерно 0,1 ммоль) сырого мезильного соединения растворяют в 8,00 мл диметилформамида. К смеси добавляют 724 мг (4,83 ммоль) иодида натрия, 111 мг (0,81 ммоль) карбоната калия и 243 мг (1,05 ммоль) 1-[2-(3-цианофенокси)этил]пиперазина и нагревают до 60°С. После окончания реакции к смеси добавляют насыщенный раствор соли и целевой продукт экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают и получают сырой продукт. Сырой продукт обрабатывают силикагелем Cromatorex NH (элюирование этилацетатом/гексаном, 1/1), получая при этом 289 мг (0,63 ммоль, 77,3%) указанного в заголовке соединения в виде желтого сиропа.
1H-ЯМР (400 МГц, CDCl3) δ 0,92 (д, J=6,8 Гц, 3Н), 1,21 (д, J=6,4 Гц, 3Н), 1,20-1,38 (м, 1Н), 1,60-1,86 (м, 2Н), 2,01-2,12 (м, 1Н), 2,18-2,30 (м, 1Н), 2,30-2,75 (м, OН), 2,80-2,90 (м, 2Н), 4,08-4,18 (м, 2Н), 7,11-7,18 (м, 3Н), 7,23-7,28 (м, 1Н), 7,34-7,40 (м, 1Н), 7,52 (д, J=3,60 Гц, 1H).
ESI-MC: 462 (МН+).
Пример 71
1-[(4-Циано-5-метил-4-(5-циано-2-тиенил)гексил]-4-[2-{N-(2-цианоэтил)аналино}этил]пиперазин
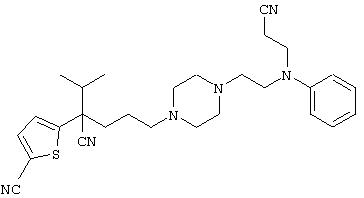
Указанное в заголовке соединение синтезируют, используя [2-{N-(2-цианоэтил)анилино}этил]пиперазин, аналогично способу получения 1-[(4-циано-5-метил-4-(5-циано-2-тиенил)гексил]-4-[2-(3-цианофенокси)этил]пиперазина по примеру 70 (выход 90,1%, бледно-желтое масло).
1H-ЯМР (400 МГц, CDCl3) δ 0,92 (д, J=6,4 Гц, 3Н), 1,20-1,33 (м, 1H), 1,21 (д, J=6,4 Гц, 3Н), 1,58-1,73 (м, 1H), 1,73-1,84 (м, 1H), 2,02-2,11 (м, 1H), 2,23 (дт, J=4,0 Гц, 12,8 Гц, 1H), 2,31-2,64 (м, 12Н), 2,68 (т, J=7,2 Гц, 2Н), 3,51 (т, J=6,8 Гц, 2Н), 3,69 (т, J=7,2 Гц, 2Н), 6,67 (д, J=8,0 Гц, 3Н), 6,76 (т, J=7,4 Гц, 1H), 7,15 (д, J=4,00 Гц, 1H), 7,23-7,30 (м, 2Н), 7,52 (д, J=4,0 Гц, 1Н).
ESI-MC: 489 (М+Н+).
Пример 72
1-[4-Циано-5-метил-4-(3-циано-2-тиенил)гексил]-4-[2-(3-цианофенокси)этил]пиперазин
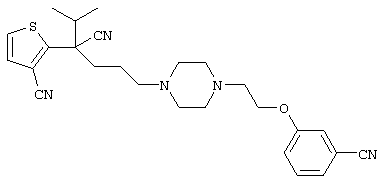
В 1,5 мл ацетонитрила растворяют 111 мг (0,31 ммоль) 4-циано-5-метил-4-(3-циано-2-тиенил)гексилиодида. К смеси добавляют 56,2 мкл (0,40 ммоль) триэтиламина и 109 мг (0,47 ммоль) 1-(3-цианофеноксиэтил)пиперазина и перемешивают в течение 3 дней. Органический слой отделяют, добавляя этилацетат и насыщенный раствор соли, реакционный раствор сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 12,5 г силикагеля Cromatorex NH (этилацетат/гексан, 1/2), получая при этом 144 мг (количественный выход) указанного в заголовке соединения в виде желтого сиропа.
1H-ЯМР (400 МГц, CDCl3) δ 0,92 (д, J=6,4 Гц, 3Н), 1,15-1,28 (м, 1Н), 1,26 (д, J=6,4 Гц, 3H), 1,60-1,75 (м, 1Н), 2,17-2,27 (м, 1Н), 2,27-2,70 (м, 12Н), 2,81 (т, J=6,0 Гц, 2Н), 4,10 (т, J=6 Гц, 2Н), 7,11-7,16 (м, 2Н), 7,22-7,26 (м, 1Н), 7,26-7,28 (м, 2Н), 7,33-7,39 (м, 1Н).
ESI-MC: 462 (МН+).
Пример 73
1-[4-Циано-5-метил-4-(3-циано-2-тиенил)гексил]-4-[2-(3-фторфенокси)этил]пиперазин
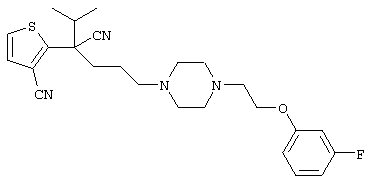
Указанное в заголовке соединение синтезируют способом по примеру 72 (выход 82,3%).
1H-ЯМР (400 МГц, CDCl3) δ 0,92 (д, J=6,4 Гц, 3Н), 1,15-1,29 (м, 1Н), 1,26 (д, J=6,8 Гц, 3Н), 1,60-1,74 (м, 1Н), 2,17-2,27 (м, 1Н), 2,27-2,70 (м, 12Н), 2,80 (т, J=6,0 Гц, 2Н), 4,08 (т, J=6,0 Гц, 2Н), 6,59-6,70 (м, 3Н), 7,16-7,24 (м, 1Н), 7,26-7,28 (м, 2Н).
ESI-MC: 455 (М+Н+).
Пример 74
1-[4-Циано-5-метил-4-(3-циано-2-тиенил)гексил]-4-[2-(4-фторфенокси)этил]пиперазин
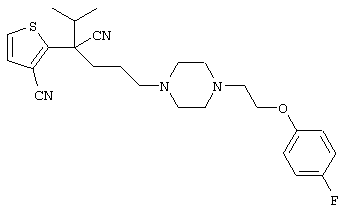
Указанное в заголовке соединение синтезируют способом по примеру 72 (выход 70,2%).
1H-ЯМР (400 МГц, CDCl3) δ 0,92 (д, J=6,8 Гц, 3Н), 1,14-1,29 (м, 1H), 1,26 (д, J=6,8 Гц, 3Н), 1,60-1,74 (м, 1Н), 2,17-2,27 (м, 1H), 2,27-2,70 (м, 12Н), 2,78 (т, J=6,0 Гц, 2Н), 4,05 (т, J=6,0 Гц, 2Н), 6,81-6,85 (м, 2Н), 6,93-6,98 (м, 1H), 7,26-7,28 (м, 2Н).
ESI-MC: 455 (М+Н+).
Пример 75
1-[4-Циано-5-метил-4-(2-тиенил)гексил]-4-[2-(3-цианофенокси)этил]пиперазин
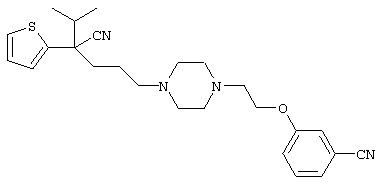
Указанное в заголовке соединение синтезируют способом по примеру 72, используя 4-циано-5-метил-4-(2-тиенил)гексилиодид (выход 94,7%).
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,6 Гц, 3Н), 1,18 (д, J=6,8 Гц, 3Н), 1,20-1,38 (м, 1H), 1,55-1,72 (м, 1H), 1,73-1,83 (м, 1H), 2,02-2,12 (м, 1H), 2,12-2,22 (м, 1H), 2,28-2,35 (м, 2Н), 2,35-2,65 (м, 8Н), 2,81 (т, J=5,9 Гц, 2Н), 4,10 (т, J=5,9 Гц, 2Н), 6,93-6,97 (м, 1H), 7,10-7,17 (м, 3Н), 7,22-7,30 (м, 2Н), 7,33-7,39 (м, 1H).
ESI-MC: 437 (М+Н+).
Пример 76
1-[4-Циано-5-метил-4-(2-тиенил)гексил]-4-[2-(4-цианофенокси)этил]пиперазин
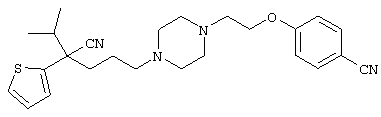
Указанное в заголовке соединение синтезируют способом по примеру 72, используя 4-циано-5-метил-4-(2-тиенил)гексилиодид (выход 40,9%).
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,8 Гц, 3Н), 1,18 (д, J=6,8 Гц, 3Н), 1,22-1,38 (м, 1Н), 1,56-1,70 (м, 1Н), 1,72-1,81 (м, 1Н), 2,01-2,10 (м, 1Н), 2,10-2,21 (м, 1Н), 2,27-2,34 (м, 2Н), 2,34-2,62 (м, 8Н), 2,81 (т, J=6,0 Гц, 2Н), 4,12 (т, J=6,0 Гц, 2Н), 6,92-6,96 (м, 3Н), 7,11 (дд, J=1,2 Гц, 3,6 Гц, 1Н), 7,24-7,27 (м, 2Н), 7,57 (д, J=8,8 Гц, 2Н).
ESI-MC: 437 (М+Н+).
Пример 77
1-[4-Циано-5-метил-4-(5-циано-2-тиенил)гексил]-4-[3-(5-циано-2-тиенил)пропил]пиперазин
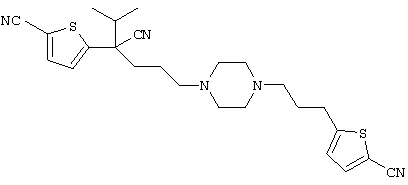
В ацетонитриле (3 мл) растворяют 200 мг (0,56 ммоль) 4-циано-5-метил-4-(5-циано-2-тиенил)гексилиодида. К смеси добавляют 78,0 мкл (0,56 ммоль) триэтиламина и 178 мг (0,76 ммоль) 1-[3-(5-циано-2-тиенил)пропил]пиперазина и перемешивают при 55°С. Через 5 часов реакционный раствор концентрируют и остаток обрабатывают силикагелем Cromatorex NH (этилацетат/гексан, 1/2), получая при этом 243 мг (0,52 ммоль, 92,8%) указанного в заголовке соединения в виде желтого сиропа.
1H-ЯМР (400 МГц, CDCl3) δ 0,92 (д, J=6,8 Гц, 3Н), 1,18-1,31 (м, 1Н), 1,21 (д, J=6,8 Гц, 3Н), 1,60-1,72 (м, 1Н), 1,73-1,91 (м, 3Н), 2,00-2,10 (м, 1Н), 2,17-2,27 (м, 1Н), 2,28-2,50 (м, 12Н), 2,88 (т, J=7,6 Гц, 2Н), 6,80 (д, J=4,0 Гц, 1Н), 7,15 (д, J=4,0 Гц, 1Н), 7,45 (д, J=4,0 Гц, 1Н), 7,51 (д, J=4,0 Гц, 1Н).
ESI-MC: 466 (М+Н+).
Пример 78
1-[4-Циано-5-метил-4-(5-циано-2-тиенил)гексил]-4-[3-(2-тиенил)пропил]пиперазин
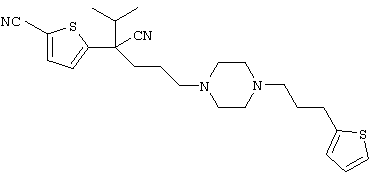
Указанное в заголовке соединение синтезируют способом, описанным в примере 77 (выход 96,4%).
1H-ЯМР (400 МГц, CDCl3) δ 0,92 (д, J=6,8 Гц, 3Н), 1,19-1,31 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,60-1,72 (м, 1Н), 1,72-1,81 (м, 1Н), 1,82-1,91 (м, 2Н), 2,00-2,10 (м, 1Н), 2,17-2,24 (м, 1Н), 2,27-2,54 (м, 12Н), 2,85 (т, J=7,6 Гц, 2Н), 6,78 (дд, J=0,8 Гц, 3,6 Гц, 1Н), 6,91 (дд, J=3,6 Гц, 5,2 Гц, 1Н), 7,10 (дд, J=0,8 Гц, 5,2 Гц, 1Н), 7,14 (д, J=4,0 Гц, 1Н), 7,51 (д, J=4,0 Гц, 1Н).
ESI-MC: 441 (М+Н+).
Пример 79
1-[4-Циано-5-метил-4-(2-тиенил)гексил]-4-[3-(5-циано-2-тиенил)пропил]пиперазин
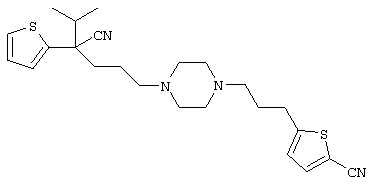
Указанное в заголовке соединение синтезируют способом по примеру 77, используя 4-циано-5-метил-4-(2-тиенил)гексилиодид (выход 96,4%).
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,8 Гц, 3Н), 1,18 (д, J=6,4 Гц, 3Н), 1,23-1,37 (м, 1Н), 1,60-1,70 (м, 1Н), 1,72-1,90 (м, 3Н), 2,02-2,09 (м, 1Н), 2,11-2,20 (м, 1Н), 2,26-2,52 (м, 12Н), 2,88 (т, J=7,6 Гц, 2Н), 6,80 (д, J=3,6 Гц, 1Н), 6,94 (дд, J=3,6 Гц, 5,2 Гц, 1Н), 7,11 (дд, J=1,2 Гц, 3,6 Гц, 1Н), 7,26 (дд, J=1,2 Гц, 5,2 Гц, 1Н), 7,45 (д, J=3,6 Гц, 1Н).
ESI-MC: 441 (М+Н+).
Пример 80
1-[4-Циано-5-метил-4-(4-циано-2-тиенил)гексил]-4-[3-(2-тиенил)пропил]пиперазин
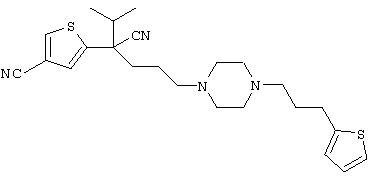
Указанное в заголовке соединение получают в описанных ниже условиях синтеза трет-бутил-4-[3-(2-тиенил)пропил]-1-пиперазинкарбоксилата, используя 4-циано-5-метил-4-(4-циано-2-тиенил)гексанол и 1-[3-(2-тиенил)пропил]пиперазин, синтезированный способом по примеру 69 (выход 23,6%).
1H-ЯМР (400 МГц, CDCl3) δ 0,92 (д, J=6,8 Гц, 3Н), 1,20 (д, J=6,8 Гц, 3Н), 1,22-1,32 (м, 1Н), 1,59-1,72 (м, 1Н), 1,72-1,91 (м, 3Н), 2,02-2,12 (м, 1Н), 2,15-2,24 (м, 1Н), 2,28-2,56 (м, 12Н), 2,85 (т, J=7,6 Гц, 2Н), 6,77-6,80 (м, 1Н), 6,91 (дд, J=3,6 Гц, 5,2 Гц, 1H), 7,11 (дд, J=1,2 Гц, 5,2 Гц, 1Н), 7,28 (д, J=1,2 Гц, 1H), 7,89 (д, J=1,2 Гц, 1H).
ESI-MC: 441 (М+Н+).
Пример 81
1-[4-Циано-5-метил-4-(2-тиенил)гексил]-4-[(2-бензоксазолил)метил]пиперазин
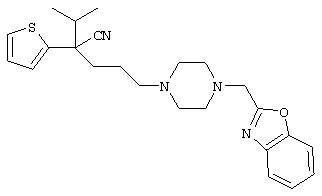
В ацетонитриле (5 мл) растворяют 230 мг (0,82 ммоль) 1-[4-циано-5-метил-4-(2-тиенил)гексил]пиперазин, синтезированный аналогично вышеуказанному 1-[3-(5-циано-2-тиенил)пропил]пиперазину. К смеси добавляют 120 мг (0,72 ммоль) 2-(хлорметил)бензоксазола и 0,10 мл (0,72 ммоль) триэтиламина и нагревают до 50°С. Через 5 часов реакционный раствор концентрируют и остаток обрабатывают силикагелем Cromatorex NH (этилацетат/гексан, 1/2), получая при этом 244 мг (0,58 ммоль, 80,5%) указанного в заголовке соединения в виде желтого сиропа.
1H-ЯМР (400 МГц, CDCl3) δ 0,89 (д, J=6,8 Гц, 3Н), 1,18 (д, J=6,4 Гц, 3Н), 1,20-1,38 (м, 1H), 1,55-1,69 (м, 1H), 1,71-1,81 (м, 1H), 2,00-2,09 (м, 1H), 2,10-2,19 (м, 1H), 2,28-2,53 (м, 6Н), 2,55-2,73 (м, 4Н), 3,86 (с, 2Н), 6,93 (дд, J=3,6 Гц, 5,2 Гц, 1H), 7,10 (дд, J=1,2 Гц, 3,6 Гц, 1H), 7,24 (дд, J=1,2 Гц, 5,2 Гц, 1H), 7,30-7,36 (м, 2Н), 7,50-7,55 (м, 1Н), 7,68-7,73 (м, 1Н).
ESI-MC: 423 (М+Н+).
Пример 82
1-[4-Циано-5-метил-4-(5-циано-2-тиенил)гексил]-4-[(2-бензоксазолил)метил]пиперазин
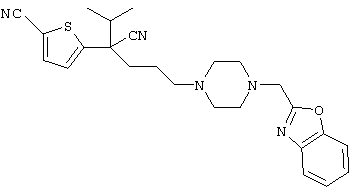
В ацетонитриле (3 мл) растворяют 200 мг (0,56 ммоль) 4-циано-5-метил-4-(5-циано-2-тиенил)гексилиодида. К смеси добавляют 78,0 мкл (0,56 ммоль) триэтиламина и 146 мг (0,67 ммоль) 1-[(2-бензоксазолил)метил]пиперазина и перемешивают при 55°С. Через 14 часов реакционный раствор концентрируют и остаток обрабатывают силикагелем Cromatorex NH (этилацетат/гексан, 1/2), получая при этом 237 мг (0,53 ммоль, 94,6%) указанного в заголовке соединения в виде желтого сиропа.
1H-ЯМР (400 МГц, CDCl3) δ 0,91 (д, J=6,8 Гц, 3Н), 1,20 (д, J=6,8 Гц, 3Н), 1,20-1,30 (м, 1Н), 1,59-1,70 (м, 1Н), 1,70-1,80 (м, 1Н), 2,00-2,09 (м, 1Н), 2,15-2,25 (м, 1Н), 2,33 (т, J=7,2 Гц, 2Н), 2,37-2,52 (м, 4Н), 2,57-2,72 (м, 4Н), 3,87 (с, 2Н), 7,14 (д, J=4,0 Гц, 1Н), 7,30-7,36 (м, 2Н), 7,50 (д, J=4,0 Гц, 1Н), 7,51-7,55 (м, 1Н), 7,68-7,73 (м, 1Н).
ESI-MC: 448 (M+H+).
Пример 83
1-[4-Циано-5-метил-4-(2-тиенил)гексил]-4-[{2-(5-цианобензоксазолил)}метил]пиперазин
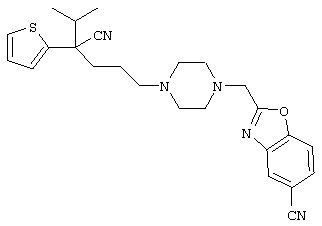
Указанное в заголовке соединение синтезируют способом, описанным в примере 82 (выход 89,3%).
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,4 Гц, 3Н), 1,18 (д, J=6,8 Гц, 3Н), 1,22-1,36 (м, 1Н), 1,56-1,70 (м, 1Н), 1,71-1,80 (м, 1Н), 2,00-2,09 (м, 1Н), 2,10-2,19 (м, 1Н), 2,29-2,36 (м, 2Н), 2,36-2,52 (м, 4Н), 2,56-2,71 (м, 4Н), 3,89 (с, 2Н), 6,93 (дд, J=3,6 Гц, 5,2 Гц, 1Н), 7,10 (дд, J=1,2 Гц, 3,6 Гц, 1Н), 7,25 (дд, J=1,2 Гц, 5,2 Гц, 1Н), 7,60-7,66 (м, 2Н), 8,02-8,04 (м, 1Н).
ESI-MC: 448 (М+Н+).
Пример 84
1-[4-Циано-5-метил-4-(3-тиенил)гексил]-4-[2-(3-фторфенокси)этил]пиперазин
1-[2-(4-Фторфенокси)этил]пиперазин (50 мг), синтезированный способом, описанным в примере 1 JP-A 11-206862, добавляют при комнатной температуре в атмосфере азота к раствору (3 мл) 1-иод-4-циано-5-метил-4-(3-тиенил)гексана (50 мг) и триэтиламина (0,06 мл) в ацетонитриле. Смесь перемешивают при 50°С в течение 4 часов, растворитель выпаривают и образовавшийся остаток очищают хроматографией на колонке с силикагелем Cromatorex NH (система: гексан/этилацетат), получая при этом указанное в заголовке соединение в виде желтого масла (62 мг, 96%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,83 (д, J=6,8 Гц, 3Н), 1,16 (д, J=6,6 Гц, 3Н), 1,55-1,65 (м, 1Н), 1,74-1,84 (м, 1Н), 2,02-2,12 (м, 2Н), 2,29 (т, J=7,2 Гц, 2Н), 2,30-2,47 (м, 4Н), 2,47-2,65 (м, 4Н), 2,79 (т, J=6,0 Гц, 2Н), 4,07 (т, J=6,0 Гц, 2Н), 6,58-6,70 (м, 3Н), 6,92 (дд, J=1,5 Гц, 5,0 Гц, 1Н), 7,17-7,24 (м, 1Н), 7,26-7,28 (м, 1Н), 7,33 (дд, J=3,0 Гц, 5,0 Гц, 1Н).
62 мг полученного выше указанного в заголовке свободного соединения растворяют в метаноле и добавляют избыток 4 н. раствора хлористоводородной кислоты в этилацетате. Смесь перемешивают и упаривают. К образовавшемуся остатку добавляют воду и водный раствор замораживают, погружая в ванну со смесью сухого льда с метанолом. Растворитель удаляют сушкой вымораживанием в течение суток, получая при этом гидрохлорид указанного в заголовке соединения (белое аморфное вещество, 62 мг).
Гидрохлорид:
ESI-MC: 430 (МН+).
Пример 85
1-[4-Циано-5-метил-4-(3-тиенил)гексил]-4-[2-(3-цианофенокси)этил]пиперазин
Указанное в заголовке соединение получают в виде бесцветного масла способом, описанным в примере 84 (85%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,83 (д, J=6,8 Гц, 3Н), 1,16 (д, J=6,6 Гц, 3Н), 1,15-1,30 (м, 1Н), 1,54-1,66 (м, 1Н), 1,75-1,85 (м, 1Н), 2,02-2,15 (м, 2Н), 2,25-2,33 (м, 2Н), 2,33-2,48 (м, 4Н), 2,48-2,65 (м, 4Н), 2,80 (т, J=5,7 Гц, 2Н), 4,10 (т, J=5,7 Гц, 2Н), 6,93 (дд, J=1,3 Гц, 5,1 Гц, 1Н), 7,10-7,30 (м, 2Н), 7,20-7,26 (м, 1Н), 7,26-7,28 (м, 1Н), 7,32-7,39 (м, 2Н).
Гидрохлорид указанного в заголовке свободного соединения получают способом, описанным в примере 84.
Гидрохлорид:
ESI-MC: 437 (МН+).
Пример 86
1-[4-Циано-5-метил-4-[4-(2-циано)тиенил]гексил]-4-[2-(3-фторфенокси)этил]пиперазин
Указанное в заголовке соединение получают в виде бесцветного масла способом, описанным в примере 84 (76%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,84 (д, J=6,8 Гц, 3Н), 1,01-1,02 (м, 1Н), 1,17 (д, J=6,6 Гц, 3Н), 1,50-1,70 (м, 1Н), 1,75-1,85 (м, 1Н), 2,00-2,08 (м, 1Н), 2,08-2,18 (м, 1Н), 2,27-2,33 (м, 2Н), 2,33-2,48 (м, 4Н), 2,48-2,66 (м, 4Н), 2,80 (т, J=5,8 Гц, 2Н), 4,07 (т, J=5,8 Гц, 2Н), 6,59-6,70 (м, 3Н), 7,17-7,25 (м, 1Н), 7,46 (д, J=1,6 Гц, 1Н), 7,56 (д, J=1,6 Гц, 1Н).
Гидрохлорид указанного в заголовке свободного соединения получают способом, описанным в примере 84.
ESI-MC: 455 (МН+).
Пример 87
1-[4-Циано-5-метил-4-[4-(2-циано)тиенил]гексил]-4-[2-(3-цианофенокси)этил]пиперазин
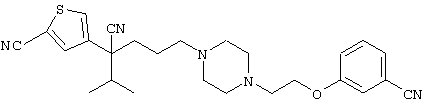
Указанное в заголовке соединение получают в виде бесцветного масла способом, описанным в примере 84 (78%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,84 (д, J=6,8 Гц, 3Н), 1,01-1,02 (м, 1Н), 1,17 (д, J=6,6 Гц, 3Н), 1,50-1,65 (м, 1Н), 1,75-1,85 (м, 1Н), 2,00-2,09 (м, 1Н), 2,09-2,18 (м, 1Н), 2,27-2,33 (м, 2Н), 2,33-2,48 (м, 4Н), 2,48-2,66 (м, 4Н), 2,81 (т, J=5,8 Гц, 2Н), 4,10 (т, J=5,8 Гц, 2Н), 7,12-7,16 (м, 2Н), 7,23-7,28 (м, 1Н), 7,36 (дт, J=0,8 Гц, 7,8 Гц, 1Н), 7,46 (д, J=1,6 Гц, 1H), 7,56 (д, J=1,6 Гц, 3Н).
Гидрохлорид указанного в заголовке свободного соединения получают способом, описанным в примере 84.
ESI-MC: 462 (МН+).
Пример 88
1-[4-Циано-5-метил-4-(2-тиенил)гексил]-4-[2-(2-циано-4-фторфенокси)этил]пиперазин
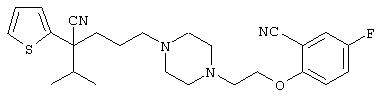
Указанное в заголовке соединение получают в виде бесцветного масла способом, описанным в примере 84 (72%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,8 Гц, 3Н), 1,18 (д, J=6,6 Гц, 3Н), 1,22-1,38 (м, 1Н), 1,52-1,70 (м, 1Н), 1,73-1,83 (м, 1Н), 2,00-2,11 (м, 1Н), 2,11-2,20 (м, 1Н), 2,27-2,33 (м, 2Н), 2,33-2,51 (м, 4Н), 2,51-2,70 (м, 4Н), 2,86 (т, J=5,8 Гц, 2Н), 4,17 (т, J=5,8 Гц, 2Н), 6,89-6,97 (м, 2Н), 7,09-7,12 (м, 1Н), 7,20-7,30 (м, 2Н).
Гидрохлорид указанного в заголовке свободного соединения получают способом, описанным в примере 84.
ESI-MC: 455 (МН+).
Пример 89
1-[4-Циано-5-метил-4-(3-тиенил)гексил]-4-[2-(2-циано-4-фторфенокси)этил]пиперазин
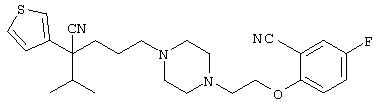
Указанное в заголовке соединение получают в виде бесцветного масла способом, описанным в примере 84 (72%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,83 (д, J=6,8 Гц, 3Н), 1,16 (д, J=6,6 Гц, 3Н), 1,16-1,20 (м, 1Н), 1,50-1,66 (м, 1Н), 1,76-1,86 (м, 1Н), 2,01-2,13 (м, 2Н), 2,24-2,33 (м, Н), 2,33-2,51 (м, 4Н), 2,51-2,70 (м, 4Н), 2,87 (т, J=5,8 Гц, 2Н), 4,17 (т, J=5,8 Гц, 2Н), 6,89-6,97 (м, 2Н), 7,20-7,30 (м, 3Н), 7,33-7,38 (м, 1Н).
Гидрохлорид указанного в заголовке свободного соединения получают способом, описанным в примере 84.
ESI-MC: 455 (МН+).
Пример 90
1-[4-Циано-5-метил-4-(2-тиенил)гексил]-4-[2-(4-циано-2-фторфенокси)этил]пиперазин
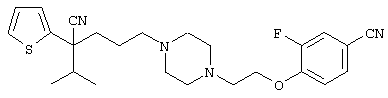
Указанное в заголовке соединение получают в виде бесцветного масла способом по примеру 84 (64%), используя в качестве исходного вещества 2-(4-циано-2-фторфенокси)этил]пиперазин, синтезированный способом по справочному примеру 69.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,6 Гц, 3Н), 1,18 (д, J=6,8 Гц, 3Н), 1,22-1,38 (м, 1Н), 1,52-1,70 (м, 1Н), 1,72-1,82 (м, 1Н), 2,00-2,10 (м, 1Н), 2,11-2,20 (м, 1Н), 2,27-2,33 (м, 2Н), 2,33-2,51 (м, 4Н), 2,51-2,70 (м, 4Н), 2,85 (т, J=5,8 Гц, 2Н), 4,20 (т, J=5,8 Гц, 2Н), 6,94 (дд, J=3,7 Гц, 5,2 Гц, 1Н), 7,00 (т, J=8,2 Гц, 1H), 7,10 (дд, J=1,3 Гц, 3,7 Гц, 1Н), 7,24-7,27 (м, 1H), 7,35 (дд, J=1,9 Гц, 10,4 Гц, 1H), 7,38-7,42 (м, 1H).
Гидрохлорид целевого соединения получают, обрабатывая свободное соединение способом по примеру 84.
ESI-MC: 455 (МН+).
Пример 91
1-[4-Циано-5-метил-4-(3-тиенил)гексил]-4-[2-(4-циано-2-фторфенокси)этил]пиперазин
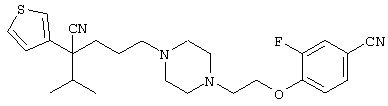
Указанное в заголовке соединение получают в виде бесцветного масла способом по примеру 84 (64%), используя в качестве исходного вещества 2-(4-циано-2-фторфенокси)этилпиперазин, синтезированный способом по справочному примеру 69.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,83 (д, J=6,8 Гц, 3Н), 1,16 (д, J=6,8 Гц, 3Н), 1,22-1,38 (м, 1H), 1,52-1,70 (м, 1H), 1,74-1,84 (м, 1H), 2,00-2,13 (м, 2Н), 2,25-2,33 (м, 2Н), 2,33-2,49 (м, 4Н), 2,49-2,68 (м, 4Н), 2,85 (т, J=5,8 Гц, 2Н), 4,20 (т, J=5,8 Гц, 2Н), 6,92 (дд, J=1,5 Гц, 5,1 Гц, 1H), 7,00 (т, J=8,4 Гц, 1H), 7,25-7,28 (м, 1H), 7,32-7,37 (м, 2Н), 7,40 (ддд, J=1,3 Гц, 1,8 Гц, 8,4 Гц, 1H).
Гидрохлорид указанного в заголовке свободного соединения получают способом, описанным в примере 84.
ESI-MC: 455 (МН+).
Пример 92
1-{4-Циано-5-метил-4-[(2,5-дибром)-3-тиенил]гексил}-4-[2-(3-цианофенокси)этил]пиперазин
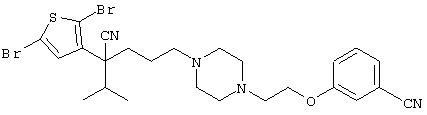
Указанное в заголовке соединение получают в виде бесцветного масла способом, описанным в примере 84 (78%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,6 Гц, 3Н), 1,17 (д, J=6,8 Гц, 3Н), 1,22-1,38 (м, 1Н), 1,52-1,70 (м, 1Н), 1,82-2,02 (м, 1Н), 2,30-2,53 (м, 8Н), 2,53-2,68 (м, 4Н), 2,81 (т, J=5,8 Гц, 2Н), 4,10 (т, J=5,8 Гц, 2Н), 7,04 (с, 1Н), 7,11-7,20 (м, 2Н), 7,22-7,29 (м, 1Н), 7,34-7,39 (м, 1Н).
Гидрохлорид указанного в заголовке свободного соединения получают способом, описанным в примере 84.
ESI-MC: 593, 595, 597 (МН+).
Пример 93
1-{4-Циано-5-метил-4-(2-бром-5-циано-3-тиенил)гексил}-4-[2-(3-цианофенокси)этил]пиперазин
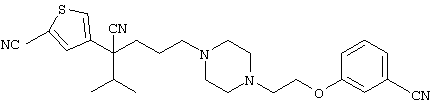
1-{4-Циано-5-метил-4-[(2,5-дибром)-3-тиенил]гексил}-4-[2-(3-цианофенокси)этил]пиперазин (145 мг) растворяют в атмосфере азота в смешанном растворе цианида цинка (57,3 мг) и 1,1’-бис(дифенилфосфино)ферроцена (13,5 мг) в диметилформамиде (10 мл)/воде (0,1 мл). К полученной смеси добавляют комплекс палладия и дибензилиденацетона (8,9 мг), трижды заменяют атмосферу азота и перемешивают раствор при 120°С в течение 4 часов. К смеси добавляют воду, диэтиловый эфир и водный раствор аммиака и отделяют органический слой. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над безводным сульфатом магния. Осушитель отфильтровывают, фильтрат упаривают и остаток очищают ЖХ-МС (колонка ODS; система ацетонитрил/вода), получая при этом указанное в заголовке соединение в виде желтого масла (8 мг, 6,7%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,89 (д, J=6,6 Гц, 3Н), 1,19 (д, J=6,6 Гц, 3Н), 1,19-1,25 (м, 1Н), 1,53-1,68 (м, 1Н), 2,00-2,10 (м, 1Н), 2,30-2,70 (м, 12Н), 2,83 (т, J=5,7 Гц, 2Н), 4,11 (т, J=5,7 Гц, 2Н), 7,11-7,17 (м, 2Н), 7,22-7,27 (м, 1Н), 7,34-7,39 (м, 1Н), 7,55 (с, 1Н).
Гидрохлорид указанного в заголовке свободного соединения получают способом, описанным в примере 84.
ESI-MC: 540, 542 (МН+).
Пример 94
1-[4-Циано-5-метил-4-(2-тиенил)гексил]-4-[2-(4-метилтиофенокси)этил]пиперазин
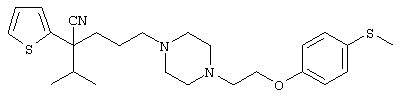
Указанное в заголовке соединение получают в виде бесцветного масла способом по примеру 45, описанным в JP-A 11-206862 (64%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,8 Гц, 3Н), 1,18 (д, J=6,8 Гц, 3Н), 1,22-1,38 (м, 1Н), 1,55-1,70 (м, 1Н), 1,71-1,82 (м, 1Н), 2,02-2,10 (м, 1Н), 2,11-2,21 (м, 1Н), 2,27-2,35 (м, 2Н), 2,35-2,50 (м, 4Н), 2,44 (с, 3H), 2,50-2,65 (м, 4Н), 2,78 (т, J=5,9 Гц, 2Н), 4,07 (т, J=5,9 Гц, 2Н), 6,84 (шир.д, J=8,8 Гц, 2Н), 6,94 (дд, J=3,7 Гц, 4,9 Гц, 1Н), 7,11 (шир.д, J=3,7 Гц, 1Н), 7,22-7,29 (м, 3Н).
Гидрохлорид указанного в заголовке свободного соединения получают способом, описанным в примере 84.
ESI-MC: 456 (МН+).
Пример 95
1-[4-Циано-5-метил-4-(2-тиенил)гексил]-4-[2-(4-метилсульфонилфенокси)этил]пиперазин
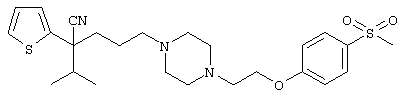
Указанное в заголовке соединение получают в виде бесцветного масла способом, описанным в примере 84 (85%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,8 Гц, 3Н), 1,18 (д, J=6,6 Гц, 3Н), 1,22-1,38 (м, 1Н), 1,55-1,71 (м, 1Н), 1,71-1,82 (м, 1Н), 2,02-2,10 (м, 1Н), 2,11-2,21 (м, 1Н), 2,27-2,35 (м, 2Н), 2,35-2,50 (м, 4Н), 2,50-2,65 (м, 4Н), 2,83 (т, J=5,8 Гц, 2Н), 3,03 (с, 3Н), 4,16 (т, J=5,8 Гц, 2Н), 6,84 (шир.д, J=8,8 Гц, 2Н), 6,94 (дд, J=3,7 Гц, 4,9 Гц, 2Н), 7,11 (шир.д, J=3,7 Гц, 1Н), 7,22-7,29 (м, 3Н).
Гидрохлорид указанного в заголовке свободного соединения получают способом, описанным в примере 84.
ESI-MC: 490 (МН+).
Пример 96
1-[4-Циано-5-метил-4-(2-тиенил)гексил]-4-[2-(3-ацетилфенокси)этил]пиперазин
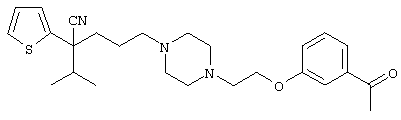
Указанное в заголовке соединение получают в виде бесцветного масла способом, описанным в примере 84 (72%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,8 Гц, 3Н), 1,18 (д, J=6,6 Гц, 3Н), 1,22-1,38 (м, 1Н), 1,55-1,71 (м, 1Н), 1,71-1,82 (м, 1Н), 2,02-2,10 (м, 1Н), 2,11-2,21 (м, 1Н), 2,28-2,35 (м, 2Н), 2,35-2,50 (м, 4Н), 2,50-2,65 (м, 4Н), 2,59 (с, 3Н), 2,82 (т, J=5,8 Гц, 2Н), 4,14 (т, J=5,8 Гц, 2Н), 6,94 (дд, J=3,5 Гц, 4,9 Гц, 1Н), 7,09-7,13 (м, 2Н), 7,24-7,28 (м, 1Н), 7,36 (т, J=7,9 Гц, 1Н), 7,47-7,50 (м, 1Н), 7,54 (шир.д, J=7,9 Гц, 1Н).
Гидрохлорид указанного в заголовке свободного соединения получают способом, описанным в примере 84.
ESI-MC: 454 (МН+).
Пример 97
1-[4-Циано-5-метил-4-(3-тиенил)гексил]-4-[2-(3-ацетилфенокси)этил]пиперазин
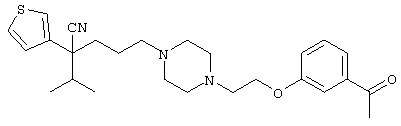
Указанное в заголовке соединение получают в виде бесцветного масла способом, описанным в примере 84 (60%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,83 (д, J=6,6 Гц, 3Н), 1,16 (д, J=6,8 Гц, 3Н), 1,16-1,30 (м, 1Н), 1,50-1,68 (м, 1Н), 1,75-1,84 (м, 1Н), 2,02-2,13 (м, 2Н), 2,25-2,35 (м, 2Н), 2,35-2,47 (м, 4Н), 2,47-2,68 (м, 4Н), 2,59 (с, 3Н), 2,81 (т, J=5,9 Гц, 2Н), 4,14 (т, J=5,9 Гц, 2Н), 6,92 (дд, J=1,4 Гц, 4,9 Гц, 1Н), 7,09-7,13 (м, 1Н), 7,25-7,28 (м, 1Н), 7,32-7,38 (м, 2Н), 7,47-7,50 (м, 1Н), 7,51-7,56 (м, 1Н).
Гидрохлорид указанного в заголовке свободного соединения получают способом, описанным в примере 84.
ESI-MC: 454 (МН+).
Пример 98
1-[4-Циано-5-метил-4-(3-тиенил)гексил]-4-[2-(4-цианофенокси)этил]пиперазин
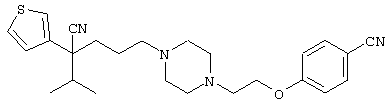
Указанное в заголовке соединение получают в виде бесцветного масла способом, описанным в примере 84 (55%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,83 (д, J=6,8 Гц, 3Н), 1,16 (д, J=6,8 Гц, 3Н), 1,16-1,30 (м, 1Н), 1,50-1,68 (м, 1Н), 1,72-1,84 (м, 1Н), 2,02-2,12 (м, 2Н), 2,25-2,35 (м, 2Н), 2,35-2,45 (м, 4Н), 2,45-2,65 (м, 4Н), 2,81 (т, J=5,8 Гц, 2Н), 4,12 (т, J=5,8 Гц, 2Н), 6,90-6,97 (м, 3H), 7,23-7,32 (м, 1Н), 7,32-7,36 (м, 1Н), 7,57 (д, J=8,6 Гц, 2Н).
Гидрохлорид указанного в заголовке свободного соединения получают способом, описанным в примере 84.
ESI-MC: 437 (МН+).
Пример 99
1-[4-Циано-5-метил-4-(3-тиенил)гексил]-4-[2-(4-метилтиофенокси)этил]пиперазин
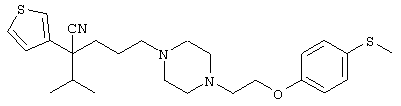
Указанное в заголовке соединение получают в виде бесцветного масла способом по примеру 45, описанным в JP-A 11-206862 (59%).
1H-ЯМР (400 МГц, CDCl3) δ 0,83 (д, J=6,6 Гц, 3Н), 1,16 (д, J=6,8 Гц, 3Н), 1,16-1,30 (м, 1Н), 1,50-1,68 (м, 1Н), 1,72-1,84 (м, 1Н), 2,02-2,12 (м, 2Н), 2,25-2,35 (м, 2Н), 2,35-2,48 (м, 4Н), 2,44 (с, 3Н), 2,48-2,65 (м, 4Н), 2,78 (т, J=5,9 Гц, 2Н), 4,06 (т, J=5,9 Гц, 2Н), 6,84 (шир.д, J=6,6 Гц, 2Н), 6,92 (дд, J=1,5 Гц, 5,1 Гц, 1Н), 7,22-7,28 (м, 3Н), 7,33 (дд, J=3,0 Гц, 5,1 Гц, 1Н).
Гидрохлорид указанного в заголовке свободного соединения получают способом, описанным в примере 84.
ESI-MC: 456 (MH+).
Пример 100
1-[4-Циано-5-метил-4-(3-тиенил)гексил]-4-[2-(4-метилсульфонилфенокси)этил]пиперазин
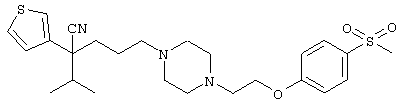
Указанное в заголовке соединение получают в виде бесцветного масла способом, описанным в примере 84 (56%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,83 (д, J=6,6 Гц, 3Н), 1,16 (д, J=6,8 Гц, 3Н), 1,16-1,30 (м, 1Н), 1,50-1,68 (м, 1Н), 1,74-1,84 (м, 1Н), 2,02-2,12 (м, 2Н), 2,25-2,35 (м, 2Н), 2,35-2,48 (м, 4Н), 2,48-2,65 (м, 4Н), 2,82 (т, J=5,9 Гц, 2Н), 3,03 (с, 3Н), 4,16 (т, J=5,9 Гц, 2Н), 6,92 (дд, J=1,5 Гц, 5,1 Гц, 1Н), 7,02 (шир.д, J=8,8 Гц, 2Н), 7,24-7,29 (м, 1Н), 7,33 (дд, J=3,0 Гц, 5,1 Гц, 1Н), 7,86 (шир.д, J=8,8 Гц, 2Н).
Гидрохлорид указанного в заголовке свободного соединения получают способом, описанным в примере 84.
ESI-MC: 490 (MH+).
Пример 101
1-[4-Циано-5-метил-4-(2-тиенил)гексил]-4-[2-(3-бромфенокси)этил]пиперазин
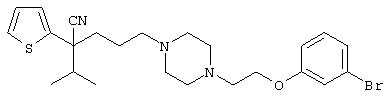
Указанное в заголовке соединение получают в виде бесцветного масла способом, описанным в примере 84 (87%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,6 Гц, 3Н), 1,18 (д, J=6,6 Гц, 3Н), 1,20-1,40 (м, 1Н), 1,55-1,70 (м, 1Н), 1,72-1,82 (м, 1Н), 2,00-2,10 (м, 2Н), 2,10-2,22 (м, 2Н), 2,25-2,35 (м, 2Н), 2,35-2,50 (м, 4Н), 2,50-2,65 (м, 4Н), 2,78 (т, J=5,8 Гц, 2Н), 4,06 (т, J=5,8 Гц, 2Н), 6,80-6,85 (м, 1Н), 6,94 (шир.дд, J=3,5 Гц, 5,0 Гц, 1Н), 7,04-7,15 (м, 4Н), 7,24-7,28 (м, 1Н).
Гидрохлорид указанного в заголовке свободного соединения получают способом, описанным в примере 84.
ESI-MC: 490, 492 (МН+).
Пример 102
1-[4-Циано-5-метил-4-(2-тиенил)гексил]-4-(2-феноксиэтил)пиперазин
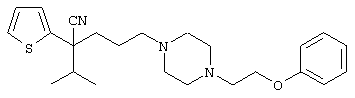
Указанное в заголовке соединение получают в виде бесцветного масла способом, описанным в примере 84 (97%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,6 Гц, 3Н), 1,18 (д, J=6,6 Гц, 3Н), 1,20-1,40 (м, 1Н), 1,55-1,70 (м, 1Н), 1,72-1,82 (м, 1Н), 2,00-2,10 (м, 2Н), 2,10-2,22 (м, 2Н), 2,25-2,35 (м, 2Н), 2,35-2,50 (м, 4Н), 2,50-2,65 (м, 4Н), 2,80 (т, J=5,8 Гц, 2Н), 4,09 (т, J=5,8 Гц, 2Н), 6,87-6,97 (м, 4Н), 7,08-7,12 (м, 1Н), 7,23-7,30 (м, 2Н).
Гидрохлорид указанного в заголовке свободного соединения получают способом, описанным в примере 84.
ESI-MC: 412 (MH+).
Пример 103
1-[4-Циано-5-метил-4-(2-бром-5-тиенил)гексил]-4-[2-(3-цианофенокси)этил]пиперазин
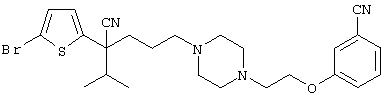
Используя [4-циано-5-метил-4-(2-бром-5-тиенил)гексилокси]-трет-бутилдиметилсилан (700 мг), полученный в примере 114-5), приведенном в JP-A 11-206862, синтезируют 4-циано-5-метил-4-(2-бром-5-тиенил)гексанол (371 мг, 80%) в виде желтого масла способом по примеру 114-8), описанному в JP-A 11-206862. Из 105 мг полученного соединения и 96 мг 2-(3-цианофенокси) этилпиперазина синтезируют указанное в заголовке соединение в виде бесцветного масла способом, описанным в примере 84 (138 мг, 62%).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,93 (д, J=6,8 Гц, 3Н), 1,18 (д, J=6,8 Гц, 3Н), 1,20-1,40 (м, 1Н), 1,55-1,70 (м, 1Н), 1,90-2,05 (м, 1Н), 2,05-2,20 (м, 2Н), 2,30-2,38 (м, 2Н), 2,38-2,50 (м, 4Н), 2,50-2,65 (м, 4Н), 2,81 (т, J=5,8 Гц, 2Н), 4,10 (т, J=5,8 Гц, 2Н), 6,90 (дд, J=3,8 Гц, 8,6 Гц, 2Н), 7,10-7,17 (м, 2Н), 7,22-7,30 (м, 1Н), 7,33-7,40 (м, 1Н).
Гидрохлорид указанного в заголовке свободного соединения получают способом, описанным в примере 84.
ESI-MC: 515, 517 (MH+).
Пример 104
1-[4-Циано-4-(3-циано-5-тиенил)-5-метилгексил]-4-[2-(4-метилсульфонилфенокси)этил]пиперазин
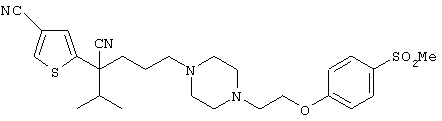
Из 4-циано-4-(3-циано-5-тиенил)-5-метилгексанола и 1-[2-(4-метилсульфонилфенокси)этил]пиперазина синтезируют указанное в заголовке соединение в виде бледно-желтого масла способом по примеру 68 (39%). Гидрохлорид получают, обрабатывая указанное в заголовке свободное соединение обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,92 (д, J=6,8 Гц, 3Н), 1,20 (д, J=6,8 Гц, 3Н), 1,21-1,31 (м, 1Н), 1,60-1,72 (м, 1Н), 1,78 (дт, J=4 Гц, 13,2 Гц, 1Н), 2,07 (квин, J=6,8 Гц, 1Н), 2,20 (дт, J=4 Гц, 13,2 Гц, 1Н), 2,33 (т, J=7,2 Гц, 2Н), 2,42 (шир.с, 4Н), 2,59 (шир.с, 4Н), 2,83 (т, J=5,6 Гц, 2Н), 3,03 (с, 3Н), 4,16 (т, J=5,6 Гц, 2Н), 7,02 (д, J=8,8 Гц, 1Н), 7,29 (д, J=1,2 Гц, 1Н), 7,86 (д, J=8,8 Гц, 2Н), 7,90 (д, J=1,2 Гц, 1Н).
Гидрохлорид:
ESI-MC: 515 (МН+).
Пример 105
1-[4-Циано-4-(3-циано-5-тиенил)-5-метилгексил]-4-[2-(3-ацетилфенокси)этил]пиперазин
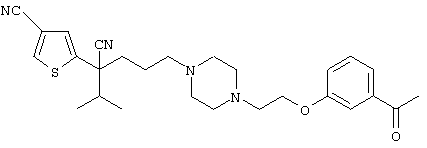
Из 4-циано-4-(3-циано-5-тиенил)-5-метилгексанола и 1-[2-(3-ацетилфенокси)этил]пиперазина получают указанное в заголовке соединение в виде бледно-желтого масла способом по примеру 68 (выход 38%). Гидрохлорид получают, обрабатывая указанное в заголовке свободное соединение обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,92 (д, J=6, 8 Гц, 3Н), 1,20 (д, J=6,8 Гц, 3Н), 1,21-1,32 (м, 1Н), 1,60-1,74 (м, 1Н), 1,78 (дт, J=4 Гц, 13,2 Гц, 1Н), 2,07 (квин, J=6,8 Гц, 1Н), 2,20 (дт, J=4 Гц, 13,2 Гц, 1Н), 2,29-2,37 (м, 2Н), 2,43 (шир.с, 4Н), 2,59 (шир.с, 4Н), 2,60 (с, 3Н), 2,83 (т, J=5,6 Гц, 2Н), 4,15 (т, J=5,6 Гц, 2Н), 7,10-7,13 (м, 1Н), 7,29 (д, J=1,2 Гц, 1Н), 7,37 (т, J=8 Гц, 1Н), 7,49 (дд, J=1,6 Гц, 2,8 Гц, 1Н), 7,52-7,55 (м, 1Н), 7,90 (д, J=1,2 Гц, 1Н).
Гидрохлорид:
ESI-MC: 479 (МН+).
Пример 106
1-[4-Циано-5-метил-4-(2-тиенил)гексил]-4-[{2-(5-цианобензофуранил)}метил]пиперазин
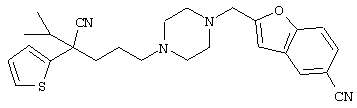
Используя 1-[{2-(5-цианобензофуранил)}метил]пиперазин, синтезируют указанное в заголовке соединение способом по примеру 75 (выход 100%).
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,4 Гц, 3Н), 1,18 (д, J=6,8 Гц, 3Н), 1,22-1,37 (м, 1Н), 1,56-1,70 (м, 1Н), 1,70-1,80 (м, 1Н), 2,00-2,09 (м, 1H), 2,10-2,19 (м, 1Н), 2,32 (т, J=7,2 Гц, 2Н), 2,35-2,65 (м, 8Н), 3,70 (с, 2Н), 6,65 (шир.д-с, 1Н), 6,93 (дд, J=3,2 Гц, 5,2 Гц, 1Н), 7,10 (дд, J=1,2 Гц, 3,2 Гц, 1Н), 7,24 (дд, J=1,2 Гц, 5,2 Гц, 1Н), 7,52-7,54 (м, 2Н), 7,85-7,87 (м, 1Н).
ESI-MC: 447 (М+Н+).
Пример 107
1-[4-Циано-5-метил-4-(5-циано-2-тиенил)гексил]-4-(2-феноксиэтил)пиперазин
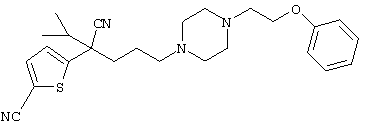
Используя 1-[2-феноксиэтил]пиперазин, синтезируют целевое соединение способом по примеру 77 (выход 96,5%). Физико-химические данные указанного в заголовке соединения приведены ниже.
1H-ЯМР (400 МГц, CDCl3) δ 0,92 (д, J=6,8 Гц, 3Н), 1,21 (д, J=6,4 Гц, 3Н), 1,20-1,32 (м, 1Н), 1,60-1,72 (м, 1Н), 1,72-1,82 (м, 1Н), 2,00-2,12 (м, 1Н), 2,17-2,27 (м, 1Н), 2,33 (т, J=7,2 Гц, 2Н), 2,32-2,48 (м, 4Н), 2,50-2,70 (м, 4Н), 2,81 (т, J=6,0 Гц, 2Н), 4,10 (т, J=6,0 Гц, 2Н), 6,88-6,97 (м, 3Н), 7,15 (д, J=4,0 Гц, 1Н), 7,25-7,30 (м, 2Н), 7,51 (д, J=4,0 Гц, 1Н).
ESI-MC: 437 (М+Н+).
Пример 108
1-[4-Циано-5-метил-4-(5-циано-2-тиенил)гексил]-4-[2-(3-бромфенокси)этил]пиперазин
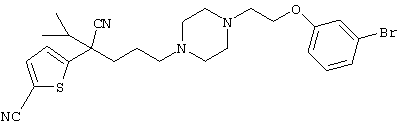
Используя 1-[2-(3-бромфенокси)этил]пиперазин, синтезируют указанное в заголовке соединение способом по примеру 77 (выход 83,5%). Физико-химические данные указанного в заголовке соединения приведены ниже.
1H-ЯМР (400 МГц, CDCl3) δ 0,93 (д, J=6,4 Гц, 3Н), 1,22 (д, J=6,8 Гц, 3Н), 1,20-1,32 (м, 1Н), 1,60-1,72 (м, 1Н), 1,72-1,83 (м, 1Н), 2,02-2,12 (м, 1Н), 2,17-2,28 (м, 1Н), 2,28-2,50 (м, 6Н), 2,50-2,67 (м, 4Н), 2,80 (т, J=6,0 Гц, 2Н), 4,10 (т, J=6,0 Гц, 2Н), 6,81-6,86 (м, 1Н), 7,05-7,10 (м, 2Н), 7,10-7,14 (м, 1Н), 7,16 (д, J=3,6 Гц, 1Н), 7,52 (д, J=3,6 Гц, 1Н).
ESI-MC: 515, 517 (М+Н+).
Соединения по примерам 110, 111, 112, 113, 114, 115, 116, 117, 118, 119 и 120 синтезируют способами, описанными в примерах 1, 89 или 99 в JP-A 11-206862, или аналогично указанным способам.
Пример 109
1-[4-Циано-5-метил-4-(2-бром-5-тиенил)гексил]-4-[2-(3-цианофенокси)этил]пиперазин
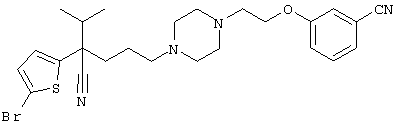
Указанное в заголовке соединение получают в виде бледно-коричневого масла способом по примеру 1, описанным в JP-A 11-206862.
Гидрохлорид:
ESI-MC (m/e): 515, 517 (М+Н).
Пример 110
1-[4-Циано-5-метил-4-(2-циано-5-тиенил)гексил]-4-[2-(3-хлорфенокси)этил]пиперазин
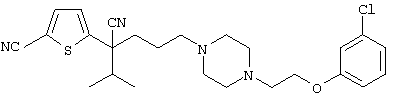
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,92 (д, J=6,6 Гц, 3Н), 1,21 (д, J=6,6 Гц, 3Н), 1,21-1,32 (м, 1Н), 1,55-1,73 (м, 2Н), 2,00-2,12 (м, 1Н), 2,15-2,30 (м, 1Н), 2,30-2,38 (м, 2Н), 2,38-2,45 (м, 4Н), 2,50-2,65 (м, 4Н), 2,80 (т, J=5,8 Гц, 2Н), 4,07 (т, J=5,8 Гц, 2Н), 6,76-6,82 (м, 1Н), 6,88-6,95 (м, 1Н), 7,13-7,21 (м, 3Н), 7,51 (д, J=3,8 Гц, 1Н).
Гидрохлорид:
ESI-MC (m/e): 471 (М+Н).
Пример 111
1-[4-Циано-5-метил-4-(2-циано-5-тиенил)гексил]-4-[2-(3-иодфенокси)этил]пиперазин
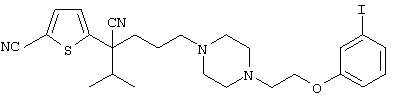
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,92 (д, J=6, 6 Гц, 3Н), 1,21 (д, J=6,6 Гц, 3Н), 1,21-1,32 (м, 1Н), 1,55-1,73 (м, 2Н), 2,00-2,12 (м, 1Н), 2,15-2,30 (м, 1Н), 2,30-2,38 (м, 2Н), 2,38-2,45 (м, 4Н), 2,50-2,65 (м, 4Н), 2,79 (т, J=5,8 Гц, 2Н), 4,06 (т, J=5,8 Гц, 2Н), 6,86-6,99 (м, 1Н), 6,96-7,01 (м, 1Н), 7,15 (д, J=3,8 Гц, 1H), 7,25-7,30 (м, 2Н), 7,51 (д, J=3,8 Гц, 1Н).
Гидрохлорид:
ESI-MC (m/e): 563 (М+Н).
Пример 112
1-[4-Циано-5-метил-4-(2-тиенил)гексил]-4-{N-[(3-цианофенил)-N-изопропиламино]этил}пиперазин
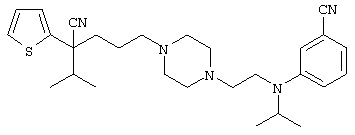
Гидрохлорид:
ESI-MC (m/e): 478 (М+Н).
Пример 113
1-[4-Циано-5-метил-4-(2-тиенил)гексил]-4-{N-[(3-цианофенил)-N-метиламино]этил}пиперазин
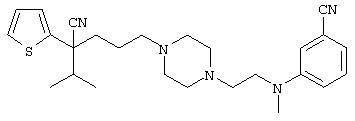
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,6 Гц, 3Н), 1,18 (д, J=6,6 Гц, 3Н), 1,20-1,40 (м, 1Н), 1,45-1,70 (м, 1Н), 1,70-1,82 (м, 1Н), 2,00-2,10 (м, 1Н), 2,10-2,20 (м, 1Н), 2,24-2,60 (м, 12Н), 3,00 (с, 3H), 3,46 (т, J=7,4 Гц, 2Н), 6,84-6,98 (м, 4Н), 7,11 (дд, J=3,5 Гц, 1,1 Гц, 1Н), 7,23-7,33 (м, 2Н).
Гидрохлорид:
ESI-MC (m/e): 450 (М+Н).
Пример 114
Синтез 1-[3-циано-4-метил-5-(2-тиенил)пентил]-4-[2-(3-цианофенокси)этил]пиперазин
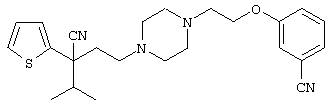
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,91 (д, J=6,8 Гц, 3Н), 1,19 (д, J=6,6 Гц, 3Н), 1,85-1,98 (м, 1Н), 2,00-2,20 (м, 2Н), 2,30-2,70 (м, 10Н), 2,80 (т, J=5,9 Гц, 2Н), 4,09 (т, J=5,9 Гц, 2Н), 6,95 (дд, J=5,1 Гц, 3,7 Гц, 1Н), 7,10-7,15 (м, 3Н), 7,22-7,29 (м, 2Н), 7,33-7,39 (м, 1Н).
Гидрохлорид:
ESI-MC (m/e): 423 (М+Н).
Пример 115
1-[3-Циано-4-метил-5-(2-тиенил)пентил]-4-[2-(4-фторфенокси)этил]пиперазин
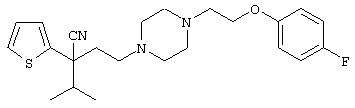
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,91 (д, J=6,8 Гц, 3Н), 1,19 (д, J=6,8 Гц, 3Н), 1,85-1,98 (м, 1Н), 2,00-2,20 (м, 2Н), 2,30-2,70 (м, 10Н), 2,78 (т, J=5,9 Гц, 2Н), 4,04 (т, J=5,9 Гц, 2Н), 6,80-6,85 (м, 2Н), 6,92-6,99 (м, 3Н), 7,10-7,13 (м, 1Н), 7,26-7,30 (м, 1Н).
Гидрохлорид:
ESI-MC (m/e): 416 (М+Н).
Пример 116
1-[4-Циано-5-метил-4-(2-тиенил)гексил]-4-(циклогексилметил)пиперазин
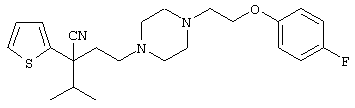
Трифторацетат:
ESI-MC (m/e): 388 (М+Н).
Пример 117
4-[4-(4-Фенилпиперидинил)пиперидинил]-1-изопропил-1-фенилбутилцианид
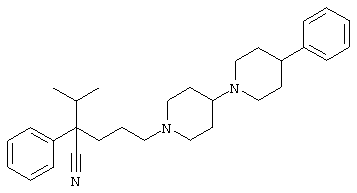
Свободное соединение:
Rf=0,5 (проявляющий растворитель: этилацетат:гексан=2:1, Fuji Silysia Chemical Ltd. TCX на силикагеле NH).
Гидрохлорид:
ESI-MC (m/e): 444 (M+H).
Пример 118
4-[4-(4-Циано-4-фенилпиперидинил)пиперидинил]-1-изопропил-1-фенилбутилцианид
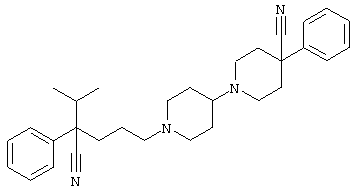
Свободное соединение:
Rf=0,4 (проявляющий растворитель: этилацетат:гексан=2:1, Fuji Silysia Chemical Ltd. TCX на силикагеле NH).
Гидрохлорид:
ESI-MC (m/e): 469 (M+H).
Пример 119
4-[4-(4-Бензилпиперидинил)пиперидинил]-1-изопропил-1-фенилбутилцианид
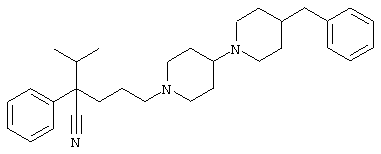
Свободное соединение:
Rf=0,5 (проявляющий растворитель: этилацетат:гексан=2:1, Fuji Silysia Chemical Ltd. TCX на силикагеле NH).
Гидрохлорид:
ESI-MC (m/e): 458 (M+H).
Пример 120
1-[4-Циано-5-метил-4-(2-тиенил)гексил]-4-{2-[N-(1,2,3,4-тетрагидро-1-хинолинил)сульфамоил]этил}пиперазин
Указанное в заголовке соединение синтезируют способами по примерам 63 или 67, описанными в JP-A 11-206862, или аналогично указанным способам.
Трифторацетат:
ESI-MC (m/e): 515 (M+H).
Пример 121
1-[3-Циано-4-метил-5-(2-тиенил)пентил]-4-{2-[N-(1,2,3,4-тетрагидро-1-хинолинил)сульфамоил]этил}пиперазин
Указанное в заголовке соединение синтезируют способами по примерам 63 или 67, описанными в JP-A 11-206862, или аналогично указанным способам.
Трифторацетат:
ESI-MC (m/e): 501 (М+Н).
Пример 122
1-[4-Циано-5-метил-4-(2-тиенил)гексил]-4-{2-[N-(пиперидинил)сульфамоил]этил}пиперазин
Указанное в заголовке соединение синтезируют способами по примерам 63 или 67, описанными в JP-A 11-206862, или аналогично указанным способам.
Гидрохлорид:
ESI-MC (m/e): 467 (М+Н).
Пример 123
Бис-1,4-[(3-циано-4-метил-3-фенил)пентил]пиперазин
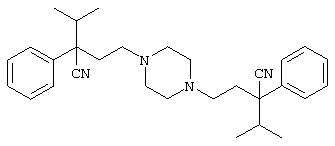
3-Метил-2-(2-оксоэтил)-2-фенилбутаннитрил (100 мг) и безводный пиперазин (22 мг) растворяют в метиленхлориде (5 мл). К смеси добавляют уксусную кислоту (0,085 мл) и триацетоксиборогидрид натрия (158 мг) и перемешивают в течение ночи при комнатной температуре. Органический слой отделяют, добавляя насыщенный водный раствор бикарбоната натрия и метиленхлорид, промывают водой, сушат над безводным сульфатом магния и упаривают. Образовавшийся остаток очищают хроматографией на колонке с силикагелем Chromatorex NH (система: гексан/этилацетат), получая при этом указанное в заголовке соединение в виде бесцветного масла (81 мг, 71%). Гидрохлорид (89 мг) указанного в заголовке соединения получают, обрабатывая свободное соединение обычным способом.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,76 (д, J=6,8 Гц, 6Н), 1,10-1,20 (м, 2Н), 1,19 (д, J=6,8 Гц, 6Н), 1,50-1,60 (м, 2Н), 1,90-2,15 (м, 6Н), 2,00-2,45 (м, 8Н), 7,25-7,42 (м, 10Н).
Гидрохлорид:
ESI-MC (m/e): 457 (М+Н).
Указанные в заголовке соединения по примерам 124-126 синтезируют способом, описанным в примере 123.
Пример 124
Бис-1,4-[(3-циано-4-метил-3-фенил)пентил]гомопиперазин
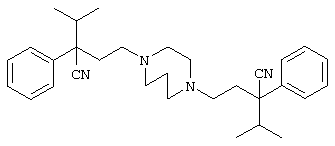
Гидрохлорид:
ESI-MC (m/e): 471 (M+H).
Пример 125
Бис-1,4-[(3-циано-4-метил-3-фенил)гексил]гомопиперазин
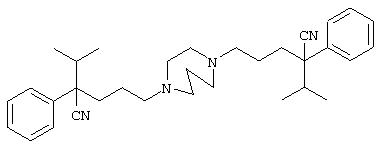
Гидрохлорид:
ESI-MC (m/e): 499 (M+H).
Пример 126
Бис-1,4-[(3-циано-4-метил-3-(2-тиенил)пентил]пиперазин
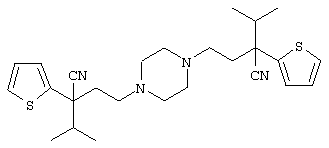
Гидрохлорид:
ESI-MC (m/e): 469 (M+H).
Пример 127
{1-[(4-Циано-5-метил-4-фенил)гексил]пиперазинил}амид (S)-3-фенил-2-аминопропановой кислоты
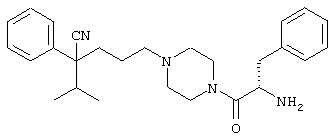
1-[(4-Циано-5-метил-4-фенил)гексил]пиперазин (14 мг) и N-(трет-бутоксикарбонил)-L-фенилаланин (10 мг) растворяют в метиленхлориде (0,5 мл), добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (10 мг) и триэтиламин (0,015 мл) и перемешивают смесь в течение ночи при комнатной температуре. Раствор очищают хроматографией на колонке с силикагелем (диэтиловый эфир) и удаляют растворитель, производя продувку азотом.
Образовавшийся остаток растворяют в метиленхлориде (0,4 мл), добавляют трифторуксусную кислоту (0,2 мл) и смесь перемешивают при комнатной температуре в течение 9 часов. Реакционный растворитель удаляют, оставляя смесь выстаиваться при 35°С, производя продувку азотом в течение ночи, и получают таким образом гидрохлорид (21 мг, 91%) указанного в заголовке соединения.
Гидрохлорид:
ESI-MC (m/e): 433 (М+Н).
Указанные в заголовке соединения по примерам 128 и 129 синтезируют способом, описанным в примере 127.
Пример 128
{1-[(4-Циано-5-метил-5-(2-тионил)гексил]пиперазинил}амид (S)-3-фенил-2-аминопропановой кислоты
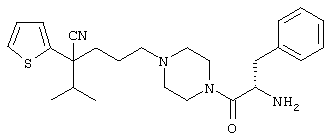
Гидрохлорид:
ESI-MC (m/e): 439 (М+Н).
Пример 129
{1-[(3-Циано-4-метил-4-(2-тионил)гексил]пиперазинил}амид (S)-3-фенил-2-аминопропановой кислоты
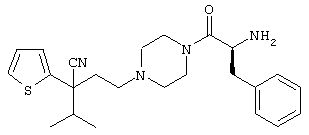
Гидрохлорид:
ESI-MC (m/e): 425 (М+Н).
Пример 130
5-[3-(Бензиламино)-4-гидрокситетрагидро-1Н-1-пирролил]-2-изопропил-5-оксо-2-(2-тиенил)пентаннитрил
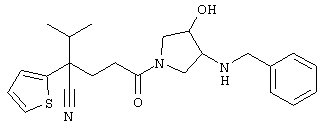
В атмосфере азота 5-(2,5-дигидро-1Н-1-пирролил]-2-изопропил-5-оксо-2-(2-тиенил)пентаннитрил (260 мг) растворяют при комнатной температуре в смешанном растворителе, включающем диметилсульфоксид (2 мл) и воду (0,1 мл). К смеси добавляют N-бромсукцинимид (177 мг) и перемешивают в течение ночи. Реакционный раствор распределяют между этилацетатом и водой, полученный органический слой сушат над безводным сульфатом магния и упаривают. Остаток очищают хроматографией на колонке с силикагелем (система: этилацетат/гексан), получая бесцветное маслянистое промежуточное соединение (140 мг). Промежуточное соединение (20 мг) растворяют в тетрагидрофуране (0,05 мл), добавляют 1 н. водный раствор гидроксида натрия (0,06 мл) и смесь перемешивают при комнатной температуре. Смесь перемешивают в течение 45 минут, добавляют раствор бензиламина (11 мг) в тетрагидрофуране (0,05 мл) и продолжают перемешивать при 70°С в течение ночи. Реакционный раствор охлаждают до комнатной температуры и распределяют между этилацетатом и водой. Полученный органический слой сушат над безводным сульфатом магния и упаривают. Остаток очищают хроматографией на колонке с силикагелем Cromatorex NH (система этилацетат/гексан), получая при этом указанное в заголовке соединение в виде бесцветного масла (20 мг).
Гидрохлорид:
ESI-MC (m/e): 412 (М+Н).
Указанные в заголовке соединения по примерам 131-136 синтезируют способом, описанным в примере 130.
Пример 131
5-[3-(N-Метилбензиламино)-4-гидрокситетрагидро-1Н-1-пирролил]-2-изопропил-5-оксо-2-(2-тиенил)пентаннитрил
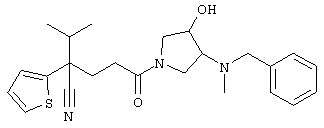
Гидрохлорид:
ESI-MC (m/e): 426 (М+Н).
Пример 132
5-[3-(2-Тиенилэтиламино)-4-гидрокситетрагидро-1Н-1-пирролил]-2-изопропил-5-оксо-2-(2-тиенил)пентаннитрил
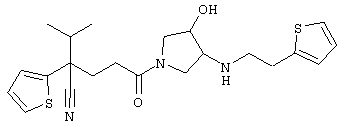
Гидрохлорид:
ESI-MC (m/e): 432 (М+Н).
Пример 133
5-[3-(N-Фенилпиперазино)-4-гидрокситетрагидро-1Н-1-пирролил]-2-изопропил-5-оксо-2-(2-тиенил)пентаннитрил
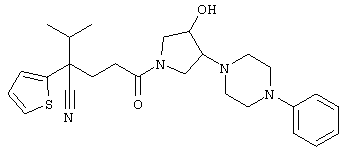
Трифторацетат:
ESI-MC (m/e): 467 (М+Н).
Пример 134
5-{3-[4-(2,3-Дигидро-1Н-1-индолил)пиперазино]-4-гидрокситетрагидро-1Н-пирролил}-2-изопропил-5-оксо-2-(2-тиенил)пентаннитрил
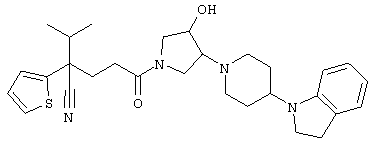
Трифторацетат:
ESI-MC (m/e): 507 (М+Н).
Пример 135
5-[3-(3-Пиридилэтиламино)-4-гидрокситетрагидро-1Н-пирролил]-2-изопропил-5-оксо-2-(2-тиенил)пентаннитрил
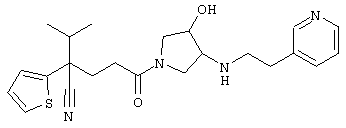
Трифторацетат:
ESI-MC (m/e): 427 (М+Н).
Пример 136
5-{3-[4-(1Н-1-Индолил)пиперидино]-4-гидрокситетрагидро-1Н-пирролил}-2-изопропил-5-оксо-2-(2-тиенил)пентаннитрил
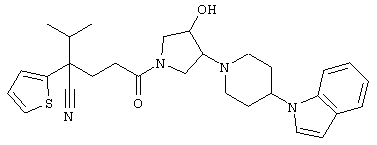
Трифторацетат:
ESI-MC (m/e): 505 (М+Н).
Указанные в заголовке соединения по примерам 137-172 синтезируют способом, описанным в приведенном выше примере 64.
Пример 137
1-[(4-Циано-5-метил-4-фенил)гексил]-4-(бензотиазолил)пиперазин
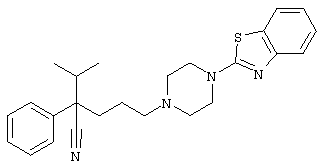
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,10-1,30 (м, 1Н), 1,21 (д, J=6,6 Гц, 3Н), 1,50-1,70 (м, 1Н), 1,87-1,20 (м, 1Н), 2,08-2,24 (м, 2Н), 2,30-2,38 (м, 1Н), 2,40-2,48 (м, 4Н), 3,52-3,64 (м, 4Н), 7,04-7,10 (м, 1Н), 7,24-7,34 (м, 2Н), 7,35-7,40 (м, 4Н), 7,50-7,61 (м, 2Н).
Гидрохлорид:
ESI-MC (m/e): 449 (М+Н).
Пример 138
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[2-(6-метокси)бензотиазолил]пиперазин
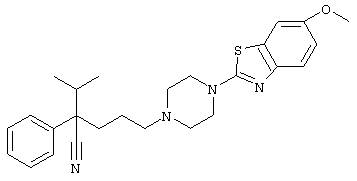
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,10-1,30 (м, 1H), 1,21 (д, J=6,6 Гц, 3Н), 1,50-1,70 (м, 1Н), 1,87-1,20 (м, 1H), 2,08-2,24 (м, 2Н), 2,30-2,38 (м, 1H), 2,38-2,48 (м, 4Н), 3,50-3,62 (м, 4Н), 3,82 (с, 3H), 6,86-6,92 (м, 1H), 7,12-7,15 (м, 1H), 7,22-7,35 (м, 3Н), 7,35-7,40 (м, 3Н), 7,43-7,48 (м, 1H).
Гидрохлорид:
ESI-MC (m/e): 419 (М+Н).
Пример 139
1-[(4-Циано-5-метил-4-фенил)гексил]-4-(2-бензоксазолил)пиперазин
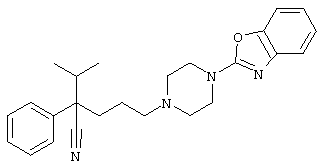
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,10-1,30 (м, 1H), 1,21 (д, J=6,6 Гц, 3Н), 1,50-1,70 (м, 1H), 1,77-1,20 (м, 1H), 2,08-2,25 (м, 2Н), 2,28-2,38 (м, 1H), 2,38-2,48 (м, 4Н), 3,60-3,72 (м, 4Н), 6,98-7,04 (м, 1H), 7,12-7,18 (м, 1H), 7,22-7,28 (м, 1H), 7,28-7,43 (м, 5Н).
Гидрохлорид:
ESI-MC (m/e): 403 (М+Н).
Пример 140
1-[(4-Циано-5-метил-4-фенил)гексил]-4-(2-хинолинил)пиперазин
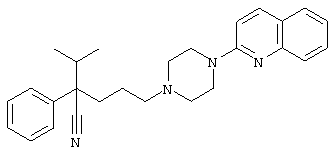
Свободное соединение:
Rf=0,6 (проявляющий растворитель: диэтиловый эфир, ТСХ на силикагеле Merck 60F254).
Гидрохлорид:
ESI-MC (m/e): 413 (М+Н).
Пример 141
1-[(4-Циано-5-метил-4-фенил)гексил]-4-(1-хинолинил)пиперазин
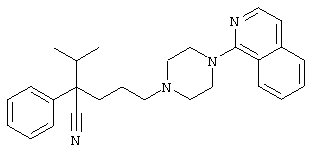
Свободное соединение:
Rf=0,45 (проявляющий растворитель: диэтиловый эфир, ТСХ на силикагеле Merck 60F254).
Хлористоводородная соль:
ESI-MC (m/e): 413 (М+Н).
Пример 142
4-[4-(1-Изобутил-1Н-бензо[d]имидазол-2-ил)-1,4-диазепан-1-ил]-1-изопропил-1-фенилбутилцианид
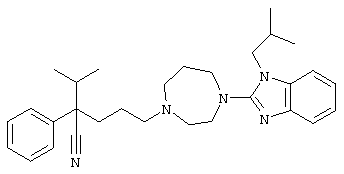
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 0,81 (д, J=8,1 Гц, 6Н), 1,08-1,30 (м, 1Н), 1,20 (д, J=7,0 Гц, 3Н), 1,50-1,70 (м, 1Н), 1,77-1,20 (м, 2Н), 2,00-2,32 (м, 4Н), 2,40-2,52 (м, 2Н), 2,60-2,67 (м, 2Н), 2,67-2,73 (м, 2Н), 3,48-3,60 (м, 4Н), 3,81 (д, J=7,3 Гц, 2Н), 7,07-7,18 (м, 3Н), 7,25-7,42 (м, 5Н), 7,51-7,56 (м, 1Н).
Гидрохлорид:
ESI-MC (m/e): 472 (М+Н).
Пример 143
4-[4-(1-Изобутил-1Н-бензо[d]имидазол-2-ил)-1,4-диазепан-1-ил]-1-изопропил-1-(2-хлорфенил)бутилцианид
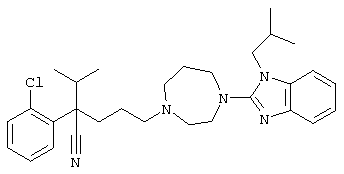
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 0,81 (д, J=8,1 Гц, 6Н), 1,08-1,30 (м, 1Н), 1,20 (д, J=7,0 Гц, 3Н), 1,50-1,70 (м, 1Н), 1,77-1,20 (м, 2Н), 2,00-2,32 (м, 4Н), 2,40-2,52 (м, 2Н), 2,60-2,67 (м, 2Н), 2,67-2,73 (м, 2Н), 3,48-3,60 (м, 4Н), 3,81 (д, J=7,3 Гц, 2Н), 7,05-7,35 (м, 5Н), 7,3035-7,40 (м, 1Н), 7,51-7,56 (м, 1Н), 7,72-7,79 (м, 1Н).
Гидрохлорид:
ESI-MC (m/e): 506 (M[34Cl]+H), 508 (M[36Cl]+H).
Пример 144
1-Изопропил-4-[4-(1H-бензо[d]имидaзoл-2-ил)пиперазино]-1-фенилбутилцианид
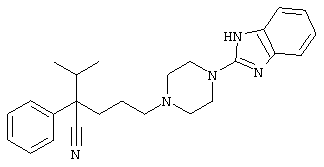
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,04-1,25 (м, 1Н), 1,20 (д, J=6,6 Гц, 3Н), 1,50-1,70 (м, 1Н), 1,87-1,99 (м, 1Н), 2,05-2,23 (м, 2Н), 2,25-2,40 (м, 2Н), 2,40-2,47 (м, 4Н), 3,42-3,58 (м, 4Н), 7,00-7,40 (м, 9Н).
Гидрохлорид:
ESI-MC (m/e): 402 (М+Н).
Пример 145
1-Изопропил-4-[4-(1-метил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-фенилбутилцианид
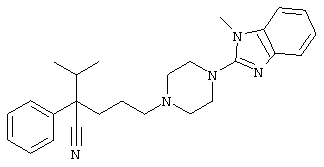
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,10-1,30 (м, 1Н), 1,21 (д, J=6,8 Гц, 3H), 1,50-1,70 (м, 1Н), 1,92-2,03 (м, 1Н), 2,08-2,25 (м, 2Н), 2,28-2,45 (м, 2Н), 2,45-2,56 (м, 4Н), 3,25-3,35 (м, 4Н), 3,59 (с, 3Н), 7,02-7,62 (м, 9Н).
Гидрохлорид:
ESI-MC (m/e): 416 (М+Н).
Пример 146
1-Изопропил-4-[4-(1-этил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-фенилбутилцианид
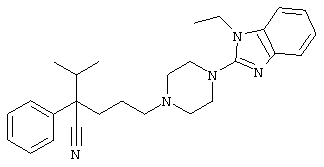
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,10-1,30 (м, 1Н), 1,21 (д, J=6,8 Гц, 3H), 1,44 (т, J=7,3 Гц, 3Н), 1,50-1,70 (м, 1Н), 1,92-2,03 (м, 1Н), 2,08-2,25 (м, 2Н), 2,28-2,45 (м, 2Н), 2,45-2,56 (м, 4Н), 3,20-3,35 (м, 4Н), 4,03 (кв, J=7,3 Гц, 2Н), 7,14-7,64 (м, 9Н).
Гидрохлорид:
ESI-MC (m/e): 430 (М+Н).
Пример 147
4-[4-(1-Этил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-изопропил-1-(2-тиенил)бутилцианид
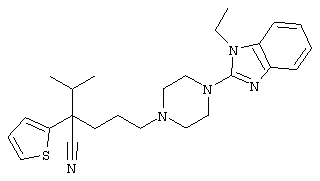
Свободное соединение:
Rf=0,35 (проявляющий растворитель: этилацетат:гексан = 1:1, Fuji Silysia Chemical Ltd. TCX на силикагеле NH).
Гидрохлорид:
ESI-MC (m/e): 436 (M+H).
Пример 148
4-[4-(1-Изобутил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-изопропил-1-(2-тиенил)бутилцианид
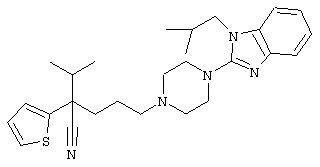
Свободное соединение:
Rf=0,4 (проявляющий растворитель: этилацетат:гексан = 1:1, Fuji Silysia Chemical Ltd. TCX на силикагеле NH).
Гидрохлорид:
ESI-MC (m/e): 464 (M+H).
Пример 149
1-Изопропил-4-[4-(1-изопропил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-фенилбутилцианид
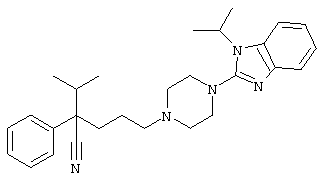
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,6 Гц, 3Н), 1,10-1,25 (м, 1Н), 1,21 (д, J=6,6 Гц, 3Н), 1,50-1,68 (м, 7Н), 1,90-2,04 (м, 1Н), 2,05-2,24 (м, 2Н), 2,25-2,45 (м, 2Н), 2,45-2,53 (м, 4Н), 3,15-3,25 (м, 4Н), 4,56-4,68 (м, 1Н), 7,09-7,19 (м, 2Н), 7,25-7,33 (м, 1Н), 7,34-7,42 (м, 5Н), 7,60-7,64 (м, 1Н).
Гидрохлорид:
ESI-MC (m/e): 444 (M+H).
Пример 150
4-[4-(1Н-Бензо[d]имидазол-2-ил)-1,4-диазепан-1-ил]-1-изопропил-1-фенилбутилцианид
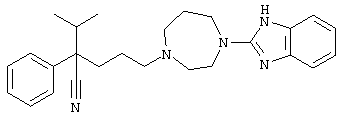
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,74 (д, J=6, 6 Гц, 3Н), 1,00-1,15 (м, 1Н), 1,14 (д, J=6,6 Гц, 3Н), 1,40-1,50 (м, 1Н), 1,78-1,93 (м, 3Н), 2,00-2,17 (м, 2Н), 2,30-2,40 (м, 2Н), 2,45-2,55 (м, 2Н), 2,57-2,64 (м, 2Н), 3,57-3,63 (м, 4Н), 6,96-7,52 (м, 9Н).
Гидрохлорид:
ESI-MC (m/e): 416 (М+Н).
Пример 151
4-[4-(1-Метил-1Н-бензо[d]имидазол-2-ил)-1,4-диазепан-1-ил]-1-изопропил-1-фенилбутилцианид
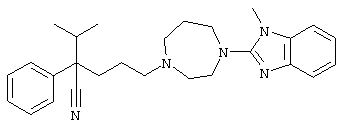
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,76 (д, J=6,8 Гц, 3Н), 1,07-1,17 (м, 1Н), 1,18 (д, J=6,6 Гц, 3Н), 1,45-1,60 (м, 1Н), 1,76-2,25 (м, 5Н), 2,40-2,50 (м, 2Н), 2,60-2,67 (м, 2Н), 2,68-2,76 (м, 2Н), 3,53-3,63 (м, 4Н), 3,57 (с, 3Н), 7,08-7,54 (м, 9Н).
Гидрохлорид:
ESI-MC (m/e): 430 (М+Н).
Пример 152
4-[4-(1-Этил-1Н-бензо[d]имидазол-2-ил)-1,4-диазепан-1-ил]-1-изопропил-1-фенилбутилцианид
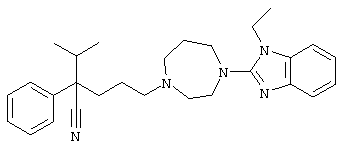
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1, 05-1,17 (м, 1Н), 1,19 (д, J=6,6 Гц, 3Н), 1,40 (т, J=7,2 Гц, 3Н), 1,47-1,62 (м, 1Н), 1,76-2,23 (м, 5Н), 2,40-2,50 (м, 2Н), 2,60-2,67 (м, 2Н), 2,68-2,76 (м, 2Н), 3,51-3,63 (м, 4Н), 4,02 (д, J=7,2 Гц, 3Н), 7,06-7,54 (м, 9Н).
Гидрохлорид:
ESI-MC (m/e): 444 (М+Н).
Пример 153
1-Изопропил-4-[4-(1-этил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-(4-фторфенил)бутилцианид
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 1,13-1,23 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,44 (т, J=7,1 Гц, 3Н), 1,56-1,66 (м, 1Н), 1,89-1,97 (м, 1Н), 2,04-2,22 (м, 2Н), 2,34-2,41 (м, 2Н), 2,50-2,51 (м, 4Н), 3,26-3,29 (м, 4Н), 4,01-4,07 (м, 2Н), 7,05-7,10 (м, 2Н), 7,14-7,25 (м, 3Н), 7,34-7,38 (м, 2Н), 7,60-7,62 (м, 1Н).
Пример 154
1-Изопропил-4-[4-(1-бензил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-(4-фторфенил)бутилцианид
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6, 6 Гц, 3Н), 1,08-1,15 (м, 1H), 1,18 (д, J=6,6 Гц, 3Н), 1,53-1,57 (м, 1Н), 1,85-1,93 (м, 1H), 2,02-2,19 (м, 2Н), 2,29-2,38 (м, 2Н), 2,42 (м, 4Н), 3,21-3,24 (м, 4Н), 5,20 (с, 2Н), 6,99-7,11 (м, 4Н), 7,15-7,21 (м, 3Н), 7,26-7,35 (м, 5Н), 7,62-7,65 (м, 1H).
Пример 155
1-Изопропил-4-[4-(1-изобутил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-(4-фторфенил)бутилцианид
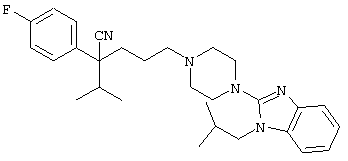
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6,8 Гц, 3Н), 0,82-0,85 (м, 6Н), 1,12-1,25 (м, 1H), 1,20 (д, J=6,6 Гц, 3Н), 1,57-1,63 (м, 1H), 1,90-1,98 (м, 1H), 2,04-2,12 (м, 1H), 2,14-2,42 (м, 4Н), 2,48 (м, 4Н), 3,23-3,25 (м, 4Н), 3,81 (д, J=7,3 Гц, 2Н), 7,05-7,20 (м, 2Н), 7,21-7,23 (м, 3Н), 7,33-7,38 (м, 2Н), 7,60-7,63 (м, 1H).
Пример 156
1-Изопропил-4-[4-(1-изобутил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-(3-фторфенил)бутилцианид
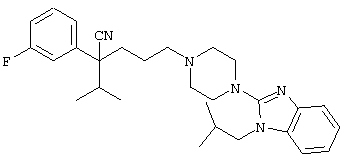
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77-0,89 (м, 9Н), 1,13-1,26 (м, 1Н), 1,21 (д, J=6,6 Гц, 3Н), 1,58-1,65 (м, 1Н), 1,90-1,98 (м, 1Н), 2,04-2,41 (м, 5Н), 2,41-2,50 (м, 4Н), 3,23-3,25 (м, 4Н), 3,80 (д, J=7,5 Гц, 2Н), 6,98-7,03 (м, 1Н), 7,08-7,23 (м, 5Н), 7,33-7,39 (м, 1Н), 7,60-7,63 (м, 1Н).
Пример 157
1-Изопропил-4-[4-(1-изобутил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-(2-фторфенил)бутилцианид
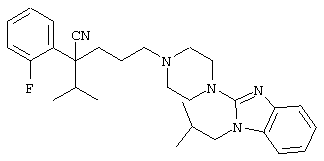
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,80-0,88 (м, 9Н), 1,15-1,25 (м, 1Н), 1,23 (д, J=6,6 Гц, 3Н), 1,58-1,64 (м, 1Н), 2,04-2,16 (м, 1Н), 2,25-2,51 (м, 9Н), 3,22-3,25 (м, 4Н), 3,80 (д, J=7,5 Гц, 2Н), 7,02-7,08 (м, 1Н), 7,13-7,21 (м, 4Н), 7,29-7,33 (м, 1Н), 7,58-7,62 (м, 2Н).
Пример 158
1-Изопропил-4-[4-(1-метил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-(3-фторфенил)бутилцианид
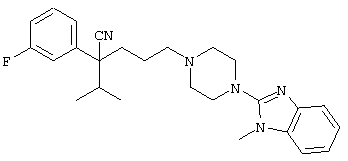
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,80 (д, J=6,8 Гц, 3Н), 1,15-1,27 (м, 1Н), 1,22 (д, J=6,8 Гц, 3Н), 1,58-1,66 (м, 1Н), 1,89-1,97 (м, 1Н), 2,01-2,24 (м, 2Н), 2,34-2,41 (м, 2Н), 2,51-2,53 (м, 4Н), 3,29-3,32 (м, 4Н), 3,59 (с, 3Н), 6,98-7,04 (м, 1Н), 7,08-7,21 (м, 5Н), 7,33-7,39 (м, 1Н), 7,58-7,61 (м, 1Н).
Пример 159
1-Изопропил-4-[4-(1-этил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-(3-фторфенил)бутилцианид
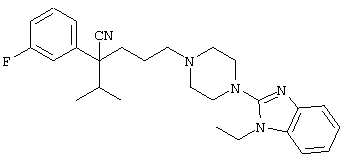
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,80 (д, J=6,8 Гц, 3Н), 1,13-1,28 (м, 1Н), 1,22 (д, J=6,8 Гц, 3Н), 1,44 (т, J=7,1 Гц, 3Н), 1,58-1,66 (м, 1Н), 1,89-1,97 (м, 1Н), 2,04-2,24 (м, 2Н), 2,33-2,41 (м, 2Н), 2,51-2,52 (м, 4Н), 3,27-3,30 (м, 4Н), 4,01-4,07 (м, 2Н), 6,98-7,04 (м, 1Н), 7,08-7,27 (м, 5Н), 7,33-7,39 (м, 1Н), 7,59-7,62 (м, 1Н).
Пример 160
1-Изопропил-4-[4-(1-бензил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-(3-фторфенил)бутилцианид
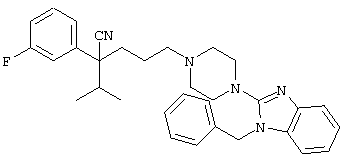
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,78 (д, J=6, 6 Гц, 3Н), 1,08-1,18 (м, 1Н), 1,20 (д, J=6,8 Гц, 3Н), 1,54-1,65 (м, 1Н), 1,84-1,92 (м, 1Н), 2,04-2,20 (м, 2Н), 2,28-2,36 (м, 2Н), 2,38-2,43 (м, 4Н), 3,22-3,25 (м, 4Н), 5,20 (с, 2Н), 6,96-7,01 (м, 2Н), 7,05-7,10 (м, 2Н), 7,14-7,21 (м, 4Н), 7,26-7,36 (м, 4Н), 7,63-7,64 (м, 1Н).
Пример 161
1-Изопропил-4-[4-(1-этил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-(2-фторфенил)бутилцианид
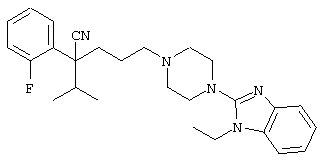
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,81 (д, J=6,8 Гц, 3Н), 1,15-1,28 (м, 1Н), 1,23 (д, J=6,8 Гц, 3Н), 1,44 (т, J=7,1 Гц, 3Н), 1,59-1,68 (м, 1Н), 2,04-2,16 (м, 1Н), 2,25-2,54 (м, 8Н), 3,27-3,30 (м, 4Н), 4,00-4,06 (м, 2Н), 7,02-7,08 (м, 1Н), 7,13-7,24 (м, 4Н), 7,29-7,34 (м, 1Н), 7,58-7,63 (м, 2Н).
Пример 162
Синтез 1-изопропил-4-[4-(1-метил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-(2-толил)бутилцианид
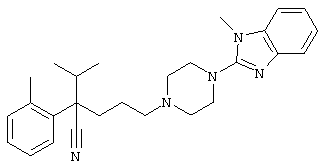
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,77 (д, J=6,8 Гц,3Н), 1,07 (д, J=6,8 Гц, 3Н), 1,25-1,40 (м, 1Н), 1,53-1,70 (м, 1Н), 1,97-2,10 (м, 1Н), 2,20-2,35 (м, 1Н), 2,40-2,50 (м, 1Н), 2,47 (с, 3Н), 3,05-3,20 (м, 2Н), 3,10-3,30 (м, 4Н), 3,33-3,50 (м, 4Н), 3,59 (с, 3Н), 7,07-7,15 (м, 2Н), 7,20-7,29 (м, 3Н), 7,34-7,46 (м, 3Н).
Пример 163
1-Изопропил-4-[4-(1-метил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-(4-фторфенил)бутилцианид
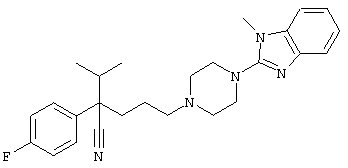
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,66 (д, J=6,4 Гц, 3Н), 1,10 (д, J=6,4 Гц, 3Н), 1,10-1,30 (м, 1Н), 1,50-1,67 (м, 1Н), 1,95-2,30 (м, 2Н), 2,15-2,27 (м, 1Н), 2,95-3,20 (м, 2Н), 3,10-3,30 (м, 4Н), 3,35-3,50 (м, 4Н), 3,59 (с, 3Н), 7,07-7,15 (м, 2Н), 7,28 (т, J=8,8 Гц, 2Н), 7,34-7,46 (м, 2Н), 7,43-7,50 (м, 2Н).
Пример 164
1-Изопропил-4-[4-(1-этил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-(2-хлорфенил)бутилцианид
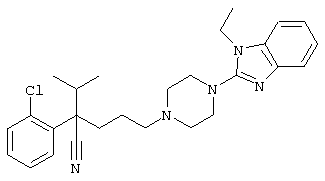
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,73 (д, J=6,8 Гц, 3Н), 1,12 (д, J=6,8 Гц, 3Н), 1,10-1,35 (м, 1Н), 1,30 (т, J=7,2 Гц, 3Н), 1,50-1,68 (м, 1H), 2,00-2,15 (м, 1Н), 2,50-2,70 (м, 1Н), 2,78-2,90 (м, 1H), 3,00-3,20 (м, 2Н), 3,05-3,30 (м, 4Н), 3,25-3,45 (м, 4Н), 4,06 (кв, J=7,2 Гц, 2Н), 7,06-7,15 (м, 2Н), 7,38-7,49 (м, 4Н), 7,54 (дд, J=7,6 Гц, 2,0 Гц, 1H), 7,65 (дд, J=7,6 Гц, 2,0 Гц, 1H).
Пример 165
1-Изопропил-4-[4-(1-изобутил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-(2-хлорфенил)бутилцианид
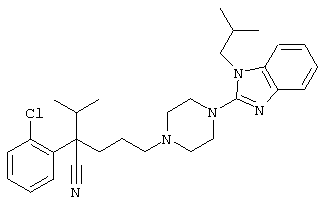
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,75 (д, J=6,8 Гц, 9Н), 1,12 (д, J=6,4 Гц, 3Н), 1,15-1,45 (м, 1H), 1,50-1,70 (м, 1H), 2,00-2,25 (м, 2Н), 2,50-2,65 (м, 1H), 2,75-2,90 (м, 1H), 3,00-3,30 (м, 2Н), 3,00-3,30 (м, 4Н), 3,20-3,45 (м, 4Н), 3,87 (д, J=7,2 Гц, 2Н), 7,00-7,18 (м, 2Н), 7,38-7,48 (м, 4Н), 7,54 (д, J=7,6 Гц, 1H), 7,64 (д, J=7,6 Гц, 1H).
Пример 166
1-Изопропил-4-[4-(1-метил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-(2-метоксифенил)бутилцианид
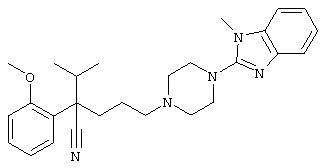
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,68 (д, J=6,8 Гц, 3Н), 1,09 (д, J=6,8 Гц, 3Н), 1,10-1,30 (м, 1Н), 1,50-1,65 (м, 1Н), 1,90-2,05 (м, 1Н), 2,35-2,50 (м, 1Н), 2,57-2,70 (м, 1Н), 2,95-3,20 (м, 2Н), 3,05-3,25 (м, 4Н), 3,30-3,50 (м, 4Н), 3,59 (с, 3Н), 3,81 (с, 3Н), 6,98-7,04 (м, 1Н), 7,07-7,15 (м, 3Н), 7,33-7,43 (м, 4Н).
Пример 167
1-Изопропил-4-[4-(1-этил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-(2-метоксифенил)бутилцианид
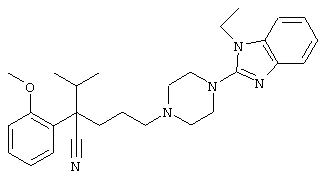
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,67 (д, J=6,4 Гц, 3Н), 1,08 (д, J=6,8 Гц, 3Н), 1,10-1,30 (м, 1Н), 1,30 (т, J=7,2 Гц, 3Н), 1,45-1,60 (м, 1Н), 1,90-2,05 (м, 1Н), 2,35-2,50 (м, 1Н), 2,58-2,70 (м, 1Н), 2,90-3,10 (м, 2Н), 3,00-3,20 (м, 4Н), 3,25-3,45 (м, 4Н), 3,81 (с, 3Н), 4,06 (кв, J=7,2 Гц, 2Н), 7,01 (т, J=7,6 Гц, 1H), 7,06-7,14 (м, 3Н), 7,36 (т, J=7,6 Гц, 1H), 7,35-7,45 (м,3Н).
Пример 168
1-Изопропил-4-[4-(1-изобутил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-(2-метоксифенил)бутилцианид
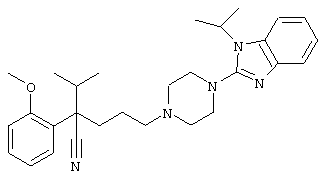
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,67 (д, J=6,8 Гц, 3Н), 0,74 (д, J=6,4 Гц, 6Н), 1,09 (д, J=6,4 Гц, 3Н), 1,05-1,30 (м, 1Н), 1,45-1,65 (м, 1Н), 1,90-2,03 (м, 1Н), 2,10-2,20 (м, 1Н), 2,35-2,50 (м, 1Н), 2,57-2,70 (м, 1Н), 3,00-3,20 (м, 2Н), 3,10-3,25 (м, 4Н), 3,25-3,45 (м, 4Н), 3,81 (с, 3Н), 3,86 (д, J=7,6 Гц, 2Н), 7,01 (тд, J=7,6 Гц, 2,0 Гц, 1Н), 7,06-7,14 (м, 3Н), 7,33-7,46 (м, 4Н).
Пример 169
1-Изопропил-4-[4-(1-бензил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-(2-метоксифенил)бутилцианид
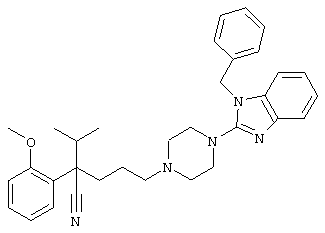
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,67 (д, J=6,8 Гц, 3Н), 1,08 (д, J=6,8 Гц, 3Н), 1,10-1,25 (м, 1Н), 1,45-1,65 (м, 1Н), 1,90-2,00 (м, 1Н), 2,33-2,45 (м, 1Н), 2,55-2,70 (м, 1Н), 2,90-3,20 (м, 2Н), 3,10-3,25 (м, 4Н), 3,25-3,45 (м, 4Н), 3,79 (с, 3Н), 5,30 (с, 2Н), 6,97-7,20 (м, 7Н), 7,21-7,47 (м, 6Н).
Пример 170
1-Изопропил-4-[4-(1-этил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-(2-метилфенил)бутилцианид
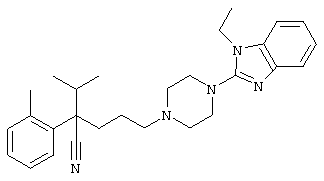
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,87 (д, J=6,8 Гц, 3Н), 1,19 (д, J=6,8 Гц, 3Н), 1,20-1,28 (м, 1Н), 1,44 (д, J=7,3 Гц, 3Н), 1,55-1,70 (м, 1Н), 2,06-2,20 (м, 1Н), 2,35-2,45 (м, 4Н), 2,45-2,58 (м, 7Н), 3,25-3,35 (м, 4Н), 4,04 (кв, J=7,3 Гц, 2Н), 7,15-7,23 (м, 6Н), 7,57-7,68 (м, 1Н), 7,59-7,60 (м, 1Н).
Гидрохлорид:
ESI-MC (m/e): 444 (М+Н).
Пример 171
1-Изопропил-4-[4-(1-бензил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-(2-метилфенил)бутилцианид
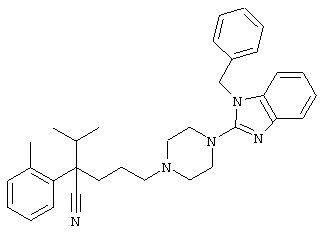
Свободное соединение:
1H-ЯМР (400 МГц, СDСl3) δ 0,86 (д, J=6,8 Гц, 3Н), 1,17 (д, J=6,8 Гц, 3Н), 1,17-1,25 (м, 1Н), 1,50-1,65 (м, 1Н), 2,00-2,10 (м, 1Н), 2,20-2,48 (м, 8Н), 2,49 (с, 3Н), 3,19-3,24 (м, 4Н), 5,19 (с, 2Н), 6,99-7,01 (м, 1Н), 7,08-7,21 (м, 8Н), 7,27-7,38 (м, 2Н), 7,43-7,55 (м, 1Н), 7,63-7,65 (м, 1Н).
Гидрохлорид:
ESI-MC (m/e): 506 (М+Н).
Пример 172
1-Изопропил-4-[4-(1-изобутил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-(2-метилфенил)бутилцианид
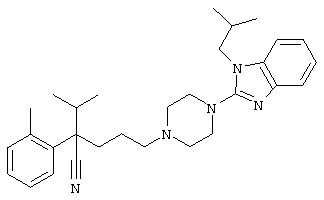
Свободное соединение:
1H-ЯМР (400 МГц, СDСl3) δ 0,83 (д, J=4,0 Гц, 3Н), 0,85 (д, J=4,0 Гц, 3Н), 0,87 (д, J=6,б Гц, 3Н), 1,19 (д, J=6,6 Гц, 3Н), 1,20-1,29 (м, 1Н), 1,54-1,65 (м, 1Н), 2,05-2,16 (м, 1Н), 2,24-2,51 (м, 9Н), 2,52 (с, 3Н), 3,20-3,25 (м, 4Н), 3,80 (д, J=7,5 Гц, 2Н), 7,12-7,22 (м, 6Н), 7,48-7,56 (м, 1Н), 7,59-7,60 (м, 1Н).
Гидрохлорид:
ESI-MC (m/e): 472 (М+Н).
Пример 173
1-[4-Циано-4-(5-циано-2-тиенил)-5-метилгексил]-(3R)-3-[N-(2-цианоэтил)-N-бензиламино]пирролидин
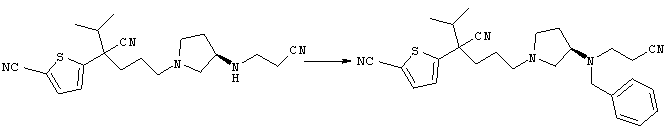
В дихлорметане (8 мл) растворяют 300 мг (0,81 ммоль) 1-[4-циано-4-(5-циано-2-тиенил)-5-метилгексил]-(3R)-3-[N-(2-цианоэтил)амино]пирролидина, полученного в справочном примере 81, и поочередно добавляют 98,9 мг (0,93 ммоль) бензальдегида, 0,09 мл (1,62 ммоль) уксусной кислоты и 258 мг (1,22 ммоль) триацетоксиборогидрида натрия. После окончания реакции реакционный раствор подщелачивают 5 н. раствором гидроксида натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают, получая сырой продукт. Сырой продукт обрабатывают 25 г силикагеля Cromatorex NH (этилацетат:гексан = 25% этилацетата), получая при этом 220 мг (0,48 ммоль, 59,1%) указанного в заголовке соединения в виде бесцветного сиропа. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, СDСl3) δ 0,90 (д, J=6, 4 Гц, 3Н), 1,19 (д, J=6,4 Гц, 3Н), 1,16-1,29 (м, 1Н), 1,54-1,66 (м, 1Н), 1,70-1,84 (м, 2Н), 1,91-2,08 (м, 2Н), 2,17-2,37 (м, 5Н), 2,38-2,51 (м, 2Н), 2,51-2,58 (м, 1Н), 2,61-2,68 (м, 1Н), 2,78-2,94 (м, 2Н), 3,40-3,50 (м, 1Н), 3,60 (д, J=14 Гц, 1Н), 3,71 (д, J=14 Гц, 1Н), 7,13 (д, J=3,6 Гц, 1Н), 7,32-7,39 (м, 5Н), 7,50 (д, J=3,6 Гц, 1Н).
Диастереомер указанного в заголовке соединения получают способом по примеру 173 из 4-циано-4-(5-циано-2-тиенил)-5-метилгексанола (далее именуемого "спирт В"), синтезированного способом по справочным примерам 104 и 105 из 4-циано-4-(2-тиенил)-5-метилгексановой кислоты, полученной в справочном примере 103, и (3R)-3-трет-бутоксикарбониламинопирролидина. Аналогичным образом зеркальный изомер указанного в заголовке соединения синтезируют способом по примеру 173 из спирта В и (3S)-3-трет-бутоксикарбониламинопирролидина.
Пример 174
1-[4-Циано-4-(5-циано-2-тиенил)-5-метилгексил]-(3R)-3-[N-(2-цианоэтил)-N-(2-тиенилметил)амино]пирролидин
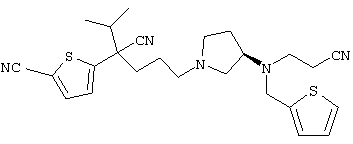
Указанное в заголовке соединение синтезируют способом по примеру 173 из 1-[4-циано-4-(5-циано-2-тиенил)-5-метилгексил]-(3R)-3-[N-(2-цианоэтил)амино]пирролидина, полученного в справочном примере 81, и 2-тиофенкарбоксиальдегида. Физико-химические данные соединения приведены ниже.
Выход 46,7%.
1H-ЯМР (400 МГц, СDСl3) δ 0,90 (д, J=6,8 Гц, 3Н), 1,19 (д, J=6,4 Гц, 3Н), 1,16-1,29 (м, 1Н), 1,54-1,67 (м, 1Н), 1,67-1,84 (м, 2Н), 1,95-2,09 (м, 2Н), 2,17-2,35 (м, 3Н), 2,35-2,56 (м, 5Н), 2,61-2,70 (м, 1Н), 2,80-2,96 (м, 2Н), 3,44-3,54 (м, 1Н), 3,84 (д, J=15,0 Гц, 1Н), 3,92 (д, J=15,0 Гц, 1Н), 6,92-7,04 (м, 2Н), 7,13 (д, J=4,0 Гц, 1Н), 7,23-7,31 (м, 1Н), 7,51 (д, J=4,0 Гц, 1Н).
Пример 175
1-[4-Циано-4-(5-циано-2-тиенил)-5-метилгексил]-(3S)-3-[N-(2-цианоэтил)-N-бензиламино]пирролидин
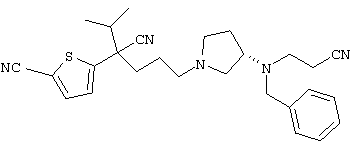
Указанное в заголовке соединение синтезируют описанными ниже двумя способами (способы синтеза А и В).
Способ синтеза А
(1) (3S)-3-[N-(2-Цианоэтил)-N-бензиламино]пирролидин
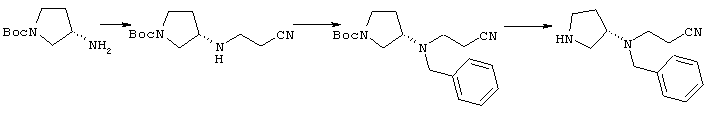
(3S)-3-[N-(2-Цианоэтил)-N-бензиламино]-1-(трет-бутоксикарбонил)пирролидин синтезируют способами по справочному примеру 81 и примеру 173 из (3S)-3-амино-1-(трет-бутоксикарбонил)пирролидина. Указанное в заголовке соединение получают, снимая защиту с Вос-группы способом по справочному примеру 80 (выход 78,2%, 3 стадии). Физико-химические данные соединения приведены ниже.
Физико-химические данные (3S)-3-[N-(2-цианоэтил)-N-бензиламино]-1-(трет-бутоксикарбонил)пирролидина:
1H-ЯМР (400 МГц, CDCl3) δ 1,46 (с, 9Н), 1,77-1,95 (м, 1Н), 1,98-2,12 (м, 1Н), 2,32 (т, J=6,8 Гц, 2Н), 2,87 (т, J=6,8 Гц, 2Н), 3,10-3,78 (м, 7Н), 7,27-7,39 (м, 5Н).
Физико-химические данные (3S)-3-[N-(2-цианоэтил)-N-бензиламино]пирролидина:
1H-ЯМР (400 МГц, CDCl3) δ 1,66-1,78 (м, 1Н), 1,88-2,02 (м, 1Н), 2,31 (т, J=6,8 Гц, 2Н), 2,78-2,95 (м, 4Н), 3,02-3,12 (м, 2Н), 3,32-3,41 (м, 1Н), 2,87 (т, J=6,8 Гц, 2Н), 3,64 (д, J=14 Гц, 1Н), 3,71 (т, J=14 Гц, 1Н), 7,27-7,38 (м, 5Н).
(2) 1-[4-Циано-4-(5-циано-2-тиенил)-5-метилгексил]-(3S)-3-[N-(2-цианоэтил)-N-бензиламино]пирролидин
Оптически активное соединение, 4-циано-4-(5-циано-2-тиенил)-5-метилгексилиодид (иодид С, оптически активное вещество) синтезируют из спирта В способом по примеру 77(1). Указанное в заголовке соединение синтезируют способом по примеру 77(2) из иодида С и (3S)-3-[N-(2-цианоэтил)-N-бензиламино]пирролидина, полученного на стадии (1). Физико-химические данные соединения приведены ниже.
Выход 90,6%.
ESI-MC: 460 (М+Н)+.
1H-ЯМР (400 МГц, CDCl3) δ 0,91 (д, J=6,8 Гц, 3Н), 1,19 (д, J=6,8 Гц, 3Н), 1,16-1,30 (м, 1Н), 1,56-1,68 (м, 1Н), 1,70-1,81 (м, 2Н), 1,93-2,10 (м, 2Н), 2,21-2,44 (м, 7Н), 2,57-2,67 (м, 2Н), 2,80-2,95 (м, 2Н), 3,39-3,48 (м, 1Н), 3,62 (д, J=14 Гц, 1Н), 3,69 (д, J=14 Гц, 1Н), 7,15 (д, J=4,0 Гц, 1Н), 7,23-7,37 (м, 5Н), 7,52 (д, J=4,0 Гц, 1Н).
Способ синтеза В
Указанное в заголовке соединение синтезируют способом по примеру 173 из вышеуказанного иодида С (или спирта В) и (3S)-3-трет-бутоксикарбониламинопирролидина.
Пример 176
1-[4-Циано-4-(2-тиенил)-5-метилгексил]-(3S)-3-[N-(2-цианоэтил)-N-бензиламино]пирролидин
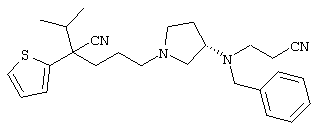
Оптически активное соединение, 4-циано-4-(2-тиенил)-5-метилгексилиодид (иодид D, оптически активное вещество) синтезируют из спирта А способом по примеру 77(1). Указанное в заголовке соединение синтезируют способом по примеру 75 из иодида D и (3S)-3-[N-(2-цианоэтил)-N-бензиламино]пирролидина, полученного в "способе синтеза А" (1) по примеру 175. Физико-химические данные указанного в заголовке соединения приведены ниже.
Выход 97%.
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,8 Гц, 3Н), 1,17 (д, J=6,4 Гц, 3Н), 1,20-1,35 (м, 1Н), 1,55-1,68 (м, 1Н), 1,69-1,82 (м, 2Н), 1,92-2,10 (м, 2Н), 2,17-2,43 (м, 7Н), 2,54-2,66 (м, 2Н), 2,87 (т, J=6,8 Гц, 2Н), 3,37-3,46 (м, 1Н), 3,62 (д, J=14 Гц, 1Н), 3,68 (д, J=14 Гц, 1Н), 6,95 (дд, J=3,6 Гц, 5,2 Гц, 1Н), 7,15 (дд, J=1,2 Гц, 3,6 Гц, 1Н), 7,23-7,39 (м, 6Н).
Пример 177
1-[4-Циано-4-(2-тиенил)-5-метилгексил]-(3S)-3-[N-(2-цианоэтил)-N-(3-цианобензил)амино]пирролидин
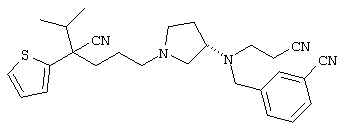
Указанное в заголовке соединение синтезируют способом по примеру 75 из иодида D и (3S)-3-[N-(2-цианоэтил)-N-(3-цианобензил)амино]пирролидина, полученного в "способе синтеза А" (1) по примеру 175. Физико-химические данные соединения приведены ниже.
Выход 82%.
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,4 Гц, 3Н), 1,16 (д, J=6,8 Гц, 3Н), 1,22-1,34 (м, 1Н), 1,54-1,67 (м, 1Н), 1,67-1,80 (м, 2Н), 1,93-2,09 (м, 2Н), 2,16-2,27 (м, 2Н), 2,27-2,43 (м, 5Н), 2,59-2,72 (м, 2Н), 2,88 (т, J=6,8 Гц, 2Н), 3,34-3,43 (м, 1Н), 3,68 (д, J=15 Гц, 1Н), 3,74 (д, J=15 Гц, 1Н), 6,96 (дд, J=3,6 Гц, 5,2 Гц, 1Н), 7,11 (дд, J=1,2 Гц, 3,6 Гц, 1Н), 7,27 (дд, J=1,2 Гц, 5,2 Гц, 1Н), 7,41-7,48 (м, 1Н), 7,54-7,58 (м, 1Н), 7,62-7,66 (м, 2Н).
Пример 178
1-[4-Циано-4-(2-тиенил)-5-метилгексил]-4-[{3-метокси-(2R)-2-(2-пиридилокси)}пропил]пиперазин
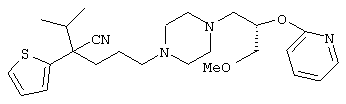
Указанное в заголовке соединение синтезируют способом по примеру 75 из иодида D и 1-[{3-метокси-(2R)-2-(2-пиридилокси)}пропил]пиперазина. Физико-химические данные полученного целевого соединения приведены ниже.
1H-ЯМР (400 МГц, CDCl3) δ 0,89 (д, J=6,8 Гц, 3Н), 1,17 (д, J=6,4 Гц, 3Н), 1,21-1,35 (м, 1Н), 1,55-1,69 (м, 1Н), 1,70-1,80 (м, 1Н), 2,00-2,18 (м, 2Н), 2,20-2,62 (м, 10Н), 2,62-2,72 (м, 2Н), 3,38 (с, 3Н), 3,60-3,70 (м, 2Н), 5,47-5,55 (м, 1Н), 6,71-6,78 (м, 1Н), 6,81-6,87 (м, 1Н), 6,94 (дд, J=3,6 Гц, 5,2 Гц, 1Н), 7,10 (дд, J=1,6 Гц, 3,6 Гц, 1Н), 7,25 (дд, J=1,6 Гц, 5,2 Гц, 1Н), 7,50-7,58 (м, 1Н), 8,09-8,13 (м, 1Н).
Пример 179
1-(6-Бром-2-пиридил)-(3R)-3-{N-[4-циано-4-(2-тиенил)-5-метилгексил]амино}пирролидин
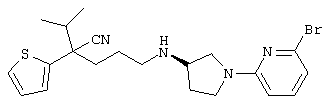
Указанное в заголовке соединение синтезируют способом по примеру 75 из иодида С (оптически активное соединение) и (3R)-3-{N-[4-циано-4-(2-тиенил)-5-метилгексил]амино}пирролидина.
Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,8 Гц, 3Н), 1,18 (д, J=6,8 Гц, 3Н), 1,23-1,36 (м, 1Н), 1,57-1,70 (м, 1Н), 1,73-1,83 (м, 2Н), 2,00-2,10 (м, 1Н), 2,10-2,24 (м, 2Н), 2,56-2,71 (м, 2Н), 3,14-3,22 (м, 1Н), 3,34-3,44 (м, 2Н), 3,49-3,58 (м, 1Н), 3,59-3,66 (м, 1Н ), 6,21 (д, J=8,0 Гц, 1Н), 6,65 (д, J=7,2 Гц, 1Н), 6,94 (дд, J=3,6 Гц, 5,2 Гц, 1Н), 7,11 (дд, J=1,2 Гц, 3,6 Гц, 1Н), 7,22 (дд, J=7,2 Гц, 8,0 Гц, 1Н), 7,26 (дд, J=1,2 Гц, 5,2 Гц, 1Н).
Пример 180
1-[4-Циано-4-(5-циано-2-тиенил)-5-метилгексил]-4-[2-(5-хлорбензоксазолил)метил]пиперазин
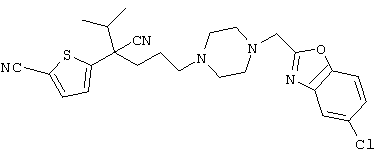
Указанное в заголовке соединение синтезируют способом по примеру 77 из 1-[4-циано-4-(5-циано-2-тиенил)-5-метилгексил]пиперазина и 2-хлорметил-5-хлорбензоксазола, полученного способом по примеру 83. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, CDCl3) δ 0,91 (д, J=6,8 Гц, 3Н), 1,20 (д, J=6,4 Гц, 3Н), 1,20-1,30 (м, 1Н), 1,58-1,71 (м, 1Н), 1,71-1,81 (м, 1Н), 2,00-2,10 (м, 1Н), 2,16-2,26 (м, 1Н), 2,34 (т, J=6,8 Гц, 2Н), 2,37-2,54 (м, 4Н), 2,54-2,73 (м, 4Н), 3,86 (с, 2Н), 7,14 (д, J=4,0 Гц, 1Н), 7,31 (дд, J=2,0 Гц, 8,4 Гц, 1Н), 7,45 (д, J=8,4 Гц, 1Н), 7,51 (д, J=4,0 Гц, 1Н), 7,68 (д, J=2,0 Гц, 1Н).
Пример 181
1-[4-Циано-4-(5-циано-2-тиенил)-5-метилгексил]-4-[2-(5-метилбензоксазолил)метил]пиперазин
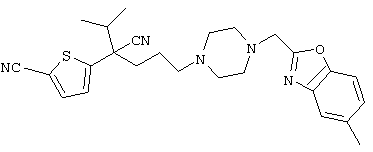
Аналогично примеру 180 из 1-[4-циано-4-(5-циано-2-тиенил)-5-метилгексил]пиперазина и 2-хлорметил-5-метилбензоксазола, полученного способом по примеру 83, синтезируют указанное в заголовке соединение способом по примеру 77. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, CDCl3) δ 0,91 (д, J=6,8 Гц, 3Н), 1,20 (д, J=6,4 Гц, 3Н), 1,20-1,30 (м, 1Н), 1,58-1,70 (м, 1Н), 1,70-1,81 (м, 1Н), 2,00-2,10 (м, 1Н), 2,16-2,26 (м, 1Н), 2,33 (т, J=6,8 Гц, 2Н), 2,46 (с, 3Н), 2,37-2,54 (м, 4Н), 2,55-2,73 (м, 4Н), 3,85 (с, 2Н), 7,12-7,16 (м, 1Н), 7,14 (д, J=4,0 Гц, 1Н), 7,39 (д, J=8,4 Гц, 1Н), 7,47-7,49 (м, 1Н), 7,51 (д, J=4,0 Гц, 1Н).
Пример 182
1-[4-Циано-4-(5-циано-2-тиенил)-5-метилгексил]-4-[2-бензотиазолилметил]пиперазин
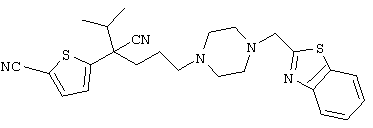
Аналогично примеру 180 указанное в заголовке соединение синтезируют способом по примеру 77 из 1-[4-циано-4-(5-циано-2-тиенил)-5-метилгексил]пиперазина, полученного в соответствии с примером 180, и 2-хлорметилбензотиазола, полученного по примеру 83. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, CDCl3) δ 0,92 (д, J=6,8 Гц, 3Н), 1,21 (д, J=6,8 Гц, 3Н), 1,20-1,32 (м, 1Н), 1,59-1,72 (м, 1Н), 1,72-1,83 (м, 1Н), 2,01-2,10 (м, 1Н), 2,18-2,28 (м, 1Н), 2,35 (т, J=7,4 Гц, 2Н), 2,35-2,52 (м, 4Н), 2,54-2,74 (м, 4Н), 3,95 (с, 2Н), 7,14 (д, J=3,6 Гц, 1Н), 7,33-7,39 (м, 1Н), 7,42-7,48 (м, 1Н), 7,51 (д, J=3,6 Гц, 1Н), 7,84-7,88 (м, 1Н), 7,94-7,99 (м, 1Н).
Пример 183
1-[4-Циано-4-(2-тиенил)-5-метилгексил]-4-[2-(5-трифторметил-2-пиридилокси)этил]пиперазин
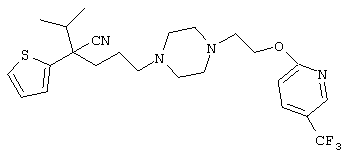
Целевое соединение синтезируют способом по примеру 75 из 4-циано-[4-(2-тиенил)-5-метилгексил]иодида и 1-[2-(5-трифторметил-2-пиридилокси)этил]пиперазина. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,4 Гц, 3Н), 1,18 (д, J=6,4 Гц, 3Н), 1,20-1,38 (м, 1Н), 1,55-1,70 (м, 1Н), 1,71-1,82 (м, 1Н), 2,00-2,10 (м, 1Н), 2,10-2,20 (м, 1Н), 2,31 (т, J=7,4 Гц, 2Н), 2,30-2,48 (м, 4Н), 2,48-2,65 (м, 4Н), 2,78 (т, J=6,0 Гц, 2Н), 4,48 (т, J=6,0 Гц, 2Н), 6,83 (д, J=8,8 Гц, 1Н), 6,94 (дд, J=3,6 Гц, 5,2 Гц, 1Н), 7,11 (дд, J=1,2 Гц, 3,6 Гц, 1Н), 7,75 (дд, J=2,4 Гц, 8,8 Гц, 1Н), 8,39-8,44 (м, 1Н).
Пример 184
1-[4-Циано-4-(5-циано-2-тиенил)-5-метилгексил]-4-[2-(5-трифторметил-2-пиридилокси)этил]пиперазин
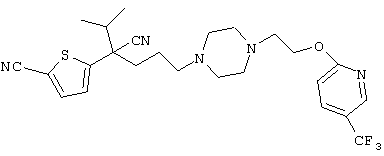
Указанное в заголовке соединение синтезируют способом по примеру 77 из 4-циано-4-(5-циано-2-тиенил)-5-метилгексилиодида и 1-[2-(5-трифторметил-2-пиридилокси)этил]пиперазина. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, CDCl3) δ 0,92 (д, J=6,4 Гц, 3Н), 1,21 (д, J=6,4 Гц, 3Н), 1,20-1,31 (м, 1Н), 1,60-1,82 (м, 2Н), 2,00-2,10 (м, 1Н), 2,17-2,28 (м, 1Н), 2,28-2,48 (м, 6Н), 2,48-2,65 (м, 4Н), 2,79 (т, J=6,0 Гц, 2Н), 4,49 (т, J=6,0 Гц, 2Н), 6,83 (д, J=8,8 Гц, 1H), 7,15 (д, J=4,0 Гц, 1H), 7,51 (д, J=4,0 Гц, 1Н), 7,76 (дд, J=2,4 Гц, 8,8 Гц, 1Н), 8,40-8,44 (м, 1Н).
Пример 185
1-[4-Циано-4-(2-тиенил)-5-метилгексил]-4-[2-(5-хлор-3-пиридилокси)этил]пиперазин
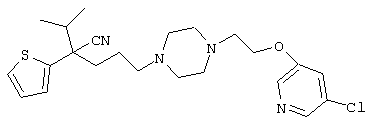
Указанное в заголовке соединение синтезируют способом по примеру 75 из 4-циано-4-(2-тиенил)-5-метилгексилиодида и 1-[2-(5-хлор-3-пиридилокси)этил]пиперазина. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,8 Гц, 3Н), 1,18 (д, J=6,4 Гц, 3Н), 1,20-1,37 (м, 1Н), 1,55-1,71 (м, 1Н), 1,71-1,82 (м, 1Н), 2,00-2,10 (м, 1Н), 2,10-2,21 (м, 1Н), 2,25-2,49 (м, 6Н), 2,49-2,65 (м, 4Н), 2,80 (т, J=5,6 Гц, 2Н), 4,12 (т, J=5,6 Гц, 2Н), 6,94 (дд, J=3,6 Гц, 5,2 Гц, 1Н), 7,11 (дд, J=1,2 Гц, 3,6 Гц, 1Н), 7,22 (т, 2,0 Гц, 1Н), 7,24-7,28 (м, 1Н), 8,18 (д, J=2,0 Гц, 1Н), 8,20 (д, J=2,0 Гц, 1Н).
Пример 186
1-[4-Циано-4-(5-циано-2-тиенил)-5-метилгексил]-4-[2-(5-хлор-3-пиридилокси)этил]пиперазин
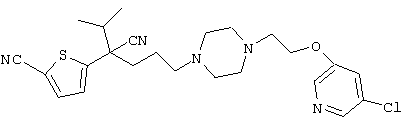
Указанное в заголовке соединение синтезируют способом по примеру 77 из 4-циано-4-(5-циано-2-тиенил)-5-метилгексилиодида и 1-[2-(5-хлор-3-пиридилокси)этил]пиперазина. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, CDCl3) δ 0,92 (д, J=6,4 Гц, 3Н), 1,21 (д, J=6,4 Гц, 3Н), 1,20-1,30 (м, 1Н), 1,60-1,72 (м, 1Н), 1,72-1,82 (м, 1Н), 2,00-2,11 (м, 1Н), 2,17-2,28 (м, 1Н), 2,28-2,48 (м, 6Н), 2,49-2,65 (м, 4Н), 2,81 (т, J=5,6 Гц, 2Н), 4,13 (т, J=5,6 Гц, 2Н), 7,15 (д, J=4,0 Гц, 1Н), 7,21-7,23 (м, 1Н), 7,51 (д, J=4,0 Гц, 1Н), 8,19 (д, J=1,6 Гц, 1Н), 8,20 (д, J=2,8 Гц, 1Н).
Пример 187
1-[4-Циано-4-(2-тиенил)-5-метилгексил]-4-[2-(5-хлор-3-пиридилокси)этил]пиперидин
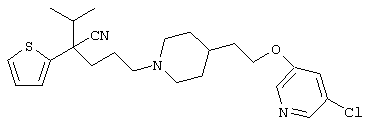
Указанное в заголовке соединение синтезируют способом по примеру 75 из 4-циано-4-(2-тиенил)-5-метилгексилиодида и 4-[2-(5-хлор-3-пиридилокси)этил]пиперидина. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,8 Гц, 3Н), 1,18 (д, J=6,8 Гц, 3Н), 1,20-1,38 (м, 2Н), 1,40-1,56 (м, 1Н), 1,60-1,93 (м, 9Н), 2,00-2,20 (м, 2Н), 2,25-2,35 (м, 2Н), 2,77-2,87 (м, 2Н), 4,02 (т, J=6,4 Гц, 2Н), 6,95 (дд, J=3,6 Гц, 5,2 Гц, 1Н), 7,11 (дд, J=1,2 Гц, 3,6 Гц, 1Н), 7,17-7,20 (м, 1Н), 7,24-7,28 (м, 1Н), 8,16-8,20 (м, 2Н).
Пример 188
1-[4-Циано-4-(2-тиенил)-5-метилгексил]-4-(3-пиридиламино)пиперидин
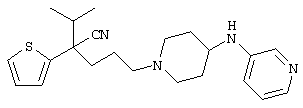
Указанное в заголовке соединение синтезируют способом по примеру 75 из 4-циано-4-(2-тиенил)-5-метилгексилиодида и 4-(3-пиридиламино)пиперидина. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,8 Гц, 3Н), 1,18 (д, J=6,8 Гц, 3Н), 1,24-1,38 (м, 1Н), 1,38-1,50 (м, 2Н), 1,58-1,71 (м, 1Н), 1,73-1,83 (м, 1Н), 1,95-2,21 (м, 5Н), 2,29-2,36 (м, 2Н), 2,72-2,81 (м, 2Н), 3,20-3,31 (м, 1Н), 3,48-3,56 (м, 1Н), 6,81-6,86 (м, 2Н), 6,94 (дд, J=3,6 Гц, 5,2 Гц, 1Н), 7,05 (дд, J=4,8 Гц, 12,8 Гц, 1Н), 7,11 (дд, J=1,2 Гц, 3,6 Гц, 1Н), 7,26 (дд, J=1,2 Гц, 5,2 Гц, 1Н), 7,92 (дд, J=1,6 Гц, 4,8 Гц, 1Н), 7,99 (д, J=2,1 Гц, 1Н).
Пример 189
1-[4-Циано-4-(2-тиенил)-5-метилгексил]-4-[2-{N-изопропил-N-(2-пиридил)амино}этил]пиперазин
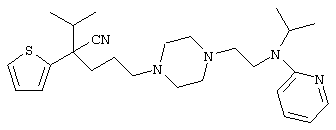
Указанное в заголовке соединение синтезируют способом по примеру 75 из 4-циано-4-(2-тиенил)-5-метилгексилиодида и 1-[2-{N-изопропил-N-(2-пиридил)амино}этил]пиперазина. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,8 Гц, 3Н), 1,14-1,21 (м, 9Н), 1,24-1,38 (м, 1Н), 1,58-1,70 (м, 1Н), 1,72-1,82 (м, 1Н), 2,00-2,10 (м, 1Н), 2,10-2,21 (м, 1Н), 2,28-2,66 (м, 12Н), 3,41 (т, J=8,0 Гц, 2Н), 4,74-4,84 (м, 1Н), 6,47-6,53 (м, 2Н), 6,94 (дд, J=3,6 Гц, 5,2 Гц, 1Н), 7,11 (дд, J=1,2 Гц, 3,6 Гц, 1Н), 7,24-7,29 (м, 1Н), 7,37-7,44 (м, 1Н), 8,12-8,16 (м, 1Н).
Пример 190
1-[4-Циано-4-(2-тиенил)-5-метилгексил]-4-[2-(6-метоксиметил-2-пиридилокси)этил]пиперазин
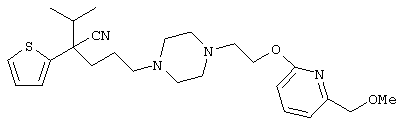
Указанное в заголовке соединение синтезируют способом по примеру 75 из 4-циано-4-(2-тиенил)-5-метилгексилиодида и 1-[2-(6-метоксиметил-2-пиридилокси)этил]пиперазина. Физико-химические данные соединения приведены ниже.
ESI-MC: 457 (М+Н)+.
Пример 191
1-[4-Циано-4-(2-тиенил)-5-метилгексил]-4-[2-(6-фторметил-2-пиридилокси)этил]пиперазин
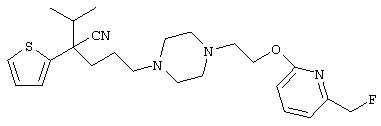
Указанное в заголовке соединение синтезируют способом по примеру 75 из 4-циано-4-(2-тиенил)-5-метилгексилиодида и 1-[2-(6-фторметил-2-пиридилокси)этил]пиперазина. Физико-химические данные соединения приведены ниже.
ESI-MC: 445 (М+Н)+.
Пример 192
1-[4-Циано-4-(2-тиенил)-5-метилгексил]-4-[2-(6-бром-2-пиридилокси)этил]пиперазин
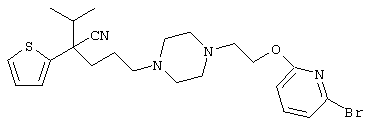
Указанное в заголовке соединение синтезируют способом по примеру 75 из 4-циано-4-(2-тиенил)-5-метилгексилиодида и 1-[2-(6-бром-2-пиридилокси)этил]пиперазина. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,4 Гц, 3Н), 1,18 (д, J=6,4 Гц, 3Н), 1,22-1,38 (м, 1Н), 1,58-1,70 (т, 1Н), 1,71-1,82 (м, 1Н), 2,00-2,10 (м, 1Н), 2,10-2,20 (м, 1Н), 2,25-2,65 (м, 10Н), 2,76 (т, J=6,0 Гц, 2Н), 4,42 (т, J=6,0 Гц, 2Н), 6,69 (д, J=8,0 Гц, 1Н), 6,94 (дд, J=3,6 Гц, 5,2 Гц, 1Н), 7,04 (д, J=8,0 Гц, 1Н), 7,11 (дд, J=1,6 Гц, 3,6 Гц, 1Н), 7,24-7,28 (м, 1Н), 7,40 (т, J=8,0 Гц, 1Н).
Пример 193
1-[4-Циано-4-(2-тиенил)-5-метилгексил]-4-[2-(6-фтор-2-пиридилокси)этил]пиперазин
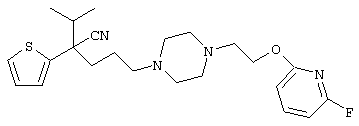
Указанное в заголовке соединение синтезируют способом по примеру 75 из 4-циано-4-(2-тиенил)-5-метилгексилиодида и 1-[2-(6-фтор-2-пиридилокси)этил]пиперазина. Физико-химические данные соединения приведены ниже.
ESI-MC: 431 (М+Н)+.
Пример 194
1-[4-Циано-4-(2-тиенил)-5-метилгексил]-4-[2-(2-пиридилокси)этил]пиперазин
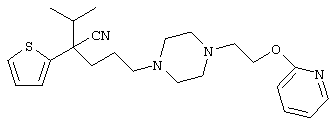
Указанное в заголовке соединение синтезируют способом по примеру 75 из 4-циано-4-(2-тиенил)-5-метилгексилиодида и 1-[2-(2-пиридилокси)этил]пиперазина. Физико-химические данные соединения приведены ниже.
ESI-MC: 413 (М+Н)+.
Пример 195
1-[4-Циано-4-(2-тиенил)-5-метилгексил]-4-[2-(6-метил-2-пиридилокси)этил]пиперазин
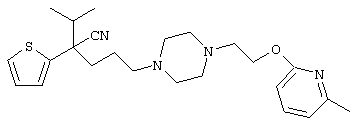
Указанное в заголовке соединение синтезируют способом по примеру 75 из 4-циано-4-(2-тиенил)-5-метилгексилиодида и 1-[2-(6-метил-2-пиридилокси)этил]пиперазина. Физико-химические данные соединения приведены ниже.
1H-ЯМР (400 МГц, CDCl3) δ 0,90 (д, J=6,8 Гц, 3Н), 1,18 (д, J=6,8 Гц, 3Н), 1,22-1,38 (м, 1Н), 1,58-1,70 (м, 1Н), 1,71-1,82 (м, 1Н), 2,00-2,10 (м, 1Н), 2,10-2,21 (м, 1Н), 2,27-2,70 (м, 10Н), 2,42 (с, 3Н), 2,77 (т, J=6,0 Гц, 2Н), 4,41 (т, J=6,0 Гц, 2Н), 6,51-6,55 (м, 1Н), 6,67-6,72 (м, 1Н), 6,94 (дд, J=3,6 Гц, 5,2 Гц, 1Н), 7,11 (дд, J=1,6 Гц, 3,6 Гц, 1Н), 7,25 (дд, J=1,6 Гц, 5,2 Гц, 1Н), 7,43 (дд, J=7,2 Гц, 8,4 Гц, 1Н).
Пример 196
1-[4-Циано-4-(2-тиенил)-5-метилгексил]-4-[2-(6-циано-2-пиридилокси)этил]пиперазин
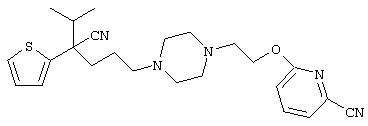
Указанное в заголовке соединение синтезируют способом по примеру 75 из 4-циано-4-(2-тиенил)-5-метилгексилиодида и 1-[2-(6-циано-2-пиридилокси)этил]пиперазина. Физико-химические данные соединения приведены ниже.
ESI-MC: 438 (М+Н)+.
Пример 197
1-[4-Циано-4-(5-циано-2-тиенил)-5-метилгексил]-4-[2-(6-циано-2-пиридилокси) этил]пиперазин
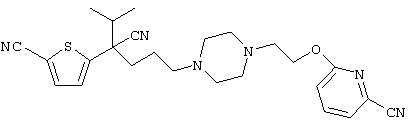
Указанное в заголовке соединение синтезируют способом по примеру 75 из 4-циано-4-(5-циано-2-тиенил)-5-метилгексилиодида и 1-[2-(6-циано-2-пиридилокси)этил]пиперазина. Физико-химические данные соединения приведены ниже.
ESI-MC: 463 (М+Н)+.
Пример 198
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[N-[2-(4-фторфенокси)этил]-N-2-цианоэтил]аминопиперидин
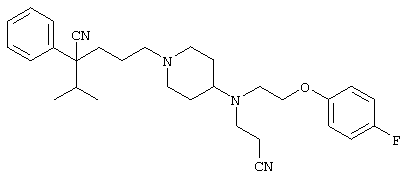
Указанное в заголовке соединение синтезируют способом по примеру 35.
Гидрохлорид:
ESI-MC: 491 (МН+).
Пример 199
1-[(4-Циано-5-метил-4-фенил)гексил]-4-(2-гидроксибензил)пиперазин
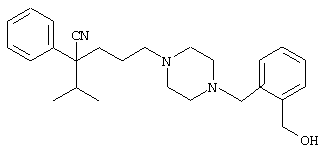
Указанное в заголовке соединение получают способом по примеру 3.
Гидрохлорид:
ESI-MC: 406 (МН+).
Пример 200
1-[[4-Циано-5-метил-4-(2-тиенил)]гексил]-4-[3-[1-(4-фторфенил)циклогексил]пропил]пиперазин
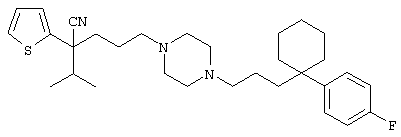
Указанное в заголовке соединение получают способом по примеру 70, используя вышеуказанный 4-[3-[1-(4-фторфенил) циклогексил]пропил]пиперазин.
Гидрохлорид:
ESI-MC: 510 (МН+).
Пример 201
1-[[4-Циано-5-метил-4-(3-бензотиенил)]гексил]-4-[2-(3-цианофенокси)этил]пиперазин
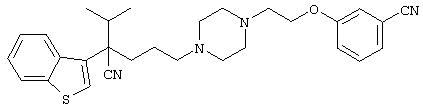
Указанное в заголовке соединение получают способом по примеру 70.
Гидрохлорид:
ESI-MC: 487 (МН+).
Пример 202
1-[[4-Циано-5-метил-4-(3-бензотиенил)]гексил]-4-бензилпиперазин
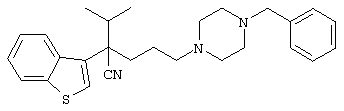
Указанное в заголовке соединение получают способом по примеру 70.
Гидрохлорид:
ESI-MC: 432 (МН+).
Пример 203
1-[[4-Циано-5-метил-4-(3-бензотиенил)]гексил]-4-(3-цианобензил)пиперазин
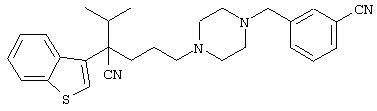
Указанное в заголовке соединение получают способом по примеру 3.
Гидрохлорид:
ESI-MC: 457 (МН+).
Пример 204
1-[[4-Циано-5-метил-4-(3-бензотиенил)]гексил]-4-[(2-тиенил)метил]пиперазин
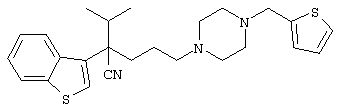
Указанное в заголовке соединение получают способом по примеру 3.
Гидрохлорид:
ESI-MC: 438 (МН+).
Пример 205
1-[[4-Циано-5-метил-4-(3-бензотиенил)]гексил]-4-[(4-циано-2-тиенил)метил]пиперазин
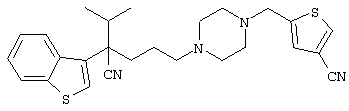
Указанное в заголовке соединение получают способом по примеру 3.
Гидрохлорид:
ESI-MC: 463 (МН+).
Пример 206
1-[[4-Циано-5-метил-4-(3-бензотиенил)]гексил]-4-[6-метил-2-пиколил]пиперазин
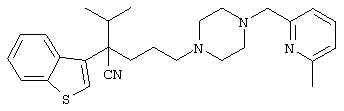
Указанное в заголовке соединение получают способом по примеру 3.
Гидрохлорид:
ESI-MC: 447 (МН+).
Пример 207
1-[[4-Циано-5-метил-4-(1-метил-2-пирролил)]гексил]-4-[2-(3-цианофенокси)этил]пиперазин
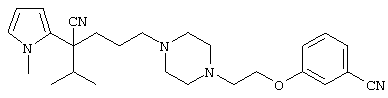
Указанное в заголовке соединение получают способом по примеру 70.
Оксалат:
ESI-MC: 434 (МН+).
Пример 208
1-[[4-Циано-5-метил-4-(5-метил-2-тиенил)]гексил]-4-[N-[2-(4-фторфенокси)этил]-N-2-цианоэтил]аминопиперидин
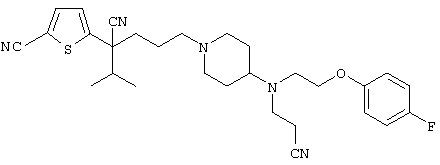
Указанное в заголовке соединение получают способом по примеру 35.
Гидрохлорид:
ESI-MC: 522 (МН+).
Пример 209
1-[[4-Циано-5-метил-4-(2-тиенил)]гексил]-4-[N-[2-(4-фторфенокси)этил]-N-2-цианоэтил]аминопиперидин
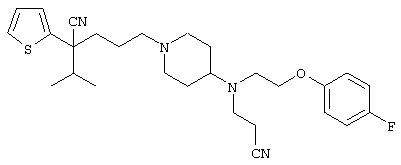
Указанное в заголовке соединение получают способом по примеру 35.
Гидрохлорид:
ESI-MC: 497 (МН+).
Пример 210
1-[[4-Циано-5-метил-4-(2-тиенил)]гексил]-4-[(2-бензоксазолил)амино]пиперидин
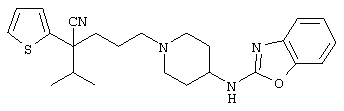
Указанное в заголовке соединение получают способом по примеру 17.
Гидрохлорид:
ESI-MC: 423 (МН+).
Пример 211
1-[[4-Циано-5-метил-4-(5-циано-2-тиенил)]гексил]-4-[(2-бензоксазолил)амино]пиперидин
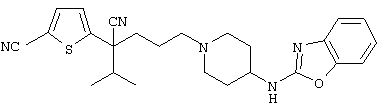
Указанное в заголовке соединение получают способом по примеру 17.
Гидрохлорид:
ESI-MC: 448 (МН+).
Пример 212
1-[[4-Циано-5-метил-4-(2-фурил)]гексил]-4-[2-(3-цианофенокси)этил]пиперазин
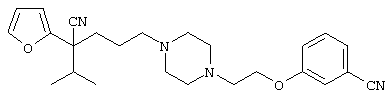
Указанное в заголовке соединение получают способом по примеру 7 0.
Гидрохлорид:
ESI-MC: 421 (МН+).
Пример 213
1-[[4-Циано-5-метил-4-(2-фурил)]гексил]-4-[(2-бензоксазолил)амино]пиперидин
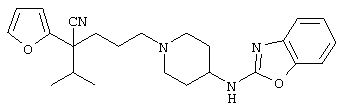
Указанное в заголовке соединение получают способом по примеру 17.
Оксалат:
ESI-MC: 407 (МН+).
Пример 214
1-[[4-Циано-5-метил-4-(2-тиенил)]гексил]-4-[N-(2-бензоксазолил)-N-(2-цианоэтил)амино]пиперидин
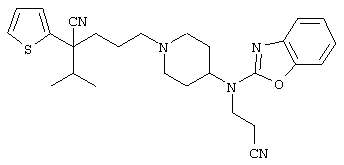
Указанное в заголовке соединение получают способом по примеру 35.
Гидрохлорид:
ESI-MC: 476 (MH+).
Пример 215
1-[[4-Циано-5-метил-4-(2-фурил)]гексил]-4-[N-(2-бензоксазолил)-N-(2-цианоэтил)амино]пиперидин
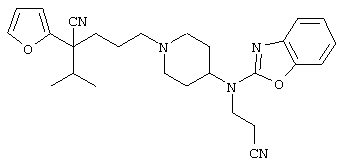
Указанное в заголовке соединение получают способом по примеру 35.
Оксалат:
ESI-MC: 460 (МН+).
Пример 216
1-[(4-Циано-5-метил-4-фенил)гексил]-4-(2-пиридил)пиперазин
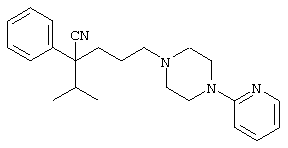
Указанное в заголовке соединение получают способом по примеру 70.
Гидрохлорид:
ESI-MC: 363 (МН+).
Пример 217
1-[[4-Циано-5-метил-4-(2-тиенил)]гексил]-4-(2-пиридил)пиперазин
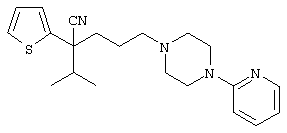
Указанное в заголовке соединение получают способом по примеру 70.
Гидрохлорид:
ESI-MC: 369 (МН+).
Пример 218
1-[(2-Оксо-1,2-дигидро-3-хинолил)метил]-4-[(4-циано-5-метил-4-фенил)гексил]пиперазин
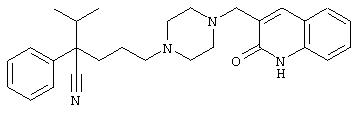
Оксалат указанного в заголовке соединения получают в виде бесцветного твердого вещества способом по примеру 3.
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,64 (д, J=6,8 Гц, 3Н), 1,09 (д, J=6,4 Гц, 3H), 1,00-1,20 (м, 1Н), 1,40-1,60 (м, 1Н), 1,95-2,15 (м, 1Н), 2,10-2,25 (м, 1Н), 2,60-3,05 (м, 11Н), 3,59 (с, 2Н), 7,17 (т, J=7,2 Гц, 1Н), 7,29 (д, J=8,4 Гц, 1Н), 7,30-7,38 (м, 1Н), 7,35-7,50 (м, 5Н), 7,62 (дд, J=8,0 Гц, 1,2 Гц, 1Н), 7,89 (с, 1Н), 11,88 (с, 1Н).
Пример 219
1-[(2-Оксо-1,2-дигидро-3-хинолил)метил]-4-[(4-циано-5-метил-4-фенил)гексил]пиперидин
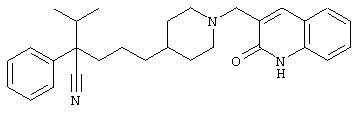
Оксалат указанного в заголовке соединения получают в виде бесцветного твердого вещества способом по примеру 3.
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,63 (д, J=6,8 Гц, 3Н), 0,70-0,85 (м, 1Н), 1,00-1,45 (м, 6Н), 1,09 (д, J=6,8 Гц, 3Н), 1,60 (шир.д, J=2,8 Гц, 2Н), 1,87-2,08 (м, 2Н), 2,10-2,23 (м, 1Н), 2,75-2,95 (м, 2Н), 3,20-3,35 (м, 2Н), 4,08 (с, 2Н), 7,19-7,25 (м, 1Н), 7,28-7,44 (м, 6Н), 7,53-7,58 (м, 1Н), 7,65-7,70 (м, 1Н), 8,13 (с, 1Н), 12,13 (с, 1Н).
Пример 220
1-[(2-Оксо-1,2-дигидро-3-пиридинил)метил]-4-[(4-циано-5-метил-4-фенил)гексил]пиперидин
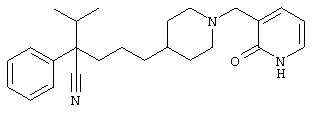
Оксалат указанного в заголовке соединения получают в виде бесцветного твердого вещества способом по примеру 3.
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,63 (д, J=6,8 Гц, 3Н), 0,70-0,85 (м, 1Н), 1,00-1,45 (м, 6Н), 1,09 (д, J=6,8 Гц, 3Н), 1,59 (шир.д, J=13,2 Гц, 2Н), 1,87-2,08 (м, 2Н), 2,10-2,23 (м, 1Н), 2,73-2,95 (м, 2Н), 3,15-3,33 (м, 2Н), 3,98 (с, 2Н), 2,26 (д, J=6,8 Гц, 1Н), 7,28-7,35 (м, 1Н), 7,36-7,44 (м, 4Н), 7,50 (дд, J=6,4 Гц, 2,0 Гц, 1Н), 7,62-7,68 (м, 1Н).
Пример 221
1-[(5-Хлор-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(4-циано-5-метил-4-фенил)гексил]пиперидин
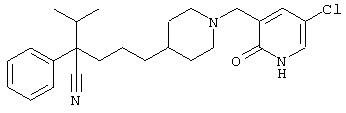
Оксалат указанного в заголовке соединения получают в виде бесцветного твердого вещества способом по примеру 3.
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,63 (д, J=6,8 Гц, 3Н), 0,70-0,85 (м, 1Н), 1,00-1,40 (м, 6Н), 1,09 (д, J=6,4 Гц, 3Н), 1,53 (шир.д, J=13,2 Гц, 2Н), 1,87-2,08 (м, 2Н), 2,10-2,23 (м, 1Н), 2,40-2,60 (м, 2Н), 3,04 (шир.д, J=11,6 Гц, 2Н), 3,68 (с, 2Н), 7,25-7,35 (м, 1Н), 7,36-7,44 (м, 4Н), 7,59 (д, J=2,8 Гц, 1Н), 7,66 (д, J=2,4 Гц, 1Н).
Пример 222
4-[(4-Циано-5-метил-4-фенил)гексил]-1-{[2-(метансульфониламино)фенил]метил}пиперазин
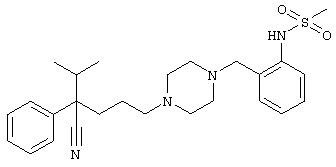
Оксалат указанного в заголовке соединения получают в виде бесцветного твердого вещества способом по примеру 3.
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,64 (д, J=6,4 Гц, 3Н), 0,80-1,20 (м, 1Н), 1,09 (д, J=6,8 Гц, 3H), 1,40-1,60 (м, 1Н), 1,90-2,15 (м, 1Н), 2,10-2,25 (м, 1Н), 2,60-3,10 (м, 11Н), 3,03 (с, 3H), 3,65 (с, 2Н), 7,13 (т, J=7,2 Гц, 1Н), 7,26-7,47 (м, 8Н).
Пример 223
4-[(4-Циано-5-метил-4-фенил)гексил]-1-{[2-(п-толуолсульфониламино)фенил]метил}пиперазин
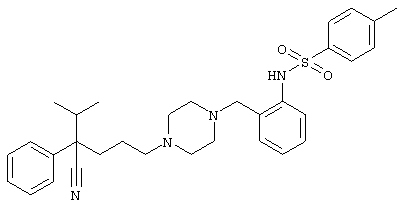
Оксалат указанного в заголовке соединения получают в виде бесцветного твердого вещества способом по примеру 3.
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,65 (д, J=6,4 Гц, 3Н), 0,80-1,20 (м, 1H), 1,09 (д, J=6,8 Гц, 3Н), 1,45-1,60 (м, 1Н), 1,95-2,15 (м, 1Н), 2,10-2,25 (м, 1Н), 2,33 (с, 3Н), 2,60-3,05 (м, 11Н), 3,34 (с, 2Н), 7,05-7,12 (м, 2Н), 7,16-7,24 (м, 2Н), 7,32 (д, J=7,6 Гц, 2Н), 7,29-7,37 (м, 1Н), 7,37-7,46 (м, 4Н), 7,58 (д, J=8,0 Гц, 2Н).
Пример 224
4-[(4-Циано-5-метил-4-фенил)гексил]-1-{[2-(метансульфониламино)фенил]метил}пиперидин
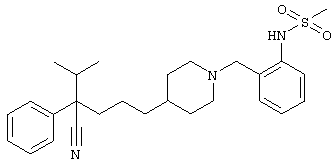
Указанное в заголовке соединение получают в виде бесцветного масла способом по примеру 3.
1H-ЯМР (400 МГц, CDCl3) δ 0,80 (д, J=6,8 Гц, 3Н), 0,85-1,05 (м, 1Н), 1,05-1,45 (м, 6Н), 1,22 (д, J=6,4 Гц,3Н), 1,50-1,68 (м, 2Н), 1,73-1,88 (м, 1Н), 1,90-2,05 (м, 2Н), 2,00-2,20 (м, 2Н), 2,75-2,90 (м, 2Н), 3,04 (с, 3H), 3,60 (с, 2Н), 6,96-7,11 (м, 2Н), 7,24-7,36 (м, 2Н), 7,34-7,44 (м, 4Н), 7,46-7,52 (м, 1Н).
Пример 225
4-[(4-Циано-5-метил-4-фенил)гексил]-1-{[2-(п-толуолсульфониламино)фенил]метил}пиперидин
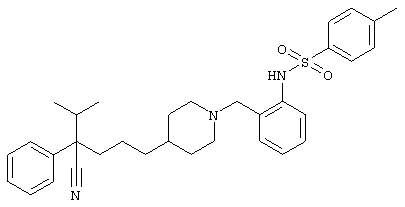
Указанное в заголовке соединение получают в виде бесцветного масла способом по примеру 3.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 0,85-1,02 (м, 1Н), 1,08-1,30 (м, 5Н), 1,25-1,44 (м, 1Н), 1,19 (д, J=6,4 Гц, 3Н), 1,57 (шир.т, J=13,6 Гц, 2Н), 1,76-1,90 (м, 3Н), 2,06-2,16 (м, 2Н), 2,37 (с, 3Н), 2,68 (шир.д, J=11,2 Гц, 2Н), 3,13 (с, 2Н), 6,91 (д, J=7,2 Гц, 1Н), 6,95 (т, J=7,6 Гц, 1Н), 7,19 (д, J=8,4 Гц, 2Н), 7,16-7,22 (м, 1Н), 7,26-7,41 (м, 5Н), 7,46 (д, J=8,0 Гц, 1Н), 7,63 (д, J=8,4 Гц, 2Н).
Пример 226
1-[4-Циано-5-метил-4-(2-хлорфенил)гексил]-4-[2-(4-фторфенокси)этил]пиперазин
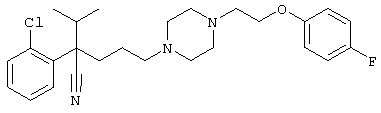
Оксалат указанного в заголовке соединения получают в виде бесцветного твердого вещества способом по примеру 48.
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,72 (д, J=6,8 Гц, 3Н), 1,10 (д, J=6,8 Гц, 3Н), 1,00-1,25 (м, 1Н), 1,42-1,60 (м, 1Н), 1,95-2,10 (м, 1Н), 2,45-2,65 (м, 1Н), 2,60-3,10 (м, 13Н), 4,09 (т, J=5,2 Гц, 2Н), 6,89-6,99 (м, 2Н), 7,10 (т, J=8,8 Гц, 2Н), 7,37-7,46 (м, 2Н), 7,51 (дд, J=7,6 Гц, 1,6 Гц, 1Н), 7,62 (дд, J=7,6 Гц, 1,6 Гц, 1Н).
Пример 227
1-[4-Циано-5-метил-4-(о-толил)гексил]-4-[2-(4-фторфенокси)этил]пиперазин
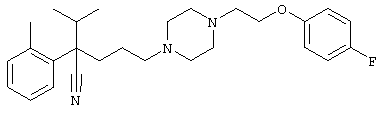
Оксалат указанного в заголовке соединения получают в виде бесцветного твердого вещества способом по примеру 48.
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,76 (д, J=6,4 Гц, 3Н), 1,05 (д, J=6,4 Гц, 3Н), 1,10-1,30 (м, 1Н), 1,43-1,60 (м, 1Н), 1,93-2,07 (м, 1Н), 2,15-2,30 (м, 1Н), 2,38-2,53 (м, 1Н), 2,45 (с, 3H), 2,65-3,05 (м, 12Н), 4,07 (т, J=5,2 Гц, 2Н), 6,89-6,96 (м, 2Н), 7,10 (т, J=8,0 Гц, 2Н), 7,18-7,27 (м,3Н), 7,38-7,44 (м, 1Н).
Пример 228
1-[4-Циано-5-метил-4-(2-метоксифенил)гексил]-4-[2-(4-фторфенокси)этил]пиперазин
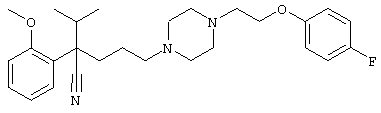
Оксалат указанного в заголовке соединения получают в виде бесцветного твердого вещества способом по примеру 48.
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,66 (д, J=6,8 Гц, 3Н), 1,07 (д, J=6,4 Гц, 3Н), 1,00-1,20 (м, 1Н), 1,40-1,55 (м, 1Н), 1,85-2,00 (м, 1Н), 2,30-2,43 (м, 1Н), 2,55-2,70 (м, 1Н), 2,60-3,05 (м, 12Н), 3,79 (с, 3Н), 4,07 (т, J=5,2 Гц, 2Н), 6,88-6,96 (м, 2Н), 6,99 (т, J=7,6 Гц, 1Н), 7,05-7,14 (м, 3Н), 7,32-7,42 (м, 2Н).
Пример 229
N-{1-[(4-Циано-5-метил-4-фенил)гексил]пиперидин-4-ил}-п-толуолсульфонамид
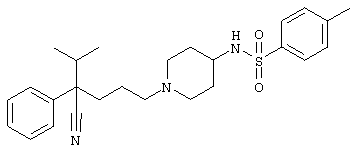
Указанное в заголовке соединение получают в виде бледно-коричневого масла способом по примеру 15.
1H-ЯМР (400 МГц, СDСl3) δ 0,76 (д, J=6,8 Гц, 3Н), 0,95-1,15 (м, 1Н), 1,18 (д, J=6,8 Гц, 3Н), 1,30-1,45 (м, 2Н), 1,35-1,55 (м, 1Н), 1,63-1,75 (м, 2Н), 1,75-1,95 (м, 5Н), 2,00-2,15 (м, 2Н), 2,15-2,25 (м, 2Н), 2,45-2,65 (м, 2Н), 3,00-3,15 (м, 1Н), 7,29 (д, J=8,0 Гц, 2Н), 7,31-7,40 (м, 5Н), 7,75 (д, J=7,6 Гц, 2Н).
Пример 230
1-[(4-Циано-5-метил-4-фенил)гексил]-4-[3-гидрокси-1-(4-фторфенокси)пропан-2-ил]пиперазин
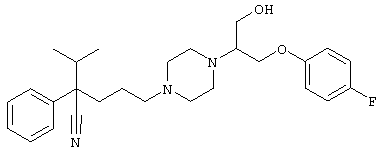
Оксалат указанного в заголовке соединения получают в виде бесцветного твердого вещества способом по примеру 15.
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,64 (д, J=6,8 Гц, 3Н), 1,09 (д, J=6,8 Гц, 3Н), 1,00-1,40 (м, 1Н), 1,43-1,60 (м, 1Н), 1,93-2,15 (м, 2Н), 2,10-2,25 (м, 1Н), 2,60-3,20 (м, 11Н), 3,45-3,60 (м, 2Н), 4,04 (д, J=5,6 Гц, 2Н), 6,88-6,96 (м, 3Н), 7,26 (т, J=7,6 Гц, 1Н), 7,30-7,38 (м, 1Н), 7,36-7,46 (м, 4Н).
Пример 231
1-[(4-Циано-5-метил-4-фенил)гексил]-4-(3-цианобензилокси)пиперидин
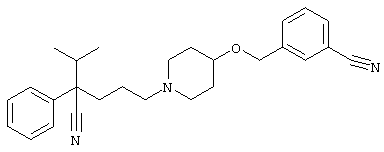
Оксалат указанного в заголовке соединения получают в виде бесцветного твердого вещества способом по примеру 15.
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,64 (д, J=6,8 Гц, 3Н), 1,11 (д, J=6,4 Гц, 3H), 1,63-1,80 (м, 2Н), 1,85-2,00 (м, 2Н), 2,13-2,27 (м, 1Н), 2,30-2,45 (м, 1Н), 2,35-2,55 (м, 1Н), 2,75-3,00 (м, 4Н), 3,00-3,20 (м, 2Н), 3,50-3,60 (м, 1Н), 4,52 (с, 2Н), 7,33-7,40 (м, 1Н), 7,40-7,48 (м, 4Н), 7,54 (т, J=8,0 Гц, 1Н), 7,66 (д, J=8,0 Гц, 1Н), 7,74 (д, J=8,0 Гц, 1Н), 7,77 (м, 1Н).
Пример 232
4-[(3-Циано-4-метил-3-фенил)пентил]-1-{2-[3-(п-толуолсульфониламино)фенокси]этил}пиперазин
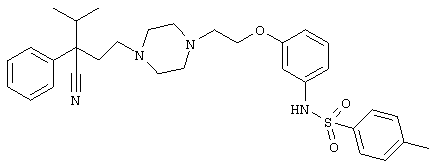
Оксалат указанного в заголовке соединения получают в виде бесцветного твердого вещества способом по примеру 3.
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,64 (д, J=6,8 Гц, 3Н), 1,11 (д, J=6,4 Гц, 3Н), 2,13-2,50 (м, 1Н), 2,20-2,50 (м, 2Н), 2,37 (с, 3Н), 2,45-2,50 (м, 2Н), 2,50-2,60 (м, 2Н), 2,60-2,80 (м, 4Н), 2,70-3,00 (м, 4Н), 3,63 (т, J=6,4 Гц, 2Н), 6,41 (дд, J=8,0 Гц, 2,0 Гц, 1Н), 6,47 (д, J=2,0 Гц, 1Н), 6,70 (дд, J=8,0 Гц, 2,4 Гц, 1Н), 7,09 (т, J=8,0 Гц, 1Н), 7,36 (д, J=8,4 Гц, 2Н), 7,32-7,40 (м, 1Н), 7,38-7,48 (м, 4Н), 7,46 (д, J=8,0 Гц, 2Н).
Пример 233
4-[(4-Циано-5-метил-4-фенил)гексил]-1-{2-[3-(п-толуолсульфониламино)фенокси]этил}пиперазин
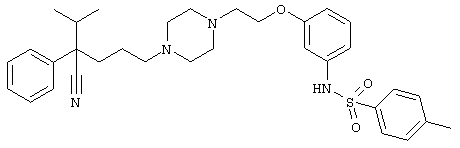
Оксалат указанного в заголовке соединения получают в виде бледно-коричневого твердого вещества способом по примеру 15.
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,64 (д, J=6,4 Гц, 3Н), 1,09 (д, J=6,4 Гц, 3Н), 1,00-1,20 (м, 1Н), 1,43-1,60 (м, 1Н), 1,90-2,13 (м, 2Н), 2,15-2,25 (м, 1Н), 2,37 (с, 3Н), 2,25-2,50 (м, 4Н), 2,80-3,00 (м, 8Н), 3,57 (т, J=6,8 Гц, 2Н), 6,38-6,43 (м, 1Н), 6,46 (с, 1Н), 6,68 (дд, J=8,0 Гц, 2,0 Гц, 1Н), 7,08 (т, J=7,6 Гц, 1Н), 7,36 (д, J=8,4 Гц, 2Н), 7,30-7,40 (м, 1Н), 7,36-7,48 (м, 4Н), 7,45 (д, J=8,4 Гц, 2Н).
Пример 234
1-[(4-Циано-5-метил-4-фенил)гексил]-4-{[3-(п-толуолсульфониламино)фенокси]метил}пиперидин
Указанное в заголовке соединение получают в виде желтого аморфного вещества способом по примеру 15.
1H-ЯМР (400 МГц, CDCl3) δ 0,75 (д, J=6,8 Гц, 3Н), 1,15 (д, J=6,4 Гц, 3Н), 1,05-1,30 (м, 3Н), 1,30-1,45 (м, 1Н), 1,45-1,65 (м, 1Н), 1,65 (шир.д, J=12,4 Гц, 2Н), 1,65-1,80 (м, 1Н), 1,75-1,95 (м, 2Н), 2,00-2,18 (м, 2Н), 2,26 (т, J=7,2 Гц, 2Н), 2,40 (с, 3Н), 2,67-2,80 (м, 2Н), 3,31 (д, J=7,6 Гц, 2Н), 6,43 (д, J=8,0 Гц, 1Н), 6,56 (д, J=2,0 Гц, 1Н), 6,67-6,76 (м, 1Н), 7,08 (т, J=8,0 Гц, 1Н), 7,22 (д, J=6,8 Гц, 2Н), 7,20-7,40 (м, 5Н), 7,45 (д, J=8,0 Гц, 2Н).
Пример 235
1-[(3-Циано-4-метил-3-фенил)пентил]-4-{[3-(п-толуолсульфониламино)фенокси]метил}пиперидин
Указанное в заголовке соединение получают в виде бледно-коричневого аморфного вещества способом по примеру 3.
1H-ЯМР (400 МГц, CDCl3) δ 0,73 (д, J=6,8 Гц, 3Н), 1,14 (д, J=6,4 Гц, 3Н), 1,15-1,30 (м, 2Н), 1,35-1,52 (м, 1Н), 1,68 (шир.д, J=12,4 Гц, 2Н), 1,73-2,05 (м, 3Н), 2,00-2,18 (м, 2Н), 2,30-2,43 (м, 2Н), 2,40 (с, 3Н), 2,70-2,90 (м, 2Н), 3,20-3,38 (м, 2Н), 6,38 (дд, J=8,0 Гц, 2,0 Гц, 1Н), 6,58 (д, J=1,6 Гц, 1Н), 7,00 (дд, J=8,0 Гц, 2,0 Гц, 1Н), 7,07 (т, J=8,0 Гц, 1Н), 7,22 (д, J=7,6 Гц, 2Н), 7,25-7,40 (м, 5Н), 7,43 (д, J=8,4 Гц, 2Н).
Пример 236
1-(3-Цианобензил)-4-[(4-циано-5-метил-4-фенил)гексил]пиперидин
Оксалат указанного в заголовке соединения получают в виде бесцветного твердого вещества способом по примеру 48.
Оксалат:
1H-ЯМР (400 МГц, ДМСО-d6) δ 0,63 (д, J=6,8 Гц, 3Н), 0,70-0,85 (м, 1Н), 1,00-1,30 (м, 5Н), 1,08 (д, J=6,4 Гц, 3Н), 1,20-1,35 (м, 1Н), 1,58 (шир.д, J=12,8 Гц, 2Н), 1,87-2,08 (м, 2Н), 2,10-2,23 (м, 1Н), 2,61 (шир.т, J=11,2 Гц, 2Н), 3,11 (шир.д, J=10,8 Гц, 2Н), 4,10 (с, 2Н), 7,28-7,33 (м, 1Н), 7,34-7,44 (м, 4Н), 7,61 (т, J=7,6 Гц, 1Н), 7,76 (д, J=7,6 Гц, 1Н), 7,84-7,90 (м, 2Н).
Пример 237
1-[(5-Фенил-2-оксо-1,2-дигидро-3-пиридинил)метил]-4-[(4-циано-5-метил-4-фенил)гексил]пиперидин
Указанное в заголовке соединение получают в виде бледно-желтого масла способом по примеру 3.
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 0,85-1,00 (м, 1Н), 1,10-1,45 (м, 4Н), 1,19 (д, J=6,8 Гц, 3Н), 1,50-1,65 (м, 2Н), 1,60-2,20 (м, 5Н), 2,80-3,00 (м, 2Н), 3,54 (с, 2Н), 7,24-7,48 (м, 10Н), 7,64-7,70 (м, 1Н), 7,78-7,84 (м, 1Н).
Пример 238
Этил-1-бензил-4-(4-циано-5-метил-4-фенилгексил)-2-пиперазинкарбоксилат
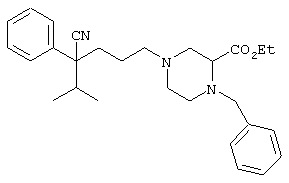
Указанное в заголовке соединение синтезируют способом по примеру 15, используя 1-бензил-2-(этоксикарбонил)пиперазин (Synthesis, 318, 1991).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,76 (д, J=6,6 Гц, 3Н), 1,05-1,10 (м, 1H), 1,18-1,31 (м, 6Н), 1,50-1,63 (м, 1Н), 1,86-1,94 (м, 1H), 2,04-2,15 (м, 2Н), 2,21-2,54 (м, 7Н), 2,96 (м, 1H), 3,22-3,27 (м, 1H), 3,51 (м, 1H), 3,86-3,90 (м, 1H), 4,12-4,23 (м, 2Н), 7,21-7,37 (м, 10Н).
Пример 239
Этил-4-(4-циано-5-метил-4-фенилгексил)-1-[2-(4-фторфенокси)этил]-2-пиперазинкарбоксилат
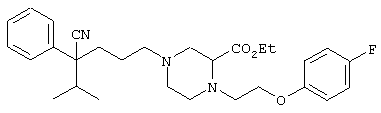
Указанное в заголовке соединение синтезируют способом по примеру 48, используя этил-4-(4-циано-5-метил-4-фенилгексил)-2-пиперазинкарбоксилат.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,06-1,11 (м, 1Н), 1,17-1,29 (м, 6Н), 1,51-1,62 (м, 1Н), 1,86-1,91 (м, 1Н), 2,05-2,11 (м, 2Н), 2,22-2,36 (м, 4Н), 2,52-2,55 (м, 3Н), 2,94-3,01 (м, 2Н), 3,13-3,16 (м, 1Н), 3,38-3,39 (м, 1Н), 4,01-4,03 (м, 2Н), 4,14-4,22 (м, 2Н), 6,78-6,82 (м, 2Н), 6,92-6,97 (м, 2Н), 7,26-7,31 (м, 1Н), 7,36-7,37 (м, 4Н).
Пример 240
1-(4-Циано-5-метил-4-фенилгексил)-3-гидроксиметил-4-[2-(4-фторфенокси)этил]пиперазин
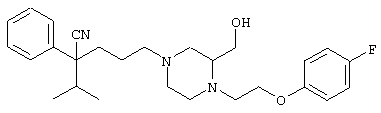
К раствору (5,0 мл) алюмогидрида лития (20 мг) в диэтиловом эфире при охлаждении льдом по каплям добавляют раствор (3,0 мл) 213 мг этил-4-(4-циано-5-метил-4-фенилгексил)-1-[2-(4-фторфенокси)этил]-2-пиперазинкарбоксилата в диэтиловом эфире. Смесь перемешивают при охлаждении льдом в течение одного часа и поочередно добавляют воду (0,1 мл), 1 н. водный раствор гидроксида натрия (0,1 мл) и воду (0,2 мл). К реакционному раствору добавляют безводный сульфат магния и отфильтровывают побочный продукт. Растворитель выпаривают, получая при этом указанное в заголовке соединение (194 мг).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,6 Гц, 3Н), 1,09-1,16 (м, 1Н), 1,20 (дд, J=6,8 Гц, 1,8 Гц, 3H), 1,53-1,60 (м, 1Н), 1,86-1,91 (м, 1H), 2,04-2,27 (м, 5Н), 2,35-2, 61 (м, 5Н), 2,74-2,78 (м, 1H), 3,02-3,06 (м, 1H), 3,12-3,18 (м, 1H), 3,51-3,54 (м, 1H), 3,97-4,02 (м, 3Н), 6,80-6,85 (м, 2Н), 6,94-6,98 (м, 2Н), 7,26-7,33 (м, 1H), 7,35-7,39 (м, 4Н).
Пример 241
Этил-1-бензил-4-[2-(4-фторфенокси)этил]-2-пиперазинкарбоксилат
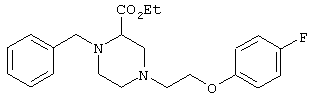
Указанное в заголовке соединение синтезируют способом по примеру 48, используя 1-бензил-2-(этоксикарбонил)пиперазин (Synthesis, 318, 1991).
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,28 (м, 3Н), 2,36-2,12 (м, 1H), 2,54-2,61 (м, 2Н), 2,71-2,83 (м, 4Н), 3,02 (м, 1H), 3,31-3,34 (м, 1H), 3,53-3,56 (м, 1H), 3,89-3,92 (д, J=16,6 Гц, 1H), 3,99-4,05 (м, 2Н), 4,11-4,24 (м, 2Н), 6,79-6,83 (м, 2Н), 6,93-6,98 (м, 2Н), 7,23-7,34 (м, 5Н).
Пример 242
Этил-1-(4-циано-5-метил-4-фенилгексил)-4-[2-(4-фторфенокси)этил]-2-пиперазинкарбоксилат
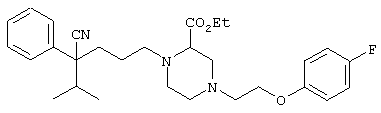
Указанное в заголовке соединение синтезируют способом по примеру 15, используя этил-4-[2-(4-фторфенокси)этил]-2-пиперазинкарбоксил.
Свободное соединение:
ESI-MC (m/e): 496 (М+Н).
Этил-4-[2-(4-фторфенокси)этил]-2-пиперазинкарбоксилат
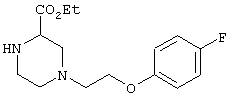
получают в виде сырого продукта (752 мг, 100%), для чего этил-1-бензил-4-[2-(4-фторфенокси)этил]-2-пиперазинкарбоксилат (977 мг), синтезированный способом по примеру 241, растворяют в этаноле (15 мл), добавляют 210 мг 10% Pd-C, заменяют атмосферу реакционного раствора водородом, смесь перемешивают и упаривают после окончания реакции.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 1,24-1,28 (м, 3Н), 2,33-2,34 (м, 1Н), 2,48-2,50 (м, 1Н), 2,72-2,91 (м, 4Н), 3,04-3,10 (м, 2Н), 3,56-3,59 (м, 1Н), 4,04-4,08 (м, 2Н), 4,16-4,22 (м, 2Н), 6,82-6,86 (м, 2Н), 6,94-6,99 (м, 2Н).
Пример 243
1-(4-Циано-5-метил-4-фенилгексил)-2-гидроксиметил-4-[2-(4-фторфенокси)этил]пиперазин
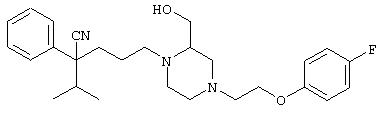
Указанное в заголовке соединение синтезируют способом по примеру 240, используя этил-1-(4-циано-5-метил-4-фенилгексил)-4-[2- (4-фторфенокси)этил]-2-пиперазинкарбоксилат.
Свободное соединение:
1H-ЯМР (400 МГц, CDCl3) δ 0,77 (д, J=6,8 Гц, 3Н), 1,07-1,14 (м, 1Н), 1,20 (д, J=6,6 Гц, 3H), 1,43-1,56 (м, 1Н), 1,79-1,90 (м, 1Н), 2,04-2,83 (м, 13Н), 3,47-3,51 (м, 1Н), 3,83-3,91 (м, 1Н), 4,01-4,10 (м, 2Н), 6,80-6,84 (м, 2Н), 6,94-6,98 (м, 2Н), 7,26-7,40 (м, 5Н).
Испытательные примеры
В нижеследующих примерах описаны испытания соединений по настоящему изобретению на ингибирование кальция in vitro (испытательный пример 1), уменьшение очага поражения инфарктом в in vivo модели с закупоркой средней артерии головного мозга у крыс (испытательный пример 2) и аналгезирующее действие при вызывании реакции на формалин у мышей (испытательный пример 3). Ниже приведены способы испытания и полученные результаты.
Испытательный пример 1
Измерение ингибирующего действия на потенциалзависимый кальциевый канал с использованием флуоресцентного красителя (fura2)
Наибольшая важность, в качестве механизма инфаркта головного мозга (гибели нервных клеток вследствие ишемии), приписывается допущению "глутаминовая кислота - Са". А именно, при уменьшении кровотока в головном мозге происходит анаэробный гликолиз, вызывающий истощение аденозинтрифосфата (АТР) в тканях головного мозга. В результате исчерпания энергетического потенциала нарушается градиент концентрации ионов внутри и снаружи клетки, что ведет к деполяризации. Происходит активация потенциалзависимого кальциевого канала в предсинапсе вследствие деполяризации, что вызывает избыточное высвобождение глутаминовой кислоты. Активация потенциалзависимого кальциевого канала в постсинапсе вследствие деполяризации вызывает увеличение концентрации Са2+ в клетке, при этом избыточное высвобождение глутаминовой кислоты стимулирует рецептор глутаминовой кислоты, что также увеличивает концентрацию Са2+ в клетке. В результате этого такие ферменты, как карпаин и фосфолипаза, зависящие от концентрации Са2+, активизируются и вызывают гибель нервной клетки. Экспериментальная система согласно настоящей заявке позволяет оценить приток Са2+ в предсинапсе в описанной выше схеме процесса.
Кроме того, известно, что 10 мкМ нифедипина, являющегося ингибитором кальциевого канала L-типа, 12 мкМ н-конотоксина GVIA, являющегося ингибитором кальциевого канала N-типа, и 1 мкМ w-агатоксина IVA, являющегося ингибитором кальциевого канала P/Q-типа, тормозят приток Са2+ соответственно на 16%, 18% и 64% (см. нижеследующую ссылку на литературу). Поэтому данная система считается пригодной для оценки ингибирования кальциевых каналов N-типа и P/Q-типа.
Ссылка на литературу
D. Bowman, S. Alexander and D. Lodge, Pharmacological characterization of the calcium channels coupled to the plateau phase of KCl-induced intracellular free Ca2+ elevation in chicken and rat synaptosomes, Neutopharmacology, 32 (11), 1195-1202 (1993).
(1) Получение синаптосом коры головного мозга
Синаптосомы коры головного мозга получают нижеследующим способом, описанным в "Neuropharmacology, 32(11), 1195-1202, 1993". А именно, кору головного мозга отделяют от головного мозга обезглавленной крысы и измельчают ножницами. Измельченную кору головного мозга помещают в гомогенизатор, гомогенизируют в 3 М сахарозы и центрифугируют (1500 g × 10 минут) при 4°С. Образовавшийся супернатант снова центрифугируют (10000 g × 20 минут) при 4°С. К полученному осадку добавляют 0,3 М сахарозы и смесь суспендируют. Суспензию стратифицируют в 0,8 М сахарозы и центрифугируют (10000 g × 30 минут). Полученный осадок суспендируют в "растворе А" (118 мМ NaCl, 4,6 мМ КСl, 1 мМ CaCl2, 1 мМ MgCl2, 1,2 мМ Na2HPO4, 10 мМ D-глюкозы, 20 мМ HEPES-NaOH, pH 7,4, 0,1% BSA), получая таким образом синаптосомы коры головного мозга.
(2) Ингибирование кальциевого канала
4 мМ красителя fura2/AM (Doujin) суспендируют в вышеуказанном растворе А и получают раствор для загрузки. Указанный раствор в равном количестве добавляют к раствору синаптосом, полученному вышеописанным способом, и смесь инкубируют в течение 40 минут при комнатной температуре. Закончив инкубацию, раствор для загрузки удаляют центрифугированием и 2 раза промывают раствором А. К полученному раствору добавляют раствор А, содержащий соединение по настоящему изобретению, и смесь инкубируют в течение 10 минут при комнатной температуре. Кальциевый канал стимулируют, добавляя к полученному раствору 1/10 объема "раствора В" (122,6 мМ КСl, 1 мМ CaCl2, 1 мМ MgClz, 1,2 мМ Na2HPO4, 10 мМ D-глюкозы, 20 мМ HEPES-NaOH, pH 7,4, 0,1% BSA). Концентрацию ионов кальция в клетке определяют, производя измерения двумя длинами волн, равными 340 и 380 нм, в аппарате ARUGUS-FDSS (HAMAMATSU-PHOTONICS Co.), и устанавливают значения IC50 для соответствующих испытуемых соединений. В качестве контрольного соединения для сравнения с испытуемыми соединениями используют гидрохлорид верапамила.
Испытательный пример 2
Уменьшение соединением формулы (I) очага поражения инфарктом на модели закупорки средней артерии головного мозга у крыс
Ионы кальция, присутствующие в клетке, играют важную роль в выполнении разных функций клетки. Но значительное увеличение концентрации ионов кальция вызывает поражение клетки (см. ссылки (1) и (2)). В качестве примера можно привести поражение нервной клетки стимулирующей аминокислотой в том случае, когда ишемия головного мозга вызывает избыточное повышение концентрации ионов кальция в клетке (3) и (4). В результате локальной ишемии головного мозга (3) под действием стимулирующей аминокислоты нарушается механизм сохранения мембранного потенциала, происходит деполяризация мембраны (5) и увеличивается приток ионов кальция в клетку через потенциалзависимый кальциевый канал (6) и (7). В свете вышеизложенного можно предположить, что гипотеза о гибели нервной клетки под действием стимулирующей аминокислоты находится в соответствии с гипотезой о том, что гибель нервной клетки связана с повышением концентрации ионов кальция в клетке и что активация потенциалзависимого кальциевого канала вносит вклад в индуцирование гибели нервной клетки (8). Потенциалзависимые кальциевые каналы, имеющиеся в нервной клетке, можно классифицировать на 6 подтипов на основании электрофизиологических и фармакологических исследований (типы Т, L, N, Р, Q и R). Среди них кальциевые каналы N-, Р- и Q-типов играют важную роль в высвобождении глутаминовой кислоты из синаптосом коры головного мозга крысы (10) и (11). Поэтому у типичных соединений по настоящему изобретению оценивают защитное действие в отношении поражаемой нервной клетки после локальной ишемии головного мозга, на модели закупорки средней артерии головного мозга у крыс.
(1) Получение образца
Соединение вышеуказанной формулы (I) по настоящему изобретению растворяют в физиологическом растворе и полученный раствор используют для получения доз, равных 1,5, 5 и 15 мг/кг в час. Концентрацию образца вычисляют в расчете на среднюю массу тела животного. Кроме того, высчитывают среднюю массу тела, измеряя массу тела всех животных, используемых в эксперименте. Например, дозу, равную 5 мг/кг в час, высчитывают следующим образом: концентрация образца = 5 мг × средняя масса тела (кг)/вводимый объем (0,616 мл) в час.
(2) Изготовление найлонового эмбола
Окклюзию средней артерии головного мозга вызывают эмболом, изготовленным из найлоновой мононити 4-0 (Ethicon, Inc., Somerville, NJ, USA). Чтобы получить найлоновый эмбол, конец нити оплавляют пламенем в виде шарика, отрезают часть нити длиной 25 мм и масляным фломастером делают отметку на расстоянии 17 мм от конца нити.
(3) Имплантация катетера для внутривенного введения
Катетер для внутривенного введения (катетер 3Fr Atom Vein фирмы ATOM MEDICAL Co., Ltd. Tokyo) имплантируют под наркозом смесью 70% закиси азота с 2% галотана. Катетер, заполненный физиологическим раствором, вводят в бедренную вену левой лапы крысы.
(4) Закупорка средней артерии головного мозга
Среднюю артерию головного мозга перекрывают способом, описанным Лонга и др. (12). Операцию делают под наркозом смесью 70% закиси азота с 2% галотана сразу же после имплантации катетера. Перед операцией крысу кладут на спину под стереоскопический микроскоп, рассекают шею и определяют место, где правосторонняя общая сонная артерия разветвляется на внешнюю сонную артерию и внутреннюю сонную артерию. Внешнюю сонную артерию отсекают с периферической стороны и в конец внешней сонной артерии, отсеченной от внутренней сонной артерии, вставляют найлоновый эмбол. Эмбол вводят до положения, когда отметка на расстоянии 17 мм от его конца соответствует точке разветвления внешней и внутренней сонных артерий, и фиксируют. Найлоновый эмбол удаляют из средней артерии головного мозга через 2 часа, чтобы возобновить кровоток.
(5) Отбор животных с симптомами ишемии
Через 30 минут после окклюзии средней артерии головного мозга крыс отлавливают и поднимают за хвост; для эксперимента отбирают животных с явными признаками одностороннего паралича передней лапы (паралич передней лапы со стороны, противоположной индуцированному инфаркту) и используют их в качестве модели окклюзии средней артерии головного мозга с симптомами ишемии.
(6) Введение субстрата и препарата
Крыс, у которых обнаружены симптомы одностороннего паралича через 30 минут после окклюзии средней артерии головного мозга, помещают в клетки, оборудованные прибором для измерения температуры тела, и вводят в прямую кишку зонд для измерения температуры тела. Шприц, заполненный субстратом или препаратом, вставляют в катетер для внутривенного введения и в течение одной минуты внутривенно вводят половину дозы (0,34 мл), которую следует вводить в течение 1 часа. Затем вливание производят со скоростью 0,682 мл/час в течение 24 часов, используя шприц с насосом для вливаний (Razel Scientific Instruments, Inc. Stamford, CT, USA). Во время введения и в течение 2 часов после введения при помощи системы для измерения температуры тела измеряют температуру в прямой кишке, которая находится в пределах от 37,0 до 38,5°С.
(7) Измерение величины очага поражения инфарктом (окрашивание среза головного мозга хлористым 2,3,5-трифенилтетразолом (ТТС))
Через 24 часа после окклюзии средней артерии головного мозга крыс обезглавливают, мозг удаляют и кровь смывают охлаждаемым льдом физиологическим раствором. Из мозга удаляют обонятельную луковицу и делают срезы толщиной 2 мм (всего 6 срезов), полученные срезы погружают в 2% раствор ТТС и переворачивают задней поверхностью мозга вверх. ТТС был растворен в физиологическом растворе. Срезы оставляют в растворе ТТС на один час или более при комнатной температуре и затем используют для определения величины очага поражения инфарктом.
(8) Вычисление объема очага поражения инфарктом
Верхнюю часть каждого среза (задняя поверхность мозга) используют для вычисления величины очага поражения инфарктом. Изображения срезов головного мозга получают в компьютере (РМ7500/100, Apple Japan, Tokyo) при помощи фотографического устройства (цветная фотокамера CCD, SANKEI Inc., Tokyo). Очаги поражения инфарктом коры головного мозга на полученных изображениях измеряют при помощи программного обеспечения для анализа изображений (NIH image ver. 1,60, National Institutes of Health, USA). Объем очага поражения инфарктом одного животного вычисляют в виде общей суммы (единица измерения = мм3) для 6 срезов путем умножения площади (единица измерения = мм2) очага поражения инфарктом соответствующих срезов на 2 (единица измерения = мм), что равно толщине среза.
(9) Метод анализа данных
Объем (единица измерения = мм3) очага поражения инфарктом коры головного мозга выражают в виде среднего значения ± стандартная ошибка. Статистическую значимость по отношению к контрольной группе, которой вводят субстрат, для соответствующих экспериментальных групп, которым вводят препарат, анализируют при помощи мультиплексного сравнительного анализа методом Даннетта и уровень значимости задают равным 5% для обеих сторон. Реактивность дозы определяют посредством регрессионного анализа и уровень значимости задают равным 5% для одной стороны.
(10) Результаты
Среднюю артерию головного мозга перекрывают найлоновым эмболом, который удаляют через 2 часа для возобновления кровотока, и через 24 часа после окклюзии средней артерии головного мозга измеряют объем очага поражения инфарктом. В результате выполненного эксперимента установлено, что соединение по настоящему изобретению существенно уменьшает объем очага поражения инфарктом коры головного мозга, при этом регрессионный анализ подтверждает зависимость, существующую между вводимой дозой и уменьшением очага поражения инфарктом при использовании соединения по настоящему изобретению. Например, соединение по примеру 70 уменьшает объем очага поражения инфарктом коры головного мозга соответственно на 4% (128,9±12,5 мм3, n=16), 20% (108,0±14,9 мм3, n=15) и 44% (75,7±11,2 мм3, n=12; р<0,01) при внутривенном введении в дозах 1,5, 5 и 15 мг/кг/час через 30 минут после окклюзии средней артерии головного мозга по сравнению с объемом очага поражения инфарктом коры головного мозга, равным 134,3±12,3 мм3 (n=19) для контрольной группы. Соединение по примеру 75 уменьшает объем очага поражения инфарктом коры головного мозга соответственно на 26% (119,9±12,6 мм3, n=16), 37% (102,0±14,1 мм3, n=14; p<0,01) и 49% (83,7±21,3 мм3, n=11; р<0,01) при внутривенном введении в дозах 1,5, 5 и 15 мг/кг в час через 30 минут после окклюзии средней артерии головного мозга по сравнению с объемом очага поражения инфарктом коры головного мозга, равным 162,9±8,4 мм3 (n=15) для контрольной группы.
А именно, соединение по настоящему изобретению ингибирует приток ионов кальция в синаптосомы коры головного мозга крысы, индуцируемый высокой концентрацией КСl, и препятствует выделению глутаминовой кислоты из среза коры головного мозга крысы. Кроме того, соединение по настоящему изобретению защищает нервные клетки от поражения, вызываемого локальной ишемией головного мозга в данном эксперименте, и существенно уменьшает очаг поражения инфарктом при введении через 30 минут после возникновения ишемии. Таким образом, соединение по настоящему изобретению оказывает эффективное действие даже при введении после кровоизлияния в мозг у человека.
Полученные результаты подтверждены отчетами, в которых SNX-111 (CAS Registration No. 107452-89-1), являющийся пептидом, ингибирующим кальциевый канал N-типа, препятствует высвобождению глутаминовой кислоты из коры головного мозга и предотвращает последующее поражение нервных клеток в животной модели локальной ишемии головного мозга у крыс (13) и (14), а также отчетом, в котором ω-агатоксин IVA, являющийся пептидом, ингибирующим кальциевый канал P/Q-типа, оказывает защитное действие на нервные клетки в животной модели локальной ишемии коры головного мозга у крыс (15).
Ссылки
1) Schanne, F.A.X., Kane, А.В., Young, E.E., Farber, J.L. Calcium dependence of toxic cell death: a final common pathway. Science 206: 700-702 (1979).
2) Kristian, Т., Siesjo, В.К. Calcium in ischemic cell death. Stroke 29: 705-718 (1998).
3) Graham, S.H., Shiraisi, К., Panter, S.S., Simon, R.P., Faden, A.I. Changes in extracellular amino acid neurotransmitters produced by focal cerebral ischemia. Neurosci. Lett. 110: 124-130 (1990).
4) Rothman, S.M., Olney, J.W. Glutamate and the pathophysiology of hypoxic-ischemic brain damage. Ann. Neurol. 19: 105-111 (1986).
5) Siesjo, В.К., Bengtsson, F.Calcium influxes, calcium antagonists, and calcium-related pathology in brain ischemia, hypoglycemia, and spreading depression: A unifying hypothesis. J. Cereb. Blood Flow Metab. 9: 127-140 (1989).
6) Mayer, M.L., Miller, R.J. Excitatory amino acid receptors, second messengers and regulation of intracellular Ca2+ in mammalian neurons. Trends Pharmacol. Sci. 11: 254-260 (1990).
7) Osuga, H., Hakim, A.M.Relationship between extracellular glutamate concentration and voltage-sensitive calcium channel function in focal cerebral ischemia in the rat. J.Cereb. Blood Flow Metab. 16: 629-636 (1996).
8) Choi, D.W.Calcium-mediated neurotoxicity: Relationship to specific channel types and role in ischemic damage. Trends Neurosci. 11: 465-469 (1988).
9) Randall, A.D., Tsien, R.W. Pharmacological dessection of multiple types of Са2+ channel currents in rat cerebellar granule neurons. J. Neurosci. 15: 2995-3012 (1995).
10) Turner, T.J., Dunlap, К. Pharmacological characterization of presynaptic calcium channels using subsecond biochemical measurements of synaptosomal neurosecretion. Neuropharmacology 34: 1469-1478 (1995).
11) Maubecin, V.A., Sanchez, V.N., Rosato Siri, M.D., Cherksey, B.D., Sugimori, K., Llinas, R., Uchitel, O.D. Pharmacological characterization of the voltage-dependent Ca2+ channels present in synaptosomes from rat and chicken central nervous system. J. Neurochem. 64: 2544-2551 (1995).
12) Longa, E.Z., Weinstein, P.P., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke 20: 84-91 (1989).
13) Bowersox, S.S., Singh, Т., Luther, R.R. Selective blockade of N-type voltage-sensitive calcium channels protects against brain injury after transient focal ischemia in rats, Brain Res. 747: 343-347 (1997).
14) Takizawa, S., Matsushima, К., Fujita, H., Nanri, К., Ogawa S., Shinohara, Y. A selective N-type calcium channel antagonist reduces extracellular glutamate release and infarct volume in focal cerebral ischemia. J.Cereb. Blood flow Metab. 15: 611-618 (1995).
15) Asakura, К., Matsuo, Y., Kanemasa, Т., Ninomiya, M.P/Q-type Ca2+ channel blocker ω-agatoxin IVA protect against brain injury after focal ischemia in rats. Brain Res. 7760: 140-145 (1997).
Испытательный пример 3
Аналгезирующее действие (I) при вызывании реакции на формалин у мышей
Кальциевый канал N-типа, который является одним из нейронспецифических кальциевых каналов, можно избирательно ингибировать препаратом SNX-111, являющимся низкомолекулярным полипептидом. Кроме того, известно, что SNX-111 оказывает аналгезирующее действие при введении в спинной мозг в ответ на вызванную формалином реакцию, что является одним из методов испытания аналгезирующего действия (1) и (2). Поэтому у соединений по настоящему изобретению оценивают аналгезирующее действие при вызывании реакции на формалин у мышей (3).
(1) Подопытные животные
В эксперименте использованы мыши Ddy (самцы в возрасте 4-7 недель), предоставленные фирмой Japan SLC Со. Мышей адаптируют в течение 4 или более дней (условия содержания: комнатная температура 23±1°С, влажность воздуха 55±5%, цикл чередования света и темноты каждые 12 часов). Мышей расселяют группами, состоящими примерно из 20 мышей, по клеткам из поликарбоната с напольным покрытием, рассчитанным на 20 мышей (White Flake, Charles River Co., Ltd. Tokyo), и выкармливают. Утром в день испытания мышей переносят в лабораторию. Мыши без ограничения получают корм MF (Oriental Yeast Co., Tokyo). Кроме того, они без ограничения получают питьевую воду.
(2) Испытуемое соединение
В качестве испытуемых соединений используют соединения по примерам 7, 20, 47, 49, 58, 63, 64, 198, 199, 209, 189, 123, 124, 219 и 221. В качестве контрольных лекарственных средств используют известные аналгетики, такие как морфин, который является сильным наркотическим аналгетиком, и индометацин, который является противовоспалительным аналгетиком.
(3) Приготовление испытуемого соединения
Соединение по настоящему изобретению растворяют в 5,28% манните с концентрацией 1 мг/мл (10 мг/кг). Испытуемые соединения взвешивают для приготовления в день эксперимента. Морфин растворяют в физиологическом растворе с концентрацией 3 мг/мл (30 мг/кг) и индометацин суспендируют в 0,5% метилцеллюлозе с концентрацией 1 мг/мл (10 мг/кг). Испытуемые соединения взвешивают в день эксперимента.
(4) Получение реагента
Отбирают 30 мкл коммерчески производимого 35,0-38,0% раствора формальдегида и добавляют к 970 мкл физиологического раствора. Полученный раствор используют в качестве 3% формалина. Формалин является 37% раствором формальдегида, и поскольку чистота используемого раствора формальдегида равна 35,0-38,0%, то 3% формалин, полученный для использования в данном эксперименте, представляет собой как раз 2,84-3,08% формалин.
(5) Доза, способ введения, количество образцов
Внутривенно вводят 10 мг/кг соединения по настоящему изобретению (0,1 мл раствора с концентрацией 1 мг/мл в расчете на 10 г массы тела). Перорально вводят 30 мг/кг морфина (0,1 мл раствора с концентрацией 3 мг/мл в расчете на 10 г массы тела). Кроме того, перорально вводят 10 мг/кг индометацина (0,1 мл суспензии с концентрацией 1 мг/мл в расчете на 10 г массы тела). В качестве контрольных веществ внутривенно или перорально вводят 0,1 мл соответствующих растворителей в расчете на 10 г массы тела. В каждой группе испытывают пять разных образцов.
(6) Способ испытания
В хвостовую вену вводят 10 мг/кг соединения по настоящему изобретению, перорально вводят 30 мг/кг морфина, а также 10 мг/кг индометацина. Через 5, 30 и 90 минут после соответствующего введения в подошву левой задней лапы мыши подкожно вводят 20 мкл 3% формалина и помещают мышь в клетку для наблюдения из прозрачного пластика. После введения формалина в течение 5 минут определяют время воздействия, на протяжении которого мышь лижет свою левую заднюю лапу, и полученный результат рассматривают в качестве показателя болевого ощущения. Соответствующие растворители вводят аналогичным образом в качестве контрольных веществ. Принимая время облизывания при введении контрольного вещества за 100%, по нижеследующей формуле высчитывают степень уменьшения болевого ощущения (%) соединением по настоящему изобретению.
Формула:
Степень уменьшения болевого ощущения (%) = (время облизывания при введении контрольного вещества - время облизывания при введении испытуемого соединения)/(время облизывания при введении контрольного вещества) х 100
(7) Результаты
Соединение по настоящему изобретению на статистически значимом уровне уменьшает время облизывания по сравнению с контрольной группой, причем степень уменьшения болевого ощущения находится в пределах 33-88%. В частности, аналгезирующее действие соединения по примеру 189 соответствует 59% уменьшению болевого ощущения. С другой стороны, аналгезирующее действие морфина соответствует 54% уменьшению болевого ощущения, и степень уменьшения болевого ощущения индометацином составляет -38%, при этом аналгезирующее действие не обнаружено.
Будучи нейронспецифическим ингибитором кальциевого канала, соединение по настоящему изобретению оказывает аналгезирующее действие, подобное SNX-111, который является ингибитором кальциевого канала N-типа, и морфину, который является сильным наркотическим аналгетиком даже в сравнении с известными аналгетиками, и оказывает гораздо более сильное аналгезирующее действие, чем индометацин, который является противовоспалительным аналгетиком. Таким образом, соединение по настоящему изобретению является исключительно полезным для лечения и ослабления болевого синдрома.
Ссылки
1) Annika В. Malmberg, and Tony L.Yaksh (1994) Voltage-Sensitive Calcium Channels in Spinal Nociceptive Processing: Blockade of N- and P- Type Channels Inhibits Formalin-Induced Nociception. The Journal of Neuroscience 14(8): 4882-4890.
2) S.Scott Bowersox, Theresa Gadbois, Tejinder Singh, Mark Pettus, Yong-Xiang Wang and Robert R. Luther (1996) Selective N-type Neuronal Voltage-Sensitive Calcium Channel Blocker, SNX-111, Produces Spinal Antinociception in Rat Models of Acute, Persistent and Neuropathic Pain. The Journal of pharmacology and Experimental Therapeutics 279 (3): 1243-1249.
3) Hunskaar S., Fasmer O.В. and Hole К. (1985) Formalin test in mice, a useful technique for evaluating mild analgesics. Journal of Neuroscience Methods 14 (1): 69-76.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ N, N-ЗАМЕЩЕННОГО ЦИКЛИЧЕСКОГО АМИНА | 1999 |
|
RU2232156C2 |
| ПИПЕРИДИНОВОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ НАТРИЕВЫХ КАНАЛОВ И КАЛИЕВЫХ КАНАЛОВ | 2001 |
|
RU2259365C2 |
| Новые производные пиразола | 2022 |
|
RU2816835C1 |
| ПРОИЗВОДНЫЕ ЗАМЕЩЕННОГО ПИРРОЛОПИРИДИНОНА, ПРИГОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗЫ | 2001 |
|
RU2267490C2 |
| 2, 5-ДИОКСОИМИДАЗОЛИДИН-4-ИЛ-МЕТИЛКАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ В ИЗГОТОВЛЕНИИ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2003 |
|
RU2326117C2 |
| ПРОИЗВОДНЫЕ 2-АМИНОПИРИДИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 2001 |
|
RU2250898C2 |
| АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1996 |
|
RU2182574C2 |
| Соединения, обладающие активностью антагонистов мускариновых рецепторов и агонистов бета-2-адренергических рецепторов | 2016 |
|
RU2709777C2 |
| АЛКИНИЛ-ЗАМЕЩЕННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2017 |
|
RU2729069C1 |
| НОВОЕ ПРОИЗВОДНОЕ КУМАРИНА, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2428420C2 |
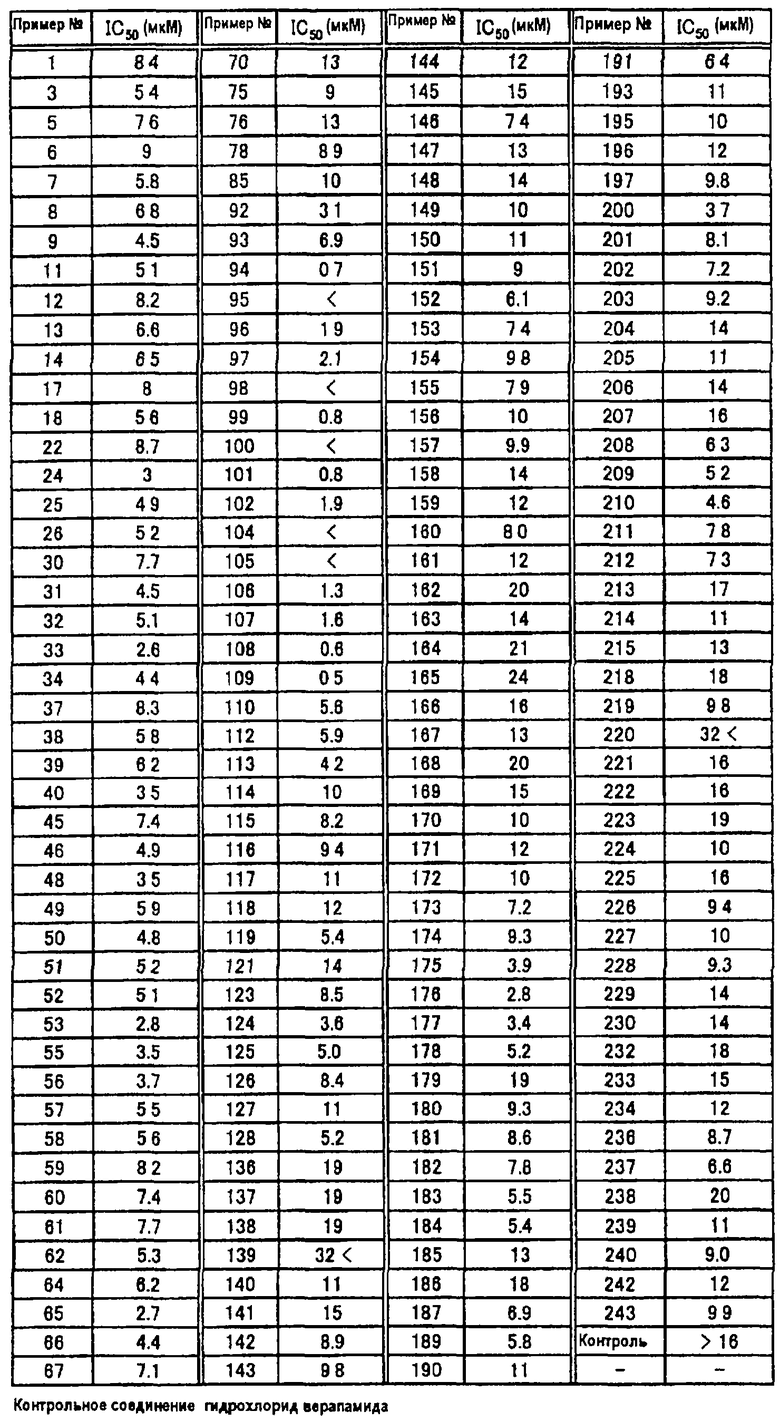
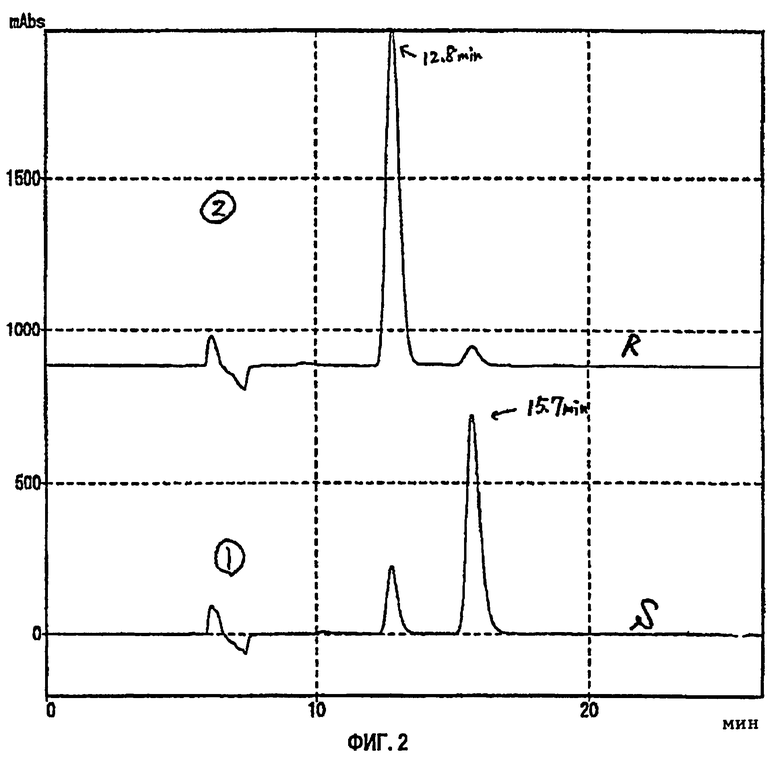
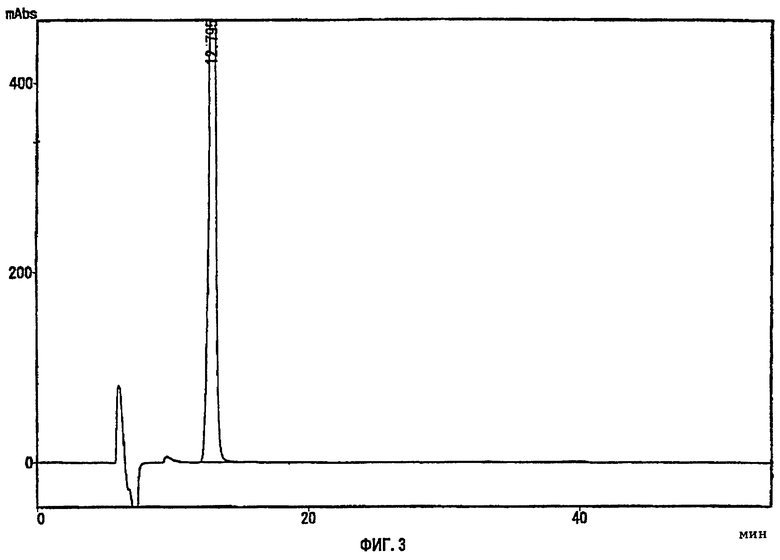
Настоящее изобретение относится к новому соединению, характеризующемуся высокой степенью антагонизма в отношении кальция, в частности нейронизбирательного антагонизма в отношении кальция. Данное изобретение относится к соединению нижеследующей формулы, его соли или гидрату.
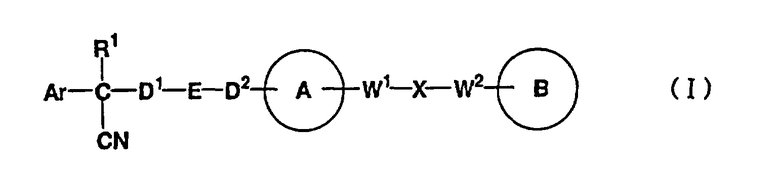
В указанной формуле Ar означает необязательно замещенное 5-14-членное ароматическое кольцо и тому подобное; кольцо А представляет любое кольцо, выбираемое из пиперазина, гомопиперазиина, пиперидина и тому подобных; кольцо В представляет необязательно замещенное С3-14 углеводородное кольцо и тому подобное; Е означает простую связь, группу формулы -СО- и тому подобные; Х означает простую связь, атом кислорода и тому подобные; R1 означает атом водорода, атом галогена, гидроксильную группу и тому подобные; D1, D2, W1 и W2 имеют одинаковые или разные значения и представляют каждый простую связь или необязательно замещенную C1-6 алкиленовую цепь. 4 с.и 46 з.п. ф-лы, 3 ил., 1 табл.
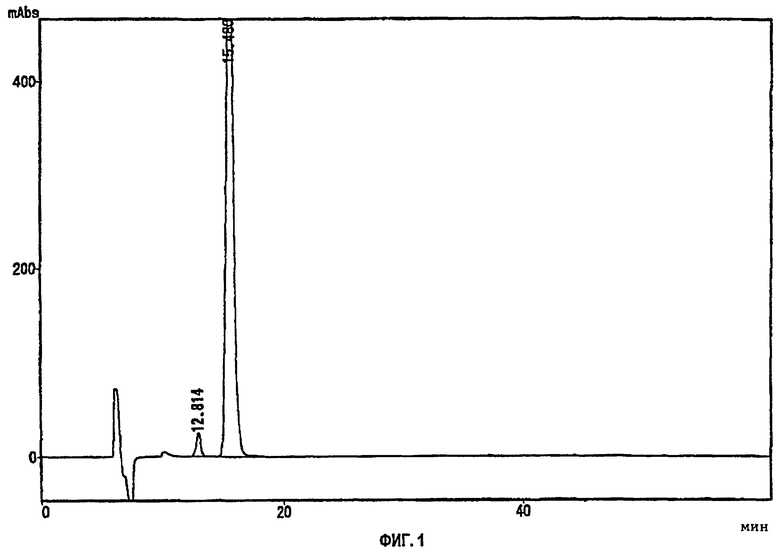
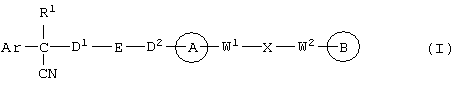
где Ar означает С6-14 ароматическую углеводородную циклическую группу, которая может быть замещена, 5-14-членную ароматическую гетероциклическую группу, которая может быть замещена;
кольцо А представляет соответственно пиперазиновое кольцо, гомопиперазиновое кольцо, пиперидиновое кольцо, пирролидиновое кольцо или диазабицикло[2,2,1]гептановое кольцо, которые, соответственно, могут быть замещены;
кольцо В представляет С3-14 углеводородное кольцо, которое может быть замещено, или 5-14-членное гетероциклическое кольцо, которое может быть замещено;
Е означает простую связь или группу формулы -СО-;
Х означает простую связь, атом кислорода, С1-6 алкиленовую цепь, которая может быть замещена, группу формул -СО-, -SO-, -SO2-, -NR8SO2- (где R8 означает атом водорода или С1-6 алкильную группу, которая может быть замещена), >C=N-OR9 (где R9 означает атом водорода или С1-6 алкильную группу, которая может быть замещена), -NH-CO-NH-, -NH-CS-NH-, -C(=NR15)NR16- (где R15 и R16 имеют одинаковые или разные значения и представляют атом водорода, нитрильную группу, С1-6 алкильную группу, С2-6 алкенильную группу, С3-8 циклоалкильную группу или С3-8 циклоалкенильную группу), -NHC(=NH)-, -О-CO-S-, -S-CO-O-, ОCOO-, -NHCOO-, -OCONH-, -CO(CH2)mO- (где m означает 0 или целое число от 1 до 6), -СНОН- или -СНОН(СН2)nО- (где n означает 0 или целое число от 1 до 6);
R1 означает атом галогена, гидроксильную группу, С1-6 алкильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы, С2-6 алкенильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы, С2-6 алкинильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы, С3-8 циклоалкильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы, С1-6 алкокси-С1-6 алкильную группу; и
D1, D2, W1 и W2 имеют одинаковые или разные значения и представляют простую связь или С1-6 алкиленовую цепь, которая может быть замещена,
при условии, что из приведенного выше определения исключены 1-[4-циано-5-метил-4-(2-циано-5-тиенил)гексил]-4-[2-(4-фторфенокси)этил]пиперазин; 1-[4-циано-5-метил-4-(2-циано-5-тиенил)гексил]-4-[2-(3-фторфенокси)этил]пиперазин и 1-[4-циано-5-метил-4-(2-тиенил)гексил]-4-[2-(3-фторфенокси)этил] пиперазин.
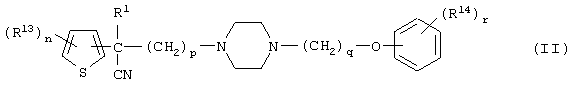
где R1 имеет приведенные выше значения;
R13 и R14 имеют одинаковые или разные значения и представляют атом водорода, атом галогена, гидроксильную группу, меркаптогруппу, С1-6 алкильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы и атома галогена, С1-6 алкоксильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и С1-6 алкоксикарбонильной группы, нитрогруппу, аминогруппу, которая может быть замещена, цианогруппу, карбоксильную группу, С1-6 алкоксикарбонильную группу, С1-6 тиоалкоксильную группу, С1-6 алкилсульфонильную группу, низшую ацильную группу, С6-14 ароматическую углеводородную циклическую группу, которая может быть замещена, 5-14-членную ароматическую гетероциклическую группу, которая может быть необязательно замещена, арилоксигруппу или аралкилоксигруппу, либо все вместе элементы R13 или все вместе элементы R14 связаны друг с другом с образованием алифатического кольца, которое может быть замещено, гетероциклического кольца, которое может быть замещено, или алкилендиоксигруппы; n означает 0 или целое число от 1 до 3; р означает целое число от 1 до 6; q означает целое число от 1 до 6; и r означает 0 или целое число от 1 до 5,
при условии, что из приведенного выше определения исключены 1-[4-циано-5-метил-4-(2-циано-5-тиенил)гексил]-4-[2-(4-фторфенокси)этил]пиперазин; 1-[4-циано-5-метил-4-(2-циано-5-тиенил)гексил]-4-[2-(3-фторфенокси)этил]пиперазин и 1-[4-циано-5-метил-4-(2-тиенил)гексил]-4-[2-(3-фторфенокси)этил]пиперазин.
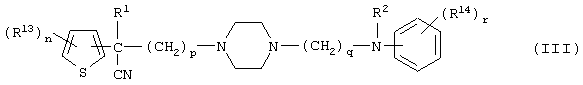
где в указанной формуле R1 и R2 имеют приведенные выше значения;
R13 и R14 имеют одинаковые или разные значения и представляют атом водорода, атом галогена, гидроксильную группу, меркаптогруппу, С1-6 алкильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы и атома галогена, С1-6 алкоксильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и С1-6 алкоксикарбонильной группы, нитрогруппу, аминогруппу, которая может быть замещена, цианогруппу, карбоксильную группу, С1-6 алкоксикарбонильную группу, С1-6 тиоалкоксильную группу, С1-6 алкилсульфонильную группу, низшую ацильную группу, С6-14 ароматическую углеводородную циклическую группу, которая может быть замещена, 5-14-членную ароматическую гетероциклическую группу, которая может быть замещена, арилоксигруппу, аралкилоксигруппу, или все вместе элементы R13 или все вместе элементы R14 могут быть связаны друг с другом с образованием алифатического кольца, которое может быть замещено, гетероциклического кольца, которое может быть замещено, или алкилендиоксигруппы; n означает 0 или целое число от 1 до 3; р означает целое число от 1 до 6; q означает целое число от 1 до 6; r означает 0 или целое число от 1 до 5.
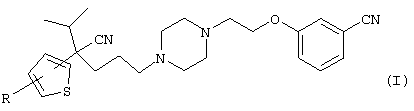
где R означает атом водорода или нитрил.
1-[4-циано-5-метил-4-(5-циано-2-тиенил)гексил]-4-[2-(3-цианофенокси)этил]пиперазина;
1-[4-циано-5-метил-4-(2-тиенил)гексил]-4-[2-(3-ианофенокси)этил]пиперазина;
1-[4-циано-5-метил-4-(3-циано-2-тиенил)гексил]-4-[2-(3-цианофенокси)этил]пиперазина
и
1-[4-циано-4-(3-циано-5-тиенил)-5-метилгексил]-4-[2-(3-цианофенокси)этил]пиперазина.
1-[4-циано-5-метил-4-(5-циано-2-тиенил)гексил]-4-[2-(3-цианофенокси)этил]пиперазина;
1-[4-циано-5-метил-4-(3-циано-2-тиенил)гексил]-4-[2-(3-цианофенокси) этил]пиперазина
и
1-[4-циано-4-(3-циано-5-тиенил)-5-метилгексил]-4-[2-(3-цианофенокси)этил]пиперазина.
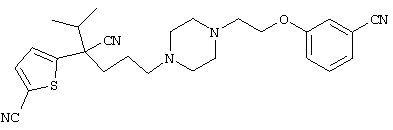 .
.
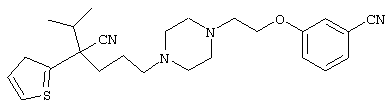 .
.
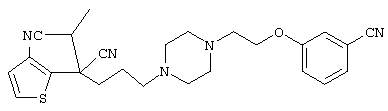
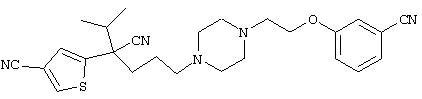 .
.
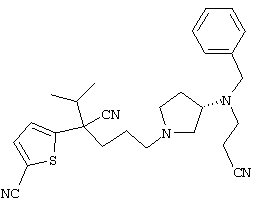
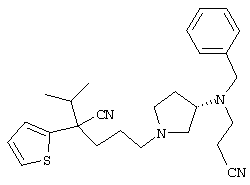
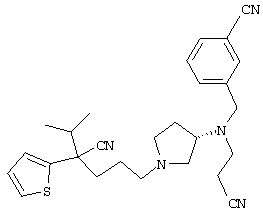
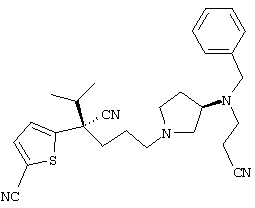
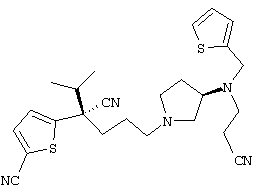
4-[(4-циано-5-метил-4-фенил)гексил]-N-(4-фторфенил)-N'-(2-метилпропил)-1(2Н)-пиразинкарбоксиимидамид;
1-изопропил-4-[4-(1-изобутил-1Н-бензо[d]имидазол-2-ил)пиперазино]-1-фенилбутилцианид;
1-[4-циано-5-метил-4-(5-циано-2-тиенил)гексил]-4-[2-(3-цианофенокси)этил]пиперазин;
1-[4-циано-5-метил-4-(2-тиенил)гексил]-4-[2-(3-цианофенокси)этил]пиперазин;
1-[4-циано-5-метил-4-(5-циано-2-тиенил)гексил]-4-[3-(5-циано-2-тиенил)пропил]пиперазин;
1-[4-циано-5-метил-4-(3-тиенил)гексил]-4-[2-(3-цианофенокси)этил]пиперазин;
1-{4-циано-5-метил-4-[4-(2-циано)тиенил]гексил}-4-[2-(3-цианофенокси)этил]пиперазин;
1-[(4-циано-5-метил-4-фенил)гексил]-4-[(2-бензоксазолил)амино]пиперидин;
1-[4-циано-4-(5-циано-2-тиенил)-5-метилгексил]-(3S)-3-[N-(2-цианоэтил)-N-бензиламино]пирролидин;
1-[4-циано-4-(5-циано-2-тиенил)-5-метилгексил]-(3R)-3-[N-(2-цианоэтил)-N-бензиламино]пирролидин;
1-[(4-циано-5-метил-4-фенил)гексил]-4-(бензотиазолил]пиперазин;
1-[(4-циано-5-метил-4-фенил)гексил]-4-[2-(6-метокси)бензотиазолил]пиперазин;
1-[(4-циано-5-метил-4-фенил)гексил]-4-(2-бензоксазолил)пиперазин;
1-[(4-циано-5-метил-4-фенил)гексил]-4-(2-хинолинил)пиперазин;
4-[4-(1-метил-1Н-бензо[d]имидазол-2-ил)-1,4-диазепан-1-ил]-1-изопропил-1-фенилбутилцианид;
4-[4-(1-этил-1Н-бензо[d]имидазол-2-ил)-1,4-диазепан-1-ил]-1-изопропил-1-фенилбутилцианид;
этил-4-(4-циано-5-метил-4-фенилгексил)-1-[2-(4-фторфенокси)этил]-2-пиперазинкарбоксилат;
1-[(2-оксо-1,2-дигидро-3-хинолил)метил]-4-[(4-циано-5-метил-4-фенил)гексил]пиперидин;
4-[(4-циано-5-метил-4-фенил)гексил]-1-{[2-(метансульфониламино)фенил]метил}пиперазин;
4-[(4-циано-5-метил-4-фенил)гексил]-1-{[2-(метансульфониламино)фенил]метил}пиперидин;
{1-[4-циано-5-метил-5-(2-тионил)гексил]пиперазинил}амид(S)-3-фенил-2-аминопропановой кислоты;
4-[4-(4-фенилпиперидинил)пиперидинил]-1-изопропил-1-фенилбутилцианид;
4-[4-(4-циано-4-фенилпиперидинил)пиперидинил]-1-изопропил-1-фенилбутилцианид и
4-[4-(4-бензилпиперидинил)пиперидинил]-1-изопропил-1-фенилбутилцианид.
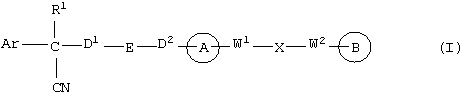
где Ar означает С6-14 ароматическую углеводородную циклическую группу, которая может быть замещена, 5-14-членную ароматическую гетероциклическую группу, которая может быть замещена;
кольцо А представляет соответственно пиперазиновое кольцо, гомопиперазиновое кольцо, пиперидиновое кольцо, пирролидиновое кольцо или диазабицикло[2,2,1]гептановое кольцо, которые соответственно могут быть замещены;
кольцо В представляет С3-14 углеводородное кольцо, которое может быть замещено, или 5-14-членное гетероциклическое кольцо, которое может быть замещено;
Е означает простую связь или группу формулы -СО-;
Х означает простую связь, атом кислорода, С1-6 алкиленовую цепь, которая может быть замещена, группу формулы -СО-, -SO-, -SO2-, -NR8SO2- (где R8 означает атом водорода или С1-6 алкильную группу, которая может быть замещена), >C=N-OR9 (где R9 означает атом водорода или С1-6 алкильную группу, которая может быть замещена), -NH-CO-NH-, -NH-CS-NH-, -C(=NR15)NR16- (где R15 и R16 имеют одинаковые или разные значения и представляют атом водорода, нитрильную группу, С1-6 алкильную группу, С2-6 алкенильную группу, С3-8 циклоалкильную группу или С3-8 циклоалкенильную группу), -NHC(=NH)-, -О-CO-S-, -S-CO-O-, -ОCOO-, -NHCOO-, -OCONH-, -CO(CH2)mO- (где m означает 0 или целое число от 1 до 6), -СНОН- или -СНОН(СН2)nО- (где n означает 0 или целое число от 1 до 6);
R1 означает атом галогена, гидроксильную группу, С1-6 алкильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы, С2-6 алкенильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы, С2-6 алкинильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы, С3-8 циклоалкильную группу, которая может быть замещена одной или несколькими группами, выбираемыми из гидроксильной группы, атома галогена и нитрильной группы, С1-6 алкокси-С1-6 алкильную группу; и
D1, D2, W1 и W2 имеют одинаковые или разные значения и представляют простую связь или С1-6 алкиленовую цепь, которая может быть замещена,
при условии, что из приведенного выше определения исключены 1-[4-циано-5-метил-4-(2-циано-5-тиенил)гексил]-4-[2-(4-фторфенокси)этил]пиперазин; 1-[4-циано-5-метил-4-(2-циано-5-тиенил)гексил]-4-[2-(3-фторфенокси)этил]пиперазин и 1-[4-циано-5-метил-4-(2-тиенил)гексил]-4-[2-(3-фторфенокси)этил] пиперазин.
| Огнетушитель | 0 |
|
SU91A1 |
Авторы
Даты
2004-06-10—Публикация
2001-01-18—Подача