Изобретение относится к производным 2,5-диазабицикло [2.2.1]гептана и к способу их получения. Указанные соединения могут быть в качестве промежуточных продуктов при получении антибиотических хинолинов.
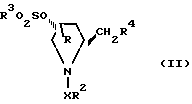
Более конкретно изобретение относится к производным 2,5-диазабицикло [2.2.1]- гептана формулы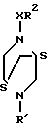 (I) где Х представляет SO2;
(I) где Х представляет SO2;
R1 - С1-С6-алкил;
R2 - фенил, замещенный С1-С6-алкилом, и к способу их получения, предусматривающему взаимодействие соединения формулы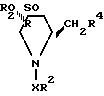 (II) где Х - SO2;
(II) где Х - SO2;
R2 и R3 каждый независимо представляет фенил, замещенный С1-С6-алкилом;
R4 - галоген, OSO2R3, где R3 имеет значения, определенные выше, или гидрокси с (С1-С6)-алкиламином или аммиаком.
В предпочтительном осуществлении настоящего изобретения, в приведенных выше формулах указанный С1-С6-алкиламин является метиламином, а R2 - п-толилом.
Более предпочтительно R1 представляет метил, а R2 - п-толил. Соединения формулы I имеют оптические центры и могут существовать в двух стереоизометрических конфигурациях S, S-конфигурации и R,R-конфигурации. Настоящее изобретение охватывает оба стереоизомера соединений формулы I, а также их рацемическую смесь. В приведенных здесь формулах указывается конкретно конфигурация R или S, они обозначаются соответственно R и S.
Исходные соединения формулы II, представленной выше, могут быть получены путем взаимодействия соединения формулы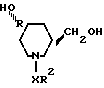 или его энантиомера или рацемата с соединением формулы
или его энантиомера или рацемата с соединением формулы
R3SO2X1, (IV) где R3 является фенилом, замещенным С1-С6-алкилом, а Х1 является галогеном или OSO2R3, где R3 определен выше.
Термин "алкил" в определениях групп R1,R2,R3 или R4 означает насыщенный одновалентный прямой или разветвленный алифатический углеводородный радикал, такой как метил, этил, пропил, трет-бутил, гексил и т.п. Термин "галоген" означает фтор, хлор, бром или йод.
Способ получения соединения I из соединения II осуществляют, в основном, с избытком алкиламина, предпочтительно около трех молярных эквивалентов алкиламина. Реакцию проводят в герметично закрытом сосуде, что зависит от вида используемого алкиламина. Например, поскольку метиламин и этиламин при реакционных температурах являются газами, то реакцию необходимо проводить в герметично закрытом сосуде. В основном, реакцию осуществляют в спиртовом растворе или воде, предпочтительно в метаноле или воде. Температура реакции колеблется в пределах ≈ 50-130оС и составляет около 90оС.
Способ получения соединения II из соединения III обычно осуществляют в инертном растворителе. Соответствующими растворителями являются неполярные растворители, такие как толуол и бензол. Реакцию проводят в присутствии основания. Подходящими основаниями являются алифатические органические основания, такие как третичный С1-С6-алкиламин, например триэтиламин, или ароматические органические основания, такие как 2,6-лютидин, пиридин, С1-С6-алкилзамещенный пиридин или N,N-диметил-4-аминопиридин. Предпочтительно, реакцию проводят в пиридине, который выполняет функции основания и растворителя. Соединение IV присутствует, в основном, в избытке двух молярных эквивалентов, предпочтительно в количестве трех молярных эквивалентов. Реакционная температура колеблется в пределах приблизительно 0-50оС, и составляет около 15оС.
Ниже приводятся примеры, иллюстрирующие настоящее изобретение.
П р и м е р 1. (1S,4S)-2-(4-толуолсульфонил)-5-метил-2,5-диазабицикло-[2.2.1.] гептан.
В сосуд Парра загружали 115 г (198,4 ммоль) (2S,4R)-1-(4-толуолсульфонил)-2-(п-толуолсульфонилоксиметил)-4- (4-толуолсульфонилокси)-пирролидина и 690 мл металола, а затем сосуд тарировали. Газ - метиламин - барботировали в раствор метанола, до тех пор, пока не растворится 62 г (2 моль) газа. Затем сосуд герметично закрывали и нагревали до 90оС. После нагревания в течение 16 ч реакционную смесь охлаждали, а растворитель выпаривали при пониженном давлении. Оставшиеся твердые вещества распределяли между 500 мл метиленхлорида и 400 мл 10%-ного водного раствора гидроксида натрия. Слои отделяли, а органический слой промывали 400 мл 10%-ного водного раствора гидроксида натрия и высушивали сульфатом натрия. После выпаривания растворителя при пониженном давлении получали 47,5 г целевого продукта (выход 90%; т.пл.87-88оС).
П р и м е р 2. (1S,4S)-2-(4-толуолсульфонил)-5-метил-2,5-диазабицикло-[2.2.1.] гептан.
В сосуд Парра загружали 3,8 г (8,56 ммоль) (2S,4R)-1-(4-толуолсульфонил)-2-(хлорометил)-4-(4- толуолсульфонилокси)-пирролидина и 25 мл метанола, после чего сосуд тарировали. Затем через раствор метанола пропускали газ метиламин, до тех пор, пока не растворится 2,65 г (85,6 ммоль) газа. После этого сосуд герметизировали и нагревали до 90оС. После нагревания в течение 16 ч реакционную смесь охлаждали, а растворитель выпаривали при пониженном давлении. Затем твердые остатки распределяли между 50 мл метиленхлорида и 40 мл 10%-ного водного раствора гидроксида натрия. Слои отделяли, а органический слой промывали 30 мл 10%-ного водного раствора гидроксида натрия. После выпаривания растворителя при пониженном давлении получали 1,73 г целевого продукта (выход 76%, т.пл. 87-88оС).
П р и м е р 3. Из (2R,4S)-1-(4-толуолсульфонил)-2-хлорметил-4-(4-толуолсульфонил- окси)- пирролина по способу, описанному в предыдущих примерах, получали (1R, 4R)-2-(4-толуолсульфонил)-5-метил-2,5-диазабици- кло-[2.2.1.] гептан; т.пл.82-87оС.
П р и м е р 4. (1R,4R)-2-(4-толуолсульфонил)-5-метил-2,5-диазабицикло-[2.2.1.]- гептан.
В сосуд Парра загружали 0,5 г (1,29 ммоль) (2R,4S)-2-хлорметил-4-хлор-1-(4-толуолсульфонил)-пирролидина и 6 мл метанола и сосуд тарировали. Затем через метанольный раствор барботировали метиламин до тех пор, пока 0,4 г (12,9 моль) газа не растворится. Затем сосуд герметизировали и нагревали до 110оС. После нагревания в течение 16 ч реакционную смесь охлаждали, а растворитель выпаривали при пониженном давлении. Твердые остатки распределяли между 50 мл метиленхлорида и 40 мл 10%-ного водного раствора NaOH. Слои отделяли, и органический слой промывали дополнительными 40 мл 10% -ного водного раствора NaOH, а затем высушивали в присутствии Na2SO4. После выпаривания растворителя при пониженном давлении получали 309 мг целевого продукта с выходом 90% и т.пл. 82-87оС; [x]D = -16,8о. (с = =1,038, CH3OH).
Использование: в качестве промежуточных продуктов при получении антибиотических хинолинов. Сущность изобретения: 2,5-дизабицикло [2,21] гептановые соединения общей ф-лы I, где X - SO2; R1-C1-C6 -алкил; R2 - фенил, замещенный C1-C6 -алкил, или их энантиомеры, рацематы или их кислотно-аддитивные соли. Реагент 1: соедиение ф-лы II, где X и R2 указано выше, R3 -фенил, замещенный C1-C6 -алкил, R4 - галоген, гидрокси или OSO2R3 , где R3 указано выше. Реагент 2: C1-C6 -алкиламин, предпочтительно метилами или аммиак. Соединения 1,2 
 2 с.п. и 2 з.п. ф-лы.
2 с.п. и 2 з.п. ф-лы.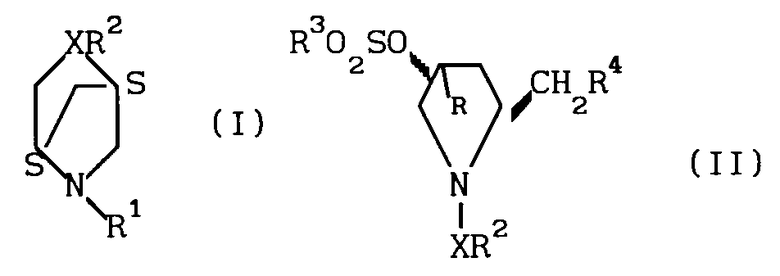
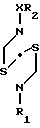
где Х - SO2;
R2 - фенил, замещенный C1-C6-алкилом;
R1 - C1-C6-алкил, или их энантиомеры, или рацематы, или кислотно-аддитивные соли.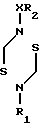
где Х - SO2;
R2 - фенил, замещенный C1-C6-алкилом;
R1 - C1-C6-алкил,
или их энантиомеров, или рацематов, или кислотно-аддитивных солей, отличающийся тем, что соединение общей формулы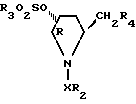
где Х и R2 имеют указанные значения;
R3 - фенил, замещенный C1-C6-алкилом;
R4 - галоген, гидрокси или OSO2 R3, где R3 имеет указанные значения,
или его энантиомер, или рацемат подвергают реакции с C1-C6=алкиламином или аммиаком.
| Патент США N 4775668, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1994-12-15—Публикация
1990-05-10—Подача