Изобретение относится к области медицины, в частности, к иммунологии и может быть использовано для определения и детектирования иммунологически реактивного аналита.
Известен способ иммуноанализа аналита, который включает использование антител, иммобилизованных на нитроцеллюлозной мембране. Антитела используют для поглощения антигенов при иммунофильтрации образца через мембрану. После этого мембрану окрашивают коллоидным золотом, связывающим антитела. Красное пятно означает положительную реакцию. В способе имеются две стадии, связанные с жидкостью, а для его осуществления требуется предварительная подготовка и использование мембраны, с которой связываются специфические антитела.
Изобретение обеспечивает улучшенный, чувствительный и специфичный метод анализа, в котором применяются стабильные компоненты и обеспечивается стабильный результат анализа. В соответствии с изобретением процесс предусматривает обнаружение и детектирование иммунологически реактивного анализа в водном образце. Процесс включает обеспечение меченым компонентом, содержащим продукт сочетания иммунологически реактивного вещества и частицы, содержащий металл, размер и характер которой способствует сохранению в целом стабильной новодисперсной суспензии меченого компонента. Также обеспечивается наличие твердофазного компонента, который включает продукт сочетания иммунологически реактивного вещества и твердофазной частицы, размер и характер которой способствует сохранению в целом стабильной суспензии твердофазного компонента. Твердофазный компонент и меченый компонент перемешивают и подвергают взаимодействию с анализируемым образцом для получения единой смешанной водной суспензии, содержащей компоненты и анализируемый образец аналита. Иммунологически реактивные вещества, соединенные с частицами, способны к прямому и непрямому связыванию, что является функцией присутствия аналита, образуя тем самым дисперсный собираемый твердофазный композит, содержащий металл. Метод включает конечную стадию сбора композита и определение или детектирование аналита в образце посредством прямого визуального исследования для установления присутствия металла в собранном твердофазном композите.
Метод полезен при определении и детектировании иммунологически реактивных аналитов, в общем и в частности аналитов, являющихся лигандами или антилигандами, которые иногда упоминаются как рецепторы лигандов. В более специфических аспектах и изобретения частицы, содержащие металлы, являются предпочтительно частицами золя металла. Размер частиц колеблется в области от примерно 50 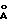 до примерно 1000
до примерно 1000 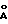 , предпочтительнее в области от примерно 135 до 500
, предпочтительнее в области от примерно 135 до 500 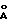 . В особенно предпочтительной форме изобретения процесс включает использование частиц золя золота.
. В особенно предпочтительной форме изобретения процесс включает использование частиц золя золота.
Меченый компонент, использованный в изобретении, может быть приготовлен принятым соединением иммунологически реактивного вещества с частицей. Кроме того, меченый компонент может быть приготовлен связыванием вещества с частицей с использованием связи биотинавидин. В последнем случае вещество может быть биотинилировано, а частицы, содержащие металл, покрыты авидиновым компонентом. Затем на веществе может произойти реакция с авидиновым компонентом на частице, в результате которой происходит соединение вещества и частицы. В альтернативной форме изобретения меченый компонент может быть получен соединением вещества с частицей с использованием бычьего сывороточного альбумина (BSA).
В соответствии с изобретением твердофазный компонент также может быть приготовлен прямым связыванием соответствующего вещества с твердофазной частицей. С другой стороны, твердофазный компонент может быть приготовлен связыванием вещества с частицей с использованием BSA-связи. А еще в одной альтернативной форме твердофазный компонент может быть приготовлен соединением вещества с частицей с использованием желатина.
В соответствии с одной предпочтительной формой реализации изобретения иммунологически реактивные вещества оба могут быть способными к связыванию аналита с образованием сэндвича. В данном случае каждое из веществ может обладать способностью антитела иммунологически связывать антиген-аналит. Предпочтительно, подобные антитела связывают, каждый на своем месте, разные участки на антигене.
В другой предпочтительной форме изобретения иммунологически реактивные вещества могут связывать друг друга, то есть, одно из веществ может быть антителом, а другое - антигеном. Предпочтительно, чтобы иммунологически реактивное вещество меченого компонента было бы антителом. В данной форме изобретения метод анализа может полагаться на метод конкурентного ингибирования.
В одном предпочтительном аспекте изобретения стадия сбора может включать в себя поглощение композита на поверхности пористого фильтрующего элемента, который обеспечивает проход фильтрата, но предотвращает проход компонента. В данном аспекте изобретения фильтрат может быть пропущен через элемент с помощью силы тяжести или центробежной, или капиллярной силы. В другом аспекте изобретения стадия сбора может состоять из осаждения композита на дно емкости ограниченного объема с образованием при этом концентрированного шарика. В следующем аспекте изобретения стадия сбора может состоять в том, что водную суспензию подвергают центрифугированию, чтобы осадить композит внутри емкости ограниченного объема, и таким образом упаковать его внутри плотного шарика.
В другом важном аспекте изобретение обеспечивает набор материалов для использования в определении и детектировании иммунологически реактивного аналита в водном образце. Набор может включать, например, меченый компонент, включающий продукт связывания иммунологически реактивного вещества и частицы, содержащей металл, размер и характер которой способствует сохранению в целом стабильной монодисперсной суспензии меченого компонента; твердофазный компонент, включающий продукт связывания иммунологически реактивного вещества и твердофазной частицы, размер и характер которой способствует поддержанию в целом стабильной суспензии твердофазного компонента, упомянутые компоненты, будучи действующими и способными к взаимодействию, образуют смешанную водную суспензию упомянутых компонентов, которая содержит анализируемый образец аналита, вещество упомянутого компонента и вещество твердофазного компонента, способные к прямому и непрямому связыванию, как функции присутствия аналита в образце, в результате чего образуется собираемый дисперсный твердофазный композит; и собирающий элемент для сбора, дающий возможность прямого визуального исследования композита с целью оценки присутствия металла в твердофазном композите, чтобы таким образом детектировать или определить начальное присутствие аналита в образце.
В еще одном из аспектов изобретение обеспечивает стабильную собранную массу твердофазного композита, содержащего металл. Композит поддается прямому визуальному наблюдению с целью установления начального присутствия, отсутствия или количества аналита в водном образце. Композит включает меченый компонент, который представляет собой продукт связывания иммунологически реактивного вещества и частицы, содержащей металл, причем размер и характер частицы в начальной стадии способствуют поддержанию в целом стабильной монодисперсной суспензии меченого компонента; твердофазный компонент, включающий продукт связывания иммунологически реактивного вещества и твердофазной частицы, размер и характер которой в начальной стадии способствуют поддержанию в целом стабильной суспензии твердофазного компонента, упомянутые вещества, будучи прямо или непрямо связанными друг с другом, присутствуют в указанном композите. В данном аспекте изобретения массу собирают на пористом фильтрующем элементе или на дне пробирки. Собранный композит относительно стабилен по окраске и может быть сохранен для подтверждения результатов анализа в более позднем времени.
В соответствии с концепциями и принципами, изложенными в изобретении, частицы золя металла, имеющие размер частиц порядка 50-1000 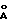 , могут быть покрыты антителами. Подобные металлические частицы, в частности частицы золя и золота, с покрытием из антител на их поверхности, уже были описаны M. Horisberger и др. в Experimentia 31, рр.1147-1149, 15 октября 1075 г. Такие частицы золота, покрытые антителом или антигеном, интенсивно окрашены в оранжевый, красный или фиолетовый цвет, в зависимости от размера частицы.
, могут быть покрыты антителами. Подобные металлические частицы, в частности частицы золя и золота, с покрытием из антител на их поверхности, уже были описаны M. Horisberger и др. в Experimentia 31, рр.1147-1149, 15 октября 1075 г. Такие частицы золота, покрытые антителом или антигеном, интенсивно окрашены в оранжевый, красный или фиолетовый цвет, в зависимости от размера частицы.
В соответствии с изобретением и совершенно неожиданно было обнаружено, что во многих иммуноанализах, которые в норме используют ферменты в качестве образователей окраски, меченые золотом иммунореагенты могут быть прямой заменой иммунореагентам, меченым ферментам, без значительной потери чувствительности. Это одно из наиболее важных открытий, так как меченые золотом антитела при условиях, описанных ниже, являются доступными прямому наблюдению невооруженным глазом, тогда как детектирование антител, меченых ферментом, требует добавления субстрата для этого фермента. При анализах, использующих золи металлов и, в особенности, золь золота, требуется одной стадией меньше и одним реагентом меньше. Кроме того, частицы коллоидного золота, в основном, значительно более стабильны, чем большинство антител, меченых ферментом.
В соответствии с методом изобретения частицы золота, покрытые иммунореагентом, смешивают с суспензией твердофазных частиц, таких, как латекс, силанизированное стекло, Сефароза, Реактогель или стекло, активированное изотиоцианатом, твердофазные частицы также покрывают иммунореагентом. Такую смешанную суспензию проводят в соприкосновении с образцом, содержащим аналит, который способен связаться с одним или обоими иммунореагентами, связываясь с фазой золя золота и суспендированое твердой фазой. Частицы золота затем иммуноспецифически связывают с твердой фазой (по типу сэндвича) или предотвращают ускоренное соединение (по типу конкурентного ингибирования). Варианты воплощения этой концепции описаны далее.
В каждом из вариантов осуществления изобретения и в примерах суспендированная твердая фаза собирается или поглощается осаждением, центрифугированием или улавливанием внутрь пористой всасывающей матрицы. Результаты анализов получают прямым визуальным исследованием поглощенной твердой фазы. При использовании частиц золя золота поглощенная твердая фаза будет окрашена либо в ярко-красный, розовый цвет или будет совершенно бесцветной, в зависимости от присутствия аналита, при том, что твердая фаза сама по себе, в отсутствие частиц золя золота, бесцветна.
Частицы золя золота, используемые в соответствии с изобретением, можно приготовить по уже известной методике. Например, приготовление частиц золя золота описано в статье G.Freus, Nature, 241, 20-22 (1973). Кроме того, частицы золя металла могут быть металлом или соединением металла, или полимерными ядрами, покрытыми металлами или металлическими соединениями. В этом отношении частицами золя металла могут быть платина, золото, серебро или медь, или любое из металлических соединений, которое обнаруживает характерное окрашивание.
Частицы твердой фазы могут включать любые из числа известных диспергируемых в воде частиц, такие, как частицы полистирольного латекса. Такие твердофазные материалы состоят просто из суспензий частиц небольшого размера, нерастворимых в воде, с которыми способны связываться белки, такие, как иммунологически реактивные вещества в изобретении.
Твердофазные частицы, полезные в связи с изобретением, могут, например, включать частицы латекса или частицы другого поддерживающего материала, такого, как оксид кремния, агароза, стекло, полиакриламид, полиметилметакрилат, модифицированный карбоксилатный латекс и Сефароза. Предпочтительно, чтобы размер частиц варьировался от примерно 0,2 мк до примерно 10 мк. В частности, полезные, коммерчески доступные материалы, включают модифицированные карбоксилатный латекс (polysciences) размером 0,99 мк, бусинки Сефарозы, активированной цианогенбромидом (Sigma), оплавленные частицы оксида кремния (Ciba Corning, lot 6), изотиоцинат - стекло (Sigma), Реактогель 25DF (pierce) и полибадкарбоксилатные монодисперсные микросферы (polysciences). В соответствии с изобретением, подобные частицы могут быть покрыты слоем иммунологически реактивных веществ, соединенных с ними по способу, известному на данном уровне техники, для получения твердофазного компонента.
Как моноклональные, так и поликлональные антитела могут быть применены, в соответствии с изобретением, для детектирования или определения специфических антигенов. Используемые моноклональные антитела можно приготовить в соответствии с описанием Milstein и Kohler. Моноклональные антитела, которые в особенности желательны в соответствии с представленным изобретением, можно приготовить с использованием активизированного полиэтиленгликолем (PEG) метода гибридизации Cefter, Margulies и Scharff, опубликованного в Somatiс Cell Cenetics том N 2, 1977, с.231-236. Подходящие антитела, пригодные для определения хорно гонадотропина человека (hcG) и лютеинизирующего гормона человека (hLH), могут быть приготовлены с использованием слегка модифицированного метода Cefter'a и др., включающего иммунизацию линии А мышей (Jackson Laboratories, Bar Harrber, Maine), либо hLН, либо hCG с использованием любого из числа известных режимов иммунизации, дозы антигена и способа представления антигена. Такие процедуры вызывают образование реактивных к антигену сывороточных антител, способных к успешной наработке гибридомных клеточных линий. В частности, были получены гибридомы путем слияния лимфоцитов мышей и Sp6 из иммунных мышей с клетками SP2/0-Ag14 (см.M.I. Shulman и G.Kohler, Nature том 274, с.917-9 (1978), посредством катализируемого полиэтиленгликолем слияния по методу Cefter'a и др. Супернатанты культуры тканевой гибридомы первоначально анализировались способами иммуноанализа на связывание твердофазного антигена в соответствии с методом Klimnan'a и др. После анализа и отбора с использованием общепринятых методов были установлены линии гибридомных клеток для получения антител, имеющих соответствующую эффективность связывания и специфичность. Антитела, полученные с использованием подобных гибридомных клеточных линий, идентифицируют, для удобства, с использованием терминологии 2В2 для hCG специфических антител, LH26 для hLH специфических антител и HCG/KLH/2G9 для антител, которые специфически взаимодействуют с обоими - и с hLH и hCG. 2В2 антитело избирательно связывает один отдельно взятый участок связывания на молекуле антигена hCG, в то время как антитело HCG/KLH/2G9 избирательно связывает самостоятельный, отдельно взятый участок связывания на молекуле hCG. Подобно этому антитела LH26 и HCG/KLH/2G9 избирательно связывают самостоятельные, отдельно взятые участки связывания на молекуле hLH.
Перечень мишеней-лигандов и антилигандов, которые потенциально могут быть детектированы или определены в соответствии с представленным изобретением, слишком велик для того, чтобы его сюда включить. Однако достаточно сказать, что лиганды и антигены, такие, как (IgE, hCG, hLH, прегнандиол-3-глюкуронид (РЗG) и другие антигены и люганды, найденные в жидкостях организма животного, так же, как и антигены, связанные с бактериями, паразитами, грибами или вирусами, такими, как, например, стрептококки, хламида или гонорея, могут быть детектированы или определены методом предложенного изобретения. Более того, терапевтические лекарства, контролируемые вещества, имеющие молекулы, такие, как, например, теофилин, могут быть детектированы или определены с использованием изобретения.
П р и м е р 1. Приготовление золя золота.
а) Частицы золя золота готовят согласно методу Frens (1973). 0,2 г Хлорауровой кислоты (HaUCl4) (AESAP, Seabrook, New Hampshire) растворяют в 2 л 19-мегаомной деионизированной дистиллированной воде и кипятят в течение 30 мин. 48 мл свежеприготовленного раствора 1% тринатриум цитрата быстро добавляют при взбалтывании. В течение 5 ммн образуется дисперсия блестящего оранжевого золя. Оптическое излучение полученных материалов обнаружило максимум поглощения при 520 нм. Диаметр полученных частиц был определен рассматриванием в электронном сканирующем микроскопе и был найден равным примерно 135  .
.
в) Частицы золя золота, имеющие диаметр в 500  , готовят, используя методику примера 1(а), за исключением того, что добавляют 15 мл тринатриум цитрата, вместо 48 мл.
, готовят, используя методику примера 1(а), за исключением того, что добавляют 15 мл тринатриум цитрата, вместо 48 мл.
П р и м е р 2. Приготовление зонда из золота.
Оптимальные условия для покрывания белками частиц золя золота отличаются от белка к белку и от одной партии частиц золя золота к другой. И такие условия обычно подбираются опытным путем.
Для определения оптимальных условий белки, предназначенные для поглощения частицами золя золота, сначала подвергаются исчерпывающему диализу при комнатной температуре против раствора, содержащего 2 мМ борат - 10 мМ азид, имеющего рН 8,0. До покрытия диализованный препарат фильтруют через 0,20 мкм фильтр Millex G.V. (Miliporo, Bedford, Massachusetts). Концентрацию белка определяют спектрофотометрически, используя коэффициент экстинкции 1.4. Для определения количества белка, нужного для оптимального покрытия частиц золя золота, составляют различные изотермы рН-концентрация белка. Метод Goodman, Hodges, Trejdosiewic и Livingston, Journal of Microscopy, том 123, ч.2, август 1981, с.201-213, используется с некоторыми модификациями, как указано ниже. Эффект рН на абсорбцию белка на частицах золота исследован в серии из 11 различных буферов, имеющих рН от 2,3 до 11,0. Буферами, использованными для повышения рН, являются трис, фосфат натрия, карбонат натрия, лимонная кислота, борная кислота, барбитал, пиперазин, морфолин, молочная кислота, салицилат натрия и фталевая кислота. Для спектрофотометрических анализов 270 мкл золя золота добавляют к 30 мкм аликвоты 70 мл буфера, содержащего азид в концентрации 10 мМ. Эти растворы взбалтывают и оставляют на 15 мин при комнатной температуре. 60 мкм раствора белка, концентрация которого 50 мкг в 1 мл раствора добавляют затем при взбалтывании. После выдерживания в течение 1 ч при комнатной температуре добавляют 60 мкл 10% раствора хлористого натрия. Поглощение измеряют при максимуме поглощения (525 нм) для нефлоккулированного золя. Реакцию также отмечают визуально, так как первоначально золь оранжево-красный, затем окраска изменяется до голубовато-серого в процессе флоккуляции. Эксплуатируя это свойство коллоидного золота, выбирают оптимальный буфер в соответствии с методикой Goodman'a и др. Изотерму белковой концентрации можно определить подобным способом, используя концентрации, колеблющиеся от 1 мг на мл до 3,9 мг на мл.
Таким способом можно подобрать оптимальный буфер и концентрацию абсорбтивного белка для каждой комбинации белковых материалов и картин золотого золя. Эффекты сверхадсорбции белка также можно изучить, используя препараты зондов при концентрациях белка выше и ниже уровней оптимального покрытия. Оптимально покрытые частицы золя золота готовят в соответствии с предшествующей методикой и используют в следующих примерах.
а) Золотой зонд, покрытый моноклональным антителом, способным специфически взаимодействовать либо с хорионическим гонадотропином человека (hCG), либо с лютеинизирующим гормоном человека (hLH), идентифицированный выше, как антитело (HCG/KLH/2G9, готовят быстрым перемешиванием 200 мл буфера, содержащего 70 мМ карбоната - 10 мМ азида, и 1800 мл препарата дисперсии золотого золя, приготовленного в соответствии с примером 1(а) в 4-литровом сосуде. Конечный рН 9,9. При перемешивании добавляют 400 мл раствора, содержащего антитело в концентрации 150 мкг/мл в буфере, содержащем 2 мМ бората - 10 мМ азида, рН 8,0 и оставляют на 15 мин для прохождения реакции. Затем добавляют при перемешивании 180 мл 5% полиэтиленгликоля (PEG) 20 M (Sigmal, St Louis), предварительно отфильтрованного через 5 мкм Acrodisc (Gelman, Ann Arbor), и смесь выдерживают 15 мин при комнатной температуре для прохождения реакции. Аликвоты зонда переносят в сосуды Нальгена из поликарбоната емкостью 220 мл, помещают в ротоp Sorvall, GSA и центрифугируют при 10000 об/мин на центрифуге Sorvall РС5В в течение 45 мин при 4оС. Супернатанты отбрасывают, а темно-красные бусинки повторно суспендируют в равных объемах Буфера Х, имеющего рН 7,3 и состоящего из 0,1% бычьего сывороточного альбумина (BSA) (Miles) 0,1 г/л fhimerosal (Marchem Research), 0,3 г/л хлорида натрия и 0,2 г/л PEG 20 М (Sigma). Процедуру центрифугирования повторяют, и полученные шарики повторно суспендируют в минимальном объеме Буфера Х, фильтруют через 0,2 мкм GY фильтры (Millipore) и затем доводят до объема в 50 мл, снова используя Буфер Х. Приготовленные зонды помещают в амберглассовые сосуды и хранят при 4оС до использования. Аликвота, разбавленная деионизованной водой в соотношении 1:20, показывает максимум поглощения при 525 нм и имеет оранжево-красную окраску.
(b) Зонд для прегнандиол-3-глюкуронида готовят быстрым перемешиванием 598,5 мл дисперсии золя золота (см.пример 1(а) и 66,5 мл буфера, содержащего 70 мМ бората и 10 мМ азида, рН 8,5, 133 мл раствора, содержащего антитела к прегнандиолу в концентрации 75 мкг/мл, и буфер, содержащий 2 мМ бората и 10 мМ азида, рН 8,0 добавляют при перемешивании к буферной смеси золя золота. Полученную смесь выдерживают 15 мин. Затем материал центрифугируют и обрабатывают как следует из примера 2(b).
(с) Другой многоцелевой зонд для обоих hCG и hLH готовят, сначала покрывая частицы золя золота стрептавидином (Sigma, St Louis). В этом случае 67,5 мл суспензии с частиц золя золота, пример (1(а) и 7,5 мл карбонатного буфера, рН 8,3, помещают в стакан и быстро перемешивают. Продолжая интенсивное перемешивание, добавляют 15 мл раствора, содержащего стрептавидин в концентрации 75 мкг/ил и боратный буфер. Раствор оставляют для перемешивания на 15 мин при комнатной температуре, затем добавляют 6,75 мл отфильтрованного PEG 20 М. После цинтрифугирования и промывания водой этот зонд обрабатывают как указано в примере 2(а).
Антитело HCG/KLH/2G9, которое специфически взаимодействует как с hCG, так и с hLH, биотинилируют для того, чтобы улучшить прикрепление к стерпавидиновому золотому зонду. Для этой цели 1 мг эфира биотин-е-аминокапроновой и N-гидроксисукцинимида (Biotin-X-NHS, Cal.Biochem) растворяют в 1 мл ДМСО (Aldridge). Раствор, содержащий антитело в концентрации 1 мг/мл, готовят, используя 0,1 М буфер, содержащий бикарбонат натрия, поддерживающий рН 8,2. Порции раствора биотин-Х-Н объемом в 60, 120 и 240 мкл, добавляют соответственно к 1 мл аликвоты раствора, содержащего антитело, и оставляют для взаимодействия при комнатной температуре на 2,4 ч. После инкубации проводят диализ в течение 16 ч при комнатной температуре против раствора, содержащего физиологический раствор (PBS) в фосфатном буфете, азид, при рН 7,2. Затем аликвоты каждого образца объемом в 40 мкл взаимодействуют с 156 мкл золотого зонда, покрытого авидином. Каждый образец выдерживают 15 мин при комнатной температуре, затем образец разбавляют, добавляя 12 мл буфера Х, и ценрифугируют в течение 30 мин при 10000 об/мин на центрифуге Sorvall RC5B при 4оС. Затем образец фильтруют через 0,2 мкм Millex GV и хранят при 4оС.
(d) Приготовление зонда для теофиллина начинают с реакции конъюгации масляной кислоты - теофиллина (ТВА-Cal.Biochem., 581116) и бычьего сывороточного альбумина (BSA) при растворении 110 мг BSA и 20 мл ТВА в 3 мл смеси, содержащей 9 частей воды и 1 часть пиридина. К этому раствору добавляют 29 мг N-этил-, N-диметиламинокарбодиимидгидрохлорида. После инкубации в течение ночи при комнатной температуре смесь подвергают исчерпывающему диализу против PBS и затем хранят в 4 мл PBS.
ТВА-BSA конъюгатом покрывают коллоидное стекло. 8 мл дисперсии золя золота, приготовленной в соответствии с примером 1(а), в 0,001 М трис-буфере, добавляют к 1 мл 0,07 М трис-буферу при рН 7,0. 200 мкл полученного раствора конъюгата ТВА-BSA разбавляют 3 мл PBS и полученную смесь по каплям добавляют к буферному раствору коллоидного золота при взбалтывании последнего. Затем добавляют 30 мл PBS и смесь центрифугируют при 27000 g в течение 20 мин. Шарик повторно суспендируют и одинаково промывают 6 раз с помощью центрифугирования. Покрытый теофиллином золь золота подвергают последнему суспензированию в приблизительно 3 мл PBS, содержащего 0,1%BSA.
(е) Золотой зонд, покрытый моноклональным антителом, способным к специфическому взаимодействию или с hCG или с hLH, готовят с использованием методики примера 2(а), за исключением того, что в этом случае дисперсию золя золота готовят в соответствии с примером 1(b) и раствор, содержащий антитело, имеет концентрацию антитела 300 мкг/мл. Полученные частицы золотого зонда, имеющие диаметр 500  , фильтруют, промывают, обрабатывают и хранят, как представлено в примере 2(а).
, фильтруют, промывают, обрабатывают и хранят, как представлено в примере 2(а).
П р и м е р 3. Приготовление твердофазных компонентов.
(а) 1,0 мл 0,99 мкл концентрированного карбоксилатного латекса (polysciences) и 20 мл 0,15 М раствора NaCl помещают в центрифужную пробирку. 0,75 мл водного раствора 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорида при концентрации 100 мг/мл добавляют в центрифужную пробирку, и смесь взбалтывают в течение 20 мин. Сразу же после этого добавляют 11 мл 0,15 М раствора NaCl и смесь центрифугируют при 30000 g в течение 10 мин. Супернатант отбрасывают, а латексные шарики повторно суспендируют в 20 мл 0,15 М раствора NaCl. Суспензию еще раз центрифугируют, как указано выше, а шарики суспендируют в последний раз в 4 мл 0,15 М раствора NaCl. 2 мл этой латексной суспензии 1,5 мл 0,15 М раствора NaCl и 1,5 мл раствора, содержащего специфическое антитело (обозначенное символом LH26), при концентрации 1,678 мг/мл смешивают в 15-миллиметровой пластиковой пробирке. Пробирку вставляют в ротор и смесь инкубируют при постоянном перемешивании в течение 16 ч при 22оС в Labquake роторе. Сразу же за этим к смеси добавляют 1,0 мл 1 М раствора лизина, имеющего рН 7,5, и смесь взбалтывают еще дополнительно в течение 30 мин. Латекс, покрытый антителом, промывают четыре раза 30 мл 0,15 М раствора NaCl с повторным суспендированием, как представлено выше. Окончательно шарик суспендируют в 2 мл 0,15 М раствора NaCl, содержащего 1 мг/мл BSA.
(b) Кроличья антитеофиллиновая антисыворотка получена из Kallestad Laboratories, Chaska, Minnesota (Каталог N 334, Серия N Х3531). Гамма-глобулиновую фракцию сыворотки получают добавлением сульфата аммония до конечной концентрации 40% , центрифугированием, повторным растворением в PBS и диализом против PBS. 0,2 мл этого препарата с концентрацией белка 23 мг/мл взаимодействуют с 0,5 г сефарозным цианогенбромидом, которые суспендированы в 2 мл раствора, содержащего 0,15 М NaCl и 0,059 М NaHCO3. После перемешивания в течение 2 ч при комнатной температуре реакцию останавливают добавлением 2 мл 0,27 М раствора лизина, имеющего рН 8,4. Шарики, покрытые поликлональным антителом, собирают затем на металлокерамическом стеклянном фильтре, промывают 0,15 М NaCl и хранят в изотоническом физиологическом растворе.
(с) Приготовление цианобромидсефарозного антитела к hCG заключается в следующем. 1,0 г шариков цианогенбромид Сефарозы 4В (Sigma) промывают на металлокерамическом стеклянном фильтре в 200 мл 0,0001 М HCl. Затем промытые шарики добавляют в пробирку, в которой содержится 3 мл PBS, содержащего 9,0 мг специфичного к hCG антитела, идентифицированного и обозначенного, как упоминалось выше, 2В2. Пробирку помещают в ротор, и смесь инкубируют при постоянном перемешивании в течение ночи при комнатной температуре. Реакцию останавливают добавлением раствора лизина, содержащего 100 мг в 2 мл воды, рН 8,1. Смешивание продолжается еще 30 мин при ручном встряхивании и суспензию затем фильтруют на металлокерамическом стеклянном фильтре и быстро промывают 0,15 М раствора NaCl. Шарики, покрытые hCG антителом, затем повторно суспендируют в 4 мл изотонического физиологического раствора.
(d) Препарат антитела к изотиацианатной стеклянной твердой фазы, покрытой hCG, готовят смешиванием 0,127 г изотиоцианатных стеклянных шариков (Sigma) с 3 мл раствора 2В2 антитела с концентрацией белка 2,886 мг/мл. Раствор антитела забуферивают боратным буфером до рН 9,0, и смесь инкубируют при постоянном перемешивании в течение ночи при комнатной температуре. Реакцию останавливают добавлением 1 мл раствора лизина в соляной кислоте, концентрация лизина 40 мг/мл, рН 8,1. Час спустя после перемешивания суспензию фильтруют на металлокерамическом стекле и промывают 0,15 М раствора NaCl. Стеклянные шарики, покрытые 2В2 антителом, хранят в 3 мл 0,15 М раствора NaCl.
(е) Препарат Реактогель-антитело к hCG готовят соединением 0,15 г Реактогеля 25DF (pierce chemical) с 2В2 антителом, используя точно такую же методику, как описано для изотиоцианатного стекла в примере 3(d).
(f) Соединенное с кремнием стеклом антитело к hCG твердой фазе готовят следующим образом. Плавленные кремниевые частицы (Cina Catalog 6) силанизируют при суспендировании 10 г кремниевых частиц в 40 мл воды и добавлении 10 мл 3-аминопропилтриэтоксисилана (bastman Kodak Company, каталог N 8746, серия N С14Д). Эту смесь вращают в герметически закрытой пробирке в течение 4 ч при комнатной температуре. Силанизированные частицы затем промывают 6 раз в 50 мл воды на одну процедуру и центрифугируют при 1500 g в течение 10 мин. 100 мг аминоалкилсиланизированных частиц суспендируют в 2 мл водного раствора, содержащего 2,5% глутаральдегида. Эту смесь вращают в герметично закрытой пробирке в течение 4 ч при комнатной температуре. Частицы затем собирают центрифугированием при 1500 g в течение 10 мин. Полученный шарик суспендируют в 2 мл раствора, содержащего 2В2 hCG специфическое антитело с концентрацией белка 3,5 мг/мл. Эту суспензию вращают в течение 4 ч. Частицы затем собирают центрифугированием, как прежде, и суспендируют в 2 мл раствора, содержащего 10 мг/мл BSA и PBS. Эту суспензию также вращают в течение часа, собирают и частицы суспендируют в 2 мл PBS, содержащего 1 мл/мл BSA.
(g) Прегнандиол-3-глюкуронид (P3G) (Sigma) в виде свободной кислоты связывают с помощью ковалентной связи с желатином при использовании смешанного кислотно-ангидридного метода так, как описано brlanger и др. J.Biol. Chem. 228, 713-727 (1957). 1 мл Полибед-карбоксилатных монодисперсных микросфер (polysciences) смешивают с 10 мл PBS и затем добавляют 11 мг 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорид (Sigma). После 10 мин инкубации при постоянном вращении в герметически закрытой пробирке при 22оС латексную суспензию центрифугируют при 10000 об/мин в RC58 центрифуге, оборудованной SS-34 ротором, и супернатант выбрасывают. Шарик повторно суспендируют в 10 мл PBS, содержащем 8,9 мг желатина Р3G. Эту смесь инкубируют при вращении в течение 12 ч при 22оС. Затем добавляют 1 мл раствора гидрохлорида лизина при концентрации лизина 10 мг/мл для блокирования непрореагировавших участков связывания и через 10 мин частицы, покрытые антителом, собирают центрифугированием, как описано. После двойного промывания шарики согласно этому методу латексные частицы, покрытые антителом, окончательно суспендируют в 5 мл PBS.
(h) Твердофазный компонент, состоящий из латексных частиц, покрытых антителом, специфичным к hCG, готовят, используя методику примера 3(а), за исключением того, что в этом случае используют 1,5 мл раствора, содержащего 2В2hCG специфичного антитела при концентрации 1,678 мг/мл, вместо раствора hLH специфичного антитела.
П р и м е р 4. Анализ форматов.
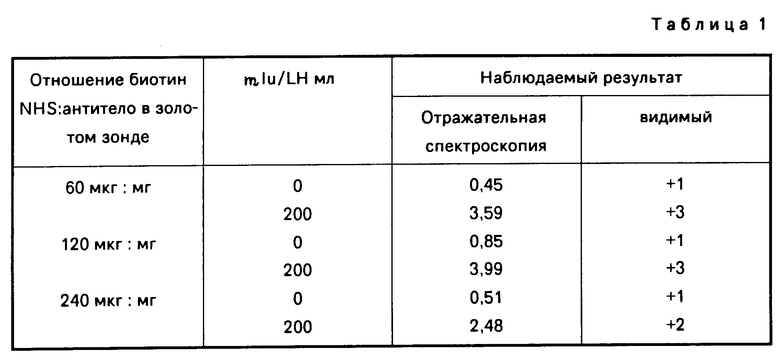
(а) Золотые зонды, содержащие поглощенный авидин, связанный с биотинилированным hCG/KLH/2G9 антителом, и имеющие разные соотношения количества биотина и авидина, все это приготовлено в соответствии с примером 2(с), оценивают методом анализа. По этому методу готовят 6 анализируемых пробирок, содержащих 0,5 мл буферного раствора, содержащего 0,3 М NaCl, 0,1 М HEPES-буфер, рН 7,2 и 1% PVP (360000 мол.м.) три из 6 пробирок таким образом содержат 200 mI HLH в миллилитре, в то время как оставшиеся пробирки не содержат LH. Соответственно 0,020 мл латексной суспензии, содержащей дисперсные латексные частицы, покрытые ковалентно связанным LH специфичным антителом, приготовленным в соответствии с примером 3(а) и от 0,150 до 0,175 мл золотых зондов, приготовленных в соответствии с примером 2 (с); добавляют к каждой пробирке. Полученные смеси, каждая из которых содержит дисперсный твердофазный компонент, включающий латексные частицы, покрытые антителом, и меченый компонент, включающий частицы золотого зонда, покрытые антителом, имеющим оранжево-красную окраску. Образцы инкубируют при комнатной температуре в течение 10 мин, при этом окраска в пробирках не меняется, а затем каждый образец подвергают вакуумной фильтрации на 1 мкм РС60 Schleicher и Schuell фильтре, встроенном в Schleicher и Schuell SPC-96 коллектор. После фильтрации каждый из образцов промывают 0,5 мл Igepal СА-720 (GAF), содержащем 1% SIS. Фильтр высушивают воздухом, и интенсивность окрашивания уловленных частиц, окрасивших 1 мкм, фильтр, определяют как визуально, так и с помощью отражательного спектрофотометра (Macbeth, Kollmorgen Corporation). Результаты представлены в табл.1.
Как можно видеть из предыдущего, присутствие LH в образце определяют и детектируют оцениванием посредством прямого визуального исследования наличия металла в собранном твердофазном композите. Металл дает окрашивание на фильтре, которое может быть установлено визуально, и такая окраска означает, что здесь имеется металл. Как другой результат упомянутого метода анализа, было установлено, что лучшие видимые результаты получены при использовании меньших отношений биотина к антителу. Этот результат определяют, как непосредственно, так и с использованием отражательной спектроскопии.
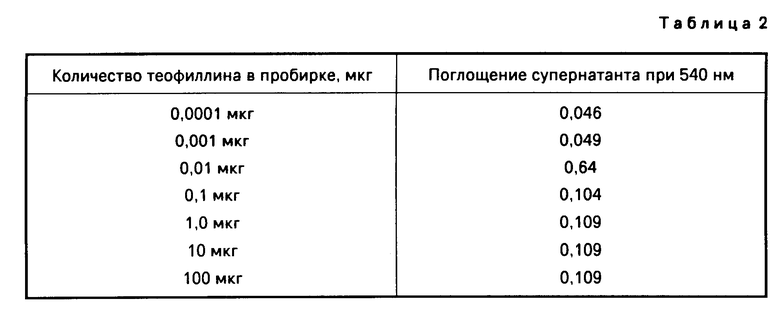
(b) Конкурентный седиментационный анализ теофиллина проводят следующим образом. Серофазную суспензию, покрытую антителом, приготовленную в соответствии с примером 3 (b), повторно суспендируют встряхиванием сразу же перед использованием, и 40 мл из нее добавляют в каждую из серии конических пластиковых пробирок (Falcon 2097). Растворы, содержащие теофиллин в различных концентрациях, добавляют в пробирки и после смешивания и инкубации в течение 2 мин при комнатной температуре добавляют 250 мкл суспензии теофиллин-BSA золь золота, приготовленной в соответствии с примером 2 (d), к каждой пробирке, и содержимое смешивают при встряхивании в течение 4 мин. Затем шарикам дают осесть приблизительно в течение 30 мин и окрашивание как осевших шариков, так и супернатанта, в каждой пробирке оценивают визуально. В пробирках, содержащих более чем 0,1 мкг теофиллина, шарики совершенно белые, а супернатант отчетливо розовый. В пробирках, содержащих менее чем 0,1 мкг теофиллина, интенсивность розовой окраски шариков нарастает с падением концентраций теофиллина. В то же время супернатанты нарастающие прозрачны. Результаты также определяют измерением поглощения супернатанта при следующих данных (табл.2).
Как можно видеть, результаты согласуются с конкурентным анализом главным образом в том, что возрастание уровня теофиллина в анализируемом образце приводит к снижению присутствия меченого теофиллина в твердой фазе. То есть, теофиллин в образце ингибирует связывание меченого теофилина с твердой фазой. Соответственно, как это установлено прямым визуальным наблюдением, возросшие концентрации теофиллина в образце приводят к меньшему окрашиванию в собранной твердой фазе и к большему окрашиванию в супернатанте.
(с) Анализы гравитационного разделения hCG проводят следующим образом. В этой методике 50 мкл частиц сефарозы, покрытых hCG специфическим антителом, приготовленных в соответствии с примером 3 (с). 300 мкл частиц золя золота, покрытых антителом, приготовленных в соответствии с примером 2 (а), 100 мкл одного из нескольких стандартных растворов, содержащих разные количества (1, 10 или 100 нг) hCG и 300 мкл PBS-BSA буфера, добавляют в каждую из серий конических пластиковых пробирок. После 30-35 мин вращения шарикам дают осесть на дно пробирок. После осаждения наблюдают окрашивание шариков прямым визуальным обследованием. Окраска твердой фазы, в сущности, белая в тех пробирках, где количество hCG соответствует 1 нг. Однако в тех пробирках, где количество hCG равно 10 нг, окраска шариков бледно-розовая, а в тех пробирках, где исходное содержание hCG составляло 100 нг, шарики имеют замечательную розовую окраску. Соответственно, присутствие hCG в образцах и количество его там определяют в детектируют посредством прямого визуального исследования, окрашивание является следствием металла, связанного в собранном твердофазном композите. Разумеется, бледно-голубое и замечательное розовое окрашивание является следствием присутствия наличия золота в собранном твердофазном композите, содержащем металл, который оседает на дно каждой пробирки в процессе этих анализов.
(d) 100 мкл стеклянных частиц, активированных изоцианатом, покрытых антителом и приготовленных в соответствии с примером 3 (d), добавляют к соответствующим пробиркам из серии конических пластиковых пробирок. 20 мкл золотых частиц, покрытых антителом, приготовленных в соответствии с примером 2 (а), 400 мкл PBS-BSA буфера и 100 мкл раствора, содержащего либо 1000, 100, 100, 1 либо 0 нг/мл hCG, добавляют к каждой пробирке. Пробирки закрывают и перемешивают вращением при комнатной температуре в течение 1 ч. Сразу же после осаждения окраску шариков наблюдают прямым визуальным обследованием. Процедуру повторяют, используя частицы Реактогеля 25, покрытые антителом, приготовленным в соответствии с примером 3 (е). Чувствительность анализа уровня до 10 нг hСG в пробирке отмечается в случае использования изоцианатных стеклянных частиц такой же хорошей, как и для частиц Реактогеля, почти такой же, какая найдена для цианогенбромидсефарозных шариков, в соответствии с примером 4 (с). Снова, частицы золота, покрытые антителом, и твердофазные частицы, покрытые антителом, взаимодействуют с антигеном, образуя дисперсный, собираемый, твердофазный, содержащий металл композит, который собирают осаждением. Присутствие и количество hCG с исходном образце оценивают прямым визуальным исследованием окрашивания, вызванного присутствием металла в собранном твердофазном композите. В каждом случае присутствие металла в композите вызывает розовое окрашивание шариков, когда начальный уровень hCG в пробирке составляет 10 нг или больше.
(е) Также hCG детактируют или определяют по методике, в которой центробежная сила применяется для сбора композита, 200 мкл PBS-BSA буфера, 25 мкл соответствующих растворов, содержащих 25, 2,5 нг или 0 hCG, 20 мкл частиц золя золота, покрытых антителом, приготовленных в соответствии с примером 2 (а), и 10 мкл оплавленных керамических частиц, покрытых антителом, приготовленных в соответствии с примером 3 (f), добавляют к ячейкам 96-ячеечной микротитровальной платы (Dynatech Immunolon). После инкубации в течение 5 мин платы центрифугируют при 2000 об/мин на IEC PR2 центрифуге, оборудованной 276 ротором.
Супернатанты выбрасывают, а шарики промывают с 200 мкл PBS. Конечные шарики исследуют прямым визуальным наблюдением, поместив платы на белой подложке. Белые по существу шарики наблюдают в отсутствии hCG в исходном образце, тогда как получают отчетливые розовые или красные шарики в тех ячейках, которых в начальной стадии содержали 2,5 или 25 нг hCG антигена.
(f) Анализ поглощения пористой матрицей hCG антигена проводят следующим образом. По этой методике готовят 2 пробирки для анализа, каждая содержит смесь, состоящую из 50 мкл суспензии латексных частиц, покрытых антителом, специфичным к hCG, приготовленных в соответствии с примером 3 (а), 300 мкл частиц золя золота, покрытых антителом, приготовленных согласно примеру 2 (а), и 300 мкл PBS-BSA буфера. Одна из пробирок содержит 100 мкл стандартного раствора, содержащего 50 mI uhCG в миллилитре, другая пробирка также содержит 100 мкл стандартного раствора, но без hCG. Полученные смеси, каждая из которых содержит дисперсный твердофазный компонент, включающий латексные частицы, золотого зонда, покрытые антителом, имеют оранжево-красное окрашивание. Смеси в пробирках инкубируют при комнатной температуре в течение 10 мин, при этом окраска в пробирках не меняется. Образцы наносят на фильтр из стеклянных волокон (Whatman GF-A), вмонтированный в отдельное проточное устройство. Видимое невооруженным глазом пятно, имеющее характерную розовую окраску, появляется на фильтрующей матрице в точке, контактирующей с раствором, содержащим hCG. Подобное пятно не появляется там, где матрица соприкасается с раствором, не содержащим hCG. Матрицу с пятнами заслоняют от света в течение четырех дней и розовое пятно сохраняет свою первоначальную окраску. Подобные пятна сохранялись в тетрадях от 6 до 12 месяцев и все еще отчетливо узнаваемы.
(g) Другой анализ поглощения hCG пористой матрицей проводят, используя методику, идентичную примеру 4 (d), за исключением того, что золотой зонд по примеру 2 (f) используют вместо золотого зонда при примеру 2 (а). В этом случае растворы первоначально имеют темно-розовое окрашивание и окрашенное пятно, которое проявляется в точке, где раствор, содержащий hCG, соприкасается с поглощающей матрицей, имеет розово-пурпурную окраску. В других отношениях результаты те же самые, что получены в примере 4 (f).
(h) Анализы конкурентным осаждением P3G проводят, используя золотой зонд из примера 2 (b), твердую фазу из примера 3 (g) и методику из примера 4 (b). Наблюдаемые результаты, такие же, как и в примере 4 (b), в котором происходит нарастание золотого окрашивания шариков и нарастание прозрачности супернатантом, так как уменьшается концентрация P3G.
Вид поглощения пористой матрицей подобный тому, что в примере 4 (f), можно оценить как наиболее важный в коммерческом отношении вариант для изобретения. При поглощении пористой матрицей дисперсный,твердофазный, собираемый композит, содержащий металл, независимо от того, какой твердофазный компонент он содержит, поглощается на поверхности и в промежутках пор пористой матрицы. Для улучшения процесса поглощения матрицей в лаборатории было сконструировано отдельное проточное устройство, которое служит для выдерживания матрицы в тесном контакте с абсорбентом, таким образом, что поток жидкости через поглощаемую матрицу является самопроизвольным и не требует вакуумного или внешнего источника давления. Поглощающим средством, найденные наиболее пригодным в лаборатории, является Transorh (American Filtrona). Элемент, включающий целлюлозную пробку. Было найдено, что когда разделитель располагают между поглощающей матрицей и абсорбентом, полное разделение между поглощенной жидкой фазой и поглощенной и собранной твердой фазой на пористой матрице гарантировано.
Был оценен ряд разделительных слоев и было найдено, что таковые могут быть составлены из слоя стеклянных волокон (Whatman), промокательной бумаги (Gillman) или слоя пористого пласта (porex or pillon), с одинаковыми по существу результатами. Подобным образом было оценено и найдено подходящим значительное количество поглощающих матриц. Стекловолокнистые фильтры (Whatman GF/A), регенерированные целлюлозные мембраны (Schleicher и Schuell) и микропористые мембраны (Millipore MF) серии мембран HAWP, SSWP, SMWP и SCWP с размером пор 0,45, 3, 5 и 8 мк соответственно, все успешно применяются для поглощения и сбора твердофазных композитов, содержащих металл, в соответствии с изобретением. Пока еще не определено, которая из этих поглощающих матриц была бы наилучшей в коммерческом приложении и, возможно, одна матрица была бы лучшей для одной ситуации, а иная матрица - для другой ситуации. Однако в особенности пригодным для работы в лаборатории был найден фильтр из стекловолокна.
При выборе соответствующей поглощающей матрицы должны быть приняты во внимание два фактора - пористость и неспецифические связывающие свойства. Больший размер пор или пористость будет способствовать более быстрому течению, и это может быть благоприятным, особенно в тем случаях, когда наружное давление или вакуум не может быть применено. Однако, если поглощающая матрица слишком пориста или открыта, твердофазный композит, содержащий металл, может проходить через матрицу и таким образом не быть видимым. Было замечено также, что некоторые поглощающие матрицы связывают металлические частицы, покрытые антителом неспецифически, а именно в отсутствии иммунной реакции и, возможно даже, при отсутствии твердофазных поглощающих частиц. Это неспецифическое связывание хорошо известно квалифицированным специалистам и может быть подавлено предварительной обработкой поглощающей матрицы блокаторами неспецифического основания, такими, как поливинилпирролидон, сыворотка теленка, бычий сывороточный альбумин и/или других материалов и полимеров, широко известных в этой области техники. Один вариант, который может быть успешно применен в соответствии с изобретением, описан в патенте США N 4632901, принципиальная разница в том, что мембрана, используемая в соответствии с изобретением, не имеет к тому же иммунореагентной связи. Вернее, мембрана для изобретения используется просто как механический фильтр. Другие устройства из уровня техники, которые могут быть приспособлены для целей изобретения, описаны в United States Letters патент N 4246339 и 4407943. С другой стороны, эти устройства из уровня техники имеют реактивную связь с мембраной, тогда как в изобретении нет необходимости в том, чтобы реактант был связан с мембраной. Вернее, композит просто собирают с помощью фильтрации.
В соответствии с изобретением, хотя твердые частицы, покрытые антителом, и металлические частицы, покрытые антителом, являются мультивалентными, так как каждая частица несет на себе разнообразие антител, было установлено, что конечный дисперсный, собираемый, твердофазный композит, содержащий металл, полученный в результате анализа, просто включает покрытые твердофазные частицы со связанными с ними частицами золота. Покрытые золотом частицы, прикрепленные к твердофазным частицам в результате иммунологической реакции изобретения, по-видимому, не связывают другие частицы, покрытые антителом, хотя каждая золотая частица несет на своей поверхности непрореагировавшие антитела. Причина этого не полностью понятна, однако было установлено, что подобное связывание происходит и что представленное изобретение не включает феномен агглютинации или агломерации, так как разработано в соответствии United States Letters патент N 4313734.
Благодаря использованию изобретения и благодаря, в частности, использованию суспендируемых в воде частиц, таких, как латекс, стеклянные шарики и т. р. , и использованию частиц золя золота, покрытых антителом, в анализах hCG в соответствии с изобретением есть возможность определения такого минимального количества hCG, как 37,5 m I U и предельный уровень чувствительности еще не установлен. Очевидно, что улучшенные результаты, полученные вследствие изобретения, поднимутся при использовании суспендируемых частиц, обладающих значительно большей площадью поверхности и поглощением частиц в ограниченном объеме, при этом усиливая в несколько раз окраску, воспринимаемую человеческим глазом.
Следует также заметить, что в областях техники, в которых используются принципы агглютинации, изменение окраски в жидкой фазе, обычно от красной к пурпурно-голубой, используется для определения направления реакции. Хотя специалист может предположить, что если смешать золь золота, покрытый антителом, и шарики, покрытые антителом, частицы будут коагглютинировать, образуя переход окраски в жидкой фазе от красной до пурпурно-голубой. В случае изобретения, такое смещение окрашивания не имеет места ни в жидкой фазе, ни в твердой фазе, и последняя, будучи собранной, и, в особенности, когда в качестве маркера используется золото, проявляет интенсивное красное окрашивание, которое без труда можно видеть человеческим глазом.
Хотя изобретение не ограничено детектированием или определением аналитов в моче человека, в коммерческом применении и, в особенности, там, где предполагаются тесты на беременность и овуляцию, анализируемые растворы будут, в основном, включать образцы первой утренней мочи. Как было найдено, в моче содержится ряд неспецифических, дисперсных, отдельных загрязнений и/или включений, которые могут обеспечивать фальшивые положительные результаты и, с другой стороны, противоречить анализам изобретения. Поэтому при проведении анализов изобретения с использованием образцов мочи, как было в целом обнаружено, желательно, чтобы образцы фильтровали для удаления таких загрязнений до проведения анализов. Могут быть использованы любые сорта фильтров, способные удалять частицы загрязнений. Однако пластины пористого полиэтилена высокой плотности Роrex сорта, используемого как разделитель, как было найдено, являются высоко эффективными для подобных целей фильтрования.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНАЛИЗ АНАЛИТОВ С ИСПОЛЬЗОВАНИЕМ ЧАСТИЦ В КАЧЕСТВЕ МЕТКИ | 1997 |
|
RU2251572C2 |
| УСОВЕРШЕНСТВОВАННОЕ УСТРОЙСТВО И СПОСОБ ТЕСТИРОВАНИЯ НА БЕРЕМЕННОСТЬ | 2014 |
|
RU2674266C2 |
| СИСТЕМА (ВАРИАНТЫ) И СПОСОБ ДЕТЕКТИРОВАНИЯ НАЛИЧИЯ АНАЛИТА В ЖИДКОМ ОБРАЗЦЕ | 2011 |
|
RU2653451C2 |
| СПОСОБ ОБНАРУЖЕНИЯ ОПУХОЛЕВОГО МАРКЕРА RSP В ЖИДКОСТЯХ ТЕЛА, СПОСОБ ОБНАРУЖЕНИЯ ЗЛОКАЧЕСТВЕННОСТИ, ЗОНД ДЛЯ ИЗБИРАТЕЛЬНОГО СВЯЗЫВАНИЯ С ОПУХОЛЕВЫМ МАРКЕРОМ RSP | 1990 |
|
RU2025734C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ B-ЛИМФОЦИТОВ, ПРОДУЦИРУЮЩИХ IGE | 1988 |
|
RU2047177C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИТЕЛ, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩИХСЯ С Ig E | 1988 |
|
RU2082428C1 |
| ГРАФИТОВЫЕ НАНОТРУБКИ В ЛЮМИНЕСЦЕНТНЫХ АНАЛИЗАХ И СПОСОБЫ ПРОВЕДЕНИЯ ТАКИХ АНАЛИЗОВ | 1997 |
|
RU2189043C2 |
| СПОСОБЫ ОДНОВРЕМЕННОГО ВЫЯВЛЕНИЯ ОБОИХ КОМПОНЕНТОВ СВЯЗЫВАЮЩЕЙСЯ ПАРЫ | 2000 |
|
RU2251111C2 |
| СПОСОБ ОБНАРУЖЕНИЯ АНТИТЕЛА В ПРОБЕ С ИСПОЛЬЗОВАНИЕМ ХЕМИЛЮМИНЕСЦЕНТНОГО СОЕДИНЕНИЯ И СПОСОБ ИЗМЕРЕНИЯ КОНЦЕНТРАЦИИ И/ИЛИ ОТНОСИТЕЛЬНОГО СОДЕРЖАНИЯ СПЕЦИФИЧЕСКОГО АНТИТЕЛА В ПРОБЕ | 1993 |
|
RU2132070C1 |
| СПОСОБ МУЛЬТИПЛЕКСНОГО ИММУНОЛОГИЧЕСКОГО АНАЛИЗА БИОЛОГИЧЕСКИХ ПРОБ ИЗ ВОЗДУХА В АВТОМАТИЧЕСКОМ РЕЖИМЕ | 2019 |
|
RU2717671C1 |
Покрытые антителом частицы золя золота и покрытые антителом твердофазные частицы, рассеянные в водной системе, взаимодействуют иммунологически, определяя тем самым присутствие аналита в анализируемом образце. В результате иммунологической реакции получают твердофазный композит, содержащий золото. Композит собирают на фильтре или на дне пробирки центрифугированием или осаждением. Аналит в образце определяют или детектируют прямым визуальным исследованием собранного твердофазного композита, окрашенного в розовый, красный или пурпурный цвет в зависимости от содержания в нем золота. Материалы, требуемые для проведения анализа, включают покрытые золотые частицы, покрытые твердофазные частицы и фильтр в качестве собирающего элемента. Собранный твердофазный композит, содержащий металл, может быть подвергнут прямому визуальному исследованию с тем, чтобы определить или детектировать там золото и таким образом аналит в образце. Композит стабилен и остается пригодным для подтверждения результатов анализа впоследствии. 2 з. п. ф-лы, 2 табл.
 , либо непосредственно, либо с помощью биотин авидина, либо альбумина бычьей сыворотки, вторые иммунологически активные вещества иммобилизируют на носителе в виде частиц либо непосредственно, либо с помощью бычьей сыворотки, либо желатина, далее полученные суспензии смешивают и детекцию осуществляют на поверхности пористого фильтрующего элемента или в виде плотного осадка.
, либо непосредственно, либо с помощью биотин авидина, либо альбумина бычьей сыворотки, вторые иммунологически активные вещества иммобилизируют на носителе в виде частиц либо непосредственно, либо с помощью бычьей сыворотки, либо желатина, далее полученные суспензии смешивают и детекцию осуществляют на поверхности пористого фильтрующего элемента или в виде плотного осадка.
| Abstracts of the Anncal Meeting | |||
| Пневматический водоподъемный аппарат-двигатель | 1917 |
|
SU1986A1 |
Авторы
Даты
1994-12-30—Публикация
1988-10-06—Подача