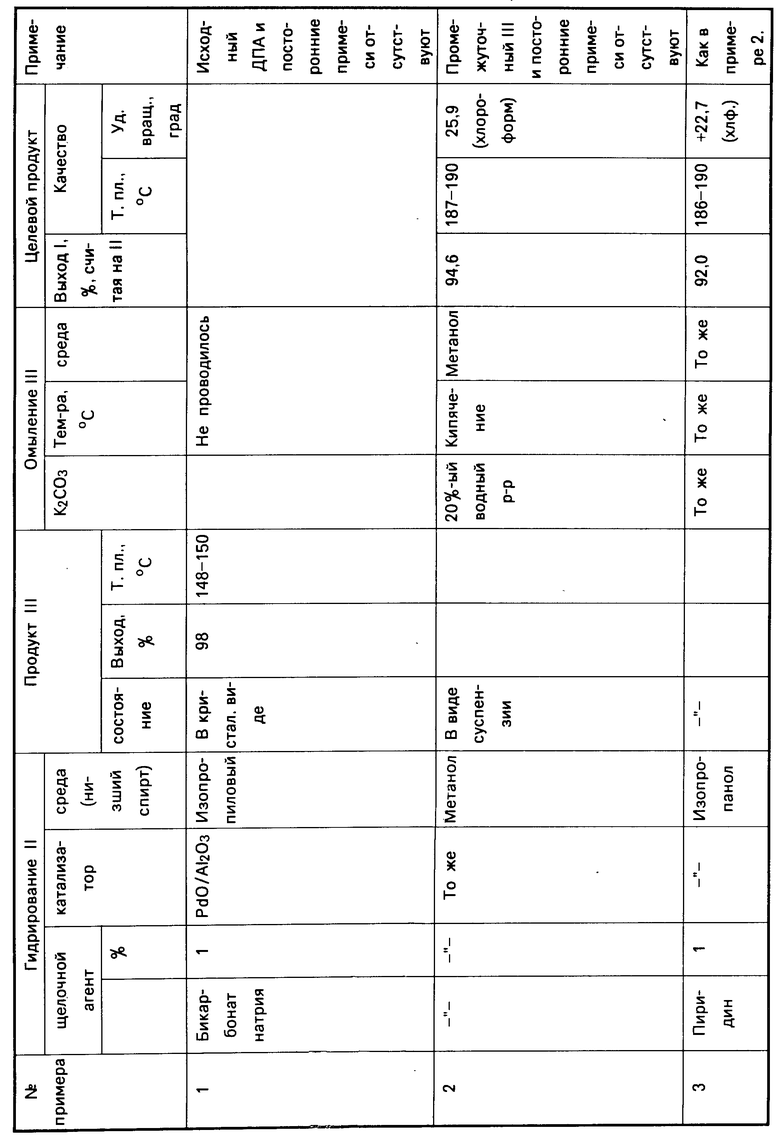
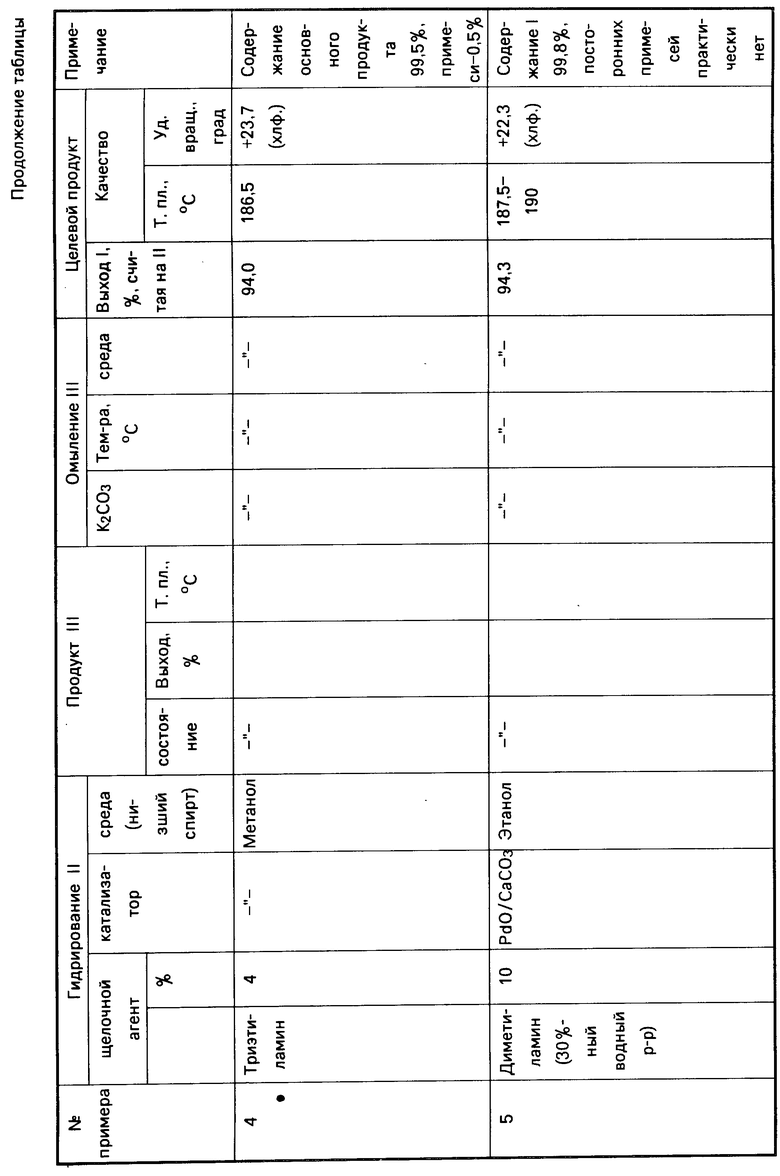
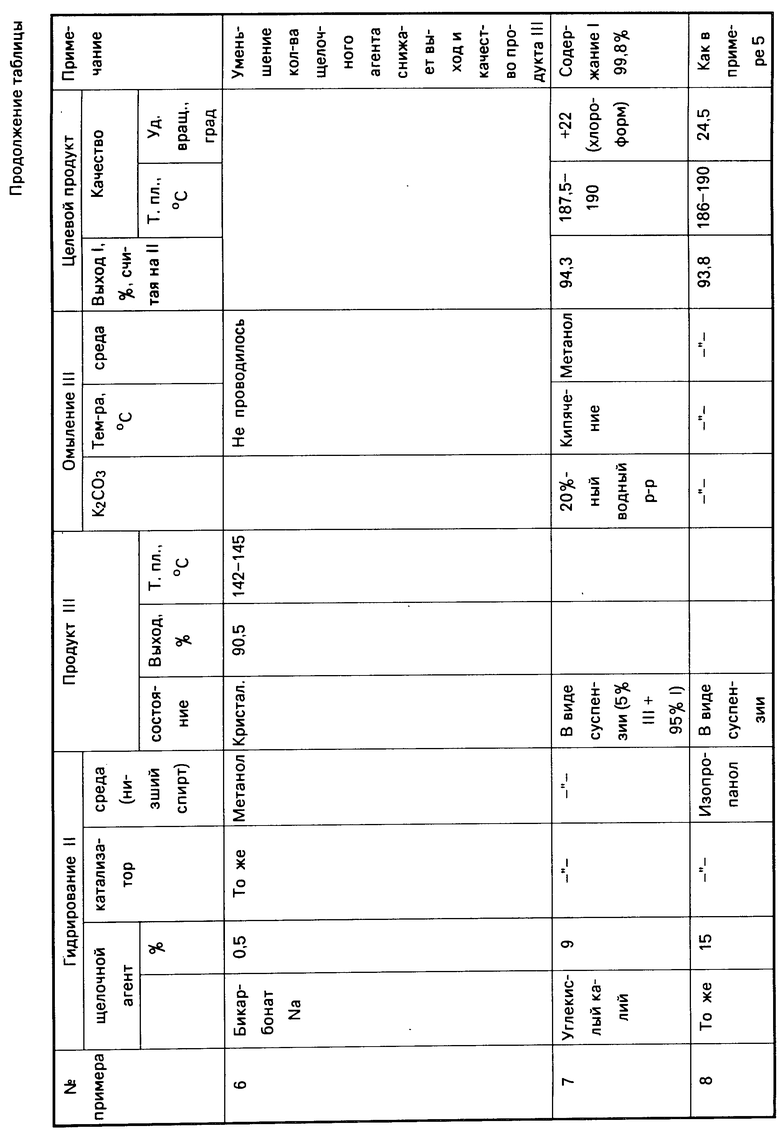
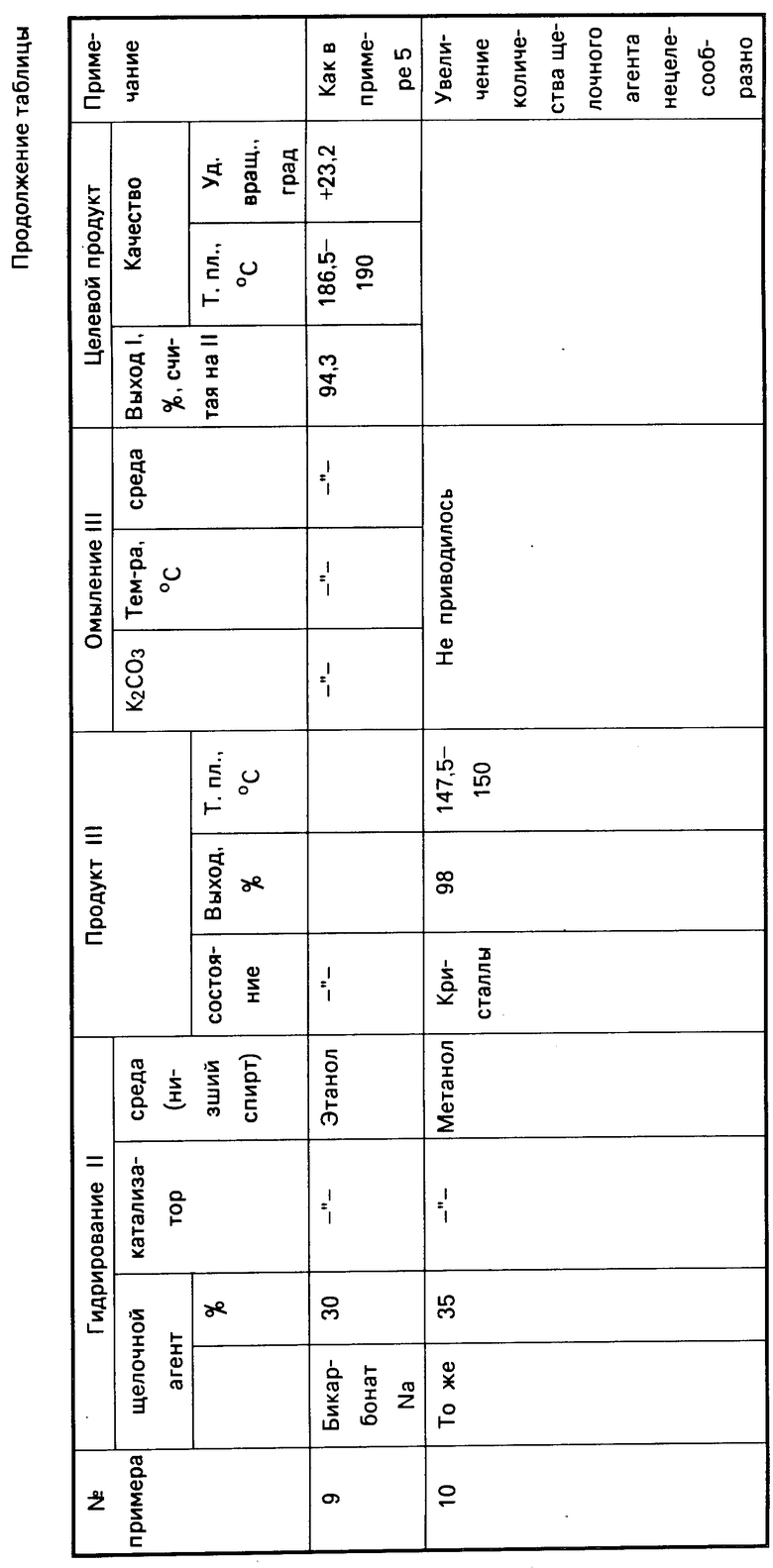
Изобретение относится к химии ряда прегнена и касается усовершенствования способа получения 3β -гидроксипрегн-5-ен-20-она (условно прегненолона) формулы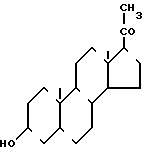 (I)
(I)
Соединение I используют в качестве полупродукта в синтезе прогестерона [1]. Прогестерон - гормон желтого тела (гестагенный лекарственный препарат) применяют в гинекологической практике для лечения привычного и угрожающего выкидыша, функциональных маточных кровотечений и др. [2].
В литературе известно множество способов получения соединения I из различных видов исходного стероидного сырья [3]. Известен способ получения соединения I [4], где в качестве полупродукта синтеза используют 3β-гидроксипрегн-5,16-диен-20-она ацетат (дегидропрегнелона ацетат (ДПА, II) [5].
Данный способ получения 3 β-гидроксипрегн-5-ен-20-она (I) заключается в том, что 3 β-гидроксипрегн-5,16-диен-20-она ацетат (ДПА, II) гидрируют водородом в присутствии 10% окиси палладия, нанесенной на углекислый кальций (массовое соотношение исходного соединения II и катализатора 1:100) в среде пиридина (массообъемное соотношение II и пиридина 1:8).
Получают промежуточный 3 β-гидроксипрегн-5-ен-20-она ацетат (93% , считая на II, т. пл. 148-150оС), последний омыляют ( условия омыления не указаны).
Получают целевой продукт 3 β-гидроксипрегн-5-ен-20-он (I) с выходом 96% ( расчет авторов данной заявки), считая на III, или 89,2%, считая на II; т. пл. 187-190оС; удельное вращение не указано.
Данный способ лежит в основе промышленного регламента на производство лекарственного препарата прогестерона [6].
Способ получения 3 β-гидроксипрегн-5-ен-20-она, согласно регламенту [6] , заключается в том, что 3 β-гидроксипрегн-5,16- диен-20-она ацетат (ДПА, II) подвергают гидрированию водородом в присутствии 5% окиси палладия на углекислом кальции (массовое соотношение II и катализатора 5:1) в среде пиридина в течение 60-66 ч, образующийся 3 β-гидроксипрегн-5-ен-20-она ацетат (III) выделяют, выливая в течение 3-4 ч пиридиновый раствор III в 10%-ный раствор кислоты, охлажденной до 0оС с последующей выдержкой, выпавший осадок III отфильтровывают, промывают водой от соляной кислоты до нейтральной реакции и сушат до постоянной массы.
Получают 3 β-гидроксипрегн-5-ен-20-она ацетат (III) с выходом 98%, считая на ДПА (II); т.пл. 145-151оС, содержание исходного продукта не более 1% , затем его подвергают омылению с 2,5-кратным избытком углекислого калия в среде метанола при кипячении.
Целевой продукт I выделяют известным способом: после охлаждения реакционной массы выпавший осадок целевого продукта I отфильтровывают, промывают водой до нейтральной реакции и сушат.
Получают 3 β-гидроксипрегн-5-ен-20-он (1) в виде кристаллического порошка с выходом 94%, считая на III, или 92%, считая на II (без маточников), содержание III - не более 1% или 94% после доомыления метанольных маточников III; т.пл. 186-190оС, удельное вращение (+22 24)о(в хлороформе), (в действительности в промышленных условиях продукт I получают стабильного качества; удельное вращение 1 колеблется от (+22 - +24)о до (+47-+78)о ).
Данный способ является близким по технической сущности и положительному эффекту аналогом описываемого способа.
Схема способа прототипа [6]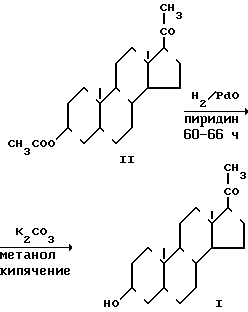
Одним из основных недостатков прототипа [6] является неудовлетворительное качество целевого продукта I, так как, согласно данным масс-спектров, в промышленных образцах целевого продукта I присутствует примесь - гидрированный по Δ5,6-двойной связи стероидный продукт (мол.масса 318).
Полное удаление примеси путем очистки методом кристаллизации или хроматографического разделения невозможно из-за сходства структур этой примеси и целевого продукта. Указанная примесь переходит и в лекарственный препарат прогестерон (который синтезируют из целевого продукта I), что требует дополнительных очисток для получения фармакопейного лекарственного препарата.
Кроме этого, недостатками способа-прототипа являются:
длительность процесса гидрирования (60-66 ч);
необходимость использования токсичного пиридина в большом количестве (массовое соотношение исходного продукта П пиридина 1:11 или на 7,5 кг II берут 84 кг пиридина), регенерация которого трудоемка и составляет всего 45% , остальное количество уходит в канализацию, что загрязняет окружающую среду;
необходимость использования большого количества концентрированной соляной кислоты (на 7,5 кг ДПА (П) берут 130 кг 31%-ной соляной кислоты) и маточных промывных вод (на 7,5 кг ДПА (П) образуется 650 л воды), которые также направляются в канализацию;
трудоемкость выделения промежуточного продукта III.
Вышеуказанные недостатки данного способа создают определенные трудности при промышленном производстве продукта I с высоким качеством и в дальнейшем затрудняет получение фармакопейного лекарственного препарата прогестерон.
Целью изобретения является повышение качества целевого продукта, упрощение технологического процесса, повышение его техники безопасности.
Цель достигается описываемым усовершенствованным способом получения 3β -гидроксипрегн-5-ен-20-она (1), заключающимся в том, что 3 β-гидроксипрегн-5,16-диен-20-она ацетат (II) гидрируют водородом в присутствии палладиевого катализатора и щелочного агента, взятого в количестве 1%-30% от исходного II, в среде низшего спирта, полученный 3 β-гидроксипрегн-5-ен-20-она ацетат (III) подвергают омылению 20% -ным водным раствором углекислого калия (2,5-кратное количество к III) в среде метанола при кипячении.
Полученный целевой продукт в виде бесцветного кристаллического порошка с выходом 96% , считая на III, или 94%, считая на II, т.пл.: 187-190оС; удельное вращение (+22 - +25,9)о (в хлороформе).
Схема способа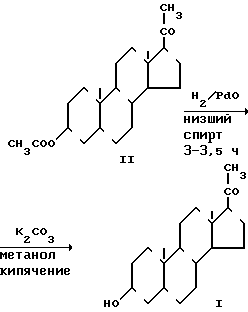

В качестве щелочного агента используют карбонаты щелочных металлов (например (карбонат калия, бикарбонат натрия) и амины (например (триэтиламин, диметиламин, пиридин).
Следует отметить, что в случае использования в качестве щелочного агента углекислого калия гидрирование исходного соединения II проводят в метаноле или этаноле, при этом углекислый калий берут в количестве 1-9% от исходного соединения П. В этом случае наряду с промежуточным продуктом III образуется целевой продукт I (до 40-95% соответственно).
В случае проведения процесса гидрирования соединения II в изопропиловом спирте углекислый калий используют в количестве 1-30% от исходного соединения II. В этом случае наблюдается образование только соединения III.
В качестве палладиевого катализатора используют окись палладия на различных носителях: окиси алюминия, угле, углекислом кальции.
Выделение 3 β-гидроксипрегн-5-ен-20-она ацетата III осуществляют следующим образом: спиртовый раствор полученного промежуточного продукта III частично упаривают и остаток выливают в 2,5-кратный объем воды, при этом наблюдается выпадение кристаллического осадка Ш, который отфильтровывают, промывают водой и сушат.
Промежуточный продукт 3 β-гидроксипрегн-5-ен-20-она ацетат получают с выходом 98%, считая на II, практически чистым; т.пл. 148-150оС, и не требует дополнительной очистки [7].
Целевой продукт I - 3 β-гидроксипрегн-5-ен-20-она выделяют после омыления III путем охлаждения реакционной массы, фильтрации и промывки выпавшего в виде бесцветного кристаллического осадка с последующей сушкой его до постоянного веса.
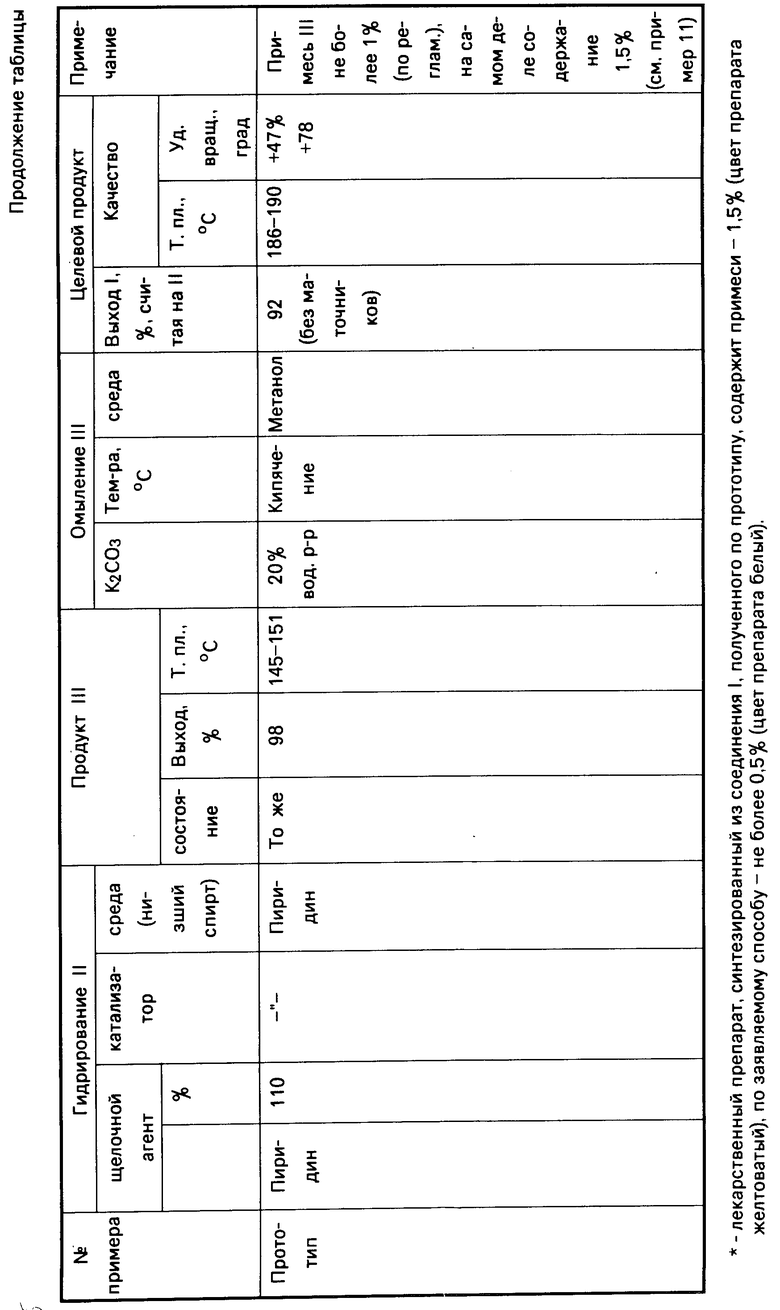
Нижеследующие примеры иллюстрируют заявляемый способ получения соединения I (все примеры сведены в таблицу).
П р и м е р 1. Щелочной агент - NaНСО3 - 1% от ДПА, среда - изопропиловый спирт,
III - выделяют.
К суспензии 5 г 3 β-гидроксипрегна-5,16-диен-20-она ацетата (ДПА, П) в 50 мл изопропилового спирта прибавляют 1 г 4%-ной окиси палладия, нанесенной на окись алюминия и 0,05 г бикарбоната натрия. Смесь гидрируют водородом при комнатной температуре и атмосферном давлении в течение 3-3,5 ч.
Реакционную массу отфильтровывают от катализатора, последний промывают 250 мл изопропилового спирта.
Растворитель отгоняют (отгон спирта в количестве 85% используют повторно) до объема 40 мл, охлаждают до комнатной температуры и выливают в 100 мл воды, охлажденной до +15±3оС. Выпавший осадок 3 β-гидроксипрегн-5-ен-20-она ацетат (III) отфильтровывают, промывают и сушат до постоянной массы. Получают 4,92 г (98% считая на ДПА) 3 β-гидроксипрегн-5-ен-20-она ацетата (III) в виде бесцветного кристаллического порошка т.пл. 148-150оС, ТСХ (Silufol) отсутствует ДПА и посторонние примеси (система бензол-ацетон 9:1, проявитель УФ и фосфорномолебденовая кислота).
П р и м е р 2. NaНСО3-1% от ДПА, среда - метанол, промежуточный продукт III после гидрирования выделяют в виде суспензии и омыляют.
К суспензии 5 г ДПА (П) в 50 мл метанола, прибавляют 1 г 4%-ной окиси палладия, нанесенной на окись алюминия и 0,05 г бикарбоната натрия. Смесь подвергают гидрированию при комнатной температуре и атмосферном давлении в течение 3 ч.
Реакционную массу отфильтровывают от катализатора, последний промывают 250 мл метанола. Растворитель отгоняют (отгон 85% метанола используют повторно в процессе гидрирования ) до объема 40 мл.
К суспензии промежуточного продукта III прибавляют 10 мл 20%-ного водного раствора углекислого калия и кипятят в течение 1 ч 15 мин.
Охлаждают реакционную массу до 0оС и дают выдержку 30 мин.
Выпавший осадок целевого продукта (I) отфильтровывают, промывают водой до нейтральной реакции и сушат до постоянной массы.
Получают 4,19 г (94,6%, считая на II) 3 β-гидроксипрегн-5-ен-20-она, т. пл. 187-190оС, удельное вращение +25,9о(в хлороформе). ТСХ (пластины Silufol, ИГ-254 в системе бензол:ацетон 9:1), отсутствуют промежуточный продукт III и посторонние примеси.
П р и м е р 3. Щелочной агент - пиридин в количестве 1% от ДПА, среда - метиловый спирт, продукт III выделяют в виде суспензии и омыляют.
К суспензии 2 г ДПА (П) в 20 мл метанола прибавляют 0,4 г 5%-ной окиси палладия на углекислом кальции и 0,02 г (0,013 мл) пиридина. Смесь гидрируют при комнатной температуре и атмосферном давлении в течение 3,5 ч.
Реакционную массу отфильтровывают от катализатора, последний промывают 80 мл метанола и отгоняют растворитель до объема 15 мл.
К полученной массе (суспензии) промежуточного продукта III прибавляют 4 мл 20%-ного водного раствора углекислого калия и кипятят 1 ч 20 мин, охлаждают до 0оС, дают выдержку 30 мин и отфильтровывают выпавший кристаллический осадок I, промывают водой до нейтральной реакции и сушат до постоянной массы.
Получают 1,63 г (92%, считая на ДПА) 3 β-гидроксипрегн-5-ен-20-она, т. пл. 186-190оС, удельное вращение +22,7о (в хлороформе). Качество, как в примере 1.
П р и м е р 4. Щелочной агент - триэтиламин в количестве 4% от ДПА, среда - метанол, после гидрирования суспензию (III) омыляют.
К суспензии 4 г ДПА (П) в 40 мл метанола прибавляют 0,8 г 4%-ной окиси палладия на окиси алюминия и 0,04 г (0,22 мл) триэтиламина. Смесь гидрируют водородом при комнатной температуре и атмосферном давлении в течение 3 ч. Реакционную массу отфильтровывают от катализатора, последний промывают 160 мл метанола, растворитель отгоняют до объема 30 мл.
К суспензии III приливают 8 мл 20%-ного водного раствора углекислого калия и кипятят 1 час 30 мин.
Реакционную массу охлаждают до 0оС и дают выдержку в течение 30 мин. Выпавший осадок целевого продукта I выделяют, как описано в примере 2.
Получают 3,33 г (94%, считая на ДПА) 3β-гидроксипрегн-5-ен-20-она (I); т. пл. 186,5-190оС; удельное вращение +23,77о (в хлороформе), содержание основного вещества 99,5%, посторонние примеси - 0,5%.
П р и м е р 5. Щелочной агент - диметиламин в количестве 10% от ДПА, среда - этиловый спирт, промежуточный продукт III в виде суспензии омыляют.
К суспензии 2 г ДПА (II) в 20 мл этанола прибавляют 0,4 г 5%-ной окиси палладия на углекислом кальции и 0,2 г (0,7 мл 33% водного раствора) диметиламина. Смесь гидрируют при комнатной температуре и атмосферном давлении 3 ч.
Реакционную массу отфильтровывают от катализатора, последний промывают 80 мл этанола, растворитель отгоняют досуха, приливают 25 мл метанола. К полученной суспензии промежуточного III приливают 4 мл 20%-ного водного раствора углекислого калия и кипятят 1 ч 20 мин. Выпавший осадок целевого продукта I выделяют, как описано в примере 2.
Получают 1,67 г (94,3%, считая на ДПА) 3β -гидроксипрегн-5-ен-20-она (I); т.пл. 187,5-190оС; удельное вращение +22,3о (в хлороформе), содержание I - 99,8%.
П р и м е р 6. Щелочной реагент - гидрокарбонат натрия в количестве 0,5% от ДПА; III - выделяют; среда-метанол.
К суспензии 1 г ДПА (II) в 10 мл метанола прибавляют 0,2 г 5%-ной окиси палладия на углекислом кальции и 0,005 г бикарбоната натрия. Смесь гидрируют водородом при комнатной температуре и атмосферном давлении 3,5 ч.
Реакционную массу отфильтровывают от катализатора, последний промывают 60 мл метанола, растворитель отгоняют до объема 10 мл, охлаждают и выливают в 30 мл воды, охлажденной до +15оС.
Выпавший осадок промежуточного продукта III отфильтровывают, сушат.
Получают 0,91 г (90,5%, считая на ДПА) 3 β-гидроксипрегн-5-ен-20-она ацетата; т.пл. 142-145оС; содержание III 98,5%, посторонних примесей - 1,5% .
П р и м е р 7. Щелочной агент - углекислый калий в количестве 9% от ДПА, среда - метиловый спирт; образование смеси III и I.
К суспензии 2 г ДПА (II) в 20 мл метанола прибавляют 0,4 г 5%-ной окиси палладия на углекислом кальции и 0,018 г углекислого калия. Смесь гидрируют при комнатной температуре и атмосферном давлении 4 ч.
Реакционную массу отфильтровывают от катализатора, последний промывают 80 мл метанола. Растворитель отгоняют до объема 15 мл. По данным ТСХ содержание продукта III 5%, целевого продукта 1 - 95%.
К суспензии полученной смеси прибавляют 3 мл 20%-ного водного раствора углекислого калия и кипятят в течение 1 ч.
Выпавший осадок целевого продукта выделяют обычным способом, как описано в примере 2.
Получают 1,67 г (94,3%, считая на ДПА) 3β-гидроксипрегн-5-ен-20-она; т. пл. 187,5-190оС; удельное вращение +22о(в хлороформе), содержание 1-99,8%.
П р и м е р ы 8, 9 и 10 (см.таблицу).
П р и м е р 11. Получение лекарственного препарата прогестерона из соединения I.
К 153 мл толуола добавляют 4 г прегненолона (1) (3β-гидроксипрегн-5-ен-20-она), отгоняют 40 мл толуола, к охлажденной реакционной массе прибавляют 11,3 мл циклогексанона и снова отгоняют 20 мл толуола. Реакционную массу охлаждают и приливают 4 г 35%-ного толуольного раствора изопропилата алюминия и снова кипятят 1 ч с отгонкой 20 мл толуола.
По окончании кипячения реакционную массу охлаждают до +10оС и прибавляют 60 мл воды. Переносят в колбу для отгонки с паром, отгоняют с паром в вакууме толуол и циклогексанон, приливая по 100 мл толуола 3 раза. По окончании отгонки растворителей реакционную массу охлаждают и выпавший осадок прогестерона отфильтровывают и промывают водой, сушат.
Технический прогестерон кристаллизуют из ацетона с добавлением осветляющего угля и окиси алюминия. Полученный кристаллический прогестерон кипятят два раза с 30 мл гексана, сливая гексановые вытяжки, а прогестерон еще раз перекристаллизовывают из ацетона с осветляющим углем и промывкой 10 мл холодного эфира.
Получают 2,8 г (70,6%, считая на соединение I) прегн-4-ен-3,20-диона в виде бесцветного кристаллического порошка; т.пл. 129-131оС, / α/20 + 190о, содержание основного вещества 99,5%, примесь - 0,5% (отвечает требованиям ВФС) (в прототипе основного вещества 98,5%, примесь - 1,5%).
Предложенный способ (новая совокупность условий) получения целевого продукта I позволяет повысить качество целевого продукта.
Целевой продукт в заявленных условиях получают без примеси гидрированного по Δ5,6-двойной связи стероидного продукта, что позволяет улучшить качество лекарственного препарата прогестерона.
Прогестерон, синтезированный из продукта I, полученного заявленным способом, отвечает требованиям ВФС (пример 11). Заявляемый способ позволяет также упростить процесс получения целевого продукта I, а именно сократить продолжительность процесса гидрирования (с 66 до 3 ч), упростить процесс выделения промежуточного продукта III (в прототипе выделение III производят путем многочасового выливания пиридинового раствора III в концентрированную соляную кислоту, сильного охлаждения, многочасовой отмывки от кислоты), в заявленном способе выделение III производят путем выливания реакционной массы в небольшой объем воды.
Данный способ позволяет повысить технику безопасности процесса:
существенно сократить объем токсического, дорогостоящего пиридина (в прототипе используют 11-кратное количество пиридина, а в заявленном способе - 0,01-кратное количество - см.пример 3); заменить пиридин на низший спирт на стадии гидрирования; исключить использование соляной кислоты; тем самым исключить образование большого объема маточных и промывных вод (в прототипе на 7,5 кг исходного ДПА образуется 650 л вод).
Примеры, иллюстрирующие получение 3β-гидроксипрегн-5-ен-20-она в различных условиях (двухстадийный процесс), представлены в таблице.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ НОВЫХ 3β-АЦЕТОКСИ-17α-ГИДРОПЕРОКСИ-16α-МЕТИЛПРЕГНАНОВ ИЗ Δ-20-КЕТОСТЕРОИДОВ И СПОСОБ ПОЛУЧЕНИЯ 3β-АЦЕТОКСИ-17α-ГИДРОКСИ-16α-МЕТИЛПРЕГНАНОВ С ИСПОЛЬЗОВАНИЕМ 3β-АЦЕТОКСИ-17α-ГИДРОПЕРОКСИ-16α-МЕТИЛПРЕГНАНОВ | 2009 |
|
RU2418805C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6α-МЕТИЛГИДРОКОРТИЗОНА ИЛИ ЕГО ЭФИРОВ ИЗ 21-АЦЕТАТА ГИДРОКОРТИЗОНА | 2017 |
|
RU2663484C1 |
| 17 α АЦЕТОКСИ-3 β БУТАНОИЛОКСИ-6-МЕТИЛПРЕГНА-4,6-ДИЕН-20-ОН, ОБЛАДАЮЩИЙ ГЕСТАГЕННОЙ АКТИВНОСТЬЮ | 1996 |
|
RU2099347C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЦЕТАТА 16α,17α-ЦИКЛОГЕКСАНОПРЕГН-5-ЕН-3β-ОЛ-20-ОНА | 2012 |
|
RU2495047C1 |
| СПОСОБ ПОЛУЧЕНИЯ β- ЗАМЕЩЕННОГО 4-АЗААНДРОСТАНА | 1993 |
|
RU2109746C1 |
| 17α-АЦЕТОКСИ-3β-ФЕНИЛПРОПИОНИЛОКСИ-6-МЕТИЛПРЕГНА-4,6-ДИЕН-20-ОН, ОБЛАДАЮЩИЙ ГЕСТАГЕННОЙ АКТИВНОСТЬЮ, И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ЕГО ОСНОВЕ | 2001 |
|
RU2200165C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6-МЕТИЛЕНО-16α,17α-ЦИКЛОГЕКСАНОПРЕГН-4-ЕН-3,20-ДИОНА | 2014 |
|
RU2566368C1 |
| Способ получения кортизон-ацетата | 1956 |
|
SU106380A1 |
| СПОСОБ ПОЛУЧЕНИЯ 6-ДЕГИДРО-6-МЕТИЛГИДРОКОРТИЗОНА ИЛИ ЕГО ЭФИРОВ ИЗ 21-АЦЕТАТА ГИДРОКОРТИЗОНА | 2017 |
|
RU2663893C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6-МЕТИЛЕНХОЛЕСТ-4-ЕН-3-ОНА, ОБЛАДАЮЩЕГО ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ, ИЗ ХОЛЕСТЕРИНА | 2024 |
|
RU2841084C1 |
Использование: в качестве гестагенного препарата. Сущность: продукт 3 b -гидроксипрегн-5-ен-20-он; выход 94 - 98%; т.пл. 186 - 190°С; [α]
СПОСОБ ПОЛУЧЕНИЯ 3 3β - ГИДРОКСИПРЕГН-5-ЕН-20-ОНА каталитическим гидрированием 3β -гидроксипрегна-5,16-диен-20-она ацетата водородом в щелочной среде в присутствии оксида палладия на носителе с последующим омылением полученного 3β -гидроксипрегн-5-ен-20-она ацетата водным раствором углекислого калия при кипячении в среде метанола, отличающийся тем, что, с целью повышения качества целевого продукта и упрощения процесса, в качестве щелочного агента используют карбонат щелочного металла или амин в количестве 1-30% по отношению к 3β -гидроксипрегна-5,16-диен-20-онуа и процесс проводят в среде низшего спирта.
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Суворов Н.Н., Ярославцева З.А., Соколова Л.В., Морозовская Л.М., Овчинникова Ж.Д., Мурашева В.С., Лейбельман Ф.Я., Воробьев М.А | |||
| Синтез кортизона из соласодина, -Медицинская промышленность, N 2, 7-9 (1958). | |||
Авторы
Даты
1995-01-20—Публикация
1989-12-14—Подача