Изобретение относится к производным 4-(2-пиримидинил)-пиперазина, которые могут быть полезны в качестве анксиолитических седативных средств. Изобретение относится к соединениям, в которых ацильный заместитель представляет собой гетероциклилкарбонильную или гетероциклилсульфонильную группу.
Известно изобретение [1] - ряд N-(гетероарилциклических)-пиперазинилалкил- азаспироалкандионов формулы
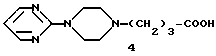
(C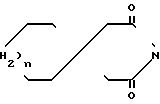 -A-N
-A-N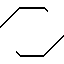 N-B, где А представляет С2-6 алкилен; В-2-пиримидинил; а n представляет 4 или 5. Указанные соединения обладают транквилизирующей и противорвотной способностью.
N-B, где А представляет С2-6 алкилен; В-2-пиримидинил; а n представляет 4 или 5. Указанные соединения обладают транквилизирующей и противорвотной способностью.
Обнаружено, что некоторые 1-ацил-3-[4-(2-пиримидинил)-1-пиперазинил] пропаны формулы [1] полезны в качестве устраняющих чувство страха, тревоги или беспокойства средств.
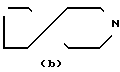
A = (CH2)3= N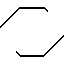 N
N 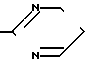 , [1] где А представляет собой группу -
, [1] где А представляет собой группу - 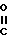 - R (соединения формулы 1') или -
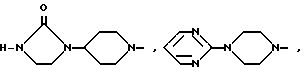
- R (соединения формулы 1') или - 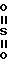 - R1 (соединения формулы 1'') где R представляет группу:
- R1 (соединения формулы 1'') где R представляет группу: N- ,
N- ,  N-,
N-,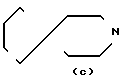 - ,
- , 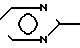 N
N N-,
N-, N- ,
N- , 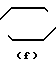 N-,
N-,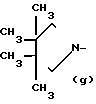 ,
, 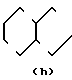 N-,
N-,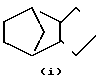 N- ,
N- , 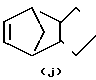 N-,
N-,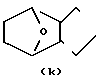 N- ,
N- , 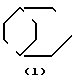 N-,
N-,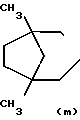 N- или
N- или 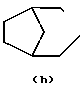 N-
N-
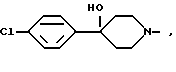
R1 - группа формулы: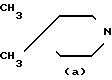 - ,
- ,  -,
-,
Cl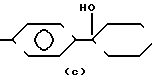 N- , H-N
N- , H-N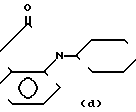 N-,
N-,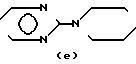 N ,
N , 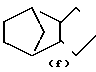 N-,
N-, N-
N-
Изобретение охватывает также фармацевтически приемлемые кислотно-аддитивные соли соединений формулы [1].
Под термином фармацевтически приемлемые кислотно-аддитивные соли соединений формулы [1] подразумевают соли хлористоводородной, бромистоводородной, иодистоводородной, серной, сульфаминовой кислот, паратолуолсульфокислоты, уксусной, молочной, лимонной, аскорбиновой, кислот метан-сульфокислоты и соли с другими органическими кислотами, известными специалистам, которые находят применение при получении фармацевтически приемлемых солей присоединения кислот. Указанные соли получают известными методами, например путем взаимодействия соответствующего соединения формулы [1] c эквимолярным или почти эквимолярным количеством требуемой кислоты в реакционно-инертном растворителе (этанол, вода, галоидированные углеводороды) с последующим выделением полученной соли фильтрованием или выпариванием растворителя.
Соединения предлагаемого изобретения формулы (1') легко получают дегидратационного сочетания 4-[4-(2-пиримидинил)- 1-пиперазинил] масляной кислоты с соответствующими амином формулы RH в реакционно-инертном растворителе, т. е. таком растворителе, который не взаимодействует с реагентами или получаемыми продуктами. Подходящие дегидратирующие агенты сочетания известны специалистам и включают карбодиимиды, такие как дициклогексилкарбодиимид в ди-пара-диметиламинофенилкарбодиимид, N, N'-карбонилди- имидазол, н-этил-5-фенилзоксазолен-3'-сульфонат и диэтилцианофосфат. 1-гидроксибензотриазол обычно добавляется в реакционную смесь для облегчения реакции сочетания. К примерам реакционно-инертных растворителей относятся хлористый метилен, хлороформ, тетрагидрофуран, диоксан и бис-(2-метоксиэтиловый) эфир.
Хотя для стехиометрии указанной реакции необходимы эквимолярные количества индивидуальных реагентов, на практике амин, кислоту, агент сочетания и 1-гидроксибензотриазол обычно используют в молярном соотношении 1:1:1, 1:1: 5. Конечно в компетенции специалиста возможны различные изменения в соотношениях используемых реагентов для оптимизации технологии получения конкретного соединения формулы [1]. Указанную реакцию осуществляют при температуре примерно от 0оС до температуры окружающей среды. Целевые продукты выделяются с помощью известных приемов.
Кислотный компонент [4-4-(2-пиримидинил)-1-пиперазинил]-масляная кислота обычно доступна в виде дихлоргидратной соли и, следовательно, используется в таком виде в указанной реакции. Вследствие этого для нейтрализации кислоты, содержащейся в указанной соли, в указанной реакции используют достаточное количество основания. Для этого можно использовать различные основания. К предпочтительным основаниям относятся третичные амины, например триэтиламин и N-метилморфолин.
4-[4-(2-пиримидинил)-1-пиперазинил]масляную кислоту получают путем взаимодействия 1-(2-пиримидинил)пиперазина с этиловым эфиром тетраброммасляной кислоты в реакционно-инертном растворителе, например, метилизобутилкетоне, при температуре дефлегмации кипения до тех пор, пока реакция по существу не завершится. В реакции используют молярное соотношение реагентов наряду с 10% избытком бикарбоната натрия в качестве акцептора кислоты. Для ускорения реакции используют также примерно от 1 до 10% иодистого калия по весу этил 4-бромбутирата. Полученный в результате сложный эфир отделяют с помощью отфильтровывания твердых побочных продуктов и удаления растворителя. Кислотный гидролиз сложного эфира, например, соляной кислотой, дает требуемую кислоту.
Соединения формулы (1'') легко получают путем взаимодействия 1-(2-пиримидинил)пиперазина с соответствующим 3-хлорпропилсульфонамидом формулы
Сl(CH2)3-SO2-R1, где R1 имеет вышеуказанные значения. Реакцию осуществляют в реакционно-инертном растворителе, в качестве которого фактически можно использовать любой растворитель, не вступающий во взаимодействие с реагентами или получаемыми продуктами. В качестве растворителя используют метилизобутилкетон. Реакцию проводят при температуре кипения (дефлегмации) реакционной смеси до полного или практически полного завершения взаимодействия. С целью облегчения прохождения реакции используют реакционные температуры в интервале от 60 до 150оС. Если для реакции выбрано верхнее граничное значение температуры из указанного интервала, то в качестве растворителя используют бис-2-метоксиметиловый эфир.
Амин и хлорпропилсульфонамид обычно вводятся в реакцию при молярном соотношении 1:1 в присутствии акцептора кислоты, такого как безводный карбонат или третичный амин, например триэтиламин N-метилморфолин или пиридин. Для ускорения реакции добавляют примерно от 1 до 10 мас.% йодистого калия в расчете на хлорный реагент. Продукт выделяют известными методами.
Требуемые 3-хлорпропилсульфонамиды легко получаются при взаимодействии соответствующего амина R1H (где R1 означает гетероциклический остаток формулы [1'' a-g], указанной выше, с 3-хлорпропансульфонилхлоридом в хлористом метилене при температуре примерно от 0оС до температуры окружающей среды. Обычно один эквивалент 3-хлорпропансульфонилхлорида добавляют к раствору, содержащему один эквивалент каждого из соответствующего амина и триэтиламина при температуре примерно от 0 до 10оС. После завершения добавления реакционную смесь перемешивают в течение дополнительных 10 мин, затем подогревают до комнатной температуры. Продукт выделяют экстракцией.
Активность соединений изобретения в качестве успокаивающих (снимающих чувство страха) средств определяется с помощью модификации антиконфликтного теста Вогеля. Указанная методика базируется на способности испытуемых соединений увеличивать число воспринимаемых раздражений испытывающими жажду крысами, которых подвергают раздражению на питье. Методика заключается в том, что крыс-самцов весом 160-170 г, находящихся в виварии, за неделю до проведения эксперимента переводят в опытную лабораторию в клетки по 6 крыс на клетку. Животных лишают воды за 48 ч до проведения теста на конфликтную ситуацию. Перед испытанием животных (8 животных на группу) помещают в экспериментальные камеры для трехминутного периода тренировки. После размещения лотка с водой для питья каждому животному дают возможность в течение трех минут напиться без применения наказания, после чего животных убирают из камеры.
После этого животным вводят инъекции носителя или лекарственного вещества и через заданные промежутки времени после обработки помещают опять в экспериментальную камеру для теста на конфликтную ситуацию. Через первые 20 глотков (лаканий) воды осуществляют 0,5-секундный шок через трубку для питья и пол с управляющей электрической сеткой. Таким образом шоковое поражение ротовой полости регулируется через эту сетку путем отсоединения от указанной трубки для питья. Затем животных подвергают шоку через каждый двадцатый глоток в течение 15 мин. Данные, полученные от животных, которые не находят питьевой лоток в течение первых пяти минут, исключают из анализа. Анализируют данные, полученные из первых десяти минут после первого шока.
Вводят стандартный анксиолитик с одновременной проверкой испытуемых соединений. Затем осуществляют статистический анализ среднего количества воспринимаемых каждой группой раздражений в сравнении со средним количеством ответных реакций на раздражение соответствующей контрольной группы.
Соединения предлагаемого изобретения демонстрируют увеличение по крайней мере в два раза количества воспринимаемых животными раздражений (шоков) по сравнению с контрольными группами животных, которым не вводили никакого анксиолитика.
Ниже приводятся данные фармакологической активности соединений изобретения (примеров 1-21) и двух известных антипсихотических веществ Буспирона и Джепирона. Джепирон является аналогом Буспирона, в котором спиропентильная группа замещена диметилом. Для каждого из этих соединений приводятся данные следующих трех испытаний активности:
1. Анализ связывания серотонина 1А с использованием 3Н 8-гидрокси-2(ди-N-пропиламино)тетралина;
2. Ингибирование серотонэргического нейронного воспаления в ядрах дорсального ствола;
3. Противоконфликтное испытание Вогеля.
Предлагаемые далее примеры и составы служат только для иллюстрации. Для спектров ЯМР поглощательная способность дается в частях на млн. (млн. долей) от тетраметилсилана.
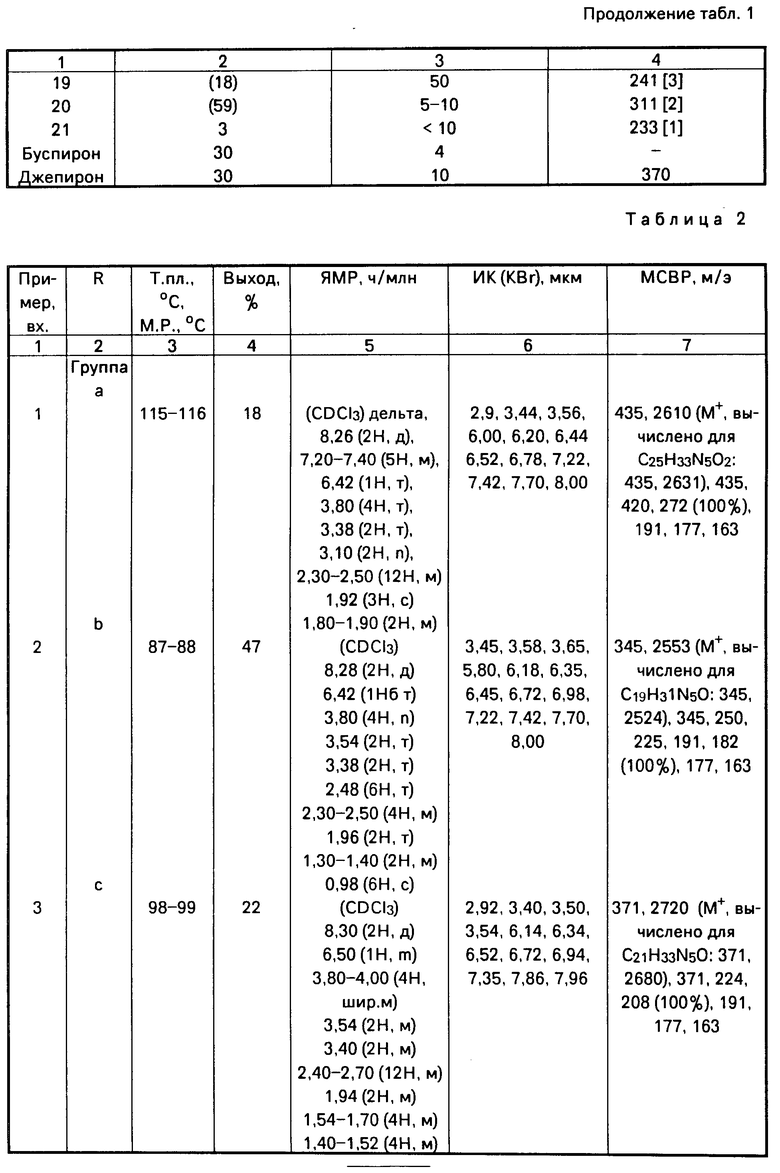
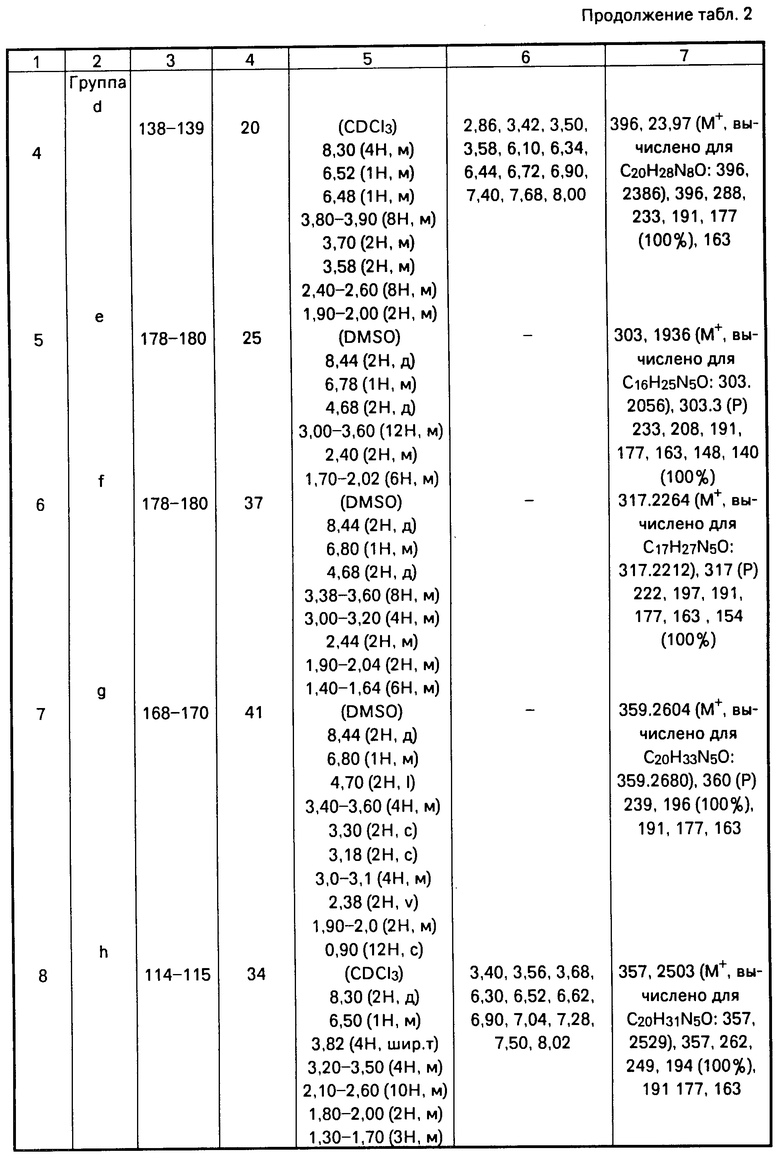
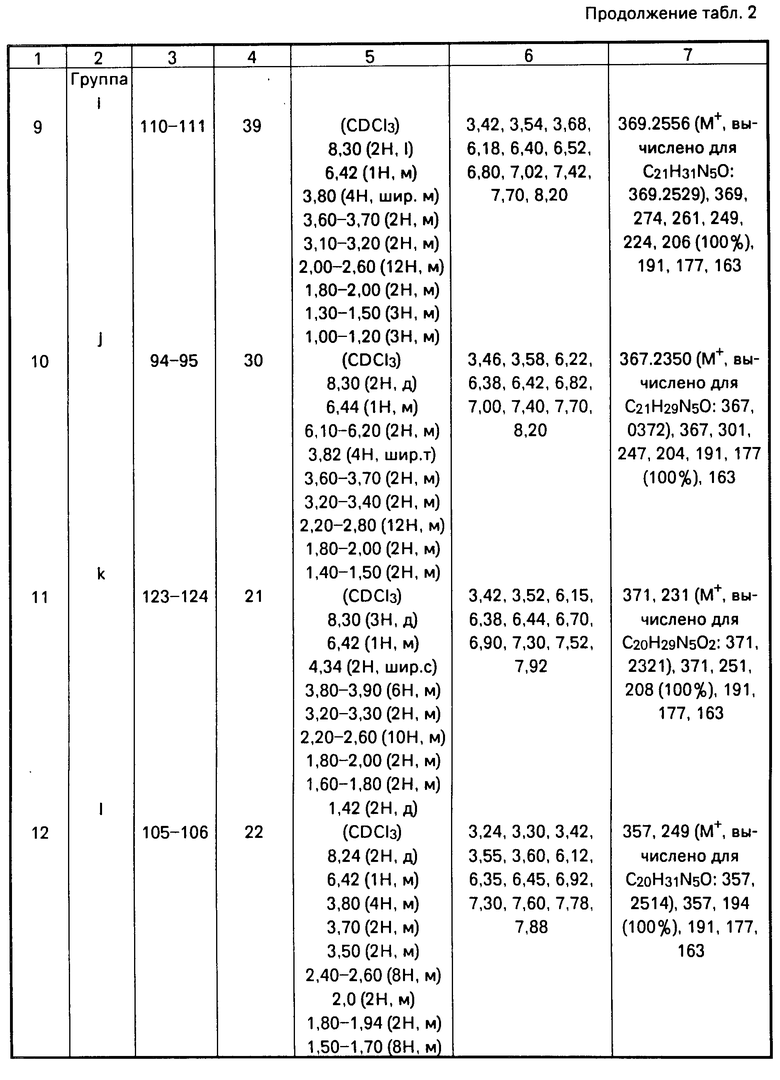
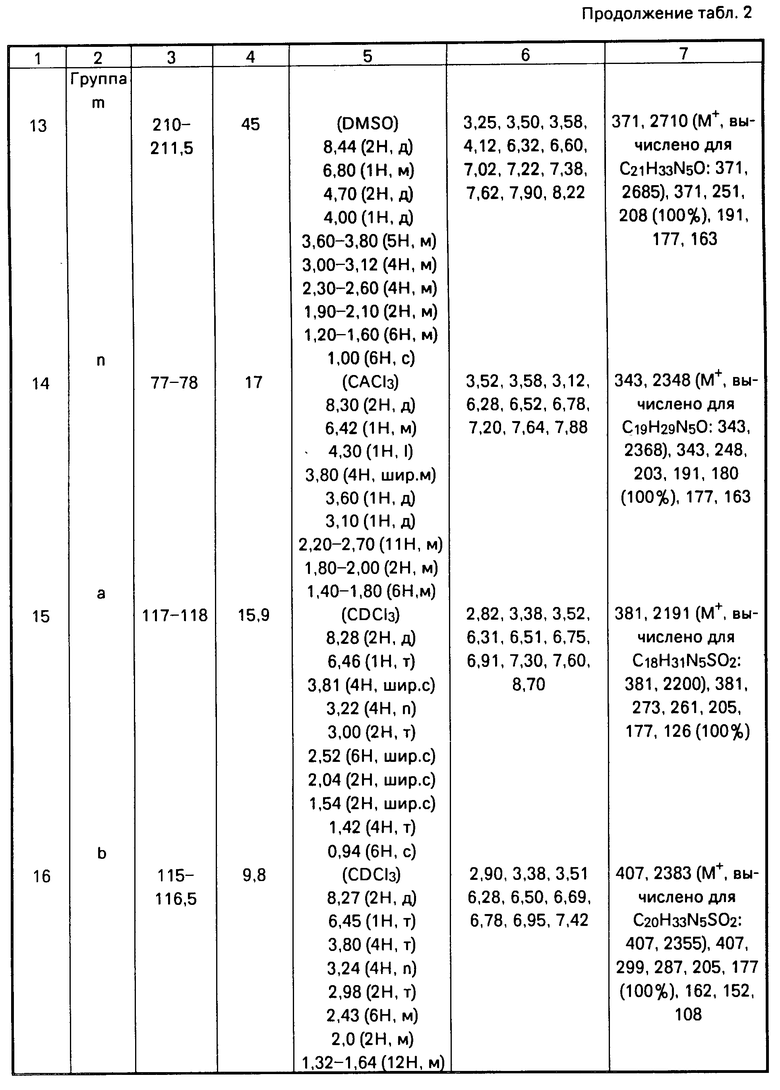
П р и м е р ы 1-14. Общая методика получения соединений формулы [1].
Раствор, содержащий соответствующий амин, один молярный эквивалент дихлоргидрата 4-[4-(2-пиримидинил)-1-пипе- разинил]масляной кислоты, 2 эквивалента триэтиламина и 1,5 эквивалента 1-гидроксибензотриазола в хлористом метилене, выливают в трехгорлую круглодонную колбу, оснащенную холодильником, отверстием для подачи азота, магнитной мешалкой и термометром, и охлаждают до 0оС на водяной бане со льдом и солью. Затем добавляют 1,1 эквивалента дициклогексилкарбоди- имида. Полученную смесь перемешивают при 0оС в течение 3 ч, затем постепенно нагревают до комнатной температуры с последующим перемешиванием при комнатной температуре в течение ночи.
Дициклогексилмочевину (ДЦГМ) отфильтровывают и для удаления следов 1-гидроксибензотриазола фильтрат промывают водой (3 х 100 мл) и два раза насыщенным раствором бикарбоната натрия. Водные слои объединяют и промывают хлористым метиленом. Объединенные органические слои сушат, фильтруют и после упаривания получают полутвердый продукт. Указанный полутвердый продукт берут в минимальное количество ацетона и перемешивают в течение 1 ч для кристаллизации остаточных следов дициклогексилмочевины. Нерастворимый продукт отфильтровывают, фильтрат конденсируют до коричневого масла.
Очищенные продукты получают либо непосредственной кристаллизацией полученного масла из этилацетата, либо флэш-хроматографией на колонке с силикагелем. Целевые продукты затем перекристаллизовывают из этилацетата. Выходы продуктов не оптимизированы.
Получены следующие соединения, свойства которых представлены в табл. 2.
П р и м е р ы 15-21. Общая методика получения соединений формулы (1'').
Хлоргидрат 1-(2-пиримидил)пиперазина растворяют в воде, после чего полученный раствор подщелачивают до рН 12-14 с помощью 10%-ного NaOH. Полученную двухфазную смесь (продукт в виде желтого масла) экстрагируют трижды метилизобутилкетоном (МИБК).
В одногорлую круглодонную колбу, оснащенную магнитной мешалкой, водосборником Дина-Старка, холодильником и азотным барботером, помещают объединенные метилизобутилкетоновые слои, содержащие свободное основание 1-(2-пиримидинил)пиперазина. К указанному основанию добавляют один эквивалент соответствующего 3-хлорпропилсульфонамида [формулы Cl(CH2)3-SO2NR1, где R1 имеет вышеуказанные значения] , 1,3 эквивалента безводного Na2CO3 и каталитическое количество К1. Реакционную смесь затем кипятят с обратным холодильником в течение ночи при умеренной скорости.
Неорганические твердые вещества, содержащиеся в реакционной смеси, затем отфильтровывают, полученный фильтрат упаривают до получения масла. В большинстве случаев неочищенное масло подвергают хроматографии на силикагеле, используя этилацетат в качестве элюента. В некоторых случаях целевой продукт кристаллизуют из неочищенного масла, растворенного в этилацетате. Во всех случаях после кристаллизации очищенного продукта из этилацетата или изопропилового спирта получают чистый кристаллический продукт.
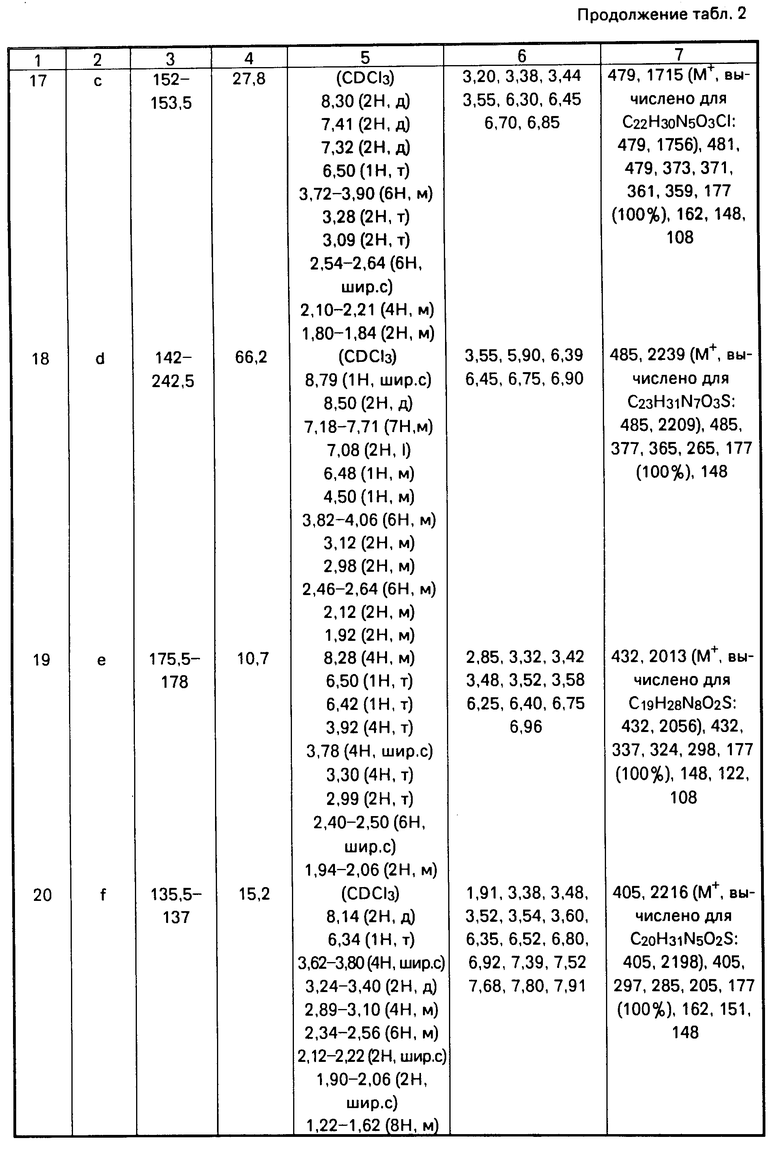
Использование: в медицине, в частности в качестве анксиолитических седативных средств. Сущность изобретения: продукт - производные 4-(2-пиридинил)пиперазина формулы  где A = -C(O)R ; -S(O)(O)R1 R - группа формулы
где A = -C(O)R ; -S(O)(O)R1 R - группа формулы 
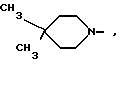
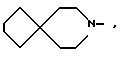
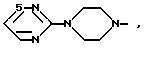
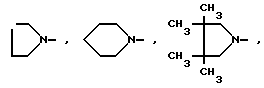
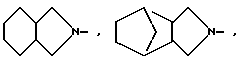
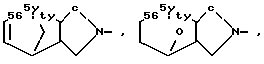
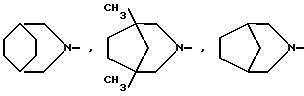 и R1 - группа формулы
и R1 - группа формулы 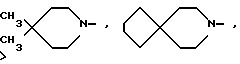
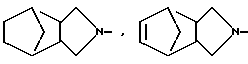 Реагент 1 - соединение формулы 2 или 3 : R-H; Cl(CH) -S(O) -R. Реагент 2 - соединение формулы 4 или 5. Условия реакции: в среде инертного растоворителя. Структура формул
Реагент 1 - соединение формулы 2 или 3 : R-H; Cl(CH) -S(O) -R. Реагент 2 - соединение формулы 4 или 5. Условия реакции: в среде инертного растоворителя. Структура формул 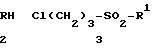
 2 табл.
2 табл.
ПРОИЗВОДНЫЕ 4-(2-ПИРИМИДИНИЛ)ПИПЕРАЗИНА общей формулы I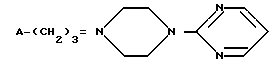
где А - группа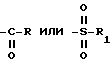
R - группа
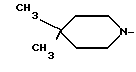
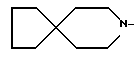
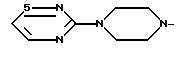
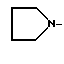
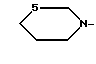
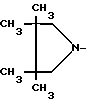
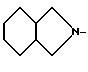
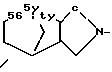
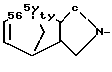
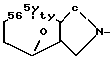
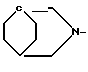
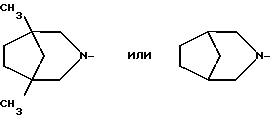
R1 - группа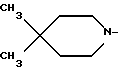
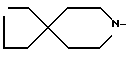
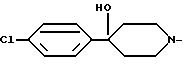
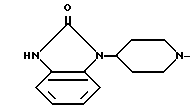
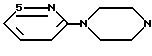
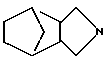
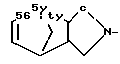
или его фармацевтически приемлемая кислотно-аддитивная соль.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Chemical abstracts Service, 36505-84-7. | |||
Авторы
Даты
1995-02-27—Публикация
1990-04-25—Подача