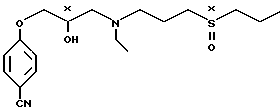
Изобретение относится к стереоизомерам 4-/3-(этил/3-(пропилсульфинил)пропил/- амино-2-гидроксипропокси -бензонитрила, и способу их получения.
Известны соединения [1] применяемые в качестве лекарственных препаратов для снятия пароксизмальной и хронической форм сердечной аритмии различной этиологии. Среди таких соединений описан 4-/3-/ этил/3-(пропилсульфинил)пропил/амино/-2-гидроксипропокси/-бензонитрил формулы
который может быть получен в виде смеси стереоизомеров или отдельных стереоизомеров в частности двух следующих стереоизомеров:
4-/3-/этил/3-(пропилсульфинил)про- пил/амино /2(R) гидроксипропокси/-бензонитрил и
4-/3-/этил/3-(пропилсульфинил)/про-пил/амино /-2-(S)-гидроксипропокси/бензонитрил.
Новые же соединения формулы I имеют два хиральных центра (х):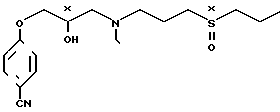 и полученные в виде следующих стереоизомеров:
и полученные в виде следующих стереоизомеров:
4-/3-/этил/3-((Rx)-пропилсульфинил)про- пил/амино/-2-(R) гидроксипропокси/-бензонитрил, 4-/3-/этил/3-((Sx)(-пропилсульфонил) пропил/амино/-2(R) гидроксипропокси
бензонитрил, 4-/3-/этил/3-((Rx)-пропилсульфинил/пропил/амино/-2(S) гидроксипропокси/-бензонитрил, 4-/3-/этил/3- ((Sx)-пропилсульфинил) пропил/амино/-2(S) гидроксипропокси -бензонитрил,
или их солей, подходят для фармацевтических целей, и, в частности, для использования в качестве новых ценных препаратов для снятия пароксизмальной и хронической форм сердечной аритмии различной этиологии.
Соединения по изобретению позволяют получать антиаритмические средства, обладающие более слабыми побочными эффектами, чем существующие препараты, снимающие аритмию. Например, соединения не обладают отрицательным инотропным эффектом, а могут проявлять даже положительное инотропное действие. Кроме того, антиаритмический эффект этих препаратов не сопровождается влиянием на центральную нервную систему и желудочно-кишечный тракт.
Стереоизомеры изобретения могут быть использованы в терапевтических целях в виде чистых форм.
Изобретение также касается способа получения указанных изомеров формулы I, которые получают взаимодействием соединения формулы II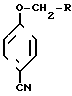 где R группа формулы: a)
где R группа формулы: a) 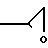 или
или
б) -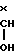 -CH2-O-SO2M где М метил или 4-метилфенил,
-CH2-O-SO2M где М метил или 4-метилфенил,
с соединением формулы III
H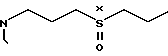
Реакция а) обычно протекает в соответствующем растворителе, как например, изопропанол или N, N-диметилформамид. Смесь необходимо нагревать до 40-100оС вплоть до окончания реакции. После этого можно приступить к выделению полученного продукта, используя общепринятые методы.
Реакцию б) обычно выполняют при использовании соответствующего органического растворителя, как например, ацетонитрил или N,N-диметилформамид. К смеси добавляется подходящее органическое или неорганическое основание. Затем смесь нагревают до 90-100оС, пока не закончится реакция, после чего производят выделение и очистку продуктов реакции, используя обычные методы.
П р и м е р 1. 4-/3-/Этил /3-((Sx)-пропилсульфинил) пропил/амино/-2-(R)-гидроксипропокси/-бензонитрил
а) Этил (3-(Sx)-пропилсульфинил)пропиламин.
Горячий раствор 27,2 г (0,1 моль) (-) -1,3,2-диоксафосфоринан-5,5-диметил-2-ок- си-4-(2-метоксифенил)-2-оксида и 17,73 г (0,1 моль) рацемического этил (3-пропилсульфинил)-пропиламина в 750 мл ацетона и 32,5 мл метанола охлаждали до комнатной температуры, в результате чего получено 23,9 г кристаллического продукта. Эксперимент повторяли при концентрации 0,25 моль, что обеспечило выход 53,0 г кристаллов. Объединенные сборы подвергали пятикратной перекристаллизации из ацетон-метанола, при этом окончательный выход составил 8,95 г соли.
Раствор 15,06 г (0,0382 моль) триоктиламина в дихлорметане перемешивали с 19,6 мл 2 М соляной кислоты. После разделения фаз органический слой промывали водой. Органическую фазу, содержащую хлорид триоктиламмония, перемешивали в течение 90 мин с раствором 8,8 г (0,0196 моль) указанной соли в воде. После разделения фаз органический слой промывали водой. Объединенные водные фазы промывали дихлорметаном, после чего доводили рН до 11,5 с помощью 10 М раствора гидроокиси натрия. В результате четырехкратной экстракции дихлорметаном получено 2,3 г левовращающегося аминооснования, условно обозначенного Sx α|D20 -8,0o (c 1, CH3OH).
13С ЯМР (в качестве соли с (-)-1,3,2-диоксифосфоринан-5,5-диметил-2-окси-4-(2-ме-токсифенил)-2-оксидом) в CDCl3; 10,80; 12,95. 15,81; 17,55; 19,49; 19,58; 20,41; 36,59; 36,61; 42,37; 45,50; 48,73; 53,67; 54,71; 76,79; 76,83; 77,34; 109,63; 119,69; 126,42; 126,50; 128,33; 128,93; 155,83.
б) (R)-4-(Оксиранилметокси)-бензонитрил.
Раствор 2,71 г (2S)-1-(4-цианофенокси)-3-метаносульфонилоксипропан-2-ола в 40 мл 1,2-диметоксиэтана перемешивали с 1,0 г порошкообразной гидроокиси натрия в течение 22 ч при комнатной температуре. После добавления 10 мл насыщенного раствора хлористого натрия смесь дважды экстрагировали эфиром. В результате промывания смеси 5 р раствором кислого углекислого натрия, высушивания над сульфатом магния, фильтрации и выпаривания получено 1,76 г кристаллического материала с точкой плавления 67,5оС.α|D20 -14,7oC (c=1, ацетон).
ЯМР: 13С в CDCl3: 44,40, 49,71, 69,02, 104,59, 115,34, 118,95, 133,98, 161,66 частей на миллион.
с) 4-/3-/Этил/3-((Sx)-пропилсульфинил) пропил/амино/-2(R)-гидроксипропокси/- бензонитрил.
Смесь на 3 г этил-(3-(Sx)-пропилсульфинил)-пропиламина и 3,18 г (R)-4-(оксиранилметокси)-бензонитрила подвергали кипячению с обратным холодильником в течение 16 ч в 25 мл изопропилового спирта. После выпаривания растворителя остаток растворяли в 2М соляной кислоте, промывали эфиром, доводили рН раствора до 11,5 2 М раствором гидроокиси натрия и подвергали экстракции дихлорметаном. В результате выпаривания органической фазы было получено 6,11 г масла.
13С ЯМР в CDCl3: 11,23, 13,17, 16,08, 20,46, 47,41, 49,98, 52,41, 54,46, 56,11, 66,05, 70,50, 108,80, 115,13, 118,92, 113,69, 161,92 частей на миллион.
П р и м е р 2. 4-/3-/Этил/3-((Rx)-пропилсульфинил) пропил/амино/-2-(S) гидроксипропокси/-бензонитрил.
а) Этил (3-(Rx)-пропилсульфинил) пропиламин.
Разделение рацемического этил-(3-пропилсульфинил)-пропиламина при помощи (+)-1,3,2-диоксифорфоринан-5,5-диметил-2-окси-4-(2-метоксифенил)-2-оксида по аналогии с примером 1a привело к образованию правовращающегося аминооснования. Это соединение, условно обозначенное Rx, имеет следующие характеристики:α|D20 + 7,6о (с=1, СН3ОН).
13С ЯМР (в качестве соли с (+) -1,3,2-диоксифосфоринан-5,5-диметил-2-окси-4-(2-метоксифенил)-2-оксидом); в CDCl3: 10,92, 13,07, 15,93, 17,66, 19,56, 19,70, 20,52, 36,72, 36,73, 42,48, 45,61, 48,85, 53,79, 54,82, 76,92, 76,96, 77,45, 77,49, 109,73, 119,81, 126,54, 126,62, 128,44, 129,06, 155,95.
б) (S)-4-(оксиранилметокси)-бензонитрил.
Из 2,7 г (2R)-1-(4-цианофенокси)-3-метаносульфонил-оксипропан-2-ола по аналогии с примером 1б получено 1,75 г кристаллического материала; точка плавления 68,0оСα|D20 + 14,5о (с=1, ацетон)
13С ЯМР в CDCl3: 44,21, 49,58, 68,90, 104,25, 115,20, 118,86, 113,80, 161,53.
с) 4-/3-/Этил/3-((Rx)-пропилсульфинил) пропил/амино/-2(S)-гидроксипропокси/ бензонитрил.
Смесь из 2,3 г этил (3-(Rx)-пропилсульфинил) пропиламина и 3,18 г (S)-4-(оксиранилметокси)-бензонитрила в 19 мл изопропилового спирта была подвергнута кипячению с обратным холодильником в течение 16 ч, и после последующей обработки по аналогии с 1c было получено 4,1 г масла; α|D20 + 26,5о (с=1, СН3ОН)
13С ЯМР в CDCl3: 11,16, 13,05, 15,96, 20,37, 47,38, 49,87, 52,37, 54,31, 56,05, 66,10, 70,47, 103,65, 11,06, 118,78, 133,55, 161,86.
П р и м е р 3. 4-/3-/Этил/3-((Rx)-пропилсульфинил) пропил/амино/-2(R) гидроксипропокси/-бензонитрил.
Смесь из 2,3 г этил (Rx)-3-пропилсульфинил пропиламина и 2,5 г (R)-4-(оксиранилметокси)-бензонитрила подвергали кипячению с обратным холодильником в течение 16 ч в 19 мл изопропилового спирта по аналогии с примером 1 с. В результате использования традиционных методов обработки было получено 4,27 г масла; α|D20 13,4о (с=1, СН3ОН).
13С ЯМР в CDCl3: 11,58, 13,36, 16,29, 20,57, 47,70, 49,96, 52,41, 54,64, 56,36, 66,24, 70,63, 104,18, 115,33, 119,07, 133,91, 162,09.
П р и м е р 4. 4-/3-/Этил/3-((Sx)-пропилсульфинил) пропил/амино/-2-(S)-гидроксипропокси/-бензонитрил.
Смесь из 2,3 г этил 3-(Sx)-пропилсульфинил пропиламина и 2,5 г (S)-4-(оксиранилметокси-бензонитрила в 19 мл изопропилового спирта подвергали кипячению с обратным холодильником в течение 24 ч по аналогии с примером 1 с. В результате использования обычных методов обработки получено 3,65 г масла; α|D20 + 11,1о (с=1, СН3ОН)
13С ЯМР в CDCl3: 11,56, 13,23, 16,25, 20,54, 47,71, 49,92, 52,42, 54,53, 56,31, 66,33, 70,64, 104,03, 115,33, 119,06, 133,86, 162,11.
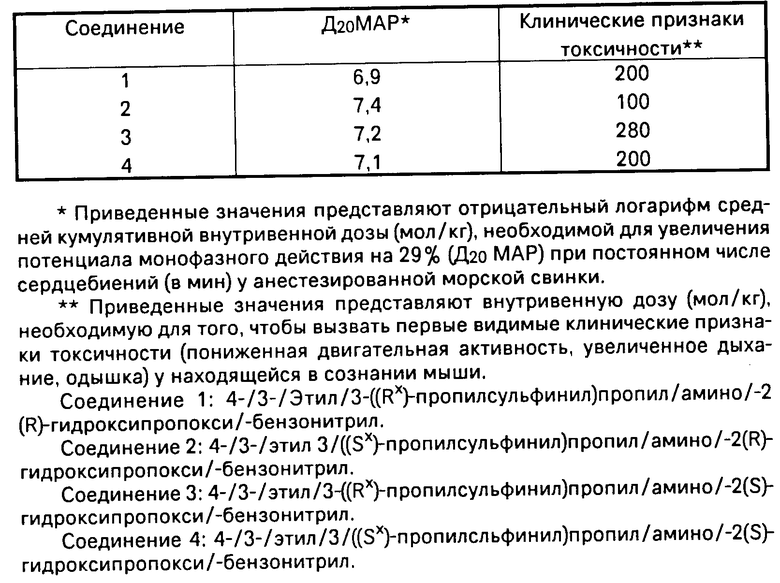
В таблице приводятся данные активности новых соединений в виде значения Д20МАР и токсичности в виде клинических показателей токсичности.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ БЕНЗОНИТРИЛА, ИЛИ ИХ РАЦЕМАТЫ, ИЛИ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ОБЛАДАЮЩИЕ АНТИАРИТМИЧЕСКИМ ДЕЙСТВИЕМ, И СОСТАВ ДЛЯ ЛЕЧЕНИЯ СЕРДЕЧНОЙ АРИТМИИ | 1989 |
|
RU2024503C1 |
| Способ получения производных бензонитрила или их фармацевтически приемлемых солей | 1991 |
|
SU1836343A3 |
| Способ получения производных бензонитрила | 1989 |
|
SU1836342A3 |
| НОВЫЕ БИСПИДИНОВЫЕ СОЕДИНЕНИЯ, ПОЛЕЗНЫЕ ПРИ ЛЕЧЕНИИ СЕРДЕЧНЫХ АРИТМИЙ | 2000 |
|
RU2250903C2 |
| ПРОИЗВОДНЫЕ АЗАБИЦИКЛООКТАНА, ФАРМАЦЕВТИЧЕСКИЕ ПРЕПАРАТЫ, СПОСОБ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ, СПОСОБЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ, СОЕДИНЕНИЯ | 2000 |
|
RU2262505C2 |
| ПРОИЗВОДНЫЕ 3,3`-ДИТИОБИС(ПРОПИОНОВОЙ КИСЛОТЫ) ИЛИ ИХ СТЕРЕОИЗОМЕРЫ И СОСТАВ, ОБЛАДАЮЩИЙ ИММУНОМОДУЛИРУЮЩИМ ДЕЙСТВИЕМ | 1991 |
|
RU2041208C1 |
| ЗАМЕЩЕННЫЕ (R)-3-(4-МЕТИЛКАРБАМОИЛ-3-ФТОРФЕНИЛАМИНО)-ТЕТРАГИДРО-ФУРАН-3-ЕНКАРБОНОВЫЕ КИСЛОТЫ И ИХ ЭФИРЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2013 |
|
RU2520134C1 |
| ПРОИЗВОДНЫЕ АЗОТСОДЕРЖАЩИХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБЫ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ И ЗАБОЛЕВАНИЙ ДЫХАТЕЛЬНЫХ ПУТЕЙ | 2001 |
|
RU2265011C2 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2001 |
|
RU2298550C2 |
| НОВЫЕ СОЕДИНЕНИЯ | 2001 |
|
RU2419608C2 |
Использование: в качестве антиаритмического средства для снятия пароксизиальной и хронической форм и сердечной аритмии. Сущность изобретения: 4-/3-/этил-/3-(пропилсульфинил)-пропил/-амино/ -2- гидроксипропокси / -бензонитрил. БФ C18H28N2O3S; 4-стереоизомера. Реагент 1: соответствующее эпокси- или сульфосоединение. Реагент 2: аминосульфоксид. Условия реакции: в растворителе, при 40 - 100°С в случае необходимости в присутствии основания. 2 с.п. ф-лы, 1 табл.
в виде стереоизомеров:
4-(3-(Этил-(3-((Rx) пропилсульфинил)- пропил)-амино)-2 (R)- гидроксипропокси ) бензонитрил,
4-(3-( Этил -(3-((Sx) пропилсульфинил )- пропил )-амино)-2-(R) - гидроксипропокси) бензонитрил,
4 (3- (Этил-(3-((Rx) пропилсульфинил) пропил) амино) 2(S) гидроксипропокси) бензонитрил,
4 (3-(Этил-)3-((Sx) пропилсульфинил)- пропил)-(амино) 2 (S) - гидроксипропокси) бензонитрил,
или их фармацевтически приемлемые соли.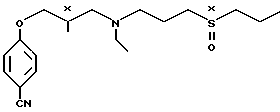
в виде одного из следующих стереоизомеров:
4-(3-(Этил-(3-((Rx)- пропилсульфинил )-пропил)-амино) -2(R) - гидроксипропокси ) бензонитрил,
4-(3-(Этил-(3-((Sx)- пропилсульфинил )-пропил)-амино)-2-(R)- гидроксипропокси ) бензонитрил,
4 ( 3-(Этил-(3-( (Rx) пропилсульфинил) пропил) амино) 2 (S) гидроксипропокси ) бензонитрил,
4 (3-(Этил-(3-((Sx) пропил сульфинил) пропил) амино) 2 (S ) гидроксипропокси) бензонитрил,
или их фармацевтически приемлемых солей, отличающийся тем, что соединение общей формулы
где R группа формулы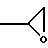 или
или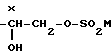
где M -метил или 4-метилфенил,
подвергают взаимодействию с соединением формулы
| W.O | |||
| Способ размножения копий рисунков, текста и т.п. | 1921 |
|
SU89A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-04-10—Публикация
1991-12-19—Подача