Изобретение относится к генной инженерии, конкретно к использованию химерного соматостатинсодержащего белка для повышения продуктивности сельскохозяйственных животных.
Ускорение роста сельскохозяйственных животных при снижении экономических затрат на 1 кг привеса является одной из основных задач животноводства. Известно, что можно повысить продуктивность сельскохозяйственных животных за счет введения им соматотропина [1,2] Однако, высокая стоимость соматотропина делает такой способ не всегда рентабельным, а применение гормональных препаратов для получения пищевых продуктов вызывает настороженное отношение в обществе. По совокупности этих причин соматотропиновые препараты пока не нашли широкого применения в практике животноводства. Возможно, однако, повысить концентрацию эндогенных анаболических факторов, воздействуя на их ингибитор соматостатин [1,2]
Соматостатин биологически активный тетрадекапептид, имеющий следующую аминокислотную последовательность, A G C K N F F W K T F T S C, вырабатывается в гипоталамусе и желудочно-кишечном тракте. Последовательность соматостатина -14 сильно консервативна среди позвоночных, а у млекопитающих вообще не имеет видовой специфичности. Соматостатин оказывает сильное ингибирующее действие на широкий круг гормонов и связанных с ним функций организма: соматотропин, тиреотропный гормон, инсулин, глюкогон, секретин, гастрин, пепсин, малетин и целый ряд регуляторных пептидов. Широкий спектр действия соматостатина на факторы, необходимые для роста и утилизации пищи, открывает большие перспективы для использования его в качестве регулятора роста животных, снижения экономических затрат на фураж и т.д. В связи с этим большой интерес представляет аутоиммунная реакция на соматостатин, приводящая к снижению концентрации пептида в крови, и, как следствие, к индукции анаболических факторов и ускорению роста животных. Для понижения концентрации эндогенного соматостатина используются активная или пассивная иммунизация животных, в результате чего в крови появляются антисоматостатиновые антитела [2]
Соматостатин является низкомолекулярным белком-гаптеном, время полужизни в кровотоке составляет несколько минут. В связи с этим для иммунизации соматостатином используют его конъюгаты с различными белками. Следует подчеркнуть, что данный подход позволяет получать экологически чистые продукты питания, так как он не связан с применением каких бы то ни было препаратов прямого гормонального действия и антибиотиков, а основан на небольших изменениях концентраций эндогенных белковых анаболических факторов, характерных для элитных, высокопродуктивных экземпляров животных [2]
Многочисленные исследования показали, что у иммунизированных соматостатином животных отмечается увеличение среднего дневного привеса на 10-20% уменьшение аппетита на 9% и возрастание эффективности утилизации пищи на 11% При этом наблюдается улучшенная абсорбция компонентов пищи и более медленное ее прохождение по желудочно-кишечному тракту при более вялой перистальтике. Иммунизированные соматостатином животные, а также их потомство, имеют правильные пропорции, и распределение веса животных между мускулатурой, костями и жиром является таким же, как и в контроле [1, 2] Иммунизация беременных коз приводит к увеличению на 10% веса новорожденных и возрастанию надоев молока.
Однако практического распространения в животноводстве антисоматостатиновая иммунокоррекция не получила, ввиду высокой стоимости препаратов химически синтезированного соматостатина (48 долларов за 1 мг по каталогу фирмы Sigma 1992г. ) Поскольку небольшие размеры соматостатина-14 не позволяют осуществить его прямой микробный синтез с помощью технологии рекомбинантной ДНК, описано несколько попыток осуществить его синтез в форме химерных белков с последующим специфическим выщеплением целевого продукта, не давших однако удовлетворительных результатов [3, 4] Основным недостатком описанных выше химерных белков являлась крайне низкая иммуногенность в отношении соматостатина, обусловленная, вероятнее всего, его маскированием в молекуле химерного белка, вследствие чего данные белки не нашли применения в сельскохозяйственной или медицинской практике.
Нами разработан новый способ конструирования химерных соматостатинсодержащих белков с применением аминокислотного спейсера (Sp), содержащего аргинин и пролин (RF) и обуславливающего локализацию соматостатина (S) на поверхности белка-носителя и тем самым высокую иммуногенность. Конструкция состоит из водонерастворимого белка-носителя (фрагмента бактериальной хлорамфениколацетилтрансферазы без 10 С-концевых аминокислот (рС), тетрамерного спейсера (RF)4 и С-концевого соматостатина-14 с общей формулой рС(Sp)4S. Молекулярный вес такого химерного белка по данным электрофореза в ПААГ составляет 28 кДа.
Плазмидная конструкция, программирующая такой химерный белок размером 4912 п. н. содержащая ScaI-BamHI фрагмент плазмидного вектора pBR 325 размером 4828 п.н. включающей часть гена устойчивости к тетрациклину с сайтом рестриктазы BamHI на 5'-конце; ген устойчивости к ампициллину; часть гена хлорамфениколацетилтрансферазы с полусайтом рестрикции ScaI на 3'-конце и элиминированным сайтом рестриктазы EcoRI;
SmaI EcoRI фрагмент линкера, содержащий сайт рестрикции EcoRI и фланкированный с 5'-конца нуклеотидной последовательностью GGG полусайт SmaI для сочленения с 3' концом гена хлорамфениколацетилтрансферазы по сайту ScaI;
EcoRI* -BglI фрагмент адаптера для соединения с последовательностью спейсера (Sp) размером 9 п.н.
GATCTATGC
ATACGTTAA
BglII-EcoRI спейсерная последовательность размером 36 п.н.
GATCTGGGCCCCGGCCCCGGCCCGGCCCCGGCCGG
ACCCGGGGCCGGGGCCGGGGCCGGGGCCGGCCTTAA
EcoRI-BamHI фрагмент синтетического гена соматостатина-14 со "стоп"-кодоном, размером 54 н.п.
AATTCATGGCTGGTTGCAAAAACTTCTTCTGGAAAACCTTCACGTCTTGCTAGG
GTACCGACCAACGTTTTTGAAGAAGACCTTTTGGAAGTGCAGAACGATCCCTAG
генетические маркеры: ген устойчивости к ампициллину;
один участок расщепления рестриктазы BamHI, принятый за 0 точку отсчета;
один участок расщепления рестриктазы SalGI, расположенный на расстоянии 276 п.н. по часовой стрелке от BamHI сайта;
один участок расщепления рестриктазы PstI, расположенный на расстоянии 3236 п.н. по часовой стрелке от BamHI сайта;
один участок расщепления рестриктазы NcoI, расположенный на расстоянии 4712 п.н. по часовой стрелке от BamHI сайта;
один участок расщепления рестриктазы BglII, расположенный на расстоянии 4840 п.н. по часовой стрелке от BamHI сайта;
один участок расщепления рестриктазы Bsp1201, расположенный на расстоянии 4846 п.н. по часовой стрелке от BamHI сайта;
один участок расщепления растриктазы EcoRI, расположенный на расстоянии 4876 п.н. по часовой стрелке от BamHI сайта. (4)
Названные выше спейсер, носитель адаптер и ген соматостатина-14 синтезировались, собирались и клонировались в плазмиде стандартными методами.
Данный химерный белок экспрессируется штаммом E.coli В-6519, трансформированным указанной плазмидой рС(Sp)4S. Штамм депонирован в коллекции ВКПМ под номером В-6519.
Химерный блок с экспонированным соматостатином представляет собой водонерастворимую ферментативно неактивную хлорамфениколацетилтрансферазу без 10 концевых аминокислотных остатков, к которой через спейсерную последовательность (RF)4 присоединена последовательность соматостатина-14.
Анализ экспрессии генов, кодирующих соматостатин в составе гибридных белков, проводят в клетках E.coli МКD 3207. Гибридные гены в составе экспрессирующих векторов pC(Sp)nS в клетках E.coli MKD 3207 детерминируют конститутивный синтез под контролем собственного промотора CAT. Клетки E.coli MKD 3207, трансформированные плазмидой pC(Sp)4S, выращивают в среде LB, содержащей ампициллин (50 мкг/мл), до плотности ОД550 2,0-2,5 при 37оС в течение 18 ч. В качестве контроля используют исходную плазмиду pCCS, кодирующую химерный белок CAT-соматостатин под контролем собственного Pcat. Из 1,5 мл клеточной культуры центрифугированием получают осадок клеток, который суспендируют в 200 мкл буферного раствора, содержащего 50 мМ Трис-НСl, рН 6,8, 10% глицерин, 2% SDS и 2% β -меркаптоэтанол. Суспензию кипятят 5 мин и анализируют с помощью электрофореза в 15% SDS-ПААГ. Результаты показывают наличие доминирующей полосы молекулярного веса 28 кД для химерного белка с тетрамерным спейсером и составляет 30% от суммарных бактериальных белков.
Для выделения гибридного белка с последовательностью соматостатина, клетки E.coli MKD 3207, трансформированные плазмидой pC(Sp)4S, культивируют в среде LD как описано выше в ферментере до плотности ОД550 4,0-5,0. Клетки осаждают центрифугированием при 5 тыс.g 10 мин. Осадок клеток суспендируют в 50 мМ Трис-НСl, рН 8,0, содержащем 50 мМ NaCl, 10 мМ EDTA из расчета 38 мл буфера на биомассу из одного литра клеточной культуры. После суспендирования добавляют лизоцим до конечной концентрации 100 мкг/мл, Тритон-Х100 до концентрации 0,1% и инкубируют суспензию во льду. Клетки разрушают ультразвуком. Осадок телец-включений, содержащий водонерастворимый гибридный белок, получают центрифугированием при 12 тыс.g 10 мин при 4оС. промывают двукратно буфером с Тритоном, центрифугируют и ресуспендируют в первоначальном буфере без Тритона. Отбирают аликвоты и анализируют в 15% SDS-ПААГ электрофорезе. В результате данной процедуры очистки получают препарат гибридного белка, имеющий чистоту 90% от суммарных белков осадка.
Данная методика выделения и очистки гибридного белка адаптирована для последующего применения выделяемого белка как препарата-стимулятора в животноводстве.
Целью настоящего изобретения является составление иммуногенной композиции для иммунизации животных, установление оптимального режима иммунизации, выяснение возможных побочных эффектов и определение максимального стимулирующего эффекта на мясную и молочную продуктивность и его возможного механизма.
П р и м е р 1. Подготовка химерного соматостатинсодержащего белка для иммунизации.
Очищенный препарат белка, полученный из водонерастворимых телец включений, как описано выше, растворяют в буфере 0,2 М трис-HCl рН 8.0, содержащем 6 М гуанидинхлорид и 2 мМ ЭДТА, добавляют 50-кратный молярный избыток β -меркаптоэтанола в расчете на количество S-S групп химерного белка, и раствор быстро разбавляют 10-кратным объемом буфера без гуанидинхлорида. Образовавшийся преципитат гибридного белка отделяют центрифугированием в течение 15 мин при 12000 g при 4оС и лиофильно высушивают для хранения. Непосредственно перед использованием лиофильно высушенный препарат ресуспендируют в минимальном объеме 10 мМ фосфатного буфера рН 7,0, и затем готовую водно-масляную суспензию с неполным адъювантом Фрейнда при соотношении белок-адъювант 1:1, гомогенизируют непродолжительным озвучиванием. Иммунизация проводится путем внутримышечной инъекции суспензией в области шеи или лопатки в дозе 50 мкг химерного белка на 1 кг живого веса. Повторяют инъекцию трижды с двухнедельным интервалом. В дальнейшем в зависимости от продолжительности инкубационного периода проводят еще 1-2 бустерных иммунизации с тем, чтобы повысить продуктивность животных до желаемого уровня на поздних сроках содержания.
П р и м е р 2. Применение препарата химерного соматостатин- содержащего белка для повышения продуктивности.
2а. Надои крупного рогатого скота.
Препарат вводят стельным телкам черно-пестрой породы в возрасте 24-25 месяцев приблизительно за 50 дней до отела, определяя срок стельности ректальным исследованием. Доза составляет 50 мкг/1 кг живого веса, инъекции повторяются трижды с двухнедельным интервалом в область шеи или лопатки. В этих условиях в крови появляются антисоматостатиновые антилета, а у иммунизируемых животных не наблюдается проявлений токсичности препарата, в том числе нет нарушений воспроизводительных функций (абортов, мертворожденности, уродств и т.п.).
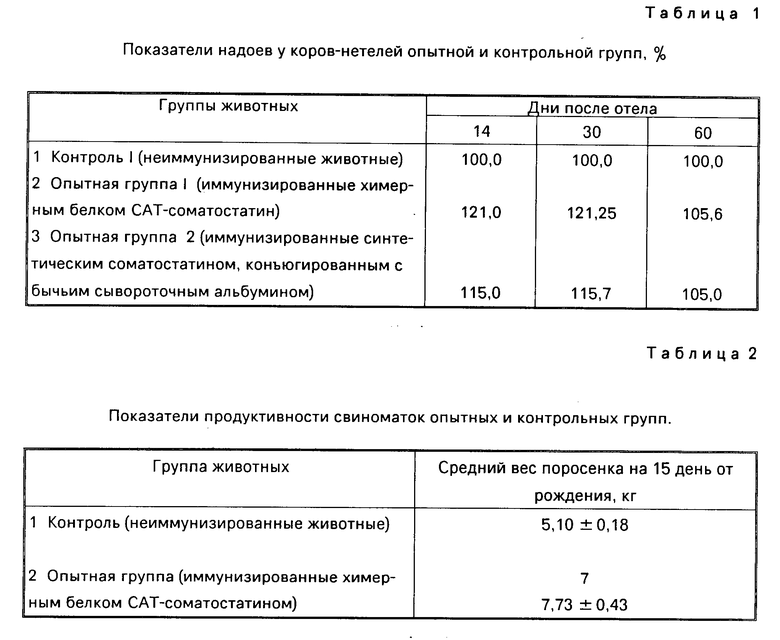
Как видно из данных табл. 1, у иммунизированных животных после отела вплоть до 60-го дня наблюдения отмечалось значительное увеличение надоев у коров, иммунизированных химерным белком с соматостатином: на 14 день эта разница достигала 21% и в дальнейшем сохранялась на уровне 9-13% причем разброс данных не превышал 1,5-3,0% Бустерные инъекции химерных белков в этом случае не проводили.
Увеличение надоев при иммунизации коров химерным соматостатинсодержащим белком (п. 2 табл.1), по крайней мере в течение первых 30 дней после отела, превышало таковое у животных, иммунизированных синтетическим соматостатином, конъюгированным с бычьим сывороточным альбумином (п.3 табл.1).
2б. Применение для свиней.
Препарат вводят супоросным свиноматкам крупной белой породы приблизительно за 50 дней до опороса. Препарат вводят в дозе 50 мкг на 1 кг веса животного внутримышечно в область шеи. Иммунизацию проводят трижды с интервалом в две недели.
У иммунизированных животных не наблюдается проявлений, указывающих на токсичность препарата, в том числе нет нарушений воспроизводительных функций (абортов, мертворожденности, уродств и т.п.).
Показатели веса поросят в опытной группе в 1,5 раза выше, чем в контрольных (см.табл.2).
В эксперименте были использованы препараты белка C(Sp)4S и C(Sp)8S. Результаты опытов для обоих препаратов были примерно одинаковы.
П р и м е р 3. Факторы стимуляции продуктивности сельскохозяйственных животных, подвергнутых антисоматостатиновой иммунокоррекции.
Как видно из данных табл.3, наряду со значительным увеличением мясной и молочной продуктивности животных при их иммунизации химерным белком с соматостатином, имеет место также и достаточно эффективное и статистически достоверное повышение надоев и привесов при иммунизации белком-носителем. Этот стимулирующий эффект может быть связан с неоднократно отмечавшейся в научной литературе стимуляцией жизнедеятельности и продуктивности животных под влиянием самой процедуры иммунизации, независимо от характера иммуногена. Однако, в подавляющей части этих работ использовались не индивидуальные препараты очищенных белков, а различного рода полиантигенные комплексы неидентифицированного состава от клеточных экстрактов и биологических жидкостей до смеси органических веществ типа речного ила, что исключает возможность однозначной интерпретации полученных результатов. Таким образом, конечный эффект увеличения продуктивности сельскохозяйственных животных при иммунизации соматостатинсодержащим химерным белком складывается из специфического действия антисоматостатинового ответа и неспецифического эффекта иммунизации носителем, причем иммунизация белком-носителем, несмотря на меньший стимулирующий эффект, может быть также использована самостоятельно в хозяйственной практике.

Использование: генная инженерия, использование химерного соматостатин-содержащего белка для повышения мясной и/или молочной продуктивности сельскохозяйственных животных. Сущность изобретения: в качестве иммуностимулятора использовали водонерастворимый полипептид, содержащий фрагмент хлорамфениколацетилтрансферазы без 10 С-терминальных аминокислот, аминокислотный спейсер (Sp)n типа (где n = 1, 2, 4 или 8) и аминокислотную последовательность соматостатина - 14. Иммунизация животных композицией, состоящей из указанного химерного белка и неполного адъюванта Фрейнда, вызывала у них стойкое повышение надоев и/или привесов, причем повышение продуктивности складывалось из специфического воздействия антисоматостатиновой иммунизации и неспецифического эффекта стимуляции, вызываемого самой процедурой иммунизации. Последний эффект, несмотря на свою меньшую величину, может быть также использован для повышения продуктивности сельскохозяйственных животных. 2 с.п. ф-лы, 3 табл.
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Шишкина А.А | |||
| и др | |||
| Синтез фрагментов гена соматостатина | |||
| Химия природных соединений, 1988, N 6, стр.614-615. | |||
Авторы
Даты
1995-05-10—Публикация
1993-06-22—Подача