Область применения
Изобретение относится к генной инженерии, биотехнологии и ветеринарии, а конкретно к рекомбинантному соматостатинсодержащему белку, способу его получения, иммуногенной композиции, содержащей в качестве антигена соматостатин, инъекционный препарат для повышения мясной и молочной продуктивности сельскохозяйственных животных, а также метод использования указанного инъекционного препарата для увеличения мышечной массы животных.
Известный уровень
Соматостатин (СОМ) - биологически активный циклический тетрадекапептид, вырабатывающийся в гипоталамусе и желудочно-кишечном тракте млекопитающих и присутствующий в организме в двух формах: одна форма содержит 14 аминокислот, а вторая форма содержит 28 аминокислот. Биологическая активность данных двух форм СОМ схожа. Форма СОМ-14 преобладает в центральной нервной системе. Она ингибирует секрецию гормона роста соматотропными клетками переднего гипофиза. Форма СОМ-28 предпочтительно экспрессируется в желудке и поджелудочной железе. Биологическая активность СОМ вызывается посредством ряда мембранных рецепторов, соединенных с белком G, среди которых описаны 5 подтипов, а именно подтипы с SSTR1 по SSTR5 (Reubi J.C., Cancer Res., 47, 551-558; Resine Т. et al. Endocr. Review, 16, 427-442; Lamberts S.W. et al. Endocr. Review, 12, 450-482).
Изучение аминокислотного состава соматостатина у различных представителей животного царства показало высокую степень гомологии пептидов, синтезируемых живыми организмами, находящимися на различных ступенях эволюционного развития. Аминокислотная последовательность СОМ-14 идентична у живых организмов - от рыб до млекопитающих и человека.
COM-14 оказывает сильное ингибирующее действие на ряд гормонов (соматотропин, тиреотропный гормон, инсулин, глюкагон, гастрин, пепсин), инициирует угнетение секреции желудочных ферментов, поджелудочной железы, тонкого отдела кишечника, замедление моторики желудочно-кишечного тракта и эвакуации его содержимого. Снижение концентрации соматостатина приводит к ускоренному росту животных, лучшему усвоению пищи. Добиться этого стало возможно с использованием аналогов-антагонистов соматостатина, препятствующих связыванию гормона с рецепторами. Однако данная технология имеет целый ряд ограничений к применению, поскольку требует систематического многомесячного применения дорогостоящих производных соматостатина. Снизить концентрацию соматостатина в крови животных и уменьшить связывание с рецепторами гипофиза можно не только при помощи аналогов-анагонистов, но и при помощи технологии соматостатиновой иммунокоррекции.
Снижение концентрации соматостатина-14 с помощью аутоантител оказывает анаболическое воздействие на организм животных - ускоренный рост и лучшее усвоение пищи с/х животными. Технологическое решение данной идеи было реализовано в патентах RU 2031121 С1, МПК C12N 15/12, 1995 и RU 2034457 С1, МПК A01K 67/02, 1995.
Метод соматостатиновой иммунокоррекции лишен многих недостатков, возникающих при использовании рекомбинантного соматотропина. Механизм действия основан на временном связывании эндогенного соматостатина-14 специфическими антисоматостатиновыми антителами и возрастании концентрации эндогенного соматотропного гормона и других ростовых факторов, синтез которых он ингибирует, в физиологических пределах. Однако широкое применение метода активной иммунизации животных против эндогенного соматостатина-14 длительное время было невозможно вследствие его высокой стоимости, поскольку основным путем получения пептида являлся химический синтез, что экономически не позволяло реализовать данный подход на практике. Поскольку небольшие размеры соматостатина-14 не позволяют осуществить его прямой микробный синтез с помощью технологии рекомбинантной ДНК, описано несколько способов его синтеза в форме химерных белков с последующим выделением целевого продукта, не давших удовлетворительных результатов. Основным недостатком упомянутых методов является крайне низкая иммуногенность полученных препаратов в отношении соматостатина, обусловленная его маскированием в молекуле химерного белка, вследствие чего данные методы получения химерных белков не нашли широкого практического использования (Itakura R. et al., 1977. Expression in E. coli of a chemically synthesized gene of hormone somatostatin. Science, 1986, 1056-1063; Шишкина А.А. и др. Синтез фрагмента генов соматостатина. Химия природных соединений, 1988, №6, с. 614-615).
Известен способ конструирования химерных соматостатинсодержащих белков с применением аминокислотного спейсера, содержащего аргинин и пролин, обусловливающего локализацию соматостатина на поверхности белка-носителя и тем самым высокую иммуногенность препарата (RU 2031121 С1, МПК C12N 15/12, 1995). Конструкция состоит из водонерастворимого белка-носителя (фрагмент бактериальной хлорамфениколацетилтрансферазы без 10 C-концевых аминокислот), тетрамерного спейсера и C-концевого соматостатина-14. Молекулярный вес химерного белка (белок CAT-СОМ) составляет 28 кДа. Метод антисоматостатиновой иммунизации животных с использованием указанного химерного соматостатинсодержащего белка используется в промышленном животноводстве (RU 2034457 С1, МПК A01K 67/02, 1995). Однако технология очистки этого соматостатинсодержащего белка, основанная на растворении телец-включения белка CAT-СОМ в хаотропном агенте (гуанидин-хлорид) и последующий диализ, не позволяет полностью освободиться от значительного количества бактериальных белков, содержит высокие концентрации высокотоксичного липополисахарида, что не соответствует современным биотехнологическим стандартам качества иммунобиологического препарата. Нерастворимость в воде затрудняет очистку белка CAT-СОМ с помощью стандартных методов колоночной хроматографии. Белок CAT-СОМ характеризуется низкой иммуногенностью, что требует больших количеств белка для иммунизации животных. Этих недостатков лишен рекомбинантный белок, содержащий повышенное количество копий соматостатина (две) и аффинно-связывающийся с полисахаридными сорбентами. Это позволяет проводить простую и эффективную очистку белка до необходимой гомогенности и обеспечивает высокую иммуногенность за счет увеличенного количества копий соматостатина и иммобилизации на полисахаридном сорбенте в форме полиантигена.
Сущность изобретения
Цель изобретения заключается в стимуляции мясной и молочной продуктивности животных иммуногенной соматостатинсодержащей композицией за счет увеличения активности гормона роста в сыворотке крови и индукции комплексных перестроек адаптивного генеза, выражающихся в усилении активности анаболических процессов у сельскохозяйственных животных, приводящих к росту мышечной массы, увеличению молочной продуктивности при использовании препарата для инъекций с низкой реактогенностью адъюванта, позволяющего осуществлять инъекции без болезненных ощущений.
Задача изобретения заключается в создании рекомбинантного иммунологически активного соматостатинсодержащего белка, легко поддающегося очистке и обладающего достаточной иммуногенностью в отношении соматостатина как антигена, который может быть использован для повышения анаболических процессов в организме, роста мышечной массы, увеличения молочной продуктивности у сельскохозяйственных животных (крупный рогатый скот, свиньи, лошади, кролики) за счет индукции синтеза специфических аутоантител к соматостатину, блокирования его действия и, как следствие, увеличения содержания в организме животных эндогенного гормона роста.
Другая задача изобретения заключается в реализации препарата на основе указанного белка и в создании способа использования этого препарата, решающего проблему повышения анаболических процессов с помощью индукции аутоантител к соматостатину, приводящей к повышению концентрации гормона роста и усилению активности анаболических процессов у сельскохозяйственных животных при условии несистематического применения препарата.
Следует отметить, что аминокислотная последовательность соматостатина идентична как у человека, так и у всех сельскохозяйственных животных. Вследствие этого разработанный препарат является универсальным средством для увеличения концентрации гормона роста и как следствие повышения мышечной массы тела и увеличения молочной продуктивности у сельскохозяйственных животных.
Решение первой поставленной задачи обеспечивается следующими объектами изобретения.
Рекомбинантный белок, состоящий из соматостатина Гли-Сер спейсер, глюкансвязывающего домена и соматостатина (СОМ-ГСД-СОМ) с молекулярной массой 25,9 кДа, соматостатин с двух концов белка, Гли-Сер спейсер, альфа-глюкансвязывающий домен из Streptococcus mutans, имеющий аминокислотную последовательность SEQ ID NO 1 и кодируемый последовательностью нуклеотидов SEQ ID NO 1.
Способ получения рекомбинантного белка СОМ-ГСД-СОМ на глюкане включает:
- выращивание клеток штамма Е. coli, экспрессирующих ген СОМ-ГСД-СОМ;
- связывание белка СОМ-ГСД-СОМ в составе клеточных экстрактов штамма Е. coli M15 с глюкансодержащем сорбентом за счет аффинного взаимодействия при процедуре инкубации;
- последующую отмывку от несвязавшихся бактериальных белков и выделение целевого продукта.
Рекомбинантный белок СОМ-ГСД-СОМ включает в себя белковую последовательность глюкансвязывающего домена, определяющего способность данного белка связываться с глюкансодержащем сорбентом, что позволяет проводить в одну стадию концентрирование, очистку и иммобилизацию белкового продукта на глюкане. Иммобилизацию на глюкане обеспечивает входящий в структуру рекомбинантного белка глюкансвязывающий домен из альфа-глюкансвязывающего домена гена из Streptococcus mutans, который обладает высоким сродством к альфа-глюканам (пуллулан, гликоген, декстран, крахмал) и обеспечивает необратимое связывание с носителем в широком диапазоне значений pH 6,0-9,0 и концентраций соли NaCl 0-3 М.
Поскольку в клетках Е. coli отсутствуют белки, связывающиеся с альфа-глюканом, то синтезируемый в клетках Е. coli рекомбинантный белок СОМ-ГСД-СОМ является единственным белком клеток штамма-продуцента, прочно связывающимся с альфа-глюканом. Это обеспечивает возможность одностадийного получения высокоочищенного препарата рекомбинантного белка, иммобилизованного на глюкансодержащем сорбенте.
Решение второй поставленной задачи обеспечивается следующими объектами изобретения.
Инъекционный препарат для повышения мышечной массы тела и увеличения молочной продуктивности у сельскохозяйственных животных содержит рекомбинантный белок СОМ-ГСД-СОМ, охарактеризованный выше, суспендированный в среде из глюкансодержащего сорбента в приемлемом для инъекционного использования жидком носителе. Метод повышения мышечной массы тела и увеличения молочной продуктивности у сельскохозяйственных животных включает двукратное с интервалом в 14 суток проведение подкожных или внутримышечных инъекций препарата, содержащего рекомбинантный белок СОМ-ГСД-СОМ, суспендированный в среде из глюкансодержащего сорбента в приемлемом для инъекционного использования жидком носителе, в дозе 50-200 мкг указанного белка на 1 кг живой массы тела.
Таким образом, создан бифункциональный рекомбинантный белок СОМ-ГСД-СОМ, обладающий способностью самопроизвольно связываться с глюкансодержащим сорбентом, формируя высокоиммуногенную композицию в форме полиантигена, индуцировать синтез специфических аутоантител к соматостатину при введении животным и, как следствие, стимулировать повышение мышечной массы тела и увеличение молочной продуктивности у сельскохозяйственных животных.
Получение рекомбинантного слитного белка СОМ-ГСД-СОМ
На первом этапе осуществляют получение гена соматостатина (далее по тексту СОМ) с последующим его клонированием. Ген СОМ получали химико-ферментативным методом. Был спланирован олигонуклеотидный дуплекс, кодирующий соответствующий ген, оптимизированный для экспрессии в E.coli. Затем осуществляли получение плазмиды рСОМ-ГСД-СОМ, содержащей последовательности, кодирующие соматостатин, Гли-Сер спейсер и глюкансвязывающий домен (ГСД).
Получение штамма Е. coli - продуцента рекомбинантного белка соматостатина, соединенного с глюкансвязывающим доменом
Для получения штамма Е. coli - продуцента рекомбинантного белка СОМ-ГСД-СОМ клетки Е. coli M15 трансформировали плазмидой рСОМ-ГСД-СОМ. В культуру добавляли 3 мкл 0,1 М раствора изопропил-бета-D-тиогалактопиранозида (ИПТГ) и выращивали в течение 3 ч при температуре 37°C. При сравнении спектра белков, синтезированных клетками штамма Е. coli M15 [рСОМ-ГСД-СОМ] обнаруживали появление дополнительной белковой полосы. Молекулярная масса дополнительной полосы соответствовала ожидаемой для рекомбинантного белка СОМ-ГСД-СОМ массой в 25,9 кДа. Уровень синтеза белков в E.coli определяли, сравнивая интенсивность окрашивания полосы рекомбинантного белка с полосой соответствующего белка-стандарта молекулярной массы. Было показано, что рекомбинантный белок СОМ-ГСД-СОМ синтезируется в клетках E.coli в нерастворимой форме в виде телец-включения.
Получение рекомбинантного белка СОМ-ГСД-СОМ, иммобилизированного на альфа-глюкане
Для получения рекомбинантного белка клеточную культуру штамма E. coli M15 [СОМ-ГСД-СОМ] выращивали в 1000 мл среды LB с ампициллином (100 мкг/мл) при 37°C до оптической плотности, соответствующей 1 ед. поглощения при длине волны 550 нм. В среду добавляли 15 мкл 0,1 М раствора ИПТГ и выращивали в течение 3 ч. Клетки осаждали центрифугированием при 5500g в течение 15 мин.
Осадок ресуспендировали в фосфатном буфере с лизоцимом. Дополнительно суспензию обрабатывали ультразвуком. После центрифугирования при 6000g нерастворимый белок СОМ-ГСД-СОМ оставался в осадке. Осадок суспендировали в 8М мочевине, центрифугировали при 12000g 30 мин и отбирали надосадочную жидкость. Для иммобилизации рекомбинантного белка СОМ-ГСД-СОМ на сорбенте супернатант разводили фосфатным буфером в четыре раза, добавляли 1/10 объема суспензии альфа-глюкана, инкубировали при 25°С в течение 2 ч. Центрифугировали при частоте оборотов, равной 8000 об/мин, осадок ресуспендировали в фосфатном буфере; отмывку альфа-глюкана повторяли 3 раза. Иммобилизованный на альфа-глюкане антиген СОМ-ГСД-СОМ представляет собой суспензию сорбента с адсорбированными на нем белком. Степень чистоты препарата составляла не менее 95-97%. Консервацию препарата проводили, добавляя бензиновый спирт до конечной концентрации 0,1%.
Биологическое действие рекомбинантного белков СОМ-ГСД-СОМ
В предпочтительном варианте осуществления изобретения препарат содержит рекомбинантный белок СОМ-ГСД-СОМ, суспендированный в растворе глюкана (90% по массе), водно-масляной суспензии (10% по массе) или гидроокиси алюминия (равный объем), используется путем подкожных или внутримышечных инъекций препарата дважды с межинъекционным интервалом 14 суток в дозе 10-50 мкг рекомбинантного белка на 1 кг массы тела животного.
Эффективность применения рекомбинантного белка СОМ-ГСД-СОМ для повышения молочной продуктивности у коров
На первом этапе работы проведены исследования по определению оптимальной 'дозы рекомбинантного белка СОМ-ГСД-СОМ, обеспечивающей стабильное повышение молочной продуктивности у коров.
С этой целью на базе животноводческого хозяйства были сформированы по принципу аналогов (порода, возраст, продуктивность, продолжительность сервис-периода, клиническое состояние животных) четыре группы животных по 20 голов в каждой. Живая масса коров была 500-570 кг, молочная продуктивность животных за предыдущую лактацию находилась в пределах 23,5-24,7 кг в сутки. Рекомбинантный белок СОМ-ГСД-СОМ, суспендированный в растворе глюкана (90% по массе), водно-масляной суспензии (10% по массе) или гидроокиси алюминия (равный объем), при помощи индивидуального шприц-тюбика вводили подкожно в подлопаточную область тела животных: 1 группе - в дозе 10 мкг рекомбинантного белка/кг, 2 группе - в дозе 50 мкг белка/кг, 3 группе - в дозе 250 мкг белка/кг, 4 группа животных являлась контрольной, препарат животным этой группы не применяли. На протяжении опыта все животные находились в одинаковых условиях содержания и кормления. Рационы были сбалансированы по энергетической и питательной ценности в соответствии с рекомендациями профильных специалистов.
Учитывая динамику изменения лактационной кривой, первую инъекцию рекомбинантного белка СОМ-ГСД-СОМ проводили на 70 сутки после отела животных, вторую инъекцию - через 14 суток после первой инъекции. Результаты исследований молочной продуктивности животных опытных и контрольных групп представлены в таблице 1.
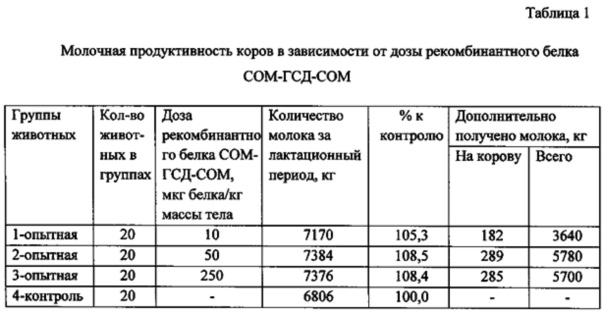
Анализ результатов исследования показал, что оптимальными дозами рекомбинантного белка СОМ-ГСД-СОМ для повышения молочной продуктивности у коров является доза 50 мкг белка/кг массы тела. Это количество соматостатинсодержащего белка в достаточной степени индуцирует синтез специфических антисоматостатиновых антител, что приводит к повышению концентрации эндогенного соматотропина и поддержанию его на высоком физиологическом уровне.
Эффективность применения рекомбинантного белка СОМ-ГСД-СОМ при откорме крупного рогатого скота
На основании предварительных исследований была предложена схема применения рекомбинантного белка СОМ-ГСД-СОМ при откорме крупного рогатого скота. Препарат применяли через 3-4 дня после постановки животных на откорм в дозе 10-250 мкг белка/кг массы тела дважды подкожно в область лопатки с межиньекционным интервалом, равным 14 суткам.
Рекомбинантный белок СОМ-ГСД-СОМ, суспендированный в растворе глюкана (90% по массе), водно-масляной суспензии (10% по массе) или гидроокиси алюминия (равный объем), при помощи индивидуального шприц-тюбика вводили подкожно в подлопаточную область тела животных: 1 группе - в дозе 10 мкг рекомбинантного белка/кг, 2 группе - в дозе 50 мкг белка/кг, 3 группе - в дозе 250 мкг белка/кг, 4 группа животных являлась контрольной, препарат животным этой группы не применяли. На протяжении опыта все животные находились в одинаковых условиях содержания и кормления. Рационы были сбалансированы по энергетической и питательной ценности в соответствии с рекомендациями профильных специалистов. Результаты опыта представлены в таблице 2.
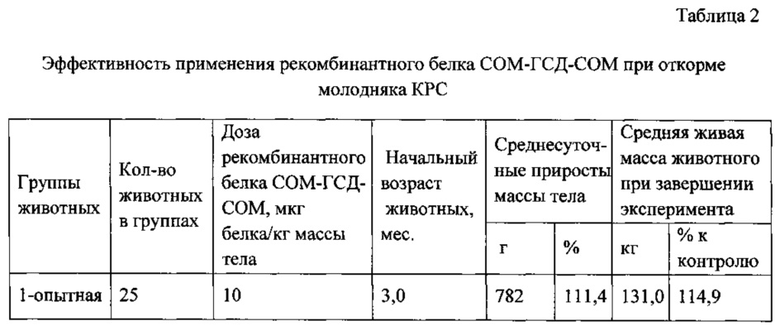

В экспериментах установлена эффективность применения рекомбинантного белка СОМ-ГСД-СОМ при откорме молодняка крупного рогатого скота. Наиболее оптимальными дозами белка являются дозы 10-50 мкг белка на 1 кг живой массы тела.
Эффективность применения рекомбинантного белка СОМ-ГСД-СОМ при откорме поросят
Разработана и апробирована в производственных условиях схема применения рекомбинантного белка СОМ-ГСД-СОМ для повышения мясной продуктивности свиней. Препарат применяли в дозе 10-250 мкг белка/кг массы тела дважды подкожно в область лопатки с межинъекционным интервалом, равным 14 суткам.
Рекомбинантный белок СОМ-ГСД-СОМ, суспендированный в растворе глюкана (90% по массе), водно-масляной суспензии (10% по массе) или гидроокиси алюминия (равный объем), при помощи индивидуального шприц-тюбика вводили подкожно в подлопаточную область тела животных: 1 группе - в дозе 10 мкг рекомбинантного белка/кг, 2 группе - в дозе 50 мкг белка/кг, 3 группе - в дозе 250 мкг белка/кг, 4 группа животных являлась контрольной, препарат животным этой группы не применяли. На протяжении опыта все животные находились в одинаковых условиях содержания и кормления. Рационы были сбалансированы по энергетической и питательной ценности в соответствии с рекомендациями профильных специалистов. Результаты опыта представлены в таблице 3.

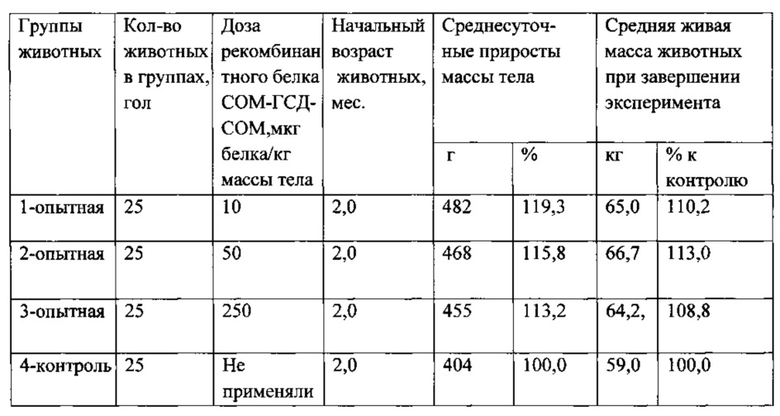
В экспериментах установлена эффективность применения рекомбинантного белка СОМ-ГСД-СОМ при откорме поросят. Наиболее оптимальными дозами белка являются дозы в диапазоне 10-50 мкг белка на 1 кг живой массы тела.


Изобретение относится к генной инженерии, биотехнологии и ветеринарии. Описан рекомбинантный иммуногенный белок, содержащий соматостатин и глюкансвязывающий домен. Представлен способ получения описанного белка на глюкане, который включает связывание белка с глюкансодержащим сорбентом за счет аффинного взаимодействия, последующую отмывку от несвязавшихся бактериальных белков и выделение целевого продукта. Также описан инъекционный препарат на основе указанного белка. Описан способ повышения мышечной массы и увеличение молочной продуктивности сельскохозяйственных животных, включающий двукратное проведение подкожных или внутримышечных инъекций препарата. Изобретение позволяет получать рекомбинантный иммунологически активный соматостатинсодержащий белок, легко поддающийся очистке и обладающий достаточной иммуногенностью в отношении соматостатина. Изобретение может быть использовано для повышения мясной и молочной продуктивности сельскохозяйственных животных (крупный рогатый скот, свиньи, кролики) за счет индукции синтеза специфических аутоантител к соматостатину, блокирования его действия и, как следствие, усиления анаболических процессов в организме животных. 4 н.п. ф-лы, 3 табл.
1. Рекомбинантный иммуногенный белок, состоящий из соматостатина, Гли-Сер спейсера и глюкансвязывающего домена (СОМ-ГСД-СОМ) с молекулярной массой 25,9 кДа, имеющий аминокислотную последовательность SEQ ID NO 1 и кодируемый нуклеотидной последовательностью SEQ ID NO 1.
2. Способ получения рекомбинантного иммуногенного белка СОМ-ГСД-СОМ по п. 1 на глюкане, включающий связывание белка СОМ-ГСД-СОМ в составе клеточных экстрактов штамма Е. coli M15 [СОМ-ГСД-СОМ] с альфа-глюкансодержащим сорбентом при процедуре инкубации, последующую отмывку от несвязавшихся бактериальных белков и выделение целевого продукта.
3. Инъекционный препарат для повышения мышечной массы сельскохозяйственных животных, содержащий рекомбинантный иммуногенный белок СОМ-ГСД-СОМ по п. 1, суспендированный в среде с альфа-глюкансодержащим сорбентом в приемлемом для инъекционного использования жидком носителе.
4. Способ повышения мышечной массы и увеличения молочной продуктивности сельскохозяйственных животных, включающий двукратное с интервалом в 14 суток проведение подкожных или внутримышечных инъекций препарата, содержащего рекомбинантный иммуногенный белок СОМ-ГСД-СОМ по п. 1, суспендированный в среде с альфа-глюкановым сорбентом в приемлемом для инъекционного использования жидком носителе, в дозе 10-50 мкг/кг массы тела животного.
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНЫХ ПЛАЗМИДНЫХ pC(Sp) , КОДИРУЮЩИХ ХИМЕРНЫЙ БЕЛОК С ПОСЛЕДОВАТЕЛЬНОСТЬЮ СОМАТОСТАТИНА-14;РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pC(Sp) , КОДИРУЮЩАЯ ЧАСТЬ ГЕНА ХЛОРАМФЕНИКОЛАЦЕТИЛТРАНСФЕРАЗЫ, ТЕТРАМЕРНЫЙ СПЕЙСЕР И СОМАТОСТАТИН-14;ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ХИМЕРНОГО БЕЛКА С ПОСЛЕДОВАТЕЛЬНОСТЬЮ СОМАТОСТАТИНА-14;ПОЛИПЕПТИД | 1993 |
|
RU2031121C1 |
| СПОСОБ ПОВЫШЕНИЯ ПРОДУКТИВНОСТИ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ И ПРЕПАРАТ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1993 |
|
RU2034457C1 |
Авторы
Даты
2017-03-22—Публикация
2016-08-01—Подача