Изобретение относится к биотехнологии и генетической инженерии и представляет собой рекомбинантную плазмидную ДНК для получения соматостатина-14 и штамм бактерии Escherichia coli - продуцент соматостатина-14.
Описано конструирование экспрессирующих плазмидных векторов, предназначенных для продукции под контролем промоторов гибридов соматостатина-14 с различными белками носителями [1, 2, 3, 4, 5, 6, 7] .
Недостатком этих векторов является, в одних случаях, нестабильность плазмиды и низкий уровень экспрессии гибридного белка в клетках E. coli, в других - трудоемкость конструирования и способов достижения экспрессии гибридных генов.
Известны штаммы-продуценты соматостатина-14 [1, 2, 3, 4, 5, 6, 7] , но как штамм-прототип E. coli RRI [1] , так и другие штаммы-аналоги имеют высокий уровень протеолитической активности.
Однако данный штамм содержит мутации, снижающие деградацию аномальных белков, мутантных белков, и стабильно сохраняет амбер фрагменты.
Целью изобретения является получение рекомбинантной плазмидной ДНК, содержащей в своем составе ген соматостатина-14, и штамма-продуцента соматостатина-14 с использованием штамма Escherichia coli со сниженным уровнем деградации аномальных белков.
Сконструированная рекомбинантная плазмида pCCS размером 4920 п. н. содержит фрагмент вектора pBR 325 размером 4860 п. н. с геном -Лактамазы и частью модифицированного гена хлорамфениколацетилтрансферазы (САТ), к 3'-концу которого через синтетический линкер, содержащий сайт рестрикции EcoRI и фланкированный с 5'-конца нуклеотидной последовательностью GG, подстроен по EcoRI сайту синтетический ген соматостатина-14. Данная плазмида детерминирует конститутивный синтез гибридного белка САТ-соматостатин-14 под контролем собственного промотора САТ в клетках E. coli МКД 3207 со сниженным уровнем деградации аномальных белков.
П р и м е р 1. Сборка и молекулярное клонирование гена соматостатина.
Олигонуклеотиды 1-10 синтезируют блочным триэфирным методом в растворе (см. чертеж).
Каждую из цепей химически синтезированных олигонуклеотидов (1-10) фосфорилируют отдельно. Реакцию проводят в 10 мл буфера трис-НСl рН 9,5, содержащего 10 мМ MgCl2, 50 мМ дитиотрейтол, 1 мМ АТФ, 100 пмоль олигонуклеотида, 1 ед. полинуклеотидкиназы фага Т4 в течение 1 ч при 37оС. После окончания реакции энзим инактивируют прогреванием 65оС 10 мин.
Для клонирования гена соматостатина-14 применяют плазмидный вектор pBR 325, который в качестве маркерных генов содержит гены устойчивости к ампициллину, тетрациклину и хлорамфениколу. Молекулярное клонирование гена, кодирующего соматостатин-14, проводят следующим образом: 5 мг плазмиды pBR 325 инкубируют с эндонуклеазами рестрикции EcoRI и BamHI (по 5 ед. ) в буфере трис-HCl рН 7,5, содержащем 100 мМ NaCl, 7 мМ MgCl2, 7 мМ 2-меркаптоэтанол при 37оС в течение 2 ч. После инкубации пробы прогревают при 65оС в течение 10 мин и фрагменты разделяют с помощью электрофореза в 0,8% -ном агарозном геле. Большой фрагмент (4042 п. н. ) экстрагируют из геля пятью объемами 1,5 М NaCl. Супернатант, полученный после центрифугирования суспензии, обрабатывают фенолом и хлороформом, ДНК осаждают этиловым спиртом, предварительно добавив т-РНК до концентрации 10 мкг/мл и растворяют в ТЕ буфере (10 мМ трис-НСl, рН 7,4, 1 мМ ЭДТА).
По 50 ммоль каждого фосфорилированного олигонуклеотида прибавляют к 1 мкг ДНК большого фрагмента pBR 325. Лигирование смеси олигонуклеотидов и фрагмента ДНК проводят в среде, содержащей 66 мМ трис-HCl, рН 7, 6, 5 мМ дитиотрейтол, 5 мМ MgCl2, 1 мМ АТФ и 1 ед. ДНК-лигазы фага Т4. Инкубацию проводят при 12оС в течение 16 ч.
Полученную лигированную смесь фрагмента ДНК и олигонуклеотидов вводят трансформацией в клетки E. coli НВ101. Трансформацию проводят с использованием замороженных клеток E. coli НВ101. 5 свежих колоний по 2 мм диспергируют на встряхивателе в 1 мл среды SOB (2% бакто-триптон, 0,5% дрожжевой экстракт. 10 мМ NaCl, 10 мМ MgCl2, 10 мМ MgSO4). 500 мкл суспензии клеток вносят в 10 мл жидкой питательной среды SOB и выращивают при 37оС до титра 7х107 клеток/мл. Клетки охлаждают во льду и центрифугируют 750 g в течение 15 мин при 4оС, тщательно удаляют супернатант, а осадок суспендируют в 3,3 мл буфера с хлористым рубидием (100 мМ RbCl, 50 мМ MgCl2 х 4Н2О, 30 мМ ацетат калия, 10 мМ CaCl2 х 2Н2О, 10 мМ глицерин). Клетки выдерживают во льду 2 ч, центригуфируют 750 g и тщательно удаляют супернатант, ресуспендируют в 800 мкл буфера, содержащего 10 мМ МОПС, 10 мМ RbCl, 75 мМ CaCl2 х 2Н2О, 15% глицерин и инкубируют 15 мин во льду, после чего аликвоты конечной суспензии замораживают в жидком азоте и используют для трансформации.
200 мкл приготовленной суспензии клеток смешивают с 5-10 мкл раствора лигированной смеси фрагмента ДНК и олигонуклеотидов и инкубируют во льду, затем 30 с при 42оС и опять во льду 2 мин, добавляют 800 мкл среды SOC (SOB с добавкой 20 мМ глюкозы) и инкубируют с умеренным встряхиванием при 37оС в течение 60 мин.
Небольшую часть суспензии клеток рассеивают на чашки с агаром, приготовленном на среде SOB, содержащем 0,8% бакто-агар и 50 мкг/мл ампициллина.
Произвольно выбирают 12 клонов, выросших на чашках с ампициллином, выделяют плазмидную ДНК щелочным методом. После обработки этих плазмид различными рестриктирующими эндонуклеазами и электрофореза в агарозном геле выбирают плазмиду искомой конструкции и содержащую в своем составе фрагмент вектора pBR 325, несущий ген bla, определяющий устойчивость к ампициллину, и ген соматостатина-14 и обозначают ее как pSOM 3-13. Анализ нуклеотидной последовательности вставки EcoRI - BamHI из этой плазмиды проводят методом Максама-Гилберта и подтверждают наличие в ней последовательности, кодирующей соматостатин-14.
П р и м е р 2. Конструирование плазмиды для экспрессии соматостатина в клетках E. coli.
Для экспрессии соматостатина в составе химерного белка в клетках E. coli конструируют рекомбинатную плазмиду в несколько этапов. На первом этапе конструируют промежуточные плазмиды pCMRI- и pSOM 3-13-5.
А. Конструирование плазмиды pCMRI-.
В векторе pcMRI- гены, кодирующие устойчивость к ампициллину и хлорамфениколу, берут из плазмиды pBR 325, а тандем терминаторов транскрипции фага fd из плазмиды pLK 53.
По 5 мкг плазмиды pBR 325 и pBK 53 обрабатывают совместно эндонуклеазами рестрикции PstI и HindIII (по 10 единиц) в 50 мкл буфера, содержащего 10 мМ транс НСl, рН 7,5, 50 мМ NaCl, 10 мМ MgCl2, 1 мМ дитиотрейтол при 37оС в течение 2 ч, затем в течение 5 мин прогревают при 65оС. Фрагменты разделяют в 0,8% агарозном геле электрофорезом. Выделение малого фрагмента (1900 п. н. ) pBR 325 и большого фрагмента (2240 п. н. ) pLK 53 проводят как в примере 1.
Для соединения полученных указанным способом фрагментов смешивают по 0,5 мкг ДНК и проводят лигирование в буфере, содержащем 66 мМ трис-HCl рН 7,5, 5 Мм MgCl2, 5 мМ дитиотрейтол, 1 мМ АТФ и 1 ед. ДНК-лигазы фага Т4 в течение 16 ч при 12оС. Полученную смесь соединенных фрагментов вводят трансформацией в клетки E. coli НВ 101 кальциевым методом.
50 мкл суспензии клеток E. coli НВ 101 вносят в 10 мл жидкой питательной среды LB и выращивают клетки при 37оС до титра 7х107клеток/мл. Клетки охлаждают во льду 10 мин и центрифугируют при 750g 15 мин при 4оС. Осадок клеток суспендируют в 5 мл холодного 0,1 М CaCl2 и инкубируют во льду 30 мин, затем клетки повторно центрифугируют и осадок суспендируют в 0,8 мл холодного 0,1 М CaCl2. Клетки выдерживают во льду 12 ч, после чего используют для трансформации.
К 200 мкл клеток добавляют 10 мкл соединенных фрагментов ДНК и инкубируют во льду 40 мин, затем выдерживают 90 с при 42оС и быстро охлаждают во льду, добавляют 1 мл среды SOC и инкубируют при 37оС в течение 60 мин.
Клетки высевают на чашки с ампициллином (50 мкг/мл) и хлорамфениколом (30 мкг/мл), а затем проверяют на устойчивость к тетрациклину (20 мкг/мл). Из клонов, имеющих фенотип AprCmrTcs выделяют плазмидную ДНК и анализируют по электрофоретической подвижности и рестрикционному анализу. Идентифицируют плазмиду с искомым вариантом и обозначают рСМ.
Из плазмиды рСМ удаляют место расщепления рестриктазой EcoRI, расположенное внутри последовательности, кодирующей САТ, с целью получения плазмиды, удобной для встраивания соматостатина-14, фланкированного EcoRI - BamHI сайтами, в С-концевую область САТ.
Для удаления EcoRI сайта используют химически синтезированный линкер, имеющий последовательность: 5'-AATTGGTGG-3' - одна цепь (I) и 3'-CCACCTTAA-5' - вторая цепь (II).
3 мкг ДНК плазмиды рСМ гидролизуют рестриктазой EcoRI в 30 мкл раствора, содержащего 50 мМ трис-HCl, рН 7,5, 10 мМ MgCl2, 1 мМ дитиотрейтол, 100 мМ NaCl при 37оС в течение 2 ч. Реакционную смесь прогревают 5 мин при 65оС, экстрагируют фенолом и осаждают ДНК этанолом. Полученный препарат линейной формы вектора рСМ растворяют в 30 мкл буфера ТЕ.
К 3 мкл раствора ДНК вектора рСМ добавляют по 50 ммоль фосфорилированных холодным АТФ олигонуклеотидов (I и II), 1 ед. ДНК-лигазы фага Т4 в 30 мкл 66 мМ трис-HCl рН 7,5, 5 мМ MgCl2, 5 мМ дитиотрейтол, 1 мМ АТФ. Реакционную смесь инкубируют при 12оС в течение 16 ч.
Полученную лигазную смесь вводят в клетки E. coli НВ101 кальциевым методом трансформации как в примере 2А. Суспензию клеток после трансформации высевают на чашки с агаром, содержащим ампициллин (50 мкг/мл) и хлорамфеникол (30 мкг/мл). Из клонов, имеющих фенотип AprCmr, выделяют плазмидную ДНК щелочным методом, анализируют по электрофоретической подвижности и рестрикционным анализом. Выбирают плазмиду, утратившую место расщепления рестриктазой EcoRI и обозначают ее как pCMRI-.
В. Конструирование промежуточной плазмиды pSOM 3-13-5.
Для конструирования плазмиды pSOM 3-13-5 используют плазмиды pSOM 3-13 и pRK. Плазмида pRK аналогична плазмидам серии pUC, но имеет следующую нуклеотидную последовательность полилинкера (9): 5'-AATTCCCGGGAAACTTCGAACGGATCCTGCAGTCGACGGTACCCA-3'.
По 5 мкг плазмиды pRK и плазмиды pSOM 3-13 гидролизуют совместно эндонуклеазами рестрикции ScaI (10 ед. ) и EcoRI (10 ед. ) в 50 мкл буфера трис-HCl рН 7,5, содержащего 125 мМ NaCl, 7 мМ MgCl2, 7 мМ 2-меркаптоэтанол и 0,01% ВSA при 37оС в течение 2 ч. Затем прогревают при 65оС в течение 5 мин.
Большой фрагмент (3529 п. н. ) плазмиды pSOM 3-13 и малый фрагмент (957 п. н. ) плазмиды pRK выделяют из 0,8% агарозного геля как в примере 1. ДНК осаждают этанолом и растворяют в 10 мкл буфере ТЕ.
По 5 мкл растворов полученных фрагментов смешивают и лигирование проводят в буфере, содержащем 66 мМ трис-HCl, рН 7,6, 5 мМ дитиотрейтол, 5 мМ MgCl2, 1 мМ АТФ и 1 ед. ДНК-лигазы фага Т4. Инкубацию проводят при 12оС в течение 16 ч. Лигированную смесь фрагментов ДНК вводят в клетки E. coli НВ101 способом трансформации, описанным в примере 2А.
Отбор рекомбинантных клонов проводят после высевания суспензии клеток на чашки с ампициллином (50 мкг/мл). Из клонов выделяют плазмиды, анализируют продукты их гидролиза, полученные при совместном действии рестриктаз EcoRI и ScaI. Выбирают плазмиду, имеющую искомую конструкцию и обозначают ее как pSOM 3-13-5.
В. Конструирование целевой плазмиды.
Из плазмиды pCMRI- (пример 2А) и плазмиды pSOM 3-13-5 (пример 2В) конструируют целевую плазмиду.
Из плазмиды pCMRI-, имеющей два места действия рестриктазы ScaI, выщепляют малый фрагмент (1389 п. н. ), содержащий укороченный с 3'-конца ген САТ. Плазмиду pSOM 3-13-5 гидролизуют рестриктазами ScaI и SmaI и выделяют большой фрагмент (3531 п. н. ), несущий ген соматостатина-14. Выделенные фрагменты смешивают и лигируют, повторяя все условия выделения фрагментов плазмидной ДНК и лигирования как в примере 1. Лигированную смесь фрагментов ДНК вводят трансформацией в клетки E. coli НВ101 с использованием метода трансформации как в примере 1. Клетки высевают на чашки с ампициллином (50 мкг/мл). Из клонов, выросших на чашках с ампициллином, выделяют плазмиду с искомой конструкцией, содержащую в своем составе гибридный ген САТ-соматостатин-14 и обозначают ее как pCCS.
Проводят анализ нуклеотидной последовательности в области узнавания рестриктазой EcoRI по методу Максама-Гилберта, который показывает, что соединенные места расщепления рестриктазой ScaI, расположенного на 3'-конце гена САТ, со Smal сайтом из полилинкера плазмиды pRK позвлит получить единую фазу трансляции при экспрессии гибридного гена САТ-соматостатин-14.
П р и м е р 3. Использование рекомбинантной плазмиды pCCS для создания штамма E. coli - продуцента соматостатина-14.
Плазмиду pCCS вводят трансформацией в штамм E. coli MKD 3207 по методу, описанному в примере 1, и получают штамм - продуцент сомматостатина-14.
Штамм MKD 3207 характеризуется следующими признаками. Культурально-морфологические.
Штамм MKD 3207 (Escherichia coli K 12) - грамотрицательные, малоподвижные палочки, при неблагоприятных условиях образующие филаменты. Штамм хорошо растет в температурном интервале 30-42оС на богатых средах типа бульона и агара Хоттингера, а также МПБ и МПА, и на синтетических средах с добавками, компенсирующими ауксотрофные мутации.
На богатых средах образуются гладкие, с ровными краями колонии, которые со временем ослизняются, что обусловливается lon-мутацией. При температуре инкубации 40-42оС ослизнения колоний не происходит. При росте на синтетической среде с добавками колонии всегда слизистые.
Генетические и физиолого-биохимические.
Штамм MKD 3207 имеет следующие генетические маркеры: F-lac Y, sup E, gal 6, xyl 4, mal A1, arg H, his', lon-, apr 24, rpl и относится к женскому типу. Устойчив к стрептомицину, не сбраживает лактозы, галактозы, ксилозы и мальтозы.
Штамм растет на синтетической среде с добавками глюкозы, аргинина и гистидина.
Штамм MKD 3207, содержащий плазмиду pCCS, приобретает устойчивость к ампициллину.
Проводят анализ экспрессии гена, кодирующего соматостатин в составе гибридного белка в клетках E. coli MKD 3207. Гибридный ген в составе экспрессирующего вектора pCCS в клетках E. coli MKD 3207 направляет конститутивный синтез гибридного белка под контролем собственного промотора CAT-Pcat.
Клетки E. coli MKD 3207, трансформированные плазмидой pCCS, выращивают в среде LB, содержащей ампициллин (50 мкг/мл) до плотности OD660 1,8-2,0 при 37оС в течение 18 ч. В качестве контроля используют векторную плазмиду pBR 325 и плазмиду pCMRI-, кодирующие нативный белок САТ под контролем собственного промотора Рcat, как и в гибридном белке. Из 1,5 мл клеточной культуры получают осадок клеток центрифугированием. Осадок суспендируют в 20 мкл буферного раствора, содержащего 50 мМ трис-НСl, рН 6,8, 10% глицерин, 2% SDS, 2% 2 меркаптоэтанол. Суспензию кипятят 5 мин и анализируют с помощью электрофореза в 15% SDS ПААГ. Результаты показывают наличие доминирующей полосы в области молекулярного веса 24 кД. Уровень экспрессии гибридного белка составляет 5% от общих белков бактериальной клетки.
П р и м е р 4. Выявление соматостатина в клетках E. coli. А. Выделение гибридного белка.
Клетки E. coli MKD 3207, трансформированные плазмидой pCCS, культивируют в среде LВ, содержащей ампициллин (50 мкг/мл) при 37оС в течение 6-7 ч 10 л ферментере до плотности OD550 2,0-2,5. Клетки осаждают центрифугированием 5000 g 10 мин.
Осадок клеток суспендируют в буфере трис-НСl рН 8,0, содержащем 100 мМ NaCl и 1 мМ ЭДТА из расчета 38 мл буфера на 1 л клеточной культуры. Добавляют лизоцим до конечной концентрации 0,2 мг/мл и инкубируют суспензию во льду. Экстракт замораживают и оттаивают при 37оС в водяной бане. Клетки разрушают ультразвуком. Осадок, включающий водонерастворимый гибридный белок, получают центрифугированием 1200g 5 мин при 4оС, промывают буфером с 0,5% тритоном Х-100 (50 мМ трис-НСl рН 8,0, 10 мМ ЭДТА, 100 мМ NaCl, 0,5% тритон Х-100), повторно центрифугируют и осадок ресуспендируют в первоначальном буфере. Отбирают аликвоты по 10-15 мкл и анализируют 15% SDS-ПААГ электрофорезом. Обнаруживают доминантную полосу в области мол. м. 24 кД, соответствующую гибридному белку и составляющую 70-80% от общих белков осадка.
Б. Получение соматостатина.
Очищенный по примеру 4А гибридный белок растворяют в буфере 0,2 М трис-НСl рН 8,0, содержащем 6М гуанидинхлорид и 2 мМ ЭДТА. Добавляют 50-кратный молярный избыток дитиотрейтола в расчете на S-S группы гибридного белка и раствор диализуют в течение ночи против 0,01 М NH4HCO3. Образовавшийся преципитат гибридного белка отделяют центрифугированием 1200g 15 мин при +4оС и используют для расщепления бромистым цианом.
Осадок гибридного белка растворяют в 70% муравьиной кислоте и добавляют кристаллический бромистый циан (2 мг/мг белка). Инкубацию проводят при комнатной температуре в течение 20 ч. Полноту гидролизу контролируют с помощью 9-26% SDS-ПААГ электрофореза.
Смесь пептидов, образующихся после расщепления бромистым цианом, фракционируют на сефадексе G-50. Идентификацию соматостатина в объединенных в соответствии с хроматографическим профилем фракциях после их предварительного обессоливания проводят с помощью радиоиммунологического анализа, используя наборы фирмы Incstar (США). Фракции, содержащие соматостатин, очищают при помощи обращенно-фазовой хроматографии с использованием колонки "Диасорб" С 16 (4х50 мм, размер зерна - 8 мкм).
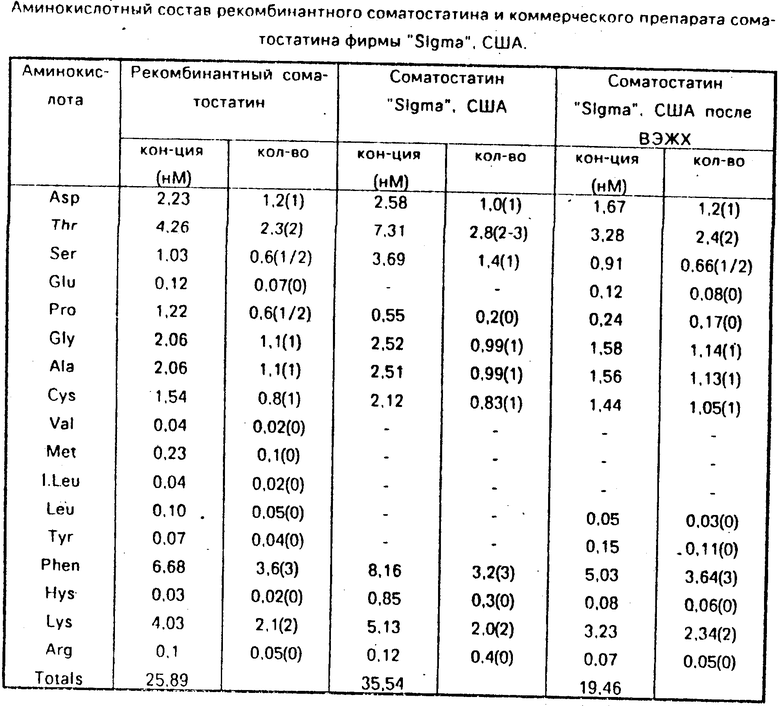
Пептиды, имеющие иммунореактивность соматостатина, собирают, замораживают, высушивают лиофильно и используют для определения N-концевой аминокислоты при помощи дансилхлорида и аминокислотного анализа. Результаты аминокислотного анализа представлены в таблице.
Выход соматостатина составляет 1 мг на 1 л бактериальной культуры. Иммунохимическая чистота препарата по данным радиоиммунологического анализа превышает 85% и соответствует коммерческому препарату фирмы "Sigma" (США).
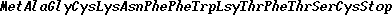
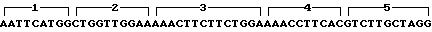
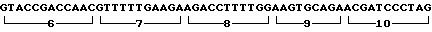
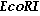
 (56) 1. ЕР N 0001929, кл. C 12 N 15/00, 1979.
(56) 1. ЕР N 0001929, кл. C 12 N 15/00, 1979.
2. ЕР N 0160190, кл. C 12 N 15/00, 1986.
3. ЕР N 0108045, кл. C 12 N 15/00, 1983.
4. ЕР N 0036776, кл. C 12 N 15/00, 1981.
5. ЕР N 0197558, кл. C 12 N 15/00, 1986.
6. Патент US N 4426437, кл. 435/317, 1984.
7. СН 662128, кл. C 12 N 15/00, 1987.
Использование: в ликероводочной промышленности и может быть использовано для получения алкогольных напитков крепостью 40% . Сущность изобретения состоит в том, что композиция ингредиентов для получения настойки горькой состоит из следующих компонентов, кг/1000 дал: аир (корень) 0,9 - 1,1; зверобой 2,7 - 2,9; женьшень (надземная часть) 0,5 - 0,7; календула 1,0 - 1,2; миррис душистая 3,0 - 3,2; пижма бальзамическая 2,5 - 2,7; ромашка лекарственная 3,8 - 4,0; сахар 20,0 - 20,4; колер 2,0 - 2,2; водно-спиртовая жидкость остальное. 1 ил, 1 табл.
- фрагмент плазмидного вектора pBR 325 размером 4860 п. н. , включающий часть гена устойчивости к тетрациклину с сайтом рестрикции Bam HI на 5'-конце, ген устойчивости к ампициллину, часть гена хлорамфениколацетилтрансферазы с полусайтом рестрикции
ScaI на 3'-конце и элиминированным сайтом рестрикции Eco RI;
- синтетический ген соматостатина со стоп-кодоном, фланкированный Eco RI - Bam HI сайтами рестрикции, размером 58 п. н. ;
- фрагмент линкера, содержащий сайт рестрикции Eco RI и фланкированный с 5'-конца нуклеотидной последовательностью GG для сочленения гена соматостатина с
3'-концом гена хлорамфениколацетилтрансферазы;
- генетические маркеры:
- ген Apr - ген устойчивости к ампициллину;
- уникальные сайты рестрикции, расположенные по часовой стрелке от Bam HI сайта: Bam HI, Sal I, Sph I, Nru I, Ava I, Nde I, Ssp I, Pst I, Pm I, Sca I, Eco 0109, Nco I, Eco RI.
Авторы
Даты
1994-03-15—Публикация
1991-03-26—Подача