Изобретение относится к области генной инженерии, конкретно к получению химерных белков, один из компонентов которых по тем или иным причинам не может быть получен в свободной форме путем микробного синтеза, а также в силу своих небольших размеров обладает лишь свойствами гаптена, т.е. способен индуцировать образование антител лишь после присоединения к высокомолекулярным носителям. В частности, к такого рода олигопептидам относится тетрадекапептид соматостатин-14, имеющий аминокислотную последовательность AGCKNFFWKTFTSC, имеющий хорошие перспективы использования в сельском хозяйстве и медицине [1,2].
Однако широкое применение соматостатина-14, в частности для стимуляции роста животных путем иммунокоррекции с помощью антисоматостатиновых антител [1,2] , невозможно из-за его высокой стоимости, поскольку основными путями получения соматостатина является химический синтез, что экономически не позволяет реализовать данный подход на практике. Появление методов генной инженерии открыло возможности для производства ряда белково-пептидных гормонов путем синтеза в клетках микроорганизмов. Однако прямой микробный синтез рекомбинантного соматостатина, представляющего собой полипептид, состоящий из 14 аминокислотных остатков, осуществить не удается [3]. Описано несколько способов его получения путем специфической деградации химерных соматостатин-содержащих белков [3], которые не дают существенных коммерческих преимуществ по сравнению с химическим синтезом этого полипептида.
Первое исследование по получению соматостатина-14 с использованием генно-инженерной технологии выполнено в 1977 г. [3]. Авторы сконструировали гибридный ген на основе β-галактозидазы E.coli, в С' -концевую область которой встроена химически синтезированная последовательность соматостатина. На основе этой схемы позже были созданы эффективные продуценты химических белков с последовательностью соматостатина на основе генов trpE, trpD и recA E.coli. Уровень экспрессии химерных белков достигал 15-30% от общего количества белков, а выход соматостатина приближался к требованиям промышленного производства.
Известны рекомбинантная плазмидная ДНК, кодирующая соматостатин, и штамм Е. coli-продуцент соматостатина. Заявленная плазмида детерминирует конструктивный синтез гибридного белка хлорамфениколацетилтрансфераза-сомaтостатин-14 под контролем собственного промотора в клетках Е.coli MKD 3207 со сниженным уровнем деградации аномальных белков [4].
Основным недостатком описанных генно-инженерных конструкций и соответствующих им химерных белков является то, что иммуногенность таких белков в отношении соматостатина была крайне низкой, вследствие чего данные белки не нашли пока применения в сельскохозяйственной или медицинской практике.
Целью изобретения является получение иммунологически активного соматостатинсодержащего белка, легко поддающегося очистке и обладающего достаточной иммуногенностью в отношении соматостатина, чтобы его можно было применять для повышения продуктивности сельскохозяйственных животных.
Поставленная цель достигается путем создания рекомбинантной плазмидной ДНК pC(Sp)nS, кодирующей химерный белок с последовательностью соматостатина-14, и спейсера (Sp)n, обеспечивающего расположение соматостатина на поверхности химерного белка. Количество мономерных блоков спейсера (n) может изменяться от 1 до 8. Описание плазмидной конструкции проводится на примере pC(Sp)4S (n=4) размерам 4912 п.н., содержащей - Sсal - BamHI фрагмент плазмидного вектора pBR 325 размером 4828 п.н., включающей часть гена устойчивости к тетрациклину с сайтом рестриктазы BamHI на 5' -конце; ген устойчивости к ампициллину; часть гена хлорамфениколацетилтрансферазы с полусайтом рестрикции ScaI на 3' -конце и элиминированным сайтом рестриктазы EcoRI;
- SmaI - EcoRI фрагмент линкера, содержащий сайт рестрикции EcoRI и фланкированный с 5' -конца нуклеотидной последовательностью GGG-полусайт SmaI - для сочленения с 3' -концом гена хлорамфениколацетилтрансферазы по сайту ScaI;
EcoRI*-BglII фрагмент адаптора, содержащий сайты рестрикции EcoRI* и BglII для соединения с последовательностью спейсера размером 9 п.н.;
- BglII-EcoRI* спейсерную последовательность размером 36 п.н.;
- EcoRI - BamHI фрагмент синтетического гена соматостатина со "стоп"-кодоном размером 54 п.н.;
- генетические маркеры: ген устойчивости к ампициллину.
- один участок расщепления рестриктазы BamHI, принятый за 0 точку отсчета;
- один участок расщепления рестриктазы SalGI, расположенный на расстоянии 276 п.н. по часовой стрелке от BamHI сайта;
- один участок расщепления рестриктазы PstI, расположенный на расстоянии 3236 п.н. по часовой стрелке от BamHI сайта;
- один участок расщепления рестриктазы NcoI, расположенный на расстоянии 4712 п.н. по часовой стрелке от BamHI сайта;
- один участок расщепления рестриктазы BglII, расположенный на расстоянии 4840 п.н. по часовой стрелке от BamHI сайта;
- один участок расщепления рестриктазы Bsp1201, расположенный на расстоянии 4846 п.н. по часовой стрелке от BamHI сайта;
- один участок расщепления рестриктазы EcoRI, расположенный на расстоянии 4876 п.н. по часовой стрелке от BamHI сайта.
Данный химерный белок экспрессируется штаммом E.coli, трансформированным указанной плазмидой pC(Sp)4S. Штамм депонирован в коллекции ВКПМ под номером В-6519.
Химерный белок с экспонированным соматостатином представляет собой водонерастворимую ферментативно неактивную хлорамфениколацетилтрансферазу без 10 концевых аминокислот остатков, к которой через спейсерную последовательность (RP)n, где n = 1-8, присоединена последовательность соматостатина-14.
Этот белок выделяют из смеси белков, продуцируемых штаммом E.coli В-6519, трансформированным рекомбинантной плазмидой рС(Sp)nS.
Химерный белок взаимодействует с антителами к соматостатину-14, а при иммунизации животных индуцирует синтез соматостатинспецифических антител.
Молекулярная масса химерного белка, определяемая методом электрофоретической подвижности в полиакриламидном геле в денатурирующих условиях, составляет 28 килодальтон.
П р и м е р 1. Сборка и молекулярное клонирование нуклеотидной последовательности спейсера (СП).
Олигонуклеотиды (2 девятичленника GATCTATGC и AATTGCATA, формирующие адаптер, и 2 восемнадцатичленника GATCTGGGCCCCGGCCGG и AATTCCGGCCGGGGCCCA, формирующих спейсер) синтезируют амидитным методом в растворе на синтезаторе PS 200 Cruachem (Англия). Каждую из цепей химически синтезированных нуклеотидов фосфорилируют отдельно. Реакцию проводят в 10 мМ буфере трис-HCl, рН 7,5, содержащем 10 мМ MgCl2, 50 мМ дитиотреитола, 1 мМ АТФ и 100 пМ олигонуклеотида, 1 ед. полинуклеотидкиназы фага Т4 в течение 1 ч при 37оС. После окончания реакции энзим инактивируют прогреванием при 65оС 10 мин.
Для клонирования СП применяют рекомбинантную плазмиду pCCS размером 4920 п.н. [4], которая содержит фрагмент вектора pBR325 размером 4860 п.н. с геном β-лактамазы и частью модифицированного гена хлорамфениколацетилтрансферазы (САТ), к 3' -концу которого через синтетический линкер, содержащий сайт рестриктазы EcoRI и фланкированный с 5' -конца нуклеотидной последовательностью GG, подстроен по EcoRI сайту синтетический ген соматостатина-14. Данная плазмида детерминирует конститутивный синтез гибридного белка САТ-соматостатин-14 под контролем собственного промотора САТ в клетках E. coli. Клонирование СП проводят в две стадии. Первоначально получают производную pCCS, в которой сайт рестриктазы EcoRI заменен на сайт BglII.
1а. Молекулярное клонирование BglII-EcoRI* адаптора.
1 мкг плазмиды pCCS инкубируют с эндонуклеазой рестрикции EcoRI в буфере 50 мМ трис-HCl, рН 7,5, 100 мМ NaCl, 7 мМ NaCl, 7 мМ MgCl2, 7 мМ β-меркаптоэтанола при 37оС в течение 1 ч. По 50 пМ каждого фосфорилированного олигонуклеотида адаптора прибавляют к 1 мкг линеаризованной плазмиды pCCS. Легирование смесей олигонуклеотидов и плазмидной ДНК проводят в буфере для кинирования, содержащем 1 ед. ДНК-лигазы фага Т4. Инкубацию проводят при 12оС в течение 16 ч. Полученную легированную смесь ДНК и олигонуклеотидов вводят трансформацией в клетки E.coli HB101. Трансформацию проводят с использованием замороженных клеток. 5 свежих колоний диспергируют на встряхивателе в 1 мл среды SOB (2% триптон, 0,5% дрожжевой экстракт, 10 мМ NaCl, 10 мМ MgCl2, 10 мМ MgSO4). 500 мкл суспензии клеток вносят в 10 мл жидкой питательной среды SOB и выращивают при 37оС до титра 7х107 клеток/мл. Клетки охлаждают во льду и центрифугируют при 800 g в течение 15 мин при 4оС, тщательно удаляют супернатант, а осадок суспендируют в 3,3 мл буфера с хлористым рубидием (100 мМ RbCl, 50 мМ MgCl2, 30 мМ КАс, 10 мМ CaCl2, 10 мМ глицерина, рН 6,8). Клетки выдерживают во льду 2 ч, центрифугируют и тщательно удаляют супернатант. Ресуспендируют в 800 мкл буфера, содержащего 10 мМ MOPS, 10 мМ RbCl, 75 мМ CaCl2, 15% глицерина, и инкубируют 15 мин во льду, после чего аликвоты конечной суспензии замораживают в жидком азоте и используют для трансформации.
200 мкл приготовленной суспензии клеток смешивают с 5 мкл раствора легированной смеси и инкубируют 30 мин во льду, затем 90 с при 42оС, опять во льду 2 мин. Добавляют 800 мкл среды SOB и инкубируют при умеренном встряхивании при 37оС в течение 60 мин. Небольшую часть суспензии клеток высевают на чашки с агаром, приготовленные на среде SOB, содержащей 1% бакто-агара и 50 мкг/мл ампициллина. Произвольно выбирают 12 клонов, выросших на чашке с ампициллином, выделяют плазмидную ДНК щелочным методом. После обработки этих плазмид рестриктирующими эндонуклеазами PstI и BglII и электрофореза в агарозном геле выбирают плазмиду искомой конструкции.
1б. Клонирование последовательности СП.
Для клонирования последовательности СП были использованы исходная плазмида pCCS и ее модифицированная производная - pCCS-BglII. 3 мкг плазмиды pCCS инкубируют с эндонуклеазами рестрикции PstI и EcoRI, а плазмиды pCCS-BglII - с эндонуклеазами рестрикции PstI и BglII в буфере и условиях примера 1а. Фрагменты разделяют с помощью электрофореза в 0,8% агарозном геле. В первом случае из геля вырезают больший фрагмент (3296 п.н.) и экстрагируют из геля пятью объемами 1,5 М NaCl. Супернатант, полученный после центрифугирования суспензии, обрабатывают хлороформом, ДНК осаждают тремя объемами этилового спирта. ДНК растворяют в 10 мкл воды. Во втором случае из геля вырезают фрагмент меньшей молекулярной массы (1175 п.н.) и обрабатывают аналогичным образом. По 50 пМ каждого фосфорилированного олигонуклеотида СП прибавляют к 5 мкл препарата ДНК каждого фрагмента. Легирование смеси олигонуклеотидов и фрагментов ДНК проводят как в примере 1а. Трансформацию лигазной смеси и отбор клонов проводят как в примере 1а. Анализ последовательности нуклеотидной вставки был проведен первоначально рестрикционным картированием на наличие сайтов рестрикции Bsp1201 и Eco521, а затем подтвержден анализом нуклеотидной последовательности методом Максама-Гилберта.
П р и м е р 2. Полимеризация СП.
Нуклеотидная последовательность СП включает в себя сайты рестриктаз Bsp1201 и Eco521, отличительной особенностью которых является наличие одинаковых "липких" концов при различных фланкирующих нуклеотидах в первом и шестом положениях. Такая организация сайтов позволяет производить полимеризацию СП, приводящую к увеличению его размера. Для этой цели 3 мкг плазмиды pCSpS в первом случае инкубируют с эндонуклеазами рестрикции PstI и Bsp1201, а во втором случае - с эндонуклеазами рестрикции PstI и Eco521. Из продуктов первого гидролиза был выделен больший фрагмент (3302 п.н.), а из продуктов второго гидролиза - фрагмент меньшей молекулярной массы (1616 п. н. ). Процедуру элюции, легирование, трансформацию, отбор клонов проводят как в примере 1а. ДНК из полученных клонов была первоначально проанализирована рестрикционным картированием эндонуклеазами NcoI-Bsp1201 и NcpI-Eco521. Клоны содержали димер СП и имели приращение 6 нуклеотидных пар относительно исходного. Плазмида получила обозначение рС(Sp)2S. Процедуру полимеризации проводят еще два раза, в результате чего получают клоны с тетра- и октамерами СП, обозначенные pC(Sp)4S и pC(Sp)8S. Эти конструкции обозначаются в общем виде (Sp)n. В описываемых ниже примерах преимущественно использовались плазмиды с числом n=4, т.е. pC(Sp)4S, хотя для оптимизации конечного эффекта применяли и pC(Sp)2 и pC(Sp)8.
П р и м е р 3. Использование рекомбинантных плазмид серии pC(Sp)nS для создания штаммов-продуцентов E.coli.
Плазмиды pC(Sp)nS вводят трансформацией в штамм E.coli MKD 3207 по методу, описанному в примере 1а, и получают штаммы-продуценты гибридных белков.
Штамм MKD 3207 характеризуется следующими признаками.
Культурально-морфологические.
Штамм MKD 3207 (производный от Escherichia coli К-12) - представляют собой грамотрицательные, малоподвижные палочки, при неблагоприятных условиях образующие филаменты. Штамм хорошо растет в температурном интервале 30-42оС на богатых средах типа LB, а также на синтетических средах с добавками, компенсирующими ауксотрофные мутации. На богатых средах штамм образует гладкие, с ровными краями колонии, которые со временем ослизняются, что объясняется lon-мутацией. При температуре инкубации 40-42оС ослизнения колоний не происходит. При росте на синтетической среде с добавками колонии всегда слизистые.
Генетические и физиолого-биохимические признаки.
Штамм MKD 3207 имеет следующие генетические маркеры: F-, lacY, supE, ga16, xy14, mal A1, arcH, his' , lon-, apr24, rpl. Устойчив к стрептомицину, не сбраживает лактозу, галактозу, ксилозу и мальтозу. Штамм растет на синтетической среде с добавками глюкозы, аргинина и гистидина. Штамм MKD 3207, содержащий плазмиды pC(Sp)nS, приобретает устойчивость к ампициллину.
Анализ экспрессии генов, кодирующих соматостатин в составе гибридных белков, проводят в клетках E.coli MKD 3207. Гибридные гены в составе экспрессирующих векторов pC(Sp)nS в клетках E.coli MKD 3207 детерминируют конститутивный синтез под контролем собственного промотора САТ. Клетки E.coli MKD 3207, трансформированные плазмидами pC(Sp)1S, pC(Sp)2S, pC(Sp)4S и pC(Sp)8S, выращивают в среде LB, содержащей ампициллин (50 мкг/мл), до плотности ОД550 2,0-2,5 при 37оС в течение 18 ч. В качестве контроля используют исходную плазмиду pCCS, кодирующую химерный белок САТ-соматостатин под контролем собственного Pcat. Из 1,5 мл клеточной культуры центрифугированием получают осадок клеток, который суспендируют в 200 мкл буферного раствора, содержащего 50 мМ трис-НCl, рН 6,8, 10% глицерин, 2% SDS и 2% β-меркаптоэтанол. Суспензию кипятят 5 мин и анализируют с помощью электрофореза в 15% SDS-ПААГ. Результаты показывают наличие доминирующей полосы молекулярной массы 26,5 кД для химерного белка с мономерной и димерной копиями спейсера, 28 кД для тетрамерного спейсера и 30 кД для октамерной последовательности спейсера. Уровень экспрессии гибридных белков с мономерной, димерной и тетрамерной спейсерными последовательностями примерно одинаков и составляет 30% от суммарных бактериальных белков, а с последовательностью октамера - 5% . Штамм Escherichia coli MKD 3207, трансформированный плазмидой pC(Sp)4S, был депонирован в ВКПМ под номером В-6519.
П р и м е р 4. Выделение гибридного белка с последовательностью соматостатина.
Клетки E. coli MKD 3207, трансформированные плазмидой pC(Sp)4S, культивируют в среде LB как описано в примере 3 в ферментере до плотности ОД550 4,0-5,0. Клетки осаждают центрифугированием при 5 тыс. g 10 мин. Осадок клеток суспендируют в 50 мМ трис-HCl, рН 8,0, содержащем 50 мМ NaCl, 10 мМ EDTA из расчета 38 мл буфера на биомассу из одного литра клеточной культуры. После суспендирования добавляют лизоцим до конечной концентрации 100 мкг/мл, Тритон-Х100 до концентрации 0,1% и инкубируют суспензию во льду. Клетки разрушают ультразвуком. Осадок, включающий водонерастворимый гибридный белок, получают центрифугированием при 12 тыс. g 10 мин при 4оС, промывают двукратно буфером с Тритоном, центрифугируют и ресуспендируют в первоначальном буфере без Тритона. Отбирают аликвоты и анализируют в 15% SDS-ПААГ электрофорезе. В результате данной процедуры очистки получают препарат гибридного белка, имеющий чистоту 90% от суммарных белков осадка.
Данная методика выделения и очистки гибридного белка адаптирована для последующего применения выделяемого белка как препарата-стимулятора в животноводстве.
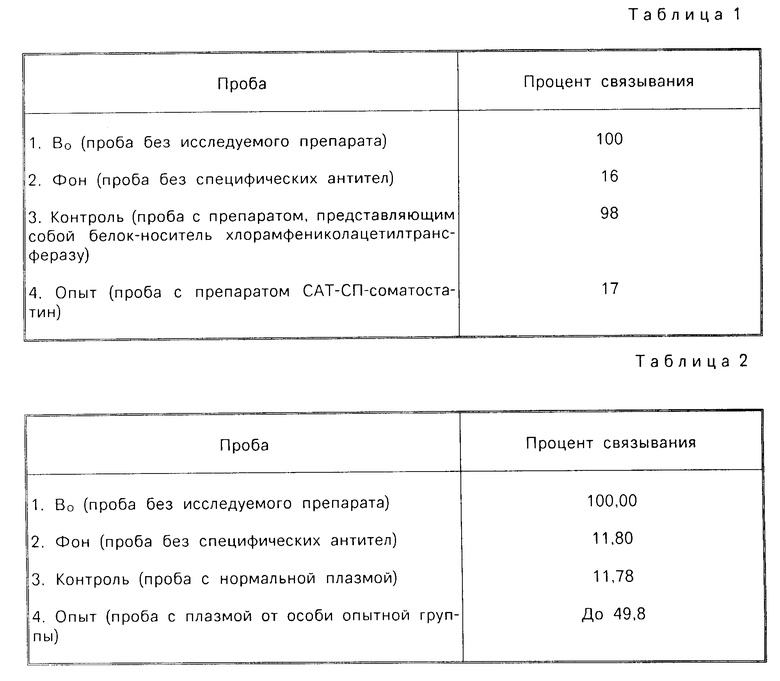
Для иммунологического анализа препарат белка, полученного по методике, описанной в примере 4, растворяют в 6М гуанидин-хлориде, а затем диализуют против 8М раствора мочевины в 10 мМ карбонатном буфере рН 11 два часа, и разбавляя диализующий раствор 10 мМ карбонатным буфером рН 11 двукратно каждые два часа, доводят концентрацию мочевины до 1М. Затем диализ проводят против 10 мМ фосфатного буфера рН 7,6 в течении 12 ч. Полученный диализат используют как антиген (добавляя в реакцию в заведомо избыточном количестве) в конкурентном РИА, проводимом с помощью набора фирмы "Incstar" (США) (см. табл. 2). Препарат ингибирует связывание меченного 125I соматостатина со специфическими антисоматостатиновыми антителами (пункт 4 табл.1).
П р и м е р 5. Получение препарата для иммунизации.
Очищенный по примеру 4 гибридный белок растворяют в буфере 0,2 М трис-HCl, рН 8,0, содержащем 6М гуанидин-хлорид и 2 мМ EDTA, добавляют 50-кратный молярный избыток β-меркаптоэтанола в расчете на S-S группы гибридного белка, и раствор быстро разбавляют 10-кратным объемом буфера без гуанидин-хлорида. Образовавшийся преципитат гибридного белка отделяют центрифугированием при 12000g 15 мин при 4оС.
Полученный преципитат лиофильно высушивают и расфасовывают по 0,5 г. Препарат для иммунизации готовят следующим образом: лиофильно высушенный препарат ресуспендируют в 10 мМ фосфатном буфере рН 7,0 в минимальном объеме, затем готовят водно-масляную суспензию с неполным адъювантом Фрейнда при соотношении белок:адъювант = 1:1, гомогенизируя непродолжительным озвучиванием.
П р и м е р 6. Применения препарата для иммунизации.
6а. Применение для крупного рогатого скота.
Препарат вводят стельным нетелям черно-пестрой породы в возрасте 24-25 месяцев приблизительно за 50 дней до отела. Срок стельности определяют ректальным исследованием. Препарат вводят в дозе 50 мкг на 1 кг массы животного внутримышечно в область шеи или лопатки. Иммунизацию проводят с интервалом две недели трижды.
У иммунизированных животных не наблюдается проявлений, указывающих на токсичность препарата, в том числе нет нарушений воспроизводительных функций (абортов, мертворожденности, уродств и т.д.).
Для анализа индукции специфических антител к соматостатину, вызываемых иммунизацией препаратом, у стельных нетелей проводят забор крови через 7 дней после последней инъекции, получают плазму и исследуют ее в РИА с помощью компонентов и протокола набора фирмы "Incstar" (США) (см. табл.1). В препаратах плазмы животных исследуемой группы наблюдается специфическое связывание соматостатина (пункт 4, табл.2).
Использование: генная инженерия, получение химерных белков, один из компонентов которых по тем или иным причинам не может быть получен в свободной форме микробного синтеза, а также в силу своих небольших размеров обладает лишь свойствами гаптена, т.е. способен индуцировать образование антител только после присоединения к высокомолекулярным носителям. Сущность изобретения: сконструирована рекомбинантная плазмидная ДНК pC(Sp)nS , детерминирующая синтез химерного белка, содержащего с часть хлорамфениколацетилтрансферазы, спейсер (Sp)n типа и соматостатин-14. Спейсер с величинами от 1 до 8 обеспечивает экспонирование соматостатина-14. Функции носителя для соматостатина выполняет ферментативно неактивная водонерастворимая хлорамфениколацетилтрансфераза без 10 концевых аминокислот, очищенный и ренатурированный химерный белок, синтезированный в протеазодефектном штамме бактерий Escherichia coli, реагирует с антителами к соматостатину и при иммунизации животных индуцирует синтез антисоматостатиновых антител. 4 с.п ф-лы, 2 табл.
СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНЫХ ПЛАЗМИД pC(SP)nS, КОДИРУЮЩИХ ХИМЕРНЫЙ БЕЛОК С ПОСЛЕДОВАТЕЛЬНОСТЬЮ СОМАТОСТАТИНА-14; РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pC(Sp)4S, КОДИРУЮЩАЯ ЧАСТЬ ГЕНА ХЛОРАМФЕНИКОЛАЦЕТИЛТРАНСФЕРАЗЫ, ТЕТРАМЕРНЫЙ СПЕЙСЕР И СОМАТОСТАТИН-14; ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ХИМЕРНОГО БЕЛКА С ПОСЛЕДОВАТЕЛЬНОСТЬЮ СОМАТОСТАТИНА-14; ПОЛИПЕПТИД.
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Шишкина А.А | |||
| и др | |||
| Синтез фрагментов гена соматостатина | |||
| - Химия природных соединений, 1988, N 6, с.614-616. | |||
Авторы
Даты
1995-03-20—Публикация
1993-06-22—Подача