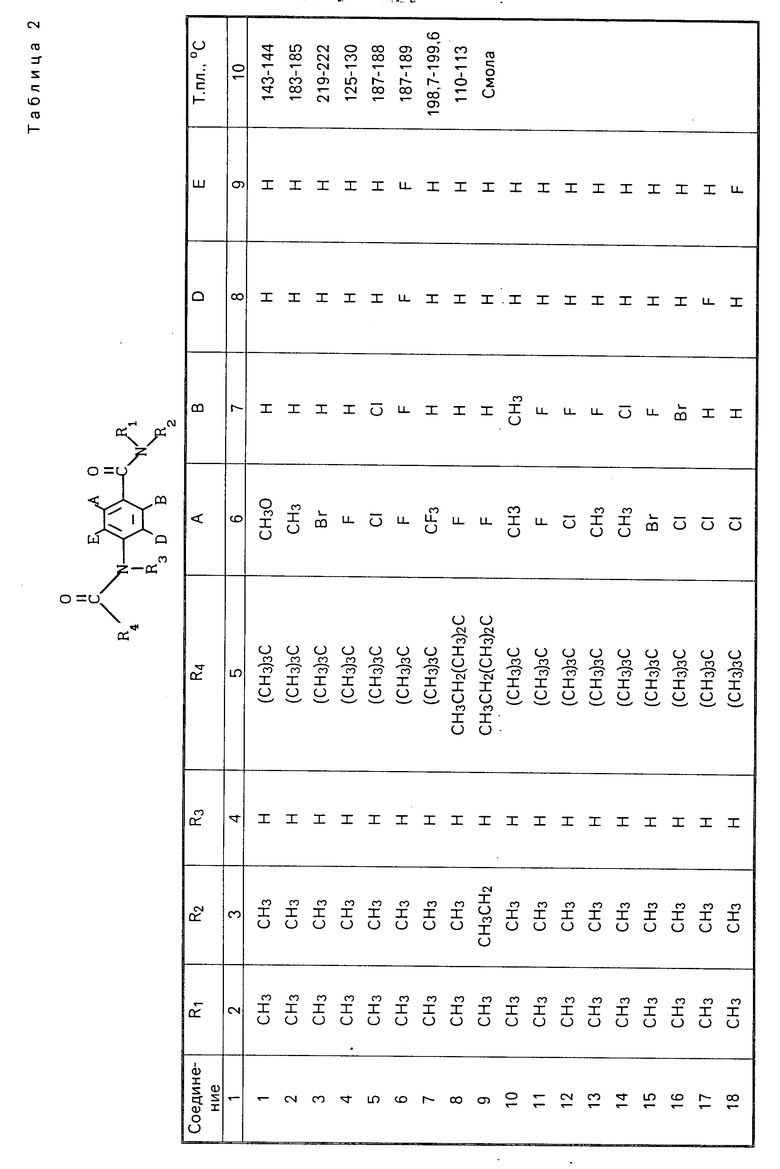
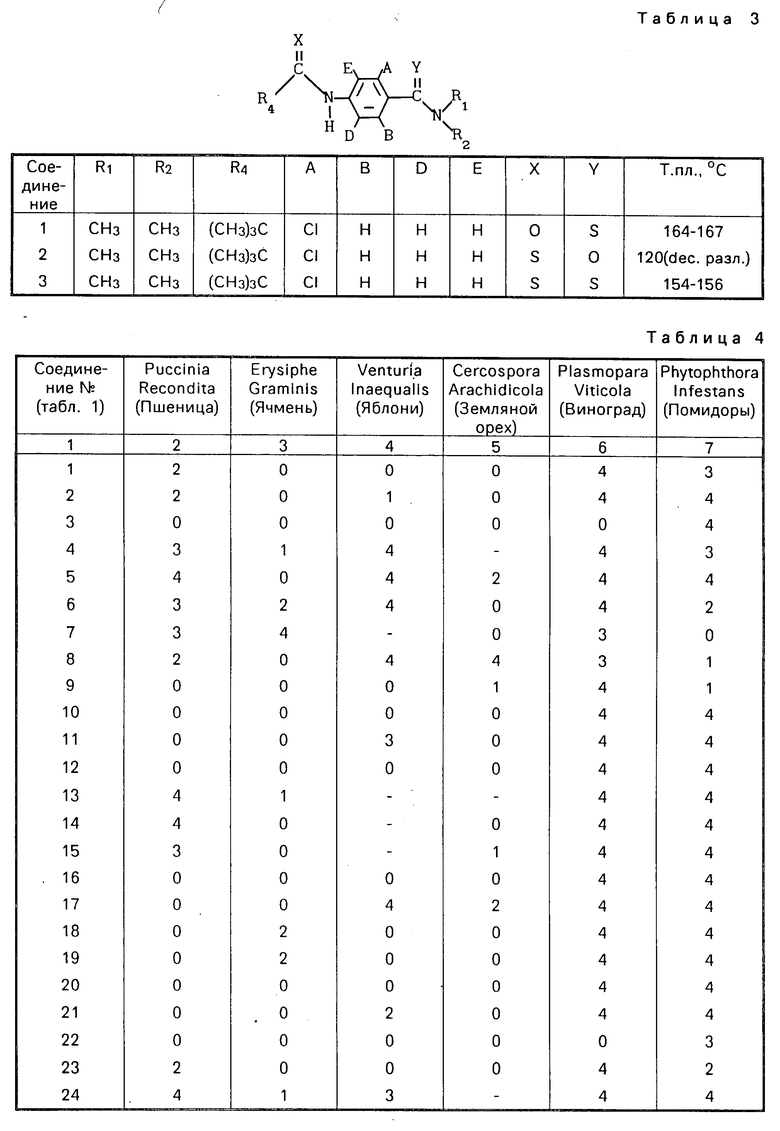
Изобретение относится к органической химии, к новым производным ациламинобензамидов общей формулы (1)
R4-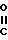 -
- -N
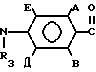
-N где А и В независимо означают Н, фтор, хлор, бром С1-4 алкил, С1-4 алкокси- или гало (С1-4) алкил при условии, что оба не являются Н, Д и Е независимо означают Н или фтор; R1 означает Н, или С1-4 алкил; R2 означает С1-4 алкил, С1-4 алкоксил, или фенил, либо R1 и R2 вместе с атомом азота, к которому они присоединены, образуют морфолиновое, пиперидиновое, пирролидиновое или азетидиновое кольцо, возможно замещенное С1-4 алкилом; R3 водород, а R4 означает трихлорметил, С2-8 алкил, возможно замещенный галогеном, С1-8 алкоксилом, или группой R12S(O)n, где R12 означает С1-4 алкил, а n означает 0,1 или 2, циклопропил, возможно замещенный галогеном или С1-4 алкилом, С2-8 алкенил, С2-8 алкинил, С1-8 алкоксигруппу, моно- или ди-(С1-4) алкиламиногруппу, или группу формулы R13ON=C(CN), где R13 означает С1-4 алкил, либо R3 и R4 вместе с группой С(O)N, к которой он присоединен, образуют азетилин-2-оновое кольцо формулы
где А и В независимо означают Н, фтор, хлор, бром С1-4 алкил, С1-4 алкокси- или гало (С1-4) алкил при условии, что оба не являются Н, Д и Е независимо означают Н или фтор; R1 означает Н, или С1-4 алкил; R2 означает С1-4 алкил, С1-4 алкоксил, или фенил, либо R1 и R2 вместе с атомом азота, к которому они присоединены, образуют морфолиновое, пиперидиновое, пирролидиновое или азетидиновое кольцо, возможно замещенное С1-4 алкилом; R3 водород, а R4 означает трихлорметил, С2-8 алкил, возможно замещенный галогеном, С1-8 алкоксилом, или группой R12S(O)n, где R12 означает С1-4 алкил, а n означает 0,1 или 2, циклопропил, возможно замещенный галогеном или С1-4 алкилом, С2-8 алкенил, С2-8 алкинил, С1-8 алкоксигруппу, моно- или ди-(С1-4) алкиламиногруппу, или группу формулы R13ON=C(CN), где R13 означает С1-4 алкил, либо R3 и R4 вместе с группой С(O)N, к которой он присоединен, образуют азетилин-2-оновое кольцо формулы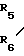 C
C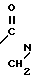 - где R5 и R6 Н, галоген или С1-4 алкил, которые обладают фунгицидными свойствами и могут использоваться для борьбы с грибками, преимущественно с грибковыми инфекциями растений.
- где R5 и R6 Н, галоген или С1-4 алкил, которые обладают фунгицидными свойствами и могут использоваться для борьбы с грибками, преимущественно с грибковыми инфекциями растений.
Наиболее близкими к предложенным по структуре и действию являются соединения, описанные в [1] и [2] однако активность их недостаточно высока.
Целью изобретения является разработка новых соединений общей формулы 1, обладающих высокой фунгицидной активностью, и способа их получения.
Поставленная цель достигается получением соединений 1 способом, заключающимся в том, что осуществляют взаимодействие соединения общей формулы
H2N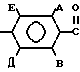 -N
-N где А, В, Д, Е, R1 и R2 имеют вышеуказанные значения с хлорангидридом формулы R4COCl, где R4 имеет вышеуказанные значения в органическом растворителе в присутствии основания, с последующим выделением целевого продукта или обработкой полученного соединения 1, где R4 означает С2-8 алкил, замещенный хлором, бромом или иодом, основанием в двухфазной системе из органического растворителя и воды в присутствии катализатора фазового переноса с получением соединения 1, где R3 и R4 вместе с группой C(O)N образуют азетидин-2-оновое кольцо, возможно размещенное галогеном или С1-4 алкилом.
где А, В, Д, Е, R1 и R2 имеют вышеуказанные значения с хлорангидридом формулы R4COCl, где R4 имеет вышеуказанные значения в органическом растворителе в присутствии основания, с последующим выделением целевого продукта или обработкой полученного соединения 1, где R4 означает С2-8 алкил, замещенный хлором, бромом или иодом, основанием в двухфазной системе из органического растворителя и воды в присутствии катализатора фазового переноса с получением соединения 1, где R3 и R4 вместе с группой C(O)N образуют азетидин-2-оновое кольцо, возможно размещенное галогеном или С1-4 алкилом.
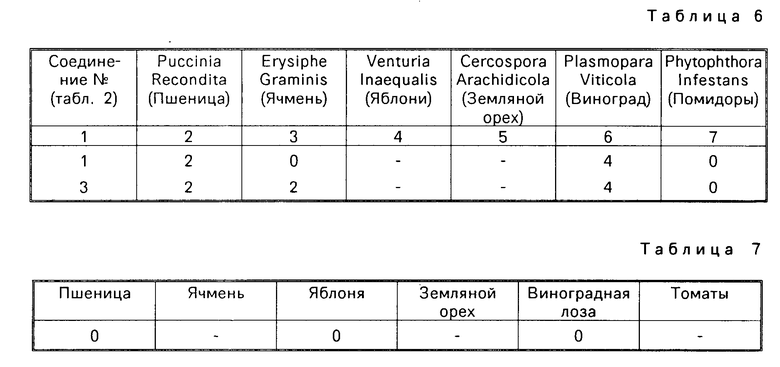
Соединения по изобретению являются активными фунгицидами и могут использоваться для борьбы одним или больше из следующих патогенных организмов: Puccinia recondita на пшенице, Erysiphe graminis (настоящая мучнистая роса) на ячмене, Venturia inaequalis (парша) на яблонях, Cercospora arachidicola на земляном орехе, Plasmopara viticola на винограде и Phytophthora infestans на картофеле. В частности, они проявляют заметную активность по отношению к Plasmopara viticola и Phytophthora infestans при системной обработке.
П р и м е р 1. В этом примере иллюстрируется получение 2-хлор-4-(2', 2'-диметилпропионамидо)-N,N-диметилбензамида (соединение N 5 в табл.1).
Стадия 1. Получение 2-хлор-4-нитро-N,N-диметилбензамида.
2-Хлор-4-нитробензойную кислоту (25,0 г) кипятят с обратным холодильником в тионилхлориде (80 г) с несколькими каплями ДМФ 3 ч. Затем избыток тионилхлорида отгоняют и сырой 2-хлор-4-нитробензоилхлорид по каплям прибавляют к 40%-ному водному диметиламину (70 мл) при 0-5оС. После перемешивания в течение 0,5 ч отфильтровывают желтый кристаллический осадок, промывают водой, сушат и получают 2-хлор-4-нитро-N, N-диметилбензамид в виде бледно-желтых кристаллов (24,97 г), т.пл. 116-117оС.
ЯМР (CDCl3, 90 МГц) δ 2,90 (3Н, с), 3,20 (3Н, с), 7,49 (1Н, д), 8,12 (1Н, д), 8,27 (1Н, м), ИК (нуйол): 3100, 1640 см-1.
Стадия 2. Получение 4-амино-2-хлор-N,N-диметилбензамида.
Порошкообразное железо (предварительно восстановленное водородом, 10,0 г) суспендируют в этаноле (80 мл) и воде (10 мл) и при интенсивном перемешивании прибавляют концентрированную соляную кислоту (4 мл). Небольшими порциями в течение 15 мин прибавляют 2-хлор-4-нитро-N,N-диметилбензамид (7,50 г) и смесь нагревают 5 ч при 50-60оС и перемешивании. Смесь фильтруют через CеI. Ie и выпаривают этанол. Прибавляют воду (200 мл) и концентрированную соляную кислоту (20 мл), реакционную смесь промывают этилацетатом и затем подщелачивают до рН 8 бикарбонатом натрия и экстрагируют метиленхлоридом. Органические экстракты сушат, выпаривают и получают 4-амино-2-хлор-N,N-диметилбензамид в виде серых кристаллов (5,21 г), из которых перекристаллизацией из смеси хлороформ/этилацетат получают белые кристаллы (3,46 г, т.пл, 170-173оС).
ЯМР (CDCl3, 270 МГц) δ: 2,89 (3Н, с), 3,11 (3Н, с), 3,87 (2Н, шс), 6,57 (1Н, дд), 6,67 (1Н, с), 7,07 (1Н, д), ИК (жидкая пленка): 3440-3340, 1640 см-1.
Стадия 3. Получение 2-хлор-4-(2',2'-диметилпропионамидо)-N,N-диметилбензами- да.
4-Амино-2-хлор-N, N-диметилбензамид (1,0 г) и триэтиламин (1,21 г) растворяют в метиленхлориде (20 мл) и раствор охлаждают до 0-5оС. По каплям прибавляют 2,2-диметилпропионилхлорид (1,21 г), поддерживая температуру ниже 10оС и результирующий оранжевый раствор перемешивают при 0-10оС в течение 0,5 ч. Затем органический раствор промывают водным бикарбонатом натрия и водой, сушат, выпаривают и получают оранжевое твердое соединение. Его перекристаллизовывают из смеси этилацетат хлороформ 3:1 и получают 2-хлор(2',2'-диметилпропионамидо)-N,N-диметилбензамил в виде белых кристаллов (1,027 г), т. пл. 202-203оС.
ЯМP (CDCl3, 270 МГц) δ: 1,32 (9Н, с), 2,86 (3Н, с), 3,13 (3Н, с), 7,16 (1Н, д), 7,34 (1Н, д), 7,68 (1H, с), 7,72 (1Н, шс), ИК (нуйол): 3340, 1690, 1630 см-1.
П р и м е р 2. В этом примере иллюстрируется получение 2-хлор-4-(2'-метилпропионамидо)-N,N-диэтилбензамида (соединение N 1 в табл.1).
Стадия 1. Получение 2-хлор-4-(2'-метилпропионамидо)бензойной кислоты.
4-Амино-2-хлорбензойную кислоту перемешивают в воде (60 мл) и 1,2-диметоксиэтана (25 мл) с бикарбонатом натрия (5,04 г) и коричневую суспензию охлаждают до 0-5оС. Пpи энергетичном перемешивании в течение 10 мин по каплям прибавляют 2-метилпропионилхлорид (4,26 г) и смесь перемешивают 2 ч при 0-10оС. Смесь выливают в 2М хлористоводородную кислоту и бледно-коричневый осадок промывают водой. Фильтруют, сушат и получают 2-хлор-4-(2'-метилпропионамидо)бензойную кислоту в виде бледно-коричневого кристаллического вещества (6,30 г), т.пл. 206-209оC.
ЯМР (d6-ДМСО, 270 МГц) δ: 1,05 (6Н, д), 2,53 (1Н, септет), 7,51 (1Н, дд), 7,78 (1Н, д), 7,86 (1Н, с), 10,19 (1Н, с), 14-12 (1Н, очень шс).
ИК (Нуйол): 3320, 1705, 1670 см-1.
Стадия 2. Получение 2-хлор-4-(2'-метилпропионамидо)бензоилхлорида.
Оксалилхлорид (0,63 г) в сухом ТГФ (5 мл) по каплям в течение 5 мин прибавляют к раствору 2-хлор-4-(2'-метилпропионамидо)-бензойной кислоты (1,0 г) в сухом ТГФ (5 мл) при комнатной температуре. После завершения прибавления прибавляют 1 каплю сухого ДМФ, что вызывает бурное выделение газа и слабый нагрев. После перемешивания в течение 4 ч и прибавления еще одной капли ДМФ, ТГФ выпаривают и получают 2-хлор-4-(2'-метилпропионамидо)бензоилхлорид в виде вязкой коричневой смолы, которую используют без дополнительной очистки.
ИК (Жидкая пленка): 3320, 3260, 3160, 3070, 1780, 1710, 1680 см-1.
Стадия 3. Получение 2-хлор-4-(2'-метилпропионамидо)-N,N-диэтилбензамида.
Сырой 2-хлор-4-(2'-метилпропионамидо)бензоилхлорид из предыдущей стадии в сухом ТГФ (10 мл) по каплям при перемешивании в течение 10-15 мин прибавляют к раствору диэтиламина (1,46 г) в сухом ТГФ (10 мл) при 0-5оC. После перемешивания при 0-10оС реакционную смесь выдерживают в течение ночи при комнатной температуре, выливают в холодную воду и экстрагируют этилацетатом. Экстракт сушат, выпаривают и получают вязкую смолу, которая медленно кристаллизуется и которую затем перекристаллизовывают из этилацетата и получают 2-хлор-4-(2'-метилпропионамидо)-N, N- диэтилбензамид в виде белых кристаллов (0,507 г).
ЯМР (CDCl3, 270 МГц) δ: 1,04 (3Н, т), 1,21 (6Н, д), 1,26 (3Н, т), 2,58 (1Н, септет), 3,15 (2Н, к), 3,39 (1Н, шм), 3,74 (1Н, шм), 7,04 (1Н, д), 7,30 (1Н, дд), 7,51 (1Н, с), 8,58 (1Н, шс).
ИК (Нуйол, паста): 3300, 3250, 3165, 1685 см-1.
П р и м е р 3. В этом примере иллюстрируется получение 1-(3'-хлор-4'-/N, N-диметилкарбамоил)фенил/-3,3-диметилазети- дин- 2-она (соединение N 11 в табл.1).
Стадия 1. Получение 2-хлор-4-(3'-хлор-2',2'-диметилпропионамидо)-N,N-диметилбензамида.
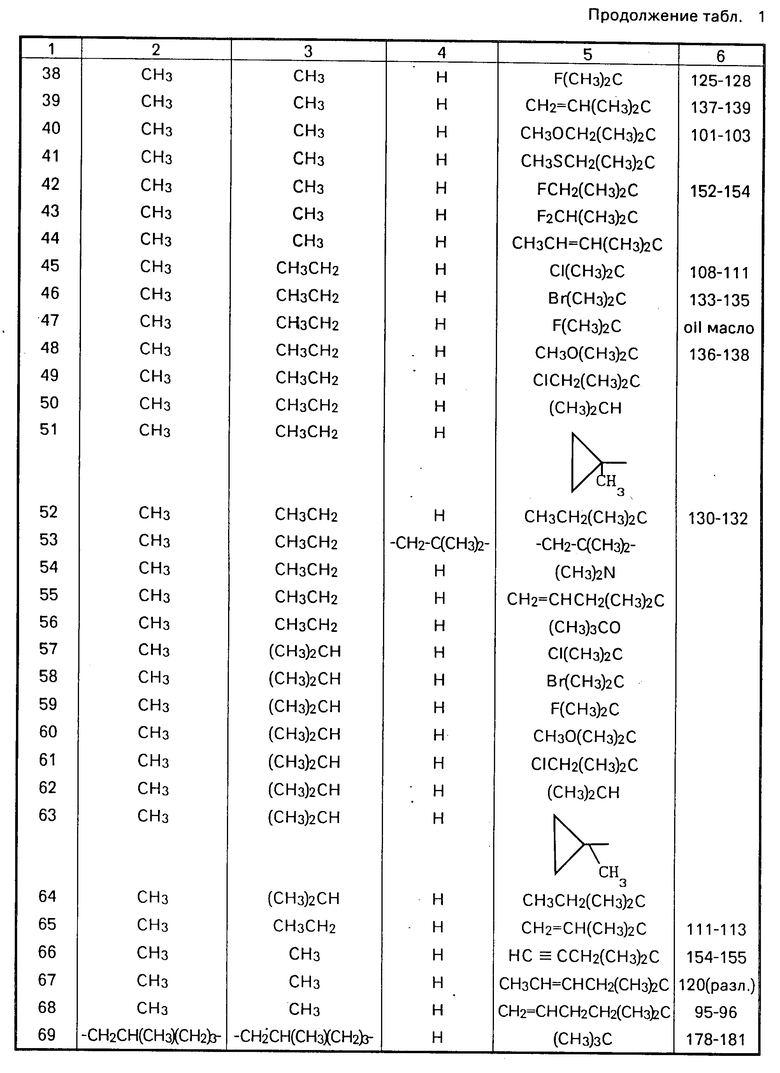
3-Хлор-2,2-диметилпропилхлорид (1,86 г) по каплям в течение 5 мин прибавляют к 4-амино-2-хлор-N, N-диметилбензамиду (2,00 г), суспензированному в сухом метиленхлориде (40 мл) и сухом триэтиламине (1,21 г), при перемешивании, поддерживая температуру ниже 10оС. После 1 ч перемешивания и нагрева до комнатной температуры прибавляют метиленхлорид (40 мл) и раствор промывают 2М НСl, насыщенном водным раствором бикарбоната натрия и затем насыщенным раствором соли. Затем раствор сушат, выпаривают и получают липкое желтое твердое соединение, которое перекристаллизовывают из смеси этилацетат/хлороформ и получают 2-хлор-4-(3'-хлор-2',2'-диметилпропионамидо)-N, N-диметилбензамид в виде белого твердого кристаллического соединения (2,349 г) т.пл. 179-181оС.
ЯМР (CDCl3, 270 МГц) δ: 1,42 (6H, с), 2,86 (3Н, с), 3,14 (3Н, с), 3,73 (2H, с), 7,06 (1Н, д), 7,26 (1Н, дд), 7,50 (1Н, с), 8,48 (1Н, шс).
ИС (Нуйол, паста): 3310, 1670, 1620 см-1.
Стадия 2. 1-(3'-Хлор-4'-)N,N-диметилкарбамоил)фенил)-3,3- диметилазетидин-2-он.
Раствор гидроксида натрия (4,00 г) и тетрабутиламмоний бромида (0,10 г) в воде (10 мл) прибавляют к суспензии 2-хлор-4-(3'-хлор-2',2'-диметилпропионамидо)N,N-ди- метилбензамеида (1,00 г) в метиленхлориде (10 мл) и двухфазную систему перемешивают 1 ч при комнатной температуре. Затем добавляют воду (10 мл) и метиленхлорид (10 мл) и весь метиленхлоридный слой промывают раствором соли, сушат, выпаривают и получают бледно-желтое твердое соединение. Его перекристаллизовывают из смеси этилацетат/гексан и получают 1-(3'-хлор-4'-/N, N-диметилкарбaмоил/фенил/-3,3-диме- тилазетидин-2-он в виде белого кристаллического твердого соединения (0,516 г), т.пл. 122-123оС.
ЯМР (CDCl3, 270 МГц) δ: 1,42 (6Н, с), 2,87 (3Н, с), 3,13 (3Н, с), 3,46 (2Н, с), 7,27 (2Н, т), 7,39 (1Н, с).
ИК (Нуйол, паста): 3600-3100, 1740, 1625 см-1.
П р и м е р 4. В этом примере иллюстрируется получение 2-метокси-4-(2', 2'-диметилпропионамидо)-N,N-диметилбензамида (соединение N 1 в табл.2).
Стадия 1. Получение метил-2-метокси-4- (2', 2'-диметилпропионамидо) бензоата.
Метил-2-метокси-4-аминобензоат (3,03 г) и триэтиламин (1,83 г) перемешивают при 0-5оС в сухом метиленхлориде (50 мл). К этому раствору прибавляют по каплям 2,2-диметилпропионилхлорид (6,07 г) в сухом метиленхлориде (10 мл). После завершения прибавления смесь перемешивают ночь при комнатной температуре и выливают в разбавленную HCl. Органический слой отделяют, промывают разбавленным водным раствором бикарбоната натрия и затем водой, сушат, выпаривают и получают кристаллизующееся масло. После нагрева с гексаном продукт фильтруют и получают в виде белого твердого соединения (3,61 г).
ЯМР (CDCl3, 270 МГц) δ: 1,33 (9H, с), 3,86 (3Н, с), 3,94 (3Н, с), 6,79 (1Н, дд), 7,45 (1Н, с), 7,79 (1Н, д), 7,82 (1Н, д).
Стадия 2. Получение 2-метокси-4-(2', 2'-диметилпропионамидо)бензойной кислоты.
Метил-2-метокси-4-(2,2-диметилпропи- онамидо)бензоат (2,98 г) перемешивают при комнатной температуре с гидроксидом калия (0,725 г) в метаноле (50 мл) 3 ч, затем кипятят с обратным холодильником 8 ч и затем выливают в воду. Смесь экстрагируют этилацетатом и подкисляют HCl. Подкисленную фракцию экстрагируют этилацетатом, экстракт сушат, выпаривают и получают твердый продукт (1,24 г).
ЯМР (CDCl3, 270 МГц) δ: 1,36 (9H, с), 4,10 (3Н, с), 6,78 (1Н, дд), 8,10 (2Н, м), 10,61 (1Н, с).
Стадия 3. Получение 2-метокси-4-(2',2'-диметилпропионамидо) бензоилхлорида.
К 2 метокси-4-(2', 2'-диметилпропионамидо)бензойной кислоте (1,04 г), перемешиваемой в сухом эфире (25 мл) прибавляют по каплям оксалилхлорид (1,4 г) в сухом эфире (5 мл) при комнатной температуре, со следами ДМФ. После завершения прибавления смесь перемешивают 4 ч и оставляют на ночь. Прибавляют метиленхлорид и смесь выпаривают, получая хлорангидрид в виде желтого твердого продукта (1,12 г).
Стадия 4. Получение 2-метокси-4-(2',2'-диметилпропионамидо)-N,N-диметилбенза- мида.
2-Метокси-4-(2', 2'-диметилпропионами- до)бензоилхлорид (1,12 г) в сухом ТГФ (10 мл) по каплям прибавляют в течение 30 мин к перемешиваемому раствору диметиламина (1,17 г 40% водного раствора) в ТГФ (15 мл) при 0-5оС. После завершения прибавления раствора перемешивают 1 ч при 5-10оС, выдерживают ночь при комнатной температуре, выливают в воду и экстрагируют этилацетатом. Экстракт сушат, выпаривают и получают желтый твердый продукт (0,889 г), т. пл. 143-144оС.
ЯМР (CDCl3, 270 МГц) δ: 1,33 (9H, с), 2,85 (3Н, с), 3,11 (3Н, с), 6,75 (1Н, дд), 7,15 (1Н, д), 7,48 (1Н, с), 7,65 (1Н, д).
П р и м е р 5. В этом примере иллюстрируется получение 2-трифторметил-4-(2',2'-диметилпропионамидо)-N,N-диметил- бензамида (соединение N 7 в табл. 2).
Стадия 1. Получение 2-трифторметил-4-(2',2'-диметилпропионамидо)бензонитрила.
2,3-Диметилпропионилхлорид (3,79 г) в сухом метиленхлориде (5 мл) медленно и по каплям прибавляют к 4-циано-3-трифторметиланилину (3,02 г) и триэтиламину (3,34 г) в сухом метиленхлориде (50 мл) при 0-5оС. После завершения прибавления смесь перемешивают при комнатной температуре 1,5 ч и выливают в разбавленную НCl. Органическую фракцию промывают разбавленным водным раствором бикарбоната натрия, затем водой, сушат и получают после выпаривания оранжевый твердый продукт. Его перекристаллизовывают и получают продукт в виде желтого порошка.
ЯМР (CDCl3, 270 МГц ) δ: 1,35 (9Н, с), 7,61, с), 7,78 (1Н, д), 7,93 (1Н, дд), 8,03 (1Н, д).
Стадия 2. Получение 2-трифторметил-4-(2',2'-диметилпропионамидо) бензамида.
Перекись водорода (85 мл 30%-ного водного раствора) и гидроксид натрия (8,5 мл 20% водного раствора) прибавляют к 2-трифторметил-4-(2',2'-диметилпропионами- до)бензонитрилу (5,03 г) в этаноле (140 мл) и реакционную смесь перемешивают 5 дней при комнатной температуре, прибавляя в это время дополнительный этанол (100 мл). Затем реакционную смесь нагревают 24 ч при 50оС, выливают в воду и экстрагируют этилацетатом. Органический слой сушат, выпаривают и получают масло, которое хроматографируют на силикагеле и получают целевой продукт (2,89 г).
ЯМР (CDCl3, 270 МГц) δ: 1,35 (9Н, с), 5,80 (2Н, шс), 7,54 (1Н, с), 7,59 (1Н, д), 7,82 (1Н, дд), 7,90 (1Н, д).
Стадия 3. Получение 2-трифторметил-4-(2',2'-диметилпропионамидо)бензойной кислоты.
Концентрированную HCl (15 мл) прибавляют к 2-трифторметил-4-(2',2'-диметилпропионамидо)бензамиду (2,35 г) в ледяной уксусной кислоте (35 мл) при (-5-0)оС. Затем к смеси по каплям прибавляют раствор нитрата натрия (1,807 г) в воде (10 мл) и проводят перемешивание 1 ч при (-5-0)оС. После разогрева до комнатной температуры перемешивают 24 ч и реакционную смесь выливают в воду и экстрагируют метиленхлоридом. Метиленхлоридную фракцию промывают разбавленным водным раствором гидроксида натрия и щелочной слой подкисляют разбавленной НCl. Подкисленный слой экстрагируют метиленхлоридом, органический слой сушат, выпаривают и получают целевую кислоту в виде белого твердого продукта (0,926 г).
ЯМР (CDCl3, 270 МГц) δ: 1,20 (9Н, с), 7,79 (1Н, д), 8,02 (1Н, дд), 8,19 (1Н, д), 9,69 (1Н, с).
Стадия 4. Получение 2-трифторметил-4-(2',2'-диметилпропионамидо)- N,N-диметилбензамида.
Оксалилхлорид (0,64 г) в сухом эфире (7 мл) по каплям прибавляют при перемешивании к 2-трифторметил-4-(2',2'-диметилпропионамидо)бензойной кислоте (0,926 г) в сухом эфире (40 мл) при комнатной температуре. В ходе прибавления добавляют каплю ДМФ. Через 2 ч прибавляют еще оксалилхлорид (0,257 г) и реакционную смесь перемешивают еще 2 ч. Затем органический раствор декантируют с осадка, выпаривают и получают 2-трифторметил-4-(2',2'-диметилпропионамидо)бензоилхлорид в виде жидкости (1,13 г), которую используют без очистки.
Хлорангидрид (1,13 г) в сухом ТГФ (10 мл) по каплям, при перемешивании, в течение 30 мин прибавляют к диметиламину (1,0 г) 40% водного раствора в ТГФ (15 мл) при 0-5оС. Реакционную смесь разогревают до комнатной температуры и выдерживают 2,5 дня, после чего выливают в воду и экстрагируют этилацетатом. Этилацетaтную фракцию промывают водным раствором бикарбоната натрия, затем разбавленной HCl и водой. После сушки органический слой выпаривают и получают 2-трифторметил-4-(2',2'-диметилпропионамидо)-N,N-диметилбензамид в виде белого твердого продукта (0,576 г), т.пл. 198,7-199,6оС.
ЯМР (CDCl3, 270 МГц) δ: 1,35 (9Н, с), 2,80 (3Н, с), 3,12 (3Н, с), 7,22 (1Н, д), 7,72 (1Н, с), 7,75 (1Н, дд), 7,85 (1Н, д).
П р и м е р 6. В этом примере иллюстрируется получение 2,3,5,6-тетрафтор-4-(2', 2'-диметилпропионамидо)-N, N-диметил- бензамида (соединение N 6 в табл.2).
Стадия 1. Получение 2,3,5,6-тетрафтор-4-(2', 2'-диметилпропионамидо)бензо- ата.
Метил-2,3,5,6-тетрафтор-4-аминобензоат (1,887 г) в сухом ТГФ (5 мл) прибавляют к суспензии гидрида натрия (0,764 г 55% дисперсии в масле) в сухом ТГФ (70 мл), перемешивая при комнатной температуре. После окончания выделения газа по каплям, при охлаждении, медленно прибавляют 2,2-диметилпропионилхлорид (1,127 г) в сухом ТГФ (5 мл). Смесь перемешивают 1 ч при 10оС и выливают в воду, затем экстрагируют этилацетатом. Этилацетатную фракцию промывают разбавленной HCl и разбавленным водным раствором бикарбоната натрия, сушат, выпаривают и получают белый твердый продукт (2,44 г).
ЯМР (CDCl3, 270 МГц) δ: 1,36 (9Н, с), 3,97 (3Н, с), 7,05 (1Н, с).
Стадия 2. Получение 2,3,5,6-тетрафтор-4-(2', 2'-диметилпропионамидо)бензойной кислоты.
Метил-2,3,5,6-тетрафтор-4-(2', 2'-диметил- пропионамидо)бензоат (1,83 г) перемешивают ночь с гидроксидом калия (0,669 г, растворен в минимальном количестве воды) в диметоксиэтане (ДМЭ) (60 мл) и затем выливают в воду. Смесь экстрагируют этилацетатом. Водную фазу подкисляют и экстрагируют этилацетатом, этилацетатный экстракт сушат, выпаривают и получают кислоту в виде бледно-желтого твердого продукта (1,538 г).
ЯМР (CDCl3, 270 МГц) δ: 1,19 (9Н, с), 9,65 (1Н, с).
Стадия 3. Получение 2,3,5,6-тетрафтор-4-(2',2'-диметилпропионамидо)-N, N-диметил- бензамида.
Оксалилхлорид (1,00 г) в сухом эфире (5 мл) по каплям при перемешивании прибавляют к 2,3,5,6-тетрафтор-4-(2',2'-диметилпропионамидо)бензойной кислоте (1,47 г) в сухом эфире (35 мл) и добавляют каплю ДМФ. После перемешивания в течение 2 ч при комнатной температуре эфирный раствор декантируют до нерастворимых соединений, выпаривают и получают хлорангидрид в виде масла (1,494 г), которое используют без дальнейшей очистки.
Хлорангидрид (1,494 г) в сухом ТГФ (10 мл) медленно по каплям в течение 30 мин прибавляют к диметиламину (1,363 г) в ТГФ (10 мл) при 0-5оС. После перемешивания 1,5 ч при 10оС реакционную смесь выливают в воду и экстрагируют этилацетатом. Экстракт промывают водным раствором бикарбоната натрия, затем разбавленной НСl, сушат, выпаривают и получают белый порошкообразный твердый продукт (1,279 г), т.пл. 187-189оС.
ЯМР (CDCl3, 270 МГц) δ: 1,35 (9Н, с), 2,97 (3Н, с), 3,17 (3Н, с), 7,82 (1Н, с).
П р и м е р 7. В этом примере иллюстрируется получение 2-хлор- 4-(2'-фтор-2'-метилпропионамидо)-N,N-диметилбензамидa (соединение N 38 в табл.1).
Тетрафторборат серебра (0,60 г) в ацетонитриле (5 мл) прибавляют к 2-хлор-4-(2'-бром-2'-метилпропионамидо)-N, N-диметил- бензамиду (1,065 г) в ацетонитриле (150 мл) и реакционную смесь перемешивают в атмосфере азота, защищая от света, 6,5 ч. Прибавляют этилацетат, раствор фильтруют через цеолит и выпаривают. Остаток растворяют в этилацетате, фильтруют через цеолит и выпаривают. Остаток очищают ЖХВД (элюент метиленхлорид ацетонитрил 2:1) и получают белый кристаллический твердый продукт (0,319 г), т.пл. 125-128оС.
ЯМР (CDCl3, 270 МГц) δ: 1,67 (6Н, д), 2,87 (3Н, с), 3,13 (3Н, с), 7,27 (1Н, д), 7,45 (1Н, дд), 7,80 (1Н, д), 8,18 (1Н, д).
П р и м е р 8. В этом примере иллюстрируется получение 2-хлор-4-(3'-фтор-2', 2'-диметилпропионамидо)-N. N-диметилбенза- мидо (соединение 42 в табл. 1).
Стадия 1. Получение 2-хлор-4-(3'-ацетокси-2',2'-диметилпропионамидо)-N, N-ди- метилбензамида.
3-Ацетокси-2,2-диметилпропионилхло- рид (7,84 г) прибавляют к перемешиваемому раствору 4-амино-2-хлор-N, N-диметилбензамиду (5,88 г) и триэтиламину (5,99 г) в сухом метиленхлориде (15 мл) при 0-5оС. После перемешивания в течение 30 мин реакционную смесь промывают разбавленным водным раствором бикарбоната натрия разбавленным гидроксимидом натрия, разбавленной HCl, а затем водой. Органический слой сушат, выпаривают и получают оранжевое твердое соединение, которое растирают с гексаном и получают целевой продукт (9,08 г), т.пл, 117-120oС.
ЯМР (CDCl3, 270 МГц ) δ: 1,35 (6Н, с), 2,10 (3Н, с), 2,86 (3Н, с), 3,13 (3Н, с), 4,20 (2Н, с), 7,11 (1Н, д), 7,29 (1Н, дд), 7,60 (1Н, д), 8,21 (1Н, с),
ИК (Нуйол, паста), 1740, 1680, 1630 см-1.
Стадия 2. Получение 2-хлор-4-(3'-гидрокси-2',2'-диметилпропионамидо)-N, N-диметил- бензамида.
2-Хлор-4-(3'-ацетокси-2', 2'-диметилпро- пионамидо)-N,N-диметилбензамид (8,14 г) перемешивают 2 ч при комнатной температуре в метаноле (100 мл), содержащем гидроксид калия (2,68 г). Метанол выпаривают и остаток экстрагируют этилацетатом. Этилацетат сушат, выпаривают и получают целевой продукт (5,03 г), т.пл. 137-139оС.
ЯМР (CDCl3, 270 МГц) δ: 1,17 (6Н, с), 2,89 (3Н, с), 3,15 (3Н, с), 3,56 (3Н, д), 5,12 (1Н, т), 7,17 (1Н, д), 7,30 (1Н, дд), 7,69 (1Н, д), 9,49 (1Н, с),
Стадия 3. Получение 2-хлор-4-(3'-фтор-2',2'-диметилпропионамидо)-N,N-диметил- бензамида.
2-Хлор-4-(3'-гидрокси-2', 2'-диметилпро- пионамидо)-N,N-диметилбензамид (1,008 г) в сухом метиленхлориде (40 мл) по каплям в течение 3 ч прибавляют к раствору трифторида диэтиламиносеры (ДАСТ) (0,68 г) в сухом метиленхлориде (20 мл) при (-70)оС. Через 0,5 ч прибавляют дополнительно ДАСТ (0,128 г), раствор перемешивают 0,5 ч при (-70)оС и затем оставляют на ночь разогреваться до комнатной температуры. Реакционную смесь промывают водой, сушат, выпаривают и получают пену. Ее растирают с гексаном и получают бледно-оранжевый порошкообразный продукт (0,269 г), т.пл. 152-154оС.
ЯМР (CDCl3, 270 МГц) δ: 1,32 (6Н, д), 2,86 (3Н, с), 3,12 (3Н, с), 4,48 (2Н, д), 7,23 (1Н, д), 7,39 (1Н, дд), 7,75 (1Н, д), 7,77 (1Н, с).
П р и м е р 9. В этом примере иллюстрируется получение 2-хлор-4-(3'-метокси-2', 2'-диметилпропионамидо)-N, N-диметил- бензамида (соединение 40 в табл.1).
Оксид (2,608 г) и гидроксид (0,540 г) бария прибавляют к раствору 2-хлор-4-(3'-гидрокси-2',2'-диметилпропионамидо)-N,N-ди- метилбензамида (0,510 г) в ДМФ (20 мл) при 0оС. После перемешивания 15 мин при 0оС по каплям прибавляют метилиодид (3,64 г). После разогрева до комнатной температуры в течение 2 ч к реакционной смеси прибавляют метиленхлорид и смесь фильтруют через цеолит. Органическую фракцию сушат, выпаривают и получают подвижную жидкость, которую очищают ЖХВД (элюент:этилацетат) и получают твердый целевой продукт (0,101 г), т.пл. 101-103оС.
ЯМР (ClCl3, 270 МГц) δ: 1,24 (6H, с), 2,86 (3Н, с), 3,12 (3Н, с), 3,43 (2Н, с), 3,51 (3Н, с), 7,21 (1Н, д), 7,39 (1Н, дд), 7,75 (1Н, д), 9,05 (1Н, с).
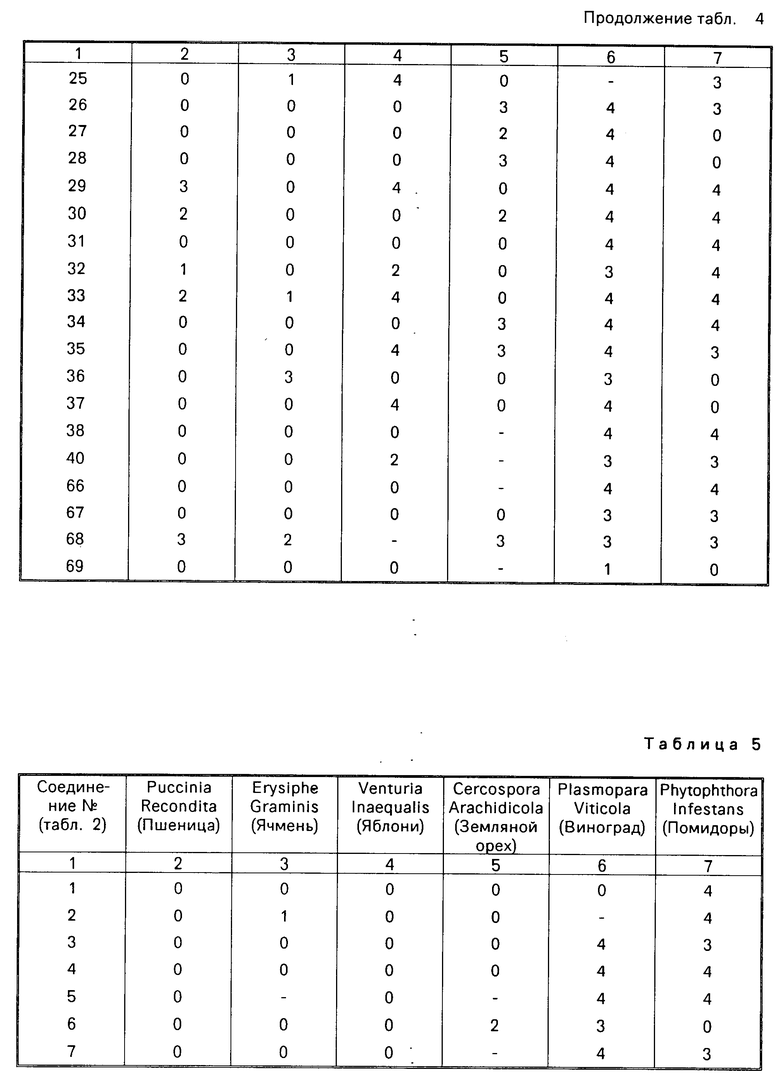
П р и м е р 10. В этом примере иллюстрируется получение 2-хлор-4-(2', 2'-диметилтиопропионамидо)-N, N-диметилтио- бензамида и 2-хлор-4-(2',2'-диметилпропионамидо)-N,N,-диметилтиобензамида (соединения соответственно 3 и 1 по табл.3).
2-Хлор-4-(2', 2'-диметилпропионамидо)- N,N-диметилбензамид (1,00 г) суспендируют в сухом толуоле (11 мл) и небольшими порциями прибавляют реагент Лавессона (0,73 г) в течение 5 мин при комнатной температуре. Суспензию кипятят с обратным холодильником 1 ч, получая прозрачный раствор, толуол выпаривают и получают вязкую смолу, которую хроматографируют на силикагеле (элюент:метиленхлорид) и получают два продукта:
1. 2-Хлор-4-(2',2'-диметилтиопропионамидо)-N,N-диметилтиобензамид (0,104 г), т.пл. 154-156оС.
ЯМР (CDCl3, 270 МГц) δ: 1,47 (9Н, с), 3,14 (3Н, с), 3,60 (3Н, с), 7,29 (1Н, д), 7,52 (1Н, дд), 7,82 (1Н, с), 8,85 (1Н, шс).
2. 2-Хлор-4-(2', 2'-диметилпропионами- до)-N,N-диметилтиобензамид (475 г), т.пл. 164-167оС.
ЯМР (ClCl3, 270 МГц) δ: 1,31 (9Н, с), 3,11 (3Н, с), 3,58 (3Н, с), 7,25 (1Н, д), 7,53 (1Н, дд), 7,38 (1Н, шс), 7,74 (1Н, с).
П р и м е р 11. В этом примере иллюстрируется получение 2-хлор-4-(2', 2'-диметилтиопропионамидо)-N,N-диметилбензамида (соединение 2 в табл.3).
Стадия 1. Получение 3-хлор-4-N,N-диметилкарбамоилфенилизотиоцианата.
Тиофосген (1,15 г) по каплям в течение 3 мин прибавляют к бикарбонату натрия (1,68 г), суспендированному и перемешиваемому в воде при комнатной температуре. Затем порциями, в течение 2 мин прибавляют 4-амино-2-хлор-N, N-диметилбензамид (1,00 г), поддерживая температуру 20-25оС. Еще через 15 мин коричневую суспензию экстрагируют метиленхлоридом, органический слой сушат, выпаривают и получают оранжево-желтый твердый целевой продукт (11,18 г), который используют без дополнительной очистки.
ЯМР (CDCl3, 270 МГц) δ: 2,86 (3Н, с), 3,13 (3Н, с), 7,17 (1Н, дд) 7,26 (1Н, с), 7,28 (1Н, д).
ИК (Нуйол, паста): 2140-2080 (шс), 1630 см-1.
Стадия 2. Получение 2-хлор-4-(2',2'-диметилтиопропионамид)-N,N-диметилбенза- мида.
Трет-бутиллитий (3,2 мл 1,7 М раствора в пентане) в течение 20 мин прибавляют к перемешиваемому раствору 3-хлор-4-N,N-диметилкарбамоилфенилизотиоциана- та (1,17 г) в ТГФ в атмосфере азота при (-70)оС. После перемешивания в течение 20 мин осторожно прибавляют воду, а затем концентрированную HCl. Смесь экстрагируют метиленхлоридом, сушат, выпаривают и получают липкий коричневый твердый продукт (1,23 г). Его очищают ЖХВД (элюент:этилацетат) и получают желтую смолу (0,099 г). Растиранием со смесью эфир/толуол получают желтый твердый целевой продукт, т.пл. 120оС (с разложением).
ЯМР (CDCl3, 270 МГц) δ: 1,66 (9Н, с), 2,88 (3Н, с), 3,14 (3Н, с), 7,25 (1Н, д), 7,45 (1Н, дд), 7,64 (1Н, д), 8,82 (1Н, шс).
П р и м е р 12. В данном примере иллюстрируется получение 2-хлор-4-(2', 2'-диметилпент-4'-инамидо)-N,N-диметилбензами- да (соединение 66 в табл.1).
Стадия 1. Получение этил-2,2-диметилпент-4-иноата.
Литийдиизопропиламид (13,7 мл 1,5М раствора моно-ТГФ-комплекса в циклогексане) по каплям в течение 20 мин прибавляют к перемешиваемому раствору этилизобутирата (2,38 г) в сухом ТГФ (10 мл) в атмосфере азота, поддерживая температуру ниже (-60)оС. Через 1 ч пропаргилбромид (2,45 г) в сухом ТГФ (5 мл) по каплям прибавляют, поддерживая температуру ниже (-60)оС. Реакционную смесь оставляют разогреваться до комнатной температуры в течение 2 ч, затем выливают в воду и экстрагируют этилацетатом. Этилацетатную фракцию сушат, выпаривают и получают оранжево-коричневую жидкость, которую перегоняют (Кугельрох, 115оС/60 мм) и получают целевой продукт (1,39 г).
ЯМР (CDCl3, 270 МГц) δ: 1,19 (3Н, т), 1,21 (6Н, с), 1,93 (1Н, т), 2,38 (2Н, д), 4,08 (2Н, к).
Стадия 2. Получение 2,2-диметилпент-4-иноевой кислоты.
Этил-2,2-диметилпент-4-иноат (1,39 г) перемешивают 7,5 ч с гидроксидом калия (1,07 г) в метаноле (20 мл) при 40оС и затем выдерживают ночь. Смесь выливают в воду и промывают этилацетатом. Водный слой подкисляют и экстрагируют этилацетатом. Этот слой затем сушат, выпаривают и получают жидкую целевую кислоту (1,05 г).
ЯМР (CDCl3, 270 МГц) δ: 1,32 (6Н, с), 2,04 (1Н, т), 2,47 (2Н, д).
ИК (Жидкая пленка): 3300, 3000-2500, 1720 см-1.
Стадия 3. Получение 2-хлор-4-(2',2'-диметилпент-4-инамидо)-N,N-диметилбенза- мида.
2,2-Диметилпент-4-иноевую кислоту перемешивают в сухом эфире (15 мл) при комнатной температуре и при перемешивании по каплям прибавляют оксалилхлорид (1,53 г) в сухом эфире (5 мл). После завершения прибавления смесь перемешивают 0,5 ч.
Смесь декантируют, эфир выпаривают и получают хлорангидрид (0,417 г) в виде бледной жидкости, которую используют без дополнительной очистки.
В перемешиваемый метиленхлоридный раствор 4-амино-2-хлор-N,N-диметилбензамида (0,524 г) и триэтиламина (0,534 г) при 0-5oC прибавляют хлорангидрид 2,2-диметилпент-4-иноевой кислоты (0,417 г). После 1,5 ч перемешивания реакционную смесь промывают разбавленной HCl, водным раствором бикарбоната натрия и водой. Метиленхлоридный раствор сушат, выпаривают и получают пену, которую кристаллизуют и получают бледно-оранжевый твердый целевой продукт (0,606 г), т.пл. 154-155оС.
ЯМР (CDCl3, 270 МГц) δ: 1,40 (6H, с), 2,17 (1Н, т), 2,52 (2Н, д), 2,87 (3Н, с), 3,13 (3Н, с), 7,05 (1Н, д), 7,33 (1Н, дд), 7,64 (1Н, д).
Физико-химические свойства полученных соединений показаны в табл.1-3.
П р и м е р 13. Получение соединения N 73 из табл.2.
Получение 4-(2-фтор-2-метилпропанамида)-2,6-дифтор-N-метокси-N- метилбензамида (соединение 73 из табл.2).
Стадия 1. 2,4,6-трифторбензонитрил (80 г) растворяют в диметилсульфоксиде (200 мл) и к полученному раствору добавляют триметиламин (140 мл, высушен над молекулярными ситами) и дибензиламина (95 мл). Полученную смесь нагревают в течение 3 ч при 60оС, дают охладиться в течение 12 ч и затем нагревают до 100оС и выдерживают при этой температуре еще 32 ч.
После охлаждения в течение приблизительно 12 ч реакционную смесь выливают в холодную воду и охлаждают в течение 30 мин, при этом образовывается осадок. Смесь перемешивают 30 мин, а затем экстрагируют толуолом (450 мл). Отделяют органический и водный слой и водный слой, еще раз экстрагируют дважды толуолом (2 х 300 мл). Органические фазы объединяют, промывают водой (2 х 300 мл) и затем упаривают в вакууме. Получаемый твердый остаток сушат в вакуумном десикаторе, получают 4-(N,N-дибензил)амино-2,6-дифторбензонитрил в виде коричневого кристаллического продукта (157,7 г, вход 92,6%).
Спектр ПМР (CDCl3, δ м.д.): 4,67 (с, 4Н), 6,27 (д, 2Н), 7,15-7,40 (м, 10Н).
Стадия 2. К раствору 4-дибензиламино-2,6-дифторбензонитрила (1 г, 3 ммоль) при перемешивании добавляют водный раствор карбоната калия (0,2 г в 3 мл, 1,5 ммоль). Затем по каплям добавляют 30%-ный водный раствор перекиси водорода с такой скоростью, чтобы температура реакции была ниже 25оС. Через 30 мин добавляли дополнительное количество диметилсульфоксида (1 мл) и 30% -ного водного раствора перекиси водорода (0,5 мл), а реакционную смесь нагревают до 80оС и выдерживают при этой температуре 2,5 ч. Реакционную массу охлаждают, выливают ее в большое количество воды и экстрагируют три раза этилацетатом. Объединенные органические экстракты промывают дважды водой, сушат (сульфатом магния) и концентрируют в вакууме. Получают масло (1,05 г), которое кристаллизуют при растирании с диэтиловым эфиром. Полученный продукт перекристаллизовывают из смеси гексанэтилацетат, получают 4-дибензиламино-2,6-дифторбензамид (230 мг) в виде бесцветных кристаллов. Продукт имеет следующие характеристики:
Спектр ПМР (CDCl3, δ м.д.): 4,67 (с, H), 5,86 (уш.с. 1Н), 6,06 (уш.с. 1Н), 6,26 (д, 2Н), 7,15-7,40 (м, 10Н).
Стадия 3. В сосуд для гидрирования на 600 мл, снабженный змеевиком для охлаждения, загружают 5%-ный палладий на угле (9 г), а затем добавляют 4-(N, N-дибензил)-амино-2,6-дифторбензамид (60 г), метанол (360 г) и трифторуксусную кислоту (38 мл) (установлено, что при нагревании сосуд должен быть полностью свободен от паров метанола, чтобы исключить воспламенение катализатора). Сосуд закрывают, проверяют на герметичность с помощью азота, продувают водородом и поднимают давление водорода в сосуде до 20 бар. Начинают перемешивание и смесь нагревают до 50оС. Поглощение водорода начинается при 47оС. Обогрев отключают через 2,5 ч после начала поглощения водорода, перемешивание прекращают через 0,5 ч после отключения обогрева и смесь оставляют на ночь. После продувки и очистки азотом (3 раза) отключают подачу охлаждающей воды, смесь снова нагревают до 50оС при атмосферном давлении и выдерживали при этой температуре в течение 1 ч, чтобы продукт полностью перешел в раствор.
Катализатор отфильтровывают на фильтре HУF10 и промывают большим количеством метанола. Фильтрат упаривают при пониженном давлении досуха, получают 4-амино-2,6-дифтор-бензиламид в виде коричневого твердого продукта (30,14 г).
Спектр ПМР (ДМСО-d6, δ м.д.): 5,9 (уш.с, 2Н), 6,10 (д, 2Н), 7,36 (уш.с, 1Н), 7,57 (уш.с, 1Н).
Стадия 4. К водному раствору гидроксида калия (257 мл раствора, имеющего молярность между 4,55 М и 5,4 М) добавляют 4-амино-2,6-дифторбензамида (90 г) и полученную смесь перемешивают при 100-105оС в течение 3,5 ч и затем давали ей остыть (в течение ночи). Окончание реакции определяют с помощью тонкослойной хроматографии. Смесь отфильтровывали через фильтр НУF10, осадок промывают водой (2 х 25 мл). Фильтрат подкисляют концентрированной соляной кислотой и полученную смесь экстрагируют этилацетатом. Этилацетатные экстракты объединяют, сушат сульфатом магния и упаривают в вакууме. Получают 4-амино-2,6-дифторбензойную кислоту в виде темно-желтого твердого продукта (53,7 г).
Спектр ПМР (ДМСО-d6, δ м.д.): 6,14 (д, 2Н), 6,29 (уш.с. 2Н), 12,6 (уш.с, 1Н).
Стадия 5. Реакцию проводят в атмосфере азота.
Смесь оксалилхлорида (0,49 г) 11,11-диметилформамида (несколько капель) и 2-фтор-изо-масляной кислоты (0,48 г) в сухом дихлорметане (4 мл) перемешивают в течение 1,5 ч. Окончание реакции фиксируют по отсутствию образования пузырьков при добавлении к реакционной смеси следовых количеств 11,11-диметилформамида. Получаемый раствор добавляют к смеси 4-амино-2,6-дифторбензойной кислоты (0,67 г) и пиридина (1,33 мл) в сухом дихлорметане (10 мл при 0оС). Получаемую смесь выдерживают в течение ночи, разбавляют этилацетатом (100 мл), а затем промывают 2 н. раствором соляной кислоты (3 раза). Исходный раствор сушат безводным сульфатом магния и упаривают при пониженном давлении. Получают 2,6-дифтор-4-(2-фтор-2-метилпропанамидо)бензойную кислоту в виде кремового твердого продукта (0,807 г, 80%), который со временем становится розовым.
Спектр ПМР (ДМСО-d6, δ м.д,): 1,52 (д, 6Н), 7,56 (g, 2Н), 10,47 (д, 1Н), 13,59 (уш.с, 1Н).
Стадия 6. К суспензии 2,6-дифтор-4-(2-фтор-2-метилпропанамидо)бензойной кислоты (500 мг) в дихлорметане (10 мл) добавляют порциями оксалилхлорида (200 мкл) и N,N-диметилформамид (несколько капель). Получаемый прозрачный раствор желтого цвета перемешивают в течение 1 ч и затем добавляют порциями в течение 1 ч к охлажденной смеси гидрохлорида 0-метилгидроксиламина (240 мг), пиридина (1 мл) и дихлорметана (10 мл).
Получаемую смесь оставляют на ночь, после чего упаривают в вакууме. Остаток обрабатывают этилацетатом и 5%-ной соляной кислотой. Органический слой дополнительно промывают 5%-ной соляной кислотой, насыщенным водным раствором бикарбоната и затем сушат сульфатом магния. При упаривании в вакууме получают 4-(2-фтор-2-метилпропанамидо)-2,6-дифтор- N-метоксибензамид в виде бесцветного твердого продукта (390 мг, 70%), т.пл. 180,5-183,5оС.
Стадия 7. При перемешивании к смеси 4-(2-фтор-5-метилпропанамидо)-2,6-дифтор- N-метоксибензамид (380 мг), карбоната кальция (90 мг) и ацетона (10 мл) добавляют метилиодид (80 мкл). Через 2 ч добавляют еще одну порцию метилйодида (20 мкл).
Через 2 ч реакционную смесь выливают в воду и экстрагируют этилацетатом. Экстракты объединяют, промывают водой, сушат сульфатом магния и упаривают при пониженном давлении. Получают светло-желтую смолу (290 мг). Смолу хроматографировали на силикагеле, элюируя смесью гексан:этилацетат (2:1). Получают указанное соединение (т.пл. 101-104оС).
Соединения испытывают против набора лиственных грибковых заболеваний растений. Используют следующую методику.
Растения выращивают в компосте John Innes (N 1 или 2) в маленьких горшках диаметром 4 см. Испытуемые соединения используют либо как смесь с водным Dispersol Т, либо в виде раствора в ацетоне или смеси ацетон/этанол, который разбавляют по требуемой концентрации непосредственно перед использованием. При заболеваниях листьев рецептуры (100 ч/млн) активного ингредиента) наносят опрыскиванием на листву и на корни растений в почве. Опрыскивание делают с максимальным удерживанием и наносят на корни по результирующей концентрации, эквивалентной приблизительно 40 ч/млн активного ингредиента в сухой почве. При опрыскивании злаковых прибавляют Tween 20 до результирующей концентрации 0,05%
В большинстве испытаний соединения наносят на почву (корни) и на листву (опрыскиванием) на 1-2 дня до заражения растения носителем заболевания. Исключение составляет испытание на Erysiphe graminis, где растения заражали за 24 ч до обработки. Лиственные патогенные организмы наносят разбрызгиванием споровых суспензий на листья испытуемых растений. После заражения растения помещают в соответствующую среду для развития инфекции и затем инкубировали до тех пор, пока заболевание будет готово для оценки. Период между заражением и оценкой варьируют 4-14 дней в зависимости от среды и заболевания.
Подавление заболевания оценивают по следующей шкале:
4 отсутствие заболевания;
3 следы 5% заболевания от необработанных растений;
2 6-25% заболевания от необработанных растений;
1 26-59% заболевания от необработанных растений;
0 60-100% заболевания от необработанных растений;
Результаты представлены в табл. 4, 5 и 6.
Данные сравнительного анализа с диэтофенкарбом.
Промышленный фунгицид диэтофенкарб показывает следующую активность при испытании его по методике, описанной в примере 19.
Как видно из данных таблицы, не отмечено никакой активности в отношении возбудителей болезней при концентрации 100 ч/мин (активный компонент).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ АЦИЛАМИНОБЕНЗАМИДОВ | 1991 |
|
RU2032662C1 |
| ПРОИЗВОДНЫЕ ПРОПЕНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 1989 |
|
RU2024496C1 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНА | 1992 |
|
RU2043990C1 |
| 1,3-ДИИОКСАНОНОВЫЕ ПРОИЗВОДНЫЕ АЛКЕНОВОЙ КИСЛОТЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ | 1989 |
|
RU2040525C1 |
| АМИДЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ СВОЙСТВАМИ ОТКРЫВАТЕЛЯ КАНАЛОВ ДЛЯ КЛЕТОЧНОГО КАЛИЯ | 1992 |
|
RU2074173C1 |
| ПРОИЗВОДНЫЕ АКРИЛОВОЙ КИСЛОТЫ И ИХ СТЕРЕОИЗОМЕРЫ, ОБЛАДАЮЩИЕ ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2037487C1 |
| ПРОИЗВОДНЫЕ 1,3-ДИОКСАНАЛКЕНОВОЙ КИСЛОТЫ | 1989 |
|
RU2045526C1 |
| СОЛЬ ХИНОЛИНА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1991 |
|
RU2045527C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПРОПЕНОВОЙ КИСЛОТЫ И ИХ СТЕРЕОИЗОМЕРОВ | 1988 |
|
RU2014320C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИФЕНИЛКАРБОНИТРИЛОВ | 1991 |
|
RU2026285C1 |


Использование: в сельском хозяйстве. Сущность изобретения: продукт - замещенные ациламинобензамиды формулы 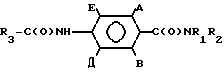 где А и В - H, F, Cl, Br, C1-C4 -алкил, C1-C4 -алкокси, гало (C1-C4) алкил при условии, что оба не являются Н; Д и Е - H, F; R1-H C1-C4 -алкил; R2-C1-C4 -алкил, C1-C4 -алкокси, C6H5 или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют морфолино-, пиперидино-, пирролидино- или ацетидиногруппу, возможно замещенную C1-C4 -алкилом; R3-Cl3C, C2-C8 -алкил, возможно замещенный галогеном, C1-C8 -алкоксилом и группой R7 R7-C1-C4 -алкил, n = 0, 1, 2, циклопропил, возможно замещенный галогеном или C1-C4 -алкилом, C2-C8 -алкенил, C2-C8 -алкинил, C1-C8 -алкоксигруппа, моно- или ди (C1-C4) алкиламиногруппа, R8ON= C(CN) R8-C1-C4 -алкил, или R3 вместе с C(O)N образуют азетидин-2-оновое кольцо, возможно замещенное галогеном или алкилом. Реагент 1: соединение формулы
где А и В - H, F, Cl, Br, C1-C4 -алкил, C1-C4 -алкокси, гало (C1-C4) алкил при условии, что оба не являются Н; Д и Е - H, F; R1-H C1-C4 -алкил; R2-C1-C4 -алкил, C1-C4 -алкокси, C6H5 или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют морфолино-, пиперидино-, пирролидино- или ацетидиногруппу, возможно замещенную C1-C4 -алкилом; R3-Cl3C, C2-C8 -алкил, возможно замещенный галогеном, C1-C8 -алкоксилом и группой R7 R7-C1-C4 -алкил, n = 0, 1, 2, циклопропил, возможно замещенный галогеном или C1-C4 -алкилом, C2-C8 -алкенил, C2-C8 -алкинил, C1-C8 -алкоксигруппа, моно- или ди (C1-C4) алкиламиногруппа, R8ON= C(CN) R8-C1-C4 -алкил, или R3 вместе с C(O)N образуют азетидин-2-оновое кольцо, возможно замещенное галогеном или алкилом. Реагент 1: соединение формулы  . Реагент 2: R4COCl . Условия реакции: в органическом растворителе в присутствии основания с последующим выделениям целевого продукта или обработкой 1, где R3-C2-C8 -алкил, замещенный галогеном, основанием в двухфазной системе в присутствии катализатора фазового переноса с выделением 1, где R3 вместе с C(O)N образуют азетидин-2-он. 2 с. и 6 з.п. ф-лы, 7 табл.
. Реагент 2: R4COCl . Условия реакции: в органическом растворителе в присутствии основания с последующим выделениям целевого продукта или обработкой 1, где R3-C2-C8 -алкил, замещенный галогеном, основанием в двухфазной системе в присутствии катализатора фазового переноса с выделением 1, где R3 вместе с C(O)N образуют азетидин-2-он. 2 с. и 6 з.п. ф-лы, 7 табл.

где А и В независимо водород, фтор, хлор, бром, С1-С4-алкил, С1-С4-алкокси- или гало(С1-С4)алкил при условии, что оба не являются одновременно водородом;
D и E независимо водород или фтор;
R1 водород или С1-С4-алкил;
R2 С1-С4-алкил, С1-С4-алкоксил или фенил либо R1 и R2 вместе с атомом азота, к которому они присоединены, образуют морфолиновое, пиперидиновое, пирролидиновое или азетидиновое кольцо, возможно замещенное С1-С4-алкилом;
R3 водород;
R4 трихлорметил, С2-С8-алкил (возможно замещенный галогеном, С1-С8-алкоксилом или группой общей формулы R12S(0)n, где R12 С1-С4-алкил,
n-0,1 или 2), циклопропил (возможно замещенный галогеном или С1-С4-алкилом), С2-С8-алкенил, С2-С8-алкинил, С1-С8-алкоксигруппа, моно- или ди-(С1-С4)-алкиламиногруппа или группа общей формулы R13ON-C(CN), где R13 C1-C4-алкил, или R3 и R4 вместе с группой С(О)N, к которой они присоединены, образуют азетидин-2-оновое кольцо общей формулы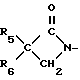
где R5 и R6 независимо водород, галоген или С1-С4-алкил,
обладающие фунгицидной активностью.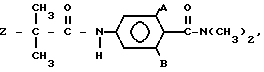
где каждый из A и B независимо хлор, бром или метил, либо B водород; Z фтор, хлор, бром, метил, этил или метоксигруппа.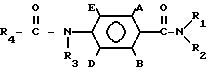
где А и В независимо водород, фтор, хлор, бром, С1-С4-алкил, С1-С4-алкокси- или гало(С1-С4) алкил при условии, что оба не являются водородом;
D и E независимо водород или фтор;
R1 водород или С1-С4-алкил;
R2 С1-С4-алкил, С1-С4-алкокси или фенил или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют морфолиновое, пиперидиновое, пирролидиновое или азетидиновое кольцо, возможно замещенное С1-С4-алкилом;
R3 водород;
R4 трихлорметил, С2-С8-алкил( возможно замещенный галогеном, С1-С8-алкоксилом, или группой общей формулы R12 S(O)n, где R12 С1-С4-алкил, а n= 0, 1 или 2), циклопропил (возможно замещенный галогеном или С1-С4-алкилом), С2-С8-алкенил, С2-С8-алкинил, С1-С8-алкоксигруппа, моно- или ди-(С1-С4)-алкиламиногруппа или группа общей формулы R13 ON C(CN), где R13 С1-С4-алкил, или R3 и R4 вместе с группой C(O)N, к которой они присоединены, образуют азетидин-2-оновое кольцо общей формулы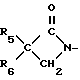
где R5 и R6 независимо водород, галоген или С1-С4-алкил,
обладающих фунгицидной активностью, отличающийся тем, что осуществляют взаимодействие соединения общей формулы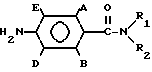
где A, B, D, E, R1 и R2 имеют указанные значения,
с хлорангидридом общей формулы
R4 COCI,
где R4 имеет указанные значения,
в органическом растворителе в присутствии основания с последующим выделением целевого продукта или обработкой полученного соединения I, где R4 С2-С8-алкил, замещенный хлором, бромом или иодом, основанием в двухфазной системе из органического растворителя и воды в присутствии катализатора фазового переноса с получением соединения I, где R3 вместе с группой С(О)N образуют азетидин-2-оновое кольцо, возможно замещенное галогеном или С1-С4-алкилом.
| Керамический экран для газового нагрева при облучении инфракрасными лучами | 1959 |
|
SU127990A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| "The Pesticide Manual", 1991, p.273. | |||
Авторы
Даты
1995-05-10—Публикация
1990-02-01—Подача