Изобретение касается нового cпоcоба приготовления производных 6 β-(3-замещенного аминопропионил)-7-диацетил- форсколина, представляющих большой интерес для фармакологии, и имеющих общую формулу I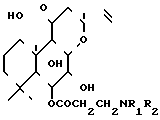 где R1 и R2 каждый означает С1-С6 алкил, R1 и R2 вместе с азотом, к которому они прикреплены, образуют пиперазиновое, пиперидиновое или морфолиновое кольцо, незамещенное или замещенное С1-С6 алкилом. Эти соединения представляют большой интерес, особенно это касается соединения NКН-477, производного 6-замещенного аминопропионилфорсколина, которое успешно используется в лечении сердечной недостаточности.
где R1 и R2 каждый означает С1-С6 алкил, R1 и R2 вместе с азотом, к которому они прикреплены, образуют пиперазиновое, пиперидиновое или морфолиновое кольцо, незамещенное или замещенное С1-С6 алкилом. Эти соединения представляют большой интерес, особенно это касается соединения NКН-477, производного 6-замещенного аминопропионилфорсколина, которое успешно используется в лечении сердечной недостаточности.
Термин алкил С1-С6 обозначает алкил с прямой или разветвленной цепью, например, как метил, этил, пропил, изопропил, n-бутил, третичный бутил или n-пентил.
Под солями, имеющими фармацевтический допуск, подразумеваются соли неорганических и органических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, сульфокислота, фосфорная кислота, муравьиная кислота, уксусная кислота, малеиновая кислота, лимонная кислота, винная кислота, молочная кислота, метансульфокислота.
Соединения общей формулы I являются водорастворимыми производными аминоацил форсколина, которые обладают сильнодействующими фармакологическими свойствами. Они были предметом различных заявок на патенты и публикаций: Евр. патент N 0222413 (1), N 0193132 (2), Германии N Р 3535086.5 (3), Германии N 3623300-5 (4), Германии N 3737353.6 (5). Молекулярная Фармакология 32,133 (1987) (6). Способы получения можно представить следующим образом: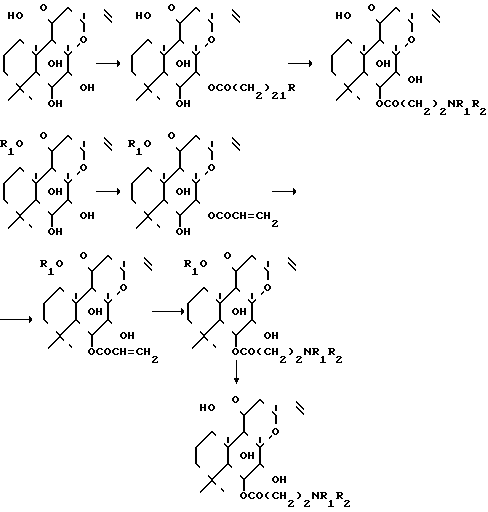
Как показывают последовательности, соединения, имеющие формулу I, приготавливаются следующим образом.
а) Непосредственно без использования блокирующей группы в положениях I-ОН или I-ОН/9-ОН, что приводит к образованию формулы I наряду с 1,6-диацилированным соединением. Разделение этих двух соединений процесс утомительный.
б) Блокированием I-ОН группы блокирующей группой такой как t-бутилдиметилсилил или метоксиэтоксиметил и удалением блокирующей группы на подходящей стадии процесса (1,2).
в) Блокированием I-ОН группы вместе с группой 9-ОН следующими группами: карбонил (С= 0), тиокарбонил (С=S), и удалением 1,9-блокирующей группы на подходящей стадии процесса (1).
Все указанные способы получения имеют следующие недостатки:
Способы, в которых за непосредственным ацилированием 7-ОН группы, следует пеpегруппировка к положению 6. Процесс происходит в 2-3 стадии с использованием безводного амина.
В способах, в которых упомянуто блокирование I-ОН или 9-ОН групп, количество этапов процесса увеличивается, т.е. сначала исходное блокирование, а затем на последующем этапе происходит разблокировка I-ОН и 9-ОН групп.
В изобретении неожиданным образом было обнаружено, что соединения, имеющие формулу I, можно приготовить в одном реакторе из 7-диацетилфорсколина, представленного формулой II,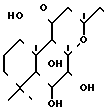 II путем последовательной обработки соединения II (I эквивалент) 3-галопропионил галоидным соединением (1,1-3,0 эквивалент) в присутствии органического основания, такого как, например, пиридин, диизопропилэтиламин или предпочтительнее триэтиламин (4-50 эквивалент), в беспротонном растворителе, таком как хлороформ, дихлорметан, толуол, или ксилол, предпочтительнее толуол, при температуре около 0-120оС; затем, концентрируя реакционную смесь в условиях вакуума досуха; добавлением смешиваемого с водой растворителя, например, тетрагидрофурана, диоксана или предпочтительнее ацетонитрила и воды, и водного основания, например КОН, водного NaОН (1-5 эквивалент); затем добавлением соответствующего амина или водного раствора амина, превышающего 1 эквивалент, например водный раствор диметиламина, пиперидина, морфолина или N-метилпиперазина, что приводит к желаемым производным 6 β-(3-замещенный аминопропионил)-7-диацетилфорсколина. Эти производные можно превратить в фармацевтически приемлемые соли.
II путем последовательной обработки соединения II (I эквивалент) 3-галопропионил галоидным соединением (1,1-3,0 эквивалент) в присутствии органического основания, такого как, например, пиридин, диизопропилэтиламин или предпочтительнее триэтиламин (4-50 эквивалент), в беспротонном растворителе, таком как хлороформ, дихлорметан, толуол, или ксилол, предпочтительнее толуол, при температуре около 0-120оС; затем, концентрируя реакционную смесь в условиях вакуума досуха; добавлением смешиваемого с водой растворителя, например, тетрагидрофурана, диоксана или предпочтительнее ацетонитрила и воды, и водного основания, например КОН, водного NaОН (1-5 эквивалент); затем добавлением соответствующего амина или водного раствора амина, превышающего 1 эквивалент, например водный раствор диметиламина, пиперидина, морфолина или N-метилпиперазина, что приводит к желаемым производным 6 β-(3-замещенный аминопропионил)-7-диацетилфорсколина. Эти производные можно превратить в фармацевтически приемлемые соли.
Новизна указанного способа получения производных 6 β-(3-замещенного аминопропионил)-7-диацетил-форсколина состоит в том, что для блокирования гидроксильной группы не требуется ступенчатой реакции; однозаливной процесс реакции, что дает простоту и экономичность; использование таких простых и технически приемлемых реагентов, например, водного диметиламина.
Не ожидается практической реализации ступени 1 и 2.
Указанные условия разработаны для осуществления процесса с хорошим выходом конечного продукта, с низкими затратами и с минимальной опасностью.
Более конкретно, настоящее изобретение описывает способ получения 6 β-(3-диметиламинопропионил)-7-диацетилфорско- лина, который включает обработку 3-хлоропропионилхлорида (1,1-3,0 эквивалент)-7-диацетилфорсколином (I эквивалент), имеющим формулу II в присутствии органического основания (триэтиламин) (4-50 эквивалент) в беспротонном растворителе (толуол) при температуре около 0оС в начале реакции и до температуры окружающей среды в конце реакции, которая протекает в течение около 1,5-3 ч, предпочтительнее 1,5 ч или диапазон температуры от 0 до 120оС на протяжении реакции, с последующей концентрацией реакционной смеси в вакууме досуха, затем добавление к остатку водного ацетонитрила, предпочтительнее в соотношении ацетонитрила к воде (8:7) и водного гидроксида натрия I н. концентрации, перемешивание при температуре окружающей среды в течение около 24 ч 80 ч (предпочтительнее 72 ч) и в конце добавление соответствующего амина (безводного или водного раствора) к реакционной смеси, продолжая перемешивание в течение еще 2-4 ч до получения целевого продукта.
Следующие примеры даны только для иллюстрирования того, как процесс осуществляется без ограничения других соединений в данном изобретении, которые также можно приготовить.
П р и м е р 1. 6 β-(3-Диметиламинопропионил)-7-диацетилфорсколин (1): 3-хлоропропионилхлорид (1 мл) добавляли к смеси 7-диацетилфорсколина (2,0 г), толуола (100 мл) и сухого триэтиламина (4 мл) при 0оС. Реакционная смесь перемешивалась при температуре окружающей среды до 120оС в течение 1,5 ч и концентрировалась в условиях вакуума.
Остаток растворяли в смеси ацетонитрила и воды (8:7, 150 мл) и добавляли 1 н. гидроксида натрия (17 мл) в указанный раствор. Реакционная смесь перемешивалась при температуре окружающей среды в течение 3 дней, затем добавляли диметиламин (30-40% 40 мл). Далее реакционная смесь перемешивалась в течение 2 ч при температуре окружающей среды и экстрагировалась этилацетатом. Органический слой промывали, высушивали в безводном сульфате натрия и концентрировали. Остаток очищали хроматографией, при этом выходил желаемый продукт. Его выход составлял около 1,4 г, точка плавления 140-142оС.
Аналогично для приготовления следующих соединений брали соответствующий амин.
6 β-(3-N-Метилпиперазинпропионил)-7-диацетилфорсколин, т.пл. 187-189оС.
6 β-(3-Пиперидинпропионил)-7-диацетил- форсколин, т.пл. 149-150оС.
6 β-(3-Морфолинпропионил)-7-диацетил- форсколин, т.пл. 188-190оС.
Данные протонного магнитного резонанса (PMR) для указанных примеров приведены ниже.
1. NR1R2 NMe2
PMR(CDCl3): δ 6,08 (d, dTцис 10,8 Гц, Tтранс 18 Гц, виниловый-Н), 5,9 (dd, T6,7 4,5 Гц, T5,6 3 Гц, 6-СН), 5,18 (dd, Tтранс 18 Гц, Tдет 2 Гц, виниловый-Н), 4,94 (dd, Tцис 10,8 Гц, Tдет 2 Гц, виниловый-Н), 4,56 (бит/c, I-СН), 4,19 (dT 4,5 Гц, 7-СН), 3,32 (d, Tдет 17 Гц, 12-СН), 2,7-2,12 (м, СОСН2, N-CН2, 12-СН), 2,3 (с, N-СН3), 1,6, 1,46, 1,42, 1,14, 1,0 (с, 5 Х СН3).
NR1R2 -N N-CH3
N-CH3
PMR(CDCl3); δ= 6,08 (dd, Tцис 10,8 Гц, Tтранс 18 Гц, виниловый-Н), 5,9 (dd, Т6,7 4,5 Гц, Т5,6 3 Гц, 6-СН), 5,14 (dd Tтранс 18 Гц, Тдет 2 Гц, виниловый-Н), 4,94 (dd Тцис10,8 Гц, Тдет 2 Гц, виниловый-Н), 4,58 бит/с, I-СН), 4,19 (d, Тдет 4,5 Гц, 7-СН), 3,2 (d, Тдет 17 Гц, 12-СН), 2,7-2,2 (м, -СОСН2, -NCН2 12-СН), 2,3 (е, N -СН3), 1,56, 1,42, 1,4, 1,1, 0,96 (с0 5 Х СН3).
NR1R2 -N
PMR(CDCl3): δ= 6,08 (dd, Тцис 10 Гц, Ттранс 17 Гц, виниловый-Н), 5,9 (dd, Т6,7 4,5 Гц, Т5,6 Гц, 6-СН), 5,14 (dd, Ттранс= 17 Гц, Тдет 2 Гц, виниловый-Н), 4,94 (dd, Тцис10 Гц, Тдет 2 Гц, виниловый-Н), 4,58 (бит/с I-СН), 4,18 (бит/с, коллапс до d при добавлении D2О I 4,5 Гц, 7-СН), 3,22 (d, Тдет 17 Гц, 12-СН), 2,8-2,08 (м, СОСН2, N-СН2, 12-СН), 1,6, 1,44, 1,4, 1,1, 0,96 (с, 5 Х СН3).
NR1R2 -N O
O
PMR(CDCl3): δ 6,08 (dd, Тцис 10 Гц, Ттранс 17 Гц, виниловый-Н), 5,9 (dd, Т6,7 4,5 Гц, Т5,6 3 Гц, 6-СН, 5,16 (dd, Ттранс 17 Гц, Тдет 2 Гц, виниловый-Н) 4,94 (dd, Тцис10 Гц, Тдет.= 2 Гц, виниловый-Н), 4,6 (бит/с, I-CН), 4,2 (dd Т6,7 4,5 Гц, Т7,ОН 6 Гц, коллапс до d, Т 4,5 Гц, 7СН), 3,7 (t, Т 5,4 Гц, О-СН2), 3,02 (d, Тдет. 17 Гц, 12-СН), 2,88-2,2 (м, СОСН2, N-СН2, 12-СН), 1,6, 1,42, 1,4, 1,1, 0,98 (с, 5 Х СН3).
Использование: в медицине в качестве средства против сердечной недостаточности. Сущность изобретения: продукт - производные 6-бета-(3-замещенного амино)-припионилокси-7-диацетилфосколина ф-лы 1, где R1 и R2 - C1-C6- алкил или вместе с атомом азота, с которым они связаны, образуют пиперазиновое, пиперидиновое или морфолиновое кольцо, незамещенное или замещенное C1-C6 -алкилом, или их фармацевтически допустимые соли. Реагент 1: 7-диацетилфосколина. Реагент 2: галогенид 3-галоидпропионила. Условия процесса: в присутствии органического основания с последующей обработкой полученного 6 бета-(3-галопропионилокси) производное амином HN(R1)(R2), где R1 и R2 имеют указанные значения, и в случае необходимости переводом их в фармацевтически приемлемые соли. Структура ф-лы I (см. чертеж) . 1 з.п. ф-лы.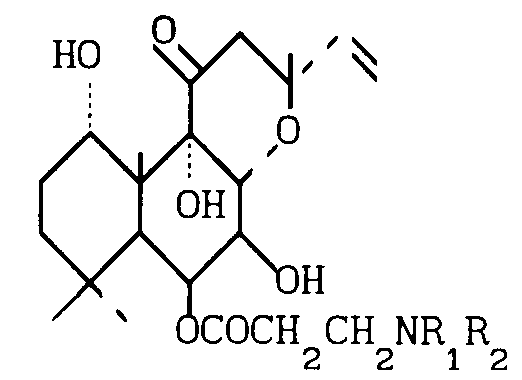
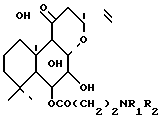
где R1 и R2 каждый C1 C6-алкил или R1 и R2 вместе с азотом, с которым они связаны, образуют пиперазиновое, пиперидиновое или морфолиновое кольцо, незамещенное или замещенное C1 - C6-алкилом,
или их фармацевтически приемлемых солей, отличающийся тем, что проводят взаимодействие 7-диацетил-форсколина формулы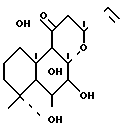
с галогенидом 3-галоидпропионила в присутствии органического основания с последующей обработкой полученного 6β -(3-галопропионилокси)-производного амином общей формулы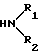
где R1 и R2 имеют указанные значения,
и в случае необходимости с переводом их в фармацевтически приемлемую соль.
| Молекулярная фармакология, 1987, с.133, 32. |
Авторы
Даты
1995-05-10—Публикация
1991-07-22—Подача