Изобретение касается борьбы с вирусами, в частности инактивации вирусов в крови и ее компонентах.
Известен способ инактивации вирусов, при котором вирусы в виде жидкости смешивают в колбе с фенотиазиновым красителем с последующим облучением светом (см. В. Снайпес и др. 1979 г. Photochem. и Photobiol. 29, стр. 785-790). При переносе известного способа на инактивацию вирусов в крови и компонентах крови было установлено, что при этом имела место инактивация не только вирусов, но и белков плазмы крови, как, например, факторов свертывания.
Цель изобретения разработать простой способ инактивации вирусов в крови и ее компонентах, при котором различного рода вирусы умерщвляются без существенного функционального влияния на белки плазмы крови.
Поставленная задача решается в способе инактивации вирусов в крови и ее компонентах путем смешения обрабатываемого раствора или суспензии фенотиазиновым красителем и последующего облучения светом за счет того, что фенотиазиновый краситель используют в концентрации 0,1-10 мкмоль, причем облучение осуществляют непосредственно в прозрачных емкостях, служащих для взятия и хранения крови. Облучение осуществляют дневным светом достаточной интенсивности или монохроматным светом, предпочтительно источника холодного света, имеющего длину волн в области максимума абсорбции соответствующего красителя. Кроме того, при инактивации вирусов в плазме крови или в растворах белков плазмы крови необходимо соблюдать следующие условия. Рабочая температура должна составлять 0--37оС, но по возможности 4-20оС. Процесс инактивации длится, в частности, от 5 мин до 5 ч, предпочтительно от 10 мин до 3 ч. Величина рН обрабатываемой среды должна составлять 5-9, предпочтительно 6-8.
Было установлено, что не имеющий оболочку вирус, как, например, аденовирус, который нельзя инактивировать в плазме в физиологических условиях, можно фотосенсибилизировать путем приемов замораживания и последующего оттаивания, после чего можно успешно проводить инактивацию. При этом инактивацию можно установить независимо от последовательности приемов замораживания и последующего оттаивания и добавления красителя. Под замораживанием понимается процесс глубокого замораживания разжиженными газами в качестве хладагента при температуре примерно от -20оС до 80оК. Как правило, замораживание осуществляют при температуре -30оС.
Инактивацию вирусов можно проводить непосредственно в мешках, предназначенных для хранения крови или плазмы крови, хотя эти мешки обладают лишь ограниченной светопропускаемостью. В таком случае предлагаемый способ сводится лишь к добавлению красителя с последующим облучением мешка вместе с его содержимым. Затем соответствующий продукт может далее обрабатываться.
Таким образом, предлагаемый способ можно осуществлять простыми техническими средствами и поэтому он может интегрироваться в технологический процесс обработки донорской крови в соответствующих хранилищах. Незначительное количество добавляемого красителя может оставаться в далее обрабатываемой жидкости. В случае необходимости его можно удалить при помощи адсорбера. Под понятием крови и ее компонентов понимаются: цельная кровь, концентраты эритроцитов, концентраты тромбоцитов, плазма крови, сыворотка, криоосадок, концентраты факторов свертывания, ингибиторы, фибронектин, альбумин.
В предлагаемом способе используют фенотиазины следующей структурной формулы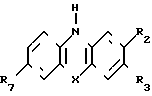
В табл. 1 приведены значения Х, R2, R3, R7.
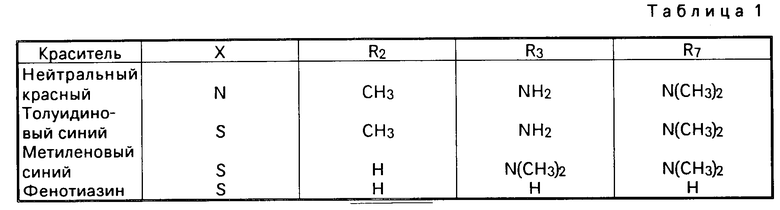
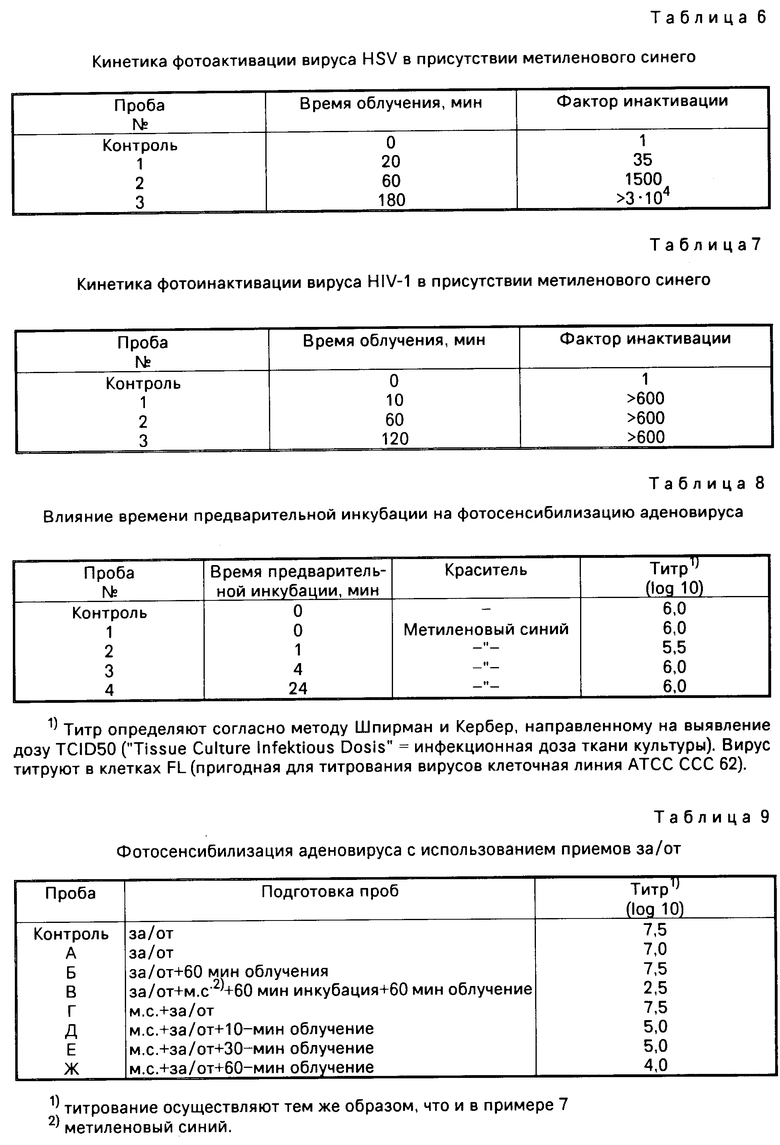
П р и м е р 1. Фотоинактивации подвергают везикулярно-стоматитный вирус в плазме крови человека в присутствии метиленового синего. При этом примерно 5˙107 пятнообразующих единиц на мл вируса суспендируют в плазме крови человека и смешивают с метиленовым синим, применяемым в различных концентрациях. Контрольные пробы не содержат красителя. Объем проб составляет 0,5 мл. Одну контрольную пробу и часть содержащих метиленовый синий проб облучают видимым светом при комнатной температуре в течение 4 ч. Остальные пробы хранят в течение того же периода времени. В качестве источника света служит диапроектор, оснащенный галогенной лампой мощностью 150 Вт. Расстояние между объективом диапроектора, т. е. отверстием выпуска света, и пробами во всех опытах составляет 30 см (за исключением случая инактивации вирусов в мешках для хранения крови). После облучения во всех пробах определяют титр вирусов с помощью анализа пятен. В качестве индикатора сушат клетки ВНК (АТСС N ССС10). Результаты опытов сведены в табл. 2.
Данные табл. 2 свидетельствуют о том, что, начиная с концентрации метиленового синего, равной 0,5 мкмоль, инфекционный титр вируса уменьшается более чем на 6 десятичных степеней.
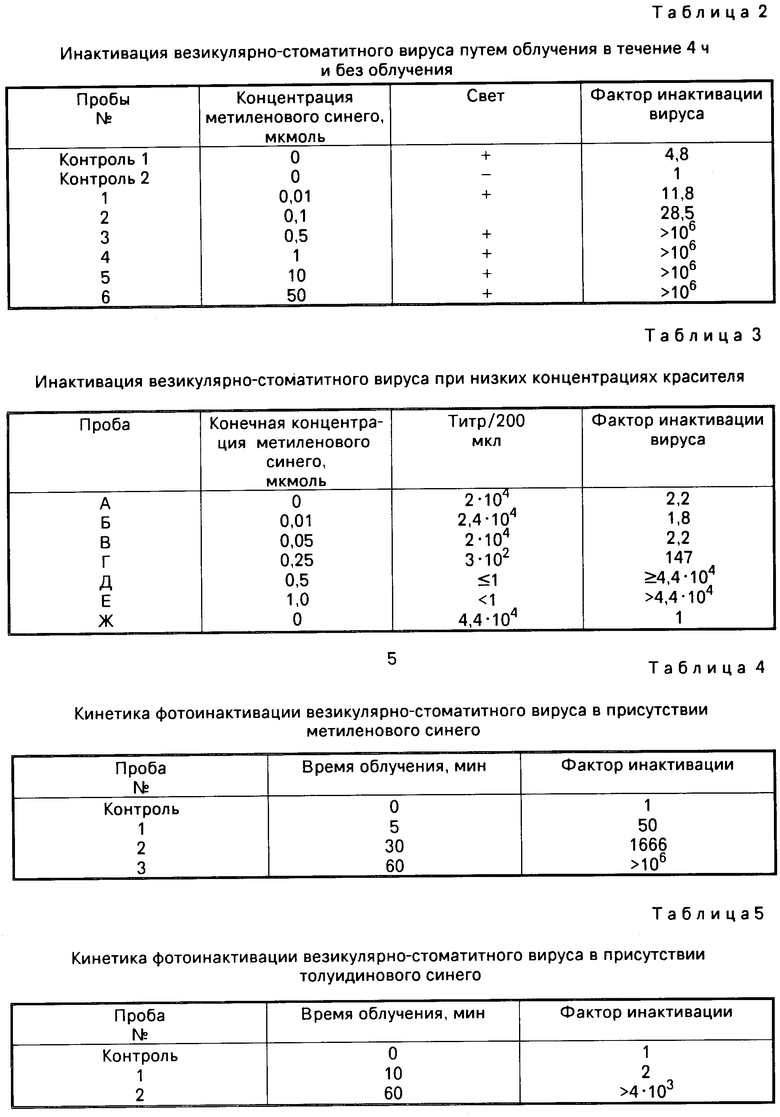
П р и м е р 2. Данный опыт подтверждает инактивацию вируса при низких концентрациях красителя.
Аликвоты плазмы крови объемом 500 мкл, содержащие везикулярно-стоматитный вирус и различное количество метиленового синего, подвергают облучению при помощи размещенного на расстоянии 30 см диапроектора в холодильной камере. Пробы А-Е облучают, а проба Ж остается необлученной.
Результаты опыта сведены в табл. 3. Они показывают, что в данных условиях указанный вирус инактивируется более чем на 4 десятичные степени. Для этого необходима концентрация метиленового синего, равная 0,5 мкмоль. Одна инкубация в течение ночи при 4оС вероятно приводит к уменьшению титра вируса на 1-2 десятичные степени, что может являться объяснением для относительно низкого исходного титра. Но это обстоятельство подробно не исследовалось.
Сравнение результатов инактивации облученной пробы А с пробой Ж (только хранение в темноте) показывает, что один свет очевидно не оказывает большого влияния на инфекционность вируса.
П р и м е р 3. Исследуется зависимость фотоинактивации вирусов в присутствии фенотиазиновых красителей от продолжительности облучения. При этом 106 пятнообразующих единиц на мл суспендируют в плазме крови и пробы облучают описанным в предыдущих примерах образом при 22оС в течение указанного в табл. 4 времени. По данным табл. 4 видно, что в данных условиях одночасовое облучение достаточно для уменьшения инфекционного титра везикулярно-стоматитного вируса более чем на 6 десятичные степени.
П р и м е р 4. Повторяют пример 3 с той разницей, что инактивацию проводят в присутствии 1 мкмоль толуидинового синего. Результаты опыта, сведенные в табл. 5, свидетельствуют о том, что везикулярно-стоматитный вирус может эффективно инактивироваться и в присутствии толуидинового синего.
В присутствии фенотиазиновых красителей можно также инактивировать вирус пузырькового лишая HSV, а также вирус спида HIV-1, о чем свидетельствуют результаты примеров 5 и 6.
П р и м е р 5. Инактивацию вируса НSV осуществляют в присутствии 1 мкмоль метиленового синего. В табл. 6 сведены данные по кинетике фотоинактивации вируса HSV.
П р и м е р 6. Инактивацию вируса HIV-1 проводят в присутствии 1 мкм метиленового синего. При этом титр вируса составляет 6˙102 пятнообразующих единиц/мл и в качестве индикатора применяют клетки МТ4 (инфицированная HTLV-1 Т-лимфобластоидная клеточная линия человека). Результаты опыта, сведенные в табл. 7, свидетельствуют о том, что вирус HIV-1, является очень чувствительным к фотоинактивации, так как уже в течение первых 10 мин титр вируса уменьшается более чем в 600 раз.
П р и м е р 7. Инактивация не имеющих оболочку вирусов в обычных физиологических условиях в присутствии 80% плазмы не увенчалась успехом. При этом в качестве примера вируса без оболочки применялся аденовирус, который предварительно инкубируют в течение указанного в табл. 8 времени при 4оС в темноте в присутствии 1 мкмоль метиленового синего. Затем осуществляют 30-минутное облучение при помощи галогеновой лампы освещенностью 150 000 люкс. При этом инфекционность аденовируса остается неизменной. Результаты опыта сведены в табл. 8.
При применении толуидинового синего в тех же экспериментальных условиях также не наблюдается уменьшения титра вируса.
Для достижения инактивации аденовируса в процесс включают приемы замораживания и оттаивания (далее: "за/от"), при этом замораживание осуществляют до -30оС. Последовательность приемов за/от и момент добавления красителя (1 мкмоль метиленового синего) играют лишь второстепенную роль. Облучение проб осуществляют при помощи галогенной лампы освещенностью 120 000 люкс. Результаты опыта сведены в табл. 9.
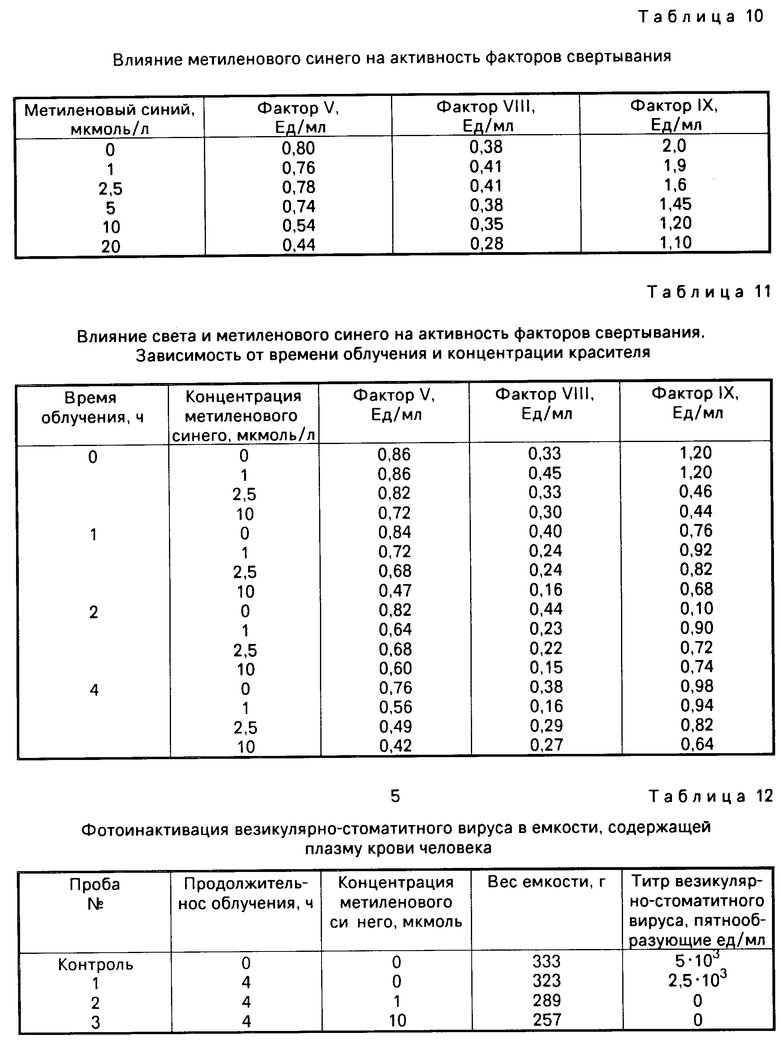
П р и м е р 8. Данный опыт направлен на исследование влияния красителя в различных концентрациях на активность факторов свертывания. При этом по 2 мл аликвоты плазмы крови человека смешивают с различными количествами метиленового синего. Непосредственно после добавления красителя измеряют активность факторов свертывания V, VIII и IX. Как видно по данным табл. 10, все факторы свертывания ингибируются в зависимости от концентрации красителя, т. е. ингибация факторов VIII и V начинается с концентрации примерно 10 мкм, а фактор IX уже ингибируется при наличии красителя в концентрации примерно 2,5 мкм. Таким образом, метиленовый синий в более высоких концентрациях влияет непосредственно на белки без воздействия света.
Результаты опыта сведены в табл. 10.
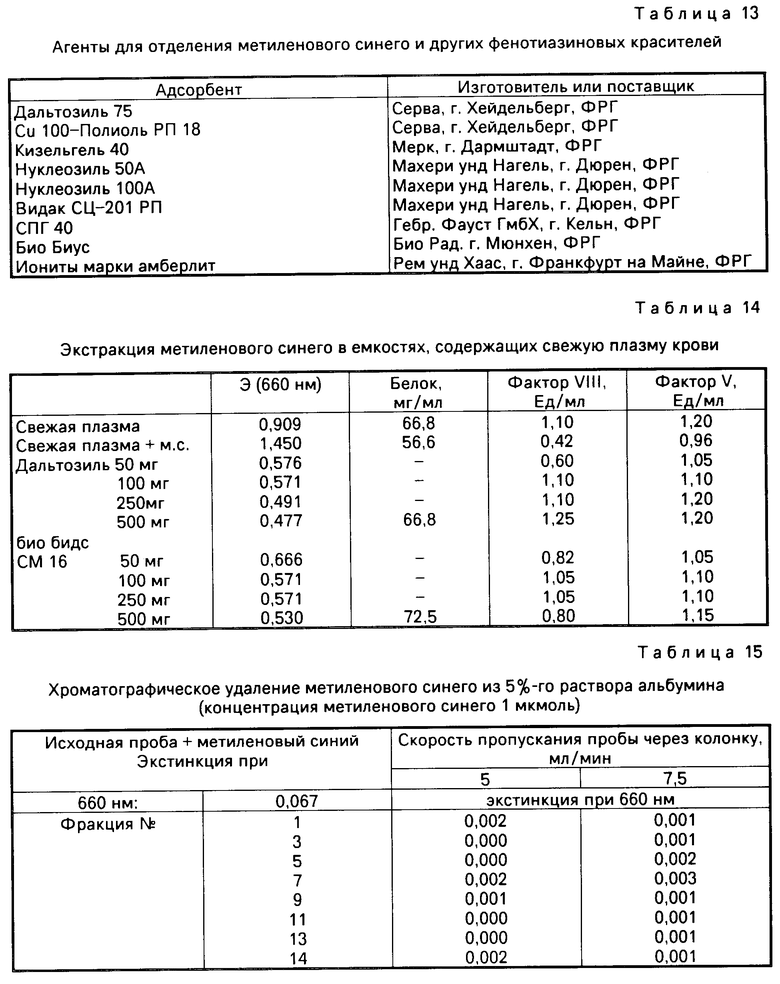
П р и м е р 9. На активность факторов свертывания влияет не только концентрация красителя, но и время облучения. Эта зависимость исследуется в данном примере. Для этого аликвоты (2 мл) плазмы крови человека смешивают с различными количествами метиленового синего и подвергают облучению описанным в примере 1 образом в течение 1-4 ч. Контрольные пробы не подвергают фотообработке. Данные табл. 11 показывают, что активность трех факторов свертывания V, VIII и IX ингибируется в зависимости от времени облучения и концентрации красителя. В частности данные по факторам свертывания VIII и IX свидетельствуют о том, что более высокая концентрация метиленового синего и облучение светом с продолжительностью от 2 ч приводит, очевидно, к усилению тромболитического эффекта.
П р и м е р 10. Согласно изобретению фотоинактивацию вирусов осуществляют непосредственно в прозрачных емкостях, служащих для взятия и хранения крови или ее компонентов, после предварительного добавления красителя в требуемом количестве. Таким простым путем можно в любой момент обрабатывать кровь и ее компоненты отдельных доноров.
В данном примере оттаивают три пробы свежей плазмы крови человека, к которым в своих емкостях добавляют 1,5˙106 пятнообразующих единицу везикулярно-стоматитного вируса. К двум пробам добавляют метиленовый синий в концентрации 1 и 10 мкмоль соответственно. Из не содержащей метиленовый синий плазмы берут пробу, которую в качестве положительного контроля хранят в темноте при 4оС. Затем все емкости зажимают между двумя плексигласными пластинками с тем, чтобы обеспечить равномерную толщину слоя примерно 2,5 см. Емкости облучают при помощи диапроектора, размещенного на расстоянии 90 см. Через 4 ч берут пробы, которые для определения титра вируса подают на клетки FL. Результаты опыта сведены в табл. 12.
Данные табл. 12 свидетельствуют о том, что уже концентрация 1 мкмоль метиленового синего достаточна для снижения инфекционного титра везикулярно-стоматитного вируса больше чем на три десятичные степени. Даже при отсутствии красителя облучение проводит к снижению титра вируса, однако только примерно на 50%
При концентрациях до 1 мкмоль применяемые для инактивации вирусов фенотиазиновые красители могут оставаться в крови или ее компонентах без каких-либо побочных действий. Но они могут также удаляться с помощью диализа, гель-фильтрации или адсорбции. Наибольший интерес представляет адсорбция, так как она связана с наименьшими затратами времени и технологии и кроме того соответствующие растворы белков не нуждаются в разбавлении. Было установлено, что метиленовый синий и другие фенотиазиновые красители связываются с различными, имеющимися в продаже разделительными гелями, в том числе и с такими гелями, которые не обладают способностью к связыванию белков или же обладают лишь слаборазвитой способностью к их связыванию. Таким образом, такие адсорбенты особенно пригодны для последующего удаления фотоокислителя. Из числа исследованных адсорбентов для отделения метиленового синего и других фенотиазиновых красителей можно с успехом применять агенты, приведенные в табл. 13.
В большинстве случаев для полной экстракции из раствора белков плазмы метиленового синего в концентрациях 10 мкмоль достаточно 2 г соответствующего адсорбента. Наиболее подходящими оказались два типа адсорбентов.
1. Силикагели с диаметром пор 40-100 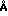 , которые не позволяют белкам плазмы проникать в матрицу. Но молекулы низкомолекулярных красителей надежно связываются в силу ионных, электростатических и гидрофобных взаимодействий. Примерами таких общедоступных адсорбентов являются Матрекс Силика Гель инофирмы Амикон, г. Виттен, ФРГ, дальтозиль инофирмы Серва, г. Хейдельберг, ФРГ, и кизельгель инофирмы Мерк, г. Дармштадт, ФРГ.
, которые не позволяют белкам плазмы проникать в матрицу. Но молекулы низкомолекулярных красителей надежно связываются в силу ионных, электростатических и гидрофобных взаимодействий. Примерами таких общедоступных адсорбентов являются Матрекс Силика Гель инофирмы Амикон, г. Виттен, ФРГ, дальтозиль инофирмы Серва, г. Хейдельберг, ФРГ, и кизельгель инофирмы Мерк, г. Дармштадт, ФРГ.
2. Гели на основе полистирола и дивинилбензола или полимеров сложных эфиров акриловой кислоты. Примерами имеющихся в продаже гелей этих типов являются амберлиты, выпускаемые, например, инофирмой Рем унд Хаас, г. Франкфурт на Майне, ФРГ, и био бидс инофирмы Био Рад, г. Мюнхен, ФРГ. Они в основном служат для удаления неполярных или поверхностно-активных веществ, например моющих агентов, из водных растворов. Они являются неполярными или же лишь слабополярными.
П р и м е р 11. Свежую плазму крови смешивают с 10 мкмоль метиленового синего (м. с. ). Аликвоты объемом 5 мл смешивают с различными количествами дальтозиль (диаметром пор 75 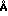 ) и био бидс СМ 16 (диаметром пор 144
) и био бидс СМ 16 (диаметром пор 144 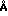 ) соответственно, после чего перемешивают в течение 30 мин. Затем гелю дают отстояться. В плазме крови определяют содержания фактора VIII и фактора V, экстинкцию при 660 нм, а также содержание белков у некоторых проб.
) соответственно, после чего перемешивают в течение 30 мин. Затем гелю дают отстояться. В плазме крови определяют содержания фактора VIII и фактора V, экстинкцию при 660 нм, а также содержание белков у некоторых проб.
Результаты опыта сведены в табл. 14.
По данным экстинкции видно, что наряду с красителем из плазмы очевидно экстрагируются еще другие вещества, которые, однако, не представляют собой белки плазмы. Данные по экстинкции плазмы, обработанной 100-250 мг адсорбента на 5 мл, т.е. 2-5 мас./ на объем, едва ли отличаются от тех данных экстинкции проб, которые экстрагировались 10 мас. адсорбента/ объем пробы. Следовательно, при концентрации метиленового синего 10 мкм достаточно применение адсорбента в количестве 2-5 мас./объем пробы с тем, чтобы в случае периодического осуществления процесса полностью удалять краситель из плазмы. При меньших концентрациях красителя требуется соответственно меньший расход адсорбента.
П р и м е р 12. В данном примере вместо плазмы крови применяют 5%-ный раствор альбумина сыворотки человека (далее: АСЧ). В данном опыте концентрация метиленового синего составляет 10 мкмоль. Аликвоты объемом 5 мл экстрагируют 100 мг (2 мас. объем) следующих адсорбентов: дальтозиль (диаметром пор 75 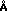 ), силикагель (диаметром пор 40
), силикагель (диаметром пор 40 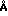 ) и био бидс СМ 16 (диаметром пор 144
) и био бидс СМ 16 (диаметром пор 144 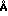 ).
).
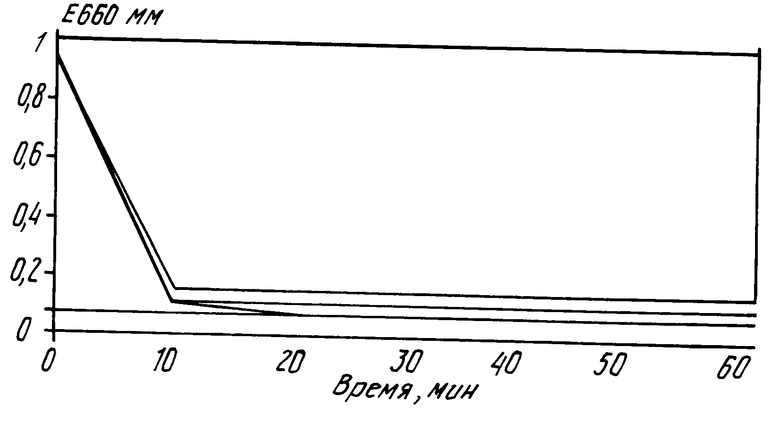
Результаты опыта показаны на чертеже. По нему видно, что во всех случаях экстинкция при 660 нм падает, т.е. указанное время достаточно для периодического удаления фотоокислителя из раствора протеина. По чертежу также видно, что в данном случае адсорбенты био бидс СМ 16 и силикагель с диаметром пор 40 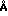 являются более эффективными, чем дальтозил с диаметром пор 75
являются более эффективными, чем дальтозил с диаметром пор 75  .
.
П р и м е р 13. В данном примере исследуют возможность адсорбционного удаления метиленового синего из раствора белков плазмы крови путем колоночной хроматографии. В основу такого метода положена идея о том, что после инактивации вирусов с помощью красителя и облучения раствор белков плазмы можно пропускать через колонку с адсорбентом и оттуда подавать в дальнейшую емкость, служащую для хранения обработанного раствора. При этом колонку можно размещать между обеими емкостями. Таким образом, возможно предварительное изготовление узла, состоящего из двух емкостей с размещенной между ними адсорбционной колонкой. Тем самым можно создать замкнутую систему, которая намного снижает риск заражения прошедшего инактивацию вируса препарата белков плазмы, в том числе и препаратов от отдельных доноров.
Данный опыт осуществляют следующим образом.
250 мл. 5%-го раствора альбумина пропускают с различной скоростью через колонку, содержащую 5 мл силикагеля с диаметром пор 40 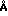 . Фракции объемом 10 мл собирают и подвергают экстинкции при 660 нм. По данным табл. 15 видно, что весь раствор альбумина можно пропускать со скоростью 5 и 7,5 мл/мин соответственно через колонку без того, чтобы в получаемых фракциях можно было бы доказать наличие остаточного метиленового синего. Следовательно, удаление красителя из раствора объемом 250 мл требует не более 30-35 мин.
. Фракции объемом 10 мл собирают и подвергают экстинкции при 660 нм. По данным табл. 15 видно, что весь раствор альбумина можно пропускать со скоростью 5 и 7,5 мл/мин соответственно через колонку без того, чтобы в получаемых фракциях можно было бы доказать наличие остаточного метиленового синего. Следовательно, удаление красителя из раствора объемом 250 мл требует не более 30-35 мин.
Результаты данного опыта показывают, что хроматографическое удаление фотоокислителя можно осуществлять безо всяких проблем. С другой стороны, доказана вышеупомянутая возможность получения содержащих инактивированные вирусы препаратов белков плазмы от отдельных доноров.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИНАКТИВИРОВАНИЯ ПАТОГЕНОВ В ДОНОРСКОЙ КРОВИ, ПЛАЗМЕ КРОВИ ИЛИ КОНЦЕНТРАТАХ ЭРИТРОЦИТОВ В ГИБКИХ КОНТЕЙНЕРАХ С ПОМОЩЬЮ ВСТРЯХИВАНИЯ | 2006 |
|
RU2466742C2 |
| УСТРОЙСТВО ДЛЯ ХРАНЕНИЯ И ПЕРЕРАБОТКА КРОВИ И ЕЕ ПРОДУКТОВ (ВАРИАНТЫ) | 1992 |
|
RU2127107C1 |
| СПОСОБ ФОТОИНАКТИВАЦИИ ВИРУСА ГРИППА А ПТИЦ ПОДТИПА H5N1 | 2007 |
|
RU2357770C1 |
| Способ патогенинактивации плазмы крови | 2021 |
|
RU2770646C1 |
| СПОСОБ ОБЛУЧЕНИЯ УЛЬТРАФИОЛЕТОВЫМ СВЕТОМ КОНЦЕНТРАТОВ ТРОМБОЦИТОВ В ГИБКИХ КОНТЕЙНЕРАХ | 2006 |
|
RU2441669C2 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ ИНАКТИВАЦИИ ЗАГРЯЗНЯЮЩИХ ПРИМЕСЕЙ В БИОЛОГИЧЕСКОЙ ЖИДКОСТИ | 1997 |
|
RU2219951C2 |
| Способ профилактического лечения коронавирусной инфекции | 2020 |
|
RU2777462C2 |
| СПОСОБ ИНАКТИВАЦИИ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА И ДРУГИХ ВИРУСОВ В ПЛАЗМЕ КРОВИ ЧЕЛОВЕКА С СОХРАНЕНИЕМ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ БЕЛКОВ ПЛАЗМЫ КРОВИ | 1998 |
|
RU2152994C2 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ИНАКТИВАЦИИ БАКТЕРИЙ | 2006 |
|
RU2316366C2 |
| ГЕТЕРОГЕННЫЙ СЕНСИБИЛИЗАТОР И СПОСОБ ФОТООБЕЗЗАРАЖИВАНИЯ ВОДЫ ОТ ВИРУСНОГО ЗАГРЯЗНЕНИЯ | 2011 |
|
RU2470051C1 |
Использование: вирусология, биотехнология. Сущность изобретения: проводят инактивацию вирусов в крови и ее компонентах путем смешения обрабатываемого раствора или суспензии с фенотиазиновым красителем и последующего облучения светом, при этом фенотиазиновый краситель используют в концентрации 0,1 - 10 мкмоль, причем облучение осуществляют непосредственно в прозрачных емкостях, служащих для взятия и хранения крови. 11 з.п. ф-лы, 1 ил., 15 табл.
| Wallance Snipes et al | |||
| Photochem and Photobiol., 1979, v.29, р.785-790. |
Авторы
Даты
1995-05-27—Публикация
1992-03-12—Подача