Изобретение относится к медицине, а именно, к трансфузиологии, и может быть использовано для получения патогенредуцированной донорской плазмы, которую возможно применять для клинического использования или дальнейшей переработки на препараты плазмы.
Известен способ инактивации патогенов в донорской крови, плазме крови или концентратах эритроцитов в гибких контейнерах с помощью встряхивания (Патент РФ №2466742, МПК A61L 2/10, публ. 2012). Способ включает: получение препаратов донорских порций крови, продуктов, полученных из нее или посредством машинного афереза, добавление подходящего фотоактивного вещества и фотодинамическая обработка облучением светом, содержащим или исключительно состоящим из длин волн в области поглощения фотоактивного вещества, и/или облучение ультрафиолетовым (УФ) излучением с длинами волн 200-320 нм. Препараты могут состоять из многих индивидуальных, раздельно хранящихся доз и находятся в гибких, проницаемых для соответствующего излучения плоских пакетах для облучения. Пакеты заполнены менее чем на 30% от максимальной емкости, и во время фотодинамической обработки и/или УФ-облучения их встряхивают так, что содержимое пакета для облучения перемешивается с образованием зон с переменной толщиной слоев, имеющих области с толщиной слоя менее 1 мм. При этом используемое УФ-излучение состоит или включает излучение УФ-В диапазона с длиной волны от менее чем 320 нм до 280 нм с энергией излучения в диапазоне от 0,3 до 10 Дж/см2 и/или УФ-С диапазона с длиной волны от менее чем 280 нм до 200 нм.
Недостатком этого способа является ограниченный объем обрабатываемого продукта, так как эффективность технологии инактивации патогенов обратно-пропорционально зависит от объема заполняемого пакета.
Известен способ уничтожения и/или инактивации патогенов в жидкости (Патент РФ №2696784, МПК A61L 2/04, публ. 2019). Способ включает в себя этапы: (а) введение жидкости в первый сосуд; (b) введение инертного газа в первый сосуд; (с) повышение давления в первом сосуде до первого давления, при котором инертный газ растворяется в жидкости, образуя смесь жидкость-инертный газ; (d) нагревание смеси жидкость-инертный газ после выхода из первого сосуда до температуры преднагрева; (е) распыление посредством форсунки смеси жидкость-инертный газ в виде капель во второй сосуд со вторым давлением и с заранее установленной и поддерживаемой в процессе распыления температурой обработки; и (f) охлаждение жидкости. Указанная форсунка имеет вход и выход, а первое давление на входе форсунки больше, чем второе давление на выходе из форсунки, температура преднагрева ниже, чем температура обработки, при этом температура преднагрева и температура обработки выбраны, исходя из условия их минимальной разницы и для обеспечения сохранения свойств жидкости.
Недостатком этого способа является применением нагрева донорской плазмы, что приводит к денатурации белков и значительному снижению факторов свертывания в получаемом продукте.
Наиболее близкой является технология инактивации патогенов, которая состоит из добавления витамина В2 (рибофлавина) в плазму крови, а также действие УФ-света широкого спектра (265-370 нм) (Чечеткин А.В. и др. Влияние инактивации патогенов на качество и показатели биологической полноценности компонентов донорской крови. Ж-л «Гематология» Том 16/2015 с. 784).
Недостатком этого способа является негативное воздействие УФО в широком спектре действия, в частности УФ-света, что негативно сказывается на белках плазмы, в частности снижения уровня фибриногена и VIII фактора свертывания, а также в ограниченном объеме обрабатываемой донорской плазмы, что не позволяет за одну процедуру обработать 750 мл донорской плазмы - максимально допустимый объем плазмы, заготавливаемый от одного донора или полученный в пуле (Приказ МЗ РФ №1166н от 28 октября 2020 г.).
Задачей предлагаемого изобретения является устранение указанных недостатков, повышение эффективности в инактивации различных инфекционных патогенов при сохранении полезных свойств донорского продукта (факторов свертывания) и увеличение объемов обрабатываемой донорской плазмы.
Для решения поставленной задачи, при патогенинактивации плазмы крови, включающей введение в плазму рибофлавина, с последующим проведением облучения, предложено в контейнер с плазмой крови в объеме 200-750 мл вводить 30-45 мл раствора рибофлавина в концентрации 800-1200 мкмоль/л в 0,9% физ. растворе. Затем вводить молекулярный кислород в количестве 5-30% от объема контейнера с плазмой, содержимое контейнера смешивают, после этого полученную смесь пропускать через проточную кювету слоем толщиной 1,5-2,5 мм с одновременным облучением монохроматическим синим светом длиной волны 450 нм при температуре 2-37°С до суммарной световой дозы 12 Дж/см2.
Предлагаемый способ инактивации патогенов позволяет значительно повысить скорость и объемы перерабатываемой плазмы, а также обеспечить достаточную инфекционную безопасность при лучшей сохранности термолабильных элементов донорского продукта.
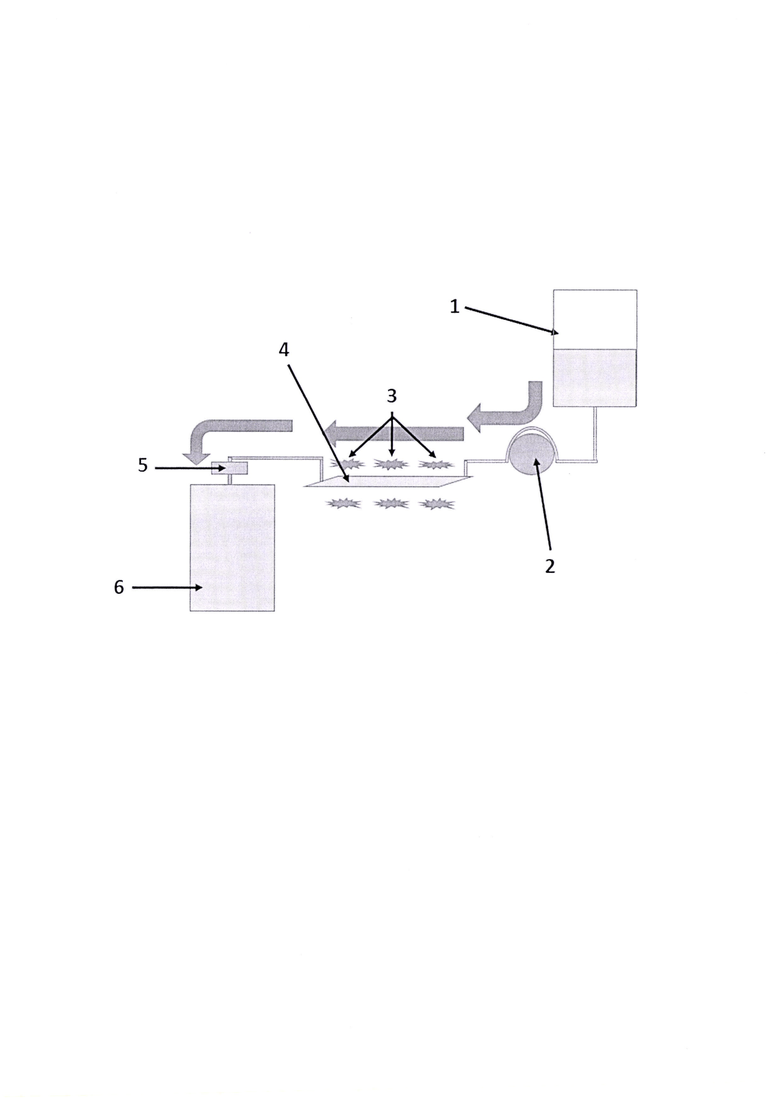
На чертеже представлена схема патогенинактивации, где 1 - донорская плазма с рибофлавином, 2 - роликовый насос, 3 - светодиоды, 4 - кювета, 5 - датчик утечки воздуха, 6 - конечный продукт с патогенинактивированной плазмой.
Способ осуществляется следующим образом.
Берется контейнер с донорской плазмой объемом 200-750 мл. Как правило, при заготовке донорской плазмы из одной единицы донорской крови, получается плазма объемом в 230-330 мл плазмы, при этом контейнер имеет максимальную вместимость в 400-500 мл. При заготовке плазмы методом автоматического афереза или плазмы пулированной, возможно получение донорской плазмы объемом до 750 мл в контейнере вместимостью до 1000 мл. При необходимости патогенинактивации донорской плазмы с различными объемами от 200 до 750 мл нужно добавить от 30 до 45 мл раствора рибофлавина в концентрации 800-1200 мкмоль/л в 0,9% физ. растворе для достижения конечной получаемой концентрации рибофлавина в плазме в диапазоне от 70 до 120 мкмоль/л. Добавление раствора рибофлавина производят через штуцер на донорском контейнере с соблюдением условий асептики через микробный фильтр, также через него вводят молекулярный кислород из баллона, заполняя на 5-30% от максимального объема донорского контейнера. Затем проводят перемешивание полученной смеси в контейнере.
Далее донорский контейнер с полученной смесью подключают к системе проточного облучения через второй штуцер на данном контейнере и подвешивают контейнер таким образом, чтобы штуцер входа располагался внизу, не растворившийся молекулярный кислород оказался в верхней точке контейнера. В проточной системе имеется кювета толщиной слоем в 1,5-2,5 мм, в которой проводится облучение смеси монохроматическим синим светом длиной волны 450 нм. Движение смеси в проточной системе производится при помощи роликового насоса с заданной скоростью для получения смесью дозы облучение до 12 Дж/см2 при температуре от +2 до +37°С и через систему трубок поступает в контейнер для переработанного продукта.
Вытеснение остатков плазмы из контура системы, осуществляется по известной методике посредством последующего заполнения/вытеснения молекулярным кислородом, который затем удаляется из конечного продукта. Контейнер с донорской плазмой извлекают из системы, отсоединяя через запаиватель для трубок и затем используют для последующей трансфузии, подвергают заморозке и хранению или применяют для производства препаратов плазмы.
Ниже приведены серия экспериментов использования представленного способа. Исследования в условиях in vitro для предлагаемого способа инактивации проводили на плазме крови человека, инфицированной различными вирусами и бактериями, для изучения степени уничтожения данных патогенов, а также на предмет редукции уровня VIII фактор свертывания и фибриногена.
Пример 1.
Донорскую плазму в объеме 200 мл, инфицированную Cytomegalovirus в титре 1,7log10, добавили 30 мл раствора рибофлавина в концентрации 800 мкмоль/л, затем ввели молекулярный кислород 13% от максимального объема пластикатного контейнера (до 300 мл). Получившуюся смесь перемешали. Затем проводили облучение монохроматическим синим светом с длиной волны 450 нм через проточную систему с кюветой толщиной до 2 мм для достижения суммарной дозы 12 Дж/см2 при температуре +7°С в течение 4 минут.
После облучения вирус не обнаруживался при этом уровень фибриногена снижался на 19%, а уровень VIII фактора - на 15%.
Пример 2.
Донорскую плазму, полученную методом автоматического афереза в объеме 750 мл с вирусной репликацией Herpes Simplex virus 5,1 log. В плазму добавляли 45 мл раствора рибофлавина в концентрации 1200 мкмоль/л в 0,9% физ. растворе и молекулярный кислород в объеме 18% от максимального объема контейнера (до 1000 мл). После перемешивания содержимого контейнера, полученную смесь облучали монохроматическим синим светом длиной волны 450 нм через проточную систему с кюветой толщиной до 1,5 мм для достижения суммарной дозы 12 Дж/см2 при температуре +37°С в течение около 10 минут.
После облучения идентифицирована полная инактивация вируса гепатита при этом уровень фибриногена снижался на 20%, а уровень VIII фактора - на 13%. Пример 3
Плазму объемом 345 мл с вирусной репликацией Human Hepatitis A virus в 2,4 log10 добавляли 37 мл раствора рибофлавина в концентрации 980 мкмоль/л в 0,9% физ. растворе и молекулярный кислород в объеме 30% от максимального объема контейнера (до 600 мл). После перемешивания содержимого контейнера, облучение монохроматическим синим светом с длиной волны 450 нм проводили на кювете с толщиной 2,2 мм для достижения суммарной дозы 12 Дж/см2 при температуре +18°С в течении 7 минут. После облучения вируса гепатита не обнаруживался при этом уровень фибриногена снижался на 24%, а уровень VIII фактора - на 17%.
Пример 4
Контейнер с донорской плазмой объемом 470 мл инфицирован Staphylococcus Epidermidis, затем добавляли 40 мл раствора рибофлавина в концентрации 1060 мкмоль/л в 0,9% физ. растворе и молекулярный кислород в объеме 5% от максимального объема контейнера (до 600 мл). Затем после перемешивания смеси, половину получившегося объема отправляли на бактериальный посев, другую половину облучали монохроматическим синим светом длиной волны 450 нм на кювете с толщиной 1,8 мм для достижения суммарной дозы 12 Дж/см2 при температуре +10°С в течение 3 минут и затем также отправляли на бактериальный посев. К концу 7 суток в смеси после облучения не было выявлено никакого роста бактерий, в смеси без облучения к 3 суткам выявлен рост Staphylococcus epidermidis до 103 КОЕ/мл.
Пример 5
Контейнер с донорской плазмой объемом 650 мл инфицирован Escherichia coli, затем добавляли 42 мл раствора рибофлавина в концентрации 1100 мкмоль/л в 0,9% физ. растворе и молекулярный кислород в объеме 28% от максимального объема контейнера (до 1000 мл). Затем после перемешивания смеси, половину получившегося объема отправляли на бактериальный посев, другую половину облучали монохроматическим синим светом длиной волны 450 нм на кювете с толщиной 2,5 мм для достижения суммарной дозы 12 Дж/см2 при температуре +2°С в течение 7 минут и затем также отправляли на бактериальный посев. К концу 7 суток в смеси после облучения не было выявлено никакого роста бактерий, в смеси без облучения к 3 суткам выявлен рост Escherichia coli до 105 КОЕ/мл.
При увеличении мощности получаемого излучения, усиливаются процессы инактивации патогенов, но в тоже время, повышается степень деструкции полезных компонентов донорской плазмы крови - фибриноген и VIII фактор свертывания крови. Экспериментальным путем было получено, что наиболее благоприятным с точки зрения сохранности полезных факторов для изучаемого способа инактивации патогенов является мощность облучения в 12 Дж/см2. В тоже время при отсутствии необходимости в сохранности полезных термолабильных факторов, например, для производства альбумина из донорской плазмы, данная доза может быть увеличена. Стоит также отметить, что степень инактивации патогенов зависит от первоначального уровня патогена, что может привести к получению иных результатов, представленных в данных исследованиях, но в тоже время быть достаточными для получения необходимых результатов по инактивации патогенов.
Инактивация патогенов по предлагаемому способу позволяет обеспечить необходимую инфекционную безопасность донорского продукта при максимальном сохранении полезных элементов донорской плазмы. Применение технологий проточного облучения с заданной толщиной кюветы предоставляет полную равномерность получаемой дозы излучения и снижает ограничение по перерабатываемому объему донорской продукта.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИНАКТИВИРОВАНИЯ ПАТОГЕНОВ В ДОНОРСКОЙ КРОВИ, ПЛАЗМЕ КРОВИ ИЛИ КОНЦЕНТРАТАХ ЭРИТРОЦИТОВ В ГИБКИХ КОНТЕЙНЕРАХ С ПОМОЩЬЮ ВСТРЯХИВАНИЯ | 2006 |
|
RU2466742C2 |
| СПОСОБ ОБЛУЧЕНИЯ УЛЬТРАФИОЛЕТОВЫМ СВЕТОМ КОНЦЕНТРАТОВ ТРОМБОЦИТОВ В ГИБКИХ КОНТЕЙНЕРАХ | 2006 |
|
RU2441669C2 |
| СПОСОБ ИНАКТИВАЦИИ ПАТОГЕНОВ | 2012 |
|
RU2558432C2 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ИНАКТИВАЦИИ БАКТЕРИЙ | 2006 |
|
RU2316366C2 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ АУТОИММУННЫМИ ЗАБОЛЕВАНИЯМИ | 1999 |
|
RU2159635C2 |
| СПОСОБ УНИЧТОЖЕНИЯ ПАТОГЕННЫХ И УСЛОВНО-ПАТОГЕННЫХ МИКРООРГАНИЗМОВ | 2010 |
|
RU2430756C1 |
| СПОСОБ ПОДАВЛЕНИЯ ПАТОГЕННЫХ И УСЛОВНО-ПАТОГЕННЫХ МИКРООРГАНИЗМОВ | 2010 |
|
RU2430757C1 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ ИНАКТИВАЦИИ ЗАГРЯЗНЯЮЩИХ ПРИМЕСЕЙ В БИОЛОГИЧЕСКОЙ ЖИДКОСТИ | 1997 |
|
RU2219951C2 |
| Монокатионный хлориновый фотосенсибилизатор для фотодинамической инактивации опухолевых клеток | 2022 |
|
RU2792003C1 |
| СПОСОБ ЛЕЧЕНИЯ И/ИЛИ ПРЕДУПРЕЖДЕНИЯ СОСТОЯНИЙ, ВЫЗВАННЫХ МИКРООРГАНИЗМАМИ, С ПРИМЕНЕНИЕМ ОРАЛЬНОГО СВЕТОВОГО УСТРОЙСТВА | 2010 |
|
RU2542781C2 |
Изобретение относится к медицине, а именно к трансфузиологии, и может быть использовано для патогенинактивации плазмы крови. В контейнер плазмы крови в объеме 200-750 мл вводят 30-45 мл раствора рибофлавина в концентрации 800-1200 мкмоль/л в 0,9% физрастворе. Вводят молекулярный кислород в количестве 5-30% от объема контейнера с плазмой. Содержимое контейнера смешивают. Полученную смесь пропускают через проточную кювету толщиной 1,5-2,5 мм с одновременным облучением монохроматическим синим светом длиной волны 450 нм при температуре 2-37°С до суммарной световой дозы 12 Дж/см2. Способ обеспечивает повышение эффективности в инактивации различных инфекционных патогенов при сохранении полезных свойств донорского продукта - факторов свертывания и увеличение объемов обрабатываемой донорской плазмы за счет обеспечения равномерности получаемой дозы излучения. 1 ил., 5 пр.
Способ патогенинактивации плазмы крови, включающий введение в плазму рибофлавина с последующим проведением облучения, отличающийся тем, что в контейнер плазмы крови в объеме 200-750 мл вводят 30-45 мл раствора рибофлавина в концентрации 800-1200 мкмоль/л в 0,9% физрастворе, а затем вводят молекулярный кислород в количестве 5-30% от объема контейнера с плазмой, содержимое контейнера смешивают, после этого полученную смесь пропускают через проточную кювету толщиной 1,5-2,5 мм с одновременным облучением монохроматическим синим светом длиной волны 450 нм при температуре 2-37°С до суммарной световой дозы 12 Дж/см2.
| Чечеткин А.В | |||
| и др | |||
| Влияние инактивации патогенов на качество и показатели биологической полноценности компонентов донорской крови | |||
| Ж-л "Гематология", т | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| Способ замораживания пищевых веществ | 1916 |
|
SU784A1 |
| Способ инактивации патогенов в препаратах крови, плазме донорской крови, биологических препаратах и устройство для его реализации | 2018 |
|
RU2696784C1 |
| RU 2010107157 A, 10.09.2011 | |||
| СПОСОБ ФОТОДИНАМИЧЕСКОГО ВОЗДЕЙСТВИЯ НА ВИРУСЫ ИЛИ КЛЕТКИ | 2002 |
|
RU2291700C2 |
| WO 2005025712 A3, 24.03.2005 | |||
| Губанова М | |||
| Н | |||
| и др | |||
| Инактивация патогенов в клеточных | |||
Авторы
Даты
2022-04-19—Публикация
2021-04-27—Подача