Изобретение относится к фармации, а именно к способу получения лекарственной формы хинидина пролонгированного действия.
Антиаритмичный препарат хинидин является эффективным лекарственным средством для лечения и профилактики различных нарушений ритма сердца. Однако хинидин быстро выводится из организма, поэтому для поддержания активных концентраций препарата в крови его назначают с малыми интервалами между очередными приемами, в результате больные вынуждены принимать этот препарат каждые 2-4 ч, т.е. по 6-8 раз в день, что неудобно и создает риск интоксикации, поскольку концентрация хинидина в крови после каждого приема резко повышается, с другой стороны, концентрации препарата во время ночного перерыва в приеме снижаются ниже эффективного уровня и возможны рецидивы аритмии.
Известны несколько способов получения композиций пролонгированного действия на основе хинидина, различающихся составом и природой полимерных носителей. Эти композиции являются многокомпонентными (7-9 компонентов) и технология их производства включает несколько стадий с применением огнеопасных и токсичных органических растворителей.
В настоящее время разрешено применение 2 импортных лекарственных форм, а именно хинидин дурулес и кинилентина. Хинидин дурулес выпускается шведской фирмой "Astra", в качестве полимерного носителя используют нерастворимый в воде поливинилхлорид. Из полученных матричных таблеток водорастворимый хинидин бисульфат высвобождается замедленно (50% за 3 ч). Масса таблетки 550 мг, содержание активного начала 36%
"Кинилентин" выпускается финской фирмой "Medica-Leiras", в ядре таблетки содержится 6% стеаринового спирта и 1,5% этилцеллюлозы, всего в состав композиции входит 11 компонентов. Таблетки покрыты оболочкой.
Известен также способ получения аналогичной композиции. В состав твердой рецептуры для орального применения сердечно-сосудистого лекарства входит терапевтически эффективное количество компонентов: 0,5-6,0 мас. устойчивого к кислой среде или гидрофобного производного целлюлозы, в частности этилцеллюлозы; 2,5-35 мас. гидрированного растительного масла; 1-20 мас. полиакриловой кислоты; 0,5-4,0 мас. двуокиси кремния; 0,4-3,0 мас. скользящего агента. Для получения этой лекарственной формы используют многостадийную технологию с применением органических растворителей.
Помимо гидрофобных производных целлюлозы также могут быть использованы и гидрофильные производные целлюлозы, например оксипропилметилцеллюлоза. В этой композиции в качестве лекарства используют хинидин полигалактуронат, в состав композиции входят красная окись железа, оксипропилметилцеллюлоза, диоктилнатрий сульфосукцинат, тальк, стеарат магния и лактоза. Для приготовления композиции также используют органический растворитель изопропанол.
Известен способ получения таблеток с контролируемым высвобождением хинидина, состоящих из хинидина сульфата, поливинилпирролидона, Карбопола 934, этилцеллюлозы, триэтилцитрата, пикколита S-115-L, стеариновой кислоты и стеарата магния. Таблетки готовят путем смешивания хинидина сульфата, поливинилпирролидона и карбопола. Во время смешивания порошок смачивают раствором этилцеллюлозы в метиленхлориде, содержащем также триэтилцитрат и пикколит, добавляют дополнительное количество триэтилцитрата для достижения желаемого уровня влажности и смесь пропускают через сито 16 меш. и сушат на воздухе. Высушенный материал просеивают через сито 20 меш, добавляют стеариновую кислоту и стеарат магния, снова перемешивают и затем прессуют в таблетки. Недостатком этой композиции является многокомпонентность, сложность технологии, использование токсичного растворителя метиленхлорида.
Известен также способ получения композиции, в состав которой входит 200 мг хинидина сульфата, 20 мг Макрогола, 3 мг талька, 150 мг Эйдрагита Е 30 Р (торговое название 30%-ной водной дисперсии полиметакриловой смолы), остальное Кутина HR (торговое название гидрированного касторового масла). В общем виде полимерным носителем является сополимер сложных эфиров акриловой и метакриловой кислот, содержащий четвертичные аммонийные группы, или анионный сополимер метакриловой кислоты и метилметакрилата. В качестве контролирующих агентов используют сложные эфиры жирных кислот, содержащие 10-30 атомов углерода, в количестве до 15 мас. во всей смеси. Недостатком этой композиции является то, что выделение активного агента происходит достаточно быстро: 42-38% всей дозы за 1 ч при содержании контролирующего агента 5-15 мас. (50% дозы за 1,5-2 ч).
Эффективность полимерного носителя связана с химической природой как самого носителя, так и лекарственного вещества. Для регулирования свойств известных композиций в них вводят многочисленные добавки, что приводит к многокомпонентности системы, однако хинидин из этих систем выделяется излишне быстро, что не позволяет длительно поддерживать эффективную концентрацию препарата в крови.
Для устранения указанных недостатков и повышения качества готового продукта первоначально смешивают сульфат хинидина с интерполимерным комплексом полиметакриловой кислоты и полиэтиленгликоля, затем смесь увлажняют водой или раствором интерполимерного комплекса и добавляют сахар, полученную массу подвергают влажной грануляции, затем сушат и проводят последующие операции по изготовлению готовой лекарственной формы.
Было обнаружено, что, если в способе получения противоаритмической лекарственной композиции пролонгированного действия, включающем смешение исходных компонентов, введение увлажняющего агента, грануляцию, сушку полученной смеси с последующим получением лекарственной формы, в качестве увлажняющего агента используют 5-15%-ный раствор интерполимерного комплекса в фосфатном буфере, или в водно-щелочном растворе с рН 6,8-7,5, или в этиловом спирте, то при этом улучшаются такие технологические показатели, как насыпная масса и сыпучесть, кроме того, повышается качество готовых таблеток. Эту же цель, как оказалось, можно достичь и с помощью варианта способа, который заключается в том, что смешивают в сухом состоянии хинидина сульфат, интерполимерный комплекс полиметакриловой кислоты и полиэтиленгликоля и сахар, затем смесь брикетируют, гранулируют размолом, опудривают полученные гранулы стеаратом магния или кальция и таблетируют.
В обоих вариантах для маскировки горького вкуса лекарственной формы в виде таблеток и увеличения срока действия препарата в организме можно наносить на эти формы защитные полимерные оболочки, получаемые из раствора 5-15 мас. того же интерполимерного комплекса, 0-4,5 мас. едкого натра или гидрокарбоната натрия, 1-5 мас. Твин-80 с добавкой 0-2 мас. двуокиси титана в дистиллированной воде или этиловом спирте.
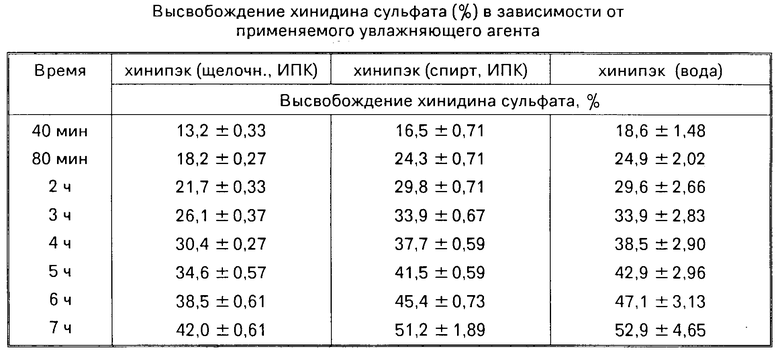
Могут быть также использованы защитные оболочки из других пленкообразующих полимеров, в частности метилацетилцеллюлозы. Готовят раствор, содержащий 2-3% метилацетилцеллюлозы, 3-4% Твин-80 0-6% диоксида титана в воде. Полученный раствор используют для покрытия таблеток. Результаты сведены в таблицу.
Заявляемый способ позволяет по упрощенной технологии получить целевой продукт высокого качества. Способ прост в осуществлении, не требует применения специального оборудования. Получаемая противоаритмическая лекарственная композиция обладает фармакологическими свойствами, присущими хинидина сульфату. Хинидин дозированно высвобождается из полимерной матрицы, за счет чего обеспечивается постоянная концентрация хинидина в крови в течение 12-24 ч. Стойкий клинический эффект достигается на третий день лечения.
Исследования хронической токсичности композиции, приготовленной по предлагаемому способу, проведенное в опытах на собаках, показало, что препарат при введении внутрь в дозе 5-6 мг/кг в течение 3 мес. не вызывает каких-либо изменений со стороны поведения животных, привеса, периферической крови, а также показателей патолого-морфологического исследования органов и ткани подопытных собак.
В клинике препарат, приготовленный предлагаемым способом, испытан в сравнении с известным препаратом "Кинилентин". Особое внимание уделялось фармакокинетическим исследованиям. Используя строго подобранные по возрасту, весу, тяжести заболевания группы больных, определяли концентрации хинидина в крови методом высокоэффективной жидкостной хроматографии.
Оказалось, что для таблеток, изготовленных из предлагаемой композиции, при сравнении с таблетками "Кинилентин" при почти одинаковой максимальной концентрации хинидина в крови, время достижения этой концентрации, среднее время удержания хинидина в организме и длительность существования эффективной концентрации примерно в 2 раза больше, в 2-3 раза выше и биодоступность препарата из таблеток, изготовленных на основе интерполимерного комплекса.
Композицию, приготовленную предлагаемым способом, применяют в качестве антиаритмического средства для лечения мерцательной аритмии и профилактики ее рецидивов, пароксизмальной суправентрикулярной тахикардии, частой предсердной или желудочковой экстрасистолии, а также для купирования и профилактики различных видов нарушений сердечного ритма при ИБС, ревматическом пороке сердца, гипертонической болезни и некоторых других заболеваниях. Наиболее эффективен при мерцании предсердий наджелудочковой экстрасистолии.
П р и м е р 1. В смеситель загружают 2,22 кг хинидина сульфата и 1,44 кг интерполимерного комплекса, перемешивают. К полученной смеси прибавляют 1 кг дистиллированной воды при перемешивании, затем 0,33 кг сахара и продолжают перемешивание. После влажной грануляции таблеточную массу сушат при температуре 50-60оС до остаточной влажности гранулята 1-2% проводят сухую грануляцию, затем опудривают стеаратом кальция и таблетируют в таблетки, содержащие 0,2 г хинидина сульфата. Полученные таблетки можно покрыть оболочкой.
П р и м е р 2. В смеситель загружают 2,22 кг хинидина сульфата и 1,39 кг интерполимерного комплекса, перемешивают. Полученную смесь увлажняют 500 мл 10% -ного раствора интерполимерного комплекса в фосфатном буфере рН 7,5 при перемешивании, добавляют 0,33 кг сахара и продолжают перемешивать. Затем проводят влажную грануляцию и сушку гранулированной смеси при температуре 50-60оС до остаточной влажности гранулята 1-2% Проводят сухую грануляцию, затем опудривают стеаратом кальция и таблетируют в таблетки, содержащие 0,2 г хинидина сульфата. Выход готового продукта составляет 97 мас. Полученные таблетки можно покрыть оболочкой.
П р и м е р 3. В смеситель загружают, 2,22 кг хинидина сульфата и 1,39 кг интерполимерного комплекса, перемешивают. К полученной смеси прибавляют 500 мл 10%-ного раствора интерполимерного комплекса в водно-щелочном растворе карбоната натрия рН 6,8 при перемешивании, 0,33 кг сахара и продолжают перемешивать. Затем проводят влажную грануляцию и сушку гранулированной смеси при температуре 50-60оС до остаточной влажности гранулята 1-2% Проводят сухую грануляцию, затем опудривают стеаратом кальция и таблетируют в таблетки, содержащие 0,2 г хинидина сульфата. Выход готового продукта составляет 97 мас. Полученные таблетки можно покрыть оболочкой.
П р и м е р 5. В смеситель загружают 2,22 кг хинидина сульфата и 1,39 кг интерполимерного комплекса, перемешивают. Полученную смесь увлажняют 500 мл 10%-ного раствора интерполимерного комплекса в этиловом спирте при перемешивании, добавляют 0,33 кг сахара и продолжают перемешивать. Затем проводят влажную грануляцию и сушку гранулированной смеси при температуре 50-60оС до остаточной влажности гранулята 1-2% Проводят сухую грануляцию, затем опудривают стеаратом кальция и таблетируют в таблетки, содержащие 0,2 г хинидина сульфата. Выход готового продукта составляет 97 мас. Полученные таблетки можно покрыть оболочкой.
П р и м е р 6. В смеситель загружают 2,22 кг хинидина сульфата, 1,44 кг интерполимерного комплекса и 0,33 кг сахара, перемешивают. Полученную смесь брикетируют, затем проводят грануляцию размолом. Гранулированную смесь опудривают стеаратом кальция и таблетируют. Получают 11000 таблеток массой 0,360 г каждая. Полученные таблетки можно покрыть оболочкой.
П р и м е р 7. Опыт осуществляют по методике примера 2 с тем исключением, что в качестве увлажняющего агента используют 500 мл 5%-ного раствора интерполимерного комплекса в фосфатном буфере рН 6,8. Выход готового продукта составляет 97%
П р и м е р 8. Опыт осуществляют по методике примера 2 с тем исключением, что в качестве увлажняющего агента используют 500 мл 15%-ного раствора интерполимерного комплекса в фосфатном буфере рН 7,5. Выход готового продукта составляет 98%
П р и м е р 9. Опыт осуществляют по методике примера 4 с тем исключением, что в качестве увлажняющего агента используют 500 мл 15%-ного раствора интерполимерного комплекса в водно-щелочном растворе бикарбоната натрия рН 7,2. Выход готового продукта составляет 98%
П р и м е р 10. Опыт осуществляют по методике примера 5 с тем исключением, что в качестве увлажняющего агента используют 500 мл 5%-ного раствора интерполимерного комплекса в этиловом спирте. Выход готового продукта составляет 97%
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ БРОНХОЛИТИЧЕСКОЙ ЛЕКАРСТВЕННОЙ КОМПОЗИЦИИ ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ НА ОСНОВЕ ТЕОФИЛЛИНА | 1992 |
|
RU2036642C1 |
| ПРОТИВОВОСПАЛИТЕЛЬНЫЙ СОСТАВ ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ НА ОСНОВЕ ДИКЛОФЕНАКА НАТРИЯ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1992 |
|
RU2070034C1 |
| ПРОЛОНГИРОВАННАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ЛЕКАРСТВЕННАЯ ФОРМА И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ (ВАРИАНТЫ) | 2009 |
|
RU2435584C2 |
| БРОНХОЛИТИЧЕСКОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1995 |
|
RU2097036C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРИМЕНЯЕМАЯ ПРИ ЗАБОЛЕВАНИЯХ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ | 2002 |
|
RU2207847C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФАРМАЦЕВТИЧЕСКОЙ КОМПОЗИЦИИ КЛОЗАПИНА В ВИДЕ ТАБЛЕТОК И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2010 |
|
RU2441651C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА НА ОСНОВЕ ТЕОФИЛЛИНА | 2001 |
|
RU2188639C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВОТУБЕРКУЛЕЗНОЙ АКТИВНОСТЬЮ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2001 |
|
RU2221565C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ФОРМЕ ТАБЛЕТКИ, ПОКРЫТОЙ ОБОЛОЧКОЙ | 2022 |
|
RU2786073C1 |
| БРОНХОЛИТИЧЕСКОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2000 |
|
RU2203062C2 |
Изобретение относится к медицине, в частности к фармации. Цель изобретения - увеличение длительности поддержания эффективной концентрации лекарственного препарата в крови. Поставленная цель достигается тем, что первоначально смешивают хинидина сульфат с интерполимерным комплексом (ИПК) полиметакриловой кислоты и полиэтиленгликоля, затем смесь увлажняют водой или раствором ИПК и добавляют сахар, полученную массу подвергают влажной грануляции, затем сушат и проводят последующие операции по изготовлению готовой лекарственной формы. По другому варианту таблетки можно получать методом брикетирования. При одинаковой максимальной концентрации хинидина в крови время достижения этой концентрации, среднее время удерживания хинидина в организме и длительность существования эффективной концентрации примерно в 2 раза больше, в 2 - 3 раза выше и биодоступность препарата из таблеток, изготовленных на основе ИПК, по сравнению с таблетками "Кинелентин". 2 з.п. ф-лы, 1 табл.
| Патент США N 4351825, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1995-06-09—Публикация
1992-05-29—Подача