Изобретение относится к способу очистки инсулина и/или производных его путем хроматографии на липофильно модифицированном силикагеле в водных, буферных растворителях, которые содержат смешивающиеся с водой органические растворители, причем в водном, буферном растворителе растворены амфотерные ионы и/или значение рН растворителя находится вблизи изоэлектрической точки очищаемого инсулина или его производного.
Из аналитических способов разделения известна очистка инсулинов или их производных на липофильно модифицированных силикагелях (обратимая фаза), которая много лет и с успехом используется в ВЖЭХ [1] В аналитическом масштабе количество белка в мкм вносят в заполненную модифицированным силикагелем колонку из стали, стекла или пластмассы и затем элюируют протекающей смесью жидкостей (большей частью кислые, водные, буферные растворы с постоянной или изменяющейся концентрацией органического растворителя). Заполнение белком составляет при этом менее 30 мкм/мл объема колонки.
До сих пор в способах очистки часто применяют относительно токсичные, используемые в лаборатории растворители (ацетонитрил) и вызывающие коррозию, дорогие буферные компоненты, например, тетраалкиламмониевые соли, алкилсульфонаты, гексафторацетон, трифторацетат (E.P.Kroeff и др. J.Chrom. 1989, 461, 45-61). При наличии смесей, в большей степени загрязненных инсулиноподобными веществами, эти растворители не дают удовлетворительного препаративного разделения, в данном случае имеют в виду качество, выход основных компонентов и общее их содержание [2] (Peter и др. J.Chrom. 408, 1987, 43-52).
Инсулины прежних химических превращений, как, например, сильно кислотного эфирного расщепления или ферментативных (транс-)пептидных процессов, кристаллизационной очистки содержат преимущественно сопутствующие вещества с подобными свойствами. Их можно очистить благодаря подбору определенного значения рН путем ионообменной хроматографии, если имеет место достаточная разность потенциалов [3]
Недостаток этого метода заключается в эффекте разбавления и связанной с этим потерей ценных веществ при переработке осадков, в относительно длительной продолжительности цикла или в том, что общее содержание и выход конечного продукта незначительны.
В принципе препаративное разделение может быть доступно благодаря увеличению объема колонки, степени заполнения и расхода элюента. Необходимые количества органических растворителей составляют объемы порядка м3, например колонок с диаметром более 20 см. Для аналитической ВЭЖХ используемые растворители (например, ацетонитрил, ДМФА, метанол, диоксан и др.) токсичны, так что применение этих методов в масштабе препаративного производства требует расходов для проведения защитных мероприятий.
Целью предлагаемого изобретения является разработка способа хроматографической очистки инсулинов и их производных, при котором сохраняется биологическая активность инсулинов, достигается высокая степень чистоты хроматографическим путем, сокращается продолжительность цикла, срок службы колонки достигает более 50 хроматографических циклов, регенерация стационарной фазы силикагеля происходит без длительного процесса уплотнения и достигается введение нетоксичных растворителей, все это способствует использованию препаративного разделения в производственных масштабах.
Найдет способ, благодаря которому можно очистить инсулин и его производные путем хроматографии в водных, буферных растворителях, содержащих смешивающиеся с водой растворители, на липофильном модифицированном силикагеле, отличающийся тем, что в буферных растворителях растворены амфотерные ионы или значение рН растворителя лежит вблизи изоэлектрической точки очищаемого инсулина или его производного и присутствуют амфотерные ионы.
Растворение амфотерных ионов или хроматография при значении рН растворителя, находящемся вблизи изоэлектрической точки очищаемого инсулина, и присутствие амфотерных ионов способствуют не только хорошему разделению ценного продукта и примесей, но и хорошему отделению белков от стационарной фазы (липофильно модифицированный силикагель). Достигаемое разделение позволяет даже очищать растворы инсулина, загрязненные инсулиноподобными компонентами, как например, отделение А21-дезамидоинсулина от инсулина и его производных. Далее благодаря успешному отделению белков от твердой фазы увеличивается срок службы колонки и возможно повышение выхода инсулина.
Итак, изобретение относится к способу очистки инсулина и/или его производных путем хроматографии в водных буферных растворителях, содержащих смешивающиеся с водой органические растворители, на липофильно модифицированном силикагеле, отличающемуся тем, что в буферных растворителях растворены амфотерные ионы или значение рН смеси растворителей лежит вблизи изоэлектрической точки очищаемого инсулина или его производного и присутствуют амфотерные ионы.
В способе согласно изобретению могут быть использованы все инсулины, например инсулины всех видов животного или человеческого происхождения, предшественники инсулина, как, например, проинсулин или пре-проинсулин, либо рекомбинированные инсулины или их производные, которые выделены из генетически модифицированных микроорганизмов. Далее можно вводить также производные инсулина, полученные путем химического или ферментативного превращения, например, дез-Фен-BI-инсулин, инсулин β-кетен-сульфонат, диаргининсулин (В31, В32), моноаргинининсулин или дифенилаланининсулин (В31, В32) US 4 601 852).
Преимущественно вводят производные инсулина формулы (1),

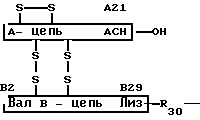

(1) в которой
R30 остаток генетически кодированной L-аминокислоты,
Х гидроксигруппа; физиологически инертная органическая группа основного характера с С1-С50; генетически кодированная L-аминокислота и имеющая стоящую в конце, свободную, карбоксил-функциональную группу, как, например, эфирную, амидную, группу лактона или восстановленную до СН2ОН группу,
n целое число от 0 до 10,
У водород или L-фенилаланин, а
А- и В-цепи ряды животного или человеческого инсулина.
Особое предпочтение отдают производным инсулина формулы (1), в которой
R30 L-аланин или L-треонин и
Х одна или несколько L-аминокислот из группы L-аргинина, L-лизина или L-фенилаланина.
Инсулины и их производные могут быть введены как в относительно неочищенном состоянии, так и в предварительно очищенной форме (например, путем хроматографии). Инсулин после многократной кристаллизации, а также после гель-хроматографии еще загрязнен инсулиноподобными сопутствующими веществами с очень близкой молекулярной массой, которые при определенном, выбранном значении рН в напряженном состоянии отличаются друг от друга и от инсулина, но образуют с инсулином комплексы (US 4 129 560). Примером таких веществ может служить инсулиноэтиловый эфир и др. Под липофильно модифицированным силикагелем нужно понимать такой силикагель, на который нанесена гидрофобная матрица. Например, в качестве гидрофобной матрицы могут быть использованы алканы с длинной цепью от С3 до С20. В особенности предпочтительны следующие липофильно модифицированные силикагели:
(R) Nucleosil, фирмы Macherey Nagel: сферические и несферические материалы с различными размерами зерен до 45 мкм, с размером пор до 100  , модифицированные С8 или С18;
, модифицированные С8 или С18;
(R) Lichroprep, фирмы Merek: несферические или сферические материалы с различными размерами зерен до 40 мкм, с размерами пор 60-250  , модифицированные С8-С18;
, модифицированные С8-С18;
(R) Lichroprep Select B, фирмы Merek: сферический материал с размерами зерен до 25 мкм, модифицированный С8;
(R) Watеrs Prep, модифицирован С18, несферические зерна размером 50-105 мкм, размеры пор 100  ;
;
(R) Zorbax Pro 10, фирмы DuPont: модифицирован С8, 10 мкм, сферические зерна, размер пор 100  ;
;
(R) Rromasil, фирмы ЕКА Nobel: модифицирован С4, С8-С18, до 16 мкм, сферические зерна, размер пор 100, 150 или 200  .
.
Амфотерные ионы это соединения, которые могут принимать или отщеплять протоны, т. е. в кислых растворах образуют катионы, а в щелочных растворах анионы, например, α-аминокислоты, бетаин или его производные. Предпочитаемые амфотерные ионы это глицин, глутамин или бетаин (N-триметил-глицин). В особенности предпочтителен глицин.
Изоэлектрическая точка (ИЭТ) инсулина или его производных это такое значение рН раствора инсулина, при котором количество катионных и анионных зарядов растворенного инсулина равно нулю. Например, ИЭТ инсулина свиньи находится между рН 5,3 и 5,4 (H.Neurath, K.Baily, Protein Hormones, Vol. II/A The Proteins, с.636). Выражение "вблизи изоэлектрической точки" нужно понимать таким образом, что имеются в виду такие значения рН, которые находятся на 1 рН-единицу выше или ниже ИЭТ очищаемого инсулина. Преимущественно используют такие значения рН, которые находятся на 0,5 рН-единиц выше или ниже ИЭТ.
Элюенты содержат буферные вещества для поддержания постоянного значения рН элюента. Пригодные буферные вещества, известные в литературе, это фосфаты, соли щелочных или щелочно-земельных металлов, например цитрат натрия или ацетат калия, а также цитрат, ацетат, сульфат или хлорид аммония. Кроме того, элюенты содержат органические растворители, смешивающиеся с водой, как, например, спирты, кетоны, метилацетат, диоксан, диметилсульфоксид или ацетонитрил. Предпочтительными являются спирты, например н- или изопропанол, метанол, этанол или метилацетат.
Концентрация растворителей, смешивающихся с водой, находится в пределах между 1 и 90% преимущественно между 10 и 60% предпочтительнее между 10 и 35% Концентрация буферных веществ лежит между 1 ммоль/ли 2 моль/л, в пересчете на воду в качестве растворителя преимущественно между 25 ммоль/л и 1 моль/л. Концентрация амфотерных ионов может колебаться в широких пределах. Преимущественные количества находятся между 10 ммоль/л и 1 моль/л, в пересчете на воду в качестве растворителя предпочтительно между 20 ммоль/л и 500 ммоль/л.
Температура в процессе хроматографии находится на уровне между 0 и 50оС, преимущественно между 10 и 30оС, в особенности между 15 и 20оС. Применяемое давление во время хроматографии остается постоянным. Хроматографию можно проводить при различном давлении, например, при давлении от 5 до 400 бар, в особенности при давлении 20-100 бар.
Заполнение колонок, хроматографию и элюирование инсулина и его производных проводят известными, обычными, техническими методами. Заполнение колонки очищаемым раствором инсулина проводят преимущественно водно-спиртовым или чисто водным буферным раствором. Раствор инсулина содержит долю белка в количестве 1-10% преимущественно 3%
Элюирование инсулинов проводят по способу согласно изобретению при постоянной концентрации буферных веществ (изокритическая) или при изменении доли органического растворителя, смешивающегося с водой, в буфере. Изменение доли органического растворителя происходит таким образом, что концентрация органического растворителя увеличивается в зависимости от объема элюента, а именно преимущественно находится в линейной зависимости.
Выделение инсулина из элюата после хроматографии происходит путем осаждения цинком или кристаллизации. При этом раствор можно освободить от растворителя с помощью предварительной дистилляции под вакуумом и последующего восстановления концентрации путем разбавления водой. В каждом случае концентрация растворителя перед осаждением или кристаллизацией должна быть 10% или ниже, чтобы поддерживать содержание белка на уровне 50 мг/л. Полученный чистый осадок инсулина можно выделить путем декантации, центрифугирования или фильтрации и затем высушить.
Способ согласно изобретению пригоден не только для аналитической хроматографии, но и для препаративной, в особенности если способ согласно изобретению проводят на установке препаративной ВЭЖХ.
Под выражением "препаративная хроматография" понимают способ очистки с целью получения чистого продукта, а не только для анализа. Количество чистого продукта может колебаться в широких пределах, например от 1 мг до 50 кг, преимущественно от 50 мг до 15 кг.
В следующих примерах в отдельности описаны способы согласно изобретению.
П р и м е р 1.
Буфер A: 0,2 моль сульфата аммония, 0,1 моль глицина, 0,05 моль цитрата натрия, рН 5,5, чисто водный раствор.
Буфер Б: 0,1 моль сульфата аммония, 0,1 моль глицина, 0,05 моль цитрата натрия, рН 5,5, вода/н-пропанол в соотношении 1:1.
Сорбент: Nucleosil С18, 15-25 мкм, сферические, размер пор 100  , фирмы Macherey * Nagel, Düren.
, фирмы Macherey * Nagel, Düren.
Размеры колонки: 40 мм х 250 мм.
Заполнение колонки проводят 3,5 г человеческого инсулина (HI), полученного расщеплением трифторуксусной кислотой человеческого инсулина-ВЗО-ди-трет-бутилового эфира/эфир, с долей белка 79,1% Элюирование инсулина происходит благодаря смешению буферов А и Б в смесительном устройстве с помощью насоса высокого давления, так что образуется градиент пропанола от 14 до 20% Элюирование инсулина происходит при ≈ 17,5% пропанола через 23 мин, если насосом подается 46 мл/мин элюента. После фракционирования и выделения кристаллического человеческого инсулина (HI) получают продукт с 97% белка в основной фракции (выход 88,5% ) и с 85,7% белка в побочной фракции (выход 7,5%). Общее содержание составляет 96% инсулина.
П р и м е р 2. Буфер A: 0,1 моль сульфата аммония, 0,1 моль глицина, 0,025 моль цитрата натрия, рН 5,5, чисто водный раствор.
Буфер Б: 0,05 моль сульфата аммония, 0,1 моль глицина, 0,025 моль цитрата натрия, рН 5,5, вода/н-пропанол в соотношении 1:1.
Сорбент: Nucleosil С 18-Р, 15-25 мкм, сферические, 100  размер пор, фирмы Macherey* Nagel.
размер пор, фирмы Macherey* Nagel.
Размеры колонки: 40 мм х 250 мм.
Колонку заполняют с помощью насоса высокого давления 7,0 г человеческого инсулина (HI) (доля белка 86,1%), полученного эфирным расщеплением человеческого инсулина-ди-трет-бутилового эфира/эфир, в виде 3%-ного раствора в буфере 0,1 моль глицина/соляная кислота, рН 2,8. Затем проводят под давлением элюирование выше описанными растворами буферов в градиенте н-пропанола. В течение 60 мин. концентрация пропанола возрастает от 14 до 17,5% После фракционирования и кристаллизации вышеописанным способом получают продукт с 98,7% доли белка. Выход очищенного человеческого инсулина составляет 91% от введенного инсулина.
П р и м е р 3.
Буфер А: 0,1 моль сульфата аммония, 0,1 моль глицина, 0,025 моль ацетата натрия, рН 5,5, чисто водный.
Буфер Б: 0,05 моль сульфата аммония, 0,1 моль глицина, 0,025 моль ацетата натрия, рН 5,5 вода/н-пропанол в соотношении 1:1.
Сорбент: Lichrospher Select В, С8, 15-25 мкм, размер пор 60  .
.
Размеры колонки: 50 мм х 250 мм.
Колонку заполняют раствором 10 г реакционной смеси, состоящей из переамидированного свиного инсулина с трипсином, растворенными в 200 мл буфера 0,1 моль глицина/соляная кислота, рН 2,8. В течение 120 мин проводят элюирование при скорости подачи 40 млн./мин и повышении концентрации пропанола от 14 до 30% и затем разделяют белки на отдельные компоненты. Получают после кристаллизации или осаждения и сушки в качестве основной фракции человеческий инсулин-В30-ди-трет-бутилтреониновый эфир) эфир со степенью чистоты более 97% и выходом 93% в пересчете на введенный инсулин.
П р и м е р 4. Буфер А: 0,1 моль хлорида натрия, 0,1 моль глицина, 0,025 моль ацетата натрия, рН 5,5, чисто водный.
Буфер Б: 0,05 моль хлорида натрия, 0,1 моль глицина, 0,025 моль ацетата натрия, рН 5,5, вода/н-пропанол в соотношении 1:1.
Сорбент: Zorbax Pro 10, С8, 10 мкм, фирмы Du Pont.
Размеры колонки: 5 см х 25 см.
Элюируют 7,5 г HI, полученного расщеплением трифторуксусной кислотой человеческого инсулина-В30-ди-трет-бутилтреонинового эфира/эфир, в 100 мл раствора 0,1 моль глицина/соляная кислота с помощью насоса и при скорости подачи 80 мл/мин. Концентрация буфера Б повышается в течение 60 мин до 18-25% время удерживания составляет около 37 мин. Из основной фракции можно выделить после кристаллизации и сушки до 96,8% HI от введенного количества со степенью чистоты менее 50%
П р и м е р 5.
Буфер A: 0,2 моль сульфата натрия, 0,1 моль глицина, 0,03 моль ацетата аммония, рН 5,5, 10%-ный метилацетат.
Буфер Б: 0,05 моль сульфата натрия, 0,1 моль глицина, 0,03 моль ацетата аммония, рН 5,5, 20%-ный метилацетат.
Сорбент: Kromasil C8, 13 мкм, размер пор 100  , фирмы ЕКА Nobel.
, фирмы ЕКА Nobel.
Размеры колонки: 5 см х 25 см.
Вводят инсулин крупного рогатого скота в количестве 8 г на 1 л объема колонки с помощью буфера, состоящего из 0,1 моль глицина/соляная кислота и уравновешенного 30% -ным раствором буфера Б. В течение 90 мин концентрация буфера Б увеличивается до 80% (= 18% метилацетата). Инсулин крупного рогатого скота, элюированный после 65 мин, со степенью чистоты более 97,5% в основной фракции (выход 63,5%) осаждают хлоридом цинка после разбавления водой. Общее содержание белка составляет 92,5%
П р и м е р 6.
Буфер A: 0,1 моль сульфата аммония, 0,1 моль глицина, 0,025 моль ацетата натрия, рН 5,5, 5% н-пропанола.
Буфер Б: 0,05 моль сульфата аммония, 0,1 моль глицина, 0,025 моль ацетата натрия, рН 5,5 вода/н-пропанол в соотношении 1:1.
Сорбент: Kromasil С8, 13 мкм, 100  размер пор, фирмы ЕКА Nobel.
размер пор, фирмы ЕКА Nobel.
Размеры колонки: 5 см х 25 см.
Заполнение колонки состоит из 4 г человеческого инсулина( 8 г/л), полученного расщеплением трифторуксусной кислотой человеческого инсулина-В30-ди-трет-бутилтреонинового эфира/эфир, со степенью чистоты около 92% Градиент 18-25% буфера в течение 90 мин элюируют человеческий инсулин, после 45 мин в нем содержится инсулина со степенью чистоты более 97% в главной фракции (выход 91,8%) и 80,5% в побочной фракции (выход 4,7%).
П р и м е р 7.
Буфер A: 0,1 моль сульфата аммония, 0,1 моль глицина, 0,026 моль ацетата натрия, рН 5,5, 10% н-пропанола.
Буфер Б: 0,05 моль сульфата аммония, 0,1 моль глицина, 0,025 моль ацетата натрия, рН 5,5, вода/н-пропанол в соотношении 1:1.
Сорбент: Kromasil 0,8, 13 мкм, размер пор 100  , фирмы ЕКА Nobel.
, фирмы ЕКА Nobel.
Размеры колонки: 10 см х 40 см.
На колонку подают 18 г свиного инсулина в 1,8 л буфера из 0,1 моль глицина/соляная кислота, рН 3,0, с 5% н-пропанола. Градиент в течение 70 мин увеличивает содержание буфера Б от 9% (= 13,6% н-пропанола) до 11% (= 14,4% н-пропанола). Свиной инсулин элюируют после 50 мин с содержанием белка более 98% в основной фракции (выход 89%). Общее содержание белка составляет 96,8% от введенного.
П р и м е р 8.
Буфер А: 0,2 моль хлорида аммония, 0,1 моль глицина, 0,025 моль цитрата натрия, 5% н-пропанола, рН 5,5.
Буфер Б: как и буфер А, только добавка 50% н-пропанола.
Сорбент: Krоmasil С8, 13 мкм, размер пор 100  , фирмы ЕКА Nobel, Швеция.
, фирмы ЕКА Nobel, Швеция.
Размеры колонки: 50 мм х 250 мм.
4 г гентехнически полученного человеческого инсулина (89,5% доли белка) растворяют в буфере 0,1 моль глицина, рН 3,0, полученный 25-ный раствор белка подают насосом высокого давления на колонку. Элюирование происходит линейными градиентами от 13 до 16% н-пропанола в течение 70 мин при подаче 80 мл/мин. После фракционирования и кристаллизации получают в основной фракции человеческий инсулин с содержанием белка 98% и выходом 93% Общее содержание белка составляет 98% от введенного.
П р и м е р 9.
Буфер А: 0,2 моль сульфата аммония, 0,1 моль глицина, 0,025 моль цитрата аммония, 5% этанола, рН 5,5.
Буфер Б: как и буфер А, только добавка 50% этанола.
Сорбент: Kromasil С8, 10 мкм, размер пор 100  , фирмы ЕКА Nobel, Швеция.
, фирмы ЕКА Nobel, Швеция.
Размеры колонки: 50 мм и 250 мм.
В 250 мл буфера глицина, рН 3,0, растворяют 4,5 г гентехнически полученного человеческого инсулина (86,3% доли белка) и затем насосом подают на колонку. Для хроматографии белка создают с помощью двух насосов высокого давления линейный градиент из обоих буферов А и Б. Элюирование проводят через 100 мин при концентрации этанола 33% и постоянной подаче 80 мл/мин. После фракционирования и кристаллизации получают в основной фракции человеческий инсулин с содержанием белка 96% а общее содержание белка составляет 93% в пересчете на вводимый продукт.
П р и м е р 10.
Буфер А: 0,2 моль хлорида аммония, 0,1 моль глицина, 0,025 моль цитрата натрия, 10% метилацетата, рН 5,5.
Буфер Б: те же концентрации солей, что и в буфере А, только 20% метилацетата.
Сорбент: Kromasil С8, 10 мкм, размер пор 100  , фирмы ЕКА Nobel, Швеция.
, фирмы ЕКА Nobel, Швеция.
Для хроматографии растворяют 4,6 г сырого человеческого инсулина, полученного переработкой гентехнически созданного инсулина, в 200 мл водного буфера глицина и затем подают насосом на ВЭЖХ-колонку размером 50 х 250 мм. Материал колонки уравновешивают предварительно смесью буферов А и Б с помощью двух насосов высокого давления до концентрации метилацетата, равной 13% После этого проводят элюирование человеческого инсулина с помощью линейного градиента 13-17% метилацетата в течение 90 мин. Выделение основного продукта происходит путем кристаллизации из элюата. При этом получают 3,8 г человеческого инсулина с долей белка 96% Общее содержание белка составляет 90% в пересчете на исходный материал.
П р и м е р 11.
Буфер А: 0,2 моль сульфата аммония, 0,1 моль бетаина, 0,05 моль лимонной кислоты, рН 5,5 с помощью щелочи натрия, чисто водный.
Буфер Б: 0,1 моль сульфата аммония, 0,1 моль бетаина, 0,05 моль лимонной кислоты, рН 5,5 с помощью щелочи натрия (вода/изо-пропанол в соотношении 1: 1).
Cорбент: Nucleosil С18, 15-25 мкм, сферические, 100  .
.
Колонка: 40 мм х 250 мм.
Подача: 45 мл/мин.
Колонку заполняют 3 г (79% доли белка) человеческого инсулина, полученного эфирным расщеплением человеческого инсулина-ди-трет-бутилового эфира/эфир, в виде 3%-ного раствора в буфере 0,1 моль бетаина/соляная кислота, рН 3,0, при помощи насоса высокого давления. Затем элюируют вышеописанной системой буферов при 44% буфера Б. Время удерживания составляет около 35 мин. После фракционирования получают в основной фракции 98,1% человеческого инсулина с выходом 80,5% Общее содержание белка 90,5%
П р и м е р 12.
Буфер А: 0,1 моль сульфата аммония, 0,1 моль глутаминовой кислоты, 0,05 моль лимонной кислоты, рН 5,45 с помощью щелочи натрия, чисто водный.
Буфер Б: 0,1 моль сульфата аммония, 0,1 моль глутаминовой кислоты, 0,05 моль лимонной кислоты, рН 5,5 с помощью щелочи натрия (вода:н-пропанол 1:1).
Сорбент: Nucleosil С18-Р, 15-25 мкм, сферические, 100  .
.
Колонка: 50 мм х 250 мм.
Подача: 60 мл/мин.
Колонку заполняют 6 г человеческого инсулина (73% доли белка), полученного эфирным расщеплением человеческого инсулина-ди-трет-бутилового эфира/эфир, в виде 3%-ного раствора в 0,1 моль уксусной кислоты, рН 3,0, с помощью насоса высокого давления. Затем элюируют вышеописанной системой буферов при 25-28% буфера Б в градиенте. Время удерживания составляет около 25 мин. После фракционирования получают в основной фракции 98,6% человеческого инсулина с 65% выходом. Общее содержание белка составляет 88,5%
П р и м е р 13.
Буфер А: 0,15 моль сульфата аммония, 0,10 моль триэтиламина, рН 6,5 с помощью серной кислоты, чисто водный.
Буфер Б: 0,08 моль сульфата аммония, 0,05 моль триэтиламина, рН 6,5 с помощью серной кислоты (вода:2-пропанол 1:1).
Сорбент: Nucleosil С18-Р, 15-25 мкм, сферические, 100  .
.
Колонка: 50 мм х 250 мм.
Подача: 60 мл/мин.
После заполнения колонки 5 г человеческого инсулина, полученного расщеплением трифторуксусной кислотой человеческого инсулина-ди-трет-бутилтреонинового эфира/эфир, в 3%-ном растворе элюируют между 32 и 42% буфера Б. Время удерживания равно 40 мин. После фракционирования и кристаллизации получают 72% в основной фракции со степенью чистоты 92,7% Общее содержание белка составляет 76% от введенного количества.
П р и м е р 14.
Буфер А: 0,1 моль лимонной кислоты, 0,2 моль сульфата аммония, рН 2,5 с помощью соляной кислоты, чисто водный.
Буфер Б: 0,1 моль лимонной кислоты, 0,1 моль сульфата аммония, рН 2,5 с помощью соляной кислоты, вода:н-пропанол 1:1.
Сорбент: Nucleosil С18, фирмы Macherey *Nagel
Колонка: 40 х 250 мм.
Подача: 45 мл/мин.
После заполнения колонки 3 г человеческого инсулина, полученного расщеплением трифторуксусной кислотой человеческого инсулина-ди-трет-бутилтреонинового эфира/эфир, в виде 3%-ного раствора в буфере 0,1 моль глицина с рН 3,0 элюируют между 34 и 35% буфера Б. Время удерживания равно 45 мин. После фракционирования, кристаллизации и сушки выделяют 57% от введенного количества в основной фракции со степенью чистоты 94,8% и 16% в побочной фракции (степень чистоты 84%).
П р и м е р 15.
Буфер А: 0,1 моль лимонной кислоты, 0,2 моль сульфата аммония, рН 3,5 с помощью соляной кислоты, чисто водный.
Буфер Б: 0,1 моль лимонной кислоты, 0,1 моль сульфата аммония, рН 3,5 с помощью соляной кислоты, вода:н-пропанол 1:1.
Сорбент: Nucleosil C18, фирмы Macherey *Nagel.
Колонка: 40 х 250 мм.
Подача: 45 мл/мин.
Заполнение колонки происходит, как в примере 14. Время удерживания около 40 мин. После фракционирования, кристаллизации и сушки получают 51% от введенного количества человеческого инсулина со степенью чистоты 97,5% в основной фракции и 4% в побочной фракции (68% степень чистоты).
П р и м е р 16. Буфер А: 0,1 моль Трис, 0,1 моль глицина, 0,1 моль хлорида аммония, рН 8,5 с помощью соляной кислоты, чисто водный.
Буфер Б: 0,1 моль Трис, 0,1 моль глицина, 0,1 моль хлорида аммония, рН 8,5 с помощью соляной кислоты, вода:н-пропанол1:1.
Сорбент: Kromasil С8, 13 мкм, 100  .
.
Колонка: 50 мм х 250 мм.
Подача: 60 мл/мин.
Колонку, уравновешенную 33%-ным буфером Б, заполняют 6 г человеческого инсулина, полученного расщеплением трифторуксусной кислотой (пример 14), в виде 3% -ного раствора в буфере 0,1 моль Трис, рН 8,5. Элюирование проводят через 35 мин. После фракционирования и кристаллизации получают основную фракцию 96,6%-ного человеческого инсулина с выходом 86% Общее содержание белка 95%
П р и м е р 17.
Буфер А: 0,1 моль хлорида аммония, 0,025 моль лимонной кислоты, рН 5,5 с помощью аммиака, 50 об. н-пропанола.
Сорбент: Kromasil С8, 13 мкм, 100  .
.
Колонка: 50 мм х 250 мм.
Поток: 60 мл/мин.
Колонку заполняют, как описано, 6 г человеческого инсулина, полученного расщеплением трифторуксусной кислотой (пример 14). Градиент устанавливается с содержанием 21-25% буфера Б в течение 60 мин. Затем элюируют инсулин, время удерживания 40 мин. Основная фракция содержит 91% от введенного продукта со степенью чистоты 97,5% Общее содержание белка 96%
П р и м е р 18.
Буфер А: 0,1 моль хлорида калия, 0,025 моль лимонной кислоты, рН 5,5 с помощью щелочи калия, 5 об. н-пропанола.
Буфер Б: 0,1 моль хлорида калия, 0,025 моль лимонной кислоты, рН 5,5 с помощью щелочи калия 50 об. н-пропанола.
Сорбент: Kromasil С8, 13 мкм, 100  .
.
Колонка: 50 мм х 250 мм.
Поток: 60 мл/мин.
Заполнение и градиент, как в примере 17. Элюирование проводят через 35 мин. Основная фракция содержит 90% введенного количества человеческого инсулина со степенью чистоты 96,5% Общее содержание белка 93%
В примерах 19-24 хроматографию проводят при равных условиях, как в примере 14. Изменяется только буфер или количество амфотерных ионов.
П р и м е р 19.
Буфер А: 0,15 моль сульфата аммония, 0,1 моль триэтиламина, рН 7,0 с помощью серной кислоты.
Буфер Б: 0,08 моль сульфата аммония, 0,05 моль триэтиламина, рН 7,0 с помощью серной кислоты.
Результат: 95,2% чистоты основной фракции, 67% выход основной фракции.
П р и м е р 20.
Буфер, как в примере 16, только без 0,1 моль глицина.
Результат: 96,1% чистоты в основной фракции, 65% выход основной фракции и 25% в побочной фракции.
П р и м е р 21.
Буфер, как в примере 15, но с дополнительно введенным 0,1 моль глицином.
Результат: 96% чистоты в основной фракции, 66% выход в основной фракции и 6% выход в побочной фракции.
П р и м е р 22.
Буфер А: 0,1 моль хлорида аммония, 0,025 моль лимонной кислоты, рН 4,5 с помощью аммиака, 5 об. н-пропанола, 0,1 моль глицинбетаина.
Буфер Б: как буфер А, но дополнительно 50% н-пропанола.
Результат: 98,1% чистоты в основной фракции, выход в основной фракции 88 и в побочной 6%
П р и м е р 23.
Буфер, как в примере 22, но рН 5,4 и 0,1 моль глицина вместо глицинбетаина.
Результат: 97,9% чистоты в основной фракции, выход в основной фракции 92% и в побочной 8%
П р и м е р 24.
Буфер, как в примере 13, но рН 6,0 и дополнительно 0,1 моль глицина.
Результат: 94,3% чистоты в основной фракции, выход в основной фракции 77% и в побочной 13%
П р и м е р 25.
Табл. 1 дает представление о выходе и чистоте инсулинов в зависимости от значения рН и/или амфотерных ионов в элюате.
Аминокислотные последовательности указанных в примерах инсулинов соответствуют формуле (1) со значениями функциональных групп, указанными ниже в табл.2.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКООЧИЩЕННОГО МОНОКОМПОНЕНТНОГО ИНСУЛИНА | 2000 |
|
RU2186581C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКООЧИЩЕННОГО КРИСТАЛЛИЧЕСКОГО ИНСУЛИНА ЛЮБОГО ПРОИСХОЖДЕНИЯ | 2011 |
|
RU2453331C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ГОТОВОЙ ЛЕКАРСТВЕННОЙ ФОРМЫ ИНСУЛИНА КОРОТКОГО ДЕЙСТВИЯ | 2002 |
|
RU2261107C2 |
| СЛОЖНЫЕ ЭФИРЫ ЦИКЛОГЕКСАНОЛА И СОДЕРЖАЩИЙ ИХ ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1995 |
|
RU2135465C1 |
| ГЛИКОПЕПТИДЫ И ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ, ОБЛАДАЮЩИЙ АНТИБИОЦИДНЫМ ДЕЙСТВИЕМ | 1992 |
|
RU2099349C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ГОТОВОЙ ЛЕКАРСТВЕННОЙ ФОРМЫ ИНСУЛИНА ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ | 2002 |
|
RU2252782C2 |
| СПОСОБ УВЕЛИЧЕНИЯ СРОКА ЭКСПЛУАТАЦИИ СОРБЕНТА ПРИ ПРОМЫШЛЕННОЙ ОЧИСТКЕ ГЕННО-ИНЖЕНЕРНОГО ИНСУЛИНА ЧЕЛОВЕКА | 2008 |
|
RU2383624C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОМБИНИРОВАННОГО ПРЕПАРАТА ИНСУЛИНА ЧЕЛОВЕКА | 2002 |
|
RU2261108C2 |
| Способ получения протеолитического препарата для медицинского применения | 2015 |
|
RU2610669C1 |
| ИНСУЛИН И ЕГО ПРОИЗВОДНЫЕ С ПОВЫШЕННОЙ СПОСОБНОСТЬЮ СВЯЗЫВАТЬ ЦИНК | 1997 |
|
RU2176646C2 |

Использование: биотехнология, очистка белков. Сущность изобретения: предлагается способ очистки инсулина и/или его производных путем хроматографии в водных буферных растворителях, которые содержат органические, смешивающиеся с водой растворители, на липофильно модифицированном силикагеле, причем водные буферные растворители имеют в своем составе амфотерные ионы или значение pH смеси растворителей находится вблизи изоэлектрической точки очищаемого инсулина или его производного и присутствуют амфотерные ионы. Способ позволяет сохранить биологическую активность очищаемых белков, ускорить и упростить процесс очистки. 6 з. п. ф-лы, 2 табл.
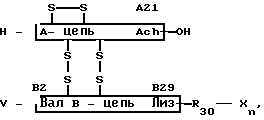
в котором R30 остаток генетически кодированной L-аминокислоты;
Х гидроксигруппа, физиологически инертная органическая группа основного характера с С1 С50, генетически кодированная L-аминокислота и имеющая стоящую в конце свободную карбоксилфункциональную группу, как, например, эфирную, амидную группу лактона или восстановленную до СН2ОН группу;
n целое число от 0 до 10;
Y водород или L-фенилаланин;
А- и В-цепи ряды животного или человеческого инсулина.
в котором R30 L-аланин или L-треонин;
Х одна или несколько L-аминокислот из группы, включающей L-аргинин, L-лизин или L-фенилаланин.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Патент США N 4129560, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-06-19—Публикация
1991-09-03—Подача