Предложенное изобретение касается новых гликопептидов и их применения.
Известно большое количество гликопептидных антибиотиков. Однако большинство этих антибиотиков менее эффективно, чем простейшие типы гликопептидов и торговый продукт ванкомицин, и предписаны in vivo (см. R.Nagarajan, Antimicrobial Agents and chemotherapy апрель 1991, с. 605-609).
Хотя ванкомицин используется при инфекционных заболеваниях, которые вызваны грамм-положительными возбудителями, он вызывает ряд тяжелых побочных действий, как, например, так называемый "красный синдром", образование некрозов и другие, что сильно ограничивает его применение. Другим очень эффективным гликопептидным антибиотиком является балимицин (см. EP N 0486504).
Неожиданно было обнаружено, что соединения, родственные с бальхимицином, могут стать более эффективными в качестве антибиотиков, причем побочные действия, наблюдаемые в случае ванкомицина, не имеют места или проявляются в слабой форме.
В соответствии с этим предметом изобретения являются: дезметил-бальхимицин соединение формулы I (см. схему 1, приведенную после описания);
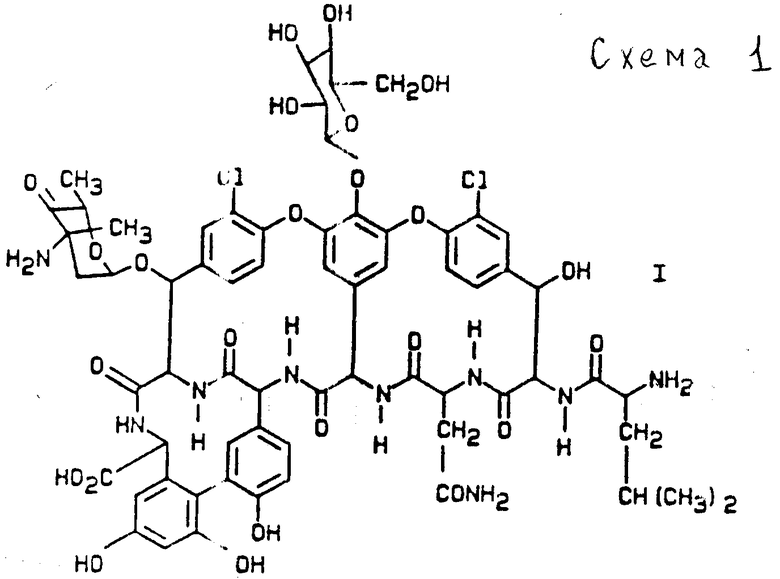
дез-метиллейцил-бальхимицин соединение формулы II (см. схему 2, приведенную после описания);
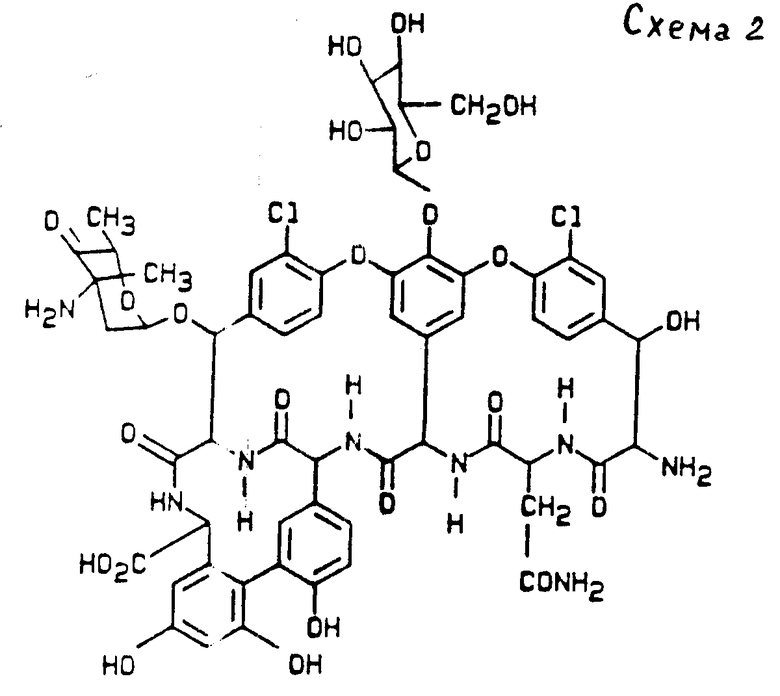
дез-глюко-бальхимицин соединение формулы III (см. схему 3);
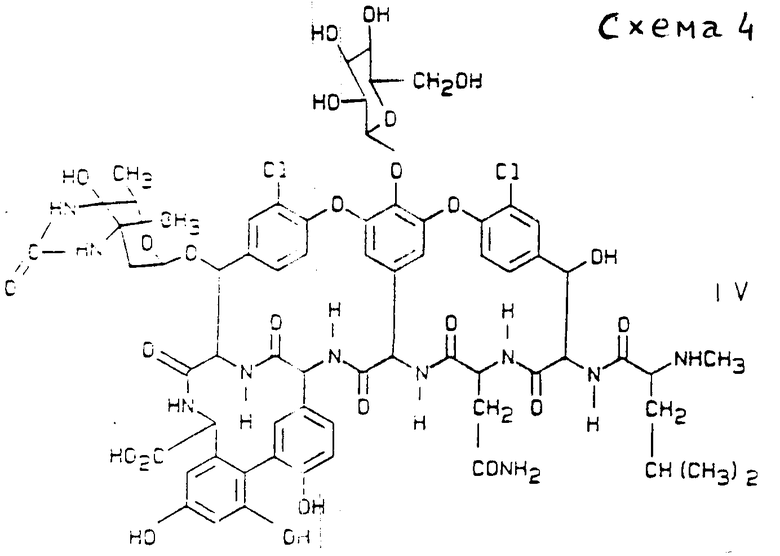
уреидо-бальхимицин соединение формулы IV (см. схему 4).
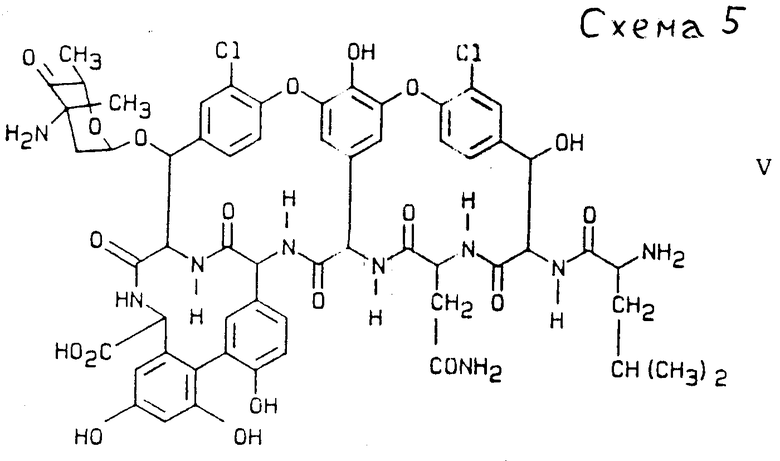
дез-метил-дез-глюко-бальхимицин соединение формулы V (см. схему 5).
метил-бальхимицин соединение формулы C67H75Cl2N9O24,
бальхимицин R соединение формулы C72H83Cl2N9O28 и
бальхимицин V соединение формулы C73H84Cl2N10O26, а также их гидраты и физиологически совместимые соли.
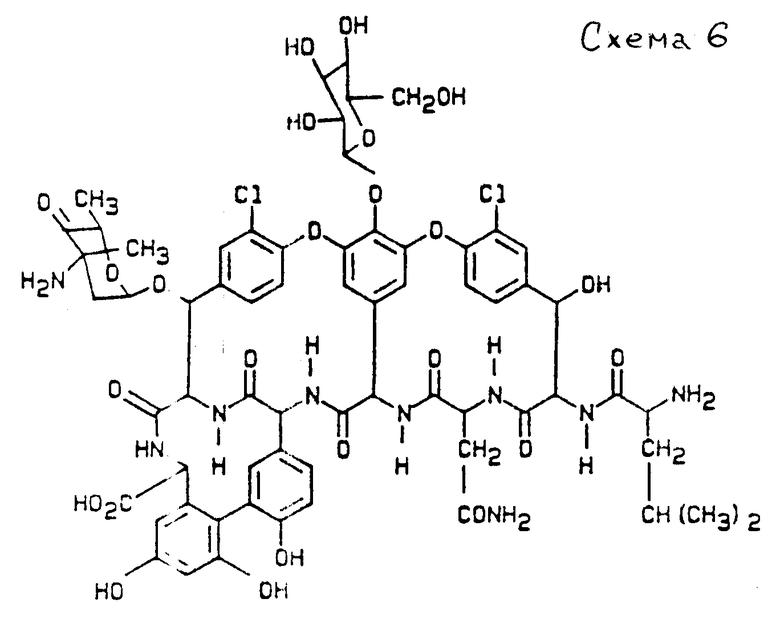
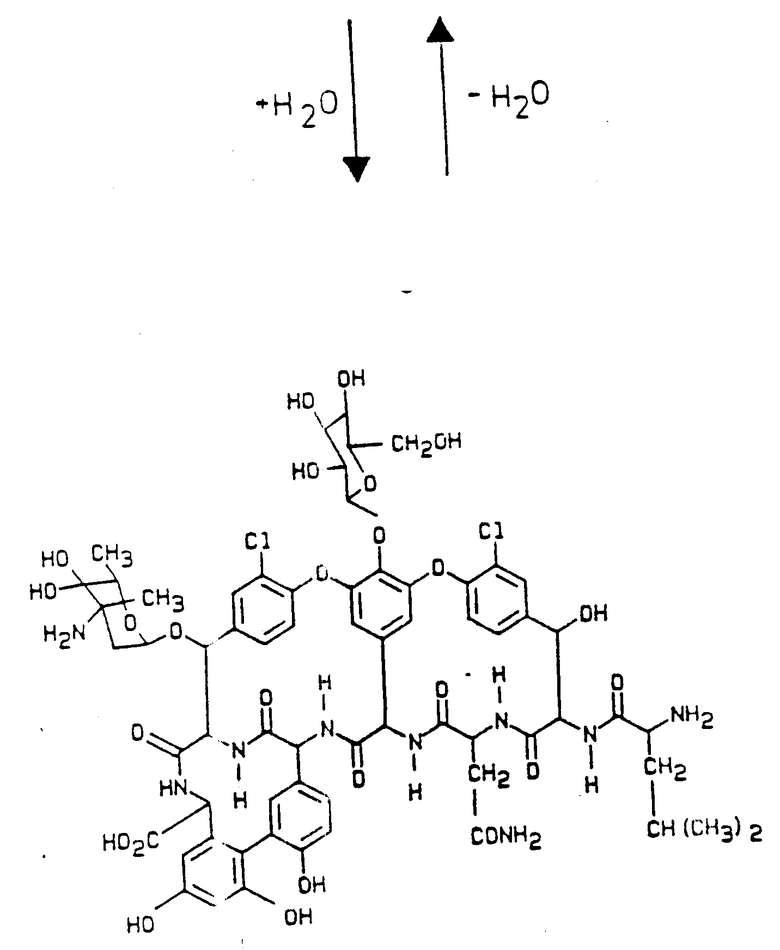
Гидраты названных соединений образуются под воздействием воды, как показано ниже на примере дез-метил-бальхимицина (см. схему 6).
Физиологически совместимые соли названных соединений, а именно ацетаты, гидрохлориды, фосфаты, сульфаты и пр. получают известными способами.
Кроме того, предметом изобретения является способ получения названных соединений. Способ получения названных соединений отличается тем, что культивируют микроорганизмы Actinomyces species Y-86, 21022 (DSM 5908) в водной питательной среде и непосредственно после этого выделяют целевое соединение и очищают его. Названный микроорганизм был оформлен 6 апреля 1990 по условиям будапештского договора.
Культивирование названного микроорганизма осуществляют как описано в вышеназванном европейском патенте в водной питательной среде, содержащей углеродные источники, источники азота и минеральные соли. Предпочтительные условия культивирования описаны в вышеназванном европейском патенте. Другие предпочтительные условия указаны в нижеприведенном примере.
При культивировании названного микроорганизма образуется в основном бальхимицин и лишь в незначительных количествах вышеназванные соединения. В результате варьирования состава питательной среды, в частности источника азота, можно достигнуть того, что соединения в соответствии с изобретением образуются в значительно больших количествах. Так, неожиданно было обнаружено, что добавление миллимолярной концентрации метионина, серина и пирувата подавляет образование бальхимицина. Если в качестве антагониста добавляют метионин, как, например, 1 ммоль α-метил-метионин, наблюдается явное увеличение выхода с сильным превалированием дезметилового компонента бальхимицина. Аллостерические ингибиторы метаболизма аспартата, как L-лизин или L-треонин, а также антагонисты лейцина также оказывают влияние на спектр продуктов.
Кроме того, на спектр продуктов штамма Actionomyces species Y-86, 21022 можно оказывать влияние с помощью генетических мер. Мутации известными мутагенами физического и химического типа в комбинации с подходящими методами селекции, например, антиметоболической устойчивостью, приводят к мутантам, которые производят целевые побочные компоненты в очень значительном количестве или исключительно их.
Разделение названных гликопептидов осуществляют предпочтительно с помощью катионообменников в буферной системе в большом количестве органического растворителя. Подходящими органическими растворителями являются, например, смешивающиеся с водой органические растворители, такие как низшие спирты, ацетон, ацетонитрил, гликоль, диоксан, диметилсульфоксид, формамид и подобные, а также водные растворы мочевины. Предпочтительными растворителями являются метанол, этанол, изопропанол и ацетон. Особенно выгодно содержание 5-95% органического растворителя в водных буферных растворах, в частности предпочтительно содержание от 25 до 85% Так как разделительный эффект улучшается с увеличением количества растворителя, практически целесообразно работать с количеством растворителя не менее 35%
Другая возможность разделения в технических масштабах состоит в том, что применяют "обратимую фазу" и подходящими мерами улучшают степень разделения. Такими мерами является применение добавок, таких как соли, например, фосфатный буфер и другие, или хаотропные вещества, как мочевина, KClO4, или другие агенты, как комплексообразователи, образователи ионной пары среди прочего в элюирующей смеси.
Альтернативной стадией выделения соединений в соответствии с изобретением является кристаллизация. При этом используют склонность к кристаллизации соединений в соответствии с изобретением вблизи изоэлектрической точки, их зависимость от смешиваемости растворителя в маточном растворе и от типа противоположных ионов. Например, соединения в соответствии с изобретением, находящиеся в водном растворе, доводят до кристаллизации путем добавления водорастворимого органического растворителя, как, например, этанол или изопропанол.
Или соединения, находящиеся в водном кислом растворе, доводят до кристаллизации путем увеличения значения pH, например, с помощью добавления NH3. Полученные кристаллические соединения как, например, уредо-бальхимицин, который кристаллизуется в нецентросимметричной пространственной группе PI с 2 молекулами в элементарной клетке и клеточной константе a 17,909 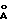 , b 18,466
, b 18,466 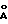 c 18,873
c 18,873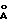 , α 96,65, b 114,15, g 114,78o, также относятся к предлагаемому изобретению.
, α 96,65, b 114,15, g 114,78o, также относятся к предлагаемому изобретению.
Другой способ получения дез-метиллейцил-бальхимицина состоит в том, что с бальхимицином или с дез-метил-бальхимицином проводят расщепление Эдмана (см. "Practical Protein Chemistry, A. Hand-book" A. Darbre, Seite 345, John Wiley Sohp, 1987).
Дополнительный способ получения дез-глюко-бальхимицина отличается тем, что с бальхимицином проводят гидролитическое расщепление. Особенно предпочтительным агентом гидролиза является 4 н. трифторуксусная кислота или более высококонцентрированная, в частности при несколько повышенной температуре.
Дополнительный способ получения дез-метил-дез-глюко-бальхимицина отличается тем, что с дез-метил-бальхимицином проводят гидролитическое расщепление. Особенно предпочтительным агентом гидролиза является 4 н. или более концентрированная трифторуксусная кислота, в частности при комнатной или слегка повышенной температуре.
Дополнительный способ получения уредо-бальхимицина отличается тем, что бальхимицин подвергают взаимодействию с изоцианатами, например калий-изоцианатом или с мочевиной. Эту реакцию проводят, например, в водной среде в широком pH-интервале, предпочтительно в интервале от 4 до 8.
Новые соединения в соответствии с изобретением близки с бальхимицином гликопептидным антибиотиком и структурно отделяются от него. Они могут быть охарактеризованы в отдельности:
а) Дез-метил-бальхимицин отличается тем, что соединение образуется с помощью штамма Y-86, 21022 (DSM 5908) и обладает следующими свойствами:
суммарная формула C65H71Cl2N9O24 определено с помощью FAB-масс-спектрометрии: M + H+ 1432,4, для изотопа:
12C65 1H71 36Cl214N9 16O24
Химический молекулярный вес: 1433,25 Da.
Аминокислотный анализ (после гидролиза в 5 М соляной кислоте при 100oC, 20 ч): аспарагиновая кислота, лейцин наряду с другими необычными нингидрин-положительными веществами.
УФ-максимум: 281 нм (Iog E 3,8).
Следовательно, дезметил-бальхимицин отличается от бальхимицина тем, что он содержит лейцин вместо N-метил-лейцина.
б) Дез-метиллейцин-бальхимицин отличается тем, что он получается с помощью штамма У-86, 21022 (DSM 5908) и обладает следующими свойствами:
суммарная формула C59H60Cl2N8O23 определено с помощью FAB-масс-спектрометрии: M + H+ 1319,3, для изотопа:
12C59 1H60 35Cl2 14N8 16O24
Химический молекулярный вес: 1320,08 Da.
Аминокислотный анализ (после гидролиза в 5 М соляной кислоте при 100oC, 20 ч): аспарагиновая кислота, наряду с необычными нингидрин-положительными веществами. Отсутствует: лейцин и N-метиллейцин.
УФ-максимум: 281 нм, (Iog E 3,8).
Дез-метиллейцин-бальхимицин отличается от бальхимицина тем, что отсутствует N-метиллейцин.
в) Дез-глюко-бальхимицин отличается тем, что образуется от актиномицетного штамма Y-86, 21022 (DSM 5908), и имеет следующие свойства:
суммарная формула C60H63Cl2N9O19 определено с помощью FAB-масс-спектрометрии: М + H+=1284,4 для изотопа:
12C60 1H63 35Cl214N8 16O19.
Химический молекулярный вес: 1285,12 Da.
Аминокислотный анализ (после гидролиза в 5 М соляной кислоте при 100oC, 20 ч): аспарагиновая кислота, N-метиллейцин наряду с необычными нингидрин-положительными веществами.
УФ-максимум: 279 нм, (IogE 3,8).
Дез-глюко-бальхимицин отличается от бальхимицина отсутствием остатка глюкозы.
г) Уреидо-бальхимицин отличается тем, что он образуется из актиномицетенового штамма Y-86, 21022 (DSM 5908) и имеет следующие свойства:
суммарная формула C67H74Cl2N10O25 определено с помощью FAB-масс-спектрометрии: М + H+=1489,4, для изотопа:
12C67 1H74 36Cl214N10 16O25.
Химический молекулярный вес 1490,20 Da.
УФ-максимум 280 нм (IogE 3,8).
Уреидо-бальхимицин является находящимся у C-атомов 3 и 4 дегидрованкозамина циклическим уреидом антибиотика бальхимицина.
д) Метил-бальхимицин отличается тем, что он образуется из актиномицетенового штамма Y-86, 21022 (DSM 5908) и имеет следующие свойства:
суммарная формула C67H75Cl2N9O24 определено с помощью FAB-масс-спектрометрии: М + H+=1460,45 для изотопа
12C67 1H75 35Cl2 14N9 16O24.
е) Бальхимицин P отличается тем, что он образуется из актиномецетенового штамма Y-86, 21022 (DSM 5908) и имеет следующие свойства:
суммарная формула C72H83Cl2N9O28 определено с помощью FAB-масс-спектрометрии: М + H+=1592,48 для изотопа
12C72 1H83 35Cl2 14N9 16O24
Химический молекулярный вес 1593,41 Da.
Уф-максимум: 280 нм (Iog E 3,8)
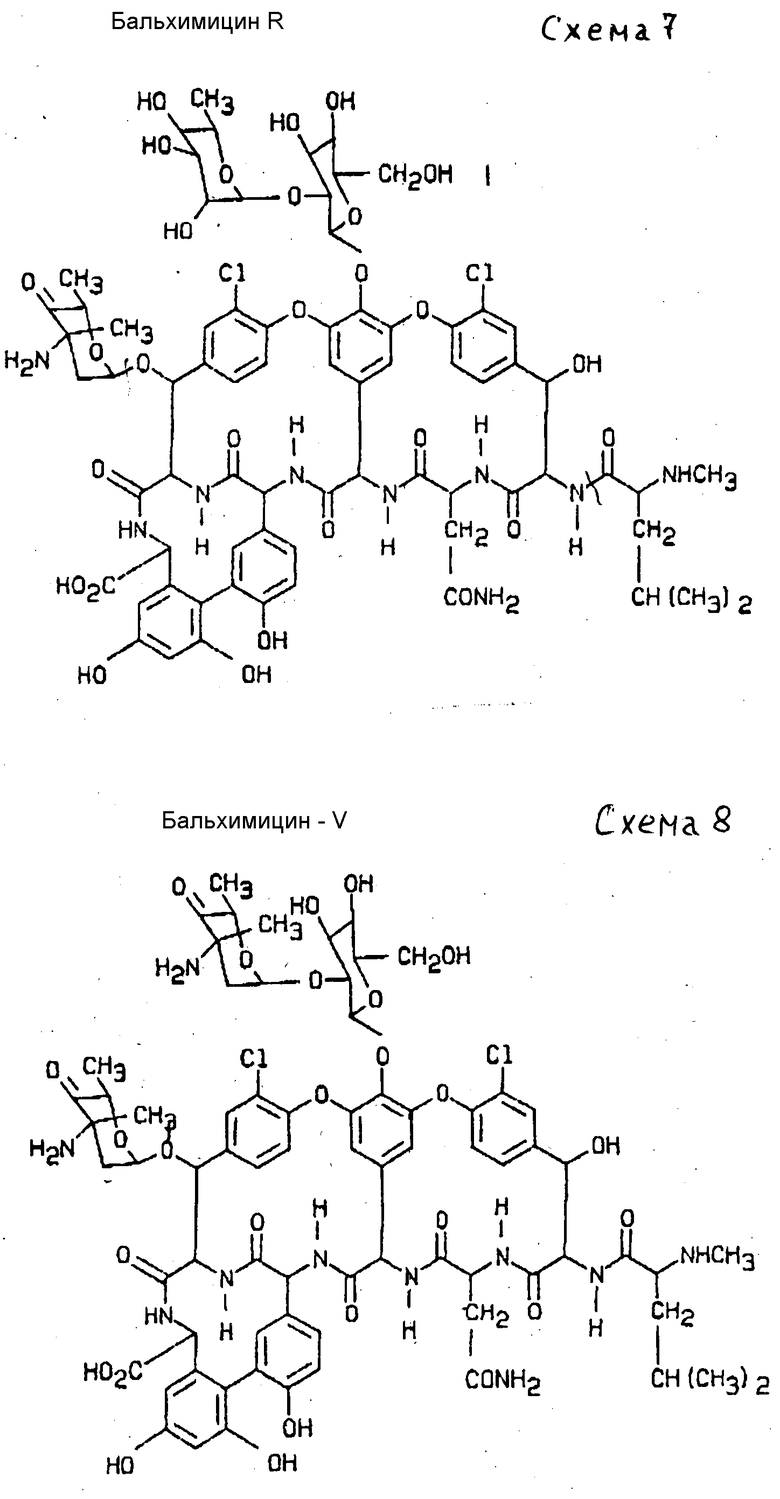
Бальхимицин R отличается от бальхимицина дополнительным остатком ромнозила.
ж) Дез-метил-дез-глюко-бальхимицин отличается тем, что он образуется из актиномицетенового штамма Y-86, 21022 (DSM 5908) и имеет следующие свойства:
суммарная формула C59H61Cl2N9O19 определено с помощью FAB-масс-спектрометрии: М + H+=1270,35 для изотопа
12C59 1H61 35Cl2 16O19.
Химический молекулярный вес 1271,09
УФ-максимум: 280 нм (IogE 3,8).
з) Бальхимицин Y отличается тем, что он получается из актиномицетенового штамма Y-86, 21022 (DSM 5908) и имеет следующие свойства:
суммарная формула C73H84Cl2N10O26 определено с помощью FAB-масс-спектрометрии: М + H+ 1587,60 для изотопа
12C73 1H84 35Cl2N10O26.
Химический молекулярный вес: 1588,44 Da.
УФ-максимум 280 нм (Iog E 3,8).
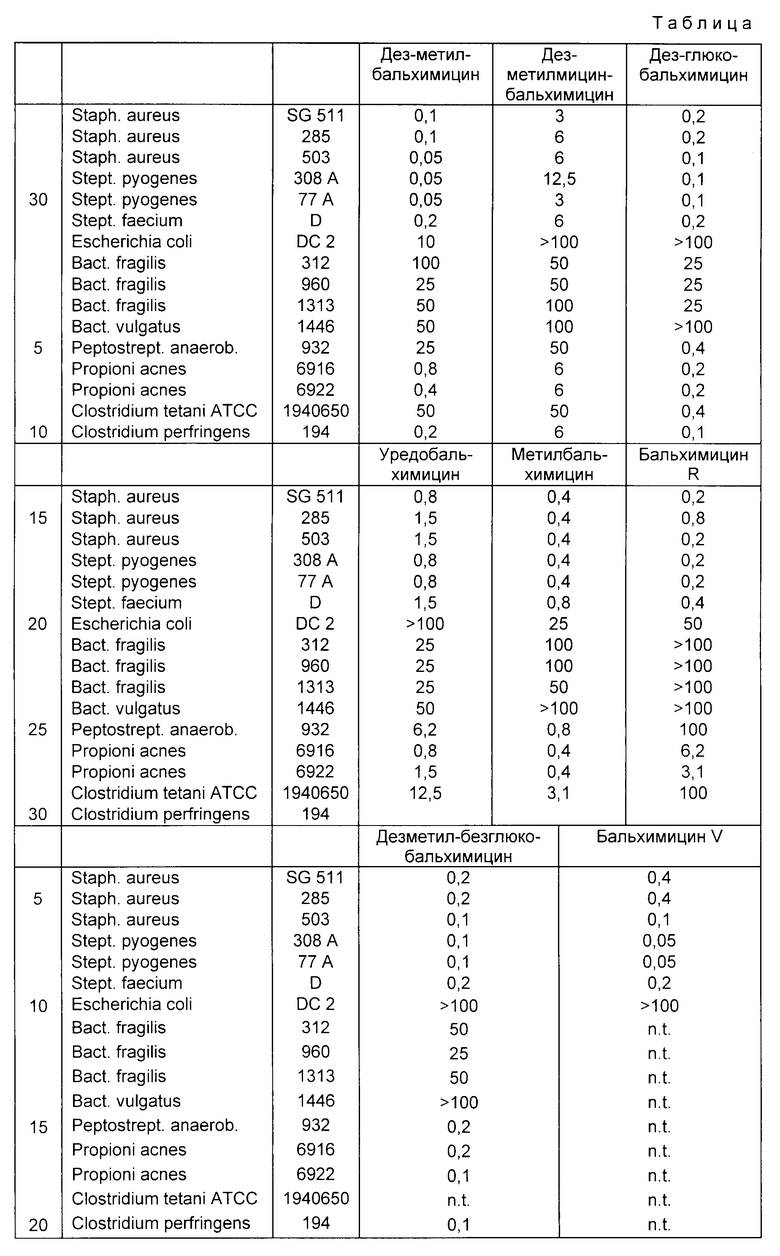
Бальхимицин Y отличается от бальхимицина дополнительным остатком 4-дегидро-ванкосаминила.
Соединения в соответствии с изобретением бесцветны, растворимы в воде или водных растворителях, которые очень стабильны в виде твердых веществ или в виде растворов.
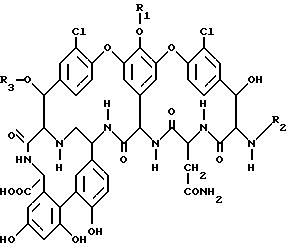
Нижеприведенная таблица показывает некоторые биологические характеристики:
минимальные бактериостатические концентрации торможения в микрограммах на миллилитр определяли с помощью метода разбавления агара.
Как видно из таблицы, соединения в соответствии с изобретением обладают, в частности, прекрасным действием против грамм-положительных бактерий, включая так называемый метициллин-устойчивый стафилококковый ауреус-штамм. Они пригодны поэтому, в частности, для лечения инфекционных заболеваний, которые были вызваны такими зародышами. Предметом изобретения являются поэтому также лекарственные препараты, содержащие эффективное количество соединения в соответствии с изобретением, а также применением соединений для получения лекарственных препаратов, в частности препаратов с действием в качестве антибиотиков: получение таких лекарственных препаратов осуществляют обычными известными способами.
Кроме того, соединения в соответствии с изобретением пригодны также для использования в качестве регуляторов роста в сельском хозяйстве.
Нижеприведенные примеры и содержание пунктов формулы изобретения поясняют подробнее предложенное изобретение.
Пример 1. Ферментация компонентов бальхимицина.
В качестве основной культуры ферментации служит питательный раствор (NL 5276). Он имеет следующий состав: глицерин 99% 20 г/л дистиллированной воды, сояпептон HySoy T 10 г/л, глюкоза 5 г/л, CaCO3 3 г/л, дрожжевой экстракт, оксоид 3 г/л, pH перед стерилизацией 7,0.
Субстраты, кроме глюкозы, при перемешивании вносят в 10 л воды и дополняют до объема 18 л. Значение pH перед стерилизацией устанавливают разбавлением 20-30%-ным NaOH, равным 7,0. Вышеуказанное количество глюкозы сепаратно растворяют в 1 л воды и стерилизуют 20 мин при 120oC в автоклаве и добавляют после охлаждения к стерилизованному раствору компонентов. Стерилизуют 45 мин при 120oC и давлении 1,2-1,4 бар. После охлаждения до рабочей температуры и после добавления раствора глюкозы ферментативный объем составляет около 20 л при значении pH около 7,0. C-ферментер прививают форкультурой в объеме 500-1000 мл, которую получают, как указано в патенте EP N 0468504 в примерах 2 и 3.
Условия ферментации: температура 28oC, пропускание воздуха 20 л/мин 1vvm, давление 0,5 бар, скорость вращения 250 об/мин.
В качестве антивспенивателя добавляют при потребности 5 мл соответственно 0,025% считая на ферментативный объем, ®дезмофен 3600 /полиолы, Байер АГ, Леверкузы/ в виде стерильной смеси воды и дезмофена.
Время ферментации составляет 96-120 с. Значение pH во время ферментации не меняют, однако культуру исследуют на стерильность, поглощение азота и образование продукта с помощью HPLC-хроматогрфии. После этого собирают урожай и клеточную массу отделяют центрифугированием.
Пример 2. Выделение бальхимицинового комплекса.
10 л фильтрата культур, полученных по примеру 1, вносят в колонну, заполненную предварительно приготовленным 1 л ®диаионом HP-20 (Митцубиси Хим. Инд. ). После этого заполненный носитель промывают обессоленной водой. Бальхимициновые компоненты элюируют градиентом, содержащим 0-50% изопропанола, и собирают фракционно жидкость после колонки. Фракции исследуют на антибиоцидную эффективность и определяют состав компонентов с помощью HPL-хроматографии. Сначала получают содержащие дез-метил-бальхимицин (I), затем бальхимицин (II) и наконец дез-метиллейцил-бальхимицин-обогащенные фракции. Их раздельно собирают и после испарения и осушки путем вымораживания получают 650 мг I, 1,1 г II и 380 г III продукта.
Пример 3. Ион-хроматографическое выделение дез-метил-бальхимицина.
Хроматографическую колонку объемом 100 мл заполняют ®фрактогелем EMD-SO3
катионообменником и устанавливают значение pH 4,8 25 ммол (буфер А) натрий-ацетатного буфера 66% метанола.
Затем 650 мг дез-метил-бальхимицин-содержащего антибиотика, полученного, например, в соответствии с примером 2, растворенных приблизительно в 100 мл буфера A, наносят на колонку и промывают 100 мл буфера A. В сборе и промывной воде находится антибиоцидно-активное, известное из литературы производное дез-дегидро-ванкомицина.
В заключение добавляют 0-200 ммол градиента хлористого натрия в буфер A, pH 5,0. 130-150 ммол NaCl элюируют бальхимицин через ионообменник, а 160-175 ммол раствора NaCl-дез-метил-бальхимицин. Соответствующие фракции диализируют соответственно от 1/100 М уксусной кислоты и сушат вымораживанием. Кристаллизация из водного раствора при добавлении этанола дает 210 мг ацетат бальхимицина с 98% -ной чистотой и 160 мг ацетата дез-метил-бальхимицина в 97%-ной чистотой.
Данные жидкостной хроматографии высокого давления (HLP): носитель ®лихросфер RP 18,5 мкм, 250 x 4 мм2, элюирующая система: 14% ацетонитрила в 0,1% -ной водной трифторуксусной кислоте, детекция: УФ-абсорбция при 210 нм, время удерживания: 8,3 мин, сравнивается с бальхимицином 10,0 мин, (D)
Пример 4. Получение чистого дез-метиллейцил-бальхимицина.
300 мг полученного по примеру 2 дез-метиллейцил-бальхимицин-содержащего продукта III в соответствии с примером 2 очищают дополнительно через 100 мл MCl-геля CHP20P (Мицубиси Хим. Инд.), в качестве буфера A служит однако 10 ммол K2HPO4, pH 7,6, в качестве буфера B применяют 10 ммол K2HPO4, pH 7,6 в 40% -ном метаноле. При градиентном элюировании собирают фракции, которые анализируют с помощью HPI-хроматографии. Дез-метиллейцил-бальхимицин-содержащие фракции с чистотой более 90% соединяют, испаряют в вакууме и обессоливают на возвратной фазе RP18, в 0,05%-ной системе трифторуксусная кислота/ацетонитрил. Осушка вымораживанием главной фракции дает 120 мг трифторацетата дез-метиллейцил-бальхимицина с чистотой 98%
Данные жидкостной хроматографии высокого давления (HIPC): носитель: ®лихросфер RP 18,5 мкм, 250 x 4 мм2, элюирующее средства: 14% ацетонитрила в 0,1% -ной водной трифторуксусной кислоте, детекция: УФ-абсорбция при 210 нм, время удерживания: 16,0 мин, сравнение с бальхимицином: 10 мин, (α)
Пример 5. Получение дез-глюко-бальхимицина и дез-метил-дез/глюко-бальхимицина.
300 мг полученного по примеру 2 продукта III растворяют в воде и вносят в препаративную, 500 мл HPL-хроматографическую колонку (250-2'), которая заполнена носителем ®нуклеозилом 1015 C18P (Махерей-Нагель, Дюрен). Затем элюируют градиентным способом 0,1%-ной трифторуксусной кислоты с 0-20% ацетонитрила. В то время, как сначала с 8-10% растворителя растворяется из носителя бальхимицина и дез-метиллейцин-бальхимицин, с 14-15% ацетонитрила промывается дез-метил-глюко-бальхимицин и дез-глюко-бальхимицин. Сушка вымораживанием фракций, содержащих дез-метил-дез-глюко- или дез-глюко-бальхимицин и их повторная хроматография в подобной же системе дает 1,3 мг трифторацетатной соли дез-глюко-бальхимицина и 4 мг трифторацетатной соли дез-глюко-бальхимицина.
Пример 6. Гидролитическое расщепление бальхимицина до дез-глюко-бальхимицина.
5 г бальхимицина, полученного в соответствии с EP N 0468504, пример 4, растворяют в 120 мл 4 М трифторуксусной кислоты и оставляют реагировать в течение ночи при 45oC. После этого растворитель удаляют в вакууме путем осушки вымораживанием. Концентрированный таким образом реакционный раствор растворяют в воде и разделяют на колонне с 800 мл MCl-геля CHP20P (Мицубиси Хим. Инд. ) градиентной системой с 0,1% уксусной кислоты, 0,1% уксусной кислоты в 50%-ном изопропаноле. Сначала элюируют бальхимицин и дез-амидо-бальхимицин из колонны, и затем дез-глюко-бальхимицин и, наконец, дез-амидо-дез-глюко-бальхимицин. Целевые фракции с чистотой более 90% собирают повторно, рехроматографируют и сушат вымораживанием. Они дают 1,3 г дез-глюко-бальхимицин-ацетата с чистотой 98,5%
Данные жидкостной хроматографии высокого давления (HPL): носитель: ®лихросфер RP 18,5 мкм, 250 x 4 мм2, элюирующее средство: 19% ацетонитрита в 0,1% -ной водной трифторуксусной кислоте, детекция: УФ-абсорбция при 210 нм, время удерживания: 10,0 мин, (α)
Пример 7. Получение уреидо-бальхимицина.
1 г сырого бальхимицина (II), полученного в соответствии с примером 2, растворяют в 25 мл воды, устанавливают добавлением уксусной кислоты значение pH 3,5 и вносят в колонну, предварительно заполненную при pH 3,5 ионообменником 150 мл фрактогелем EMD-SO3.
После нанесения промывают сначала 200 мл чистой воды, затем 200 мл 25 ммол буферного раствора ацетата натрия с pH 4,0 (буфер A).
Раствор, выходящий из колонки, содержит уреидо-бальхимицин, названный элюатом WP. И наконец, колонку элюируют смесью 0,1 ммол NaCl в 25 ммол ацетата натрия, pH 4,0. 20-30 ммол NaCl получают бальхимицин R (элюат R) с 30-70 ммол преимущественно бальхимицина (элюат B) и 80-100 ммол NaCl дез-метил, а также метил-бальхимицина (элюат M).
Для очистки уреидо-бальхимицина элюат WP подают в обратимую фазу колонки (нуклеозил 10-C18 AB/ 20 мм 11 x 250 мм высоты/ и разделяют градиентным способом системой 0,1% трифтороуксусная кислота) ацетонитрил, как описано в примере 5. Сушка вымораживанием фракций, содержащих уреидо-бальхимицин, дает 20 мг этого антибиотика в виде соли трифторацетата.
Данные жидкостной хроматографии высокого давления: носитель ®лихросфер RP 18,5 мкм, 250 x 4 мм2, элюирующая смесь: 14% ацетонитрила в 0,1%-ной водной трифторуксусной кислоты, детекция: УФ-абсорбция при 210 нм, время удерживания: 13,5 мин, сравнивают с бальхимицином: 10,0 мин, 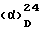 -26o (с 1% в воде).
-26o (с 1% в воде).
Пример 8. Получение метил-бальхимицина.
Элюат М, полученный по примеру 7, очищают на AB-колонке 20 мм x 250 мм (11 x H) с ®нуклеозидолом с помощью градиентной системы 10 ммол K2HPO4, pH 7,5 (45% метанола в 10 ммол K2HPO4, pH 7,5).
Раствор, выходящий из колонки, контролируют с помощью аналитической HPL-хроматографии, как описано ниже, собирают фракции, содержащие метил-бальхимицин, концентрируют их в вакууме и обессоливают их путем абсорбции ®MCI-гелем CHP 20 P в соответствии с примером 6. Сушка вымораживанием свободного от фосфора, чистого раствора антибиотика дает 11 мг ацетата метил-бальхимицина с чистотой 98%
Данные жидкостной хроматографии высокого давления: носитель: ®лихросфер RP 18,5 мкм, 250 x 4 мм2, элюирующая смесь: 14% ацетонитрила в 0,1%-ной водной трифторуксусной кислоте, детекция: УФ-абсорбция при 210 нм, время удерживания: 15,8 мин при сравнении с бальхимицином: 10,0 мин, 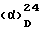 59o (с 1% в воде).
59o (с 1% в воде).
Пример 9. Гидролитическое расщепление дез-метил-бальхимицина до дез-метил-дез-глюко-бальхимицина.
100 мг дез-метил-бальхимицина, полученного в соответствии с примером 3, растворяют в 2 мл 90%-ной трифторуксусной кислоты и подвергают реакции 70 ч при комнатной температуре. Затем подвергают обработке в соответствии с примером 6. Получают 72 мг ацетата дез-метил-дез-глюко-бальхимицина с 98%-ной чистотой.
Данные жидкостной хроматографии высокого давления (HPL): носитель: ®лихросфер RP 18,5, 250 x 4 мм2, элюирующая смесь: 19% ацетонитрила в 0,1% -ной водной трифторуксусной кислоте, детекция: УФ-абсорбция при 210 нм, время удерживания: 9,1 мин.
Пример 10. Получение бальхимицина R (см. схему 7).
150 г полученного в соответствии с примером 7, обессоленного и высушенного вымораживанием элюата R повторно хроматографируют через такую же фрактогелевую колонну, как в примере 7. Полученный бальхимицин R с чистотой 79% очищают и обессоливают снова на возвратной фазе ®нуклеозил 10 RP18AB как в примере 7 в 0,1%-ной системе трифторуксусной кислоты. Высушенный вымораживанием антибиотик (52 мг) растворяют в 3 мл воды, медленно устанавливают значение pH 6 и после кристаллизации добавляют для растворения еще 0,6 мл этанола. После полной кристаллизации кристаллы центрифугируют, кристаллизат промывают этанолом и высушивают в вакууме. В результате получают 22 мг бальхимицина R с чистотой 99%
Данные жидкостной хроматографии высокого давления (HPL): носитель: ®лихросфер RP 18,5 мкм, 250 x 4 мм2, элюирующая смесь:14% ацетонитрила в 0,1% -ной водной трифторуксусной кислоте, детекция: УФ-абсорбции при 210 нм, время удерживания: 7,9 мин при сравнении с бальхимицином (10,0 мин).
Пример 11. Получение уреидо-бальхимицина из бальхимицина.
1500 мг бальхимицина, полученного в соответствии с EP N 0468504, растворяют в 60 мл воды, добавляют 162 мг цианата калия, устанавливают pH 6 и оставляют стоять раствор 2 ч. После этого разделяют смесь с помощью препаративной HPL-хроматографии в 0,1%-ной системе трифторуксусной кислоты на 500 мл-ой колонне с ®нуклеозилом 1015 C 18 P, 250-2". Собирают фракции, содержащие уреидо-бальхимицин, отделяют от бальхимицина, сушат вымораживанием и кристаллизуют из смеси вода/этанол при pH 5. Центрифугирование и сушка дают 1,3 г уреидо-бальхимицина с чистотой более 98%
Пример 12. Получение бальхимицина V (см. схему 8).
100 мл хроматографическую колонку заполняют катионообменником ®фрактогель EMD-SO3 и уравновешивают 25 ммол буфера аммоний-формиата, pH 4,2 (буфер A). Затем 1 г сырого бальхимицина (II), полученного по примеру 2, растворяют в 100 мл воды, устанавливают значение pH 4, вносят в колонну и дополнительно промывают 200 мл буфера A.
Непосредственно после этого добавляют в буфер A, pH 4 0,5 ммол градиента хлористого натрия. Сначала из колонны элюируется менее основной ряд антибиотика бальхимицина, 0,34-0,36 ммол раствором NaCl бальхимицина V. Соответствующее содержание бальхимицин V фракции собирают и, как описано в примере 6, обессоливают 100 мл RMCl-геля CHP 20 P и сушат вымораживанием. Получают 80 мг ацетата бальхимицина V.
Данные жидкостной хроматографии высокого давления (HPL): носитель: ®лихросфер RP, 18,5 мкм, 250 x 4 мм2, элюирующая смесь: 14% ацетонитрила в 0,1% -ной водной трифторуксусной кислоте, детекция: УФ-абсорбция при 210 нм, время удерживания: 10,3-10,4 мин в виде широкого пика, сравнивают с бальхимицином (10 мин).
Время удерживания продукта взаимодействия бальхимицина V с цианатом калия по примеру 10:12,4 мин. Сравнение с бальхимицином: 10 мин.
FAB-масс-спектр-: рассчитанная из всех молекул масса 15881 а.
ESI-масс-спектр-: рассчитанная из всех молекул-ионов массы. М.в. 1588 1а (форма дикетона), м.в. 1606 1а (моногидрат), м.в. 1624 1а (дигидрат).
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИБИОТИК БАЛИМИЦИН, СПОСОБ ПОЛУЧЕНИЯ АНТИБИОТИКА БАЛИМИЦИНА, ШТАММ ACTINOMYCETESSPECIES DSM 5908 - ПРОДУЦЕНТ БАЛИМИЦИНА | 1991 |
|
RU2043418C1 |
| ЛИПОПЕПТИДЫ, СПОСОБ ПОЛУЧЕНИЯ, ЛЕКАРСТВЕННОЕ СРЕДСТВО И ШТАММ ACTINOPLANES SP. DSM 7358 В КАЧЕСТВЕ ПРОДУЦЕНТА ЛИПОПЕПТИДОВ | 1994 |
|
RU2117672C1 |
| ПРОИЗВОДНЫЕ ЛИПОПЕПТИДА, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2141970C1 |
| СПОСОБ ОЧИСТКИ ИНСУЛИНА И/ИЛИ ЕГО ПРОИЗВОДНЫХ | 1991 |
|
RU2037500C1 |
| 3' И/ИЛИ 2'-АМИНО- ИЛИ ТИОЛМОДИФИЦИРОВАННЫЕ НУКЛЕОЗИДЫ, НУКЛЕОТИДЫ ИЛИ ОЛИГОНУКЛЕОТИДЫ, СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ | 1991 |
|
RU2073682C1 |
| ПРОИЗВОДНЫЕ ПЕПТИДОВ | 1992 |
|
RU2081880C1 |
| АЦИЛИРОВАННЫЕ НОНАДЕПСИПЕПТИДЫ В КАЧЕСТВЕ ПРОИЗВОДНЫХ ЛИЗОБАКТИНА | 2005 |
|
RU2414477C2 |
| СПОСОБ ФЕРМЕНТАТИВНОГО ПОЛУЧЕНИЯ ЦЕФАЛОСПОРИНА С | 1992 |
|
RU2094463C1 |
| КРИСТАЛЛИЧЕСКИЕ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ ЧИСТЫХ ДИАСТЕРЕОМЕРОВ 1-(2,2-ДИМЕТИЛПРОПИОНИЛОКСИ)-ЭТИЛОВОГО ЭФИРА 3-ЦЕФЕМ-4-КАРБОНОВОЙ КИСЛОТЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2073680C1 |
| ИМИДАЗО-АННЕЛИРОВАННЫЕ ИЗО- И ГЕТЕРОЦИКЛЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2076105C1 |
Использование: в медицине, как соединения, обладающие антибиоцидной активностью. Сущность изобретения: гликопептиды, представляющие собой группу из бальхимицина, дезметил-бальхимицина, деметиллейцил-бальхимицина, дез-глюкобальхимицина, уреидо-бальхимицина в кристаллической форме, а также лекарственный препарат, включающий в качестве активного вещества по крайней мере одно из перечисленных выше соединений в эффективном количестве. 2 с. и 2 з.п. ф-лы, 1 табл.
в которой R1 водород или радикалы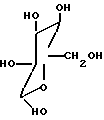
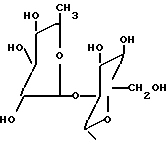
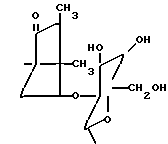
R2 -водород или радикалы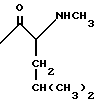
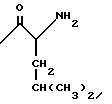
R3 радикалы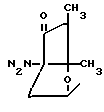
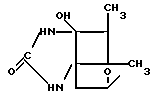
2. Гликопептиды по п.1, представляющие собой кристаллическую форму.
Приоритет по признакам.
Авторы
Даты
1997-12-20—Публикация
1992-06-26—Подача