Изобретение относится к производным акриловой кислоты, полезным в сельском хозяйстве (особенно в качестве фунгицидов, но также в качестве регуляторов роста растений, инсектицидов и нематоцидов), к процессам их получения, к сельскохозяйственным (особенно фунгицидной) композициям, содержащим их, и к способам использования их для борьбы с грибками, особенно грибковыми заражениями растений, для регулирования роста растений и для уничтожения или подавления насекомых и нематодных вредителей.
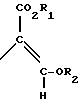
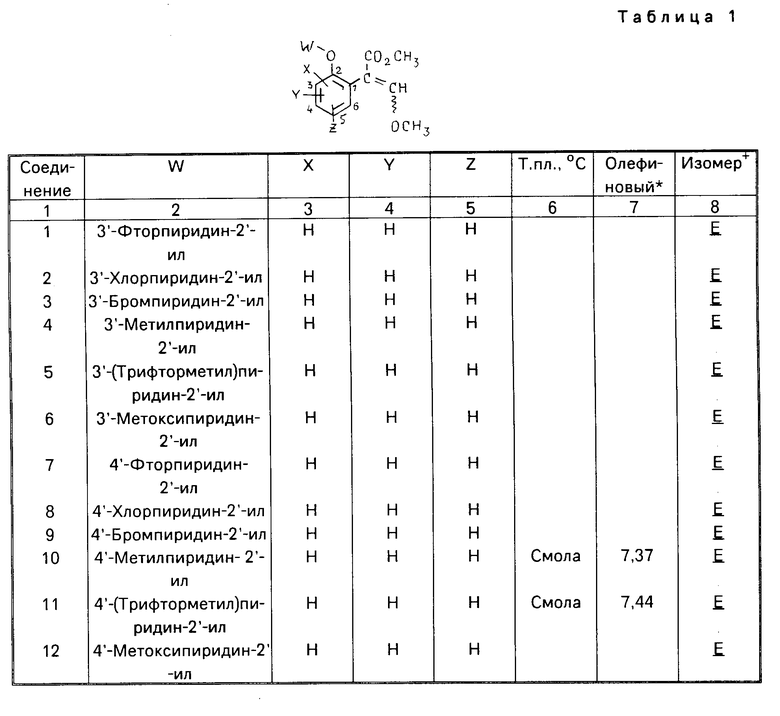
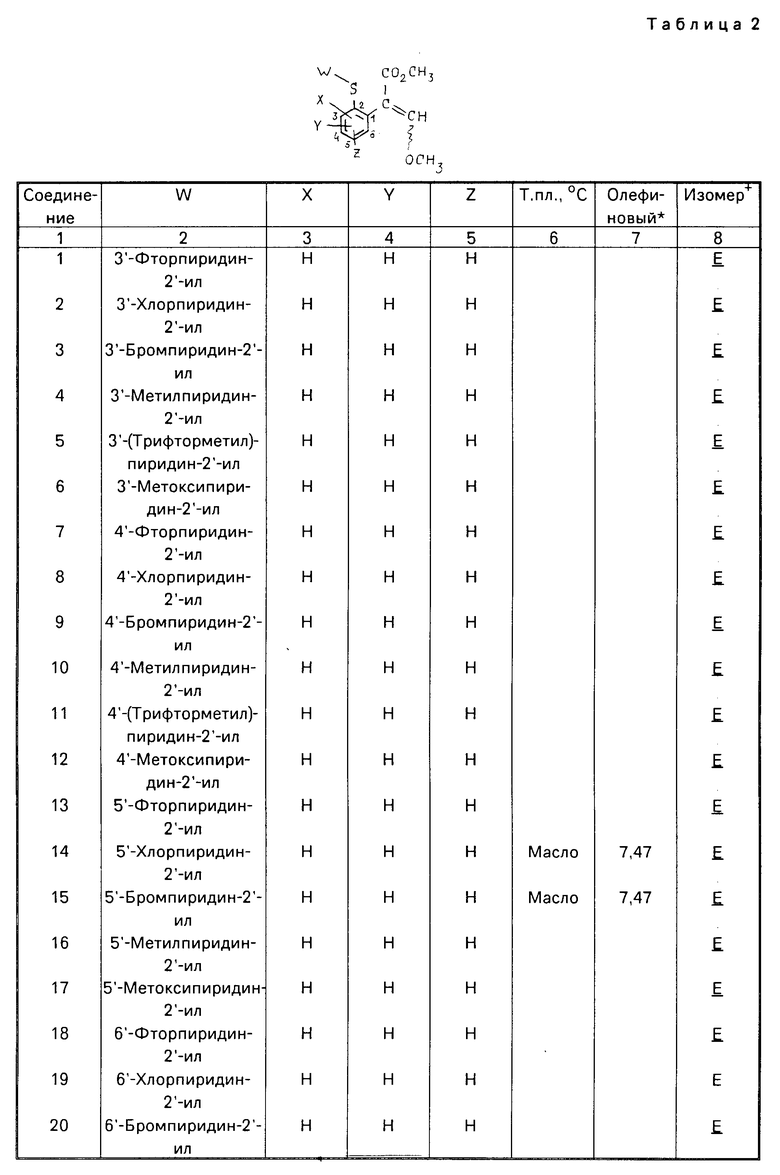
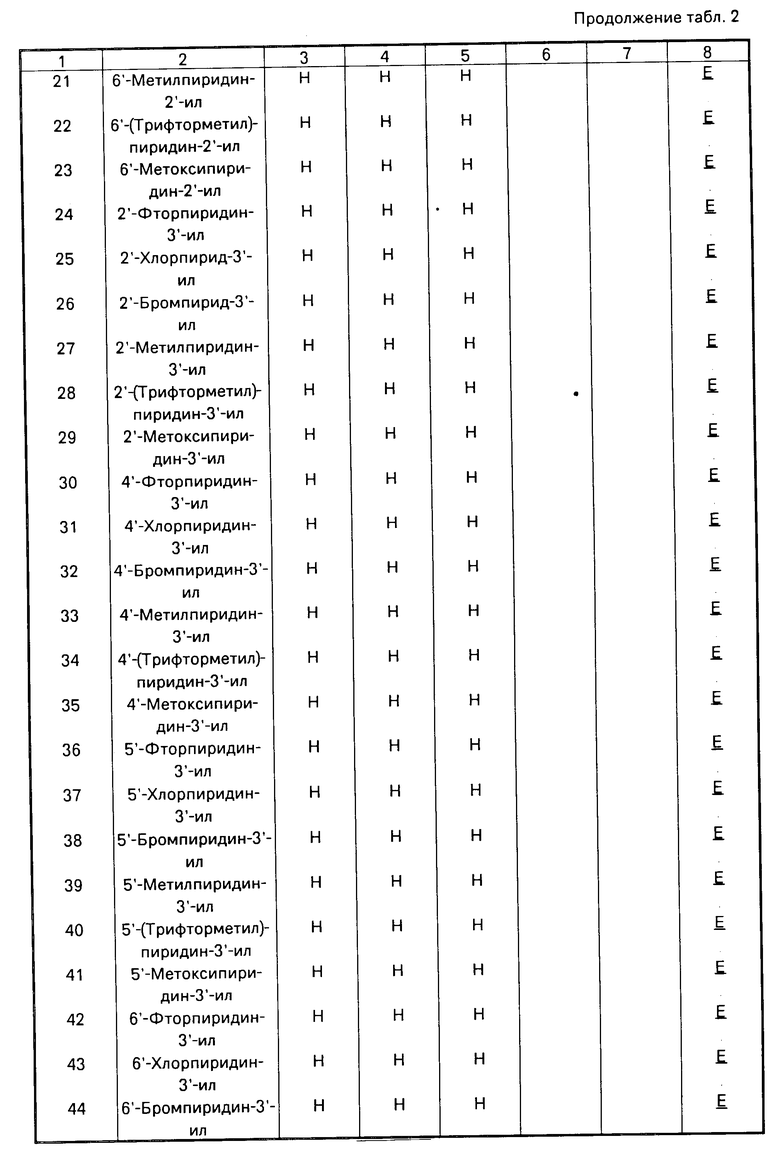
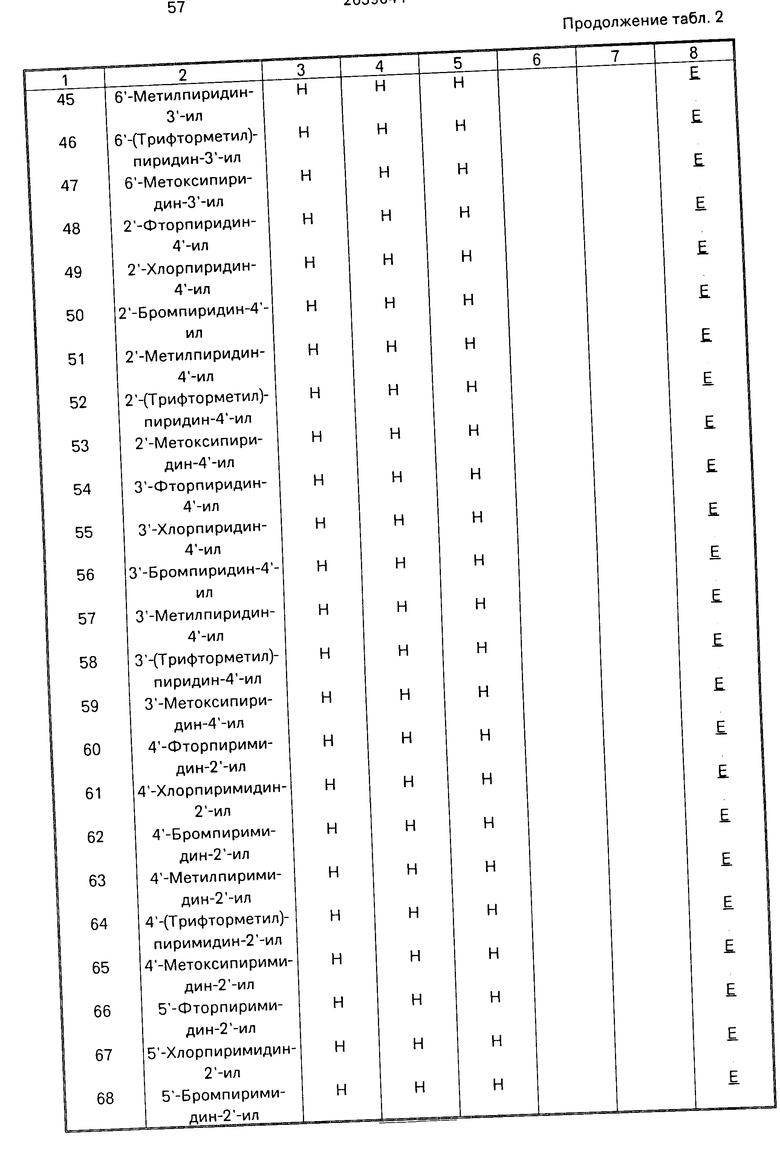
Изобретение представляет соединения, имеющие формулу 1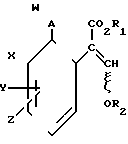 и их стереоизомерам, где W представляет собой замещенную пиридинильную или замещенную пиримидинильную группу, связанную с А с помощью любого из ее кольцевых атомов углерода; А представляет собой или кислород, или S/O/n, где n представляет собой 0,1 или 2; Х, Y и Z, которые являются одинаковыми или различными, представляют собой атомы водорода или галогена, или гидрокси, необязательно замещенную алкильную (включая галоидалкильную), необязательно замещенную алкенильную, необязательно замещенную алкинильную, необязательно замещенную алкокси, (включая галоидалкокси), необязательно замещенную алкилтио, необязательно замещенную арилокси, необязательно замещенную арилалкокси, необязательно замещенную ацилокси, необязательно замещенную амино, необязательно замещенную ациламино, нитро, циано, -СО2R3, -СОNR4R5, -COR6 или -S/O/mR7, где m представляет собой 0,1 или 2 группы, или любые две из групп Х, Y и Z, когда они находятся в смежных положениях на фенильном кольце, могут соединяться, образуя сконденсированное кольцо, или ароматическое или алифатическое необязательно содержащее один или более гетероатомов; R1 и R2, которые являются одинаковыми или различными, представляют собой необязательно замещенные алкильные (включая фторалкильные) группы, при условии, что, когда W представляет собой 5-трифторметилпиридин-2-ил, А не представляет кислород, Х представляет водород и R1 и R2 оба представляют метил, Y и Z не являются одновременно водородом, Y не является F, Сl, метилом, нитро, 5-CF3, 5-SCH3 или 4-/CH3/2N, если Z представляет собой водород, Y и Z вместе не являются 3-нитро-5-хлор, 3,5-динитро, 4,5-диметокси или 4,5-метилендиокси; и R3, R4, R5, R6 и R7, которые являются одними и теми же или различными, представляют собой атомы водорода или необязательно замещенные алкильные, необязательно замещенные циклоалкильные, необязательно замещенные циклоалкильные, необязательно замещенные алкенильные, необязательно замещенные алкинильные, необязательно замещенные арильные или необязательно замещенные аралкильные группы, и их комплексы с металлами.
и их стереоизомерам, где W представляет собой замещенную пиридинильную или замещенную пиримидинильную группу, связанную с А с помощью любого из ее кольцевых атомов углерода; А представляет собой или кислород, или S/O/n, где n представляет собой 0,1 или 2; Х, Y и Z, которые являются одинаковыми или различными, представляют собой атомы водорода или галогена, или гидрокси, необязательно замещенную алкильную (включая галоидалкильную), необязательно замещенную алкенильную, необязательно замещенную алкинильную, необязательно замещенную алкокси, (включая галоидалкокси), необязательно замещенную алкилтио, необязательно замещенную арилокси, необязательно замещенную арилалкокси, необязательно замещенную ацилокси, необязательно замещенную амино, необязательно замещенную ациламино, нитро, циано, -СО2R3, -СОNR4R5, -COR6 или -S/O/mR7, где m представляет собой 0,1 или 2 группы, или любые две из групп Х, Y и Z, когда они находятся в смежных положениях на фенильном кольце, могут соединяться, образуя сконденсированное кольцо, или ароматическое или алифатическое необязательно содержащее один или более гетероатомов; R1 и R2, которые являются одинаковыми или различными, представляют собой необязательно замещенные алкильные (включая фторалкильные) группы, при условии, что, когда W представляет собой 5-трифторметилпиридин-2-ил, А не представляет кислород, Х представляет водород и R1 и R2 оба представляют метил, Y и Z не являются одновременно водородом, Y не является F, Сl, метилом, нитро, 5-CF3, 5-SCH3 или 4-/CH3/2N, если Z представляет собой водород, Y и Z вместе не являются 3-нитро-5-хлор, 3,5-динитро, 4,5-диметокси или 4,5-метилендиокси; и R3, R4, R5, R6 и R7, которые являются одними и теми же или различными, представляют собой атомы водорода или необязательно замещенные алкильные, необязательно замещенные циклоалкильные, необязательно замещенные циклоалкильные, необязательно замещенные алкенильные, необязательно замещенные алкинильные, необязательно замещенные арильные или необязательно замещенные аралкильные группы, и их комплексы с металлами.
Соединения данного изобретения содержат, по крайней мере, одну углерод-углеродную двойную связь, и иногда получаются в форме смесей геометрических изомеров. Однако, эти смеси могут разделяться на индивидуальные изомеры; и данное изобретение охватывает такие изомеры и их смеси во всех соотношениях, включая смеси, которые состоят, по существу, из /Z/-изомера, и смеси, которые состоят в основном из /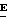 /-изомера.
/-изомера.
Индивидуальные изомеры, которые являются результатом несимметрично замещенной двойной связи акрилатной группы, обозначаются с помощью обычно используемых терминов "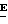 " и "
" и "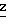 ". Эти термины определяются в соответствии с системой Cahn Ingold-Prelog, которая полностью описана в литературе (смотри, например, J. March. Advanced Organic Chemistry 3-е издание, Wiley-Jnterscience страница 109 и далее).
". Эти термины определяются в соответствии с системой Cahn Ingold-Prelog, которая полностью описана в литературе (смотри, например, J. March. Advanced Organic Chemistry 3-е издание, Wiley-Jnterscience страница 109 и далее).
Обычно, один изомер является более фунгицидно активным, чем другой; причем более активным является изомер, в котором группа -OR2, находится на той же стороне двойной связи, что и фенильное кольцо. В случае соединений настоящего изобретения им является /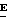 /-изомер. /
/-изомер. /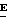 /-изомеры образуют предпочтительную группу соединений данного изобретения.
/-изомеры образуют предпочтительную группу соединений данного изобретения.
Формула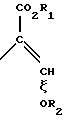 используемая здесь далее, означает разделяемую смесь обоих геометрических изомеров относительно акрилатной двойной связи, то есть
используемая здесь далее, означает разделяемую смесь обоих геометрических изомеров относительно акрилатной двойной связи, то есть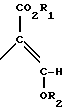
Алкильные группы, где бы они не присутствовали в виде группы или фрагмента, например, в радикалах "алкокси", "алкилтио" и "аралкил", могут быть в виде прямой или разветвленной цепей, и содержат предпочтительно 1-6, более предпочтительно 1-4, атомов углерода; примерами их являются метил, этил, пропил, /н- или изопропил/ и бутил /н-, изо- или трет-бутил/.
R1 и R2, которые являются необязательно замещенными алкильными группами, представляют собой предпочтительно незамещенные С1-С4, особенно С1-С2, алкильные группы. Предпочтительным заместителем является фтор, который может присутствовать в количестве одного или более атомов. Особенно предпочитается, чтобы R1 и R2 оба представляли собой метил, причем или одна или обе метильные группы необязательно замещены одним, двумя или тремя атомами фтора.
Атомы галогена, где бы на них не давалась ссылка, представляют собой особенно атомы фтора, хлора или брома, и особенно атомы фтора или хлора.
Циклоалкил представляет собой предпочтительно С3-С6 циклоалкил, например, циклогексил, и циклоалкилалкил представляет собой предпочтительно С3-С6 циклоалкил (С1-С4)алкил, например, циклопропилэтил. Алкенильные и алкинильные группы предпочтительно содержат 2-6, более предпочтительно 2-4, атома углерода в виде прямой или разветвленной цепей. Примерами их являются этенил, аллил и пропаргил. Арилом предпочтительно является фенил, а аралкилом предпочтительно является бензил, фенилэтил или фенил-н-пропил. Необязательно замещенный алкил включает в частности, галоидалкил, гидроксиалкил, алкоксиалкил, необязательно замещенный аралкил, особенно необязательно замещенный фенилалкил, и необязательно замещенный феноксиалкил; необязательно замещенный алкенил включает необязательно замещенный фенилалкенил, особенно необязательно замещен- ный фенилэтенил; необязательно замещенный арилокси включает необязательно замещенный фенилокси; и необязательно замещенный арилалкокси включает необязательно замещенный бензилокси. Необязательные заместители для "алкокси" и "алкилтио" включают заместители, описанные выше для "алкила".
Заместители, которые могут присутствовать в любом необязательно замещенном арильном или гетероарильном фрагменте, включают один или более из следующих: галоген, гидрокси, С1-С4 алкил (особенно метил или этил), С1-С4 алкокси (особенно метокси) галоид (С1-С4) алкил (особенно трифторметил), галоид (С1-С4) алкокси (особенно трифторметокси), С1-С4алкилтио (особенно метилтио), (С1-С4) алкокси (С1-С4) алкил, С3-С6циклоалкил, С3-С6 циклоалкил (С1-С4) алкил, арил (особенно фенил), арилокси( особенно фенилокси), арил (С1-С4) алкил (особенно бензил), фенилэтил и фенил-н-пропил-), арил С1-С4 алкокси (особенно бензилокси), арилокси (С1-С4) алкил (особенно фенилоксиметил), циклокси (особенно ацетилокси и бензоилокси), циано, тиоцианато, нитро, -NR1R11, -NHCOR1, -NHCONR1R11, -CONR1R11, -COOR1, -ОSO2R1, -SO2R1, -COR1, -OCOR1, -CR1=NR11 или -N=CR1R11, в которых R1 и R11 представляют собой независимо водород, С1-С4 алкил, С1-С4- алкокси,С1-С4 алкилтио, С3-С6циклоалкил, С3-С6 циклоалкил (С1-С4) алкил, фенил или бензил, причем фенильная и бензильная группы необязательно замещены галогеном, С1-С4алкилом или С1-С4 алкокси. Необязательно замещенные амино, ациламино и ацилокси группы включают группы -NR1R11, -NHCOR1 и -ОСОR1, в которых R1и R11 имеют вышеуказанные значения.
Заместители в замещенном пиридинильном или замещенном пиримидинильном кольце W, которые являются одинаковыми или различными, включают любое из значений, данных для Х, Y и Z. В частности, они включают атомы галогена, или гидрокси, необязательно замещенный алкил (включая галоидалкил), особенно С1-С4 алкил, необязательно замещенный алкенил, особенно С3-С4 алкенил, необязательно замещенный арил, необязательно замещенный алкинил, особенно С3-С4 алкинил, необязательно замещенный алкокси (включая галоидалкокси), особенно С1-С4 алкокси, необязательно замещенный арилокси, необязательно замещенный арилокси, необязательно замещенный гетероциклилокси (особенно гетероарилокси), необязательно замещенный арил, необязательно замещенный гетероциклил (особен- но 5- и 6-членные углерод-азотные кольца).
 нитро, циано, -NR1R11, -NHCOR1, -CONR1R11, -OCOR1, -CO2R1, CH= NOR11, CH2NR1R11, -CH2OR1, -CH2NHCOR1, -CH2ОCОR1 или S/O/mR1 /где m представляет собой 0, 1 или 2/ группы, или любые два из заместителей в пиридинильном или пиримидинильном кольцах, когда они находятся в соседних положениях в кольце, могут соединяться, образуя необязательно замещенное сконденсированное кольцо, или ароматическое или алифатическое, необязательно содержащее один или более гетероатомов; и R1, R2, R3, R4, R5, R6 и R7 имеют значения, определенные выше.
нитро, циано, -NR1R11, -NHCOR1, -CONR1R11, -OCOR1, -CO2R1, CH= NOR11, CH2NR1R11, -CH2OR1, -CH2NHCOR1, -CH2ОCОR1 или S/O/mR1 /где m представляет собой 0, 1 или 2/ группы, или любые два из заместителей в пиридинильном или пиримидинильном кольцах, когда они находятся в соседних положениях в кольце, могут соединяться, образуя необязательно замещенное сконденсированное кольцо, или ароматическое или алифатическое, необязательно содержащее один или более гетероатомов; и R1, R2, R3, R4, R5, R6 и R7 имеют значения, определенные выше.
Пиридины и пиримидины с гидроксильными заместителями в соответствующих положениях могут также существовать в соответствующих таутомерных оксо-формах, то есть в виде соответствующих пиридинов и пиримидонов, соответственно. Имеется в виду, что, когда в пиридинильном или пиримидинильном кольце W имеется гидрокси заместитель, настоящее изобретение включает все таутомерные формы и их смеси (смотри, например, G. R. Newkome и W. W. Pander, Contemporary Heterocyclic Chemistry, Wiley-Jnterscience страницы 236-241).
Предпочтительными замещенными гелоидалкильными и галоидалкокси группами являются С1-С4 алкильная и галоид (С1-С4) алкокси группа. Галоидалкил включает особенно тригалоидметил и особенно трифторметил (за исключением случаев, когда указаны иные).
Предпочтительными арильными группами или фрагментами (например, в виде фрагментов в арилокси группе) являются фенил, при этом заместителями в замещенной амино группе, или фрагменте являются предпочтительно С1-С4 алкил.
Предпочтительными гетероциклическими группами, или фрагментами (например, как в гетероциклиле или гетероциклилокси) являются, например, 2-; 3- или 4- необязательно замещенные пиридины, или 2-, 4- или 5- необязательно замещенные пиримидины.
В одном из частных аспектов данное изобретение представляет соединения, имеющие формулу 1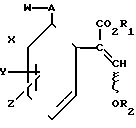 и их стереоизомеры, где W представляет собой замещенную пиридинильную или замещенную пиримидинильную группу, связанную с А с помощью любого из ее атомов углерода, и несущую заместители, определенные выше; А представляет собой или атом кислорода, или S/O/n, где n представляет 0, 1 или 2; Х, Y, Z, которые являются одними и теми же или различными, представляют собой атомы водорода, фтора, хлора или брома, С1-С4алкильные, С2-С5 алкенильные, С2-С5 алкинильные, фенильные, С1-С4галоидалкильные, С1-С4 алкокси, фенокси, бензилокси или моно- или диалкиламино группы, или любые две из групп Х, Y и Z, когда они находятся в соседних положениях в фенильном кольце, соединены, образуя сконденсированное ароматическое кольцо; где алифатические фрагменты любых из перечисленных выше групп необязательно замещены одной или более С1-С4 алкокси группами, атомами фтора, хлора или брома, фенильными кольцами, которые сами по себе являются необязательно замещенными,гетероциклическими кольцами, которые являются или ароматическими или не ароматическими и сами по себе необязательно замещены, нитро, амино, циано, гидроксильными или карбоксильными группами, и где фенильные фрагменты любого из перечисленных радикалов необязательно замещены одним или более атомами фтора, хлора или брома, фенильными кольцами, С1-С4 алкильными, С1-С4 алкокси, циано, амино, нитрильными, гидроксильными или карбоксильными группами; и R1 и R2, которые являются одними и теми же или различными, представляют собой С1-С4 алкильные группы (особенно оба метильные), каждая из которых необязательно замещена одним, двумя или тремя атомами галогена (особенно фтора), при условии, что, когда W представляет собой 5-трифторметилпиридин-2-ил, А представ- ляет кислород, Х-водород; и R1 и R2 оба являются метилами, Y и Z оба не являются одновременно водородами, Y не является F, Cl, метилом, нитро, 5-СF3, 5-SCH3 или 4-(CH3)2N, если Z представляет водород, а Y и Z вместе не являются 3-нитро-5-хлор-, 3,5-динитро, 4,5-диметокси или 4=5-метилендиокси.
и их стереоизомеры, где W представляет собой замещенную пиридинильную или замещенную пиримидинильную группу, связанную с А с помощью любого из ее атомов углерода, и несущую заместители, определенные выше; А представляет собой или атом кислорода, или S/O/n, где n представляет 0, 1 или 2; Х, Y, Z, которые являются одними и теми же или различными, представляют собой атомы водорода, фтора, хлора или брома, С1-С4алкильные, С2-С5 алкенильные, С2-С5 алкинильные, фенильные, С1-С4галоидалкильные, С1-С4 алкокси, фенокси, бензилокси или моно- или диалкиламино группы, или любые две из групп Х, Y и Z, когда они находятся в соседних положениях в фенильном кольце, соединены, образуя сконденсированное ароматическое кольцо; где алифатические фрагменты любых из перечисленных выше групп необязательно замещены одной или более С1-С4 алкокси группами, атомами фтора, хлора или брома, фенильными кольцами, которые сами по себе являются необязательно замещенными,гетероциклическими кольцами, которые являются или ароматическими или не ароматическими и сами по себе необязательно замещены, нитро, амино, циано, гидроксильными или карбоксильными группами, и где фенильные фрагменты любого из перечисленных радикалов необязательно замещены одним или более атомами фтора, хлора или брома, фенильными кольцами, С1-С4 алкильными, С1-С4 алкокси, циано, амино, нитрильными, гидроксильными или карбоксильными группами; и R1 и R2, которые являются одними и теми же или различными, представляют собой С1-С4 алкильные группы (особенно оба метильные), каждая из которых необязательно замещена одним, двумя или тремя атомами галогена (особенно фтора), при условии, что, когда W представляет собой 5-трифторметилпиридин-2-ил, А представ- ляет кислород, Х-водород; и R1 и R2 оба являются метилами, Y и Z оба не являются одновременно водородами, Y не является F, Cl, метилом, нитро, 5-СF3, 5-SCH3 или 4-(CH3)2N, если Z представляет водород, а Y и Z вместе не являются 3-нитро-5-хлор-, 3,5-динитро, 4,5-диметокси или 4=5-метилендиокси.
Когда один или более из радикалов Х, Y и Z являются отличными от водорода, предпочитается, чтобы они были единственными атомами или стерически небольшими группами, такими как фтор, хлор бром, гидрокси, метил, метокси, трифторметил, метиламино и диметиламино. Далее, предпочитается, чтобы один из таких заместителей занимал 5-положение фенильного кольца (при этом акрилатная группа присоединена в 1-положении), так как это может давать преимущества в отношении фитотоксичности, в особенности, когда присутствует только единственный заместитель, такой как хлор.
В следующем аспекте данное изобретение представляет соединения, имеющие формулу 1а: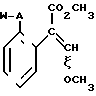 и их стереоизомеры, где А представляет собой S/O/n, где n представляет собой 0, 1 или 2, или предпочтительно, атом кислорода; W представляет собой замещенную пиридинильную или замещенную пиримидинильную группу, связанную с А одним из ее атомов углерода, причем заместители в пиридинильном или пиримидинильном кольцах, которые являются одними и теми же или различными, представляют собой один или более атомов галогена или гидроксилов, необязательно замещенные алкильные (включающие галоидалкил), необязательно замещенные алкенильные, необязательно замещенные арильные, необязательно замещенные алкинильные, необязательно замещенные алкокси (включая галоидалкокси), необязательно замещенные арилокси, необязательно замещенные гетероциклилокси, необязательно замещенные арильные, необязательно замещенные гетероциклил, необязательно замещенные ацилокси, необязательно замещенные амино, необязательно замещенные ациламино, нитро, циано, -СО2R3, -CONR4R5, -COR6или S/0/mR7 (где m=0, 1 или 2) группы; при условии, что, когда представляет собой 5-трифторметилпиридин-2-ил; А представ- ляет собой кислород; Х водород, и R1 и R2 оба представляют метил, Y и Z не являются оба водородом, Y не является F, Cl, метилом, нитро, 5-CF3, 5-SCH3 или 4-/CH2/2N, если Z представляет водород, и Y и Z вместе не являются 3-нитро-5-хлоро-3,5-динитро-4,5-диметокси или 4,5-метилен-диокси; и R3, R4, R5, R6, R7 и R7 имеют значения, определенные выше.
и их стереоизомеры, где А представляет собой S/O/n, где n представляет собой 0, 1 или 2, или предпочтительно, атом кислорода; W представляет собой замещенную пиридинильную или замещенную пиримидинильную группу, связанную с А одним из ее атомов углерода, причем заместители в пиридинильном или пиримидинильном кольцах, которые являются одними и теми же или различными, представляют собой один или более атомов галогена или гидроксилов, необязательно замещенные алкильные (включающие галоидалкил), необязательно замещенные алкенильные, необязательно замещенные арильные, необязательно замещенные алкинильные, необязательно замещенные алкокси (включая галоидалкокси), необязательно замещенные арилокси, необязательно замещенные гетероциклилокси, необязательно замещенные арильные, необязательно замещенные гетероциклил, необязательно замещенные ацилокси, необязательно замещенные амино, необязательно замещенные ациламино, нитро, циано, -СО2R3, -CONR4R5, -COR6или S/0/mR7 (где m=0, 1 или 2) группы; при условии, что, когда представляет собой 5-трифторметилпиридин-2-ил; А представ- ляет собой кислород; Х водород, и R1 и R2 оба представляют метил, Y и Z не являются оба водородом, Y не является F, Cl, метилом, нитро, 5-CF3, 5-SCH3 или 4-/CH2/2N, если Z представляет водород, и Y и Z вместе не являются 3-нитро-5-хлоро-3,5-динитро-4,5-диметокси или 4,5-метилен-диокси; и R3, R4, R5, R6, R7 и R7 имеют значения, определенные выше.
Предпочтительными заместителями в пиридинильном или пиримидинильном кольце являются хлор, фтор, бром, метил, трифторметил (за исключением случаев, когда указаны иные), трихлорметил и метокси.
Согласно еще одному аспекту данное изобретение представляет соединения, имеющие формулу (I):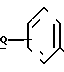
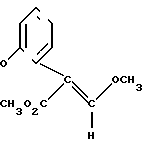 в которой Q представляет собой метил, трифторметил (но не 5-трифторметил), метокси, бром, фтор или особенно хлор.
в которой Q представляет собой метил, трифторметил (но не 5-трифторметил), метокси, бром, фтор или особенно хлор.
Q предпочтительно находится в 2-, 5- или 6-положении пиридинового кольца, и более предпочтительно в 4-положении, когда он представляет собой метил, например.
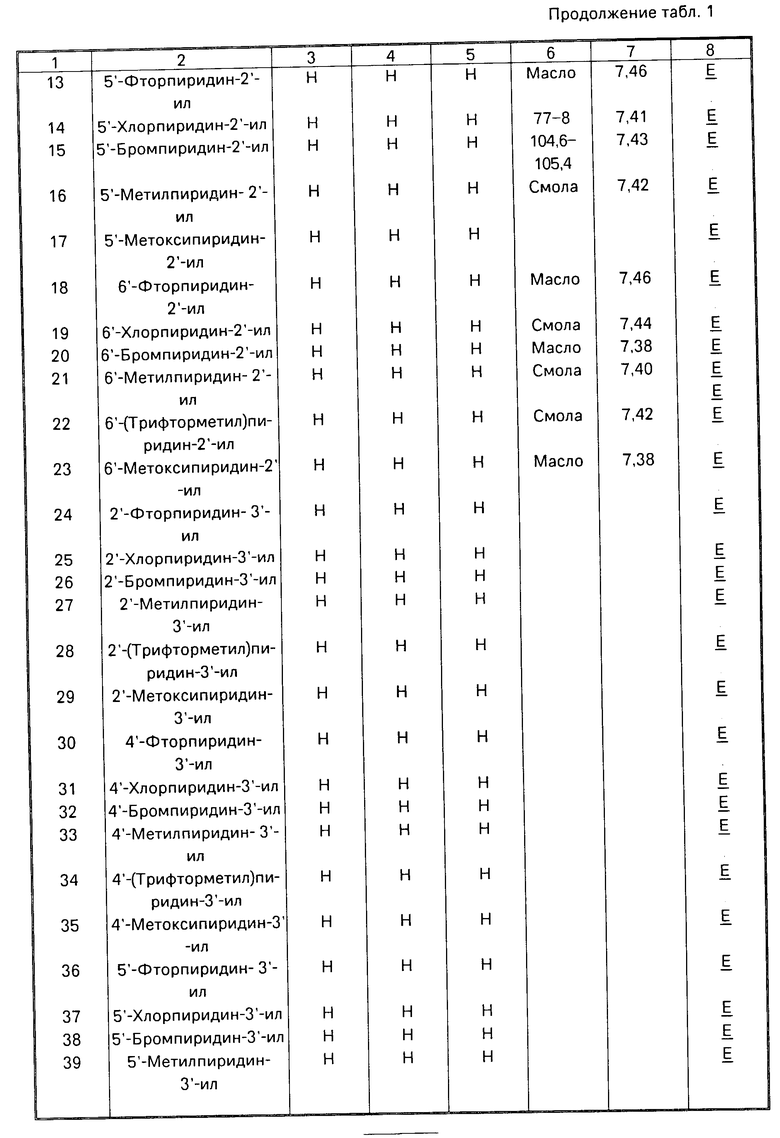
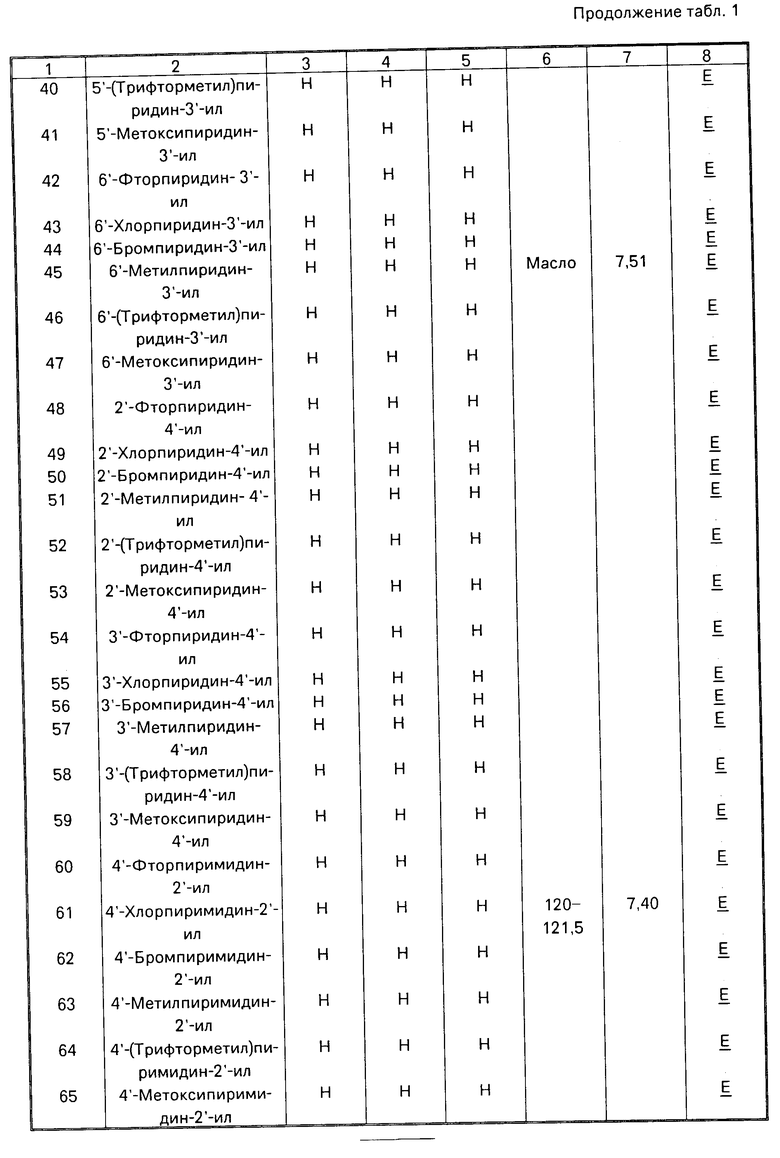
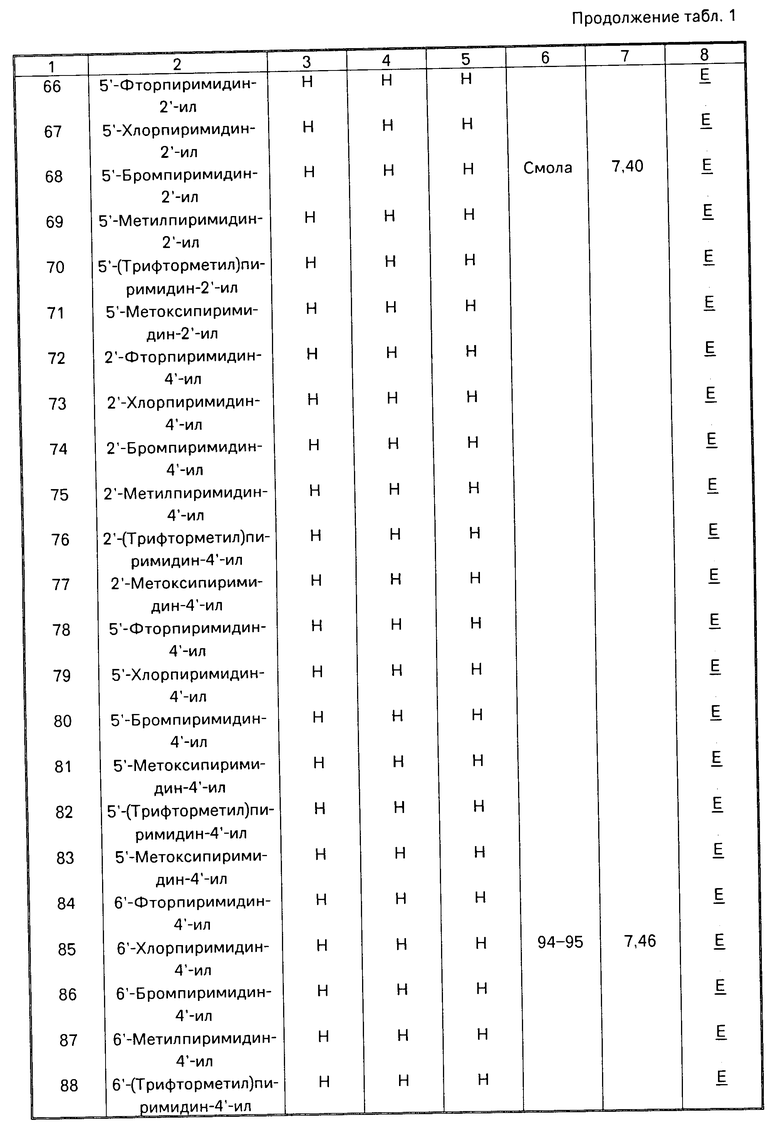
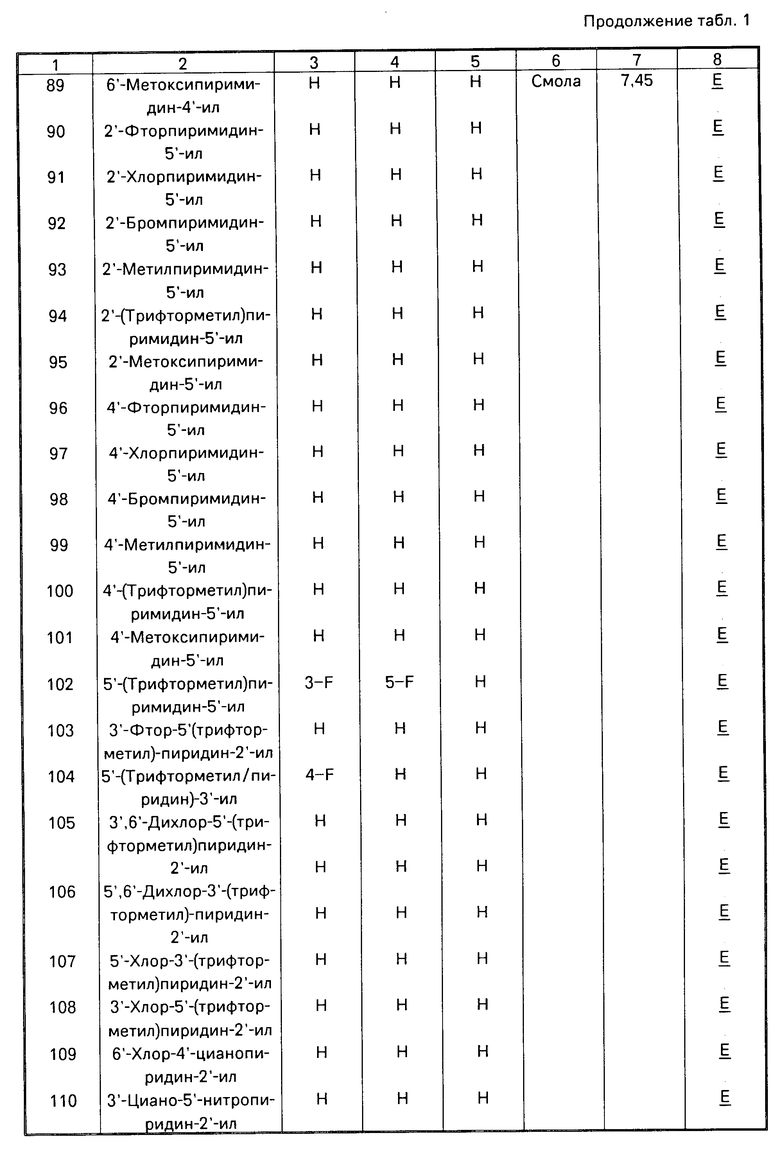
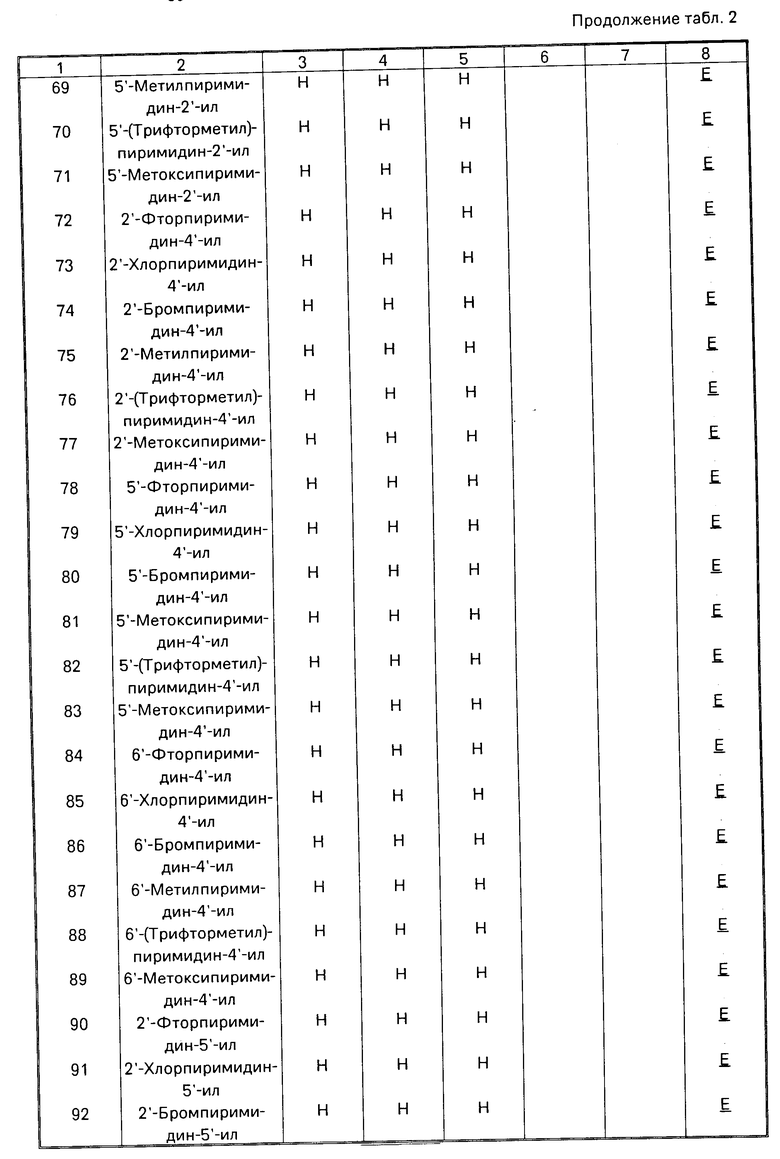
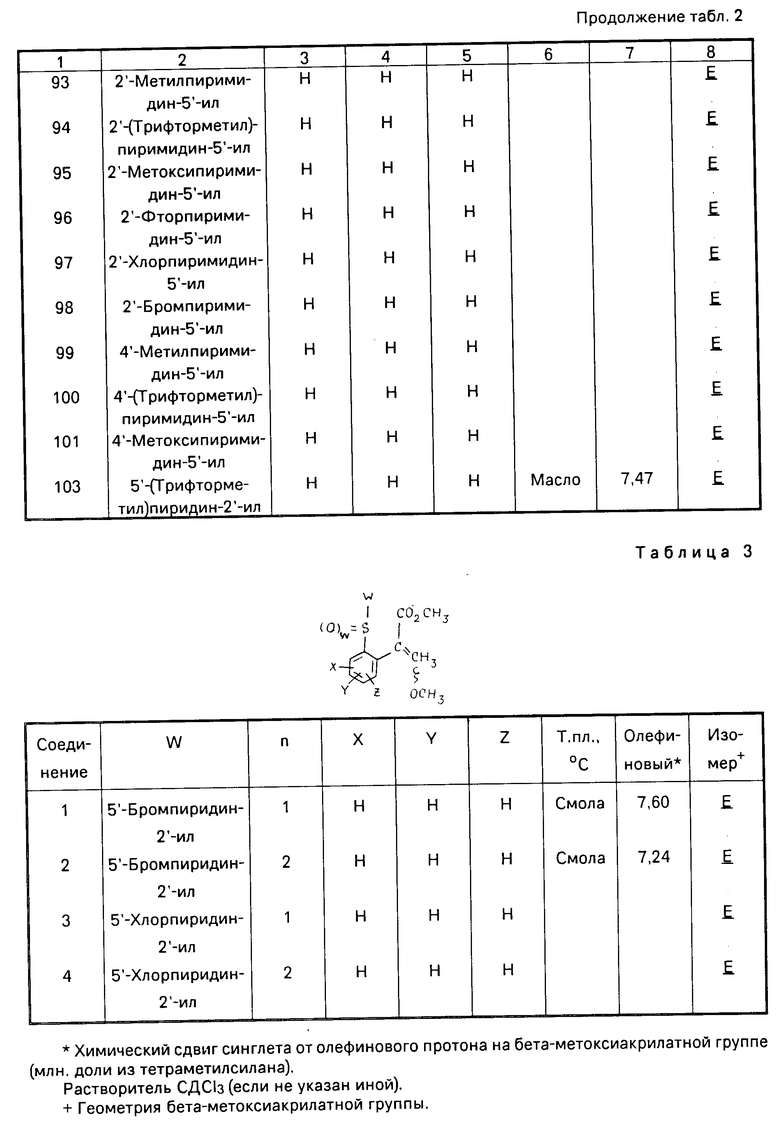
Данное изобретение иллюстрируется соединениями, представленными в табл. 1-4.
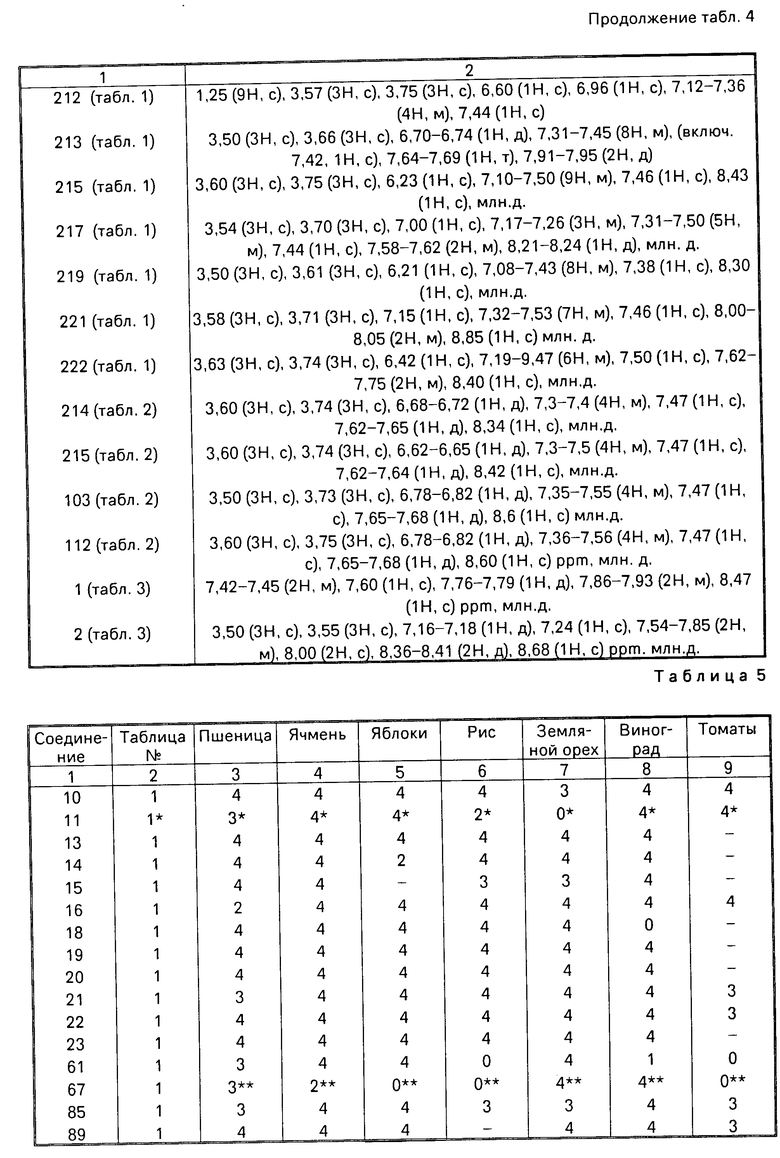
Табл. 4 показывает выбранные протонные ЯМР данные некоторых соединений, описанных в табл. 1, 2 и 3 и охарактеризованных в них как масло или смолы. Химические сдвиги измеряются в млн. долях из тетраметилсилана, а в качестве растворителя следующие соединения:
шир. широкий т. -триплет
с. синглет кв. квартер
д. дублет м. сультиплет
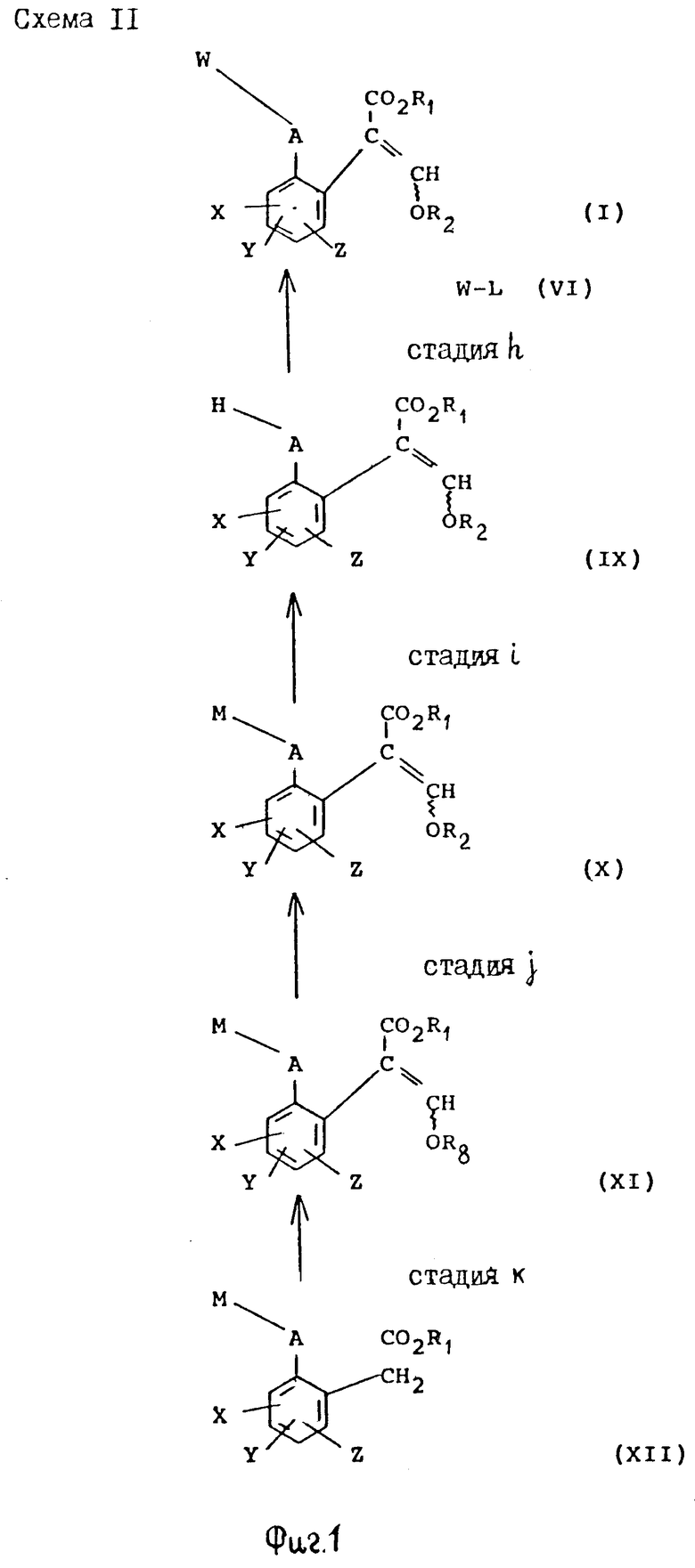
Соединения изобретения, имеющие общую формулу I, могут приготавливаться из фенилацетатов общей формулы XII с помощью стадий, показанных на схеме 11 (см. фиг. 1). На протяжении схемы 11 символы R1, R2, R8, A, W, X, Y, Z и L имеют значения, определенные выше, и М представляет защитную группу для фенольной или тиофенольной группы.
Так, соединения общей формулы I могут быть получены с помощью реакции соединений общей формулы IX с соединениями общей формулы VI в присутствии основания (такого как карбонат калия) и, если необходимо, катализатор переходного металла или соли переходного металла в подходящем растворителе (таком как N, N-диметилформамид) (стадия h схемы II).
Соединения общей формулы IX могут приготавливаться из защищенных фенольных или тиофенольных производных общей формулы X с помощью стандартных приемов снятия защиты, описанных в химической литературе (стадия i схемы II). Например, фенолы общей формулы (IX, А представляет О) могут быть получены из простых бензиловых эфиров общей формулы (X, A представляет О, М представляет собой CH2Ph) c помощью гидрогенолиза в присутствии подходящего катализатора (такого как палладий, осажденный на носителе угля).
Соединения общей формулы X, в которой группа М представляет собой стандартную защитную группу фенола или тиофенола, такую как бензил, могут быть получены с помощью обработки фенилацетатов формулы XII основанием (такими, как гидрид натрия или метилат натрия) и эфиром муравьиной кислоты (таким, как метилформат) в подходящем растворителе, таком как N,N-диметилформамид, и при подходящей температуре (стадия К схемы II). Если к реакционной смеси затем добавляется соединение формулы R2-L, в которой L имеет значения, определенные ранее, могут получаться соединения формулы Х (стадия j схемы II). Если к реакционной смеси добавляется протонная кислота, получаются соединения формулы XI, в которой R8 представляет собой водород. Альтернативно, соединение формулы XI, в которой R8 представляет собой атом металла (особенно атом щелочного металла, такой как атом натрия), могут быть сами по себе выделены из реакционной смеси.
Соединения формулы XI, в которой R8 представляет собой атом металла, могут быть превращены в соединения формулы X с помощью обработки соединением формулы R2-L, в подходящем растворителе. Соединения формулы XI, в которой R8 представляет собой водород, могут быть превращены в соединения формулы Х с помощью последовательной обработки основанием (таким как карбонат калия) и соединением формулы R2-L.
Соединения общей формулы XII могут быть получены из соединений общей формулы VIII с помощью стандартных методов, описанных в химической литературе.
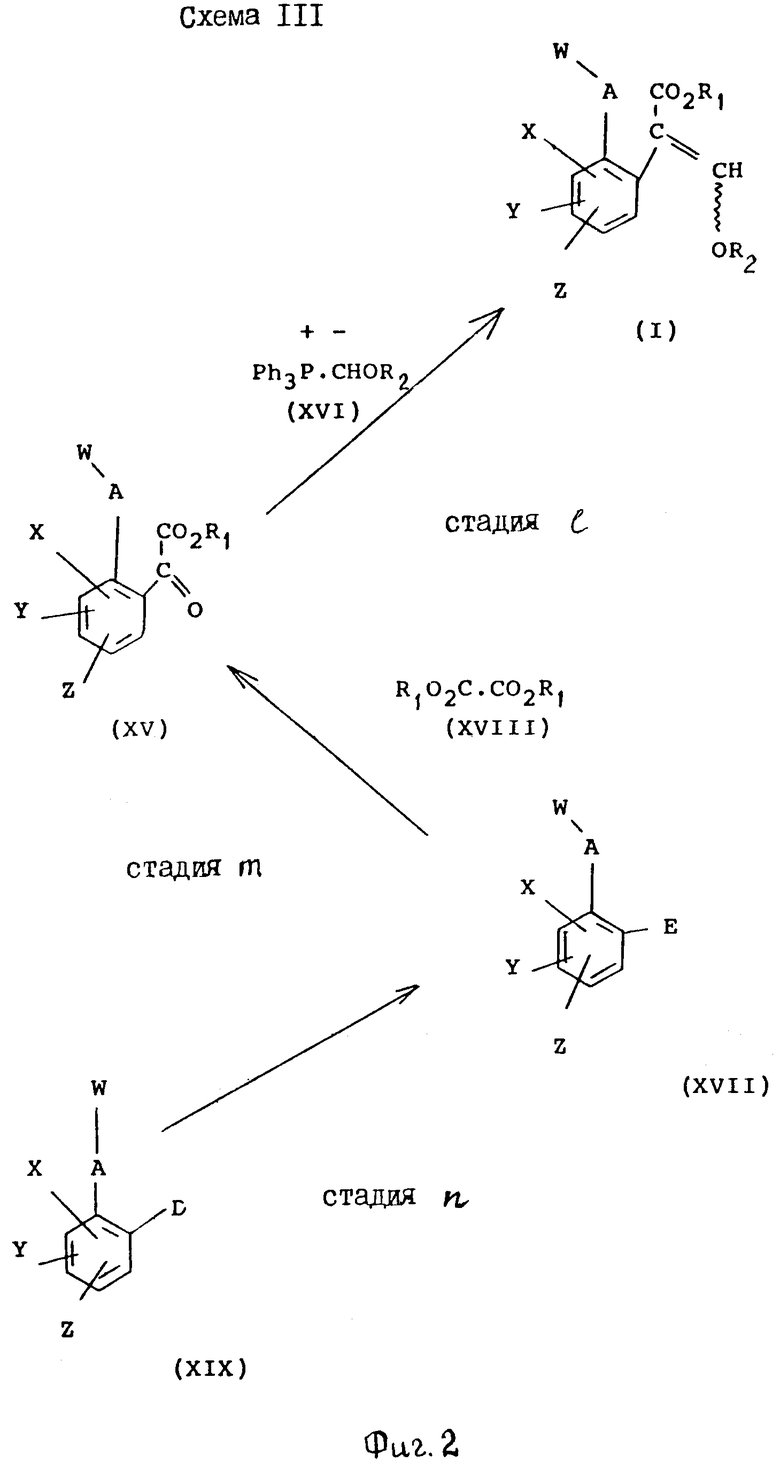
Альтернативно, соединения изобретения, имеющие общую формулу I могут быть получены из замещенных бензолов общей формулы XIX с помощью стадий, показанных на схеме III (см. фиг. 2).
В схеме III символы R1, R2, A, W, X, Y и Z имеют значения, определенные выше, представляет собой водород или галоген, и Е представляет атом металла (такой как атом лития) или атом металла плюс соединенный с ним атом галогена (такой как MgI, MgBr или MgCl).
Так, соединения, общей формулы I могут быть получены с помощью обработки сложных кетоэфиров общей формулы XY фосфоранами общей формулы XVI в подходящем растворителе, таком как диэтиловый эфир (смотри, например, ЕР-А-0044448 и ЕР-А-0178826) (стадия с схемы III).
Сложные кетоэфиры общей формулы XV могут быть получены с помощью обработки замещенного металлом соединения XVII оксалатом XVIII в подходящем растворителе, таком как диэтиловый эфир или тетрагидрофуран. Предпочтительный способ часто предусматривает медленное добавление раствора замещенного металлом соединения XVII к перемешиваемому раствору избытка оксолата XVIII (см. например, L. M. Weinstock, R.B.Curric u A.V.Zovell, Synthetic Communication 1981, II, 943, и ссылки, указанные там) (стадия m схемы III).
Замещенное металлом соединение XVII, в котором Е представляет собой MgI, MgBr или MgCl (реактивы Гриньяра) могут быть получены с помощью стандартных способов из соответствующих ароматических галогенидов XIX, в которых D представляет собой I. Br или Cl, соответственно. С некоторыми заместителями X, Y и Z, замещенное металлом соединение XVII, в котором Е представляет литий, может быть получено с помощью реакции непосредственного присоединения лития (литирования) к соединениям XIX, в которых представляет собой водород, с использованием сильного литиевого основания, такого как н-бутил-литий или литий-ди-изопропиламид (см. например, H.W.Gschwend u H.R.Rodriguez, Organic Reactions 1979,  , 1) (стадия n схемы III).
, 1) (стадия n схемы III).
Соединения общей формулы XIX могут быть получены с помощью стандартных методов, описанных в химической литературе.
В химической литературе описываются альтернативные способы получения сложных кетоэфиров общей формулы XV (см. например, D.Atkinson, K.E.Godfrey, B.Meek, I.E.Saville u M.R.Stillings, и I.Med. Chem, 1983,  , 1353; D.Horne, I. Caudino и W.I.Thompson, Tet, Lett. 1984, 25, 3529; и Axiotis, Tetrahedron Lett. 1981, 22, 1509).
, 1353; D.Horne, I. Caudino и W.I.Thompson, Tet, Lett. 1984, 25, 3529; и Axiotis, Tetrahedron Lett. 1981, 22, 1509).
Способы получения соединений изобретения, имеющих общую формулу I, описанные на схемах I и II, обычно, применимы, когда W в общей формуле I представляет собой замещенную 2-пиридинил, или 2- или 4-пиримидинильную группу, и когда W представляет собой 4-пиридинильную группу, содержащую сильные электрон-оттягивающие заместители, такие как нитро, трифторметил или фтор. Однако, для соединений общей формулы I, в которой W представляет собой замещенную 3- или 4-пиридинильную группу, способы, показанные на схеме II, обычно не могут быть применимы.
Также, хотя соединения изобретения, имеющие общую формулу I, в которой W представляет собой замещенную 3- или 4-пиридинильную группу, могут быть получены из соединений общей формулы IV с помощью стадий a, b и с, как показано на схеме I, соединения общей формулы IV, в которой W представляет собой замещенную 3- или 4-пиридинильную группу, обычно не могут быть получены с помощью стадий e и f, показанных на схеме I. Поэтому может возникнуть необходимость использования альтернативного способа получения соединений общей формулы IV.
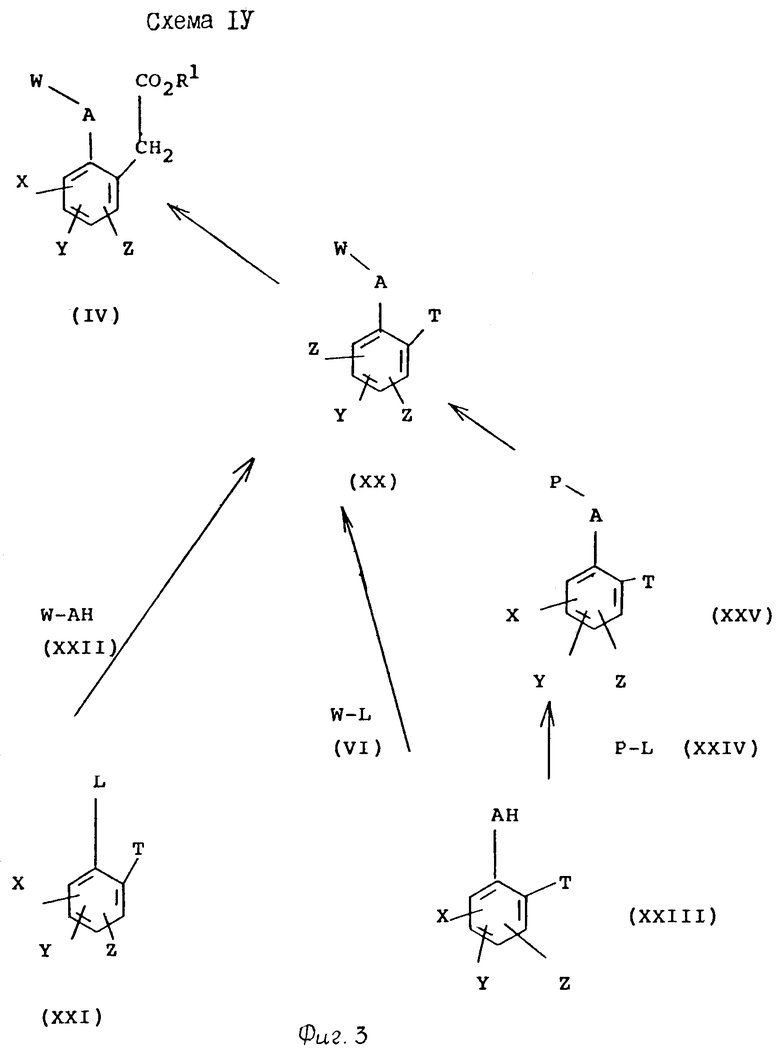
Обычно, соединения формулы IV, в которой W представляет замещенную 3- или 4-пиридинильную группу, могут предпочтительно получаться с помощью способа, показанного на схеме IV (см. фиг. 2, 3).
Так, на схеме IV соединения формулы IV, в которой W представляет замещенную 3- или 4-пиридинильную группу, могут быть получены из соединений формулы XX, в которой W представляет собой замещенную 3- или 4-пиридинильную группу.
На протяжении схемы IV символы A, X, Y, Z и L имеют значения, определенные выше для схем I-III, а Т представляет собой любую группу, которая может превращаться с помощью стандартных способов, описанных в литературе, с помощью одной или более стадий в уксусно-эфирную боковую цепь структуры СН2СOOR, как показано в формуле IV. Например, Т может быть формильной группой или любой группой, которая способна к превращению в формильную группу, такой как формилацеталь, который может гидролизоваться с помощью водной кислоты в формильную группу, или такой как нитрил, который может восстанавливаться в формильную группу с помощью восстановления гидридом металла (смотри, например, A. E.G.Miller, I.W.Bhis и L.H.Sehwartzmann J.Org. Chem. 1959,  , 627) или с помощью сплава Ренея в муравьиной кислоте (смотри, например, van ES u Staskun, J.Chem. Soc. 1965, 5775). Когда Т представляет собой формильную группу, она может затем превращаться в остаток сложного эфира уксусной кислоты CH2COOR1 c помощью реакции с метил-метилсульфинилметилсульфидом (CH3SOCH2 S CH3) (смотри, например, K.Ogura u G.Tsuchihashi, Tetrahedron Lett. 1972, 1383-6), с последующим гидролизом спиртом R1OH в присутствии кислоты, такой как хлористый водород. Например, Т может также быть группой, такой как метильная группа, которая может галоидироваться, например, бромом или N-бромсукцинимидом, давая галоидметильную группу, которая может затем обрабатываться цианидным ионом, давая цианометильную группу, которая в свою очередь может гидролизоваться в остаток уксусного эфира СН2СOOR1 с помощью методов, хорошо известных в литературе. Т может также быть, например, группой карбоновой кислоты или сложно-эфирной группой, которая может восстанавливаться в гидроксиметильную группу, которая в свою очередь может превращаться в цианометильную группу с помощью методов, хорошо известных в литературе.
, 627) или с помощью сплава Ренея в муравьиной кислоте (смотри, например, van ES u Staskun, J.Chem. Soc. 1965, 5775). Когда Т представляет собой формильную группу, она может затем превращаться в остаток сложного эфира уксусной кислоты CH2COOR1 c помощью реакции с метил-метилсульфинилметилсульфидом (CH3SOCH2 S CH3) (смотри, например, K.Ogura u G.Tsuchihashi, Tetrahedron Lett. 1972, 1383-6), с последующим гидролизом спиртом R1OH в присутствии кислоты, такой как хлористый водород. Например, Т может также быть группой, такой как метильная группа, которая может галоидироваться, например, бромом или N-бромсукцинимидом, давая галоидметильную группу, которая может затем обрабатываться цианидным ионом, давая цианометильную группу, которая в свою очередь может гидролизоваться в остаток уксусного эфира СН2СOOR1 с помощью методов, хорошо известных в литературе. Т может также быть, например, группой карбоновой кислоты или сложно-эфирной группой, которая может восстанавливаться в гидроксиметильную группу, которая в свою очередь может превращаться в цианометильную группу с помощью методов, хорошо известных в литературе.
Соединения формулы XX, в которой W представляет собой замещенную 3-пиридинильную группу, могут быть получены из соединений формулы XXI, где L имеет значения, определенные для схемы I, с помощью реакции с соединениями формулы XXII, в которой W представляет собой замещенную 3-пиридинильную группу, в условиях, обычно используемых для хорошо известного синтеза Ульмана. Например, соединения формулы XXI могут обрабатываться солью металла (предпочтительно солью натрия или калия) соединений формулы XXII, или в массе, или в подходящем растворителе, таком как N,N-диметилформамид или диметилсульфоксид, при 50-250оС, но предпочтительно при 100-180оС, в присутствии катализатора переходного металла, такого как медная бронза или галогениды меди.
Соединения общей формулы XXI могут быть получены с помощью стандартных способов, известных из химической литературы.
Соединения формулы XX, где W представляет собой замещенную 4-пиридинильную группу, могут быть получены с помощью взаимодействия соли металла (предпочтительно соли натрия или калия) соединений формулы (XXIII с соединениями формулы VI), в которой Х представляет собой замещенную 4-пиридинильную группу в подходящем растворителе, таком как N,N-диметилформамид или диметилсульфоксид, при 20-200оС, и предпочтительно при 50-150оС и необязательно в присутствии катализаторов переходного металла, такого как медная бронза или галогениды меди.
Соединения формулы XX могут быть также получены из соединений формулы XXV, в которой Р определен как пиридил, N-окись, связанная с А в 4-положении. Р может быть, а может и не быть замещенным заместителями, определенными для W в соединениях формулы I. Если группа Р в соединениях формулы XXV является замещенной, последующее дезоксигенирование N-окиси с помощью стандартных способов, например, треххлористым фосфором, дает соединения формулы XX, в которой W представляет собой замещенный 4-пиридинил. Если Р в соединениях формулы XXV является замещенным или незамещенным, последующая хорошо известная реакция N-окиси пиридина с фосфорил- или тионил-галогенидами может использоваться для получения соединений формулы XX, содержащих дополнительный атом галогена в 2- или 6-положении, с одновременной потерей N-окисной функции (смотри, например, "The chemistry of the Heterocyclic Compounds; Pyridine and Its Perivatives", Ed.E.Klingsberg, Часть 2, страница 121).
Соединения формулы XXV могут получаться с помощью взаимодействия соли металла (предпочтительно соли натрия или калия) соединений формулы XXIII с соединениями формулы XXIV, в которой Р и L имеют значения, определенные выше, в подходящем растворителе, таком как N,N-диметилформамид или диметилсульфоксид, при 20-200оС и предпочтительно при 50-150оС, необязательно в присутствии переходного металлического катализатора, такого как медная бронза или галогениды меди. Соединения формулы XXIII могут получаться с помощью стандартных способов, описанных в химической литературе. Согласно дополнительным аспектам данное изобретение представляет способы, описанные.
Соединения по изобретению являются активными фунгицидами, и они могут использоваться для борьбы с одним или более из следующих патогенных организмов:
Pyrucularia oryzal на рисе Puccinia ruondita, Puccinia striiformis и другие виды ржавчины на пшенице. Puccinia hordeli, Puccunia striiformis и другие виды ржавчины на ячмене, и ржавчинные заболевания на других культурах, например, на кофе, грушах, яблонях, земляном орехе, на овощных культурах и на декоративных растениях.
Erysiphe graminis (настоящая мучнистая роса) на ячмене и пшенице и другие виды настоящей мучнистой росы на различных культурах, такие как
Sphaerotheca malutaris на хмеле,
Sphaerotheca fuliginea на тыквенных (например, огурца), Podosphaera lucotrisha на яблонях и Ulcinulla necator на виноградной лозе, Helminthosporium spp, Rhynochosporium spp, Septoria spp. Pseudocercosporella herpotrichoides и Galumannomyces graminis на злаковых.
Cercospora arachidscola и Arcosporidium personata на земляном орехе и другие виды Cercospora на других культурах, таких, как например, сахарная свекла, бананы, соевые бобы и рис. Botrytis cinerea (серая плесень) на томатах, клубнике, овощных культурах и других культурах.
Alternaria виды на овощах (например, огурцах), на семенах масличных рапсе, яблонях, томатах и других растениях-хозяевах.
Venturia indegualis (парша) на яблонях.
Plasmopara viticola на виноградной лозе.
Другие виды ложной мучнистой росы, такие как Bremia lactical на латуке Peronospora, на соевых бобах, табаке, луке и других культурах и Pseudoperonospora humuli на хмеле и Pseudoperonospora cubensis на тыквенных, Phytophthora infestans на картофеле и томатах и другие Phytophthora spp. на овощных культурах, клубнике, авокадо, перце, декоративных культурах, табаке, какао и других.
Thanatephorus cucumeris на рисе и другие виды Phizoctonia на различных культурах-хозяевах, таких как пшеница и ячмень, овощные, хлопок и дерн.
Некоторые из соединений также показали широкий спектр активностей против грибков ин витро. Они могут проявлять активность против различных заболеваний плодов после сбора урожая (например, Penicillium digitatum и Trichoderma viride на апельсиновых и Gloesporium musarum на бананах).
Далее, некоторые из соединений могут быть активными в качестве протравливателей семян против Fusanum spp. Septoria spp. Tilletia spp. (твердая головня пшеницы, заболевания семян пшеницы), Ustillago spp. Helminthosporium spp. на злаковых, Rhizoctonia solani на хлопке и Pyricularia oryzae на рисе.
Данные соединения могут продвигаться в тканях растений акропетально. Кроме того, они могут быть достаточно летучими, чтобы быть активными в паровой фазе против грибков растений.
Следовательно, согласно еще одному аспекту изобретения в заявке предлагается способ борьбы с грибками, который предусматривает применение по отношению к растения, к семенам растений, или к местам нахождения растений или семян, эффективного количества фунгицидного соединения формулы I.
Соединения могут также быть полезными в качестве промышленных (в противоположность сельскохозяйственным) фунгицидов, например, для предотвращения грибкового поражения древесины, кож и шкур, кожи и особенно покрытий краски.
Некоторые из соединений изобретения проявляют инсектицидную и нематоцидную активность.
Следовательно, согласно дополнительному аспекту изобретения предлагается способ уничтожения или борьбы с насекомыми или нематодными вредителями, который включает применение по отношению к вредителям или к месту их распространения эффективного количества инсектицидного/нематоцидного соединения формулы I.
Предпочтительную группу соединений для использования в данном аспекте изобретения составляют соединения формулы I, в которой X представляет собой замещенный пиридинил, в котором заместителями являются заместители, предпочтительно выбранные из галогена или галоидалкила.
Особенно предпочтительными соединениями для использования в данном способе являются соединения 14 и 15, приведенные в табл. 1.
Аналогичным образом, некоторые соединения проявляют активность регулирования роста растений и могут применяться для данной цели при соответствующих нормах расхода. Следовательно, согласно еще одному аспекту изобретения представляется способ регулирования роста растений, который включает применение к растению эффективного количества соединения формулы I, регулирующего рост растений.
Соединения могут использоваться непосредственно для сельскохозяйственных целей, но более удобно их преобразовывать в композиции с использованием носителя или разбавителя. Следовательно, согласно дополнительному аспекту изобретения представляются фунгицидные, инсектицидные/нематоцидные и регулирующие рост растений композиции, включающие соединение общей формулы I, охарактеризованной здесь выше, и приемлемый носитель или разбавитель для данного соединения.
В качестве фунгицидов соединения могут применяться с помощью ряда способов. Например, они могут применяться после предварительного преобразования в готовую препаративную форму или без него, непосредственно к листве растений, к семенам или к другой среде, в которой растения выращиваются или их предполагается сажать, или они могут распыляться или разбрызгиваться, применяться в виде дуста или применяться в виде кремов или пастообразных препаративных форм, или они могут применяться в виде пара или в виде гранул с медленным высвобождением активного вещества. Применение может осуществляться по отношению к любой части растения, включая листья, стебли, ветки или корни, или по отношению к почве, окружающей корни, или к семенам перед их посевом или посадкой; или вообще к почве, к воде заливных площадей или к системам гидропонной культуры. Соединения изобретения могут также инъецироваться в растения или разбрызгиваться на растительность с использованием приемов электродинамического опрыскивания или других методов использования малого объема.
Термин "растение", как он используется здесь, включает саженцы, кустарники и деревья. Кроме того, фунгицидный способ данного изобретения включает превентивную, защитную профилактическую или лечебную обработку.
Соединения предпочтительно используются для сельскохозяйственных целей и целей садоводства в форме композиций. Тип используемой композиции в любом случае будет зависеть от конкретно преследуемой цели.
Данные композиции могут быть в форме способных к распылению в виде дуста порошков или гранул, включающих активный ингредиент (соединение изобретения) и твердый разбавитель или носитель, например, такие наполнители, как каолин, бентонит, кизельгур, доломит, карбонат кальция, тальк, порошкообразную магнезию, фуллерову землю, гипс, диатомовую землю и китайскую глину. Такие гранулы могут быть предварительно сформированными гранулами, подходящими для применения к почве без дополнительной обработки. Эти гранулы могут изготавливаться или с помощью пропитки таблеток наполнителя активным ингредиентом, или с помощью таблетирования смеси активного ингредиента и порошкообразного наполнителя. Композиции для протравливания семян могут включать агент (например, минеральное масло), способствующий адгезии композиции к семенам; альтернативно, активный ингредиент может преобразовываться в препаративную форму для целей протравливания семян с использованием органического растворителя (например, N-метилпирролидона, пропиленгликоля или диметилформамида). Композиции могут также быть в виде смачиваемых порошков или диспергируемых в воде гранул, включающих смачивающий или диспергирующий агенты для облегчения диспергирования в жидкостях. Порошки и гранулы могут также содержать наполнители и суспендирующие агенты.
Эмульгируемые концентраты или эмульсии могут приготавливаться с помощью растворения активного ингредиента в органическом растворителе, необязательно содержащем смачивающий или эмульгирующий агент, а затем добавлением смеси к воде, которая может также содержать смачивающий или эмульгирующий агент. Подходящими органическими растворителями являются такие, как алкилбензолы и алкилнафталины, кетоны, такие как изофорон, циклогексанон, и метилциклогексанон, хлорированные углеводороды, такие как хлорбензол и трихлорэтан, и спирты, такие как бензиловый спирт, фурфуриловый спирт, бутанол и гликолевые эфиры.
Суспензионные концентраты в значительной степени нерастворимых твердых веществ могут приготавливаться с помощью шарового измельчения с диспергирующим агентом и включения суспендирующего агента для предотвращения оседания твердого вещества.
Композиции, предназначенные для использования в виде спреев, могут быть в форме аэрозолей, в которых готовая форма препарата содержится в контейнере под давлением в присутствии пропеллента, например, фтортрихлорметана или дихлордифторметана.
Соединения изобретения могут смешиваться в сухом состоянии с пиротехнической смесью для образования композиции, подходящей для генерирования в закрытых пространствах дыма, содержащего соединения.
Альтернативно соединения могут использоваться в микроинкапсулированном виде. Они могут также преобразовываться в биоразлагаемые полимерные препаративные формы для получения препаратов с медленным, контролируемым высвобождением активного вещества.
Благодаря включению подходящих добавок, например, добавок, улучшающих распределение, силу адгезии и устойчивость к дождю на обработанных поверхностях, различные композиции могут лучше приспосабливаться для различных утилитарных целей.
Соединения изобретения могут использоваться в виде смесей с удобрениями (например, азот-, калий- или фосфор-содержащими удобрениями). Композиции, включающие только гранулы удобрения, например, покрытие соединением, предпочтительны. Такие гранулы подходящим образом содержат до 25% по массе соединения. Изобретение, следовательно, также предоставляет композиции удобрения, включающие удобрение и соединение общей формулы I или его соль или металлический комплекс.
Смачиваемые порошки, эмульгируемые концентраты и суспензионные концентраты обычно содержит поверхностно-активные вещества, например, смачивающий агент, диспергирующий агент, эмульгирующий агент или суспендирующий агент. Эти агенты могут быть катионными, анионными или не-ионными агентами.
Подходящими катионными агентами являются четвертичные аммониевые соединения, например, ацетилтриметил- аммонийбромид. Подходящими анионными агентами являются мыла, соли алифатических моноэфиров серной кислоты (например, лаурилсульфат натрия), и соли сульфонированных ароматических соединений (например, додецилбензолсульфонат натрия, лигносульфонат натрия, кальция, или аммония, бутилнафталинсульфонат, и смесь диизопропил- и триизопропил- нафталин-сульфонатов натрия).
Подходящими неионными агентами являются продукты конденсации окиси этилена с жирными спиртами, такими как олеиловый или цетиловый спирт, или с алкилфенолами, такими как октил- или ионил-фенол и окстилкрезол. Другими неионными агентами являются частичные сложные эфиры, происходящие из жирных кислот с длинной цепью и гекситол-ангидридов, продукты конденсации указанных частичных сложных эфиров с окисью этилена, и лецитины. Подходящими суспендирующими агентами являются гидрофильные коллоиды (например, поливинилпирролидон и натриевая карбоксиметилцеллюлоза), и набухающие глины, такие как бентонил или аттапульгит.
Композиции для использования в виде водных суспензий или эмульсий обычно поставляются в форме концентрата, содержащего большое количество активного ингредиента, причем концентрат перед использованием разбавляется водой. Эти концентраты должны быть предпочтительно способными противостоять хранению в течение продолжительных периодов и после такого хранения быть способными к разбавлению водой для того, чтобы образовывать водные препараты, которые остаются гомогенными в течение достаточного времени, давая возможность применять их с помощью обычного опрыскивающего оборудования. Концентраты могут удобным образом содержать до 95% подходящим образом до 10-85% например, 25-60% по весу активного ингредиента. После разбавления с образованием водных препаратов, такие препараты могут содержать варьирующиеся количества активного ингредиента в зависимости от преследующей цели, и могут использоваться водные препараты, содержащие 0,0005 или 0,01-10% по массе активного ингредиента.
Композиции изобретения могут содержать другие соединения, обладающие биологической активностью, например, соединения, имеющие сходную или дополнительную фунгицидную активность, или которые обладают активностью регулирования роста растений, гербицидной или инсектицидной активностью.
Фунгицидное соединение, которое может присутствовать в композиции данного изобретения, может быть соединением, которое способно подавлять заболевания колосьев злаковых культур (например, пшеницы), такие как Septoria, Giblerella, Helminthosporium spp. заболевания семян и болезни, возникающие в почве, и ложную и настоящую мучнистую росу на виноградной лозе и настоящую мучнистую росу и паршу яблони и др. Благодаря включению еще одного фунгицида композиция может иметь более широкий спектр активности, чем соединение общей формулы I, взятое одно. Кроме того, другой фунгицид может оказывать синергистическое действие на фунгицидную активность соединения общей формулы I. Примерами фунгицидных соединений, которые могут быть включены в композицию данного изобретения, являются карбендазим, феномил, тилфанат-метил, тиабендазол, фуберидазол, этридазол, дихлорфлуакил, цимоксанил, оксадиксил, металаксил, фуралаксил, 4-хлор-N-/1-циано-1-этоксиметил/бензамид, беналаксил, фозетиалюминий, фенаримол, ипродион, протиокарб, процимидон, винклозолин, пенконазол, микробутанил, пропамокарб. R 0151297, диконазол, паризофос, этиримол, диталимфос, бутиобат, тридеморф, трифорин, нуаримол, триазбутил, гуазатин, триацетатная соль, 1,1'-иминоди/октаме- тилен/дигуанидина, пропиконазол, прохлораз, флутриафол, гексаконазол, (2RS, 3RS)-(4-хлорфенил/-3-циклопропил-1-)1Н-1,2,4-триазол-1-ил/бутан-2-ол: /RS/-1-(4-хлор-фенил)-4,4-диметил-3-(1Н-1,2,4-триазол-1-ил метил)пентан-3-ол, флузидазол, триадимефон, триадименол, диклобутразол, фенпропиморф, пирифенокс, фенпропидин, хлорозолинат, амизалил, фенфурам, карбоксин, оксикарбоксин, метфуроксам, додеморф, BAS 454, бластицидин S, касугамицин, адифенфос, Китазин Р, циклогексимид, фталид, пробеназол, изопротиолан, трициклазол, пироквилон, хлорбензтиазон, неоазоцин, полиоксин D, валидамицин А, мепронил, флутоланил, пенкурон, дикломезин, феназин-оксид, диметилдитиокарбамат никеля, техлорфталам, битертанол, бупиримет, этаконазол, гидроксиизоксазол, стрептомицин, ципрофурам, билокоазол, хинометилнат, диметиримол, 1-(2-циано-2-метоксииминоацетил)-3-этил-мо- чевина, фенапанил, толклофос-метил, пироксифур, полирам, манеб, манкоцеб, каптафол, хлорроталонил, анилазин, тирам, каптан, фолпет, цинаб, пропинеб, сера, динокап, дихлон, хлоронеб, бинапакрил, нитротализопропил, додин, дитианон, фентин-гидроксид, фентин-ацетат, текназен, хинтозен, диклоран, мель-содержащие соединения, такие как оксихлорид меди, сульфат меди и Бордоская смесь, и ртуть-органическое соединения.
Соединения общей формулы 1 могут смешиваться с почвой, торфом или другими средами для роста корней для защиты растений от зарождающихся в семенах, в почве болезней или грибковых заболеваний листвы.
Подходящие инсектициды, которые могут вводиться в композицию данного изобретения, включают пиримикарб, диметоат, деметон-S-метил, формотион, карбарил, изопрокарб, ХМС, ВРМС, карбофуран, карбосульфан, диазинон, фентион, фенитротион, фентоат, хлорпирифос, изоксатион, пропафос, монократофас, бупрофезин, этропроксирен и циклопротрин.
Соединения, регулирующие рост растений, являются соединениями, которые подавляют сорняки или образование семенной метелки, или селективно регулируют рост менее желательных растений (например, трав).
Примерами подходящих соединений, регулирующих рост растений, для использования с соединениями изобретения, являются гибереллины (например, GA3, GA4 или GA7), ауксины (например, индолуксусная кислота, индолмасляная кислота, нафтоксиуксусная кислота или нафтилуксусная кислота), цитокинины (например, кинетин, дифенилмочевина, бензимидазол, бенидаденин или бензиламинопурин), феноксиуксусные кислоты (например, 2,4-D или МСРА), замещенная бензойная кислота (например, трииодбензойная кислота), морфактины (например, хлорфторэкол), малеиновый гидразид, глифосат, глифосин, длинноцепочные жирные спирты и кислоты, дикегулак, пактобутразол, флуоридамид; мефлуидид, замещенные четвертичные аммониевые и фосфониевые соединения (например, хлормекват флорфоний или мепикватхлорид), этефон, карбетамид, метил-3,6-дихлоранизат, даминозид, асулам, абсцизовая кислота, изопиримол, 1-(4-хлорфенил)-4,6-диметил-2-оксо-1, 2-дигидропиридин-3-карбоновая кислота, гидроксибен- зонитрилы (например, бромоксилин), дифензокват, бензоилпроп-этил-3,6-дихлорпиколиновая кислота, фенпентезол, инабенфид, триапентенол и текназен.
Следующие примеры иллюстрируют данное изобретение. Во всех этих примерах термин "простой эфир" или "эфир" относится к диэтиловому эфиру; хроматография осуществлялась с использованием силикагеля в качестве твердой фазы; сульфат магния использовался для сушки растворов; и реакции, включающие чувствительные к воде или воздуху промежуточные продукты, проводились в атмосфере азота и в осушенных растворителях. Где это показано, инфракрасные и ЯМР данные являются селективными: не делается попытки перечислять каждую абсорбцию. Если не указано иначе, спектры ЯМР регистрировались с использованием растворов в дейтерохлороформе. На протяжении примеров используются следующие сокращения:
дельта=химический сдвиг, СДСI3=дейтерохлороформ, с=синглет, д=дублет, Т= триплет, шир.широкий;
ДМФ= N, N-Диметилформамид, макс.максимум или максимумы НРLC=жидкостная хроматография высокой разрешающей способности;
ЯМР ядерный магнитный резонанс.
П р и м е р 1. Данный пример иллюстрирует приготовление (Е)-метил-2-[2'-(5"-нитропиридин-2"-илокси)фенил]-3-метоксиак- рилата (Соединение N 133, табл. 1).
2-(Гидроксифенил)уксусная кислота (50 г) добавлялась к раствору хлористого водорода в метаноле (приготовленному из ацетилхлорида (25 мл) и метанола (250 мл). Данный раствор перемешивался при комнатной температуре в течение 3 ч, а затем ему давали возможность стоять в течение ночи (15 ч). Получающаяся в результате смесь концентрировалась при пониженном давлении, и остаток брался в простой эфир (250 мл) и промывался водным раствором бикарбоната натрия до тех пор, пока не прекращалось бурное выделение газа. Эфирный раствор сушился, а затем концентрировался при пониженном давлении, и получающееся в результате твердое вещество перекристаллизовывалось из смеси диэтиловый эфир/бензин; давая метил (2-гидроксифенил)ацетат (50 г, 92% выход) в виде белых порошкообразных кристаллов, т.пл. 70-72оС; инфракрасный макс. (нуйол): 3420, 1715 см-1;
IH ЯМР (90 МГц): дельта 3,70 (2Н, с/, 3,75 (3Н,с), 6,80-6,95 (2Н, м), 7,05-7,10 (1Н, м), 7,15-7,25 (1Н, м), 7,40 (IH, с), миллионных долей.
Метил (2-гидроксифенил)ацетат (21,0 г) растворялся в диметилформамиде (200 мл), добавлялся карбонат калия (19,35 г) в виде одной порции. К данной смеси по каплям добавлялся бензилбромид (23,94 г) в диметилформамиде (50 мл) при перемешивании при комнатной температуре. Спустя 18 ч смесь выливалась в воду (500 мл) и экстрагировалась диэтиловым эфиром (2х400 мл). Экстракты промывались водой (3х150 мл) и солевым раствором (100 мл), сушились и фильтровались через силикагель (50 г, Мерк 60), затем концентрировались при пониженном давлении, давая желтое масло. Перегонка при 160оС и давлении 0,05 мм. рт. ст. давала метил 2-бензилоксифенилацетат в виде чистого бесцветного масла (26,99 г, 83% выход), инфракрасный макс, (пленка): 1730 см-1; IH ЯМР (90 МГц): дельта 3,60 (3Н, с), 3,75 (2Н, с), 4,10 (2H, с), 6,80-7,40 (9H, м), млн. дол.
Смесь метил 2-бензилоксифенилацетата (26,99 г) и метилформата (126,62 г) в сухом диметилформамиде (300 мл) добавлялась по каплям к перемешиваемой суспензии гидрида натрия (50% дисперсия в масле, 10,13 г) в ДМФ (300 мл) при 0оС. После перемешивания при 0оС в течение 2 ч смесь выливалась в воду (1000 мл) и промывалась диэтиловым эфиром (2x150 мл). Водный слой подкислялся до рН 4 с помощью 6 М соляной кислоты, затем экстрагировался диэтиловым эфиром (2х350 мл). Экстракты сушились и концентрировались при пониженном давлении, давая неочищенный метил 2-(2'-бензилоксифенил)-3-гидрокси-акрилат в виде желтого масла, инфракрасный макс. (пленка): 1720, 1660 см-1.
Неочищенный метил 2-(2'-бензилоксифенил)-3-гидроксиакрилат растворялся в сухом диметилформамиде (100 мл), и в виде одной порции добавлялся карбонат калия (29,0 г). Затем по каплям добавлялся диметилсульфат (16,00 г) в сухом ДМФ (10 мл) при перемешивании. Спустя девяносто минут, добавлялась вода, и раствор экстрагировался диэтиловым эфиром (2х300 мл). После промывания водой (3х150 мл) и солевым раствором экстракты сушились и концентрировались при пониженном давлении, и получающееся в результате желтое масло затвердевало после растирания со смесью диэтилового эфира и бензила. Перекристаллизация из сухого метанола давала (Н)-метил-2-/2'-бензилоксифенил/-3-метоксиак- рилат в виде белого кристаллического твердого вещества (5,44 г, 17% выход из метил 2-бензилоксифенилацетата), т.пл. 76-77оС; инфракрасный макс. /нуйол/: 1710, 1640 см-1; IH ЯМР (90 МГц): дельта 3,63 (3Н, с), 3,75 (3Н, с), 5,06 (2Н, с), 6,80-7,40 (9Н, м), 7,50 (IH, с) млн, дол.
/Е/-Метил-2-/2'-бензилоксифенил/-3-метоксиакрилал /5,44 г/ растворялся в этилацетате (50 мл) и добавлялся 5% палладий на угле (0,25 г). Перемешиваемая смесь гидрировалась при давлении в три атмосферы, при перемешивании до тех пор, пока больше не поглощался водород, затем фильтровалась через целит и силикагель (50 г, Мерк 60). Концентрирование фильтрата при пониженном давлении давало /Е/-метил-2-/2'-гидроксифенил/-3-метоксиакрилат в виде белого кристаллического твердого вещества /3,76 г, 99% выход/, т. пл. 125-126оС; инфракрасный макс. /нуйол/: 3400, 1670 см-1;
IH ЯМР (270 МГц): дельта 3,80 (3Н, с), 3,90 (3Н, с), 6,20 (1H, с), 6,80-7,00 (2Н, м), 7,10-7,30 (2Н, м), 7,60 (1Н, с), м.д.
/Е/-Метил 2-/2'-гидроксифенил/-3-метоксиакрилат /0,30 г, 1,44 ммоля/, 2-хлор-5-нитропиридин /0,48 г, 2,88 ммоля) и карбонат калия /0,40 г, 2,88 ммоля/ перемешивались вместе в ДМФ /20 мл/ при комнатной температуре в атмосфере азота. Через 18 ч реакционная смесь выливалась в воду, а затем экстрагировалась дважды диэтиловым эфиром. Объединенные эфирные слои промывались два раза водой и солевым раствором, а затем сушились. Полученный в результате раствор фильтровался через пробку из силикагеля, а затем концентрировался, давая розовое твердое вещество. Хроматография /элюент-диэтиловый эфир/ давала /E/-метил 2-[2'-(5''-нитропиридин-2''-илокси)фенил]-3-метоксиакрилат (240 мг) в виде желтой смолы, которая кристаллизовалась при стоянии, т. пл. 107-109оС;
IH ЯМР: как в табл. 4.
П р и м е р 2. Данный пример иллюстрирует приготовление /E/-метил 2-[2'-(4''-хлорпиримидин-2''-илокси)фенил] -3-меток- сиакрилата (Соединение 61 табл. 1/.
Е-Метил 2-/2'-гидроксифенил/-3-метоксиакрилат (0,63 г), 2,4-дихлорпиримидин (0,75 г) и карбонат калия (0,69 г) перемешивались вместе в ДМФ при комнатной температуре. Спустя 2 ч реакционная смесь выливалась в воду (50 мл) и экстрагировалась два раза диэтиловым эфиром. Объединенные эфирные слои промывались водой /х3/ и соловым раствором /x1/, а затем сушились. Фильтрование и упаривание растворителя при пониженном давлении давали светлое масло. Хроматография с использованием в качестве элюента диэтилового эфира давала /E/-метил-2-[2'(4''-хлорпиримидин-2''-илокси)фенил]-3-метоксиакрилат /0,35 г/ в виде масла, которое кристаллизовалось после растирания с эфиром; т. пл. 120-121,5оС;
IH ЯМР: дельта 3,60 (3Н, с), 3,80 (3Н, с), 6,60 (1Н, д. J=4 Гц), 7,40 (1Н, с), 8,40 (1Н, д. J=4 Гц) м.д.
П р и м е р 3. Данный пример иллюстрирует приготовление /E/-метил 2-[2'-(6''-метилпиридин-3''-илокси)фенил] -3-метоксиак- рилата /Соединение 45 Табл. 1/.
6-Метил-3-гидроксипиридин (9,5 г) суспендировался в толуоле (30 мл) и обрабатывался водной гидроокисью калия (4,9 г в воде 3 мл). Смесь перемешивалась энергично в течение 15 мин, затем упаривалась при пониженном давлении. Последние следы воды удалялись с помощью повторного упаривания в присутствии толуола. Образовавшееся коричневое полутвердое вещество обрабатывалось смесью 2-/2-бромфенил/-1,3-диоксолана (10,0 г/, хлористой меди /60 мг/ и трис[2-(2-метоксиэтокси)-этил] амина /0,194 г/ для солюбилизации медной соли в сухом ДМФ /25 мл/, и смесь нагревалась до 155оС при перемешивании в атмосфере азота в течение 30 ч. Добавлялась дополнительно хлористая медь (60 мг), и нагревание продолжалось в течение 14 ч.
Смесь охлаждалась, выливалась в воду и экстрагировалась этилацетатом. Экстракт промывался 2 н. водным раствором гидроокиси натрия и воды с последующим экстрагированием 2 н. соляной кислотой. Подкисленный водный экстракт обрабатывался твердым карбонатом калия до тех пор, пока рН не будет 8, а затем экстрагировался этилацетатом. Данный органический экстракт сушился, а затем упаривался при пониженном давлении, давая 2-/6'-метил- пиридин-3'- илокси/-бензальдегид /2,2 г/ в виде масла; инфракрасный максимум /пленка/: 1697, 1606, 1480 см-1;
IH ЯМР: дельта 2,58 (3Н, с), 6,86 (1H, с), 7,23 (3Н, м), 7,55 (1Н,т), 7,95 (2Н, м), 8,35 (IH, м), 10,53 (IH, с), млн. дол.
2-(6'-Метилпиридин-3'-илокси)бензаль- дегид (2,08 г) и метил метилсульфинилсульфид (1,21 г) растворялись в сухом ТГФ (15 мл), и Тритон В (1,5 мл) добавлялся медленно по каплям при перемешивании при комнатной температуре. Смесь отстаивалась в течение ночи, разбавлялась водой и экстрагировалась этилацетатом. Данный экстракт сушился, а затем упаривался при пониженном давлении, давая оранжево-коричневое масло (3,2 г). Масло обрабатывалось метанольным раствором хлористого водорода (25 мл. 2,6 н.) и стояло при комнатной температуре в течение ночи. Раствор затем разбавлялся водой и доводился до рН 8 путем добавления карбоната натрия. Смесь экстрагировалась этилацетатом и экстракт сушился и упаривался, давая коричневое масло (2,23 г), которое очищалось с помощью жидкостной хроматографии высокой разрешающей способности /элюент 1: 1, смесь этилацетат:гексан/, давая метил[2-(6'-метилпиридин-3'-илокси)фенил] ацетат в виде желтого масла /1,53 г/, инфракрасный максимум /пленка/: 1747, 1488, 1237 см-1;
IH ЯМР: дельта 2,54 (3Н, с), 3,63 (3Н, с), 3,64 (2Н, с), 6,84 (1Н, д), 7,24 (5Н, м), 8,3 (1Н, д), млн. дол.
Смесь метил [2-(6'-метилпиридин-3'-илокси)фенил] ацетата (1,3 г) и метилформата (1,52 г) в ДМФ (5 мл) добавлялась по каплям к суспензии гидрида натрия (316 мг 50% дисперсии в масле) в ДМФ (5 мл) при перемешивании при 5оС. После перемешивания в течение 4 ч смесь разбавлялась водой, делалась слабо кислой с помощью добавления ледяной уксусной кислоты /рН 4-5/ и экстрагировалась этилацетатом. Данный экстракт после сушки и упаривания при пониженном давлении давал метил 2-[2'-(6''-метилпиридин-3''-илокси)фенил]-3- гидроксиакрилат в виде желтого масла (1,15 г);
IH ЯМР: дельта 2,53 (3Н, с), 3,63 (3Н, с), 6,89 (IH, с), 7,2 (5Н, м), 8,21 (1Н, д) млн. дол.
Масло (1,14 г) растворялось в ДМФ (15 мл), добавлялся карбонат калия (1,1 г), и смесь перемешивалась в течение 15 минут. Диметилсульфат (0,53 г) растворялся в ДМФ (5 мл), и данный раствор добавлялся к смеси. Получающаяся в результате смесь перемешивалась в течение 30 минут, затем разбавлялась водой, и получающаяся эмульсия экстрагировалась этилацетатом. Данный экстракт сушился и упаривался при пониженном давлении, давая желтое масло (2,06 г), которое очищалось с помощью НРLC/элюент: этилацетат/, давая /Е/-метил-2-[2'-(6''-метилпиридин-3''-илокси)фе- нил]-3-метоксиарилат в виде бледно-желтого масла (0,73 г), инфракрасный максимум (пленка): 1705, 1642, 1488 см-1;
IH ЯМР: дельта 2,52 (3Н, с), 3,63 (3Н, с), 3,81 (3Н, с), 6,88 (1Н, д), 7,04-7,32 (5Н, м), 7,51 (1Н, с), 8,26 (1Н, д) млн. дол.
П р и м е р 4. Используя методику примера 1, получили следующие соединения; 1. /Е/-метил 2-[2'-(5''-хлорпиридин-2''-илокси)фенил]-3-метоксиакрилат, т. пл. 77-78оС;
инфракрасный макс. 1700, 1625, 1260, 1200 см-1;
1Н ЯМР: дельта /СДСI3/3, 57 (3Н, с), 3,74 (3Н, с), 6,75 (1Н, д), 7,41 (1Н, с), 8,10 (1Н, шир, с), 7,1-7,65 (м) м.д.
2. /E/-метил-2-[2'-(5''-цианопиридин-2''-илокси)фенил]-3-метоксиакрилата (соединение 127 табл. 1), в виде белых кристаллов, т. пл. 108,5-109,5оС;
1Н ЯМР дельта 3,58 (3Н, с), 3,75 (3Н, с), 6,9 (1Н, д), 7,1 (1Н, д), 7,28-7,4 (4Н, м), 7,45 (1Н, с), 7,85 (1Н, кв.), 8,45 (1Н, д), м.д.
3. /E/-метил-2-[2'-(5''-хлорпиридин-2''-илтио)фенил] -3-метоксиакрилат (соединение 14 табл. 2), в виде густой смолы, инфракрасный макс. 1700, 1630 см-1;
1Н ЯМР: как в табл. 4.
4. /E/-метил 2-[2'(5''-бромпирид-2''-илсульфонил)фенил]-3-метоксиакрилат в виде смолы;
1Н ЯМР: как в табл. 4.
5. /E/-метил 2-[2'(5''-бромпирид-2''-илсульфонил)фенил]-3-метоксиакрилат в виде аморфного твердого вещества;
1Н ЯМР: как в табл. 4.
6. /E/-Метил 2-[2'-(5''-метоксикарбонилпиридин-2''-илокси)фенил] 3-метоксиакрилата (соединение 141 табл. 1).
1Н ЯМР: дельта 3,47 (3Н, с), 3,62 (3Н, с), 3,82 (3Н, с), 6,75-7,3 (5Н, м), 7,32 (1Н, с), 8,15 (1Н, кв.), 8,72 (1,Н, д), м.д.
7. /E/-Метил 2-[2'-(5''-бензилоксикарбонилпиридин-2''-илокси)фенил]-3-метоксиак- рилата (соединение N 184 таблицы 1), в виде смолы;
1Н ЯМР: дельта 3,55 (3Н, с), 3,60 (3Н, с), 5,35 (2Н, с), 6,82 (1Н, д), 7,18-7,48 (м), включая один протонный синглет при 7,39), 8,25 (1Н, кв.), 8,25 (1Н, д), м.д.
Ниже следуют примеры композиций, подходящих для сельскохозяйственного и садового применения, которые могут преобразовываться в готовые препаративные формы из соединений данного изобретения. Такие композиции образуют еще один аспект данного изобретения.
П р и м е р 5. Эмульгируемый концентрат приготавливается путем смешения и перемешивания ингредиентов до тех пор, пока они все не растворятся. Соединение 61 табл. 1 10% Бензиловый спирт 30%
Додецилбензолсуль- фонат кальция 5%
Нонилфенолэтокси-
лат (13 молей окиси этилена) 10% Алкилбензолы 45%
П р и м е р 6. Активный ингредиент растворяется в метилендихлориде, и полученная в результате жидкость разбрызгивается на гранулы аттапульгитной глины. Растворителю затем дают возможность испариться, получая композицию в виде гранул. Соединение 14 табл. 1 5% Гранулы аппатульгита 95%
П р и м е р 7. Композиция, подходящая для использования в качестве протравления семян, приготавливается с помощью измельчения и смешения трех ингредиентов. Соединение 61 табл. 1 50% Минеральное масло 2% Китайская глина 48%
П р и м е р 8. Дустовый порошок приготавливается с помощью измельчения и смешения активного ингредиента с тальком. Соединение 61 табл. 1 5% Тальк 95%
П р и м е р 9. Суспензионный концентрат приготавливается с помощью шарового измельчения ингредиентов с образованием водной суспензии измельченной смеси с водой. Соединение 61 40% Лигносульфонат натрия 10% Бентонитная глина 1% Вода 49%
Данная препаративная форма может использоваться в виде спрея с помощью разбавления водой или применяться непосредственно по отношению к семенам.
П р и м е р 10. Форма смачиваемого порошка изготавливается путем смешения вместе с измельчением ингредиентов до тех пор, пока они все не смешаются тщательно. Соединение 61 табл. 1 25% Лаурилсульфат натрия 2% Лигносульфонат натрия 5% Кремнезем 25% Китайская глина 43%
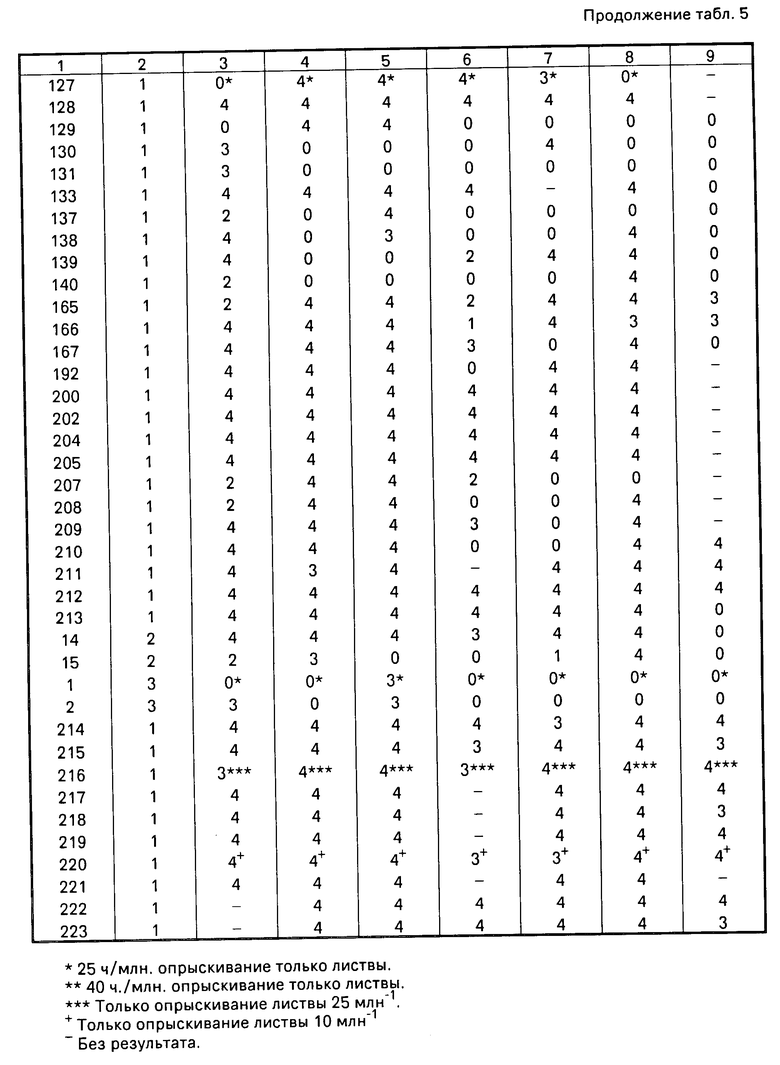
П р и м е р 11. Соединения испытывались против множества грибковых заболеваний листвы растений. Технология, применяемая при испытаниях, заключалась в следующем.
Растения выращивались в компосте для горшков John Jnnes /1 или 2/ в минигоршках диаметром 4 см. Испытываемые соединения преобразовывались в готовую форму препарата или измельчением шариками с водным Дисперзолем Т или в виде раствора в ацетоне или смеси ацетона и этанола, который разбавлялся до требуемой концентрации непосредственно перед использованием. В случае заболеваний листвы препараты (100 ч на млн. активного ингредиента) распылялись на листья и применялись к корням растений в почве. Спреи применялись до максимального удержания на поверхности, а корни увлажнялись до конечной концентрации, эквивалентной приблизительно 40 част. на млн. активного ингредиента в сухой почве. Когда спреи применялись по отношению к злаковым, добавлялся Твин 20 для получения конечной концентрации 0,05
В случае большинства испытаний соединение применялось по отношению к почве /и корням/ и к листве /опрыскиванием/ за один или два дня до заражения растения болезнью. Исключением было испытание против Erysiphe graminis, при котором растения инокулировались за 24 ч до обработки. Лиственные патогенные организмы применялись путем разбрызгивания суспензий спор на листья испытываемых растений. После инокуляции растения помещались в соответствующую окружающую среду для обеспечения возможности развития заболевания, а затем инкубировались до тех пор, пока инокуляция не была готовой для оценки. Период между инокуляцией и оценкой варьировал от 4 до 14 дней, в зависимости от болезни и окружающих условий.
Борьба с заболеванием регистрировалась по следующей шкале;
4=отсутствие болезни;
3=следы -5% заболевания на необработанных растениях;
2=6-25 болезни на необработанных растениях;
1=26-59% болезни на необработанных растениях;
0=60-100% болезни на необработанных растениях:
Результаты приведены в табл. 5.
П р и м е р 12. Данный пример иллюстрирует свойства соединений 14-16, 22, 61, 132 и 138-140 табл. 1 регулировать рост растений.
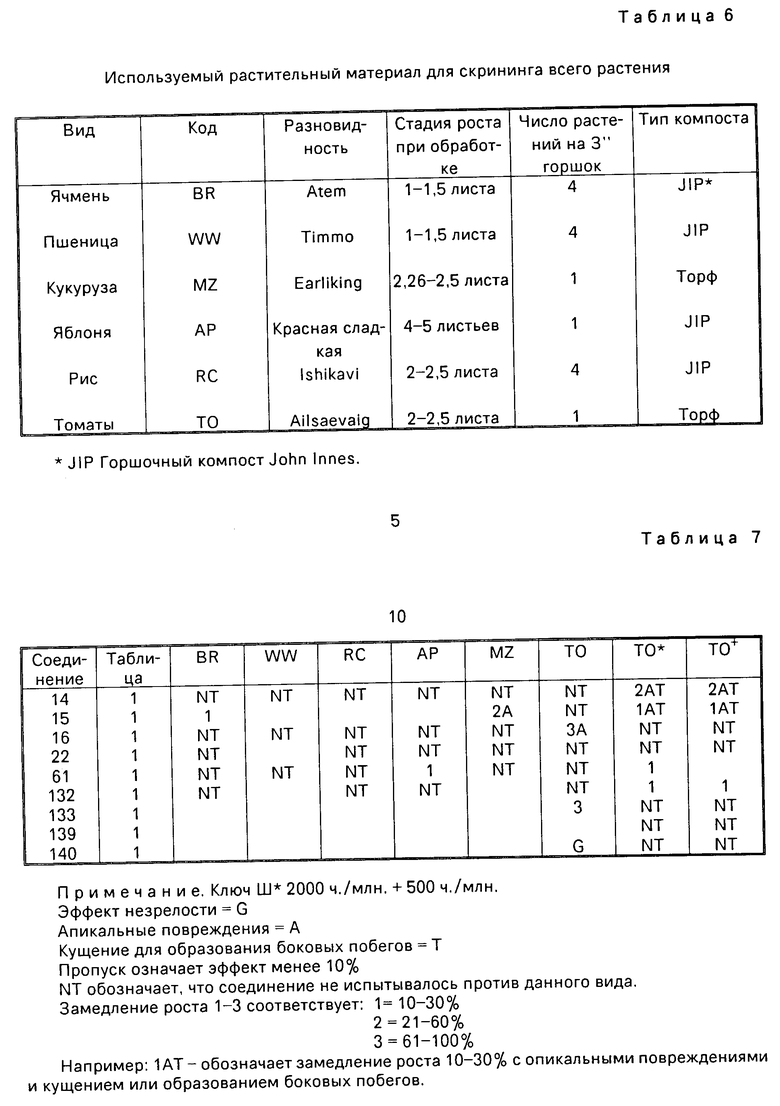
Эти соединения испытывались при проведении скрининга на активность регулирования роста растений на шести видах растений. Виды растений, используемые в данном скрининге, представлены в табл. 6 с указанием листовой стадии, на которой растения опрыскивались.
Препарат каждого химиката применялся в количестве 4000 част. /млн./4 кг/га при полевом объеме 1000 л/га/ с использованием гусеничного опрыскивателя и сопла SS 8004Е /Teejet/. Дополнительные испытания проводились на томатах с использованием 2000 и 500 ч./млн.
После опрыскивания растения выращивались в теплице с температурой днем 25оС и ночью -22оС. Исключением в данном испытании были злаковые умеренного климата, пшеница и ячмень, которые выращивались при дневных температурах 13-16оС и температурах ночью -11-13оС. Когда это было необходимо, для обеспечения средней продолжительности фотопериода 16 ч /минимум 14 ч/ применялось дополнительное освещение.
После 2-6 недель нахождения в теплице, в зависимости от вида и времени года, растения оценивались визуально в отношении морфологических характеристик по сравнению с контрольными растениями, опрыскиваемыми бланк-препаратами (без активного вещества). Результаты представлены в табл. 7.
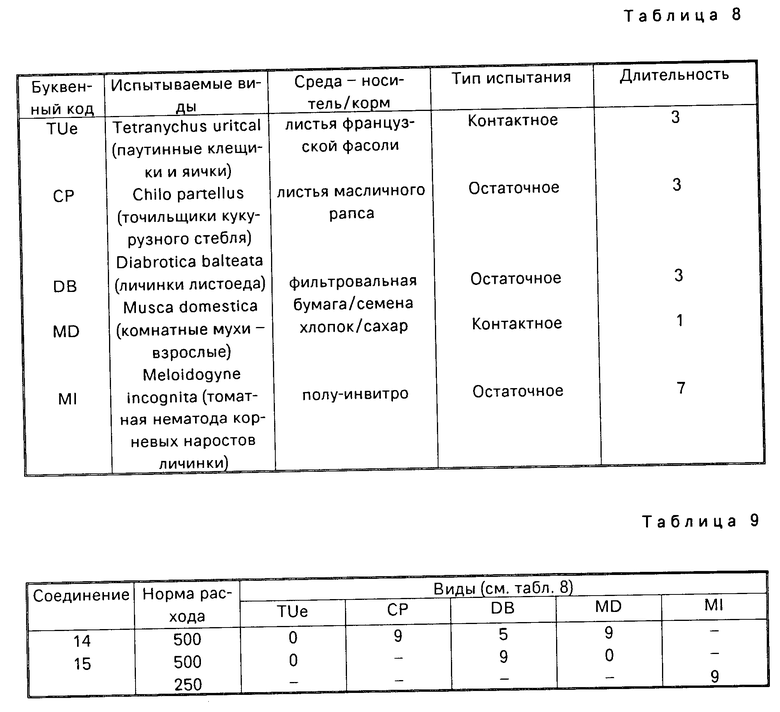
П р и м е р 13. Данный пример иллюстрирует инсектицидные свойства некоторых соединений формулы /1/.
Активность каждого соединения определялась при использовании различных насекомых клещей и нематодных вредителей. Соединение использовалось в виде жидких препаратов, содержащих 100-500 ч./млн/ по массе соединения. Препараты приготавливались с помощью растворения соединения в ацетоне и разбавления растворов водой, содержащей 0,1% по массе смачивающего агента, продаваемого под торговым наименованием "СИНПЕРОНИК" МХ, до тех пор, пока жидкие препараты не будут содержать требуемую концентрацию продукта. "СИНПЕРОНИК" является зарегистрированной торговой маркой.
Процедура испытания, применяемая в отношении каждого из вредителей, была в основном одной и той же и предусматривала помещение ряда вредителей на среду, которой было обычно растение-хозяин или корм, которым питались вредители, и обработку или среды, или вредителей или и того и другого препаратами. Смертность вредителей оценивалась через периоды, обычно варьирующиеся от одного до семи дней после обработки.
Результаты испытаний даны в таблице 9 каждого из продуктов, взятых в количестве в частях на миллион, данном во второй колонке, при этом шкала оценки смертности обозначилась как 9, 5 или 0, где 9 обозначает 80-100% смертность (70-100%) снижение отрастания корней по сравнению с необработанными растениями в случае Meloidogyne incognita, 5 означает 50-79% смертность (50-69% ) уменьшение отрастания корней в случае Meloidogyne incognita и 0 означает менее, чем 50% смертность (уменьшение отрастания корней для Мeloidogyne incognita).
В таблице 9 используемый организм вредитель обозначается буквенным кодом, а виды вредителей, среда или корм, и тип и длительность испытания даются в табл. 8.
По мнению заявителя, структурно ближайшим соединением, о котором ранее было известно о наличии у него фунгицидных свойств, является природный продукт стробилурин-А, описанный в FEBS Letters, vol, 132, N 2 (сентябрь 1981), стр. 329-333.
Стробилурин-А или "муцидин" имеет следующую структуру: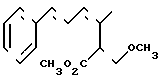 Он был впервые выделен в 1969 г. (Musilek et al. Folia Microbiol. (Prague) 1969,
Он был впервые выделен в 1969 г. (Musilek et al. Folia Microbiol. (Prague) 1969,  , 377; СА, 1970,
, 377; СА, 1970,  , 11356h), а его фунгицидная активность описана позже (например, J. Kejda Prakt. Lek. 1980,
, 11356h), а его фунгицидная активность описана позже (например, J. Kejda Prakt. Lek. 1980,  , 26; СА, 1980,
, 26; СА, 1980,  , 143792r). Было заявлено, что "муцидин" может быть потенциально полезным в защите растений "(Sasuk and Musilek, Folia Microbiol. (Prague) 1974,
, 143792r). Было заявлено, что "муцидин" может быть потенциально полезным в защите растений "(Sasuk and Musilek, Folia Microbiol. (Prague) 1974,  , 139; СА, 1974,
, 139; СА, 1974,  , 33868q). Структура соединения, включая правильную (
, 33868q). Структура соединения, включая правильную ( ,
,  ,
, 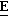 )-геометрию, появилась в 1979 г. (патент ЧССР N 180177; СА, 1980,
)-геометрию, появилась в 1979 г. (патент ЧССР N 180177; СА, 1980,  , 20428 с). То, что стробилурин-А и муцидин являются одним и тем же соединением, было выяснено в 1981 г. (Sedmara et al J. Antibiol. 1981,
, 20428 с). То, что стробилурин-А и муцидин являются одним и тем же соединением, было выяснено в 1981 г. (Sedmara et al J. Antibiol. 1981,  , 1069).
, 1069).
Чтобы проиллюстрировать положительный эффект предложенных заявителем соединений, стробилурин-А может быть сопоставлен, например, с соединением II из табл. I, имеющим структуру:
Фунгицидная активность двух соединений на растениях продемонстрирована испытаниями, проведенными с использованием общей методики, описанной в примере 11 настоящей заявки, за исключением того, что оба соединения применяли в виде препаратов, содержащих 25 млн.-1активного ингредиента. В случае соединения 11 препарат наносили лишь опрыскиванием на листву. В случае стробилурина-А препарат наносили опрыскиванием на листву, аналогично соединению 11, а также пропитыванием корневого слоя почвы. Полученные результаты (с использованием градаций, описанной в примере 11):
Результаты ясно показывают, что соединение 11 из табл. 1 заявки более активно, чем стробилурин-А в качестве фунгицида для растений, даже при использовании стробилурина-А комбинированным образом опрыскивание листвы/замачивание корневого слоя, а соединение 11 лишь опрыскивание листвы.
В отношении токсичности, на основании проведенных работ был сделан вывод, что соединения принадлежат к категории малотоксичных.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПРОПЕНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 1989 |
|
RU2024496C1 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНА | 1992 |
|
RU2043990C1 |
| ЗАМЕЩЕННЫЕ АЦИЛАМИНОБЕНЗАМИДЫ, ОБЛАДАЮЩИЕ ФУНГИЦИДНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1990 |
|
RU2034829C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ АЦИЛАМИНОБЕНЗАМИДОВ | 1991 |
|
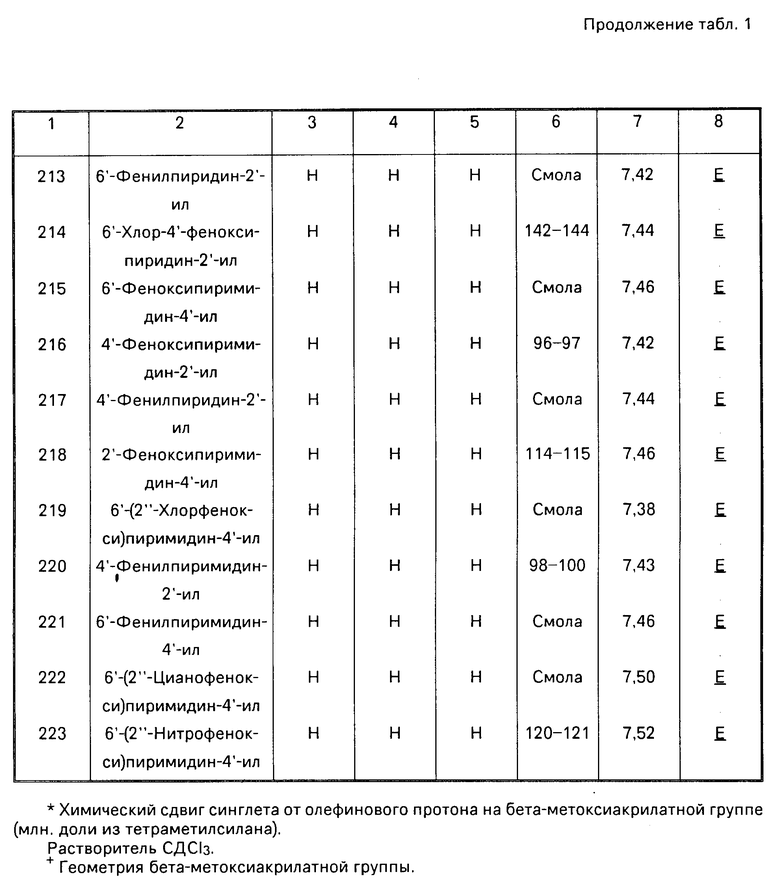
RU2032662C1 |
| СПОСОБ ПОЛУЧЕНИЯ Е-ИЗОМЕРОВ ПРОИЗВОДНЫХ АКРИЛОВОЙ КИСЛОТЫ | 1988 |
|
RU2024511C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПРОПЕНОВОЙ КИСЛОТЫ И ИХ СТЕРЕОИЗОМЕРОВ | 1989 |
|
RU2026282C1 |
| ПРОИЗВОДНЫЕ АКРИЛОВОЙ КИСЛОТЫ | 1991 |
|
RU2044723C1 |
| ПРОИЗВОДНЫЕ 1,3-ДИОКСАНАЛКЕНОВОЙ КИСЛОТЫ | 1989 |
|
RU2045526C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ГЕРБИЦИДНОЙ АКТИВНОСТЬЮ, ГЕРБИЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ БОРЬБЫ С РОСТОМ НЕЖЕЛАТЕЛЬНОЙ РАСТИТЕЛЬНОСТИ | 1991 |
|
RU2054003C1 |
| 1,3-ДИИОКСАНОНОВЫЕ ПРОИЗВОДНЫЕ АЛКЕНОВОЙ КИСЛОТЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ | 1989 |
|
RU2040525C1 |

Использование: синтез органических соединений, обладающих пестицидной активностью. Сущность изобретения: производные акриловой кислоты общей ф-лы C6H4(A-W)C(CO2CH3)=CHOCH3, где W пиридил, замещенный 1 4 раза заместителями, выбранными из галогена, C1-C4 -алкила, возможно замещенного галогеном, C1-C4 -алкокси, фенила, фенокси, амино, формамидо, нитро, циано, N-оксида; пиримидинил, замещенный 1 2 раза галогеном, C1-C4 -алкилом, возможно замещенным галогеном, C1-C4 -алкокси, фенилом, фенокси, возможно замещенным нитро, циано; хинолинил или галогенхиназолинил, связанные с А с помощью одного из кольцевых атомов углерода, А-кислород, S(O)n, n 0, 1, 2, при условии, когда W S-трифторметилпиридин-2-ил, А отличен от кислорода. 3 ил. 9 табл.
ПРОИЗВОДНЫЕ АКРИЛОВОЙ КИСЛОТЫ общей формулы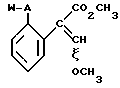
где W пиридил, однократно замещенный галогеном, С1 - С4-алкилом(возможно замещенным галогеном)фенилом, С1 - С4-алкокси, фенокси(возможно замещенным 1-метоксикарбонил-2-метоксиэтенилом); амино-, формамидо-, нитро-, циано- или N-оксидной группой, двукратно замещенный заместителями, выбранными из группы галоген, трифторметил, С1 С4-алкил, циано-, нитрогруппа, С1 С4-алкокси, фенокси, трехкратно-заместителями, выбранными из галогена, трифторметила, цианогруппы, четырехкратно-заместителями, выбранными из фтора, трифторметила, цианогруппы, или W пиримидинил, однократно замещенный галогеном, С1 С4-алкилом(возможно замещенным галогеном); С1 С4-алкокси, фенилом, фенокси(возможно замещенным галогеном, нитро- или цианогруппой)двухкратно замещенный заместителями, выбранными из галогена, трихлорметила, С1 С4-алкила, или хинолинил, или галогенхиназолинил, связанные с A с помощью одного из кольцевых атомов углерода;
A кислород или S(O)n, где n 0,1 или 2, при условии, что когда W 5-трифторметилпиридин-2-ил, A отличен от кислорода.
Приоритет по признакам:
17.04.86 при W все значения пиридила, кроме замещенного N-оксидной группой, все значения пиримидинила, A-кислород.
| Патент США 4254262, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Приспособление для изготовления в грунте бетонных свай с употреблением обсадных труб | 1915 |
|
SU1981A1 |
Авторы
Даты
1995-07-09—Публикация
1991-12-10—Подача