Изобретение относится к органической химии и касается новых соединений производных триазолилгидразида.
В частности, объектом изобретения являются производные триазолилгидразида общей формулы I
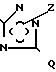 где Q водород, шестичленная гетероциклическая группа, содержащая один атом азота и один атом кислорода, шестичленная гетероциклическая группа, содержащая 1-2 атома азота и незамещенная или замещенная алкильной группой С1-С4, или группа формулы SR1, где R1 алкил С1-С4 или группа NR2R3, где R2 и R3 одинаковы и означают водород, алкил С1-С6 или линейный алкенил С2-С6, Х кислород или сера,
где Q водород, шестичленная гетероциклическая группа, содержащая один атом азота и один атом кислорода, шестичленная гетероциклическая группа, содержащая 1-2 атома азота и незамещенная или замещенная алкильной группой С1-С4, или группа формулы SR1, где R1 алкил С1-С4 или группа NR2R3, где R2 и R3 одинаковы и означают водород, алкил С1-С6 или линейный алкенил С2-С6, Х кислород или сера,
R7 водород, фенил (алкил С1-С4), при необходимости замещенный одним атомом галогена, или аминогруппа, при необходимости замещенная одной или двумя алкильными группами С1-С4,
R8 и Z различны и означают водород или группу формулы (С=Х) (N-R4) NR5R6, где R4, R5 и R6 водород или алкил С1-С4, а также фармацевтически приемлемые соли этих соединений.
Изобретение распространяется на все изомеры или все таутомерные формы соединений с общей формулой (1).
В соответствии с изобретением новые соединения обладают высокой биологичекой активностью и низкой токсичностью, они обладают противоангинным, седативным, сердечно-сосудистым и антивирусным эффектом, задерживают секрецию кислоты и развитие язвы желудка, могут быть использованы как исходные материалы для получения фармацевтически активных производных.
В соответствии с изобретением термин "гетероциклическая группа" относится к гетероциклическим группам с шестью звеньями, которые могут быть образованы из соединений, включающих в себя один или более атом(ы) азота и/или кислорода, или группу, которая может быть получена при конденсации этих соединений друг с другом или с бензолом. Это могут быть ароматические или частично или полностью насыщенные группы, которые могут содержать один или более заместитель(ей).
Примерами таких групп являются группы пиперидила, морфолинила, пиперазинила, фурила, имидазолила, пиридила, пиримидинила, пирролила, пиразолила, пиридазинила, изоаксазолила, пирролинила, пирролидинила, имидазолидинила, имидазолинила, пиразолидинила, пиразолинила, пиранила или дельта-3-пиперидин-1-ила.
Термин "алкильная группа" относится к группам насыщенных алифатических углеводородов с открытой или разветвленной цепью, включающих в себя от 1 до 4 или от 1 до 6 атомов углерода, т.е. метил, этил, изобутил, трет-бутил, н-гексил и т.п.
К группам С2-С6-алкенил относятся алкенил-группы с прямой или разветвленной цепью (т. е. винил, аллил, 2-метил-аллил, 1 пропенил, 2 пропенил, 1-бутенил, 2-бутенил, 2-пентенил, 2-гексенил и т.п.).
Термин "галоген" означает атомы фтора, хлора, брома, йода.
Соединения с общей формулой (1), где Q представляет собой морфолина, метилтио, диметиламино или N-метил-пиперазинил, и R7 и R8каждый обозначает водород, а таже фармацевтически пригодные соли, полученные путем добавления к ним кислоты, обладают довольно значительным фармацев- тическим действием.
Наиболее целесообразно использовать следующие производные соединения с общей формулой I:
1-(5-амино-3-морфолино-1 -1,2,4-триа- зол-1-ил)-N-метилкарботиогидразид,
-1,2,4-триа- зол-1-ил)-N-метилкарботиогидразид,
1-(5-амино-3-метилтиоо-1 -1,2,4-триа- зол-1-ил)карботиогидразид, 1-(5-амино-3-N-метилпиперазинил-1
-1,2,4-триа- зол-1-ил)карботиогидразид, 1-(5-амино-3-N-метилпиперазинил-1 -1,2,4-триазол-1-ил)-карботиогидразид,
-1,2,4-триазол-1-ил)-карботиогидразид,
1-(5-амино-3-морфолино-1 -1,2,4-триа- зол-1-ил)-N, N'-диметилкарботиогидразид, и фармацевтически пригодные соли, получаемые путем добавления к ним кислоты.
-1,2,4-триа- зол-1-ил)-N, N'-диметилкарботиогидразид, и фармацевтически пригодные соли, получаемые путем добавления к ним кислоты.
Соединения общей формулы I являются органическими основаниями, поэтому они могут быть превращены в соли путем добавления кислоты. Фармацевтически пригодные соли соединений общей формулы I могут быть образованы путем присоединения органических или неорганических кислот. Примерами таких фармацевтически пригодных солей, полученных путем присоединения кислот, являются гидрогалиды (такие как гидрохлориды или гидробромиды, карбонаты, сульфаты, ацетаты, фумараты, малеаты, цитраты, соли аскорбиновой кислоты и соли винной кислоты.
Новые соединения общей формулы I и их фармацевтически пригодные соли присоединения кислот получают тем, что
а) подвергают взаимодействию сложный триазолиловый эфир общей формулы II
 где Y означает водород или группу формулы (С=Х) ХR9 где Х указан выше, R9 C1-С4 алкил или фенил, по желанию, замещенный одним или более атомом(ами) галогена.
где Y означает водород или группу формулы (С=Х) ХR9 где Х указан выше, R9 C1-С4 алкил или фенил, по желанию, замещенный одним или более атомом(ами) галогена.
R7 и Q определены выше,
R10 означает водород или группу формулы (С=Х) XR9 причем если Y означает водород, то R10 представляет собой группу формулы (С=Х) XR9, где Х и R9 определены выше, а если Y означает группу формулы (С=Х) XR9, R10 представляет собой водород,
с производным гидразина общей формулы III
H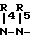 R6 где R4, R5 и R6 определены выше, или
R6 где R4, R5 и R6 определены выше, или
б) для получения изомеров общей формулы Iв, Ic и Id, представляющий собой подгруппы соединений общей формулы I

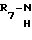

(Ic)

(Id) осуществляют взаимодействие сложного триазолилового эфира общей формулы IIa,
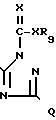
(IIa) где R7, R9, X и Q определены выше,
с производным гидразина общей формулы (III), затем нагревают полученное соединение общей формулы (Ia)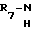
 и разделяют изомеры известными способами, или
и разделяют изомеры известными способами, или
в) для получения изомеров с общей формулой Iв, Ic и Id представляющих собой подгруппы соединений общей формулы I, нагревают соединения общей формулы Ia и выделяют изомеры из таким образом полученных веществ известными способами;
или
и) для получения соединений общей формулы Ia, представляющих собой подгруппу соединений общей формулы (I), где R4, R5, R6 и R7 обозначают водород и Q обозначает группу формулы SR11, где R11 обозначает С1-С4, алкил или фенил (С1-С4 алкил), при необходимости замещенные одним или более галогеном С1-C4 алкил- или нитрогруппами,
осуществляют взаимодействие соединения общей формулы IV,
NH2-NH- -NH-NH2 где Х определен выше, с соединением с общей формулой V
-NH-NH2 где Х определен выше, с соединением с общей формулой V
NC-N=C где R11 определен выше,
где R11 определен выше,
и по желанию превращают таким образом полученное соединение общей формулы I в фармацевтически пригодную соль присоединения кислоты или путем превращения основной соли с общей формулой I в другую соль при добавлении кислоты.
Взаимодействие соединений общей формулы II и IIa, соответственно, с производными гидразина общей формулы III проводят в растворителе, инертном по отношению к реагентам. Для этого целесообразно использовать метанол, 2 пропанол, бензол или диметилсульфоксид. Реакцию проводят при температуре 0 190оС, предпочтительно при 20-110оС. По желанию, реакцию проводят в присутствии основания, предпочтительно органического основания.
Изомеризация соединений общей формулы Ia до соединения общей формулы Iв, Ic и Id может быть проведена в расплаве или путем термической перегруппировки в полярном или диполярном апротонном растворителе, предпочтительно в уксусной кислоте или диметилформамиде, при температуре 30 110оС, предпочтительно при температуре 70 80оС. В ходе реакции образуется смесь соединений общей формулы Iв, Ic и Id, которые могут быть разделены на отдельные изомеры известными способами, т.е. путем хроматографии или фркционированной кристаллизации.
Взаимодействие соединений общей формулы IV и V, может быть осуществлено в полярном растворителе, предпочтительно в водном растворе мтеанола, диметилформамиде или диметилсульфоксиде при температуре между 0 и 190оС, предпочтительно при температуре от 50 до 160оС.
Соединения общей формулы I, полученные в форме основания, могут быть превращены в соли при добавлении кислоты известными способами, для этого свободные основания взаимодействуют с соответствующей кислотой в инертном растворителе.
Триазолил-эфиры общей формулы II, используемые как исходные вещества, являются известными соединениями или могут быть получены по аналогии с известными соединениями.
Производные гидразина общей формулы III также известны.
Карбогидразид и тиокарбогидразид с общей формулой V являются товарными продуктами.
Вещества общей формулы V также являются товарными продуктами или могут быть получены известным способом.
Соединения общей формулы I обладают высокой биологической активностью и низкой токсичностью. Они обладают противоангинным, седативным, сердечно-сосудистым и антивирусным действием, задерживают секрецию кислоты и развитие язвы желудка.
Активность соединений общей формулы I была проверена путем следующих испытаний.
1. Противоангинное действие
Испытание проводили на крысах массой 180 200 г. Животных усыпали с помощью хлоралезуретана (70-700 мг/кг). Данные ЭКГ были зарегистрированы с помощью игольчатого электрода. Экспериментальная коронарная недостаточность была вызвана действием вазопрессина (INE/кг). Высота волны Т была измерена до и после введения вазопрессина в обеих контрольной и испытуемой группах. Вещества для испытаний были введены внутривенно за две минуты до введения вазопрессина. Результаты суммированы в табл.1.
2. действие на перистальтику (кишечника)
Испытания проводили на мышах. Разные дозы вещества для испытаний перорально вводят в мышей, разделенных на группы по три мыши в каждой. Через час после введения животных для испытаний помещают в аппарат Dews. В этом аппарате подсчитывают количество прерываний инфракрасного луча за 30 минут. Полученные результаты приведены в табл.2 и 3.
3. Проверка острой токсичности на мышах
Были использованы мыши породы CFLP (масса тела 18 22 г, обоих полов), по 6 мышей для каждой дозы. Вещества для испытаний в объеме 20 мл/кг были введены внутрь. После введения веществ и наблюдения в течение 14 дней, мышей поместили в пластмассовую клетку при комнатной температуре. Мыши получили воду и стандартный корм для мышей ad libitum. Признаки отравления были определены способом по Litchfeeld и Wilcoxon. Результаты суммированы в табл.4, 5.
Приведенные данные показывают, что некоторые вещества, в соответствии с изобретением, в 8 или 10 раз эффективнее стандартного вещества прениламина при испытаниях на противоангинное действие и эффективнее стандартного вещества мепробамата в качестве ингибитора перистальтики (кишечника). В то же время они обладают очень низкой токсичностью.
Кроме того вещества в соответствии с изобретением обладают значительным антивирусным действием, особенно в отношении штаммов неферментирующих грамотрицательных бактерий. Т.о. вещество по примеру 9 ингибирует, определенные иммунодиффузным методом на агаре концентрацией 500 мг/полость штаммы бактерий, перечисленные в табл.6.
4. Испытание на секрецию желудка и образование язвы на мышах.
Были использованы истощенные мыши массой 150-250 г по 4 мужского пола и по 4 женского пола для каждой дозы. В день эксперимента привратник желудка каждой мыши был перевязан под наркозом эфиром. Дозы веществ для испытаний были введены за 3 ч до операции. Контрольные группы были обработаны аналогичным образом. Через 4 ч после операции животные снова были подвергнуты действию наркоза, их желудки были удалены, содержимое желудка было отделено, и после центрифугирования был измерен объем желудочного сока, определено содержание свободной кислоты и общая кислотность, соответственно, путем титрования с применением 0,1 н. раствора NaOH. Изменения слизистой оболочки желудка были исследованы под микроскопом и определены с помощью метода пункции Adami и сотрудниками.
Полученные результаты приведены в табл.7.
Приведенные данные однозначно показывают, что в соответствии с изобретением действие веществ достигает или даже превосходит действие циметидина, их токсичность незначительна и связана с различными структурами, они не подвержены побочному неблагоприятному влиянию, которому подвержен циметидин.
Соединения согласно изобретению применяют для получения фармацевтических препаратов, включающих в себя в качестве активного ингредиента по крайней мере одно соединение общей формулы (I) или фармацевтически пригодную соль присоединения кислоты в смеси с соответствующими инертными твердыми или жидкими фармацевтическими носителями.
Такие фармацевтические препараты могут быть получены известными способами путем смешивания активных ингредиентов с соответствующими инертными твердыми или жидкими носителями. Эти фармацевтические вещества можно применять для орального приема (т.е. таблетка, пилюля, пилюла в оболочке, драже, твердая или мягкая желатиновая капсула, раствор, эмульсия или суспензия), парентерального (т. е. инъекционный раствор) или ректального (т.е. свеча) введения.
В качестве носителя для получения таблеток, таблеток в оболочке, драже и твердых желатиновых капсул в равной степени можно использовать лактозу, кукурузный крахмал, картофельный крахмал, тальк, карбонат магния, стеарат магния, карбонат кальция, стеариновую кислоту или ее соли. В качестве носителя для мягких желатиновых капсул можно использовать растительные масла, жиры, воск или полиолы соответствующей консистенции. В качестве носителей для растворов и сиропов можно использовать волные полиолы (полиэтиленгликоль) сахарозу или глюкозу. Растворы для инъекций могут в качестве носителей содержать водные спирты, полиолы, глицерол или растительные масла. Свечи можно приготовить с помощью масел, воска, жиров или полиолов соответствующей консистенции.
Кроме того, лекарственные препараты могут включать в себя вспомогательные ингредиенты, обычно применяемые в фармацевтической промышленности, т. е. увлажнители, мягчители, ароматические вещества, соли, вызывающие изменение осмотического давления, буферные растворы.
Соединения общей формулы I целесообразно использовать в оральной терапии в виде таблеток или капсул. Особенно целесообразно использовать таблетки и капсулы с содержанием активного ингредиента 0,5 500 мг.
Дневная доза соединения общей формулы I может изменяться в широком диапазоне в зависимости от таких факторов, как активность активного ингредиента, состояние и возраст пациента, сложности заболевания и т.п. Оральная доза в целом составляет 2 5000 мг/день, целесообразно 5 1000 мг/день. Необходимо подчеркнуть, что более высокая доза имеет только информативный характер, а доза для приема должна быть всегда определена физиоте- рапевтом.
Соединения с общей формулой I или их фармацевтически пригодных соли используют для получения фармацевтических веществ, имеющих, в частности, противо- ангинное действие и/или тормозящих процесс образования язвы.
Изобретение более подробно иллюстрируется нижеследующими примерами, которые не ограничивают Обем данного изобретения.
П р и м е р 1. 1-(5-Аамино-3-морфолино-1 -1,2,4-триазол-1-ил)-N-метилкарботиоги- дразид.
-1,2,4-триазол-1-ил)-N-метилкарботиоги- дразид.
25,7 г (0,1 моля) метил-(5-амино-3-морфолино-1 -1,2,4-триазол-1-ил)карбодитиоа- та перемешивают в 150 мл метанола в присутствии 6,9 мл (0,13 моля) метилгидразина в течение 4 ч при комнатной температуре. Затем выделенные кристаллы отфильтровывают и перекристаллизовывают из бензола.
-1,2,4-триазол-1-ил)карбодитиоа- та перемешивают в 150 мл метанола в присутствии 6,9 мл (0,13 моля) метилгидразина в течение 4 ч при комнатной температуре. Затем выделенные кристаллы отфильтровывают и перекристаллизовывают из бензола.
Выход 15,0 г (59%),
Т.пл. 144-146оС.
П р и м е р 2. 1-(5-Амино-3-морфолино-1 -1,2,4-триазол-1-ил)-N'-метилкарботиоги- дразид.
-1,2,4-триазол-1-ил)-N'-метилкарботиоги- дразид.
Процесс проходит так, как описано в примере 1, с той разницей, что маточную жидкость, полученную после фильтрования реакционной смеси, выдерживают в течение 2 дней. Затем выделенные кристаллы отфильтровывают и перекристаллизовывают из 2-пропанола.
Выход 3,8 г (15%).
Т.пл. 125-126оС.
П р и м е р 3. 1-(5-Амино-3-морфолино-1 -1,2,4-триазол-1-ил)-N-метилкарботиоги- дразид.
-1,2,4-триазол-1-ил)-N-метилкарботиоги- дразид.
25,7 г (0,1 моля) метил-(5-амино-3-морфолино-1 -1,2,4-триазол-1-ил) карбодитиоата перемешивают в 100 мл диметил- сульфоксида в присутствии 5,7 мл (0,11 моля) метилгидразина в течение 8 ч при комнатной температуре. Реакционную смесь вливают в 100 мл воды, выделенные кристаллы отфильтровывают и перекристаллизовывают из бензола.
-1,2,4-триазол-1-ил) карбодитиоата перемешивают в 100 мл диметил- сульфоксида в присутствии 5,7 мл (0,11 моля) метилгидразина в течение 8 ч при комнатной температуре. Реакционную смесь вливают в 100 мл воды, выделенные кристаллы отфильтровывают и перекристаллизовывают из бензола.
Выход 8,3 г (38%).
Т.пл. 144-146оС.
П р и м е р 4. 1-(5-Амино-3-метилтио-1 -1,2,4-триазол-1-ил)-N-метилкарботиогидра- зид.
-1,2,4-триазол-1-ил)-N-метилкарботиогидра- зид.
22,0 г (0,1 моля) метил-(5-амино-3-метилтио-1 -1,2,4-триазол-1-ил) карбодитиоата перемешивают в 150 мл метанола в присутствии 6,9 мл (0,13 моля) метилгидразина в течение 4 ч при комнатной температуре. Выделенные кристаллы отфильтровывают и перекристаллизовывают из бензола.
-1,2,4-триазол-1-ил) карбодитиоата перемешивают в 150 мл метанола в присутствии 6,9 мл (0,13 моля) метилгидразина в течение 4 ч при комнатной температуре. Выделенные кристаллы отфильтровывают и перекристаллизовывают из бензола.
Выход 11,8 г (54%).
Т.пл. 164-166оС.
П р и м е р 5. 1-(5-Амино-3-метилтио-1 -1,2,4-триазол-1-ил)-N-метилкарботиогидра- зид.
-1,2,4-триазол-1-ил)-N-метилкарботиогидра- зид.
22,0 г (0,2 моля) метил-(5-амино-3-метилтио-1 -1,2,4-триазол-1-ил) карбодитиоата перемешивают в 400 мл 2-пропанола в присутствии 6,9 мл (0,13 моля) метилгидразина в течение 8 ч при комнатной температуре. Выделенные кристаллы отфильтровывают и перекристаллизуют из бензола.
-1,2,4-триазол-1-ил) карбодитиоата перемешивают в 400 мл 2-пропанола в присутствии 6,9 мл (0,13 моля) метилгидразина в течение 8 ч при комнатной температуре. Выделенные кристаллы отфильтровывают и перекристаллизуют из бензола.
Выход 10,5 г (48%).
Т.пл. 164-166оС.
П р и м е р 6. 1-(5-Амино-3-метилтио-1 -1,2,4-триазол-1-ил)-N-метилкарботиогидра- зид.
-1,2,4-триазол-1-ил)-N-метилкарботиогидра- зид.
22,0 г (0,1 моля) метил-(5-амино-3-метилтио-1 -1,2,4-триазол-1-ил) карбодитиоата перемешивают в 200 мл бензола в присутствии 6,9 мл (0,13 моля) метилгидразина в течение 8 ч при комнатной температуре. Выделенные кристаллы отфильтровывают и перекристаллизовывают из бензола.
-1,2,4-триазол-1-ил) карбодитиоата перемешивают в 200 мл бензола в присутствии 6,9 мл (0,13 моля) метилгидразина в течение 8 ч при комнатной температуре. Выделенные кристаллы отфильтровывают и перекристаллизовывают из бензола.
Выход 8,9 г (41%).
Т.пл. 164-166оС.
П р и м е р 7. 1-(5-Амино-3-метилтио-1 -1,2,4-триазол-1-ил)-N-метилкарботиогидра- зид.
-1,2,4-триазол-1-ил)-N-метилкарботиогидра- зид.
22,0 г (0,1 моля) метил-(5-амино-3-метилтио-1 -1,2,4-триазол-1-ил)карбодитиоата перемешивают в 150 мл метанола в присутствии 6,9 мл (0,13 моля) метилгидразина в течение 4 часов при комнатной температуре. Выделенные кристаллы отфильтровывают и перекристаллизовывают из бензола.
-1,2,4-триазол-1-ил)карбодитиоата перемешивают в 150 мл метанола в присутствии 6,9 мл (0,13 моля) метилгидразина в течение 4 часов при комнатной температуре. Выделенные кристаллы отфильтровывают и перекристаллизовывают из бензола.
Выход 11,8 г (54%).
Т.пл. 164-166оС.
П р и м е р 8. 1-(5-Амино-3-метилтио-1 -1,2,4-триазол-1-ил)-N-метилкарботиогидра- зид.
-1,2,4-триазол-1-ил)-N-метилкарботиогидра- зид.
22,0 г (0,1 моля) метил-(5-амино-3-метилтио-1 -1,2,4-триазол-1-ил) карбодитиоата кипятят в 140 мл метанола в присутствии 5,7 мл (0,11 моля) метилгидразина в течение 1 ч. Затем реакционную смесь выпаривают до 70 мл, выделенные кристаллы отфильтровывают и перекристаллизовывают из бензола.
-1,2,4-триазол-1-ил) карбодитиоата кипятят в 140 мл метанола в присутствии 5,7 мл (0,11 моля) метилгидразина в течение 1 ч. Затем реакционную смесь выпаривают до 70 мл, выделенные кристаллы отфильтровывают и перекристаллизовывают из бензола.
Выход 8,3 г (38%).
Т.пл. 164 166оС.
П р и м е р 9. 1-(5-Амино-3-N-метилпиперазинил)-1 -1,2,4-триазол-1-ил)-N-метил- карботиогидразид.
-1,2,4-триазол-1-ил)-N-метил- карботиогидразид.
27,2 г (0,1 моля) метил-(5-амино-3-N-метилпиперазинил-1 -1,2,4-триазол-1-ил) карбодитиоата перемешивают в 150 мл метанола в присутствии 6,9 мл (0,13 моля) метилгидразина 4 ч. Реакционную смесь выпаривают до сухого состояния в вакууме. Масляный продукт, полученный таким образом, кристаллизуется после добавления 2-пропанола. Выделенные кристаллы отфильтровывают и перекристаллизовывают из ацетонитрила.
-1,2,4-триазол-1-ил) карбодитиоата перемешивают в 150 мл метанола в присутствии 6,9 мл (0,13 моля) метилгидразина 4 ч. Реакционную смесь выпаривают до сухого состояния в вакууме. Масляный продукт, полученный таким образом, кристаллизуется после добавления 2-пропанола. Выделенные кристаллы отфильтровывают и перекристаллизовывают из ацетонитрила.
Выход 13 г (48%).
Т.пл. 150-152оС.
П р и м е р 10. 1-(5-Амино-3-диметиламино-1 -1,2,4-триазол-1-ил)-N-метилкарботи- огидразид.
-1,2,4-триазол-1-ил)-N-метилкарботи- огидразид.
21,7 г (0,1 моля) метил-(5-амино-3-диметиламино-1 -1,2,4-триазол-1-ил)карботиоа- та перемешивают в 100 мл метанола в присутствии 6,9 мл (0,13 моля) метилгидразина 4 ч при комнатной температуре. Выделенные кристаллы отфильтровывают и перекристаллизовывают из бензола.
-1,2,4-триазол-1-ил)карботиоа- та перемешивают в 100 мл метанола в присутствии 6,9 мл (0,13 моля) метилгидразина 4 ч при комнатной температуре. Выделенные кристаллы отфильтровывают и перекристаллизовывают из бензола.
Выход 12,2 г (51%).
Т.пл. 165-167оС.
П р и м е р 11. 1-(5-Амино-3-морфолино-4 -1,2,4-триазол-4-ил)-N-метилкарботиоги- дразид.
-1,2,4-триазол-4-ил)-N-метилкарботиоги- дразид.
25,5 г (0,1 моля) 1-(5-амино-3-морфолино-1 -1,2,4-триазол-1-ил)-N-метилкарбоди- тиогидразида кипятят в 75 мл уксусной кислоты 30 мин при перемешивании. Реакционную смесь охлаждают, выделенные кристаллы отфильтровывают и перекристаллизовывают из метанола.
-1,2,4-триазол-1-ил)-N-метилкарбоди- тиогидразида кипятят в 75 мл уксусной кислоты 30 мин при перемешивании. Реакционную смесь охлаждают, выделенные кристаллы отфильтровывают и перекристаллизовывают из метанола.
Выход 10,5 г (41%).
Т.пл. 239-240оС.
П р и м е р 12. 1-(5-Амино-3-морфолино-2 -1,2,4-триазол-2-ил)-N-метилкарботиоги- дразид.
-1,2,4-триазол-2-ил)-N-метилкарботиоги- дразид.
Процесс происходит так же, как описано в примере 11. Маточную жидкость, полученную после фильтрования реакционной смеси, выпаривают до сухого состояния, а остаток перекристаллизовывают сначала из водного раствора этанола, затем из ацетонитрила.
Выход 6,12 (24%).
Т.пл. 258-259оС.
П р и м е р 13. 2-Метил-4-(3-морфолино-1 -1,2,4-триазол-5-ил)тиосемикарбазид
-1,2,4-триазол-5-ил)тиосемикарбазид
25,7 г (0,1 моля) метил-(3-морфолино-2 -1,2,4-триазол-5-ил) дитиокарбамината кипятят в 250 мл метанола в присутствии 6,9 мл (0,13 моля) метилгидразина 2 ч при перемешивании. Выделенные кристаллы отфильтровывают и перекристаллизовывают из метанола.
-1,2,4-триазол-5-ил) дитиокарбамината кипятят в 250 мл метанола в присутствии 6,9 мл (0,13 моля) метилгидразина 2 ч при перемешивании. Выделенные кристаллы отфильтровывают и перекристаллизовывают из метанола.
Выход 17,34 г (68%).
Т.пл. 211-212оС.
П р и м е р 14. 1-(5-Бензиламино-3-морфолино-1 -1,2,4-триазол-1-ил)-N-метилкар- ботиогидразид.
-1,2,4-триазол-1-ил)-N-метилкар- ботиогидразид.
34,9 г (0,1 моля) метил-(5-бензиламино-3-морфолино-1 -1,2,4-триазол-1-ил) карбодитиоата перемешивают в 150 мл метанола в присутствии 6,9 мл (0,13 моля) метилгидразина 4 ч при комнатной температуре. Выделенные кристаллы отфильтровывают и перекристаллизовывают из бензола.
-1,2,4-триазол-1-ил) карбодитиоата перемешивают в 150 мл метанола в присутствии 6,9 мл (0,13 моля) метилгидразина 4 ч при комнатной температуре. Выделенные кристаллы отфильтровывают и перекристаллизовывают из бензола.
Выход 22,5 г (63%).
Т.пл. 133 134оС.
П р и м е р 15. 1-(5-Бензиламино-3-морфолино-1 -1,2,4-триазол-1-ил)-N'-метилкар- ботиогидразид
-1,2,4-триазол-1-ил)-N'-метилкар- ботиогидразид
Процесс происходит так же, как описано в примере 14, с той разницей, что маточную жидкость, полученную после фильтрования, выдерживают в течение 2 дней. Затем выделенные кристаллы отфильтровывают и перекристаллизовывают из смеси н-гексана и эфира.
Выход 5,6 г (16%)
Т.пл. 86-87оС.
П р и м е р 16. 1-(5-Амино-3-морфолино-1 -1,2,4-триазол-1-ил) карботиогидразид.
-1,2,4-триазол-1-ил) карботиогидразид.
Смесь из 25,7 г (0,1 моля) метил-(5-амино-3-морфолино-1 -1,2,4-триазол-1-ил) карботиоата, 200 мл метанола и 6 мл (0,12 моля) 99%-ного раствора гидразингидрата перемешивают 4 часа при комнатной температуре. Затем отфильтровывают и, таким образом полученные кристаллы, перекристаллизовывают из смеси диметилформальдегида и ацетонитрила.
-1,2,4-триазол-1-ил) карботиоата, 200 мл метанола и 6 мл (0,12 моля) 99%-ного раствора гидразингидрата перемешивают 4 часа при комнатной температуре. Затем отфильтровывают и, таким образом полученные кристаллы, перекристаллизовывают из смеси диметилформальдегида и ацетонитрила.
Выход 20,9 г (86%).
Т.пл. 180-182оС.
П р и м е р 17. 1-(5-Амино-3-метилтио-1 -1,2,4-триазол-1-ил)карботиогидразид.
-1,2,4-триазол-1-ил)карботиогидразид.
Смесь из 22,0 г (0,1 моля) метил-(5-амино-3-метилтио-1 -1,2,4-триазол-1-ил)карбо- тиоата, 200 мл метанола и 6 мл (0,12 моля) 99%-ного раствора гидразингидрата перемешивают 4 часа при комнатной температуре. Затем ее отфильтровывают и выпавшие кристаллы перекристаллизовывают из диметилформамида.
-1,2,4-триазол-1-ил)карбо- тиоата, 200 мл метанола и 6 мл (0,12 моля) 99%-ного раствора гидразингидрата перемешивают 4 часа при комнатной температуре. Затем ее отфильтровывают и выпавшие кристаллы перекристаллизовывают из диметилформамида.
Выход 17,3 г (85%).
Т.пл. 185 186оС.
П р и м е р 18. 1-(5-Амино-3-метилтио-1 -1,2,4-триазол-1-ил)карботиогидразид.
-1,2,4-триазол-1-ил)карботиогидразид.
К смеси из 10,6 г (0,1 моля) тиокарбогидразида и 130 мл воды добавляют раствор 15 г (0,102 моля) диметил-(N-цианокарбонимидодитиоата) в 65 мл метанола и в течение 2 ч кипятят реакционную смесь. Затем охлаждают, выпавшие кристаллы отфильтровывают и перекристаллизовывают из диметилформамида.
Выход 17,8 г (86%).
Т.пл. 185-186оС.
П р и м е р 19. 1-(5-Амино-3-(N-метилпиперазинил)-1 -1,2,4-триазол-1-ил)карботи- огидразид.
-1,2,4-триазол-1-ил)карботи- огидразид.
27,2 г (0,1 моля) метил-(5-амино-3-(N-метилпиперазинил)-1 -1,2,4-триазол-1-ил)кар- ботиоата перемешивают в 150 мл метанола в присутствии 6,9 мл (0,13 моля) гидразингидрата 4 ч при комнатной температуре. Затем реакционную смесь охлаждают и таким образом полученные кристаллы перекристаллизовывают из диметилформамида.
-1,2,4-триазол-1-ил)кар- ботиоата перемешивают в 150 мл метанола в присутствии 6,9 мл (0,13 моля) гидразингидрата 4 ч при комнатной температуре. Затем реакционную смесь охлаждают и таким образом полученные кристаллы перекристаллизовывают из диметилформамида.
Выход 24,5 г (95%).
Т.пл. 194 196оС.
Получение соли тригидрохлорида.
1 г основания, полученного вышеописанным способом, растворяют в 5 мл горячего диметилформамида, раствор подкисляют до рН 2 с помощью 15%-ного раствора хлористого водорода в изопропаноле. Выделенный продукт отфильтровывают и промывают с помощью изопропанола.
Выход 0,9 г.
Т.пл. 158-160оС.
П р и м е р 20. 1-(5-Амино-3-морфолино-1 -1,2,4-триазол-1-ил)-N,N'-диметилкарбо- тиогидразид.
-1,2,4-триазол-1-ил)-N,N'-диметилкарбо- тиогидразид.
25,7 г (0,1 моля) метил-(5-амино-3-морфолино-1 -1,2,4-триазол-1-ил) карбодитиоата кипятят в 150 мл метанола в присутствии 14,6 мл (0,12 моля) N, N'-диметилгидразиндигидрохлорида и 46 мл триэтиламина 16 ч. Затем реакционную смесь выпаривают до сухого состояния в вакууме. Добавляют 400 мл воды к остатку и три раза экстрагируют водную фазу с помощью 200 мл хлороформа. Полученную таким образом органическую фазу дважды промывают 200 мл воды, высушивают с помощью сульфата магния и выпаривают в вакууме. Выпавшие кристаллы суспендируют в диэтилэфире и отфильтровывают.
-1,2,4-триазол-1-ил) карбодитиоата кипятят в 150 мл метанола в присутствии 14,6 мл (0,12 моля) N, N'-диметилгидразиндигидрохлорида и 46 мл триэтиламина 16 ч. Затем реакционную смесь выпаривают до сухого состояния в вакууме. Добавляют 400 мл воды к остатку и три раза экстрагируют водную фазу с помощью 200 мл хлороформа. Полученную таким образом органическую фазу дважды промывают 200 мл воды, высушивают с помощью сульфата магния и выпаривают в вакууме. Выпавшие кристаллы суспендируют в диэтилэфире и отфильтровывают.
Выход 11,3 г (43%).
Т.пл. 127-128оС.
П р и м е р 21. 1-(5-Амино-3-диаллиламино-1 -1,2,4-триазол-1-ил)-N-метилкарботи- огидразид.
-1,2,4-триазол-1-ил)-N-метилкарботи- огидразид.
4,2 г (0,0156 моля) метил-(5-амино-3-диаллиламино-1 -1,2,4-триазол-1-ил) карбодитиоата и 1,38 мл (0,026 моля) метилгидразина взаимодействуют в 20 мл метанола при комнатной температуре 8 ч. После добавления 10 мл воды и таким образом полученному раствору выделяют 1,2 г (29%) чистого 1-(5-амино-3-диаллиламино-1
-1,2,4-триазол-1-ил) карбодитиоата и 1,38 мл (0,026 моля) метилгидразина взаимодействуют в 20 мл метанола при комнатной температуре 8 ч. После добавления 10 мл воды и таким образом полученному раствору выделяют 1,2 г (29%) чистого 1-(5-амино-3-диаллиламино-1 -1,2,4-триазол-1-ил)-N-метилкарботиоги- дразида. Т.пл. 86-88оС. При дальнейшем выпаривании маточной жидкости получают 2 г кристаллического вещества с т.пл. 85-88оС. Таким образом полный выход составляет 77%
-1,2,4-триазол-1-ил)-N-метилкарботиоги- дразида. Т.пл. 86-88оС. При дальнейшем выпаривании маточной жидкости получают 2 г кристаллического вещества с т.пл. 85-88оС. Таким образом полный выход составляет 77%
П р и м е р 22. 1-(5-Бензиламино-3-морфолино-1 -1,2,4-триазол-1-ил)-N, N'-диметил- карботиогидразид.
-1,2,4-триазол-1-ил)-N, N'-диметил- карботиогидразид.
6,98 г (0,02 моля) метил-(5-бензиламино-3-морфолино-1 -1,2,4-триазол-1-ил) карбодитиоата кипятят в 50 мл метанола в присутствии 2,92 мл (0,024 моля) N, N'-диметилгидразиндигидрохлорида и 9,4 мл триэтиламина 8 ч. Затем реакционную смесь выпаривают в вакууме до сухого состояния. К остатку добавляют 100 мл воды и трижды экстрагируют водную фазу 50 мл хлороформа. Таким образом полученную органическую фазу дважды промывают 50 мл воды, высушивают с помощью сульфата магния и выпаривают в вакууме до сухого состояния. Таким образом полученные кристаллы суспендируют в диэтилэфире и отфильтровывают.
-1,2,4-триазол-1-ил) карбодитиоата кипятят в 50 мл метанола в присутствии 2,92 мл (0,024 моля) N, N'-диметилгидразиндигидрохлорида и 9,4 мл триэтиламина 8 ч. Затем реакционную смесь выпаривают в вакууме до сухого состояния. К остатку добавляют 100 мл воды и трижды экстрагируют водную фазу 50 мл хлороформа. Таким образом полученную органическую фазу дважды промывают 50 мл воды, высушивают с помощью сульфата магния и выпаривают в вакууме до сухого состояния. Таким образом полученные кристаллы суспендируют в диэтилэфире и отфильтровывают.
Выход 3,25 г.
Т.пл. 66-68оС.
П р и м е р 23. 1-[5-(4-Диметиламинобензиламино)-3-морфолино-1 -1,2,4-триазол- 1-ил]карботиогидразид.
-1,2,4-триазол- 1-ил]карботиогидразид.
1,96 г (0,005 моля) метил-[5-(4-диметиламинобензиламино)-3-морфолино-1 -1,2,4- триазол-1-ил] капбодитиоат кипятят в 20 мл метанола в присутствии 0,3 мл гидразингидрата 1 ч при перемешивании. Реакционную смесь охлаждают, выделенные кристаллы отфильтровывают и перекристаллизуют из метанола.
-1,2,4- триазол-1-ил] капбодитиоат кипятят в 20 мл метанола в присутствии 0,3 мл гидразингидрата 1 ч при перемешивании. Реакционную смесь охлаждают, выделенные кристаллы отфильтровывают и перекристаллизуют из метанола.
Выход 1,43 г (83%).
Т.пл. 127-129оС.
П р и м е р 24. 1-(4-Хлорбензиламино-3-морфолино-1 -1,2,4-триазол-1-ил)-N-метил- карботиогидразин.
-1,2,4-триазол-1-ил)-N-метил- карботиогидразин.
38,2 г (0,1 моля) метил-(5-(4-хлорбензиламино)(3-морфолино-1 -1,2,4-триазол-1-ил) карбодитиоата кипятят в 700 мл метанола в присутствии 6,4 мл (0,12 моля) метилгидразина 1 ч при перемешивании. Реакцион- ную смесь охлаждают, выделенные кристаллы отфильтровывают и перекристаллизуют из смеси бензола и циклогексана.
-1,2,4-триазол-1-ил) карбодитиоата кипятят в 700 мл метанола в присутствии 6,4 мл (0,12 моля) метилгидразина 1 ч при перемешивании. Реакцион- ную смесь охлаждают, выделенные кристаллы отфильтровывают и перекристаллизуют из смеси бензола и циклогексана.
Выход 23,2 г (61%).
Т.пл. 152-154оС.
П р и м е р 25. 1-[5-(4-Хлорбензиламино)-3-метилтио-1 -1,2,4-триазол-1-ил]карботи- огидразид.
-1,2,4-триазол-1-ил]карботи- огидразид.
17,2 г (0,05 моля) метил-[5-(4-хлорбензиламино)-3-метил-тио-1 -1,2,4-триазол-1-ил] карбодитиоата кипятят в 200 мл метанола в присутствии 6 мл гидразигидрата 0,5 ч при перемешивании. Реакционную смесь охлаждают, выделенные кристаллы отфильтровывают и перекристаллизуют из метанола.
-1,2,4-триазол-1-ил] карбодитиоата кипятят в 200 мл метанола в присутствии 6 мл гидразигидрата 0,5 ч при перемешивании. Реакционную смесь охлаждают, выделенные кристаллы отфильтровывают и перекристаллизуют из метанола.
Выход 13,8 г (84%).
Т.пл. 140-142оС.
П р и м е р 26. 1-(5-Бензиламино-3-морфолино-1 -1,2,4-триазол-1-ил)карботиогид- разид.
-1,2,4-триазол-1-ил)карботиогид- разид.
3,49 г (0,01 моля) метил(5-бензиламино-3-морфолино-1 -1,2,4-триазол-1-ил)карбо- дитиоата перемешивают в 50 мл метанола в присутствии 0,64 мл (0,013 моля) гидразингидрата 4 ч при комнатной температуре. Выделенные кристаллы отфильтровывают и перекристаллизуют из метанола.
-1,2,4-триазол-1-ил)карбо- дитиоата перемешивают в 50 мл метанола в присутствии 0,64 мл (0,013 моля) гидразингидрата 4 ч при комнатной температуре. Выделенные кристаллы отфильтровывают и перекристаллизуют из метанола.
Выход 2,84 г (85%).
Т.пл. 141-143оС.
П р и м е р 27. 1-(5-(4-Хлорбензиламино)-3-морфолино-1 -1,2,4-триазол-1-ил) карботиогидразид.
-1,2,4-триазол-1-ил) карботиогидразид.
1,9 г (0,005 моля) метил-(5-(4-хлорбензиламино)-3-морфолино-1 -1,2,4-триазол-1-ил) карбодитиоата кипятят в 40 мл метанола в присутствии 0,3 мл (0,0058 моля) гидразингидрата 1 час при перемешивании. Затем выделенные кристаллы отфильтровывают и перекристаллизуют из метанола.
-1,2,4-триазол-1-ил) карбодитиоата кипятят в 40 мл метанола в присутствии 0,3 мл (0,0058 моля) гидразингидрата 1 час при перемешивании. Затем выделенные кристаллы отфильтровывают и перекристаллизуют из метанола.
Выход 0,68 г (73%).
Т.пл. 184 186оС.
П р и м е р 28. 1-(3,5-Диамино-1 -1,2,4-триазол-1-ил)-N-метилкарботиогидразид.
-1,2,4-триазол-1-ил)-N-метилкарботиогидразид.
0,76 г (0,004 моля) метил-(3,5-диамино-1 -1,2,4-триазол-1-ил)-N-метилкарботиоата перемешивают в 75 мл метанола в присутствии 0,29 мл гидразингидрата 1 ч при комнатной температуре. Выделенные кристаллы отфильтровывают и перекристаллизуют из 2-пропанола.
-1,2,4-триазол-1-ил)-N-метилкарботиоата перемешивают в 75 мл метанола в присутствии 0,29 мл гидразингидрата 1 ч при комнатной температуре. Выделенные кристаллы отфильтровывают и перекристаллизуют из 2-пропанола.
Выход 0,68 г (73%).
Т.пл. 184-186оС.
П р и м е р 29. 1-(5-Амино-3-диаллиламино-1 -1,2,4-триазол-1-ил)карботиогидразид.
-1,2,4-триазол-1-ил)карботиогидразид.
26,90 г (0,1 моля) метил-(5-амино-3-диаллиламино-1 -1,2,4-триазол-1-ил)карбодити- оата кипятят в 200 мл метанола в присуттсвии 6 мл гидразингидрата 1 ч при перемешивании. Выпавшие кристаллы отфильт- ровывают и перекристаллизуют из бензола.
-1,2,4-триазол-1-ил)карбодити- оата кипятят в 200 мл метанола в присуттсвии 6 мл гидразингидрата 1 ч при перемешивании. Выпавшие кристаллы отфильт- ровывают и перекристаллизуют из бензола.
Выход 20,64 г (82%).
Т.пл. 142-144оС.
П р и м е р 30. 1-(5-Амино-3-метилтио-1 -1,2,4-триазол-1-ил) карбогидразид.
-1,2,4-триазол-1-ил) карбогидразид.
К смеси 9 г (0,1 моля) карбогидразида и 160 мл метанола добавляют при перемешивании раствор 14,6 г (0,102 моля) диметил N-цианокарбонимидодитиоата в 100 мл метанола. Реакционную смесь кипятят 3 ч, затем охлаждают, выделенные кристаллы отфильтровывают и перекристаллизуют из метанола.
Выход 15,6 г (83%).
Т.пл. 163-164оС.
П р и м е р 31. 1-(5-Амино-2 -1,2,4-триазол-2-ил)-N-метилкарботиогидразид.
-1,2,4-триазол-2-ил)-N-метилкарботиогидразид.
0,61 г (0,0035 моля) 1-(5-амино-2 -1,2,4-триазол-2-ил) карбодитиоат перемешивают в 10 мл метанола в присутствии 0,184 г (0,004 моля) метилгидразина 2 ч при комнатной температуре. Раствор выпаривают до сухого состояния в вакууме и остаток перекристаллизуют из изопропанола.
-1,2,4-триазол-2-ил) карбодитиоат перемешивают в 10 мл метанола в присутствии 0,184 г (0,004 моля) метилгидразина 2 ч при комнатной температуре. Раствор выпаривают до сухого состояния в вакууме и остаток перекристаллизуют из изопропанола.
Выход 0,4 г (66%).
Т.пл. 85-90оС.
П р и м е р 32. 1-(5-Амино-3-морфолино-4 -1,2,4-триазол-4-ил)-N-метил-карботио- гидразид.
-1,2,4-триазол-4-ил)-N-метил-карботио- гидразид.
Действуя согласно примеру 3, маточный раствор, полученный после фильтрования реакционной смеси, содержащей соответствующие изомеры Ib, Ic и Id, выпаривают досуха и остаток растворяют в 30 мл кипящей уксусной кислоты. Смесь затем охлаждают, отделенные кристаллы отфильт- ровывают и перекристаллизуют из метанола.
Выход 6,5 г (25,4%)
Т.пл. 239-240оС.
П р и м е р 33. 1-(5-Амино-3-морфолино-2 -1,2,4-триазол-2-ил)-N-метил-карботиогид- разид.
-1,2,4-триазол-2-ил)-N-метил-карботиогид- разид.
Действуя согласно предшествующему примеру, маточный раствор, полученный после фильтрования реакционной смеси, выпаривают досуха и остаток перекристаллизуют, вначале из водного раствора этанола, затем из ацетонитрила.
Выход 3,55 г (13,9%).
Т.пл. 258-259оС.
П р и м е р 34. 2-Метил-4-(3-морфолино)-1 -1,2,4-триазол-5-ил)-тиосемикарбазид.
-1,2,4-триазол-5-ил)-тиосемикарбазид.
Действуя согласно предшествующему примеру, маточный раствор, полученный после фильтрования реакционной смеси и после перекристаллизации, собирают вместе и выпаривают досуха. Остаток перекристаллизуют из метанола дважды.
Выход 1,60 г (6,2%).
Т.пл. 211-212оС.
П р и м е р 35. 1-(5-Амино-3-(N-метилпиперазинил)-1 -1,2,4-триазол-1-ил)-акрботи- огидразидгидрохлорид.
-1,2,4-триазол-1-ил)-акрботи- огидразидгидрохлорид.
0,5 г основания, приготовленного согласно примеру 19, растворяют в 10 мл изопропанола, содержащего хлористый водород (25,4 г/100 мл), полученный таким образом раствор выпаривают досуха, остаток растирают в порошок с этилацетатом, полученные в результате кристаллы отфильтровывают и дважды промывают изопропанолом.
Выход 0,35 г.
Т.пл. 260-265оС.
П р и м е р 36. 1-(5-Амино-3-диметиламино-1 -1,2,4-триазол-1-ил)карботиогидразид.
-1,2,4-триазол-1-ил)карботиогидразид.
Смесь 21,7 г (0,1 моля) метил-(5-амино-3-диметиламино-1 -1,2,4-триазол-1-ил)-ди- тиокарбоната, 200 мл метанола и 6 мл (0,12 моля) 98%-ного гидразин-гидрата перемешивают при комнатной температуре в течение 5 ч, после чего реакционную смесь отфильтровывают. Полученные таким образом кристаллы (19,2 г; 95,3% ) суспендируют в 50 мл диметилформамида, суспензию перемешивают в течение получаса, затем отфильтровывают и тщательно промывают ацетонитрилом. Выход 18,8 г (93,4%); температура плавления 180-181оС.
-1,2,4-триазол-1-ил)-ди- тиокарбоната, 200 мл метанола и 6 мл (0,12 моля) 98%-ного гидразин-гидрата перемешивают при комнатной температуре в течение 5 ч, после чего реакционную смесь отфильтровывают. Полученные таким образом кристаллы (19,2 г; 95,3% ) суспендируют в 50 мл диметилформамида, суспензию перемешивают в течение получаса, затем отфильтровывают и тщательно промывают ацетонитрилом. Выход 18,8 г (93,4%); температура плавления 180-181оС.
П р и м е р 37. 1-(5-Амино-3-пиперидино-1 -1,2,4-триазол-1-ил)-карботиогидразид.
-1,2,4-триазол-1-ил)-карботиогидразид.
Смесь 25,7 г (0,1 моля) метил-(5-амино-3-пиперидино-1 -1,2,4-триазол-1-ил)-дити- окарбоната, 200 мл метанола и 6 мл (0,012 моля) 98%-ного гидразин-гидрата перемешивают при комнатной температуре в течение 5 ч, после чего реакционную смесь профильтровывают. Полученные таким образом кристаллы (23,3 г (96,6% ) суспендируют в 50 мл диметилформамида, суспензию перемешивают в течение получаса, затем снова отфильтровывают и тщательно промвыают ацетонитрилом. Выход: 22,1 г (91,6%); температура плавления 183-184оС.
-1,2,4-триазол-1-ил)-дити- окарбоната, 200 мл метанола и 6 мл (0,012 моля) 98%-ного гидразин-гидрата перемешивают при комнатной температуре в течение 5 ч, после чего реакционную смесь профильтровывают. Полученные таким образом кристаллы (23,3 г (96,6% ) суспендируют в 50 мл диметилформамида, суспензию перемешивают в течение получаса, затем снова отфильтровывают и тщательно промвыают ацетонитрилом. Выход: 22,1 г (91,6%); температура плавления 183-184оС.
П р и м е р 38. Таблетки, имеющие следующий состав, получают известными методами в фарацевтической промышленности:
Вещества Кол-во, г/таблетка
1-(5-амино-3-
морфолино-1 -
-
1,2,4-триазол-1-
ил) карботиогид- разид 5 Лактоза 18,5
Картофельный крахмал 13,0
Поливинилпир- ролидон 6,8 Стеариновая кислота 2,7 Тальк 4,0 Общая масса 50,0 г
П р и м е р 39. Мази, имеющие следующий состав, получают известными методами в фармацевтичеcкой промыш- ленности: Вещества Кол-во 1-(5-амино-3-мор- фолино-1 -1,2,4- триазол-1-ил)-метил- карботиогидразид 500 мг Unguentun hydrophi- licium nonbonicum 10 г
-1,2,4- триазол-1-ил)-метил- карботиогидразид 500 мг Unguentun hydrophi- licium nonbonicum 10 г
Активный ингредиент находится во внешней фазе мази в растворенном состоянии.
П р и м е р 40. Суппозитории, имеющие следующий состав, получают известными методами в фармацевтической промышленности: Вещества Количество 1-(5-Амино-3-мор- мг/суппозиторий фолино-1 -1,2,4- триазол-1-ил)кар- ботиогидразид 100 Лецитин 48 Cera alba 96 Кокосовое масло 1870 Дистиллированная вода 386 Общая масса 2500 мг
-1,2,4- триазол-1-ил)кар- ботиогидразид 100 Лецитин 48 Cera alba 96 Кокосовое масло 1870 Дистиллированная вода 386 Общая масса 2500 мг
П р и м е р 41. Капсулы, имеющие следующий состав, получают известными способами в фармацевтической промыш- ленности: Вещества Количество, 1-(5-амино-3-мор- мг/капсула фолино-1 -1,2,4-три- азол-1-ил)карботио- гидразид 50 Лактоза Картофельный крахмал 10 Стеарат магния 1 Общая масса 180 мг.
-1,2,4-три- азол-1-ил)карботио- гидразид 50 Лактоза Картофельный крахмал 10 Стеарат магния 1 Общая масса 180 мг.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 1,2,4-ТРИАЗОЛИЛТИОАМИДОВ | 1990 |
|
RU2045521C1 |
| ПРОИЗВОДНЫЕ 5-(ЗАМЕЩЕННЫЙ АМИНО)-1,2,4-ТРИАЗОЛ-[1,5А]-ПИРИМИДИНА, ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ КАРДИОТОНИЧЕСКИМ И КОРОНАРОРАСШИРЯЮЩИМ ДЕЙСТВИЕМ, И СПОСОБ КАРДИОТОНИЧЕСКОГО И/ИЛИ КОРОНАРОРАСШИРЯЮЩЕГОСЯ ВОЗДЕЙСТВИЯ НА СЕРДЦЕ | 1992 |
|
RU2097382C1 |
| Способ получения производных триазолопиримидина или их смеси, или их фармацевтически приемлемых солей с металлами | 1990 |
|
SU1776261A3 |
| ПРОИЗВОДНОЕ 2-(1,2,4-ТРИАЗОЛ-1-ИЛ)-1,3,4-ТИАДИАЗОЛА, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ | 1998 |
|
RU2180903C2 |
| ПРОИЗВОДНЫЕ 3-(2-ЗАМЕЩЕННЫЙ ФЕНИЛ)-2-(ЗАМЕЩЕННЫЙ ИМИНО)-ТИАЗОЛИДИНОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТИАНГИНАЛЬНЫМ И/ИЛИ АНТИНЕВРАЛГИЧЕСКИМ ЭФФЕКТОМ | 1992 |
|
RU2065855C1 |
| ПРОИЗВОДНЫЕ ДИГИДРОПИРИМИДОТИАЗИНА ИЛИ ИХ ТЕРАПЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ ПРИСОЕДИНЕНИЯ КИСЛОТЫ, ОБЛАДАЮЩИЕ ПРОТИВОАНГИННОЙ И АНТИВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ | 1990 |
|
RU2022965C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-(3-ХЛОРФЕНИЛ)-4-МЕТИЛ-7,8-ДИМЕТОКСИ-5Н-2,3-БЕНЗОДИАЗЕПИНА | 1992 |
|
RU2065852C1 |
| АМИДНЫЕ ПРОИЗВОДНЫЕ ТИОКИСЛОТЫ И КОРМОВЫЕ СОСТАВЫ ДЛЯ ПРИМЕНЕНИЯ В ЖИВОТНОВОДСТВЕ | 1991 |
|
RU2060995C1 |
| Способ получения производных аминоалканоилдибензо ( @ , @ ) (1,3,6) диоксазоцина или их фармацевтически приемлемых аддитивных солей с кислотами | 1987 |
|
SU1575938A3 |
| Способ получения производных дигидроарилокси алкиламино-1,2,4-триазола или их фармацевтически пригодных солей присоединения кислот | 1984 |
|
SU1480767A3 |


Использование: в химии гетероциклических веществ, в частности в способе получения производных триазолилгидразида и их фармацевтически приемлемых солей. Сущность изобретения: продукт производные триазолилгидразида и их фармацевтически приемлемые соли, обладающие седативным, сердечно-сосудистым, антивирусным эффектом и способностью задерживать секрецию, кислоты и развитие язвы желудка, общей ф-лы I, где Q водород, 6-членная гетероциклическая группа, содержащая либо азот и один кислород, либо один или два азота и не- или замещенную C1-C4 -алкильной группой, или группа SR1, или NR2R3; R1 - C1-C4 -алкил. R2 и R3 одинаковы и означают водород, C1-C6 -алкил или линейный C2-C6 -алкенил; R7 водород, фенил C1-C4 -алкил, при необходимости монозамещенный галогеном или аминогруппой, возможно моно- или дизамещенной C1-C4 -алкилом; R8 и Z различны и означают водород или группу ф-лы II -C(X)-N(R4-NR5R6; Х кислород или сера. Реагент 1: сложный триазолиловый эфир ф-лы III, где R10 и Y различны и означают водород или группу: -C(X)-XR9 I  III
III  Реагент 2: гидразин- HNR4-NR5R6. Синтез ведут взаимодействием реагентов 1 и 2 в соответствующих условиях.
Реагент 2: гидразин- HNR4-NR5R6. Синтез ведут взаимодействием реагентов 1 и 2 в соответствующих условиях.
Производные триазолилгидразида общей формулы
где R водород, шестичленная гетероциклическая группа, содержащая один атом азота и один атом кислорода, шестичленная гетероциклическая группа, содержащая 1 2 атома азота, незамещенная или замещенная алкильной группой С1 С4, или группа формулы SR1, где R1 алкил С1 С4 или группа NR2R3, где R2 и R3 одинаковы и означают водород, алкил С1 С6 или линейный алкенил С2 С6;
X кислород или сера;
R7 водород, фенил(алкил С1 C4), при необходимости замещенный одним атомом галогена, или аминогруппа, при необходимости замещенная одной или двумя алкильными группами С1 С4;
R8 и Z различны и означают водород или группу формулы (C X) (N R4) NR5R6, где R4, R5 и R6 водород или алкил С1 С4,
и их фармацевтически пригодные соли.
| ИНДИКАТОР НАИБОЛЬШИХ НАПРЯЖЕНИИ | 0 |
|
SU236096A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-07-09—Публикация
1990-10-25—Подача