Изобретение относится к производным 4-аминопиридина общей формулы I
A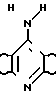 B где А означает группу R
B где А означает группу R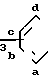 в которой фрагмент СН в положении "а" может быть заменен атомом азота,
в которой фрагмент СН в положении "а" может быть заменен атомом азота,
В означает группу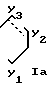 или
или 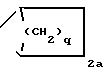 где прерывистая линия представляет необязательную двойную связь;
где прерывистая линия представляет необязательную двойную связь;
R3 водород или фтор в положении "в",
Y1 означает СН2, О или S;
Y2 означает СН2, СН, О или S;
Y3 означает СН2 или СН, при условии, что группа формулы Ia может иметь двойную связь только в том случае, когда Y2 и Y3 означает СН, и при условии, что, когда А означает указанную группу, в которой R3 водород и азот отсутствует в положении "а", только один из Y1 и Y2 означает СН2;
q 1.
Соединения формулы 1 полезны для лечения различных нарушений памяти, обусловленных пониженной холинергической функцией, например болезнью Альцгеймера. Кроме того, эти соединения стимулируют нейромышечную передачу, усиливают процессы возбуждения в возбуждаемых тканях (нервы, гладкие и поперечно-полосатые мышцы), а также восстанавливают проводимость в нервах и нейромышечных синапсах в случае их повреждения. Соединения согласно изобретению проявляют также антидепрессантную активность, которая особенно помогает пациентам, страдающим болезнью Альцгеймера. Как правило, соединения согласно изобретению менее токсичны и характеризуются более широким, чем известные соединения, например такрин и физотигмин, спектром терапевтического действия, что делает их более терапевтически предпочтительными.
При лечении болезни Альцгеймера дозировка соединений согласно изобретению меняется в зависимости от способа введения и выбранного конкретного соединения. Кроме того дозировка меняется в зависимости от конкретного больного, возраста, массы тела и состояния подлежащего лечению больного, а также от природы и степени тяжести симптомов. Однако обычно вводят дозу в интервале приблизительно 1-300 мг/день в виде единичной дозы при разделенных дозах. Предпочтительная доза находится в интервале приблизительно 1-150 мг/день в виде единичной или разделенных доз.
Обычно лечение начинают с небольших доз, значительно меньших, чем оптимальная доза данного соединения. Затем дозу постепенно увеличивают на небольшое количество до достижения оптимального эффекта.
Соединения согласно изобретению применяют отдельно или в сочетании с фармакологически приемлемыми носителями, количестко которых определяется растворимостью и химической природой соединения, выбранным способом введения и обычной медицинской практикой. Например, их вводят орально в виде капсул, таблеток, суспензий или растворов, или они могут быть введены парентерально. Капсулы и таблетки являются предпочтительной формой введения. Для парентерального введения соединения согласно изобретению могут быть применены в виде стерильного раствора, содержащего также другие растворенные вещества, например соль или глюкозу в количестве, достаточном для образования изотонического раствора.
Капсулы и таблетки с композициями могут содержать активный ингредиент в смеси с одним или более фармацевтическим эксципиентом, пригодным для изготовления капсул и таблеток. Пригодными фармацевтическими эксципиантами являются, например, крахмал, молочный сахар и некоторые виды глин. Таблетки могут быть без покрытия или они могут быть покрыты известными способами для замедления разложения и абсорбции в желудочно-кишечном тракте, благодаря чему обеспечивается более продолжительное действие лекарства.
Водные суспензии соединений формулы 1 содержат активный ингредиент в смеси с одним или более фармацевтическими эксципиентами, пригодными для изготовления водных суспензий. Пригодными эксцепиентами являются, например, метилцеллюлоза, альгинат натрия, аравийская камедь, лецитин и т.п. Водные суспензии могут также содержать один или более консервирующие агенты, один или более красящие агенты, одну или более отдушки и один или более подслащивающие агенты.
Неводные суспензии могут быть приготовлены путем суспендирования активного ингредиента в растительном масле, например в арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, либо в минеральном масле, например жидком парафине, и суспензия может содержать загуститель, например пчелиный воск, твердый парафин или цетиловый спирт. Эти композиции могут содержать также подслащивающий агент, отдушку и антиоксидант.
Следующие примеры иллюстрируют получение и свойства соединений согласно настоящему изобретению. Все температуры плавления не скорректированы. Тонкослойную хроматографию (ТСХ) проводили на силикагеле.
П р и м е р 1. 9-Амино-1,2,3,4-тетрагидро-1,4-метаноакридин.
Раствор антранилонитрила (3,6 г, 30,0 ммоль), норкамфары (3,3 г, 30,0 ммоль) и n-толуолсульфоновой кислоты (50 мг) в бензоле (50 мл) нагревают с рефлюксом в приборе Дина-Старка. После нагревания в течение 18 ч реакционную смесь охлаждают (25оС) и удаляют отделившуюся воду (приблизительно 1,5 мл). Затем избыток бензола отгоняют в вакууме (1 мм рт.ст. 15 мин). Полученный таким образом маслянистый остаток растворяют в тетрагидрофуране (ТГФ, 10 мл) и охлаждают до 0оС, затем добавляют раствор литийдиизопропиламида в ТГФ (1М, 36 мл, 36 ммоль). Потом эту реакционную смесь перемешивают при 0оС в течение 3 ч. К концу этого периода времени реакцию прекращают путем добавления к реакционной смеси 40 мл воды и реакционную смесь экстрагируют метиленхлоридом (200 мл). Полученную органическую фазу промывают водой (2х50 мл) и сушат (безводный сульфат магния). Метиленхлорид отгоняют в вакууме и получают остаток, который помещают в силикагельную колонку для флеш-хроматографии. Элюируют 5% метанола в метиленхлориде, содержащем 1% триэтиламина, и получают указанное в заголовке соединение в количестве 1,6 г (25%) в виде масла, твердеющего при стоянии. Т.пл. 185-186оС.
П р и м е р 2. 9-Амино-8-фтор-1,2,3,4-тетрагидро-1,4-метаноакридин.
По методике, описанной в примере 1, но с заменой антранилонитрила на 2-амино-6-фторбензонитрил получают указанное в заголовке соединение, 23% т. пл. 173оС.
П р и м е р 3. 9-Амино-7-хлор-1,2,3,4-тетрагидро-1,4-метаноакридин.
По методике, описанной в примере 1, но с заменой антранилонитрила на 2-амино-5-хлорбензонитрил получают указанное в заголовке соединение, 14% т. пл. 183-184оС.
П р и м е р 4. 9-Амино-1,4-дигидро-1,4-метаноакридин.
По методике, описанной в примере 1, но с заменой норкамфары на 5-норборнен-2-он получают указанное в заголовке соединение, 26% т.пл. 123оС.
П р и м е р 5. 9-Амино-2-окса-1,2,3,4-тетрагидроакридин.
Антранилонитрил (2,95 г, 25 ммоль), хлорид цинка (3,1 г, 25 ммоль) и тетрагидро-4Н-пиран-4-он растворяют в толуоле (40 мл) и нагревают с рефлюксом в течение 2,5 дня. К концу этого периода реакционную смесь охлаждают (25оС), разбавляют водным раствором гидроксида натрия (70 мл) и экстрагируют метиленхлоридом (4х60 мл). Соединенные органические фазы промывают водой (2х100 мл) и высушивают (безводный сульфат магния). Органические растворители удаляют в вакууме и получают желтый остаток, который загружают в силикагельную колонку для флеш-хроматографии. Элюируют 5% метанола в метиленхлориде и получают указанное в заголовке соединение в виде желтых кристаллов, 155 мг, 31% т.пл. 195-196оС.
П р и м е р 6. 9-Амино-2-тиа-1,2,3,4-тетрагидроакридин.
Антранилонитрил (2,6 г, 21,5 ммоль), тетрагидротиопиран-4-он (5,0 г, 43 ммоль) и хлорид цинка (2,54 г, 21,5 ммоль) соединяют и нагревают до 120оС в течение 20 мин. Реакционную смесь охлаждают и твердый остаток отфильтровывают с применением этилового эфира (100 мл). Полученное твердое вещество оранжевого цвета (5,2 г) помещают в химический стакан, содержащий насыщенный раствор ЭДТК (этилендиаминтетрауксусная кислота) в виде (125 мл) и рН доводят до 13 при помощи 12%-ного водного раствора гидроксида натрия. Затем водную фазу экстрагируют метиленхлоридом (4х5, мл) и экстракт промывают водой (2х70 мл) и высушивают (сульфат магния). После удаления метиленхлорида в вакууме получают желтую пасту (2,0 г), которую растирают с эфиром и фильтруют, получают твердое вещество светло-желтого цвета, 1,36 г, 29% т.пл. 205оС (разлагается).
П р и м е р 7. 9-Амино-4-окса-1,2,3,4-тетрагидроакридин.
К перемешиваемому при -20оС раствору дельта-валеролактона (1,0 г, 10,0 ммоль) в метиленхлориде (10 мл) добавляют 1 М раствор хлорида титана (IV) в метиленхлориде (20 мл). Реакционная смесь приобретает темно-желтую окраску и к ней добавляют смесь триэтиламина (2,0 г, 20 ммоль) и антранилонитрила (1,2 г, 10,0 ммоль) в метиленхлориде (30 мл). Реакционная смесь сразу же становится темной, ее оставляют нагреваться до комнатной температуры (приблизительно 25оС) и затем перемешивают в течение 15 ч. К концу этого периода реакционную смесь обрабатывают 25%-ным водным раствором гидроксида натрия (40 мл) и метиленхлоридом (100 мл) и фильтруют через прокладку из диатомовой земли толщиной 2 дюйма (торговое название целит, Сelit), которую промывают метиленхлоридом (50 мл) и водой (100 мл). Органический слой отделяют, промывают один раз водой (30 мл) и высушивают (безводный сульфат магния). Метиленхлорид отгоняют в вакууме и получают масло, которое растирают с эфиром, получают указанное в заголовке соединение в виде белого твердого вещества, 565 мг, 28%
1Н-ЯМР (СDCl3, 300 МГц, g): 2H, м, 2,02-2,18 м.д. 2Н, Т. 2,63 м.д. (J 6,0 Гц); 2Н, Т. 4,36 м.д. (J 6,0 Гц); 2Н, с. 4,64 м.д. 1Н, Т. 7,25 (J 8,0 Гц); 1Н, Т. 7,5 (J 8,0 Гц); 1Н, g, 7,72 (J 8,0 Гц).
П р и м е р 8. 9-Амино-8-фтор-4-окса-1,2,3,4-тетрагидроакридин.
По методике, описанной в примере 7, но с заменой антранилонитрила на 2-амино-6-фторбензонитрил получают указанное в заголовке соединение, 8% т. рл. 195-196оС.
П р и м е р 9. 9-Амино-7-фтор-4-окса-1,2,3,4-тетрагидроакридин.
По методике, описанной в примере 7, но с заменой антранилонитрила на 2-амино-5-хлорбензонитрил получают указанное в заголовке соединение, 2% т. пл. 278-279оС.
П р и м е р 10. 9-Амино-4-окса-1,2,3,4,5,6,7,8-октагидроакридин.
По методу, описанному в примере 7, но с заменой антранилонитрила на 2-амино-1-циано-1-циклогексен получают указанное в заголовке соединение, 8% т. пл. 145оС.
П р и м е р 11. 9-Амино-2,3,7,8-тетрагидро-1Н-циклопента(е)-6Н-пирано)-/2',3'-b/пиридин.
По методу, описанному в примере 7, но с заменой антранилонитрила на 2-амино-1-циано-1-циклопентен получают указанное в заголовке соединение, 22% т. пл. 164оС.
П р и м е р 12. 2,3-Дигидротиено(3,2-b)хинолин-9-амин.
К перемешиваемому при -78оС раствору тетрагидротиофен-3-она (1,1 г, 11 ммоль) в метиленхлориде (10 мл) добавляют 1 М раствор хлорида титана (IV) в метиленхлориде (11 мл). Затем к реакционной смеси добавляют в течение 5 мин смесь триэтиламина (2,2 г, 22 ммоль) и антранилонитрила (1,2 г, 10,0 ммоль) в метиленхлориде (30 мл). После этого реакционную смесь медленно нагревают до комнатной температуры и перемешивают в течение 2 ч. Потом добавляют в реакционной смеси тетрагидротиофен-3-он (1 мл) и хлорид титана (IV) (1,0 мл) и смесь перемешивают при 25оС в течение 16 ч. Затем к реакционной смеси быстро приливают 12%-ный водный раствор гидроксида натрия (100 мл), после чего реакционную смесь энергично перемешивают с дополнительным количеством метиленхлорида (300 мл). Затем реакционную смесь фильтруют через диатомовую землю (торговое название целит) и органическую фазу отделяют. Органические растворители удаляют в вакууме и получают остаток, который загружают в флеш-хроматографическую колонку. Элюируют 5% метанола в метиленхлориде, содержащем 1% триэтиламина, и получают указанное в заголовке соединение (1,3 г 64%), которое кристаллизуют из хлороформа, 560 мг, 32% т.пл. 208-210оС.
П р и м е р 13. 9-Амино-1,2,3,4,5,6,7,8-октагидро-1,4-метаноакридин.
К перемешиваемому при -20оС раствору норкамфоры (0,9 г, 8,2 ммоль) в метиленхлориде (8,0 мл) добавляют смесь триэтиламина (1,7 г, 16,4 ммоль) и 2-амино-1-циано-1-циклогексена (1,0 г, 8,2 ммоль) в метиленхлориде (24 мл) и полученную смесь перемешивают при 25оС в течение 15 мин. Затем к реакционной смеси быстро приливают 12%-ный водный раствор гидроксида натрия (60 мл) и энергично перемешивают с метиленхлоридом (60 мл). После этого реакционную смесь фильтруют через прокладку из диатомовой земли толщиной 2 дюйма (торговое название целит). Органическую фазу отделяют промывают водой (2х50 мл) и затем сушат (безводный сульфат магния). Потом метиленхлорид удаляют при пониженном давлении и получают масло, которое растирают с пентаном, получают указанное в заголовке соединение в виде беловатого твердого вещества, 225 мг, 13% т.пл. 131-133оС.
П р и м е р 14. 9-Амино-6-аза-1,2,3,4-тетрагидроакридин.
Хлорид титана (IV) (1,5 мл) добавляют к перемешиваемому раствору 3-амино-4-цианопиридина (500 мг, 4,2 ммоль) и циклогексанона (0,5 мл) в 1,2-дихлорэтане (15 мл). Затем реакционную смесь выдерживают при 90оС в течение 12 ч. К концу этого периода к реакционной смеси добавляют циклогексанон (2,0 мл) и 1,2-дихлорэтан (5,0 мл) и нагревание продолжают в течение еще 12 ч. Затем добавляют дополнительные количества циклогексанона (2,0 мл) и хлорида титана (IV) (1,2 мл) и реакционную смесь выдерживают при 90оС в течение 6 ч. Затем реакционную смесь охлаждают и быстро приливают к ней 5%-ный водный раствор гидроксида натрия (250 мл) и энергично перемешивают с метиленхлоридом (200 мл, 25 мин). Потом реакционную смесь обрабатывают, как описано в примере 8, и получают указанное в заголовке соединение (170 мг, 95%-ная чистота, 20%) после флеш-хроматографии на силикагеле (элюент 95:5:1 метиленхлорид: метанол:гидроксид аммония). Этот материал дополнительно очищают методом хроматографии и получают указанное в заголовке соединение, 75 мг, т.пл. 180-181оС.
П р и м е р 15. 9-Амино-5-аза-1,2,3,4-тетрагидроакридин.
По методу, описанному в примере 14, но с заменой 3-амино-4-цианопиридина на 2-амино-3-цианопиридин получают указанное в заголовке соединение, 38% т. пл. 225-228оС (разлагается).
1Н-ЯМР (CDCl3+CD3OD, 300 МГц, δ ):4Н, шир. с. 1,86 м.д. 2Н, шир.т. 2,5 м. д. 2Н, шир.т. 2,97 м.д. 2Н, оч.шир.с. 3,0-3,3 м.д. 1Н, дд. 7,2 м.д. (J 8,0, 4,0 Гц); 1Н, дд. 8,18 м.д. (J 8,0, 1-2 Гц); 1Н, дд. 8,77 м.д. (J 4,0, 1-2 Гц).
П р и м е р 16. 9-Амино-4,5-оксаза-1,2,3,4-тетрагидроакридин.
К перемешиваемому раствору 2-амино-3-цианопиридина (360 мг, 3,0 ммоль) и дельта-валеролактона (360 мг, 3,6 ммоль) в 1,2-дихлорэтане (7,0 мл) добавляют хлорид титана (IV) (0,9 мл), после чего реакционную смесь выдерживают при 90оС в течение 18 ч. После этого реакционную смесь быстро охлаждают путем добавления 15%-ного водного раствора гидроксида натрия (200 мл) и энергично перемешивают с метиленхлоридом (200 мл, 25 мин). Потом реакционную смесь обрабатывают так, как описано в примере 15, и получают указанное в заголовке соединение, 8% т.пл. 269-270оС (разлагается).
П р и м е р 17. 9-Амино-4,6-оксаза-1,2,3,4-тетрагидроакридин.
По методу, описанному в примере 16, но с применением 3-амино-4-цианопиридина вместо 2-амино-3-цианопиридина получают указанное в заголовке соединение, 16% т.пл. 237-238оС.
П р и м е р 18. 9-Амино-5-аза-1,2,3,4-тетрагидро-1,4-метаноакридин.
По методу, описанному в примере 16, но с применением норкамфоры вместо дельта-валеролактона получают указанное в заголовке соединение (29% т.пл. 243-244оС).
П р и м е р 19. 9-Амино-6-аза-1,2,3,4-тетрагидро-1,4-метаноакридин.
По методу, описанному в примере 16, но с применением норкамфоры вместо дельта-валеролактона и 3-амино-4-цианопиридина вместо 2-амино-3-цианопиридина получают указанное в заголовке соединение, 16% т.пл. 236-237оС.
П р и м е р 20. 9-Циклогексилметиламино-8-фтор-4-окса-1,2,3,4-тетрагидроакрид-ин.
Смесь гидрида натрия (60% масло, 110 мг, 2,75 ммоль), указанного в заголовке примера 6 соединения (600 мг, 2,75 ммоль), циклогексилметилбромида (487 мг, 2,75 ммоль) и диметилформамида (3,0 мл) нагревают при перемешивании при 25оС в течение 12 ч, затем при 65оС в течение 12 ч. К концу этого периода реакционную смесь быстро охлаждают выливанием ее в воду (45 мл) и затем полученную смесь экстрагируют этилацетатом (3 х 35 мл). Соединенные органические соли промывают водой (2 х 40 мл) и высушивают (безводный сульфат магния). Этилацетат отгоняют в вакууме и получают остаток, который загружают в колонку с силикагелем, предназначенную для флеш-хроматографии. Элюируют этилацетатом и получают масло, твердеющее при стоянии. При растирании этого твердого вещества с пентаном получают указанное в заголовке соединение (110 мг, 13% ) в виде желтовато-коричневого кристаллического вещества, т.пл. 100оС.
П р и м е р 21. 9-Циклогексилэтиламино-8-фтор-4-окса-1,2,3,4-тетрагидроакрид-ин.
По методу, описанному в примере 20, но с применением циклогексилэтилбромида вместо циклогексилметилбромида получают указанное в заголовке соединение (34%).
1Н-ЯМР (СDCl3, 300 МГц, δ ): 2Н, м. 0,8-1,02 м.д. 4Н, м. 1,02-1,4 м.д. 2Н, м. 1,44-1,56 м.д. 5Н, шир. д. 1,56-1,8 м.д. 2Н, кв. 1,92-2,04 м.д. (J 6,0 Гц); 2Н, т. 2,8 м.д. (J 6 Гц); 2Н, шир.т. 3,38 м.д. 2Н, т, 4,36 м.д. (J 6 Гц); 1Н, шир.д. 5,6 м.д. (J 20 Гц); 1Н, дд. 6,38 д.д. 6,38 м.д. (J 14,0, 7,5 Гц); 1Н, дд. 7,24-7,38 м.д. 1Н, д. 7,48 м.д. (J 8,2 Гц).
П р и м е р 22. 9-Бензиламино-8-фтор-4-окса-1,2,3,4-тетрагидроакридин.
По методу, описанному в примере 20, но с заменой циклогексилметилбромида на бензилбромид получают указанное в заголовке соединение, 38% т.пл. 134-135оС.
П р и м е р 23. 9-Фенетиламино-8-фтор-4-окса-1,2,3,4-тетрагидроакридин.
По методу, описанному в примере 20, но с заменой циклогексилметилбромида на (2-бромэтил)бензол получают указанное в заголовке соединение, 20% т.пл. 125-126оС.
П р и м е р 24. 9-Фениропиламино-8-фтор-4-окса-1,2,3,4-тетрагидроакридин.
По методу, описанному в примере 20, но с заменой циклогексилметилбромида на 1-бром-3-фенилпропан получают указанное в заготовке соединение (53% масло).
1Н-ЯМР (СDCl3, 300 МГц, δ ): 4Н, м, 1,82-2,02 м.д. 4Н, м. 2,62-2,78 м.д. 2Н, шир. с. 2,34 м.д. 2Н, t, 4,35 м.д. (J 6,0 Гц); 1Н, шир.д. 5,7 м.д. (J 20 Гц); 1Н, дд. 6,86 м.д. (J 14, 7,5 Гц); 6Н, м. 7,04-7,4 м.д. 1Н, д. 7,51 м.д. (J 8,2 Гц).
П р и м е р 25. 9-(3,3-дифенилпропиламино)-8-фтор-4-окса-1,2,3,4-тетрагидроакр- идин.
По методу, описанному в примере 20, но с заменой циклогексилметилбромида на 1-бром-3,3-дифенилпропан получают указанное в заголовке соединение, 32% т.пл. 134-135оС.
П р и м е р 26. 9-Амино-4-тиа-1,2,3,4-тетрагидроакридин.
По методу, описанному в примере 7, но с заменой дельта-валеролактона на дельта-тиовалеролактон получают указанное в заголовке соединение, 4% т.пл. 190оС.
П р и м е р 27. 9-Амино-3-метил-4-окса-1,2,3,4-тетрагидроакридин.
По способу, описанному в примере 7, но с заменой дельта-валеролактона на 6-метилтетрагидропиран-2-он получают указанное в заголовке соединение, 23% т.пл. 202-203оС.
П р и м е р 28. 9-Амино-3-метил-8-фтор-4-окса-1,2,3,4-тетрагидроакридин.
По методу, описанному в примере 7, но с заменой дельта-валеролактона на 6-метилтетрагидропиран-2-он и антрагилонитрила на 2-амино-6-фторбензонитрил получают указанное в заголовке соединение, 13% т.пл. 217-218оС.
П р и м е р 29. 9-Амино-8-фтор-2-тиа-1,2,3,4-тетрагидроакридин.
По способу, описанному в примере 7, но с заменой дельта-валеролактона на тетрагидротиопиран-4-он и антранилонитрила на 2-амино-6-фторбензонитрил получают указанное в заголовке соединение, 19% т.пл. 175-176оС.
П р и м е р 30. 9-Амино-1,2,3,4-тетрагидро-1,4-этаноакридин.
По способу, описанному в примере 1, но с применением дицикло-(2,2,2)октан-2-она вместо норкамфоры получают указанное в заголовке соединение, 20% т.пл. 197-199оС.
П р и м е р 31. 2,3-Дигидрофуро(2,3-b)хинолин-4-амин.
По способу, описанному в примере 7, но с применением гамма-бутиролактона вместо дельта-валеролактона получают указанное в заголовке соединение, т.пл. 300оС (разлагается).
1Н-ЯМР (СDCl3, 300 МГц δ ): 2Н, т. 3,17 м.д. (J 8 Гц); 2Н, шир. с. 4,6 м. д. 2Н, т. 4,69 м.д. (J 8 Гц); 1Н, т. 7,28 м.д. (J 8 Гц); 1Н, т. 7,53 м.д. (J 8 Гц); 1Н, д. 7,62 м.д. (J 8 Гц); 1Н, д. 7,77 м.д. (J 8 Гц).
П р и м е р 32. 6Н-(1)Бензопирано(4,3-b)хинолин-7-амин.
По способу, описанному в примере 7, но с применением 4-хротманона вместо дельта-валеролактона получают указанное в заголовке соединение, 3% т.пл. 275оС (разлагается).
1Н-ЯМР (ДМСО, 300 МГц, δ ): 2Н, с. 5,3 м.д. 1Н, д. 6,97 м.д. (J 8,2 Гц); 1Н, т. 7,08 м.д. (J 7,0 Гц); 2Н, м. 7,15-7,4 м.д. 1Н, т. 7,57 м.д. (J 7,0 Гц); 1Н, д. 7,78 м.д. (J 7,0 Гц); 1Н, д. 8,16 м.д. (J 8,0 Гц); 1Н, дд. 8,24 м.д. (J 7,0, 2,0 Гц).
П р и м е р 33. 6Н-(1)-Бензотиопирано(4,3-b)хинолин-7-амин.
По способу, описанному в примере 7, но с применением тиохроман-4-она вместо дельта-валеролактона получают указанное в заголовке соединение, 13% т.пл. 211-212оС.
П р и м е р 34. 9-Метиламино-8-фтор-4-окса-1,2,3,4-тетрагидроакридин.
По способу, описанному в примере 20, но с применением йодметана вместо циклогексилметилбромида получают указанное в заголовке соединение (для гидрохлорида т.пл. 240оС).
1Н-ЯМР (ДМСО, 300 МГц, δ ): 2Н, м. 2,0 м.д. 2Н т. 2,95 м.д. (J 6,5 Гц); 3Н, шир. д. 3,3 м.д. 2Н, т. 4,53 м.д. (J 6,5 Гц); 1Н, дд. 7,34 м.д. (J 8,14 Гц); 1Н, дд. 7,44 м.д. (J8,0 Гц); 1Н, м. 7,7-7,8 м.д. 1Н, шир. м. 7,94-8,06 м.д.
П р и м е р 35. 2,3-Дигидро-8-фтортиено/3,2-b/хинолин-9-амин (соединение А) и 1,3-дигидро-8-фтортиено/3,4-b/хинолин-9-амин.
По способу, описанному в примере 12, но с применением 2-амино-6-фторбензонитрила вместо антранилонитрила получают смесь 1:1 обоих указанных в заголовке соединений. Соединение А, т.пл 137оС, соединение В (т.пл. 198оС, разлагается):
1Н-ЯМР (СDCl3, 300 МГц, δ ): 2Н, с. 4,09 м.д. 2Н с. 4,38 м.д. 2Н, шир.с. 5,3 м. д. 1Н, дд. 7,0 м.д. (J 7,3, 14,5 Гц); 1Н, дд. 7,47 м.д. (J 7,3, 10,5 Гц); 1Н, д. 7,68 м.д. (J 10,5 Гц).
П р и м е р 36. 9-Амино-1,2-дигидроакридин-4(3Н)-он.
По способу, описанному в примере 1, но с применением 1,2-циклогександиона вместо норкамфоры получают указанное в заголовке соединение, 11% т.пл. 240оС (разлагается).
1Н-ЯМР (СDCl3, 300 МГц, δ ): 2Н, квинт. 2,31 м.д. 4Н мг. 2,8-2,95 м.д. 2Н, шир. с. 4,95 м.д. 1Н, т. 7,29 м.д. (J 8,5 Гц); 1Н, т. 7,64 м.д. (J 8,5 Гц); 1Н, д. 7,74 м.д. (J 8,5 Гц); 1Н, д. 8,2 м.д. (J 8,51 Гц).
П р и м е р 37. 8-Фтор-9-амино-1,2,3,4-тетрагидроакридин.
К перемешиваемому при -20оС раствору циклогексанона (1,0 г, 10,0 ммоль) в метиленхлориде (10 мл) добавляют 1 М раствор хлорида титана (IV) в метиленхлориде (20 мл). Реакционная смесь приобретает желтую окраску, и к ней добавляют смесь триэтиламина (2,0 Г, 20 ммоль) и 2-амино-6-фторбензонитрила (1,36 г, 10,0 ммоль) в метиленхлориде (30 мл). Реакционная смесь сразу же становится темного цвета и ее оставляют нагреваться до комнатной температуры (приблизительно 25оС) и перемешивают еще в течение 15 ч. К концу этого периода реакционную смесь обрабатывают 12%-ным водным раствором гидроксида натрия (100 мл) и метиленхлоридом (100 мл). Затем реакционную смесь фильтруют через прокладку из диатомовой земли толщиной 2 дюйма (торговое название целит) и прокладку промывают метиленхлоридом (50 мл) и водой (100 мл). Органический слой отделяют, промывают водой (1 х 30 мл) и сушат (безводный сульфат магния). Метиленхлорид удаляют в вакууме и получают масло, которое растирают с эфиром, получают указанное в заголовке соединение в виде белого твердого вещества, 218 мг, 10% т.пл. 175оС.
П р и м е р 38. 9-Амино-8-метил-1,2,3,4-тетрагидроакридин.
По способу, описанному в примере 37, но с применением 2-амино-6-метилбензонитрила вместо 2-амино-6-фторбензонитрила получают указанное в заголовке соединение, 11% т.пл. 143-145оС.
П р и м е р 39. 9-Амино-8-хлор-1,2,3,4-тетрагидроакридин.
По способу, описанному в примере 37, но с применением 2-амино-6-хлорбензонитрила вместо 2-амино-6-фторбензонитрила получают указанное в заголовке соединение, 23% т.пл. 144-145оС.
П р и м е р 40. 4-Амино-5-фтор-2,3-пентаметиленхинолин.
По способу, описанному в примере 37, но с применением циклогептанона вместо циклогексанона получают указанное в заголовке соединение, 22% т.пл. 203оС.
П р и м е р 41. 4-Амино-5-хлор-2,3-пентаметиленхинолин.
По способу, описанному в примере 37, но с применением циклогептанона вместо циклогексанона и 2-амино-6-хлорбензонитрила вместо 2-амино-6-фторбензонитрила получают указанное в заголовке соединение, 11% т.пл. 194-195оС.
П р и м е р 42. 4-Амино-5-фтор-2,3-триметиленхинолин.
По способу, описанному в примере 37, но с применением циклопентанона вместо циклогексанона получают указанное в заголовке соединение, 6% т.пл. 179-181оС.
П р и м е р 43. 9-Амино-8-хлор-4-оксо-1,2,3,4-тетрагидроакридин.
По способу, описанному в примере 7, но с применением 2-амино-6-хлорбензонитрила вместо антранилонитрила получают указанное в заголовке соединение, 15% т.пл. 205оС.
П р и м е р 44. 9-Амино-8-метил-4-окса-1,2,3,4-тетрагидроакридин.
По способу, описанному в примере 7, но с применением 2-амино-6-метилбензонитрила вместо антранилонитрила получают указанное в заголовке соединение, 20% т.пл. 177-179оС.
1Н-ЯМР (CDCl3, 300 МГц, δ ): 1Н, д. 7,56 м.д. (J 7 Гц); 1Н, т. 6,95 м.д. (J 7 Гц); 2Н, шир. с. 4,93 м.д. 2Н, т. 4,29 м. д. (J 6 Гц); 3Н, с. 2,89 м.д. 2Н, т. 2,52 м.д. (J 6 Гц); 2Н, м. 2,08-2,11 м.д.
П р и м е р 45. 9-Амино-8-метокси-1,2,3,4-тетрагидроакридин.
По способу, описанному в примере 37, но с применением 2-амино-6-метоксибензонитрила вместо 2-амино-6-фторбензонитрила получают указанное в заголовке соединение, 14% т.пл. 187-188оС.
П р и м е р 46. 9-Амино-8-метокси-4-окса-1,2,3,4-тетрагидроакридин.
По способу, описанному в примере 7, но с применением 2-амино-6-метоксибензонитрила вместо антранилонитрила получают указанное в заголовке соединение, 11% т.пл. 205-207оС.
1Н-ЯМР (СDCl3, 300 МГц, δ ): 2Н, м. 7,33 м.д. 1Н, дд. 6,57 м.д. (J 3,6 Гц); 2Н, шир. с. 5,92 м.д. 2Н. т. 4,29 м.д. (J 2,6 Гц); 3Н, с. 3,95 м.д. 2Н, т. 2,5 м.д. (J 2,6 Гц); 2Н, м. 2,13-2,07 м.д.
П р и м е р 47. Способность соединений, указанных в заголовках примеров 1-16, 18, 26-29 и 35-46, подавлять ацетилхолинстеразу мозга была определена спектрофотометрическим методом I.Z/Ellman и др. (Biochemical Pharmacology, 7, 88 (1961)). Для всех соединений значения ПК50 (в молях) находились в интервале 5 мкмоль-01 мкмоль.
В таблице приведены данные испытаний.
Использование: в качестве веществ, обладающих антихолинэстеразной активностью. Сущность изобретения: продукт производные 4-аминопиридина общей формулы I, где А означает группу 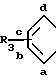 в которой фрагмент СН в положении "а" может быть заменен атомом азота; В означает группу Iа или IIа, где прерывистая линия представляет необязательную двойную связь; R3 водород или фтор в положении "в"; Y1 означает CH2 О или S; Y2 означает CH2 СН, О или S Y3 означает CH2 или СН, при условии, что группа Iа может иметь двойную связь только в том случае, когда Y2 и Y3 означает СН, и при условии, что, когда А означает указанную группу, в которой R3 - водород, и азот отсутствует в положении "а", только один из Y1 и Y2 означает CH2 q 1. Структура ф-л I, Ia, IIa:
в которой фрагмент СН в положении "а" может быть заменен атомом азота; В означает группу Iа или IIа, где прерывистая линия представляет необязательную двойную связь; R3 водород или фтор в положении "в"; Y1 означает CH2 О или S; Y2 означает CH2 СН, О или S Y3 означает CH2 или СН, при условии, что группа Iа может иметь двойную связь только в том случае, когда Y2 и Y3 означает СН, и при условии, что, когда А означает указанную группу, в которой R3 - водород, и азот отсутствует в положении "а", только один из Y1 и Y2 означает CH2 q 1. Структура ф-л I, Ia, IIa:  2 з. п. ф-лы, 1 табл.
2 з. п. ф-лы, 1 табл.
где A группа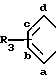
в которой фрагмент CH в положении a может быть заменен атомом азота.
B группа: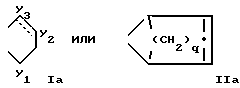
где прерывистая линия представляет необязательную двойную связь;
R3 водород или фтор в положении "b";
Y1 CH2, O или S;
Y2 CH2, CH, O или S;
Y3 CH2 или CH,
при условии, что группа формулы I а может иметь двойную связь только в том случае, когда Y2 и Y3 CH, и при условии, что, когда A означает указанную группу, где R3 водород, и азот отсутствует в положении "a", только один из Y1 и Y2 CH2
q 1.
| Патент США N 4631286, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1995-07-09—Публикация
1992-02-18—Подача