1
Изобретение относится к обл получения новых производных 1, оксида-6-альфа или 6-бета амин кил-пенициллановой кислоты общ формулы
О о
RtNHCH
ifsO -т Y
-XT -L
или
о о
X
S
СНэ СНз
сооН
СНз
СООН
где R,- бензил, фенэтил, орто-, мета- или пара-оксибензил, 3- или 4-пиколил,
обладающих антибактериальными свойствами.
Целью изобретения является разработка на основе известных методов способа получения новых соединений, обладающих высокими фармакологическими свойствами.
Пример 1. Бензил-6-альфа- -бромо-6-бета-(бензилоксикарбонилами нометил)пеницилланат и 6-бета-бромо- -6-альфа-(бензилоксикарбониламиноме- тил)пеницилланат,
К раствору бензил-6,6-дибромпени- цилланата (108,73 г, 0,242 моль) и 600 мл тетрагидрофурана (ТГФ) охлажденному до , добавили эфирньш раствор метилмагнийбромида (83,5 мл, 2,9 М). После перемешивания в течение 15 мин при за промежуток времени 10 мин добавили раствор бен- зилоксикарбоксамидометилацетата .(27 г, 0,121 моль) в 200 мл сухого ТГФ, После перемешивания в течение часа при -78 С реакцию погасили, добавив 14,52 МП уксусной кислоты. Полученной смеси дали нагреться до комнатной температу ры и летучую часть удалили в вакууме при менее .
Для растворения остатка добавили этилацетат и полученный раствор промыли водой (100 мл), водным: раствором NaH COj (100 мл) и 210 мл воды, затем высушили над Na SOu и сконцентрировали в вакууме до получения 113 г маслянистого продукта Масло хроматографируют на колонке с 1,2 кг силикагеля, элюируя ее сначала 6 л
13350, 2 .
смеси гексан:хлороформ (1:1),а затем хлороформом. Первые 6 л элюата сливают. Далее злюат собирают порциями по 25 мл. Фракции 181-190 концентри5 руют. Спектр ПМР остатка в CDClj соответствует бензил-6-альфа-бромо- -6-бета-(бензилоксикарбониламиноме- тш1)пеницш1ланату; дельта/ТМС: 1,37 (ЗН, с), 1,57 (ЗН, с), 3,86 (2Н, д,
О J - 6 Гц), 4,42 (1Н, с), 5,06 (2Н,с) 5,12 (2Н,с),5,52 (1Н,с),7,25 (10Н,с). Фракции 201-249 концентрируют и спектр этого остатка в CDClj соответствует 6- -бета-6-альфа-(бензилоксикарбонил- аминометил)пеницилланату: дельта/ТМС: 1,36 (ЗН,с) 1,60 (ЗН, с), 3,90 (2Н, д, J 6,2 Гц), 4,47 (2Н, с), 5,07 (2Н, с), 5,14 (2Н, с), 5,40 йН, т, J 6,2), 5,47 (1Н, с), 7,28 (5Н, с),
7,30 (5Н, с). Продукты фракции 171- 240 объединяют и концентрируют до получения 22 г пены,которую используют в примере 2.
Пример 2 о Бензил-6-бета- -(бензилоксикарбониламинометил)пеницилланат .
25
К раствору продукта по примеру 1 - смеси зпимероа (22 г, 0,0413 моль)
в 100 мл бензола добавляют три-н-бу- тилоловопщрид (32 J 7 мл, 0,124 моль) Полученную смесь кипятят с обратным холодильником в атмосфере азота в течение 2 ч, концентрируют в вакууме
до масла и это масло тщательно растирают с 4 100 мл гексана. Полученное вязкое масло переносят в 70 мл эфира, из которого в течение часа кристаллизуется предложенный продукт
(8,1 г в две порции).
Спектр ПМР (CDCL,,) дельта/ТМС: 1,37 (ЗЫ,с) 1,57 (ЗН,с),, 3,58 (ЗН,м),4,34 (1Н,с), 5.,04 (2Н,с),5,12 (2Н,с),5,33 (1Н, д, J 4 Гц), 7,32 (ЮН, с).
Пример 3. 1-альфа-Океид- -бензил-6-бета-(бензилоксикарбо шл- аминометил)-пеницилланата и 1-бета- Оксид-бензил-6.-бeтa-(бeнзилoкcикap- бонилметил) пеницилла,натас
К раствору продукта по примеру 2 (4,54 г, OpOl моль) в 70 мл. зтилацетата добавляют мета-хлорпербензойную кислоту (2,02 г, 0,01 моль) в 30 мл этилацетата. Полученную смесь перемешивают в течение 30 мин при комнатной температуре; промывают 1-50 мл насьпценным NaHCO, и 2 50 мл Н„0,, су
313133504
тат над и концентрируют в ва- и разбавляют 50 мл насьщенного NaHSO,,
кууме до вязкого масла. Масло растворяют в 50 мл эфира и 10 мл СНС1, и в результате кристаллизации предлагаемого альфа-оксида, вызванной поскре- быванием, получают 2,2 г продукта с т.пл. 123-124 С.
ПНР (СДС1,) дельта/ТМС: 1,22 (ЗН, с), 1,51 (ЗН, с) 3,7 (ЗН, м), 4,34
Органический слой вьщеляют, промывают 2-50 мл насыщенного NaHCO, и 2 « 50 мл HjO, сушат над и конце нтрируют в вакууме до вязкого масла (8,6 г). Масло хроматографируют на 250 г силикагеля, элюируя смесью 19:1 СНС1,гэтилацетат на фракции по 25 мл. Фракции 44-150 объединяют и
(1Н, с), 4,63 (1Н, д, J 4 Гц), 5,13fO концентрируют в вакууме до получения (2Н, с), 5,22 (2Н, с), 5,50 (1Н, м), предложенного продукта в виде белой 7,34 (5Н, с), 7,40 (5Н, с).смолистой пены (7,6 г).
ПНР
(СДС,) дельта/ТМС: 1,25 (ЗН, с), 1,49 (ЗН, с) 3,98 (ЗН, м), 4,45
(1Н, с), 4,59 (1Н, д, J 4 Гц); 5,09 (2Н, с), 5,19 (2Н, кв), 5,36 (1Н, шир), 7,36 (ЮН, с).
Пример 6. 1-1-Диоксид-бен- зил-6-альфа-(бензилоксикарбонш1-амиВ результате концентрирования маточного раствора досуха в вакууме получают предложенный бета-оксид в 15 виде вязкого масла (2,5 г).
ПМР (СДСЦ) дельта/ТМС: 1,05 (ЗН, с) 1,60 (ЗН, с), 3,8 (ЗН, м), 4,63 (1Н, с), 4,73 (1Н, д, J 4 Гц), 5,13
(2Н, с), 5,23 (2Н, кв), 5,70 (1Н, м),20 нометил)пеницилланата. 7,35 (5Нс,с), 7,39 (5Н, с).По примеру 4 диоксид примера 5
Пример 4. 1-бета-Оксид-бен- зил-6-альфа-(бензилоксикарбонилами- нометил)-пеницилланата.
К предложенному бета-оксиду по 25 примеру 3 (2,3 г, 4,9 ммоль) в 100 мл СНС1 добавляют 1,5-диазабицикло(3,3 г, 6,79 ммоль) превращают в продукт по примеру 6 (3,1; неочищенный) и очищают на хроматографической колонке на 150 г силикагеля, элюируя его смесью зтилацетат:СНС1э(1:9) на фракции по 20 мл. Фракции 26-37 объединяют и концентрируют в вакууме до получения очищенного предложенного продукта в виде вязкого масла, которое кристаллизуется при стоянии
.3.0 нон-5-ен) ДБН (0,607 г, 4,9 ммоль). Полученную смесь переме- щивают при комнатной температуре в 30 течение 15 мин, разбавляют 50 мл 1 н. НС1, и водный слой выделяют. Органический слой промывают 2-50 мл HjO, сушат над безводным , концентрируют в вакууме до получения 35 Н, с), 4,59 1Н, м), 5,07 (2Н, с), масла (2,3 г). Это масло хроматогра- 5,14 (2Н, кв), 5,30 (1Н, шир), 7,32 фируют на колонке с силикагелем (100 г) элюируя смесью 4:1 СНС1:этил- ацетат фракциями по 20 мл. Фракции
40
(1,9 г, т.пл. 112-113 С).
ПМР (СДС1э) дельта/ТМС: 1,20 (ЗН, с), 1,49 (ЗН, с), 3,65 (ЗН, м), 4,32
(ЮН, с).
41-70 объединяют и концентрируют до получения предложенного продукта в виде вязкого масла (0,9 г) ПМР (СДС1д.) ТМС: 1,03 (ЗН, с), 1,60 (ЗН, с), 3,67 (ЗН, м), 4,46 (1Н, с), 4,88 (1Н, м), 5,08 (2Н, с), 5,17 (2Н, кв), 5,39 (1Н, м), 7,32 (5Н, с), 7,37 (5Н, с).
Пример 5. 1,1-Диоксид-бен- зш1-6-бета-(бензилоксикарбониламинометил)-пеницилланата.
Продукт по примеру 6 можно также получить дальнейшим окислением продукта по примеру 4 избытком мета- -хлорпербензойной кислоты по способу примера 5.
Пример 7. 1,1-Диоксид-6- 45 -бета(-аминометил)пенициллановой кислоты.
Продукт по примеру 5 (1,9 г), ТГФ (40 мл), (40 мл) и 10% Pd(C/1,9r) объединяют и гидрируют при 50 пси 50 L3,5 в течение 1 ч. Катализатор удаляют фильтрованием, а ТГФ удаляют из фильтрата в вакууме. Водный слой промывают 30 мл этилацетата, сушат вымораживанием до получения беПродукт по примеру 5 (1,9 г), ТГФ (40 мл), (40 мл) и 10% Pd(C/1,9r объединяют и гидрируют при 50 пси 50 L3,5 в течение 1 ч. Катализатор удаляют фильтрованием, а ТГФ удаляют из фильтрата в вакууме. Водный слой промывают 30 мл этилацетата, сушат вымораживанием до получения беК раствору полученного по примеру 2 продукта (8,0 г, 0,0176 моль)
в 200 мл зтилацетата, охлажденного
до 0-5°С, добавляют мета-хлорпербен- 55лого порошка, и первую порцию крисзойную кислоту (Ю,68 г, 0,0528 моль).таллов (0,26 г) получают при тщательПолученную смесь нагревают до ком-ном растирании порошка с 5 мл воды,
натной температуры, перемешивают в Вторую порцию (0,14 г) получают при
течение 6 ч, снова охлаждают до 0,5°Сдобавлении Ю мл ацетона к маточному
Органический слой вьщеляют, промывают 2-50 мл насыщенного NaHCO, и 2 « 50 мл HjO, сушат над и конце нтрируют в вакууме до вязкого масла (8,6 г). Масло хроматографируют на 250 г силикагеля, элюируя смесью 19:1 СНС1,гэтилацетат на фракции по 25 мл. Фракции 44-150 объединяют и
концентрируют в вакууме до получения предложенного продукта в виде белой смолистой пены (7,6 г).
ПНР
(СДС,) дельта/ТМС: 1,25 (ЗН, с), 1,49 (ЗН, с) 3,98 (ЗН, м), 4,45
(1Н, с), 4,59 (1Н, д, J 4 Гц); 5,09 (2Н, с), 5,19 (2Н, кв), 5,36 (1Н, шир), 7,36 (ЮН, с).
Пример 6. 1-1-Диоксид-бен- зил-6-альфа-(бензилоксикарбонш1-ами(3,3 г, 6,79 ммоль) превращают в продукт по примеру 6 (3,1; неочищенный) и очищают на хроматографической колонке на 150 г силикагеля, элюируя его смесью зтилацетат:СНС1э(1:9) на фракции по 20 мл. Фракции 26-37 объединяют и концентрируют в вакууме до получения очищенного предложенного продукта в виде вязкого масла, которое кристаллизуется при стоянии
Н, с), 4,59 1Н, м), 5,07 (2Н, с), 5,14 (2Н, кв), 5,30 (1Н, шир), 7,32
Н, с), 4,59 1Н, м), 5,07 (2Н, с), 5,14 (2Н, кв), 5,30 (1Н, шир), 7,32
(1,9 г, т.пл. 112-113 С).
ПМР (СДС1э) дельта/ТМС: 1,20 (ЗН, с), 1,49 (ЗН, с), 3,65 (ЗН, м), 4,32
Н, с), 4 5,14 (2Н,
(ЮН, с).
Н, с), 4,59 1Н, м), 5,07 (2Н, с), 5,14 (2Н, кв), 5,30 (1Н, шир), 7,32
Продукт по примеру 6 можно также получить дальнейшим окислением продукта по примеру 4 избытком мета- -хлорпербензойной кислоты по способу примера 5.
Пример 7. 1,1-Диоксид-6- -бета(-аминометил)пенициллановой кислоты.
Продукт по примеру 5 (1,9 г), ТГФ (40 мл), (40 мл) и 10% Pd(C/1,9r) объединяют и гидрируют при 50 пси L3,5 в течение 1 ч. Катализатор удаляют фильтрованием, а ТГФ удаляют из фильтрата в вакууме. Водный слой промывают 30 мл этилацетата, сушат вымораживанием до получения бе
лого порошка, и первую порцию крисраствору, а третью (0,35 г) - при выпаривании второго маточного раствора до 2 мл и добавлении 50 мл ацетона. Полный выход предложенного продукта составляет 0,75 г.
ПМР (250 МГц) дельта/ДСС: 1,47 (ЗН, с), 1,59 (ЗН, с), 3,74 (2Н, с), 4,36 (1Н, тд, J 4,55 Гц), 4,45 (1Н, с), 5,17 (1Н, д, J 4 Гц).
Пример 8. 1,1-Диоксид-6-аль-10 фа-(аминометил)-пенициллановой кислоты.
По способу примера 7, продукт по примеру 6 (1,7 г) превращают в продукт по примеру 8 помимо того, что крис- t5 таллический продукт получают непосредственно концентрированием в вакууме с последующей экстракцией этилаце- татом (0,7 г).
ПМР (250 МГц) Д О/ДСС:
1,59 (ЗН, с), 3,63 (2Н, д, ,5Гц), 4,07 (1Н, тд, J 2,5 Гц), 4,31 (1Н, с), 5,06 (1Н, д, J, 2).
Пример 9. Бензил-6-бета- -бромо-6-альфа-трифторометансульфо- нилоксиметилценицилла нат.
К раствору трифторметансульфоно- вого ангидрида (3, 15 мл) в метилен- хлориде (20 мл) при комнатной температуре добавляют pacfaop бензил-6- -бета-бромо-б-альфа-(оксиметил)пени- цилланата (6,232 г, 15,6 ммоль) и пиридин (1,89 мл) в мет-иленхлориде (20 мл), и полученную смесь перемешивают и охлаждают на ледяной бане в течение 45 мин. Метиленхлорид выпаривают при пониженном давлении, и остаток разделяют между этилацетатом и водой. Этилацетатную фазу выделяют в водную фазу и зкстрагируют дополнительно порцией этилацетата. Объединенные растворы этилацетата промывают сначала раствором бикарбоната натрия при рН 8.3, а затем рассолом. После сушки над безводным сульфатом натрия раствор выпаривают при пониженном давлении до получения предложенного продукта в виде твердого вещества оранжевого цвета (8.,296 г).
ПМР (СДС) дельта/тис: 1,41 (с, ЗН), 1,63 (с, ЗН), 4,51 (с,- 1Н), 4,87 (с, 2Н), 5,14 (с, 2Н), 5,44 (с, IH), 7,30 (с, 5Н).
Пример 10. Бензил-6-альфа- -азидометил-6-бета-бромпеницилланат.
Тетраметилгуанидинийазид (2,96 г, 18,7 ммоль) добавляют к раствору бензил-6-бета-бромо-6-альфа-трифторметилсульфонилоксиметилпеницилланата(8,296 г, 15,6 ммоль) в хлороформе (50 мл) при 10 С. Реакционную смесь перемешивают в течение часа, а затем уменьшают объем до одной трети и фильтруют через слой силикагеля. Затем этот слой элюируют 10%-ной смесью этилацетат/хлороформ (100 мл) и полученный элюат выпаривают до получения янтарного масла (6,744 г).
ПМР (СДС1,) дельта/ТМС: 1,38 (с, ЗН), 1,61 (с, ЗН), 3,96 (с, 2Н), 4,53 (с, 1Н), 5,17 (с, 2Н), 5,40 (с, 1Н), 7,34 (с, 5Н).
Пример 11. Бензйл-б-альфа- -бромо-6-бета-грифторметансульфонил- оксиметилпеницилланат.
В соответствии с методикой примера 9 бензил-6-альфа-бромо-6-бета-ок- ,44 (ЗН,с)20 симетилпеницилланат (0,548 г, 1 ,4 ммоль) в метиленхлориде (4 мл), содержащем пиридин (0,17 мл), подвергают взаимодействию с раствором трифторметан- сульфонового ангидрида (0,42 мл) в 3 мл метиленхлорида до получения предложенного продукта в виде янтарного масла (641 мг).
ПМР (СДС) дельта/ТМС: 1,43 (с.
25
30
ЗН), 1,62 Г(
(с.
1Н),
40
4,88 (КБ, 2Н), 5,19 (с, 1Н), 5,62 (с, 1Н), 7,35 (с, 5Н).
Пример 12. Бензил-6-альфа- -бромо-6-бета--азидсметилпеницилланат,
К раствору бензил-6-альфа-бромо-6- 35 -бета-трифторметансульфони:аоксиме- тилпеницилланата (641 мг, 1,2 ммоль) в 10 мл хлороформа добавляют тетра- метилгуанидинийазид (229мг, 1,2ммоль) при 10 С. Реакционную смесь перемешивают при пониженном давлении. Маслянистый остаток фильтруют через слой силикагеля и элюируют из него 10%-ной смесью этипацетат/хлороформ. После выпаривания элюата получают предложенный продукт в виде янтарного масла (420 мг).
ПМР (СДС) дельта/ТМС: 1,43 (с, ЗН), 1,61 (с, ЗН), 3,91 (с, 2Н), 4,48 (с, 1Н), 5,15 (с, 2Н), 5,57 (с, 1Н), 7,37 (с, 5Н).
Пример 13. Бензил-6-альфа- -аминометил-б-бета-бромопеницилланат.
Сероводород барботируют в быстро- перемешиваемый раствор бензил-6-аль- фа-азидометил -ь-6ета-бромопениикл- ланата (541 мг, 1,3 ммоль) и триэтил- амина (0,71 мл, 4 эквивалента) Б хлороформе (10 мл) в одного ча45
50
55
0
ЗН), 1,62 Г(
(с.
1Н),
0
4,88 (КБ, 2Н), 5,19 (с, 1Н), 5,62 (с, 1Н), 7,35 (с, 5Н).
Пример 12. Бензил-6-альфа- -бромо-6-бета--азидсметилпеницилланат,
К раствору бензил-6-альфа-бромо-6- 5 -бета-трифторметансульфони:аоксиме- тилпеницилланата (641 мг, 1,2 ммоль) в 10 мл хлороформа добавляют тетра- метилгуанидинийазид (229мг, 1,2ммоль) при 10 С. Реакционную смесь перемешивают при пониженном давлении. Маслянистый остаток фильтруют через слой силикагеля и элюируют из него 10%-ной смесью этипацетат/хлороформ. После выпаривания элюата получают предложенный продукт в виде янтарного масла (420 мг).
ПМР (СДС) дельта/ТМС: 1,43 (с, ЗН), 1,61 (с, ЗН), 3,91 (с, 2Н), 4,48 (с, 1Н), 5,15 (с, 2Н), 5,57 (с, 1Н), 7,37 (с, 5Н).
Пример 13. Бензил-6-альфа- -аминометил-б-бета-бромопеницилланат.
Сероводород барботируют в быстро- перемешиваемый раствор бензил-6-аль- фа-азидометил -ь-6ета-бромопениикл- ланата (541 мг, 1,3 ммоль) и триэтил- амина (0,71 мл, 4 эквивалента) Б хлороформе (10 мл) в одного ча5
0
5
са. Затем реакционную смесь выпаривают н вакууме до красного масла.. Данные ЯМР показывают, что остаток содержит целевой продукт с примесью триэтиламина.
ПМР (СДС1,) дельта/ТМС: 1,39 (с, ЗН), 1,64 (с, ЗН), 3,35 (с, 2Н), 4,51 (с, 1Н), 5,16 (с, 2Н), 5,35 (с, 1Н), 7,33 (с, 5Н).
Пример 14. Бензил-6-бета- -6-альфа-бензилоксикарбониламиноме- тил/пеницилланат.
Раствор пиридина (0,14 мл) и бен- зил-6-альфа-аминометил-6-бета-бромо- пеницилланата (239 мг, 0,6 ммоль) в метиленхлориде (5 мл) добавляют через шприц за 5 мин к раствору бен- зилхлороформата в метиленхлориде (5 мл) и реакционную смесь перемеши30
35
вают на ледяной бане в атмосфере азо-20 рогидрид та в течение 75 мин. Реакционную смесь выпаривают в вакууме, а остаток помещают в смесь зтилацетат/вода. рН доводят до 2,9 разбавленной соляной кислотой,этриацетатную фазу вы- центрируют до получения пены в деляют и экстрагируют разбавленным У растворяют в 30 мл Н раствором бикарбоната натрия (рН8,1), экстрагируют 220 мл промывают рассолом и сушат над безводным сульфатом натрия. После выпаривания при пониженном давлении получают 312 мг, которые помещают в хлогоформ и хроматографируют на колонке с силикагелем (15 г, 14-20 см колонка), а затем элюируют из нее 5%-ной смесью зтилацетат/хлороформ.
Собирают фракции по 4 мл. Фракции 14-27 объединяют и выпаривают при пониженном давлении до получения предложенного продукта (168 мг).
ПМР (СДСЦ) дельта/ТМС соответствует предложенному продукту и идентичен спектру того же соединения, полученного в примере 1.
Пример 15. Бензил-6-бета- -(бензш:оксикарбониламинометил)-пе- ницилланат.
Раствор три(н-бутил)оловогидрида (0,25 мл) и бензил-6-бета-бромо-6- -альфа-(бензилоксикарбонш1аминоме- тил)пеницилланата (168 мг, 0,31 ммоль) в бензоле (4 мл) кипятят с обратным холодильником в течение 2 ч. Затем бензол выпаривают в вакууме и остаток тщательно растирают с гексаном (3-2 мл), остаток помещают в смесь этилацетат/вод., этилацетатную фазу вьщеляют, промывают рассолом и сушат над безводным сульфатом натрия. Пос40
45
50
55
(47,6 мг, 0,758 ммоль лученную смесь перемешивают в фере азота в течение 30 мин пр натной температуре. Реакционну смесь проясняют фильтрованием
этилацета
сушат вымораживанием до получе предложенного продукта в виде стеклообразного продукта (130 м ПМР (Д,,0) дельта/ДСС: 1,57
1.69(ЗН, с), Х,7-4,4 (5Н, м), (1Н, с), 5,21 (2Н, д, J 4), (5Н, с).
Пример 17. 1,1-Диоксид -бета-(2-фенилэтиламинометил)п циллановой кислоты.
Аминометиловый продукт по пр ру 7 (О,1 г) подвергают взаимод вию с фенилацетальдегидом (0,09 по способу примера 16. Реакцион смесь концентрируют в вакууме и дую часть вьщеляют, тщательно р рают с 20 мл этилацетата. Тверд часть растворяют в воде, раство единяют с водным экстрактом эти татной фазы и сушат вымораживан до получения предложенного прод (40 мг).
ПМР () дельта/ДСС: 1,56
1.70(ЗН, с), 3,0-4,0 (6Н, м), (1Н, м), 4,41 (1Н, с), 5,24 (1Н J 4), 7,48 (5Н, с).
Пример 18. 1,1-Дисксид -бета-(4-пиколиламинометил)-пен лановой кислоты.
Бета-аминометиловый продукт примеру 7 (0,1 г, 0,38 ммолъ) с
ле выпаривания в вакууме получают 101 мг масла, которое хроматографи- руют на колонке с силикагелем (4 г, I ll см колонка), устанавливают хлог роформом и злюируют 5%-ной смесью этилацетат/хлороформ. Фракции по 4 мл собирают. Фракции 3-5 объединяют и выпаривают до получения предложенного продукта (66 мг), его спектр ПМР
0 идентичен спектру продукта по примеру 2).
Пример 16. 1,1-Диoкcид-6- -бeтa-(бeнзилaминoмeтил)пeнициллaнo- вoй кислоты.
5 К мутному раствору бета-аминоме- тилового продукта по примеру 7 (0,3 г, 1,145 ммоль) Е 30 мл метанола добавляют оензальдегид (0,117 мл, 1,145 ммоль), а затем натрийцианобо0
5
0 рогидрид центрируют до получения пены в У растворяют в 30 мл Н экстрагируют 220 мл
0
5
0
5
(47,6 мг, 0,758 ммоль). Полученную смесь перемешивают в атмосфере азота в течение 30 мин при комнатной температуре. Реакционную смесь проясняют фильтрованием и конваку2°.
этилацетата и
сушат вымораживанием до получения предложенного продукта в виде белого стеклообразного продукта (130 мг). ПМР (Д,,0) дельта/ДСС: 1,57 (ЗН,с),
1.69(ЗН, с), Х,7-4,4 (5Н, м), 4,38 (1Н, с), 5,21 (2Н, д, J 4), 7,56 (5Н, с).
Пример 17. 1,1-Диоксид-6- -бета-(2-фенилэтиламинометил)пени- циллановой кислоты.
Аминометиловый продукт по примеру 7 (О,1 г) подвергают взаимодействию с фенилацетальдегидом (0,098 мл) по способу примера 16. Реакционную смесь концентрируют в вакууме и твердую часть вьщеляют, тщательно растирают с 20 мл этилацетата. Твердую часть растворяют в воде, раствор объединяют с водным экстрактом этилаце- татной фазы и сушат вымораживанием до получения предложенного продукта (40 мг).
ПМР () дельта/ДСС: 1,56 (ЗН,с),
1.70(ЗН, с), 3,0-4,0 (6Н, м), 4,28 (1Н, м), 4,41 (1Н, с), 5,24 (1Н, д, J 4), 7,48 (5Н, с).
Пример 18. 1,1-Дисксид-б- -бета-(4-пиколиламинометил)-пеницил- лановой кислоты.
Бета-аминометиловый продукт по примеру 7 (0,1 г, 0,38 ммолъ) суспен9131335010
дируют в 4 мл воды. Добавляют 4-пиридин-(0,А46 мл), получают предложенное карбальдегид (0,040 мл, 0,42 ммоль),соединение. Выделение модифицируют а затем цианоборогидрид натриятем, что неочищенный продукт внача- (15,8 мг, 0,25 ммоль) и полученнуюле осаждают в виде смолы, когда гек- смесь перемешивают в атмосфере азота 5сан добавляют к этилацетату. Эту смо- в течение 30 мин при комнатной тем-лу выделяют декантированием и разде- пературе. Затем мутный раствор освет-ляют между 20 мл этилацетата и 20мл ляют, концентрируют в вакууме, оста-Н О, а нерастворившийся материал ток помещают в 5 мл , экстрагиру-(100 мг) удаляют фильтрованием. Вод- ют 10 мл этилацетата, сушат вымора- Оньш слой сушат вымораживанием до по- живанйем до получения указанного влучения очищенного предложенного про- заглавии продукта в виде белого стек-дукта в виде твердого вещества жел- лообразного вещества (0,1 г).того цвета (0,18 г).
ПМР () дельта/ДСС: 1,53 (ЗН,с), НИР () дельта/ТМС: 1,55 (ЗН,с),
164 (ЗН, с), 3,3-4,1 (5Н, м), 4,35 (ЗН, с), 2,9-4,0 (7Н, м), 4,34
(1Н, с) 5.14 (1Н, д, J Гц), 8,1(1Н, с), 5,10 (1Н, д), 7,43 (5Н, с). (4Н, м),П р и м е р 22. 1,1-Диоксид-6Пример 19. 1,1-Диоксид-б--альфа-(4-пиколиламинометил)пеницкл-бёта-(3-пиколиламинометил)пеницш1-лаковой кислоты. лановой кислоты. 20 По способу примера 20, заменяя
Повторяют процедуру предыдущегона 4-пиридинкарбальдегид (0,182 мл)
примера, заменяя 4-пиридинкарбаль-бензальдегид, получают предложенный
дегид на 3-пиридинкарбальдег.идпродукт. Выделение его модифицируют
(0,039 мл), в результате получаютза счет того, что после фильтрации
предложенное соединение (70 мг). реакционной смеси фильтрат концентПМР (Д,0) дельта/ДСС: 1,59 (ЗН, с) ° ™ °1,71 (ЗН/с), 3,7-4,5 (5Н, с), 4, растирают с этилаце(1Н, с), 5,23 (1Н, i, J 4 ri),татом помещают в 10 мл и промь,„ . /,„ чвают 20- мл свежего этилацетата. Вод- о, 1 (.чН, м;. эл « V.
„or . . „ нь1и СЛОИ повторно концентрируют в ваПример 20. 1,1-Диоксид-б.,Vкууме до получения указанного в заг-альфа-(бензиламинометил)пеницилланолавии продукта в виде второй порции
вой кислоты.„ СП -30 N
желтой пены (0,38 г). Альфа-аминометиловое соединение
по примеру 8 (0,5 г, 1,91 ммоль) под- ,, ПМР (Д,0) дельта/ДСС: 1,57 (ЗН, с),
вергают взаимодействию с бензальде-1,70 (ЗН, с), 3,39 (2Н, м), 4,0 (ЗН,
гидом (0,194 мл, 1,91 ммоль) и циано-м), 4,32 (1Н, с), 5,01 (1Н, J 2),
борогидридом натрия (79,4 мг, 1,259 г)8,1 (4Н, м).
всего в 26 мл метанола по способу Пример 23. 1,1-Диоксид-6примера 16. После 30 мин перемешива- Q-альфа-(З-пиколиламинометил)пеницилния реакционную смесь осветляют фшть-лановой кислоты.
трованием и концентрируют в вакууме По способу примера 22, заменяя на до получения пенистого остатка.Этот3-пиридинкарбальдегид (0,182 мл) 4- остаток растворяют в 50 мл этилаце--пиридинкарбальдегид, получают пред- тата и неочищенный продукт (0,45 г) ложенный продукт. Вьщеление его мо- растворяют в 30 мл воды, экстраги-дифицируют за счет первоначального руют 2-30 мл этилацетата и концентри-выделения желтой пены, которую поме- руют в вакууме до получения указанно-щают в 10 мл , экстрагируют го в заглавий продукта в виде стекло-2-10 мл этилацетатом, И водный слой образного вещества (0,28 г). Qсушат, вымораживанием до получения
ПМР () дельта/ДСС: 1,54 (ЗН,с),предложенного продукта в виде второй
1,67 (ЗН, с), 3,47 (2Н, м), 4,03желтой пены (0,39 г).
(Н, м), 4,33 (1Н, с), 4,98 (1Н, д, ПМР (Л,,0) дельта/ДСС: 1,57 (ЗН,с),
J2), 7,53 (ЗН, с).1,70 (ЗН, с). 3,43 (2Н, м), 4,1 (ЗН,
.П р им е р 21. 1,1-Диоксид-6- (1Н, с), 5,00 (1Н, д, J 2) ,
-альфа-(2-фенилэтиламинометил)пени-8,1 (4Н, м) . циллановой кислоты.Пример 24, 1,1-Диоксид-6По способу примера 20, заменяя альфа-4(оксибензиламиномет ;л)пенкбензальдегид на фенилацетальдегидциллановой кислоты.
По способу примера 23 продукт по примеру 8 (Ojl г, 0,38 ммоль) подвергают взаимодействию с 4-оксибен- зальдегидом (46,6 мг, 0,38 мл) и цианоборогидридом (15,8 мг, 0,25ммол в 5 мл метанола до получения высушенного вымораживанием предложенного продукта в виде белого твердого вещества (0,1 г).
ПНР () дельта/ДСС: 1,53 (ЗН,с) 1,68 (ЗН, с), 3,52 (2Н, м), 4,1 (ЗН, м), 4,33 (1Н, с), 5,00 (1Н, д, ) 7,1 (4Н, м).
Соединения формул (I) и (II) повышают антибактериальную активность бета-лактамовых антибиотиков in vivo т.е. снижают количество антибиотика, которое необходимо для защиты мышей против летального (в противном случае) инокулюма определенных продуди- рующих бета-лактамазу бактерий. При определении таковой активности у мышей вызывают острые экспериментальные инфекции путем внутрибрюшинной инокуляции мышам стандартной культуры тестового организма, суспендированной в 5%-ном желудочном свином секрете. Тяжесть инфекции стандартизировали таким образом, что мьипи получали летальную дозу организма (ле- тальная доза соответствует минимальному инокулюму организма, необходимому для умерщвления 100% инфицированных, необработанных контрольных мышей). Тестовое соединение в сочета НИИ с антибиотиком вводят в различных дозах орально или внутрибрюшин- но группам инфицированных мышей. В конце теста активность смеси оценивают, считая количество выживших среди обработанных животных при данной дозе. Активность выражают, как процент животных, которые выжили при заданной дозе, или рассчитывают как РД, (доза, которая защищает 50% жи- нотных от инфекции).
Полученные предложенные соединения не проявляли признаков токсичности.
Хотя соединения (I) и (II) зффек- тивны для повышения активности бета- лактамовых антибиотиков вообще, их предпочтительно использовать в соче
тании, например, с ампициллином.
Антибактериальная активность ампициллина и сочетаний 1: 1 ампициллина с пенам-сульфонами приведены в таблице.
Формула изобретения
Способ получения производных 1,1- -диоксида-6-аминоалкил-пеницш1лано- вой кислоты общей формулы
RlCHCHT.
V
v T fHhCH3
0 T.nnv
COOti
или общей формулы
25
5 20 -30 35 45
RI
бензил, фенэтил, орто-, мета- или пара-оксибензил, 3- или 4-пиколил, ли чающийс
тем.
что
соединение общей формулы
о
0ч /О
a.
СНз
соои
-N
или общей формулы
50
подвергают взаимодействию с бензаль- дегидом, фенацетильдегидом, орто-, мета- или пара-оксибензальдегидом, 55 или 3-, или 4-пиридинкарбальдегидом в присутствии натрийцианборгидрида.
,., Н
QX/O S
L 1
Концентрация каждого компонента. Одни пенамы не проявляют значительной активности.
Составитель И. Бочарова Редактор В. Данко Техред М.Ходанич
Заказ 1984/59 Тираж 372Подписное
ВНИИПИ Государственного комитета СССР
по делам изобретений и открытий 113035, Москва, Ж-35, Раушская наб., д. 4/5
Производственно-полиграфическое предприятие, г. Ужгород, ул. Проектная, 4
QX/O S CH
COOH
Корректор С, Шекмар





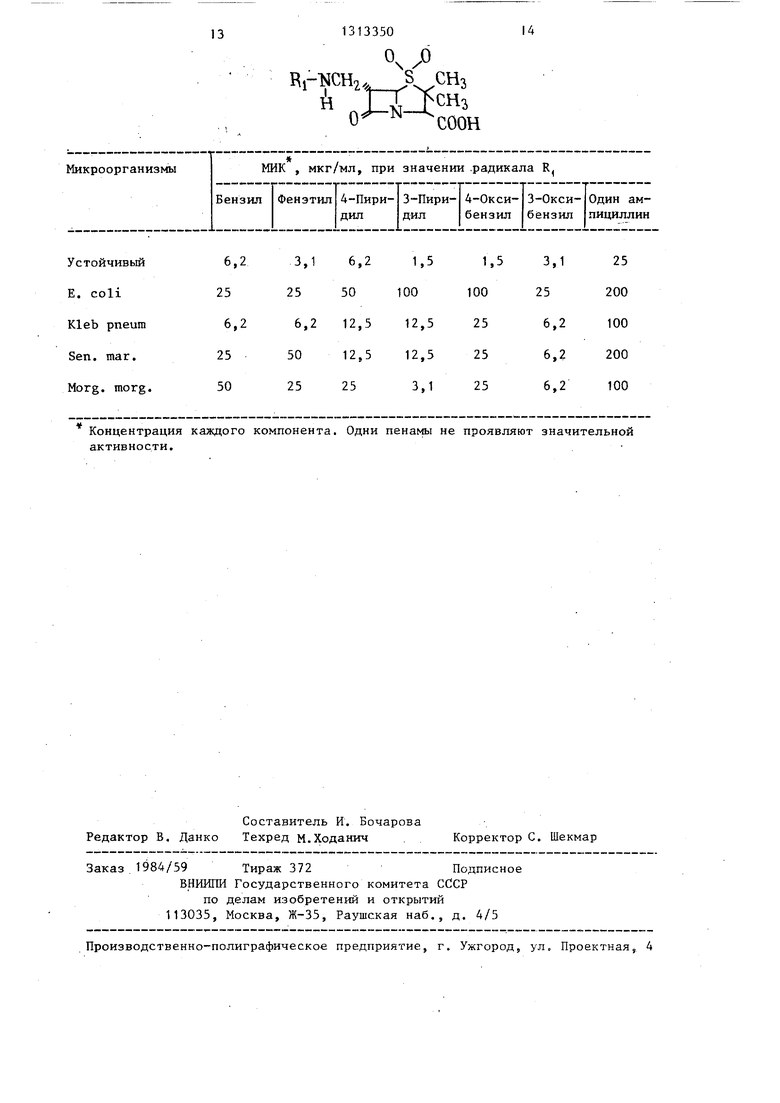
Изобретение касается производных пенициллановой кислоты, в частности 1,1-диоксида-6-аминоалкилпеницил- лановой кислоты общей формулы I и II где R - бензил, фенэтил, о-, м- или п-оксибензил, 3- или 4-пиколил, которые проявляют антибактериальное действие и могут быть использованы в медицине. Цель - создание более активных веществ указанного класса. Получение соединений I или II ведут из соответствующего незамещенного амина и альдегида в присутствии цианборгид- рида. Испытания новых I или II показывают, что они активны против микроорганизмов и эффективны для повышения активности р-лактамовых антибиотиков, например ампицилина.1 табл. W

| Патент США № 2985648, кл | |||
| Прибор для периодического прерывания электрической цепи в случае ее перегрузки | 1921 |
|
SU260A1 |
Авторы
Даты
1987-05-23—Публикация
1983-12-12—Подача