Изобретение относится к ряду новых четырехкоординационных комплексов двухвалентной платины с некоторыми аминосоединениями. Такие комплексы проявляют требуемую противоопухолевую активность при более высокой растворимости по сравнению с известными противоопухолевыми платиновыми соединениями и комплексами. Изобретение предлагает кроме того способ получения указанных комплексов, их составы и методику их применения.
Раковые заболевания относятся к главной медицинской проблеме, и часто их трудно лечить. Основная причина этого заключается в том, что различия между опухолевыми и типичными клетками очень незначительны и это приводит к тому, что соединения, действующие токсично на раковые клетки, также гибельны для обычных клеток. Химиотерапия раковых заболеваний, таким образом, обычно зависит от очень ограниченной разницы между чувствительностью опухолевых и типичных клеток к противоопухолевым агентам.
Известны различные соединения платины, которые обладают противоопухолевой активностью. При лечении опухолей успешно применяют, например, цис-платиновое соединение (см. Rosenberg и др. Nature 222, стр. 385, 1965 г. и Merck Index, 10 издание, статья 2289, 1983 г;) и для этой цели также предложена малонато-(1,2-диаминоциклогексан) платина (П) (см. патент США N 4169846 и Kidani и др. Gann, 71, стр. 637-643, 1980 г.).
Оба из указанных платиновых комплексов имеют некоторое структурное сходство с предлагаемыми соединениями. Другой комплекс платины хотя менее сходный со структурой заявляемых соединений, который недавно появился в распоряжении для лечения опухолей, представляет карбоплатиновое соединение (см. Drugs of Future, том 8, N 6, стр. 489-491, 1983 г.).
Однако большинство из известных платиновых комплексов, в том числе и указанные выше, имеют высокое токсичное действием на почки и слабую растворимость в воде, что затрудняет составление их рецептуры в требуемой дозировке.
В патентной заявке США N 902420 раскрывается другой ряд платиновых комплексов, которые имеют ограниченное структурной сходство с соединениями изобретения.
В данном исследовании найдена новая группа комплексов платины, которые проявляют хорошую противоопухолевую активность при относительно немногочисленных побочных эффектах, как например, токсичного действия на почки и подавления функции костного мозга, и имеют хорошую растворимость в воде.
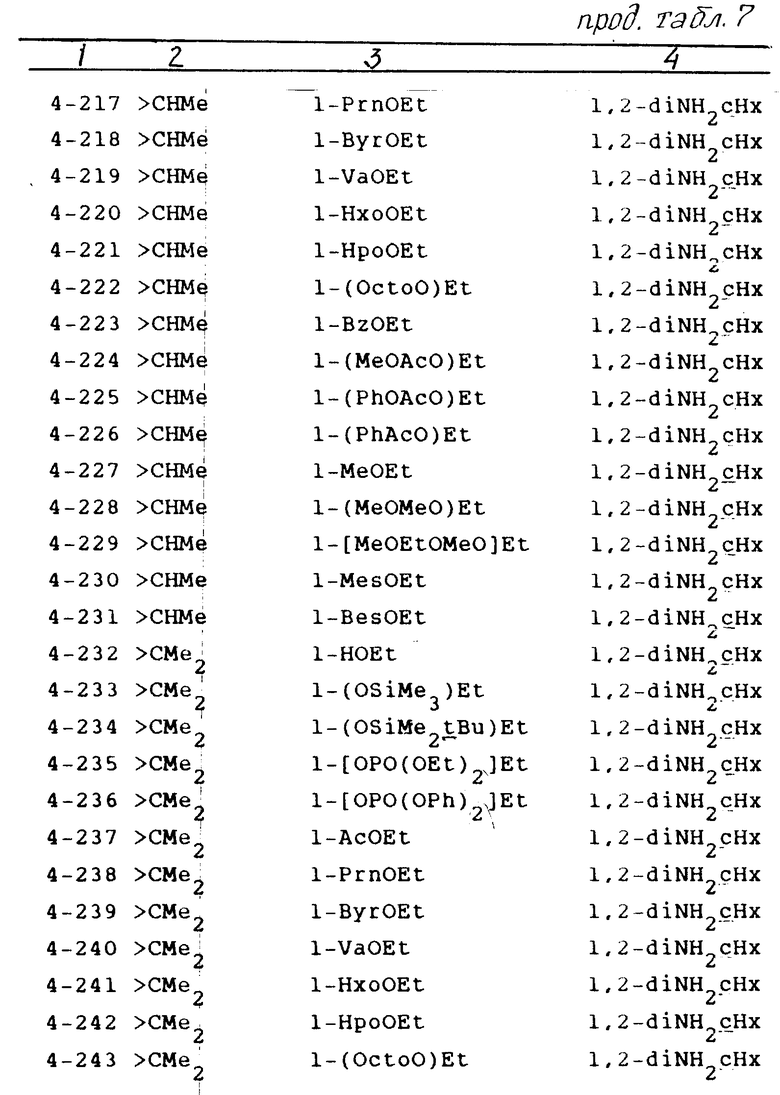
Предлагаемые соединения представляют собой четырехкоординационные комплексы двухвалентной платины, представленные формулой I Pt
Pt Z где A и B независимо друг от друга представляют амин или A и B комбинации представляют соединение формулы Н2N-Y-NH2, где Y означает алициклическую группу с 5-8 кольцевыми атомами, или А и В вместе представляют собой группу
Z где A и B независимо друг от друга представляют амин или A и B комбинации представляют соединение формулы Н2N-Y-NH2, где Y означает алициклическую группу с 5-8 кольцевыми атомами, или А и В вместе представляют собой группу Z означает группу формулы II
Z означает группу формулы II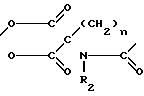 CH-R1 или группу формулы III
CH-R1 или группу формулы III где R1, R2 означают атом водорода, С1-С4-алкил или замещенный С1-С4алкил группой, состоящей из С1-С4 алкокси или алкоксиалкокси группы, содержащей 2-5 атомов углерода;
где R1, R2 означают атом водорода, С1-С4-алкил или замещенный С1-С4алкил группой, состоящей из С1-С4 алкокси или алкоксиалкокси группы, содержащей 2-5 атомов углерода;
Х означает связь или СН2 группу;
n равно 0,1 или 2;
R" С1-С4 алкил, замещенный группами ОН или алкоксиалкоксиалкокси группой С3-С7 или замещенный триалкил (С1-С4) группой или группой формулы -ОРО(ОR3)2, где R3 С1-С4 алкил.
Предлагаемые соединения содержат четырехкоординированный атом двухвалентной платины, два координационных положения которого заняты аминогруппами, полученными из одного диамино- или двух моноаминосоединений (представленных радикалами А и В), а два других его координационных положения заняты атомом кислорода карбоксильной группы.
Предлагаемые соединения, в которых Z означает группу формулы II могут быть представлены формулой Ia Pt
Pt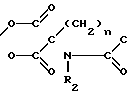 H-R1 (Iа) где A, B, R1, R2 и n имеют указанные значения. Аналогичным образом соединения формулы I, в которой Z означает группу формулы III может быть представлены формулой Iв
H-R1 (Iа) где A, B, R1, R2 и n имеют указанные значения. Аналогичным образом соединения формулы I, в которой Z означает группу формулы III может быть представлены формулой Iв P
P где A, B, R1, R7 и Х имеют указанные значения.
где A, B, R1, R7 и Х имеют указанные значения.
Предлагаемые соединения могут существовать в виде изомеров различной геометрической формы у атома платины и возможно из-за асимметрических атомов углерода в группах внутри соединений. Настоящее изобретение охватывают как отдельные изомеры, так и их смеси. Отдельные изомеры можно получить по методике синтеза стереоспецифичных полимеров или их можно получить путем выделения из смесей изомеров, как хорошо известно специалистам в данной области. Кроме того, известно, что некоторые изомеры могут быть более активны, чем другие, и это можно легко установить относительно любой конкретной пары изомеров, используя стандартные лабораторные методы.
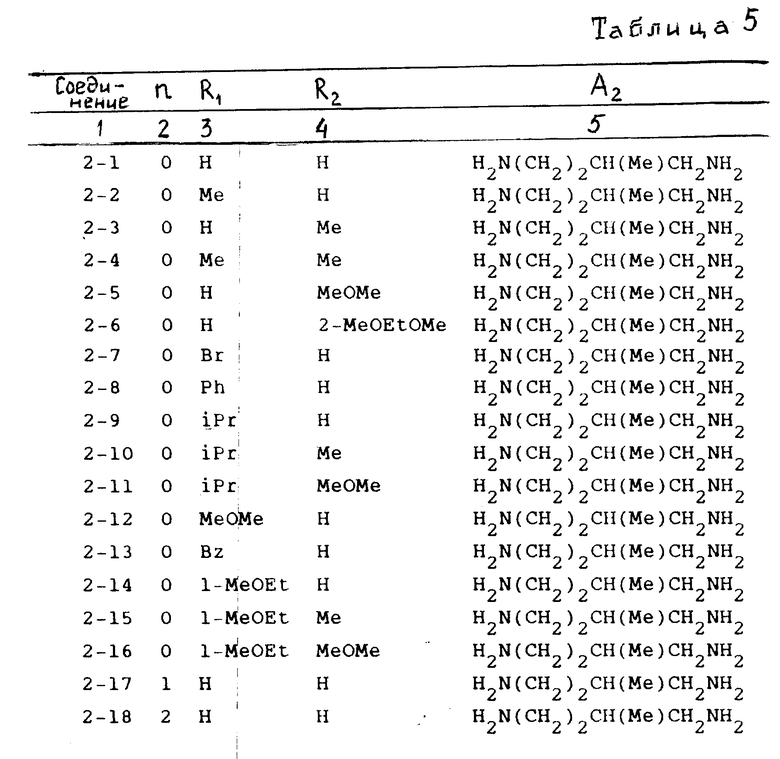
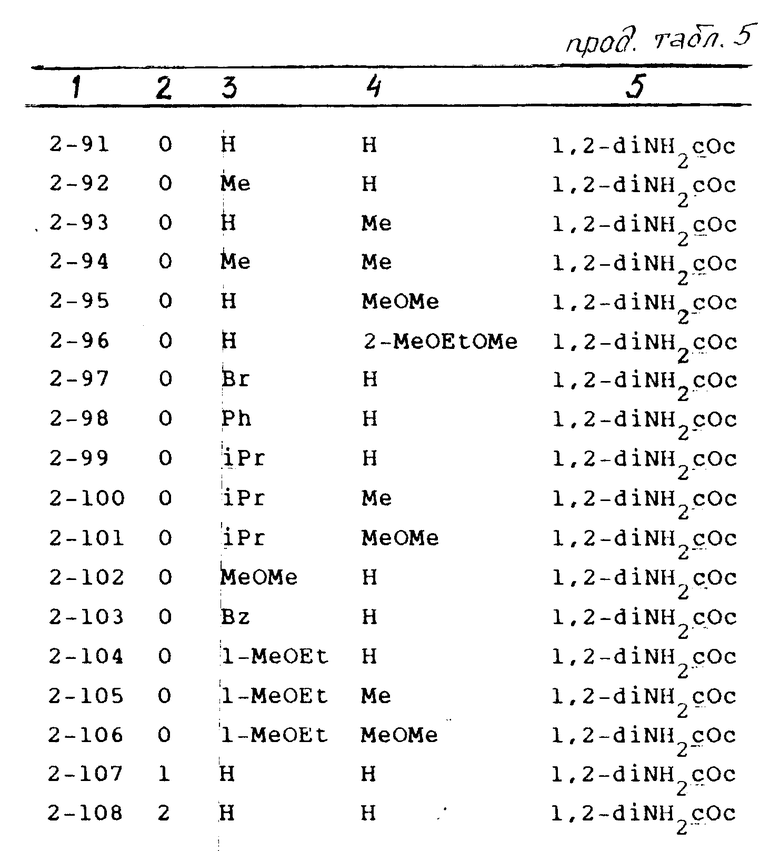
Примеры конкретных соединений изобретения приведены в следующих формулах (1-1)-(1-5), заместители в которых имеют значения, которые указаны в соответствующих формулах табл.1-5 (то есть табл.1 относится к формуле (1-1), табл. 2 к формуле (1-2) и т.д. В указанных таблицах использованы следующие аббревиатуры:
Ac ацетил; Bes бензолсульфонил;  Bu трет-бутил; Byr бутирил; Bz бензил; Et этил или этилен; НрО гептаноил;
Bu трет-бутил; Byr бутирил; Bz бензил; Et этил или этилен; НрО гептаноил;  Нх циклогексил; НхО гексаноил; Ме метил или метилен; Mes матансульфонил;
Нх циклогексил; НхО гексаноил; Ме метил или метилен; Mes матансульфонил;  Ос циклооктил; Осtо октаноил; Рr пропил; Ph фенил;
Ос циклооктил; Осtо октаноил; Рr пропил; Ph фенил;  Pr изопропил; Рrn пропионил; Рyrd пирролидинил; Va валериал.
Pr изопропил; Рrn пропионил; Рyrd пирролидинил; Va валериал.
В табл.4 и 5, в колонке для Х, дефис (-) означает прямую связь: Формулы (1-1) (1-5) приведены на фиг.1 и 2.
Из перечисленных соединений, наиболее предпочтительными являются следующие соединения:
2-оксоазетидин-4,4-дикарбоксилат 1,2-диаминоциклогексанплатины (П), особенно 2-оксизетидин-4,4-дикарбоксилатный изомер  -(транс-(
-(транс-( )-1,2-диаминоциклогексан) платины (П), (1-метил-2-оксоазетидин-4,4-дикарбоксилат 1,2-диаминоциклогексанплатины (П), особенно изомер (1-ме- тил-2-оксоазетидин-4,4-дикарбоксилата)
)-1,2-диаминоциклогексан) платины (П), (1-метил-2-оксоазетидин-4,4-дикарбоксилат 1,2-диаминоциклогексанплатины (П), особенно изомер (1-ме- тил-2-оксоазетидин-4,4-дикарбоксилата)  -(транс-(
-(транс-( )-1,2-диаминоциклогексан) платины (П);
)-1,2-диаминоциклогексан) платины (П);
(1-метоксиметил-2-оксоазетидин-4,4- дикарбоксилат) 1,2-диаминоциклогексанплатины (П), особенно (1-метоксиметил-2-оксоазетидин-4,4-дикарбоксилатный) изомер цис-(транс-( )-1,2-диаминоциклогексан) платины (П);
)-1,2-диаминоциклогексан) платины (П);
[1-(2-метоксиэтокси)-метил-2-оксоазет- идин-4,4-дикарбоксилат] 1,2-диаминоциклогексанплатины (П), особенно изомер [1-(2-метокси)токси)метил-2-оксоазетидин-4,4- дикарбоксилата] цис-[транс-( )-1,2-диаминоциклогексан]платины (П);
)-1,2-диаминоциклогексан]платины (П);
(1-метил-3-изопропил-2-оксоазетидин-4,4-дикарбоксидат) 1,2-диаминоциклогексанплатины (П), особенно изомер (1-метил-3-изопропил-2-оксоазетидин-4,4-дикарбок- силата цис/транс-(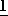 )-1,2-диаминоциклогексан/платины (П)
)-1,2-диаминоциклогексан/платины (П)
3-[1-(метоксиметокси)этил] -2-оксоазет- идин-4-илацетат 1,2-диаминоциклогексанплатины (П), особенно (3 , 4R)-3-/(
, 4R)-3-/( -1-(метоксиметокси)этил/2-оксоазетидин-4-ил ацетатный изомер цис-[транс-(
-1-(метоксиметокси)этил/2-оксоазетидин-4-ил ацетатный изомер цис-[транс-( )-1,2-диаминоциклогексан] платины (П);
)-1,2-диаминоциклогексан] платины (П);
3-[1-(2-метоксиэтоксиметокси)этил/-2-оксоазетидин-4-илацетат 1,2-диаминоциклогексанплатины (П),особенно(3 , 4
, 4 )-3-/(
)-3-/(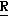 )-1-(2-метокси)этоксиметокси)этил/-2- оксоазетидин-4-ил}-ацетатный изомер цис-/транс-(
)-1-(2-метокси)этоксиметокси)этил/-2- оксоазетидин-4-ил}-ацетатный изомер цис-/транс-(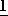 )-1,2-диаминоциклогексан/пла- тины (П); 3-(1-окстаноилоксиэтил)-2-оксоазетидин-4-илкарбоксилат-1,2- диаминоциклогексанп(П), особенно(3
)-1,2-диаминоциклогексан/пла- тины (П); 3-(1-окстаноилоксиэтил)-2-оксоазетидин-4-илкарбоксилат-1,2- диаминоциклогексанп(П), особенно(3 , 4
, 4 )-3-[(
)-3-[(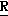 )-1-октаноилоксиэтил] -2-оксоазетидин-4-ил} карбоксилатный изомер цис-[транс-(
)-1-октаноилоксиэтил] -2-оксоазетидин-4-ил} карбоксилатный изомер цис-[транс-( )-1,2-диаминоциклогексан]платины (П);
)-1,2-диаминоциклогексан]платины (П);
3-(1-трет-бутилдиметилсилилоксиэтил)-2-оксоазетидин-4-илкарбоксилат 1,2-диаминоциклогексанплатины (П), особенно (3 , 4
, 4 )-3-[(
)-3-[( )-1-трет-бутилдиметилсилилоксиэтил] -2-оксиазетидин-4-ил} карбоксилатный изомер цис-/транс-(
)-1-трет-бутилдиметилсилилоксиэтил] -2-оксиазетидин-4-ил} карбоксилатный изомер цис-/транс-( )-1,2-диаминоциклогексан/-платины (П).
)-1,2-диаминоциклогексан/-платины (П).
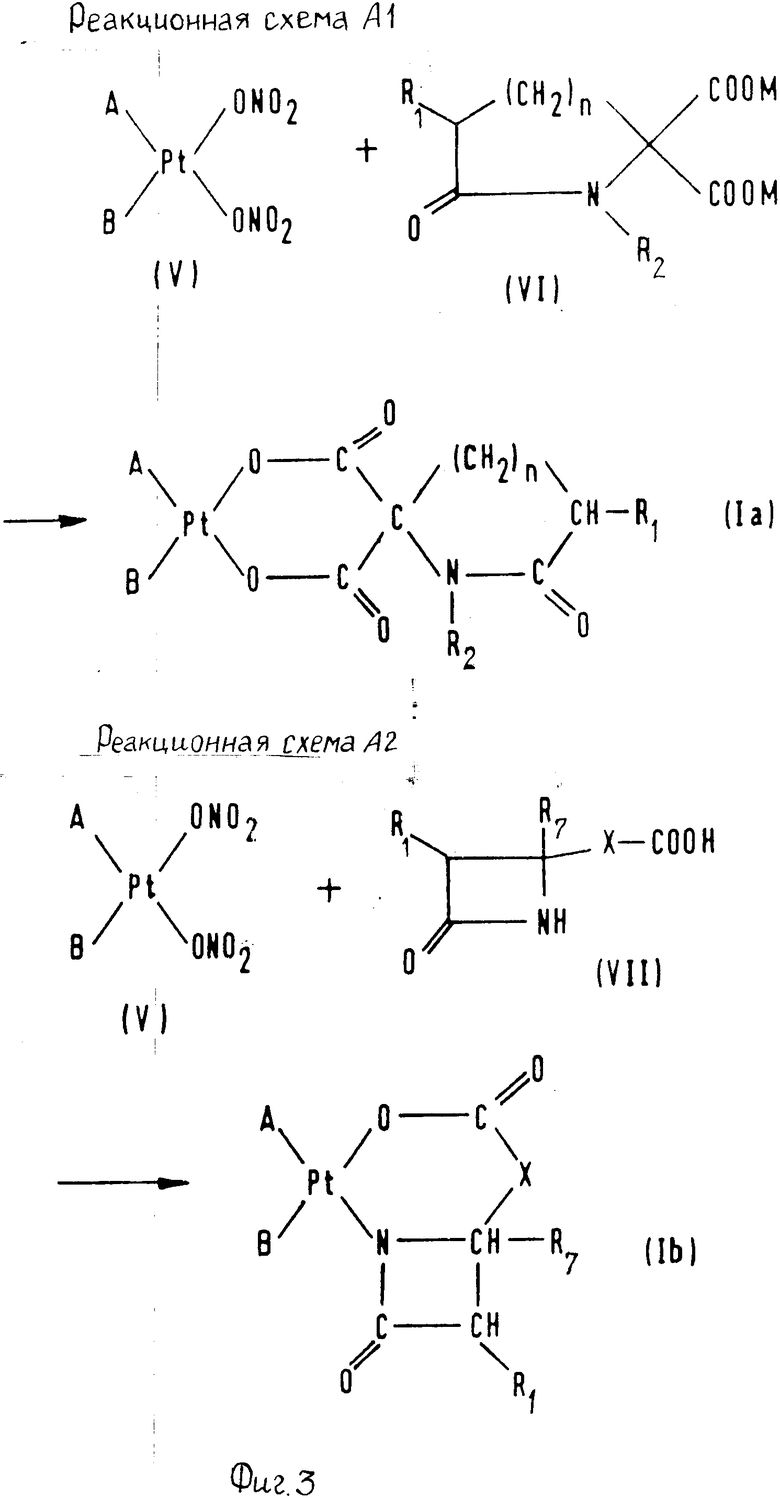
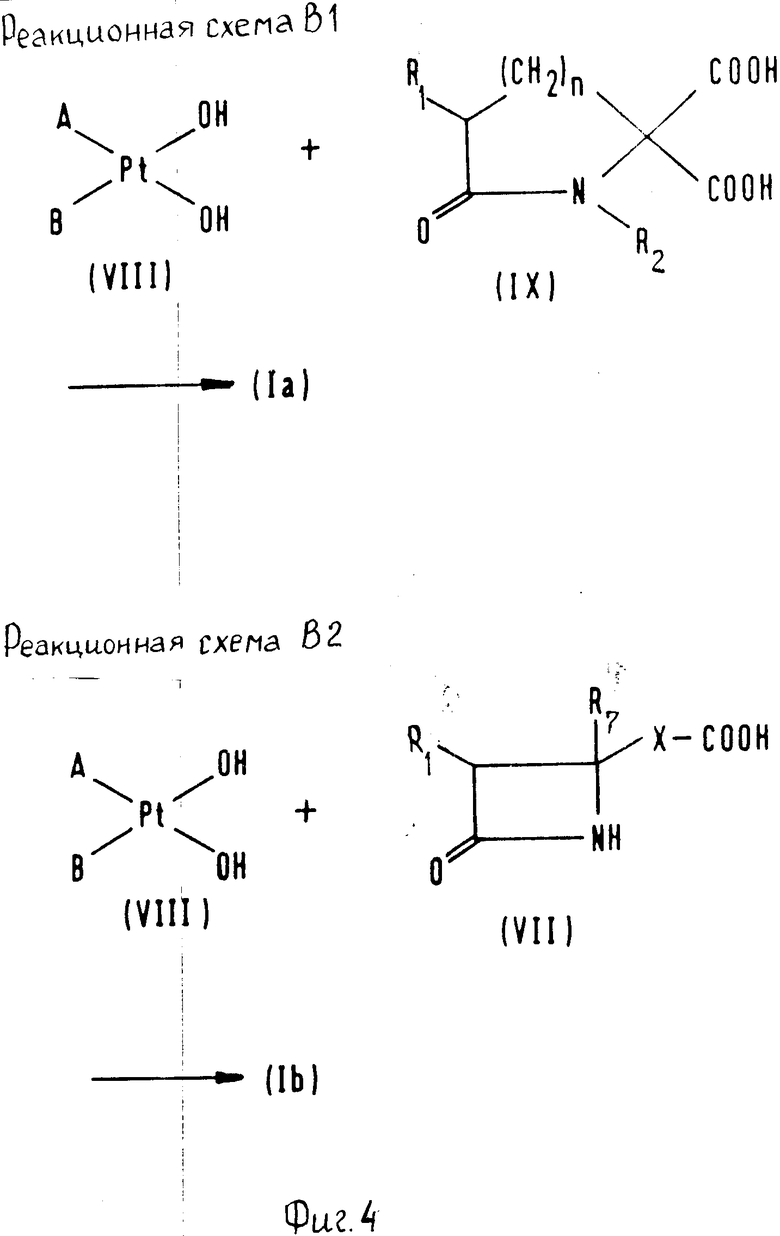
Предлагаемые соединения можно получить различными способами, которые хорошо известны для получения данного типа комплексных соединений. Примеры пригодных способов получения показаны в реакционных схемах, приведенных на фиг.3 и 4.
В формулах, приведенных выше А, В, R1, R2, R7, X и n имеют указанные значения; М означает атом металла, способного образовывать щелочную среду, например, щелочной металл, особенно натрий и калий.
Платиновые комплексы формулы V и VIII, используемые в качестве исходных материалов, представляют хорошо известные соединения. Моно- и ди-карбоновые кислоты формулы (VII) и (IX), и соль формулы (VI) можно получить по методике, раскрытой в заявке на патент Японии Кокаi N 56-142259.
В реакционной схеме А1, соединение формулы V взаимодействует с соединением формулы VI с выходом целевого соединения формулы Ia. В предпочтительном варианте указанную реакцию осуществляют путем введения соли формулы VI, предпочтительно в эквивалентном количестве или в небольшом избытке, в комплексное соединение формулы V, находящееся предпочтительно в водном растворе или в водной суспензии. В реакционной схеме А2, соединение формулы V взаимодействует с соединением формулы VII с выходом целевого соединения формулы Ia.
Указанную реакцию проводят путем прибавления к комплексу формулы V, желательно в водном растворе или водной суспензии, кислоты формулы VI, предпочтительно в эквивалентном количестве или небольшом избытке щелочи (например гидроокиси щелочного металла, например, как NaOH или КОН, или смолы на основе щелочи), предпочтительно, в количестве примерно двух эквивалентов. В альтернативном варианте процесс по реакционной схеме А1можно проводить с использованием кислоты, которая соответствует соли формулы (VI) в присутствии таких щелочей или процесс по реакционной схеме А2 можно осуществлять с использованием соли, которая соответствует кислоте формулы VII, без обязательного прибавления любой щелочи.
Обе реакции предпочтительно проводить при 0-50оС, хотя реакционная температура не является слишком критической относительно изобретения. Время, необходимое для осуществления указанного взаимодействия, может меняться в широком интервале, в зависимости от многих факторов, например от реакционной температуры и характера реагентов; однако от 20 мин до 5 дней обычно достаточно для осуществления взаимодействия по реакционной схеме А1, и от 20 мин до 20 дней по реакционной схеме А2.
Когда реакция завершена, образующийся осадок можно обычно собрать путем фильтрования. Однако, если целевое соединение не выпадает в осадок в виде кристаллов, это соединение можно выделить при следующей последовательности его извлечения, первоначально реакционную смесь концентрируют путем упаривания при пониженном давлении. Остаток смешивают с растворителем, который не оказывает вредного влияния на целевое соединение. Растворитель может привести к выкристаллизовыванию из него целевого соединения и если это происходит, указанное соединение можно собрать фильтрованием. В альтернативном варианте полученный раствор можно очистить любым из многочисленных хроматографических методов, например колоночной хроматографией, например, на адсорбционной смоле, такой как Diaion (торговое название) СНР-20Р или сефадексе (торговое название) или ионно-обменной смоле, с выходом целевого соединения.
Комплексное соединение формулы VIII, используемое в качестве исходного материала в реакционной схеме В1 и В2, можно получить путем обработки комплексного соединения формулы V щелочью (например, гидроокисью щелочного металла, например, NaOH или КОН, или щелочьсодержащей смолой). Затем обработанное соединение взаимодействует с соединением формулы IX или VIII по аналогичной методике, как описано относительно реакционных схем А1 и А2.
Предлагаемые соединения, как установлено, проявляют превосходную противоопухолевую активность, которая сопоставима с или превосходит активность цис-платинового и карбоплатинового комплекса. Более того совершенно неожиданно было установлено, что соединения изобретения эффективны даже против штамма лейкемии мыши L 1210, резистентного к цис-платиновому соединению. Кроме того, предлагаемые соединения как оказывается имеют удивительно ограниченные побочные эффекты, например токсичность на почки и подавление функции костного мозга, и характеризуются очень высокой растворимостью, в воде, что очень облегчает их введение. Штаммы опухоли, относительно которых испытывали предлагаемые соединения признаны в качестве модели для оценки возможной ценности любого соединения при лечении опухолей, поражающих организм человека.
Нет никакого особенного ограничения относительно метода их приема, однако при использовании в качестве карционостатического агента, платиновые комплексы предлагаемого изобретения предпочтительно вводить парентерально, например, в виде инъекций. Дозировка может меняться в зависимости от возраста, массы тела и состояния больного, а также от характера и стадии опухоли, но обычно предпочтительно, вводить соединение в дозе от 10 мг до нескольких грамм в день для взрослого больного, обычно принимаемой в виде дробных доз.
П р и м е р 1. 2-Оксоазетидин-4,4-дикарбоксилат цис-[транс-( -1,2-диаминоциклогексан-]платины (II).
-1,2-диаминоциклогексан-]платины (II).
2 г динитрата цис[транс-( )-1,2-диаминоциклогексан]платину (II) суспендируют в 80 мл воды и полученную суспензию тщательно перемешивают при 28оС в течение ночи. В конце этого времени реакционную смесь концентрируют путем упаривания при пониженном давлении до объема примерно 45 мл, а затем к концентрату прибавляют 1 г 2-оксоазетидин-4,4-дикарбоксилата натрия (полученного по методике, описанной в приготовлении 1). Затем реакционную смесь доводят до рН 6,1 путем прибавления водного раствора гидроокиси натрия и перемешивают в течение примерно 2 ч при охлаждении на льду. Осажденные кристаллы собирают фильтрованием и промывают небольшим количеством воды и диэтилового эфира с выходом 0,58 г названного соединения.
)-1,2-диаминоциклогексан]платину (II) суспендируют в 80 мл воды и полученную суспензию тщательно перемешивают при 28оС в течение ночи. В конце этого времени реакционную смесь концентрируют путем упаривания при пониженном давлении до объема примерно 45 мл, а затем к концентрату прибавляют 1 г 2-оксоазетидин-4,4-дикарбоксилата натрия (полученного по методике, описанной в приготовлении 1). Затем реакционную смесь доводят до рН 6,1 путем прибавления водного раствора гидроокиси натрия и перемешивают в течение примерно 2 ч при охлаждении на льду. Осажденные кристаллы собирают фильтрованием и промывают небольшим количеством воды и диэтилового эфира с выходом 0,58 г названного соединения.
ЯМР-спектр (270 МГц, D2О) δч/млн;
0,9-1,1 (4Н,мультиплет);
1,3-1,45 (2Н, дублетоподобный);
1,8-1,9 (2Н, дублетоподобный);
2,1-2,3 (2Н, мультиплет);
3,74 (2Н, синглет).
П р и м е р 2. 2-Оксоазетидин-4,4-дикарбоксилат цис-диаминплатины (II).
Раствор, содержащий 200 мг 2-оксоазетидин-4,4-дикарбоксилата натрия (полученного по методике приготовления 1) в 5 мл воды прибавляют к суспензии, состоящей из 347 мг динитрата цис-диаминплатины (II) в 5 мл воды. Полученную реакционную смесь перемешивают при комнатной температуре в течение ночи. В конце ночи осажденные кристаллы собирают фильтрованием и промывают небольшими количествами воды и диэтилового эфира с получением 219 г названного соединения, которое дополнительно очищают рекристаллизацией из воды.
ЯМР-спектр (270 МГц, D2O) δ ч/млн: 3,76 (2Н,синглет).
П р и м е р 3. (1-Метил-2-оксоазетидин-4,4-дикарбоксилат цис[транс-(l)-1,2-диаминоциклогексан]платины (II)
Следуя методике, описанной в примере 1, 0,09 г названного соединения получают из 0,399 г динитрата цис-[транс-(l)-1,2-диаминоциклогексан]платины (II) и 0,2 г 1-метил-2-оксоазетидина-4,4-дикарбоксилата натрия (приготовленного по методике, описанной в приготовлении 1).
ЯМР-спектр (270 МГц, D2О) δ ч/млн:
0,9-1,2 (4н. мультиплет);
1,4 (2Н, дублетоподобный);
1,85 (2Н, дублетоподобный);
2,2 (2Н, широкий синглетоподобный);
2,80 (3Н, синглет);
3,63 (2Н, синглет).
П р и м е р 4. (1,3-Диметил-2-оксоазетидин-4,4-дикарбоксилат)цис-[транс-(l)-1,2- диаминоциклогексан]платины (II)
Раствор, содержащий 0,2 г 1,3-диметил-2-оксоазетидин-4,4-дикарбоновой кислоты в 5 мл воды прибавляют к раствору, содержащему 0,3 г цис[транс-(l)-1,2-диаминоциклогексан] дигидроксиплатины (II) в 10 мл воды. Реакционную смесь затем перемешивают при комнатной температуре в течение 5 ч.
В конце этого времени воду удаляют из реакционной смеси путем упаривания при пониженном давлении и полученный остаток смешивают с ацетоном для индуцирования кристаллизации. Полученные кристаллы собирают фильтрованием и промывают ацетоном с выходом 0,31 г неочищенного названного соединения. Полученный сырой материал растворяют в воде и очищают колоночной хроматографией через колонку, содержащую сефадекс LH-20 (разбавленного водой) с выходом 0,17 г названного соединения.
ЯМР-спектр (270 МГц, D2О) δ ч/млн:
0,9-1,2 (4Н мультиплет);
1,38 (2Н, дублетоподобный);
1,54 и 1,59 (вместе 3Н, каждый дублет, J 7 Гц),
1,85 (2Н, дублетоподобный);
2,74 и 2,75 (вместе 3Н, каждый синглет);
3,61 и 3,64 (вместе 1Н, каждый квартет, J 7 Гц).
П р и м е р 5. 2-Оксопирролидин-5,5-дикарбоксилат цис[транс-(l)-1,2-диаминоциклогексан]платины (II)
440 мг 2-оксопирролидина-2,5-дикарбоксилата натрия (полученного по методике приготовления 2) прибавляют к раствору, содержащему 866 мг динитрата цис-[транс-(l)-1,2-диаминоциклогексан] платины (II) в 70 мл воды и затем реакционную смесь выдерживают при 26оС в течение 7 ч. В конце этого времени осажденные кристаллы собирают фильтрованием и промывают водой с выходом 219 мг названного соединения в виде бесцветных кристаллов. Фильтрат затем сгущают до объема 40 мл путем упаривания при пониженном давлении и выдерживают при 26оС. Полученные кристаллы затем обрабатывают аналогичным способом, который описан выше и получают еще 170 мг названного соединения.
ЯМР-спектр (270 МГц, D2О) δ ч/млн:
0,87-1,23 (4Н, мультиплет);
1,32-1,48 (2Н, мультиплет);
1,81-1,95 (2Н, мультиплет);
2,15-2,30 (2Н, мультиплет);
2,31-(2Н, триплет, J 7,9 Гц);
3,14-3,32 (2Н, мультиплет);
ИК-спектр (КВr) νmax, см-1: 1709, 1671, 1630.
П р и м е р 6. (3-Изопропил-2-оксоазетидин-4,4-дикарбоксилат)цис-[транс-(l)-1,2- диаминоциклогексан]платины (II)
Следует методике, которая описана в примере 1, 260 мг названного соединения получают из 707 мг динитрата цис-(транс-(l)-1,2-диаминоциклогексан)платины (II) и 400 мг 3-изопропил-2-оксоазетидин-4,4-дикарбоксилата.
ЯМР-спектр (270 МГц, D2О) δ ч/млн:
0,79 (3Н, дублет, J 6,6 Гц);
0,9-1,05 (2Н, мультиплет);
1,0-1,2 (2Н, мультиплет);
1,16 (3Н, дублет, J 7 Гц);
1,3-1,45 (2Н, мультиплет);
1,8-1,9 (2Н, мультиплет);
2,1-2,35 (2Н, мультиплет);
2,76 (3Н, синглет);
3,05-3,02 (1Н, мультиплет);
3,47 (1Н, дублет, J 3,3 Гц).
П р и м е р 7. 1-Метил-3-изопропил-2-оксоазетидин-4,4-дикарбоксилат цис-[транс-(l)-1,2-диаминоциклогексан]платины (II).
Следуя описанной в примере 1 методике, 660 мг указанного в заголовке соединения получают из 1,3 г динитрата цис-[транс-(l)-1,2-диаминоциклогексан] пла- тины (II) и 780 мг 1-метил-3-изопропил-2-оксоазетидин-4,4-дикарбоксилата натрия.
Спектр ЯМР (270 МГц, D2О) дельта рр (ч/млн): 0,81 (3Н, дублет, J 7 Гц), 0,9-1,2 (4Н, мультиплет), 1,18 (3Н, дублет, J 7 Гц), 1,35-1,45 (2Н, мультиплет), 1,8-1,95 (2Н, мультиплет), 2,05-2,3 (2Н, мультиплет), 2,76 (3Н, синглет), 3,05-3,2 (1Н, мультиплет), 3,51 (1Н, дублет, J 4 Гц).
П р и м е р 8. 1-Метоксиметил-2-оксоазетидин-4,4-дикарбоксилат цис[транс-(l)-1,2-диаминоциклогексан]платины (II)
Следуя описанной в примере 1 методике, 200 мг указанного в заголовке соединения получают из 500 мг динитрата циc[транс-](l)-1,2-диаминоциклогексан] пла- тины (II) и 280 мг 1-метоксиметил-2-оксоазетидин-4,4-дикарбоксилата натрия.
Спектр ЯМР (270 МГц, D2О) дельта ч/млн: 0,85-1,2 (4Н, мультиплет), 1,3-1,45 (2Н, мультиплет), 1,8-1,9 (2Н, мультиплет), 2,1-2,3 (2Н, мультиплет), 3,24 (3Н, синглет), 3,76 (2Н, синглет), 4,57 (2Н, синглет).
П р и м е р 9. 1(2-Метоксиэтокси)метил-2-оксоазетидин-4,4-дикарбоксилат цис-[транс-(l)-1,2-диаминоциклогексан]платины (II)
Следуя описанной в примере 1 методике, 135 мг указанного в заголовке соединения получают из 300 мг динитрата цис-[транс-(l)-1,2-диаминоциклогексан] пла- тины (II) и 200 мг 1-(2-метоксиэтокси)метил-2-оксоазетидин-4,4-дикарбоксилата натрия.
Спектр ЯМР (270 МГц, D2О) дельта ч/млн: 0,9-1,2 (4Н, мультиплет), 1,35-1,45 (2Н, мультиплет), 1,8-1,9 (2Н, мультиплет), 2,15-2,3 (2Н, мультиплет), 3,19 (3Н, синглет), 3,4-3,47 (2Н, мультиплет), 3,6-3,65 (2Н, мультиплет), 3,76 (2Н, синглет), 4,66 (2Н, синглет).
П р и м е р 10. 1-Метоксиметил-3-изопропил-2-оксоазетидин-4,4 дикарбоксилат цис-[транс-(l)-1,2-диаминоциклогексан]пла- тины (II)
Следуя описанной в примере 1 методике, 630 мг указанного в заготовке соединения получают из 750 мг динитрата цис-[транс-(l)-1,2-диаминоциклогексан] пла- тины (II) и 500 мг 1-метоксиметил-3-изопропил-2-оксоазетидин-4,4-дикарбоксилата натрия.
Спектр ЯМР (270 МГц, D2О) дельта ч/млн: 0,81 (3Н, дублет, J 5,5 Гц), 0,9-1,25 (4Н, мультиплет), 1,16 (3Н, дублет J 7 Гц), 1,3-1,45 (2Н, мультиплет), 1,8-1,9 (2Н, мультиплет), 2,1-2,35 (2Н, мультиплет), 3,23 (3Н, синглет), 3,1-3,3 (1Н, мультиплет), 3,58 (1Н, дублет, J 3,3 Гц, 4,45 (1Н, дублет, J 12 Гц). 4,62 (1Н, дублет, J 12 Гц).
П р и м е р 11. 2-Оксоазетидин-4,4-дикарбоксилат цис-[транс-/α/-1,2-диамино-циклогексан]платины (II)
Следуя описанной в примере 1 методике, 125 мг указанного в заголовке соединения получают из 500 мг динитрата цис-[транс-/α/-1,2-диаминоциклогексан] платины (II) и 234 мг 2-оксоазетидин-4,4-дикарбоксилата натрия.
Спектр ЯМР (270 МГц, D2О) дельта ч/млн: 0,9-1,1 (4Н, мультиплет), 1,3-1,45 (2Н, дублетподобный), 1,8-1,9 (2Н, дублетподобный), 2,1-2,3 (2Н, мультиплет), 3,74 (2Н, синглет).
П р и м е р 12. 1-Метил-3-изопропил-2-оксоазетидин-4,4-дикарбоксилат цис-диаминплатины (II)
Следуя описанной в примере 2 методике, 200 мг указанного в заголовке соединения получают из 400 мг динитрата цис-диаминплатины (II) и 300 мг 1-метил-3-изопропил-2-оксоазетидин-4,4-дикарбокси- лата натрия.
Спектр ЯМР (270 МГц) CD3/2SO/ дельта ч/млн: 0,88 (3Н, дублет, J 6,3 Гц), 1,22 (3Н, дублет, J 6,8 Гц), 2,81 (3Н, синглет) 2,7-2,9 (1Н, мультиплет), 3,40 (1Н, дублет, J 3 Гц), 4,2 (6Н, уширенный синглет).
П р и м е р 13. 1-Метоксиметил-2-оксоазетидин-4,4-дикарбоксилат цис-диаминплатины (II).
Следуя описанной в примере 2 методике, 105 мг указанного в заголовке соединения получают из 200 мг динитрата цис-диаминплатины (II) и 134 мг 1-метоксиметил-2-оксоазетидин-4,4-дикарбоксилата натрия.
Спектр ЯМР (270 МГц, D2О) дельта ч/млн: 3,31 (3Н, синглет), 6,67 (2Н, синглет), 4,24 (6Н, уширенный синглет), 4,60 (2Н, синглет).
П р и м е р 14. /3S, 4R/-3-/R/-1-т-бутилдиметилсилилоксиэтил/-2-оксоазетидин-4-ил/ацетат цис/транc-/l/-1,2-диаминоциклогексан/платины (II)
1,9 г динистрата цис-/транс-/l/-1,2-диаминоциклогексан/-платины (II) суспендируют в 100 мл воды и суспензию перемешивают при 28оС в течение ночи. К концу этого времени раствор /3S, 4R/-3-//R/-1-т-бутилдиметилсилилоксиэтил/-2- оксоазетидин-4-илуксусной кислоты, растворенный в 2 экв. водного раствора гидроокиси натрия, прибавляют и реакционную смесь и сразу же происходит осаждение кристаллов. Эти кристаллы собирают фильтрацией, промывают водой и сушат, получая 1,6 г указанного в заготовке соединения в виде порошка бледно-желтого цвета.
Спектр ЯМР (270 МГц, СD3 ОD) дельта ч/млн: 0,09 (3Н, синглет), 0,90 (9Н, синглет), 1,1-1,4 (2Н, мультиплет), 1,29 (3Н, дублет, J 6,5 Гц), 1,5-1,8 (2Н, мультиплет), 1,9-2,2 (2Н, мультиплет), 2,2-2,4 (2Н, мультиплет), 2,45 (1Н, дублет, дублетов J 14 и 10 Гц), 2,57 (1Н, дублет дублетов, J 14 и 5,5 Гц), 2,86 (1Н, дублет дублетов), 4,09 (1Н, мультиплет), 4,29 (1Н, мультиплет).
П р и м е р 15. //3S, 4R/-3-//R/-1-т-бутилдиметилсилилоксиэтил/-2-оксоазетидин -4-ил/ацетат цис/-транс/-d/-1,2-диаминоциклогексан/платины (II)
Следуя описанной в примере 14 методике, 1,56 г указанного в заголовке соединения получают из 1,9 г динитрата цис-/транс-/d/-1,2-диаминоциклогексан/платины (II).
Спектр ЯМР (270 Мгц, СD3OD) дельта ч/млн: 0,09 (3Н, синглет), 0,10 (3Н, синглет), 0,90 (9Н, синглет), 1,1-1,4 (2Н, мультиплет), 1,23 (3Н, дублет J 6,3 Гц), 1,5-1,8 (2Н, мультиплет), 1,9-2,2 (2Н, мультиплет), 2,2-2,4 (2Н, мультиплет), 2,4-2,7 (2Н, мультиплет), 2,84 (1Н, дублет дублетов), 4,01 (1Н, мультиплет), 4,21 (1Н, мультиплет).
П р и м е р 16. //3S, 4R/-3/R/-1-Гидроксиэтил/-2-оксоазетидин-4-ил/ацетат цис-транс-/l/-1,2-диаминоциклогексан/плати-ны (II)
866 мг динитрата цис-/транс-/l/-1,2-диаминоциклогексан/-платины (II) суспендируют в 30 мл воды, после чего в суспензию прибавляют 350 мг /3S, 4R/-3-//R/-1-гидроксиэтил/-2-оксоазетидин-4-илуксусной кислоты и 2 экв. 1 н. раствора (водного) гидроокиси натрия. Смесь перемешивают при комнатной температуре в течение 18 дней. К концу этого времени реакционную смесь концентрируют упариванием при пониженном давлении и остаток очищают колоночной хроматографией через колонку, содержащую смолу СНР-20Р, элюируют водой, получая при этом 100 мг указанного в заголовке соединения в виде порошка без цвета.
Спектр ЯМР (270 МГц, D2O) дельта ч/млн: 0,8-1,3 (4Н, мультиплет), 1,12 (3Н, дублет, J 6,2 Гц), 1,3-1,5 (2Н, мультиплет), 1,8-2,0 (2Н, мультиплет), 2,1-2,5 (5Н, мультиплет), 3,48 (1Н, мультиплет), 4,5 (1Н, мультиплет).
П р и м е р 17. //3S, 4R/-//R/-1-метоксиметокси/этил/-2-оксоазетидин-4-ил/аце- тат цис-/транс-/l/-1,2-диаминоциклогексан/платины (II).
Следуя описанной в примере 16 методике, 64 мг указанного в заголовке соединения получают из 199 мг динитрата цис-/транс-/l/-1,2-диаминоциклогексан/платины (II) и 100 мг /3S, 4R/-3-//R/-1-/метоксиметокси/этил/-2-оксоазетидин-4-илуксусной кислоты.
Спектр ЯМР (270 МГц, D2O) дельта ч/млн: 0,9-1,1 (4Н, мультиплет), 1,07 (3Н, дублет, J 6 Гц), 1,3-1,5 (2Н, мультиплет), 1,8-1,9 (2Н, мультиплет), 2,1-2,2 (2Н, мультиплет), 2,35 (1Н, дублет, дублетов, J 15 и 8 Гц), 2,41 (1H, дублет дублетов, J 15 и 6 Гц), 2,91 (1Н, дублет дублетов, J 5,2 Гц), 3,19 (3Н, синглет), 3,76 (1Н, двойной дублет дублетов J 8,6 и 2 Гц), 3,95 (1Н, квартет, дублет, J 6 и 5 Гц).
П р и м е р 18./3S, 4R/-3-[/R/-1-/2-Метоксиэтоксиметокси/этил]-2-оксоазетидин-4-ил}-ацетат цис-[транс-/l/-1,2-диаминоциклогексан]-платины (II)
Следуя описанной в примере 16 методике, 83 мг указанного в заголовке соединения получают из 166 мг динитрата цис-[транс-/l/-1,2-диаминоциклогексан] платины (II) и 100 мг /3S, 4R/-3-[/R/-1-/2-метоксиэтоксиметокси/этил/-2-оксоазетидин-4-илуксусн- ой кислоты.
Спектр ЯМР (270 МГц, D2O) дельта ч/млн: 0,8-1,2 (4Н, мультиплет), 1,07 (3Н, дублет, J 6,6 Гц). 1,3-1,5 (2Н, мультиплет), 1,7-1,9 (2Н, мультиплет), 2,1-2,2 (2Н, мультиплет), 2,35 (1Н, дублет дублетов, J 15 и 8 Гц), 2,40 (1Н, дублет дублетов, J 15 и 6 Гц), 2,91 (1Н, дублет дублетов, J 4,4 и 1,8 Гц), 3,19 (3Н, синглет), 3,45 (2Н, мультиплет), 3,54 (2Н, мультиплет), 3,75 (1Н, дублет триплетов, J 2,2 и 5,8 Гц), 3,98 (1Н, дублет квартетов).
П р и м е р 19./3S, 4R/-3-[/R/-1-диэтилфосфоноксиэтил]-2-оксоазетидин-4-ил}аце- тат цис-/транс-/l/1,2-диаминоциклогексан/платины (II)
Следуя описанной в примере 16 методике, 27 мг указанного в заголовке соединения получают из 188 мг динитрата цис-[транс/ /-1,2-диаминоциклогексан] платины (II) и 150 мг /3S, 4R/-3-[/R/-1-диэтилфосфоноксиэтил]-2-оксоазетидин-4-илуксусной кислоты.
Спектр ЯМР (270 МГц, D2O) дельта ч/млн: 0,9-1,2 (4Н, мультиплет), 1,10 (4Н, триплет дублетов, J 7,20 Гц), 1,24 (3Н, дублет, J ) 7 Гц), 1,3-1,5 (2Н, мультиплет), 1,8-1,9 (2Н, мультиплет), 2,1-2,2 (2Н, мультиплет), 2,37 (1Н, дублет дублетов, J 7 и 14 Гц), 2,42 (1Н, дублет дублетов, J=6 и 14 Гц), 3,02 (1Н, дублет, дублетов, J 2 и 6 Гц), 3,73 (1Н, квинтет, J 7 Гц), 3,86 (1Н, дублет триплетов, 2 и 6 Гц), 3,9-4,1 (4Н, мультиплет).
П р и м е р 20./3S, 4R/-3-[/R/-1-дифенилфосфоноксиэтил]-2-оксоазетидин-4-ил} ацетат цис-[транс-/l/-1,2-диаминоциклогексан] платины (II)
Следуя описанной в примере 16 методике, 101 мг указанного в заголовке соединения получают из 107 мг динитрата цис-[транс-/l/-1,2-диаминоциклогексан] пл- атины (II) и 100 мг [3S, 4R/-3-[/R/-1-дифенилфосфофоноксиэтил]-2-оксоазетидин-4-илуксусной кислоты.
Спектр ЯМР (270 МГц, D2O) дельта ч/млн: 0,8-1,2 (4Н, мультиплет), 1,27 (3Н, дублет, J 6 Гц), 1,3-1,5 (2Н, мультиплет), 1,7-2,0 (2Н, мультиплет), 2,0-2,3 (2Н, мультиплет), 2,27 (2Н, мультиплет), 3,00 (1Н, дублет дублетов, J 3 и 7 Гц), 3,73 (1Н, дублет триплетов, J 2 и 8 Гц), 4,93 (1Н, мультиплет), 7,0-7,4 (10Н, мультиплет).
П р и м е р 21./3S, 4S/-3-[/R/-1-т-бутилдиметилсилилоксиэтил]-2-оксоазетидин -4-ил}карбоксилат цис-[транс-/l/-1,2-диаминоциклогексан]-платины II
Следуя описанной в примере 14 методике, 0,16 г указанного в заголовке соединения получают из 0,19 г динитрата цис-[транс-/l/-1,2-диаминоциклогексан] пл- атины (II) и 0,13 г /3S, 4S/-3-[/R/-1-т-бутилдиметилсилилоксиэтил]-2-оксоазетидин-4-карбоновой кислоты.
Спектр ЯМР (270 МГц, CD3OD) дельта ч/млн: 0,05 (3Н, синглет), 0,09 (3Н, синглет), 0,90 (9Н, синглет), 1,1-1,4 (4Н, мультиплет), 1,29 (3Н, дублет, J 7 Гц), 1,5-1,8 (2Н, мультиплет), 1,95-2,15 (2Н, мультиплет), 2,2-2,4 (2Н, мультиплет), 3,13 (1Н, триплет, J 2 Гц), 4,10 (1Н, дублет, J 2 Гц), 4,30 (1Н, дублет квартетов, J 7,2 Гц).
П р и м е р 22./3,S, 4S/-3-[/R/-1-октаноилоксиэтил]-2-оксоазетидин-4-ил} -карбо- ксилат цис-[транс-/l/-1,2-диаминоциклогексан] платины (II)
228 мг динитрата цис-[транс-/l/-1,2-диаминоциклогексан] -платины (II) суспендируют в 10 мл воды и суспензию перемешивают при температуре 26оС в течение 3 ч с образованием гомогенного раствора. К концу данного интервала времени к раствору прибавляют 1,05 мл на 1 н. раствора (водного) гидроокиси натрия и 150 мг (3S, 4S/-3-[/R/-1-октаноилоксиэтил] -2-оксоазеатидин-4- карбоновой кислоты, и полученную смесь затем перемешивают при комнатной температуре в течение 1,5 ч.
Осажденные кристаллы собирают фильтрацией и промывают водой, ацетоном и простым диэтиловым эфиром, получая 84 мг указанного в заголовке соединения. Образуются дополнительные кристаллы, осадившиеся из смеси фильтрата и водных промывок после того, как смеси дали отстояться в течение 2 дней при комнатной температуре. Полученные кристаллы собирают фильтрацией и промывают водой, ацетоном и простым диэтиловым эфиром, что позволяет получить еще 12 мг указанного в заголовке соединения.
Спектр ЯМР (270 МГц, D2O) дельта ч/млн: 0,65 (3Н, триплет, J ) 6 Гц), 0,8-1,15 (12Н, мультиплет), 1,17 (3Н, дублет, J 6 Гц), 1,3-1,5 (4Н,мультиплет), 1,7-1,85 (2Н, дублетподобный), 1,95-2,1 (2Н, мультиплет), 2,1-2,3 (2Н, мультиплет), 3,20 (1H, триплет, J 3 Гц). 3,95 (1Н, дублет, J 3 Гц), 5,05-5,2 (1Г, мультиплет).
П р и м е р 23./3S, 4S/-3-[/1-R-/-Гидроксиэтил]-2-оксоазетидин-4-ил} карбокси-лат цис-[транс-/l/-1,2-диаминоциклогексан] платины (II)
Следуя описанной в примере 16 методике, 186 мг указанного в заголовке соединения получают из 594 мг динитрата цис-[транс-/l/-1,2-диаминоциклогексан] платины (II) и 218 мг /3S, 4S /-3-[/R/-1-гидроксиэтил]-2-оксоазетидин-4-карбоновой кислоты (полученной, как описано в получении 3).
Спектр ЯМР (270 Мгц, D2O) дельта ч/млн: 0,9-1,2 (4Н, мультиплет), 1,10 (3Н, дублет, J 7 Гц), 1,3-1,5 (2Н, мультиплет), 1,7-2,0 (2Н, мультиплет), 2,1-2,3 (2Н, мультиплет), 3,02 (1Н, дублет дублетов, J 3 и 4 Гц), 3,85 (1Н, дублет, J 3 Гц), 4,04 (1Н, дублет квартетов, J 4 и 7 Гц).
П р и м е р 24. /4S/-2-оксоазетидин-4-карбоксилат цис-[транс-/l/-1,2-диаминоциклогексан]платины (II)
735 мг динитрата цис-[транс-/l/-1,2-диаминоциклогексан] -платины (II) суспендируют в 50 мл воды и к суспензии прибавляют 230 мг /4S/-2-оксоазетидин-4-карбоновой кислоты и 1,8 мл 1 н. водного раствора гидроокиси натрия, после чего суспензию перемешивают при 28оС в течение 4 дней.
К концу этого времени реакционную смесь концентрируют упариванием при пониженном давлении, а затем к остатку прибавляют ацетон с тем, чтобы осадить кристаллы. Эти кристаллы собирают фильтрацией, промывают водой и ацетоном и сушат при пониженном давлении, в результате чего получают 195 мг указанного в заголовке соединения.
Спектр ЯМР (270 МГц, D2O) дельта ч/млн: 0,9-1,2 (4Н, мультиплет), 1,3-1,5 (2Н, мультиплет), 1,8-2,0 (2Н, мультиплет), 2,1-2,3 (2Н, мультиплет), 2,43 (1Н, дублет дублетов, J 4,0 и 17,2 Гц), 2,52 (1Н, дублет дублетов J 6,6 и 17,2 Гц), 3,58 (1Н, дублет дублетов, J 4,4 и 6,6 Гц).
П р и м е р 25./3S, 4R/-3-[/R/-1-октаноилоксиэтил]-2-оксоазетидин-4-ил} -ацетат цис-[транс-/l/-1,2-диаминоциклогексан]пл- атины (II)
Следуя описанной в примере 16 методике, 100 мг указанного в заголовке соединения получают из 579 мг динитрата цис-[транс-/l/-1,2-диаминоциклогексан] пл- атины (II) и 400 мг [/3S, 4R/-3-/R/-1-октаноилоксиэтил/-2-оксоазетидин-4-ил]-уксус- ной кислоты.
Спектр ЯМР (270 МГц, D2O) дельта ч/млн: 0,68 (3Н, триплет, J 7 Гц), 0,8-1,2 (10Н, мультиплет), 1,14 (3Н, дублет, J 6 Гц), 1,25-1,5 (4Н, мультиплет), 1,7-2,0 (2Н, мультиплет), 2,1-2,3 (2Н, мультиплет), 2,40 (2Н, дублет, J 7,5 Гц), 3,03 (1Н, дублет дублетов, J 4 и 2 Гц), 3,86 (1Н, дублет дублетов, J 2 и 7,5 Гц), 5,08 (1Н, дублет квартетов, J 4 Гц).
П р и м е р 26. /3S, 4S /-3-[/R/-1/Гексаноилоксиэтил]-2-оксоазетидин-4-карбокси- лат цис-[транс-/l/-1,2-диаминоциклогексан]платины (II)
Следуя описанной в примере 22 методике, 100 мг указанного в заголовке соединения получают из 274 мг цис-[транс-/l/-1,2-диаминоциклогексан]платины (II) и 218 мг (3S, 4S)-3-[/R/-1-гексаноилоксиэтил]-2-оксоазетидин-4-карбоновой кислоты.
Спектр ЯМР (270 МГц, D2О) дельта ч/млн: 0,68 (3Н, триплет, J 7 Гц), 0,8-1,25 (8Н, мультиплет), 1,18 (3Н, дублет, J 6,4 Гц), 1,3-1,5 (4Н, мультиплет), 1,75-1,95 (2Н, мультиплет), 1,95-2,05 (2Н, мультиплет), 2,1-2,35 (2Н, мультиплет), 3,21 (1Н, дублет дублетов, J 3,7 и 2,5 Гц), 3,97 (1Н, дублет, J2,5 Гц), 5,13 (1Н, дублет квартетов, J 3,7 и 6,4 Гц).
П р и м е р 27. /3S, 4S /-3-[/R/-1-бутаноилоксиэтил]-2-оксоазетидин-4-карбоксилат /цис[-транс-/l/-1,2-диаминоциклогексан] платины (II)
Следуя описанной в примере 22 методике, 100 мг указанного в заголовке соединения получают из 210 мг цис-[транс-/l/-1,2-диаминоциклогексан]платины (II) и 150 мг /3S, 4S/-3-[/R/-1-бутаноилоксиэтил]-2-оксоазетидин-4-карбоновой кислоты.
Спектр ЯМР (270 МГц, D2О) дельта ч/млн: 0,71 (3Н, триплет, J 7,5 Гц), 0,85-1,15 (4Н, мультиплет), 1,18 (3Н, дублет, J 6,6 Гц). 1,25-1,4 (2Н, мультиплет), 1,3 1,5 (2H, мультиплет), 1,75 1,85 (2H, мультиплет), 1,95-2,05 (2Н, мультиплет), 2,1-2,3 (2Н, мультиплет), 3,21 (1Н, дублет дублетов, J3,6 и 2,3 Гц), 3,96 (1Н, дублет, J 2,3 Гц), 5,14 (1Н, дублет квартетов, J 3,6 и 6,6 Гц).
П р и м е р 28. /3S, 4S/-3-[/R/-1-октаноилоксиэтил]-2-оксоазетидин-4-карбоксилат цис-/цис-1,2-диаминоциклогексан/плати-ны (II).
Следуя описанной в примере 22 методике, 40 мг указанного в заголовке соединения получают из 300 мг динитрата цис /цис-1,2-диаминоциклогексан/платины (II) и 197 мг /3S, 4S /-[/R-/1-октаноилоксиэтил]-2-оксоазетидин-4-карбоновой кислоты.
Спектр ЯМР (270 МГц, D2O) дельта ч/млн: 0,90 (3Н, триплет, J 7 Гц), 1,25-1,45 (10Н, мультиплет),1,39 (3Н, дублет, J 6,6 Гц), 1,55-1,75 (4Н, мультиплет), 1,75-1,9 (4Н, мультиплет), 2,25-2,4 (2Н, мультиплет), 2,6-2,7 (2Н, мультиплет), 3,42 (1Н, дублет дублетов, J 4,7 и 2,5 Гц), 3,99 (1Н, дублет, J 2,5 Гц), 5,31 (1Н, дублет квартетов, J 4,7 и 6,6 Гц).
Получение 1. 2-Оксоазетидин-4,4-дикарбоксилат натрия.
1(а). Раствор 6,11 мл хлорангидрида бромуксусной кислоты в 60 мл тетрагидрофурана прибавляют к раствору 24 г диэтил N-(2,4-диметоксибензил)аминомалоната в 120 мл тетрагидрофурана при охлаждении на льду, и к полученной смеси прибавляют затем по каплям 10,3 мл триэтиламина. Смесь перемешивают в течение 2 ч при охлаждении на льду, после чего отфильтровывают осадившиеся кристаллы и фильтрат концентрируют упариванием при пониженном давлении, Остаток экстрагируют этилацетатом и экстракт промывают разбавленным раствором хлористоводородной кислоты, водным раствором бикарбоната натрия и водой. Затем его освобождают от этилацетата упариванием при пониженном давлении с получением 31,5 г маслянистого продукта. Все это масло растворяют в 200 мл бензола, и полученный раствор смешивают с 11,2 мл триэтиламина. Смесь перемешивают в течение ночи при комнатной температуре, после чего ее разбавляют этилацетатом. Затем смесь промывают разбавленным раствором (водным) хлористоводородной кислоты, водным раствором бикарбоната натрия и водой, после чего органический слой сушат в присутствии безводного сульфата магния. Затем растворитель удаляют перегонкой при пониженном давлении. Остаток очищают колоночной хроматографией через 400 мг силикагеля, элюируя 1: 5 об. смесью этилацетата и бензола, с получением 21 г диэтил 1-(2,4-диметоксибензил)-2-оксоазатидин- 4,4-дикарбоксилата.
Спектр ЯМР (60 МГц, CDCl3) дельта ч/млн: 1,16 (6Н, триплет, J 7 Гц), 3,32 (2Н, синглет), 3,78 (6Н, синглет), 4,02 (4Н, квартет, J 7 Гц), 4,57 (2Н, синглет), 6,4 (2Н, мультиплет), 7,1 (1Н, мультиплет).
1(б). 17,4 г диэтил 1-(2,4-диметоксибензил)-2-оксоазетидин-4,4-дикарбоксилата, полученного, как описано выше, растворяют в смеси 350 мл ацетонитрила и 350 мл воды. Затем к полученному раствору прибавляют 11,2 г персульфата калия и 37,4 г двухосновного фосфата калия и смесь перемешивают при температуре 65оС в течение 1 ч. К концу этого времени нерастворимое вещество отфильтровывают и фильтрат освобождают от растворителя упариванием при пониженном давлении. Остаток экстрагируют этилацетатом. Экстракт промывают насыщенным водным раствором хлористого натрия, водным раствором бикарбоната натрия и насыщенным водным раствором хлористого натрия.
Растворитель затем удаляют перегонкой при пониженном давлении и остаток очищают колоночной хроматографией через силикагель, элюируя смесью 1:2 об. этилацетата и бензола, с получением 5,72 г диэтил-2-оксоазетидин-4,4-дикарбоксилата.
Спектр ЯМР (60 МГц, CDCl3) дельта ч/млн: 1,28 (6Н, триплет, J 7 Гц), 3,38 (2Н, дублетподобный, J 2 Гц), 4,26 (4Н, квартет, J 7 Гц), 7,2 (1Н, уширенный синглет).
1(в). 5,72 г диэтил 2-оксоазетидин-4,4-дикарбоксилата (полученного, как описано выше) растворяют в 25 мл метанола. К полученному раствору прибавляют 53,2 мл на 1 н.водного раствора гидроокиси натрия и смесь перемешивают в течение одного дня при комнатной температуре. К концу этого времени реакционную смесь концентрируют упариванием при пониженном давлении с получением кристаллов, которые промывают метанолом и простым диэтиловым эфиром с получением 5,3 г указанного в заголовке соединения в виде кристаллов.
Получение 2. 2-Оксопирролидин-5,5-дикарбоксилат натрия.
2(а). 2,8 мл триэтиламина прибавляют к суспензии 2,11 г хлоргидрата диэтил 2-аминомалоната в 50 мл метиленхлорида. Затем к смеси прибавляют 1,71 г 3-бромпропионилхлорида при ледяном охлаждении, после чего смесь перемешивают в течение 30 мин. К концу этого времени реакционную смесь выливают в воду и экстрагируют простым диэтиловым эфиром. Экстракт промывают 5% (в отношении массы к объему) водным раствором бикарбоната натрия и водой, после чего его сушат в присутствии безводного сульфата магния. Растворитель затем удаляют перегонкой при пониженном давлении с получением 2,5 г диэтил 2-/3-бромопропионамидо/малоната.
Спектр ЯМР (60 МГц, CDCl3) дельта ч/млн: 1,28 (6Н, триплет, J7,0 Гц), 2,87 (триплет, J 6,6 Гц), 3,61 (2Н, триплет, J 6,5 Гц), 4,25 (4Н, квартет, J 7,0 Гц), 5,14 (1Н, дублет, J 7,0 Гц), 6,65 (1Н, уширенный синглет).
2(б). 314 мкл 1,8-диаза[5,4,0]-7-ундецена прибавляют к раствору 620 мг диэтил 2-(3-бромопропионамидо)малоната, полученного, как описано выше), растворенного в метиленхлориде, и смесь перемешивают при комнатной температуре в течение 3 ч. К концу этого времени реакционную смесь концентрируют упариванием при пониженном давлении, вливают в воду и затем экстрагируют простым диэтиловым эфиром. Экстракт промывают 5%-ным (в отношении массы к объему) водным раствором хлористоводородной кислоты, 5%-ным (в отношении массы к объему) водным раствором бикарбоната натрия и водой, после чего сушат в присутствии безводного сульфата магния. Затем растворитель удаляют перегонкой при пониженном давлении с получением сырого продукта. Этот продукт очищают колоночной хроматографией через силикагель, элюируя 2:1 об. смесью циклогексана и этилацетата, с получением 171 мг диэтил 2-оксопирролидин-5,5-дикарбоксилата.
Спектр ЯМР (60 МГц, CDCl3) дельта ч/млн: 1,28 (6Н, триплет, J 7,0 Гц), 2,2-2,8 (4Н, мультиплет), 4,25 (4Н, квартет, J 7,0 Гц), 7,5 (1Н, уширенный синглет).
2(в). 8,74 мл 1 г водного раствора гидроокиси натрия прибавляют к раствору 1,0 г диэтил 2-оксопирролидин-5,5-дикарбоксилата, полученного как описано выше, в 10 мл этанола, и смесь перемешивают при комнатной температуре в течение 3 дней. К концу этого времени растворитель удаляют перегонкой при пониженном давлении и оставшиеся кристаллы промывают ацетоном и сушат с получением 950 мг 2-оксопирролидин-5,5-дикарбоксилата натрия в виде бесцветного порошка.
Спектр ЯМР (60 МГц, D2O) дельта ррm: 2,35 (уширенный синглет).
Инфракрасный спектр поглощения (KBr) νmax cм-1: 3180, 1700, 1630.
Получение 3. 3-[/R/-1-Гидроксиэтил]-2-оксоазетидин-4-карбоновая кислота.
3(а). 14 г бензил 1-/2,4-диметоксибензил/-3-[/R/-1-гидроксиэтил]-2-оксоазетид-ин-4-карбоксилат а [который был синтезирован в соответствии с методикой, аналогичной той, которая описана в Tetrahedron 46, 1975, (1984)] растворяют в смеси 420 мл ацетонитрила и 420 мл воды. К раствору прибавляют 66,1 г персульфата калия и 23,3 г двухосновного фосфата калия, и смесь перемешивают при 70оС в течение 60 мин. К концу этого времени нерастворимые вещества отфильтровывают и фильтрат концентрируют упариванием при пониженном давлении. Остаток экстрагируют этилацетатом. Экстракт промывают насыщенным водным раствором хлористого натрия, сушат в присутствии безводного сульфата магния и освобождают от растворителя упариванием при пониженном давлении. Остаток очищают колоночной хроматографией через силикагель с получением 6,1 г бензил 3[/R/-1-гидроксиэтил]-2-оксоазетидин-4- карбоксилата.
Спектр ЯМР (60 МГц, CDCl3) дельта ч/млн: 1,26 (3Н, дублет, J 6,0 Гц), 3,19-3,45 (2Н, мультиплет), 3,93-4,49 (1Н, мультиплет), 4,30 (1Н, дублет, J 3,0 Гц), 5,17 (2Н, синглет), 6,88 (1Н, синглет), 7,33 (5Н, синглет).
3(б). 500 мг бензил 3-[/R/-1-гидроксиэтил]-2-оксоазетидин-4-карбоксилата, полученного, как описано выше, растворяют в 5 мл метанола и смесь гидрируют в присутствии 100 мг 10%-ного (масс.) палладиево-угольного катализатора при комнатной температуре в течение 2 ч. К концу этого времени катализатор удаляют фильтрацией. Фильтрат концентрируют упариванием при пониженном давлении с получением 310 мг указанного в заголовке соединения в виде бесцветного масла.
Спектр ЯМР (60 МГц, CD3CD) дельта ч/млн: 1,27 (3Н, дублет, J 6,0 Гц), 3,2-3,4 (1Н, мультиплет), 4,23 (1Н, дублет, J 3,0 Гц), 4,0-4,35 (1Н, мультиплет), 8,07 (1Н, уширенный синглет).
Биологическая активность.
Активность соединений по изобретению изучалась при проведении ряда экспериментов.
В следующем эксперименте используемыми для исследования животными являются самки мышей в возрасте от 8 до 9 недель линии CDF1, каждая массой 20-25 г. Стандартные клетки лейкемии L1210 предоставлены в распоряжении Доктором Т.Ямамото из Института Медицины, Университет города Токио, Япония.
Мышей CDF1 инокулируют внутpибрю- шинно клетками L1210 (105клеток/мышь). Испытуемое соединение идентифицировано в табл. 1. В случае использования соединений по изобретению и карбоплатины испытуемое соединение растворяют в 5% -ном (об.) водном манните, тогда как цисплатину растворяют в 5%-ном (об.) растворе маннита в физиологическом солевом растворе. Каждое лекарство инъецируют внутрибрюшинно на 1 и 4 день вслед за имплантацией опухоли. Число мышей в каждой тестируемой группе составляет 6.
Увеличение продолжительности жизни (УПЖ) рассчитывают следующим образом:
УПЖ [/St/Sи/ 1] х 100, где St средневзвешенное число дней выживания обработанных мышей;
Sи средневзвешенное число дней выживания необработанных мышей.
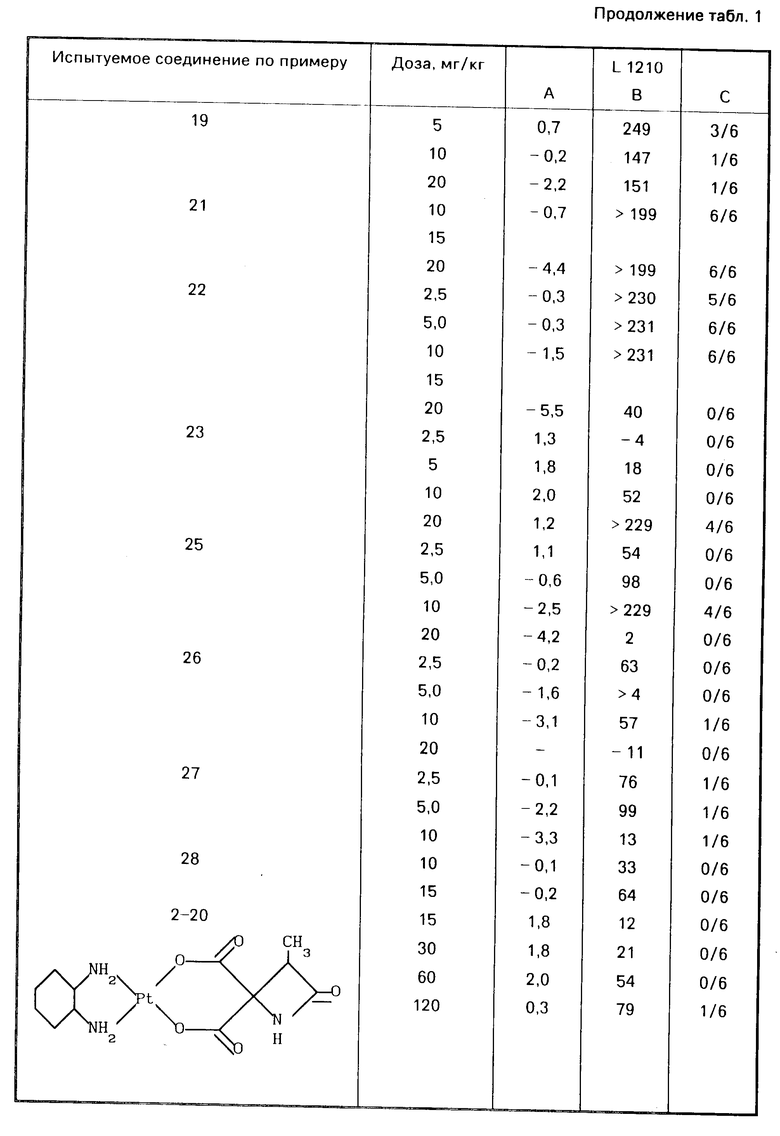
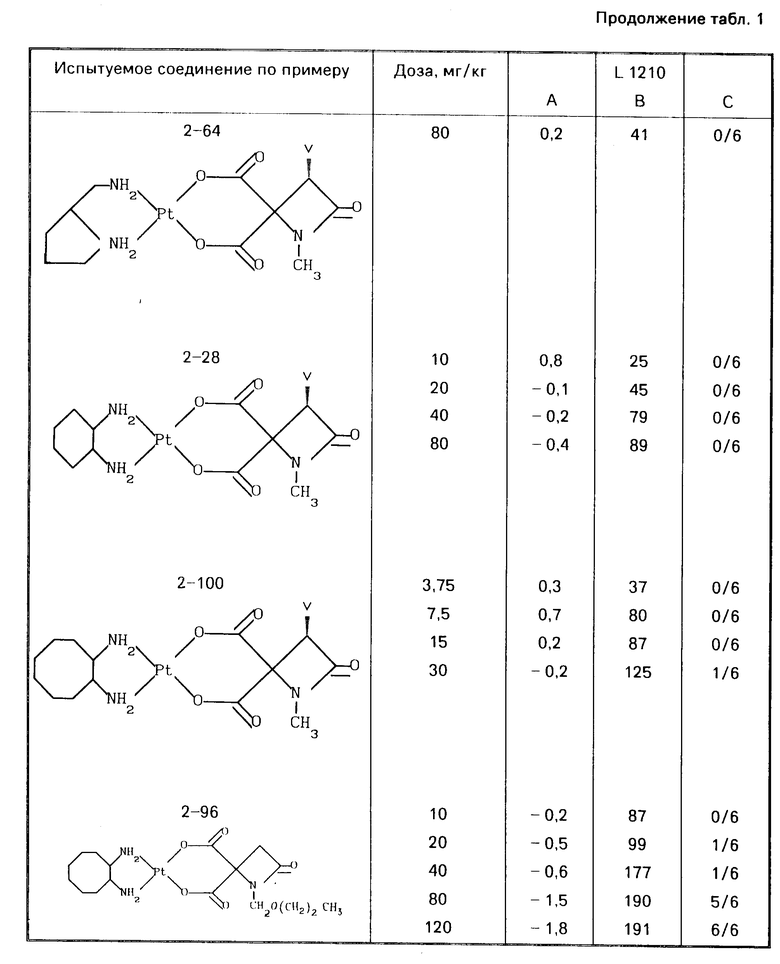
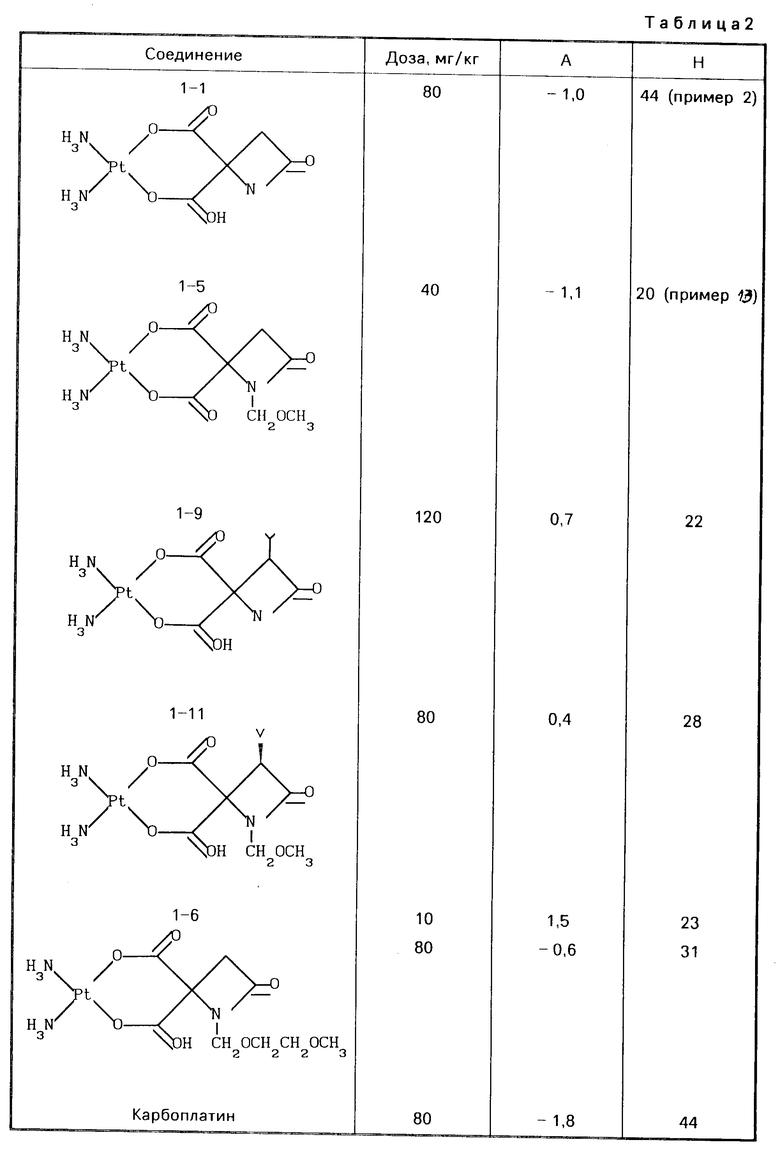
Результаты испытания представлены в табл.1. (А: Изменение массы тела на 1-7 сут. В: УПЖ (%) число выживших на 30-ые сутки).
Испытание на противоопухолевую активность в случае меланотической меланомы В 16 приведено в табл.2.
Методика описания: Описанная в Сапсен С е о егару Рерог часть 3, том 3, N 2, 11 (сентябрь 1972).
Испытываемые соединения и результаты испытаний:
5 х 105/мышь, подкожно день 1, 5, 9 вв.
А: Изменение массы тела с 1 дня по 12 день
Н: Ингибирование на 21 день (%).
Данные по острой токсичности на самцах крыс F 344 (внутривенно) приведены в табл.3.
Остальные данные приведены в табл. 4 8.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОТИВООПУХОЛЕВОГО КОМПЛЕКСА ПЛАТИНЫ | 1988 |
|
RU2007413C1 |
| ПРОИЗВОДНЫЕ АЗЕТИДИНОНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2047602C1 |
| ФУНГИЦИДНЫЕ ПРОИЗВОДНЫЕ ОКСЕТАНА И ИХ СОЛИ | 1992 |
|
RU2044736C1 |
| α,ω ДИАРИЛАЛКАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2105752C1 |
| АЗАСТЕРОИДНЫЕ СОЕДИНЕНИЯ | 1991 |
|
RU2070204C1 |
| ПРОИЗВОДНЫЕ БЕНЗОПИРАНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2038354C1 |
| ПРОИЗВОДНЫЕ КАРБАПЕНЕМА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2097383C1 |
| КРЕМНИЙСОДЕРЖАЩИЕ СОЕДИНЕНИЯ ИЛИ ИХ СОЛИ, ОБЛАДАЮЩИЕ ФУНГИЦИДНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2069213C1 |
| Способ получения производных мочевины, содержащих платину | 1986 |
|
SU1565347A3 |
| СПОСОБ ПОЛУЧЕНИЯ ИЗОКСАЗОЛОВЫХ ПРОИЗВОДНЫХ | 1991 |
|
RU2017737C1 |
























Использование: в качестве противоопухолевых препаратов в медицине. Сущность изобретения: продукт соединение ф-лы I, где А и В отдельно обозначают моноамины или вместе обозначают диамины и Z представляют собой ф-лы II или III, где R1, R2 и R представляют собой различные органические группы, n равно 0, 1 или 2 и X обозначают прямую углерод-углеродную связь или низший алкил. Реагент 1: амин-платиновый комплекс. Реагент 2: соединение, дающее группу Z. Соединения формулы I, II, III: 
 4 ил. 8 табл.
4 ил. 8 табл.
ЧЕТЫРЕХКООРДИНАЦИОННЫЕ КОМПЛЕКСЫ ДВУХВАЛЕНТНОЙ ПЛАТИНЫ общей формулы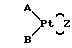
где A и B каждый амин, или A и B вместе соединение формулы NH2 J NH2, где J алициклическая группа, содержащая 5 8 кольцевых атомов, или A и B вместе группа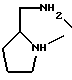
Z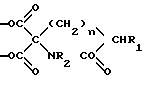
где n 0 или 1;
R1, R2 водород, C1 C4-алкил или замещенный C1 C4-алкилгруппой, состоящей из C1 C4-алкокси-или C2-C5-алкоксиалкоксигруппы,
или Z означает
где X-связь или CH2-группа;
R'' C1 C4 алкил, замещенный группами ОН, или C3 - C1- алкоксиалкоксиалкоксигруппой, или силилоксигруппой, или триалкил-C1 C4 группой, или группой общей формулы OPO (OR3)2,
где R3 C1 C4 алкил.
Приоритет по признакам:
08.05.87 при
13.05.87 при
| Заявка США N 902420, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-07-09—Публикация
1992-05-19—Подача