Изобретение относится к органическому синтезу и касается способа получения замещенных фталидов и гетероциклических фталидов общей формулы (I) где кольцо А выбрано из группы, включающей остатки:
(I) где кольцо А выбрано из группы, включающей остатки:
а) фенил,
б) пиридил,
в) пятичленное гетероароматическое кольцо, содержащее кислород, серу или азот в качестве гетероатома;
R циано, формил, кетонобразующая группа, карбоксильная группа, которая может быть в виде свободной кислоты, эфира или соли, карбамоильная группа или моно- или дизамещенная карбамоильная группа или кольцо С Z
Z
Y1, Y2 и Y3 присоединены к атомам углерода и являются независимо водородом, галогеном, гидроксилом, С1-8-алкилом, С2-8-алкенилом, С2-8-алкинилом, С1-8-алкокси, С2-8-алкенилокси, С2-8-алкинилокси, С1-8-алкилсульфонилокси, каждый из которых может быть замещен 1-6 атомами галогена, а также конъюгированный С1-8-алкоксил, С2-8-ацил, фенил С1-8-алкоксил, фенилтио, каждый из которых может быть замещен одним или тремя атомами галогена;
Y1 и Y2 вместе взятые со смежными атомами углерода образуют группу -С(О)-О-СН2;
каждый из W1, W2, W3, W4 и W5 независимо является СН, CR3 или N;
Z мостик, состоящий из элементов, выбранных из группы: метилен, замещенный метилен, -С(О)-;
R1 и R2 каждый независимо водород, галоген, С1-8-алкил, С1-8-алкокси, С2-8-алкенилокси, С2-8-алкинилокси, каждый из которых может быть замещен 1-6 атомами галогена, 5- или 6-членный гетероцикло-С1-8-алкокси, фенилокси или фенил-С1-8-алкокси, каждый из которых может быть замещен 1-3 заместителями, выбранными из галогена или С1-8-алкила; R2 С1-8-алкил, фенил-С1-8-алкокси или фенил;
Х и Y каждый независимо водород, гидроксил, галоген, циано, С1-8-алкил, С1-8-алкокси, С1-8-алкоксикарбонилокси, С2-8-ацилокси, карбамоилокси, С1-8-алкилтио, фенилокси, фенил S, каждый из которых может быть замещен 1-3 атомами галогена, или они вместе представляют0,S,NH,NOR12 илиCR13R14;
или Х и R вместе могут образовать мостик, имеющий формулу -С(О)-О- или -С(О)-NR2, где карбонил присоединен к А; при условии, что когда R карбоксил в свободном эфире или соли и Х и Y вместе являются0, то одно из колец А и В содержит гетероатом.
Способ по изобретению отличается тем, что
а) когда Х и R сочетаются с образованием мостиковой группы, как определено выше, и Y является водородом, циано или арилтио, осуществляют реакцию соединения формулы (II) где кольцо А, Y1, Y2 и Y3 определены выше; Y водород, циано или арилтио; Z1 кислород, сера или NR2, где R2 определен выше, с соединением формулы
(II) где кольцо А, Y1, Y2 и Y3 определены выше; Y водород, циано или арилтио; Z1 кислород, сера или NR2, где R2 определен выше, с соединением формулы
R (III) где W1, W2, W3, W4 и R1 определены выше; R21 метилсульфонил или галоген, для получения соответствующего соединения формулы
(III) где W1, W2, W3, W4 и R1 определены выше; R21 метилсульфонил или галоген, для получения соответствующего соединения формулы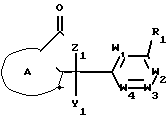 (II)
(II)
б) обрабатывают соединение формулы I', где Y1 циано или арилсульфонил; Z, кислород.
1) путем гидролиза для получения соответствующего соединения формулы I, где R1 и Х образуют мостик; Y гидроксил, или где Х и Y вместе образуют0;
2) обрабатывают амином с получением соответствующего соединения формулы I, где R является, возможно, замещенной карбамоильной группой; Х и Y вместе образуют0;
3) группой MOR22, где М щелочной металл; R22 водород или С1-8-алкил, с получением соответствующего соединения, где R и Х образуют мостик; Y гидроксил или С1-8-алкоксил.
в) осуществляют гидролиз соединения формулы I', где Y1 водород; Z1, кислород, а другие символы такие, как определено выше для получения соединения формулы I, в которой R карбоксильная группа, возможно, в виде соли; Х водород; Y гидрокси;
г) раскрывают кольцо в соединении формулы I', где Y1 гидроксил; Z1 кислород, а другие символы, такие, как определено выше, с получением соединения формулы I, где R карбоксильная группа, возможно, в виде соли; Х и Y вместе образуют0,
д) этерифицируют соединение формулы I, где R является карбоксильной группой, возможно, в виде соли; Х и Y0, а другие символы такие, как определено выше, с получением соответствующего соединения формулы I, где R карбоксильная группа в виде эфира.
е) галогенируют соединение формулы I', где Y1 гидроксил; Z1, определено в п.а), другие символы указаны выше с получением соединения формулы I, где Х и R вместе образуют мостиковую группу; Y1 галоген,
д) осуществляют реакцию соединения формулы I', где Z1 кислород; Y1 галоген, а другие символы такие, как определено выше, с группой R2NH2 и группой HOR23, где R2 определено выше; R23 представляет С1-8-алкил, С2-8-ацил или арил, с получением соответствующего соединения, где Z1 NR2; Y1 C1-8-алкокси, арилокси или С2-8-ацилокси,
з) осуществляют окислением формулы I', где Y1 водород; Х1определено в п. а), другие символы указаны выше, с получением соответствующего соединения, в котором Y1 гидроксил,
и) осуществляют взаимодействие соединения формулы I', где Z1 кислород; Y1 водород, другие символы такие, как определено выше, с группой R7NH2, где R7 водород, галоген; алкил, алкенил; алкинил, алкокси, алкенилокси, алкинилокси, каждый из которых в свою очередь может быть замещен 1-6 атомами галогенов и каждый из которых может быть присоединен к смежному атому азота через алкил; ацил; циклоалкил, циклоалкилалкил, гетероциклил, гетероциклоалкил, гетероциклоалкокси, арил, аралкил, арилокси, аралкокси, каждый из которых замещен или может быть замещен 1-3 заместителями, выбранными из 1) галогена, 2) алкила, алкенила, алкинила, алкокси, алкоксиалкокси, алкенилокси, алкинилокси, каждый из которых может быть в свою очередь замещен 1-6 атомами галогенов, и 3) нитро, циано, ацил, амино, замещенный амино, аминосульфонил, аминоалкил или замещенный аминоалкил; амино, замещенный амино, амидо, замещенный амидо, аминосульфонил, циано- или нитро, для получения соединения формулы I где R монозамещенный карбамоил; Х водород; Y- гидроксил,
к) сульфонируют, карбамоилируют, ацилируют или карбоксилируют соединения формулы II, где Z1 кислород; Y1-гидроксил, а другие символы такие, как определено выше, с получением соответствующего соединения формулы I, где R и Х образуют -С(О)-О- мостик; Y карбамоилокси, С2-8-ацилокси или С1-8-алкоксикарбонилокси,
л) осуществляют реакцию соединения формулы I', где Z1 кислород; Y1 галоген, а другие символы такие, как определено выше, с группой R7R8NH, где R7 определено в п.и); R8 такой, как определено для R7, с получением соединения формулы I, в котором R дважды замещен карбамоилом; X и Y вместе пpедставляют 0;
и выделяют полученное соединение, в котором R карбоксильная или тиокарбоксильная группа в свободной форме или в виде эфира, и соединение, в котором R карбоксил, в свободной форме или в виде соли.
Табл.1 иллюстрирует условия реакции.
Исходные материалы формулы (II) или (III) известны или могут быть изготовлены по известным методам.
Соединения формул обладают гербицидной активностью, как наблюдали при их применении до появления или после появления всходов сорняков или в локусе сорняков.
Выражение "гербицидный" используется здесь для обозначения активного ингредиента или создаваемого им эффекта, который модифицирует рост растений вследствие его свойств регулирующих рост растений, или фитотоксических свойств так, что рост растений задерживается или они повреждаются в достаточной степени для их уничтожения.
Применение соединения формулы I осуществляется согласно обычно процедуре борьбы с сорняками или их локуса с использованием гербицидно эффективного количества соединения обычно от 10 г до 10 кг/гектар.
Соединения по изобретению могут быть использованы для борьбы с широколистными или травяными сорняками как до появления всходов, так и после их появления. Соединения могут также проявлять селективность по отношению к различным урожайным культурам и являются пригодными для борьбы с сорняками в культурных растениях, таких как кукуруза, хлопок, пшеница и соевые бобы.
Оптимальное количество соединения формулы I легко определяется специалистом с помощью испытаний в теплице или на делянке. Оно зависит от используемого соединения, желаемого эффекта (фитотоксический эффект требует более высоких концентраций, чем регулирующий рост растений эффект), условий обработки и т.п. В общем удовлетворительные фитотоксические эффекты получают, когда соединение формулы I применяют в концентрации 0,01-5,0 кг, более предпочтительно 0,05-2,5 кг на гектар, например 0,05-5,0 кг на гектар, в особенности 0,1-2,5 кг на гектар.
Соединения формулы I могут применяться с другими гербицидами широкого спектра действия на сорняки, например карбаматы, тиокарбаматы, хлорацетамиды, динитроанилины, бензойные кислоты, глицериновые эфиры, пиридазиноны, полукарбазоны, урацилы и мочевины для широкого спектра действия на сорняки.
Соединения формулы I удобно использовать в виде гербицидных композиций в сочетании с приемлемыми в сельском хозяйстве разбавителями. Они могут содержать, кроме соединения формулы I в качестве активного агента, также другие активные агенты, такие как гербициды или соединения, имеющие антидотную, фунгицидную, инсектицидную или привлекающую насекомых активность. Они применяются как в твердой, так и в жидких формах, например, в форме увлажняющегося порошка или способного к эмульгированию концентрата, включающего традиционные разбавители. Такие композиции могут быть получены традиционным способом, например смешиванием активного ингредиента с разбавителем и другими составляющими композицию ингредиентами, такими как поверхностно-активные вещества.
Приемлемыми добавками могут быть такие добавки, которые применяются в гербицидных композициях для улучшения действия активного ингредиента и для снижения, например, вспенивания, комкования и коррозии.
Выражение "разбавитель" означает любое жидкое или твердое вещество, приемлемое в сельском хозяйстве, которое может быть добавлено к активному компоненту, чтобы привести его в более удобно или легко применимую форму и при соответственно требуемой силе активности. Такими веществами могут быть, например, тальк, каолин, диатомовая земля, ксилол или вода.
Выражение "поверхностно-активное вещество" означает приемлемое в сельском хозяйстве вещество, сообщающее эмульгирующие, диспергирующие, смачивающие, распространяющие или другие модифицирующие поверхность свойства. Примерами таких веществ являются лигниносульфонат и лаурилсульфат. Например, композиции, применяемые в разбрызгиваемой форме, такие как диспергируемые в воде концентраты или смачиваемые порошки, которые могут содержать такие поверхностно-активные вещества, как смачивающий и диспергирующий агенты, например конденсационный продукт формальдегида с нафтиленсульфонатом, этоксилированный алкилфенол и этоксилированный жирный спирт. Составы включают 0,01 90 мас. активного агента и 0-20 мас. приемлемого в сельском хозяйстве поверхностно-активного вещества, причем активный агент состоит либо из по меньшей мере одного соединения формулы I, либо из его смеси с другими активными агентами. Концентрированные формулы композиций содержат примерно 2-90 мас. предпочтительно, примерно 5-70 мас. активного агента. Готовые (для применения) формы состава могут, например, содержать 0,01-20 мас. активного агента.
Далее приводятся примеры для пояснения настоящего изобретения. Температура дана в градусах Цельсия. В тексте использованы следующие сокращения:
THF тетрагидрофуран;
LDA литийдиизопропиламид;
КТ комнатная температура;
DMF диметилформамид;
DDQ 2,3-дихлор-5,6-дицианобензохинон;
NBS N-бромосукцинимид;
DMSO диметилсульфоксид;
МЕК метилэтилкетон;
DMAP диметиламинопиридин.
Отдельные алкильные заместители, перечисленные в ниже следующих таблицах, являются соединениями в n-изомерной форме, если не указывается иное.
П р им е р 1. 7-Хлор-3-(4,6-диметокси-2-пиримидинил)фталид (табл.2, соединение 6).
7-Хлорофталид 1,68 г (0,01 моль) добавляют к 100 мл сухого THF и смесь охлаждают до -70оС. Затем добавляют 6,8 мл (0,01 моль) 1,5 М LDA в течение 3 мин и реакционную смесь перемешивают при -70оС в течение 15 мин. После этого 2,18 г (0,01 моль) 2-метилсульфонил-4,6-диметоксипирими-дина в 50 мл добавляют в эту смесь, которую перемешивают 4 ч при (-75) (-70)оС. Реакционную смесь нейтрализуют 1,5 г NH4Cl в 5 мл воды, нагревают и концентрируют на роторном выпаривателе. Концентрат разделяют между CH2Cl2 и Н2О (каждого по 50 мл), отделяют водную фазу и обрабатывают еще 30 мл CH2Cl2. Соединение CH2Cl2 фазы промывают 30 мл воды, разделяют и концентрируют. Концентрат флэшхроматографируют на силикагеле с использованием 80/20 гексан/этилацетат, 50/50 гексан/этилацетата (500 мл) и 80/20 ацетон/метанола (500 мл): 30 фракций х 50 мл. Целевое соединение получают после рекристаллизации из гексан/CH2Cl2 в виде белого твердого вещества с температурой плавления 148-149оС.
П р и м е р 2. 5-(4,6-Диметокси-2-пиримидинил)-фуро[3,4,б]пиридин-7(5Н)-он (табл.3, соединение 40).
Раствор 1,3 г (0,0096 моль) фуро[3,4,б]пиридин-7(4Н)-он в 50 мл сухого THF охлаждают до -75оС и по каплям в течение 5 мин добавляют 8 мл (0,0192 моль) 2,5 М LDA. Смесь оставляют реагировать в течение 1 ч при -75оС и по каплям в течение 10 мин добавляют 2,1 г (0,0096 моль) 2-метилсульфонил-4,6-диметоксипиримидина в 30 мл сухого THF. Смесь оставляют нагреться до К. Т. добавляют 1,6 мл HCl и THF выпаривают. Остаток растворяют в 75 мл CH2Cl2, промывают водой (2 х 50 мл) и органическую фазу концентрируют с получением желтовато-белого резиноподобного твердого вещества. Это вещество хроматографируют на силикагельной колонне с использованием 50/50 гексан/этилацетата (500 мл), этилацетата (500 мл) и 80/20 ацетон/метанола (1000 мл): 30 фракций. Кристаллический остаток (фракции 18-21) целевого продукта имеет температуру плавления 167-168оС.
П р и м е р 3. 7-Хлор-3-метокси-3-(4,6-диметокси-2-пиримидинил)-2-метилизои- ндол-1(3Н)-он (табл.4, соединение 54).
Смесь из 0,5 г 7-хлор-3-гидрокси-3-(4,6-диметокси-2-пиримидил)фталида, 30 мл CCl4, 2 мл SOCl2 и 4 капли DMF нагревают при 65оС в течение 1,5 ч, охлаждают и излишек SOCl2 и CCl4 удаляют на роторном выпаривателе. Остаток разводят 20 мл CH2Cl2 и добавляют к смеси 5 мл 40%-ного водного метиламина и 10 мл метанола при помешивании в течение 0,5 ч. Смесь помещают в роторный выпариватель и остаток разделяют между CH2Cl2 и водой по 50 мл каждого. Органическую фазу концентрируют и флэшхроматографируют на силикагеле с использованием 50/50 гексан/этилацетата (800 мл), этилацетата (500 мл) и 80/20 ацетон/метанола (200 мл): 30 фракций х 50 мл. Продукт (фракции 19-21) получен в виде желтого резиноподобного вещества.
П р и м е р 4. 7-Хлор-3-гидрокси-3-(4,6-диметокси-2-пиримидинил)фталид (табл.2, соединение 13).
Смесь из 1,8 г 7-хлор-3-циано-3-(4,6-диметокси-2-пиримидинил)фталида, 50 мл 1%-ного NaOH и 50 мл THF перемешивают при К.Т. в течение 3 ч. THF удаляют выпариванием, смесь разводят водой и дважды экстрагируют этилацетатом. Водный раствор окисляют 2н. H2SO4. Полученный кислый раствор экстрагируют 3 х 100 мл этилацетата, органические фазы соединяют, сушат над сульфатом натрия и концентрируют с получением бледно-желтого твердого вещества. Этот остаток помещают в этилацетат и обрабатывают активированным углем, пока не будет удален желтый основной материал с получением указанного продукта в виде твердого вещества с т.пл. 188-190оС.
П р и м е р 5. 7-Хлор-3-метокси-3-(4,6-диметокси-2-пиримидинил)фталид (табл. 2, соединение 30).
7-Хлор-3-циано-3-(4,6-диметокси-2-пи-римидинил)фталид (1 г) разводят в 20 мл этанола, раствор охлаждают на льду и добавляют по каплям 0,6 мл метоксида натрия. После перемешивания в течение 10 мин добавляют еще 1 мл метоксида натрия, перемешивание продолжают в течение 10 мин и затем смесь охлаждают 2н. H2SO4. Метанол удаляют на роторном выпаривателе и остаток разделяют между водой и этилацетатом. Органическую фазу сушат над сульфатом натрия и концентрируют. Флэшхроматография остатка на силикагеле с использованием 25% этилацетата/гексана дает выход белого твердого вещества с т.пл. 180-183оС.
П р и м е р 6.
а) Метил-2-хлор-6-(4,6-диметокси-2-пиримидинилкарбонил)бензоат (табл.4, соединение 55);
б). 7-Хлор-3-хлор-(4,6-диметокси-2-пиримидинил)фталид (табл. 2, соединение 21).
Смесь из 0,7 г 7-хлор-3-гидрокси-3-(4,6-диметокси-2-пиримидинил)фталида, 30 мл CCl4 2 мл SOCl2 и 4 капель DMF нагревают с рефлюксом при 60оС в течение 1,5 ч. Смесь затем охлаждают, излишек SOCl2 и CCl4 удаляют на роторном выпаривателе. Остаток разводят 20 мл CH2Cl2 и к этой смеси при перемешивании добавляют 10 мл метанола и 2 мл диэтиламина. Через 2,5 ч смесь помещают в роторный выпариватель для удаления излишка CH2Cl2 и метанола, остаток разделяют между CH2Cl2 (50 мл) и водой (50 мл). Органическую фазу отделяют, концентрируют и резиноподобный остаток флэшхроматографируют на силикагеле с использованием 80/20 гексан/этилацетата (500 мл), 60/40 гексана/этилацетата (500 мл): 20 фракций х 50 мл. Фракции 18-20 дали соединение а), а фракции 11-16 соединение б).
П р и м е р 7. 7-Хлор-3-циано-3-(4,6-диметокси-2-пиримидинил)фталид (табл.2, соединение 27).
7-Хлор-3-цианофталида (600 мг) добавляют к ледяной суспензии промытого гексаном NaH (160 мг) 60% в DMF (20 мл). Через 15 мин добавляют 710 мг 2-метилсульфонил-4,6-диметоксипиримидина. После перемешивания при комнатной температуре в течение 1,5 ч смесь выливают в 200 мл ледяной воды, подкисленной 2 н. H2SO4 и перемешивают. Осадок фильтруют и сушат в вакуумной печи с получением указанного продукта с т.пл. 159-161оС.
П р и м е р 8. 7-Хлор-3,3-бис(4,6-диметокси-1,3,5-триазин-2-ил)фталид (табл.2, соединение 36).
7-Хлорфталида (1,48 г) растворяют в 80 мл THF. Раствор охлаждают до -70оС и в него впрыскивают при -70оС в течение 3 мин 1,5 М LDA в THF (6 мл). Перемешивание продолжают в течение 15 мин при -70оС, по каплям добавляют 1,54 г 2-хлор-4,6-диметокси-1,3,5-триазина в 50 мл THF и затем смесь оставляют нагреться до -20оС. Смесь снова охлаждают до -70оС и добавляют 1 мл концентрированной HCl в 10 мл воды. Смесь перемешивают в течение 25 мин и ей позволяют нагреться до К. Т. при этом THF удаляют выпариванием. Остаток разделяют между CH2Cl2 и водой (каждого по 50 мл), водную фазу экстрагируют дополнительно 30 мл CH2Cl2. Соединенные органические фазы промывают 30 мл воды и концентрируют с получением желтого резиноподобного вещества. Его флэшхроматографируют на силикагеле с использованием 60/40 гексан/этилацетата (1000 мл), этилацетата (400 мл), 80/20 ацетон/метанола (500 мл): 30 фракций х 50 мл, 1 х 200 мл. Из фракций 21 и 22 получили желтое резиноподобное вещество, которое при рекристаллизации из гексана дает указанный продукт с точкой плавления 126-127оС в виде желтого твердого вещества.
П р и м е р 9. 2-Хлор-6-(4,6-диметокси-альфа-гидрокси-2-пиримидинилметил)бен-зоат лития (табл.4, соединение 53).
Смесь 1 г 7-хлор-3-(4,6-диметокси-2-пиримидинил)фталида, 0,136 г LiOH˙H2O, 2 мл воды и 10 мл метанола перемешивают до утра при К.Т. Смесь выпаривают до сухого состояния на роторном выпаривателе. Дальнейшее высушивание ("drymg pistol") дает указанное соединение в виде твердого вещества с т.пл. 153-157оС.
П р и м е р 10. 3-[(4,6-диметокси-альфа-гидрокси-2-пиримидинил)метил]пиридин-2-карбоксилат лития (табл.5, соединение 64).
Смесь из 0,490 г 5-(4,6-диметокси-2-пиримидинил)фуро[3,4,б]пиридин-7(5Н)-он, 0,0768 г LiOH H2O. 10 мл метанола и 2 мл воды перемешивают 24 ч в азотной атмосфере при К.Т. и растворитель удаляют. Желтоватое твердое вещество сушат еще 2 ч с получением указанного продукта с т.пл. свыше 250оС (декомпозиция).
П р и м е р 11. 2-Хлор-6-[(4,6-диметокси-2-пиримидинил)карбонил]бензоат натрия (табл.4, соединение 58).
1,24 г 7-Хлор-3-гидрокси-3-(4,6-диметокси-2-пиримидинил)фталида, 154 мг NaOH, 25 мл THF и 25 мл воды смешивают, пока не получат желтый гомогенный раствор. Растворитель удаляют на роторном выпаривателе и затем на "Kugelrohr" при 100оС с получением целевого соединения в виде желтого твердого вещества с т.пл. 276-278оС.
П р и м е р 12. 3-[(4,6-Диметокси-2-пиримидинил)карбонил]-пиридин-2-карбоно-вая кислота (табл.5, соединение 63).
5-(4,6-Диметокси-2-пиримидинил)-фуро [3,4б] пиридин-7(5Н)-он (490 мг) растворяют в 50 мл метанола и смесь нагревают, перемешивая, при 50оС, пока не образуется гомогенный раствор (примерно 0,5 ч). NaOCl (2,6 г) добавляют по каплям и раствор нагревают еще 0,5 ч при 55оС. При этой температуре добавляют 0,208 г 50%-ной NaOH и смесь нагревают еще 0,5 ч при этой температуре, а затем охлаждают на льду и подкисляют 1 мл концентрированной HCl. Растворитель выпаривают и остаток разделяют между 50 мл CH2Cl2 и 50 мл воды. Органическую фазу концентрируют с получением белого твердого вещества с т. пл. 71-73оС.
П р и м е р 13. 2-[(4,6-диметокси-2-пиримидинил)-альфа-иминометил]бензойная кислота (табл.4, соединение 51).
Изопропил-2-бромбензоата (2,67 г) растворяют в 100 мл безводного диэтилового эфира, раствор охлаждают до -100оС и добавляют 6,6 мл 1,6 М раствора н-бутиллития. Перемешивание продолжают в течение 10 мин и в течение 2 мин добавляют при -100оС 12 г 2-циано-4,6-диметоксипиримидина в 60 мл диэтилового эфира. Смесь перемешивают 0,5 ч при -80оС и затем оставляют нагреваться до комнатной температуры. К реакционной смеси, охлажденной на водяной бане, добавляют 3 г NH4Cl в 30 мл воды. Эфирный слой отделяют, промывают водой (2 х 30 мл) и концентрируют. Вязкий остаток растворяют в 20 мл 85/15 гексан/этилацетата и CH2Cl2 и флэшхроматографируют на силикагеле с использованием 800 мл 85/15 гексан/этилацетата, 500 мл 1%-ного метанола в этилацетате, 500 мл 5% -ного метанола в этилацетате и 500 мл 80/20 ацетон/метанола: 40 фракций по 60 мл. 1 х 200 мл. Из фракций 7-10 получали указанное в названии соединение которое после рекристаллизации из CH2Cl2 плавится при 225-235оС.
П р и м е р 14. 5-Хлор-5-(4,6-диметокси-2-пиримидинид)фуро[3,4,б]пиридин-7(5Н)-он (табл.3, соединение 68).
Смесь из 490 мг 5-(4,6-Диметокси-2-пиримидинил)фуро[3,4,б]пиридин-7(5Н)-он и 50 мл метанола нагревают при 55оС в течение 0,5 ч или пока не образуется гомогенный раствор. По каплям добавляют 2,6 г NaOCl (обычный домашний отбеливатель). Смесь помещают в дихлорметан, органическую фазу отделяют и выпаривают до полного удаления воды с получением указанного соединения.
П р и м е р 15. 3-[(4,6-Диметокси-2-пиримидинил)карбонил]пиридин-2-карбоновая кислота (табл.6, соединение 63).
0,208 г 50%-ной NaOH добавляют при 55oС к раствору из 0,551 г 5-хлор-5-(4,6-диметокси-2-пиримидинил)фуро[3,4,б]пиридина (табл.3, соединение 68) в 50 мл метанола. Смесь перемешивали еще 0,5 ч при 55оС, охлаждали на льду, подкисляли 1 мл концентрированной HCl и растворитель выпаривали. Остаток разделяли между 50 мл CH2Cl2 и 50 мл Н2О, при этом слой CH2Cl2 концентрировали с получением 0,39 г указанного продукта в виде твердого вещества с т. пл. 71-73оС.
П р и м е р 16. 2-[2-(4,4-Диметилоксазолин-2-ил)-бензил]-4,6-дихлорпиримидин (табл.4, соединение 61).
К смеси из 1,25 г 2-о-толуол-4,4-диметил-оксазолина в 20 мл эфира в атмосфере азота при -30оС добавляли шприцем 4,2 мл 1,6 М н-бутиллития в гексане с перемешиванием, которое продолжалось 1 ч при -10оС. К этой реакционной смеси медленно добавляли 0,98 г 4,6-дихлорпиримидина в 20 мл эфира, затем перемешивали при (-45) (-30)оС в течение 30 мин и при 0оС еще 30 мин. Реакционную смесь гасят уксусной кислотой (0,4 мл) и водой (0,1 мл) в THF (1,3 мл), затем обрабатывают 1,5 г 2,3-дихлор-5,6-дицианобензохинона (DDQ) в 6 мл THF. Температуру доводят до К.Т. и смесь перемешивают в течение 5 мин после охлаждения до 0оС, после этого 7,6 мл охлажденного 1н. NaOH добавляют к смеси и смесь перемешивают 5 мин. Органическую фазу отделяют и сушат над сульфатом натрия, фильтруют и удаляют растворитель. Последующей хроматографией (10/90 эфир/гексан) получают искомый продукт.
П р и м е р 17. 2-[2-(4,4-Диметил-оксазолин-2-ил)-бензил]-4,6-диметоксипиримидин (табл.4, соединение 48).
К раствору 1,7 г 2[2-(4,4-диметил-оксазолин-2-ил)бензол]-4,6-дихлорпиримидина в 100 мл метанола добавляют 2,18 г 25%-ного метанольного NaOCH3 и смесь нагревают в течение 10 ч при 65оС при перемешивании. Температуру понижают до 60оС и перемешивание продолжают до утра. Растворитель удаляют и остаток помещают в 80 мл толуола и 50 мл воды. Слой толуола отделяют и промывают 50 мл воды, отделяют и концентрируют с получением указанного соединения в виде желтого масла.
П р и м е р 18. 2-[2-(4,4-Диметил-оксазолин-2-ил)-альфа-бромобензил]-4,6-димето-ксипиримидин (табл.4, соединение 62).
0,55 г 2-[2-(4,4-диметил-оксазолин-2-ил)-бензил]-4,6-диметоксипиримидин, 0,30 г N-бромосукцинимида, 0,03 г бензоилпероксида растворяют в 60 мл CCl4 и нагревают с рефлюксом до утра при 75оС. Реакционную смесь фильтруют и фильтрат промывают 5% -ным NaHCO3 раствором (50 мл), 50 мл воды, органическую фазу отделяют и ее концентрирование дает целевое соединение.
П р и м е р 19. 2-[2-(4,4-диметил-оксазолин-2-ил)-бензоил]4,6-диметоксипирими- дин (табл.4, соединение 49).
Смесь 1,2 г 2-[2-(4,4,-диметил-оксазолин-2-ил)-альфа-бромобензил]-4,6-димето-ксипиримиди на и 2 г Na2CO3 в 30 мл нагревают при перемешивании при 50-60оС в течение 3 ч. Смесь выливают в 150 мл воды и экстрагируют толуолом. Толуоловый экстракт дважды промывают водой (2 х 50 мл), отделяют и концентрируют. Полученное таким образом резиноподобное вещество хроматографируют с 800 мл 80/20 гексан/этилацетата, 500 мл 70/30 гексан/этилацетата, 60/40 мл гексан/этилацетата: 50 мл фракции. Из фракций 29-34 получали целевое соединение.
П р и м е р 20. 2-Хлор-6-(4,6-диметокси-2-пиримидинилкарбонил)-бензойной кислоты диметиламид (табл.4, соединение 57).
7-Хлор-3-циано-3-(4,6-диметокси-2-пи-римидинил)фталид (1 г) растворяют в 15 мл THF, 0,7 мл 40%-ного водного раствора диметиламина, затем добавляют шприцом, при этом раствор темнеет. Перемешивание продолжают при К.Т. в течение 15 мин, смесь разбавляют водой и разделяют между этилацетатом и водой. Органическую фазу отделяют, промывают 2н. H2SO4, затем рассолом (насыщенным солевым раствором), обезвоживают и концентрируют. Остаток очищают на силикагеле, элюируют 200 мл 50%-ного этилацетат/гексана, а затем 100% этилацетата. Из фракций 12-15 получают целевое соединение с т.пл. 141-142оС.
П р и м е р 21. 3-Ацетокси-7-хлор-3-(4,6-диметокси-2-пиримидинил)фталид (табл.2, соединение 125).
7-Хлор-3-(4,6-диметокси-2-пиримиди-нил)-3-гидроксифталида (1,1 г) растворяют в 20 мл пиридина и добавляют 0,3 мл уксусного ангидрида при перемешивании. После перемешивания в течение 20 мин смесь выливают в 2н. HCl и экстрагируют 2 ч. этилацетата. Соединенные этилацетатные экстракты промывают один раз 2н. HCl, один раз водой и один раз солевым раствором и обезвоживают над сульфатом магния. Фильтрацию и выпаривание осуществляют с получением целевого соединения в виде белого твердого вещества с т.пл. 213-215оС.
П р и м е р 22. 3-[(4,6-Диметокси-альфа-гидрокси-2-пиримидинил)метил] пиридин-2-карбоксамид (табл.6, соединение 82).
К раствору 0,9 г аммония в 15 мл метанола добавляют 0,5 г 3-(4,6-диметокси-2-пиримидинил)-7-азафталида. После перемешивания в течение 2 ч при К.Т. метанол удаляют при пониженном давлении и концентрат рекристаллизуют из толуола с получением целевого соединения в виде твердого белого вещества с т.пл. 135-137оС.
П р и м е р 23. 3[(4,6-Диметокси-4-гидрокси-2-пиримидинил)метил]пиридин-2- [ карбокси-(4-изопропил)анилид] (табл.6, соединение 183).
К раствору 3 мл 4-изопропиланилина в 50 мл толуола впрыскивают 4 мл 15,6% -ного триметилалюминия в гексане при К.Т. Смесь перемешивают полчаса при К. Т. и добавляют 0,5 г 3-(4,6-диметокси-2-пиримидинил)-7-азафталида. Смесь перемешивают в течение 2 ч при К.Т. и подкисляют 30 мл 10%-ной соляной кислоты при 5-10оС. Толуоловый раствор отделяют, промывают 20 мл 10%-ной соляной кислоты, 20 мл 5%-ного карбоната натрия и 20 мл воды, обезвоживают и концентрируют. Концентрат рекристаллизуют из гексана с получением целевого соединения в виде твердого белого вещества с т.пл. 113-114оС.
П р и м е р 24. 3-](4,6-Диметокси-альфа-[этоксикарбонилокси]-2-пиримидинил)ме-тил] -пиридин-2-карбаксамид (табл.6, соединение 129).
К раствору 0,5 г 3-[(4,6-диметокси-альфа-гидрокси-2-пиримидинил)метил] -пири-дин-2- карбоксамида, 0,5 г 4-(диметиламино)пиридина и 1 мл триэтиламина в 20 мл толуола и 10 мл дихлорметана добавляют 1 мл этилхлороформата при К.Т. После перемешивания в течение 1 ч при температуре окружающей среды смесь промывают водой (2 х 30 мл), обезвоживают и концентрируют на роторном выпаривателе. Концентрат обрабатывают объемной смесью гексана/толуола 10 мл при 50оС, охлаждают до К. Т. и фильтруют для выделения 0,45 г указанного соединения в виде желтого твердого вещества с т.пл. 112-114оС.
П р и м е р 25. 3-[(4,6-Диметокси-альфа-бензоилокси-2-пиримидинил)метил] пи-ридин-2 -(N,N-дибензоил)карбоксамид (табл.6, соединение 159).
К раствору 0,05 г 3-[(4,6-диметокси-альфа-гидрокси-2-пиримидинил)метил] -2-кар-боксамида, 0,5 г 4-(диметиламино)пиридина и 4 мл триэтиламина в 30 мл дихлорметана добавляют 1,4 г бензоилхлорида при К.Т. двумя порциями. Реакционную смесь перемешивают при К.Т. в течение 17 ч и промывают 30 мл воды, 30 мл 5%-ной соляной кислоты и 30 мл воды. Раствор дихлорметана концентрируют и концентрат флэшхроматографируют через 300 мл силикагеля (230-400 меш) с использованием 1 л 70/30 гексан/этилацетата и 500 мл 50/50 гексан/этилацетата в качестве элюирующих растворяющих смесей. Из фракций 18-21 после рекристаллизации из 70/30 гексан/этилацетат получают целевое соединение в виде твердого белого вещества с т.пл. 168-170оС.
П р и м е р 26. 3-[(4,6-Диметокси-альфа-(N-метилкарбамоилокси)-2-пиримидинил) метил]-2-пиридина карбокс(N-аллил)амид (табл.6, соединение 133).
К раствору 0,5 г 3-[(4,6-диметокси-альфа-гидрокси-2-пиримидинил)-метил] -2-пириди-на карбокс(N-аллил)амида и 3 капли триэтиламина в 20 мл дихлорметана добавляют 3 мл метилизоцианата в трех порциях по 1 мл в день при перемешивании при К.Т. в течение 3 дней. Реакционную смесь промывают водой (2 х 50 мл), обезвоживают и концентрируют. Концентрат флэшхроматографируют через 300 мл силикагеля (230-400 меш) с использованием 1 л 50/50 гексан/этилацетата, 500 мл этилацетата, 500 мл 80/20 этилацетатного метанола, всего 34 фракциями (50 м/м). Из фракций 21-25 получают 0,4 г указанного продукта в виде желтого резиноподобного вещества.
Соединения, указанные в табл. 2-7, могут быть приготовлены аналогично предыдущим примерам или иначе, как здесь описано.
NMR данные ['H nmr (CDCl3)]
NMR данные ['H nmr (CDCl3)]
Cpd N
41 δ 3,95 (s, 6H, OCH3), 5-95 (s, 1H, пиримидин Н), 6,45 (s, 1H, OCH), 7,7-9,1 (m, 3H, пиридин Н).
44 δ: 1,32 (t, 3H, CH3), 2,87 (q, 2H, CH2), 4,05 (s, 6H, OCH3), 6,3 (s, 1H, OCH), 7,82 (d, 1H, аром), 8,72 (d, 1H, аром.).
46 δ: 1,32 (t, 3H, CH3), 2,85 (q, 2H, CH2), 3,87 (s, 6H, OCH3), 5,97 (s, 1H, пиримидин Н), 6,32 (s, 1H, OCH), 8,08 (d, 1H, пиримидин Н), 8,71 (d, 1H, пиридин Н).
48 δ: 1,25 (s, 6H, CH3), 3,85 (s, 6H, OCH3), 3,95 (2H, OCH2), 4,65 (s, 2H, CH2), 5,85 (s, 1H, пиримидин Н), 7,2-8,0 (4H, ароматы).
49 δ: 1,00 (s, 6H, CH3), 3,65 и 3,75 (d от d 2Н, OCH2), 6,05 (s, 1H, пиримидин Н), 7,2-8,1 (4H, ароматы Н).
54 δ: 2,9 (s, 3H, CH3N), 3,10 (s, 3H, CH3O), 3,90 (s, 6H, ароматы ОСН3), 6,10 (s, 1H, пиримидин Н), 7,2-7,9 (3Н, ароматы Н).
61 δ: 1,24 (s, 6H, CH3), 3,98 (s, 2H, CH2O), 4,74 (s, 2H, CH2), 7,16 (s, 1H, пиримидин Н).
65 δ: 3,96 (s, 6H, OCH3), 5,96 (s, 1H, пиримидин Н), 6,32 (s, 1H, OCH), 7,27 (d, 1H, тиенил Н), 7,85 (d, 1H, тиенил Н).
66 δ: 4,08 (s, 6H, OCH3), 6,27 (s, 1H, OCH), 7,18 (d, 1H, тиенил Н), 7,95 (d, 1H, тиенил Н).
76 δ: 1,63 (t, 3H, CH2CH3), 3,91 (s, 6H, OCH3), 4,1 (q, 2H, OCH2), 6,08 (s, 1H, пиримидин Н), 7,2-7,8 (m, 3H, ароматы Н).
83 δ: 3,85 (s, 6H, OCH3), 4,52-4,63 (d, 2H, NCH2), 5,21-5,42 (s, 1H, OH), 5,80 (s, 1H, OCH), 6,82 (s, 1H, пиримидин), 7,25 (s, 5H, ароматы), 7,31-7,52 (m, 1H, пиридин), 7,80-8,12 (d, 1H, пиридин), 8,35-8,55 (d, 1H, пиридин), 8,58-8,88 (s, 1H, NH).
84 δ: 3,85 (s, 6H, OCH3), 4,05 (t, 2H, NCH2), 5,0-5,45 (m, 3H, CH=CH2), 5,85 (s, 1H, пиримидин), 6,80 (s, 1H, OCH), 7,2-8,6 (m, 3H, пиридины).
86 δ: 3,85 (s, OCH3), 5,37 (s, OCH2Ar), 5,85 (s, пиримидин), 6,80 (d, OCH), 7,2-8,2 (m, ароматы), смесь с соед. 40.
88 δ: 4,00 (s, 3H, OCH3), 5,50 (s, 2H, OCH2), 6,05 (s, 1H, пиримидин Н), 6,27 (s, 1H, O-CH), 7,1-7,7 (m, 8H, ароматы Н).
95 δ: 3,85 (s, 6H, OCH3), 5,42 (s, 2H, OCH2), 6,05 (s, 1H, OCH), 6,42 (s, 1H, пиримидин), 7,05-7,35 (s, 5H, ароматы), 7,35-7,768 (m, 11H, пиридин), 7,78-8,1 (d, 1H, пиридин), 8,81-9,01 (d, 1H, пиридин).
97 δ: 3,80 (s, 6H, OCH3), 5,35 (s, 2H, OCH2Ar), 6,85 (s, 1H, пиримидин), 6,65 (s, 1H, OCH), 7,15-8,6 (m, 8H, ароматы), смесь с соед. 40.
107 δ: 1,92 (s, 3H, C=CCH3), 3,98 (s, 6H, OCH3), 4,92 (s, 2H, OCH2), 6,07 (s, 1H, OCH), 6,58 (s, 1H, пиримидин), 7,52-7,88 (m, 1H, пиридин), 8,10-8,32 (d, 1H, пиридин), 8,90-8,91 (d, 1H, пиридин).
110 δ: 0,75-1,12 (t, 3H, CH3), 3,18-3,48 (m, 2H, CH2), 3,81 (s, 6H, OCH3), 4,42-4,91 (m, 3H, OH и NCH2), 5,82 (s, 1H, OCH), 6,72 (s, 1H, пиримидин), 7,21-7,52 (m, 1H, пиридин), 7,82-8,08 (d, 1H, пиридин), 8,32-8,61 (f, 1H, пиридин).
112 δ: 1,12-1,31 (d, 6H, CH3), 3,81 (s, 6H, OCH3), 4,12-4,32 (m, 1H, NCH), 5,85 (s, 1H, OCH), 6,71 (s, 1H, пиримидин), 7,21-7,52 (q, 1H, пиридин), 7,81-8,09 (d, 1H, пиридин), 8,12-8,31 (m, 1H, NH), 8,39-8,55 (d, 1H, пиридин).
119 δ: 3,05 (d, 3H, NCH3), 3,94 (s, 6H, OCH3), 5,20 (s, 1H, OH), 5,75 (s, 1H, OCH), 5,98 (s, 1H, пиридин Н), 7,26 (d, 1H, пиридин Н), 7,82 (q, 1H, NH), 8,28 (d, 1H, пиридин Н).
127 δ: 3,75 (s, 6H, OCH3), 4,05 (t, 2H, NCH2), 5,05-5,5 (m, 3H, CH=CH2), 5,85 (s, 1H, пиримидин), 7,2-8,6 (m, 9H, ароматы +ОСН).
128 δ: 2,20 (s, 3H, CH3), 3,75 (s, 6H, OCH3), 4,10 (t, 2H, NCH2), 5,0-6,6 (m, 3H, CH=CH2), 5,85 (s, 1H, пиримидин), 7,2-8,6 (m, 5H, пиридин + NH, OCH).
130 δ: 0,75-1,61 (m, 15H, алифаты), 1,61-3,02 (m, 8H, алифаты), 3,15-3,61 (m, 2H, NCН2), 3,81 (s, 6H, OCH3), 5,82 (s, 1H, OCH), 6,81 (s, 1H, пиримидин), 7,21-7,52 (q, 1H, пиридин), 7,92-8,15 (d, 1H, пиридин), 8,17-8,32 (m, 1H, NH), 8,35-8,52 (d, 1H, пиридин).
133 δ: 2,85 (d, 3H, NCH3), 3,85 (s, 6H, OCH3), 4,10 (t, 2H, NCH2), 5,0-6,0 (m, 3H, CH=CH2), 5,85 (s, 1H, пиримидин), 7,2-8,6 (m, 4H, пиридин + ОСН).
150 δ: 0,96 (t, 3H, CH3), 1,68 (m, 2H, CH2CH2CH3), 3,50 (m, 2H, NCH2), 3,93 (s, 6H, OCH3), 5,92 (s, 1H, пиримидин Н), 6,17 (d, 1H, OCH), 7,21 (d от d, 1H, пиридин Н), 8,07 (d от d, 1H, пиридин Н), 8,57 (d от d 1H, пиридин Н), 8,66 (t, 1H, NH).
151 δ: 1,41-1,61 (d, 3H, CH3), 3,82 (s, 6H, OCH3), 4,92-5,35 (m, 2H, NCH, OH), 5,81 (s, 1H, OCH), 6,85 (s, 1H, пиримидин), 7,12-7,51 (m, 6H, ароматы и пиридин), 7,82-8,10 (d, 1H, пиридин), 8,38-8,50 (d, 1H, пиридин), 8,51--8,82 (m, 1H, NH).
152 δ: 2,25 (s, 3H, CH3), 3,89 (s, 6H, OCH3), 3,42-3,61 (d, 2H, NCH2), 5,81 (s, 1H, OCH), 6,85 (s, 1H, пиримидин), 7,03 (s, 4H, ароматы), 7,12-7,52 (q, 1H, пиридин), 7,85-8,12 (d, 1H, пиридин), 8,40-8,51 (d, 1H, пиридин), 8,58-8,72 (m, 1H, NH).
171 δ: 1,24 (t, 3H, CH3), 2,60 (q, 2H, CH2), 3,86 (s, 6H, OCH3), 4,62 (d, 2H, NCH2), 5,86 (s, 1H, пиримидин Н), 6,90 (d, 1H, OCH), 7,0-8,54 (m, 7H, ароматы Н), 8,60 (bs, 1H, NH).
174 δ: 3,83 (s, 3H, OCH3), 3,90 (s, 6H, OCH3), 5,83 (s, 1H, пиримидин Н), 6,60 (d, 1H, OCH), 7,30 (d от d, 1H, пиридин Н), 8,23 (d от d, 1H, пиридин Н), 8,70 (d от d, 1H, пиридин Н).
177 δ: 2,20 (s, 6H, CH3), 2,31-2,60 (m, 2H, CH2N), 3,31-3,75 (q, 2H, NCH2), 3,78 (s, 6H, OCH3), 5,75 (s, 1H, OCH), 6,61 (s, 1H, пиримидин), 7,13-7,42 (q, 1H, пиридин), 7,71-7,91 (d, 1H, пиридин), 8,31-8,51 (d, 1H, пиридин).
178 δ: 3,85 (s, 9H, OCH3), 3,95 (s, 3H, OCH3), 4,14 (s, 2H, CH2), 5,82 (s, 1H, пиримидин Н), 6,90 (d, 1H, пиридин Н), 8,12 (d, 1H, пиридин Н).
187 δ: 3,70 (s, 9H, OCH3), 5,82 (s, 1H, пиримидин Н), 6,80 (d, 1H, пиридин Н), 8,10 (d, 1H, пиридин Н).
193 δ: 0,85-1,05 (d, 6H, CH3), 3,85 (s, 6H, OCH3), 4,53-4,82 (q, 1H, CH), 5,25-5,55 (m, 2H, OH и NCH), 5,82 (s, 1H, OCH), 6,88 (s, 1H, пиримидин), 7,25-7,51 (q, 1H, пиридин), 7,83-8,05 (d, 1H, пиридин), 8,41-8,60 (d, 1H, пиридин), 8,72-8,85 (d, 1H, NH).
196 δ: 3,78 (s, 6H, OCH3), 4,51-4,78 (d, 2H, NCH2), 5,35 (s, 1H, OH), 5,81 (s, 1H, OCH), 6,28 (s, 2H, фурфурил), 6,81 (s, 1H, пиримидин), 7,12-7,43 (m, 2H, фурфурил), 7,82-8,05 (d, 1H, пиридин), 8,31-8,43 (d, 1H, пиридин), 8,52-8,71 (m, 1H, NH).
201 δ: 1,87-2,04 (m, 4H, CH2 и тетрагидрофуран), 3,71-3,92 (m, 9H, OCH3 и тетрагидрофуран), 5,86-5,87 (m, 2H, OCH и OH), 6,71 (d, 1H, пиримидин), 7,31-7,42 (d, 1H, пиридин), 7,81-7,92 (d, 1H, пиридин), 8,41-8,50 (d, 2H, NH и пиридин).
206 δ: 2,22 (s, 1H, CH3), 3,85 (s, 6H, OCH3), 3,92 (s, 3H, OCH3), 3,97 (s, 3H, OCH3), 5,86 (s, 1H, пиримидин Н), 6,80 (s, 1H, OCH), 7,10 (d, 1H, пиридин Н), 8,16 (d, 1H, пиридин Н).
209 δ: 3,63-3,74 (t, 9H, OCH3), 5,48-5,81 (m, 4H, CHO, OH, COCH), 6,88-7,42 (m, 8H, фенил, пиримидин, пиридин), 7,94-7,97 (d, 1H, пиридин), 8,45-8,47 (d, 1H, пиридин), 9,24-9,26 (d, 1H, NH).
212 δ: 3,85 (s, 6H, OCH3), 4,41-4,52 (m, 2H, NCH2), 5,21-5,72 (d, s, 4H, NH2, OCH, OH), 6,61 (s, 1H, пиримидин), 7,12-7,32 (m, 3H, пиридин, бензилсульфон), 7,71-7,80 (m, 3H, пиридин, бензилсульфон), 8,3 (d, 1H, пиридин), 8,71 (m, 1H, NH).
213 δ: 3,61 (s, 6H, OCH3), 4,60-5,18 (m, 3H, ArCH2, OH), 5,72 (s, 1H, OCH), 6,72 (s, 1H, пиримидин), 7,15-7,17 (t, 5H, пиридин), 7,84-7,86 (d, 1H, пиридин), 8,38-8,44 (d, 2H, пиридин), 9,12 (s, 1H, NH)
214 δ: 3,75 (s, 6H, OCH3), 4,72-4,74 (d, 2H, NCH2), 5,84 (s, 1H, OCH), 6,86-6,96 (d, 3H, пиримидин, тиофенил), 7,14-7,16 (d, 1H, пиридин), 7,32-7,36 (d, 1H, пиридин), 7,94-7,97 (d, пиридин), 8,39-8,40 (d, 1H, пиридин), 8,71 (d, 1H, NH).
216 δ: 1,31 (t, 3H, CH3), 2,62 (s, 3H, CH3), 3,87 (s, 6H, OCH3), 4,21 (s, 2H, CH2), 4,40 (q, 2H, OCH2), 5,83 (s, 1H, пиримидин Н), 7,13 (d, 1H, пиридин Н), 8,44 (d, 1H, пиридин Н).
218 δ: 284 (3,08) (s, 3H, NCH3), 3,92 (s, 6H, OCH3), 4,50-5,03 (m, 2H, NCH2), 6,10 (s, 1H, пиримидин Н), 7,10-7,80 (m, 7H, ароматы Н).
227 δ: 1,50 (m, 6H, CH2), 2,40 (m, 6H, NCH2) 3,55 (q, 2H, NCH2), 3,80 (s, 6H, OCH3), 5,85 (s, 1H, пиримидин Н), 6,70 (s, 1H, OCH), 7,15-8,60 (m, 1H, 3 пиридин Н + NH).
233 δ: 1,80 (q, 2H, CH2), 2,25 (s, 6H, NCH3), 2,35 (q, 2H, NH2), 3,45 (q, 2H, NCH2), 3,80 (s, 6H, CH3), 5,80 (s, 1H, пиридин), 6,65 (s, 1H, OCH), 7,15-8,50 (m, 3H, пиридин).
234 δ: 1,00 (t, 6H, CH3), 2,60 (m, 6H, NCH2), 3,50 (q, 2H, NCH2), 3,92 (s, 6H, OCH3), 5,80 (s, 1H, пиримидин Н), 6,80 (s, 1H, OCH), 7,15-8,7 (m, 3H, пиридин).
236 δ: 1,37 (t, 3H, CH3), 2,56 (s, 3H, CH3), 3,87 (s, 6H, OCH3), 4,43 (q, 2H, OCH2), 5,87 (s, 1H, пиримидин Н), 6,12 (s, 1H, CHBr), 7,90 (d, 1H, пиридин Н), 8,56 (d, 1H, пиридин Н).
237 δ: 1,40 (t, 3H, CH3), 3,87 (s, 6H, OCH3), 4,43 (q, 2H, OCH2), 4,70 (s, 2H, CH2Br), 5,88 (s, 1H, пиримидин Н), 6,23 (s, 1H, CHBr), 8,07 (d, 1H, пиридин Н), 8,65 (d, 1H, пиридин Н).
238 δ: 1,37 (t, 3H, CH3), 2,06 (s, 3H, CH3), 3,88 (s, 6H, OCH3), 4,40 (q, 2H, OCH2), 5,28 (s, 2H, OCH2), 5,87 (s, 1H, пиримидин Н), 6,23 (s, 1H, CHBr), 8,04 (d, 1H, пиридин Н), 8,64 (d, 1H, пиридин Н).
257 δ: 3,82 (s, 6H, OCH3), 4,06 (s, 2H, NCH2), 5,05-5,10 (s, 1H, OH), 5,42-5,45 (s, 1H, NH), 5,87 (s, 1H, OCH), 6,76-6,86 (s, 1H, пиримидин), 7,32-7,38 (m, 6H, пиридин, ароматы), 7,94-7,98 (d, пиридин), 8,45-8,49 (d, 1H, пиридин), 9,55 (s, 1H, NH).
264 δ: 0,8-1,9 (brs, 25H, алифаты), 3,85-3,90 (s, 6H, 2XOMe), 6,15 (s, 1H, ArH, пиримидин), 7,4 (s, 2H, ArH).
277 δ: 0,90 (t, 3H, CH3), 1,2-1,7 (m, 4H, алифаты), 3,95 (s, 6H, OCH3), 4,08 (t, 2H, OCH2), 6,15 (s, 1H, пиримидин Н), 7,5-7,7 (m, 3H, ароматы).
281 δ: 0,90 (t, 3H, CH3), 1,3 (m, 4H, алифаты), 1,6 (m, 2H, алифаты), 3,95 (s, 6H, OCH3), 4,08 (t, 2H, OCH2), 6,15 (s, 1H, пиримидин Н), 7,4-7,7 (m, 3H, ароматы).
283 δ: 3,40 (s, 6H, OCH3), 3,43 (m, 2H, NCH2), 3,82 (s, 6H, OCH3), 4,47 (t, 1H, CH), 5,86 (s, 2H, OCH, OH), 6,77 (s, 1H, пиримидин), 7,41-7,43 (m, 1H, пиридин), 7,94-7,98 (d, 1H, пиридин), 8,47-8,48 (d, 1H, NH).
284 δ: 1,71-1,76 (s, 6H, CH3), 2,31 (s, 1H, C=CH), 3,82 (s, 6H, OCH3), 5,61-5,63 (d, 1H, OH), 5,85 (s, 1H, OCH), 6,86-6,96 (d, 1H, пиримидин), 7,44-7,48 (m, 1H, пиридин), 7,94-7,98 (d, 1H, пиридин), 8,44-8,45 (d, 2H, NH).
285 δ: 0,75-1,13 (m, 4H, алифаты), 1,28-1,77 (m, 3H, алифаты), 3,23-3,52 (m, 2H, NCH2), 3,82 (s, 6H, OCH3), 5,73-5,88 (m, 2H, OH, OCH), 6,60-6,81 (d, 1H, пиримидин), 7,21-7,45 (q, 1H, пиридин), 7,78-8,01 (d, 1H, пиридин), 8,32-8,55 (d, 2H, пиридин, NH).
286 δ: 1,21-1,32 (d, 2H, CH2O), 3,38-3,58 (d, 6H, CH3), 3,85 (s, 6H, OCH3), 4,18-4,48 (m, 2H, NCH, OH), 5,88 (s, 1H, OCH), 6,73 (s, 1H, пиримидин), 7,28-7,52 (q, 1H, пиридин), 7,81-8,08 (d, 1H, пиридин), 8,43-8,62 (d, 2H, пиридин, NH).
290 δ: 3,74 (s, 9H, OCH3), 5,44 (bs, 1H, OH), 5,73 (s, 1H, пиримидин), 6,62 (bs, 1H, OCH), 6,9-8,6 (m, ароматы, 7H), 10,22 (s, 1H, NH).
291 δ: 1,40 (m, 8H, CH2), 2,28 (s, 6H, NCH3), 2,68 (m, 2H, NCH2), 3,40 (m, 2H, NCH2), 3,80 (s, 6H, OCH3), 5,80 (s, 1H, пиримидин), 6,70 (s, 1H, OCH), 7,2-8,6 (m, 4H, пиридин Н + ОН).
292 δ: 1,60 (m, 4H, CH2), 2,25 (s,6H, NCH3), 2,25 (m, 2H, NCH2), 3,48 (m, 2H, NCH2), 3,65 (s, 6H, OCH3), 5,80 (s, 1H, пиримидин), 6,65 (s, 1H, OCH), 7,2-8,6 (m, 4H, пиридин +ОН).
295 δ: 3,74 (s, 6H, OCH3), 3,80 (s, 6H, OCH3), 4,50 (d, 2H, NCH2), 5,84 (s, 1H, пиримидин), 6,5-8,6 (m, 8H, ароматы, OCH, NH).
297 δ: 3,65 (s, 6H, OCH3), 3,77 (s, 6H, OCH3), 4,50 (d, 2H, NCH2), 5,64 (d, 1H, OH), 5,80 (s, 1H, пиримидин), 6,25-6,60 (m, 3H, ароматы), 6,8 (d, 1H, OCH), 7,2-8,6 (m, 3H, пиридин).
298 δ: 3,82 (s, 6H, OCH3), 5,81 (s, 1H, OCH), 6,29-7,58 (m, 8H, OH, NH, пиримидин, ароматы, пиридин) 7,80-8,25 (d, 1H, пиридин), 8,47-8,62 (d, 1H, пиридин), 9,74-9,93 (br, 1H, NH).
299 δ: 0,85 (t, 3H, CH3), 1,2 (m, 8H, алифаты), 1,6 (m, 2H, алифаты), 3,95 (s, 6H, OCH3), 4,08 (t, 2H, OCH2), 6,15 (s, 1H, пиримидин Н), 7,4-7,7 (m, 3H, ароматы).
300 δ: 0,90 (t. 3H, CH3), 1,2 (m, 10H, алифаты), 1,6 (m, 2H, алифаты), 3,95 (s, 6H, OCH3), 4,08 (t, 2H, OCH3), 4,08 (t, 2H, OCH2), 6,15 (s, 1H, пиримидин Н), 7,4-7,7 (m, 3H, ароматы).
303 δ: 3,80 (s, 6H, OCH3), 3,90 (d, 6H, OCH3), 5,45 (d, 1H, OH), 5,80 (s, 1H, пиримидин), 6,85 (s, 1H, OCH), 7,0-8,6 (m, 6H, ароматы), 10,2 (s, 1H, NH).
305L(-) δ: 1,60 (d, 3H, CH3), 3,75 (2s, 6H, OCH3), 5,25 (m, 1H, OH), 5,75 (s, 1H, пиримидин), 6,75 (d, 1H, OCH), 7,2-8,6 (m, 8H, ароматы).
308 δ: 0,88 (t, 3H, CH3), 1,25 (bs, 17H, алифаты), 1,6 (m, 2H, алифаты), 3,95 (s, 6H, OCH3), 4,07 (t, 2H, O-CH2), 6,15 (s, 1H, пиримидин Н), 7,55-7,7 (m, 3H, ароматы).
330 δ: 1,05 (m, 6H, NCH2CH3), 1,27 (s, 9H, C(CH3)2), 2,3 (m, 4H, NCH2), 3,8 (s, 6H, OCH3), 5,8 (s, 1H, пиримидин Н), 5,9 (s, 1H, CH-Ot-Bu), 7,18 (d от d, 1H, пиридин Н), 7,45 (d от d, 1H, пиридин Н), 8,6 (d от d, 1H, пиридин Н).
407 δ: 3,18 (m, 2H, CH2S), 3,65 (m, 2H, CH2N), 3,95 (s, 6H, OCH3), 5,85 (s, 1H, пиримидин), 6,80 (s, 1H, OCH), 7,0-8,7 (m, 8H, ароматы).
411 δ: 1,90 (t, 3H, CH3), 1,55 (m, 4H, CH2), 2,65 (m, 4H, CH2), 3,62 (m, 2H, CH2N), 3,82 (s, 6H, CH3O), 5,90 (s, 1H, пиримидин), 6,75 (s, OCH), 7,2-8,65 (m, 3H, пиридин).
412 δ: 1,37 (s, 9H, tBuO), 3,30 (s, 3H, CH3N), 3,90 (s, 6H, CH3), 5,95 (s, 1H, пиримидин), 5,97 (s, 1H, OCH), 6,5-7,6 (m, 10H, ароматы).
413 δ: 2,23 (s, 1H, C=CH), 3,12-3,23 (d, 3H, N-CH3), 3,93 (s, 8H, OCH3, N-CH2C= ), 6,155 (s, 1H, пиримидин), 7,47-7,52 (m, 1H, пиридин), 8,142-8,168 (m, 1H, пиридин), 8,69-8,709 (t, 1H, пиридин).
П р и м е р 27. Способ по варианту I(i).
Получение амида 3-[(4,6-диметокси-2-пирилендинил)-гидроксиметил]-N-метил-2-пиридин карбоновой кислоты (соединение 108, табл.6).
Схема реакции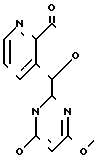


(соединение 40/ табл.3) Амид 3-[(4,6-диметокси-2- 5-(4/6-диметокси-2-пиримидил)- пирилендинил)-гидроксиметил] фуро-[3/4-в]-пиридил-7(5Н)-он -N-метил-2-пиридин
C13H11N3O4 карбоновой кислоты
273,25 C14H16N4O4
304,31
Bыход: 99/0%
Исходные вещества:
30 г (109/8 ммоль) 5-(4/6-диметокси-2-пиримидил)-
фуро-[3/4-в]-пиридил-7(5Н)-он
7/2 г (231/8 ммоль) Метиламин/ газ
300 мл Метанол
Трехгорлая колба (500 мл) снабжена трубкой для ввода газа, опущенной ниже уровня растворителя, магнитной мешалкой, карманом для термометра и трубкой для вывода газа (игловой вентиль). Обратную ловушку размещают между газовым баллоном с метиламином и газоподводящей трубкой. Колбу высушивают при 140оС в атмосфере азота, охлаждают до комнатной температуры и загружают метанолом (300 мл), высушенным над молекулярными ситами 4 . Метиламин газ (7,2 г, 231,8 ммоль) барботируют в течение 10 мин при 10оС (водоледяная баня); 5-(4,6-диметокси-2-пиримидинил)фуро[3,4-b] -пиридин-7(5Н)-он (30 г, 109,8 ммоль) добавляют одной порцией и смесь перемешивают при комнатной температуре 14 ч.
. Метиламин газ (7,2 г, 231,8 ммоль) барботируют в течение 10 мин при 10оС (водоледяная баня); 5-(4,6-диметокси-2-пиримидинил)фуро[3,4-b] -пиридин-7(5Н)-он (30 г, 109,8 ммоль) добавляют одной порцией и смесь перемешивают при комнатной температуре 14 ч.
Реакционная смесь изменялась от красной суспензии до гомогенного оранжевого раствора. За реакцией можно следить по тонкослойной хроматографии на пластинке с силикагелем с использованием 100% этилацетата (Rf 0,6 до 5, 0,50 до 8) или по газовой хроматографии DB-5 капиллярная колонка 40 _→ 300оС (15оС) мин).
Реакционную смесь при отсасывании фильтруют для удаления нерастворимых частиц и фильтрат упаривают на роторном испарителе до объема 50 мл. Охлаждающуюся суспензию охлаждают до  10оС (водоледяная баня) и при отсасывании фильтруют для отделения осадка продукта (31,5 г). Фильтрат выпаривают до сухого состояния и концентрат (2 г) кристаллизуют из 10 мл метанола с получением 1,8 г продукта. Общий выход продукта 33,3 г (99,6%), т.пл. 132-133оС.
10оС (водоледяная баня) и при отсасывании фильтруют для отделения осадка продукта (31,5 г). Фильтрат выпаривают до сухого состояния и концентрат (2 г) кристаллизуют из 10 мл метанола с получением 1,8 г продукта. Общий выход продукта 33,3 г (99,6%), т.пл. 132-133оС.
1Н-ЯМР (CDCl3) δ: 8,70-7,30 (м, 3Н, пиридин), 6,85 (g, 1Н, ОСН), 5,85 (с, 1Н, пиримидин), 5,75 (g, 1Н, ОН), 3,85 (с, 6Н, ОСН3), 3,00 (g, 3Н, NCH3).
П р и м е р 28. Способ по варианту 1(j).
Получение 4,7-дихлор-3-(4,6-диметокси-2-пиримидинил)-3-гексаноилокси-фталида (соединение 265, табл.2).
Схема реакции


(соединение 250, табл.2). 4,7-Дихлор-3-(4,6-диметокси-2-
4,7-Дихлор-3-(4,6-диметокси-2- пиримидинил)-3-гексаноилоксифталид
пиримидинил)-3-гидроксифталид
C14H10Cl2N2O5 C20H20Cl2N2O6
357,15 455,30
Выход: 75%
Исходные вещества:
52 г (159,6 ммоль) 4,7-Дихлор-3-(4,6-диметокси-2-
пиримидинил)-3-гидроксифталид
35,2 г (164,25 ммоль) Гексановый ангидрид
23,0 мл (165 ммоль) Триэтиламин
1,1 г (9,0 ммоль) 4-диметиламинопиридин (ДМАП)
500 мл Дихлорметан
В однолитровую круглодонную колбу, снабженную магнитной мешалкой, загружают 500 мл дихлорметана и 52 г (159,6 ммоль) гидроксифталида и охлаждают на ледяной бане. Добавляют триэтиламин (23 ммоль) и ДМАП (1,1 г) и смесь перемешивают до тех пор, пока большая часть твердого продукта не растворится. Свежеперегнанный гексановый ангидрид (35,2 г, 164,25 ммоль) добавляют в одну порцию и смесь перемешивают в атмосфере азота 48 ч при комнатной температуре. Раствор затем промывают 2х100 мл 1 н. H2SO4, 1х100 мл 0,1 н. NaOH и соленой водой, высушивают над Na2SO4 и выпаривают с получением 58,2 г сырого продукта (94,3% чистоты по ГХ). Твердый продукт перетирают с 150 мл Еt2O и собирают при отсасывании фильтрат с получением 49,2 г продукта. Фильтрат выпаривают и очищают флэшхроматографией над 140 г SiO2, элюент 30% ЕtOA C/гексан, собирая 50 мл фракции. Фракции 3-12 включительно собирают, получая 6,5 г сырого продукта, который перекристаллизовывают из 10 мл ЕtOAC/100 мл гексана с получением еще 5,7 г чистого продукта. Общий выход 54,67 г, т.пл. 103-105оС (чистота 95,4%).
ЯМР (ацетон-d6)δ: 0,86-0,91 (m, 3H, CH2CH3), 1,31-1,39 (m, 4H, -CH2CH2CH3), 2,5-2,6 (m, 2H, COCH2), 3,87 (c, 6H, -OCH3), 6,15 (c, 1H, пиримидинил Н), 7,75 (g, 1H, J 8,5 Гц, ArH), 7,80 (g, 1H, J 8,5 Гц, ArH).
П р и м е р 29. Способ по варианту 1 (k).
Получение амида 3-[(4,6-диметокси-2-пиримидинил)-карбонил] -N,N-диметил-2- пиридин карбоновой кислоты (соединение 385, табл.6).
Схема реакции
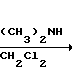

(соединение 68/ табл.3) Амид 3-[(4,6-диметокси-2-пиримидинил)
5-Хлор-5-(4/6-диметокси-2- -карбонил]-N,N-диметил-2-
пиримидинил)-фуро-[3/4-6] пиридинкарбоновой кислоты
пиридин-7(5Н)-он
С13H10ClN3O3 C15H16N4O4
Выход: 98/4%
Исходные вещества:
36 (117 ммоль) 5-Хлор-5-(4/6-диметокси-2-
пиримидинил)-фуро-[3/4-6]
пиридин-7(5Н)-он
15/8 г (351 ммоль) Диметиламин/ газ
350 мл Дихлорметан
Трехгорлая колба (500 мл) снабжена механической мешалкой, трубкой для ввода газа, опущенной ниже уровня растворителя, приемником для термометра и выводом газа (игольчатый вентиль) (реакционную колбу высушивают в собранном состоянии в атмосфере азота с использованием теплового насоса).
Через перемешиваемый раствор 36 г (116,99 ммоль) 5-хлор-5-(4,6-диметокси-2-пиримидинил)фуро[3,4-b] -пиридин-7(5Н)- она в дихлорметане (350 мл), охлажденный на водяной бане, пропускают безводный газообразный диметиламин (15,8 г, 351 ммоль) (обратную ловушку помещают между баллоном с газообразным диметиламином и газовводной трубкой). Удаляют водоледяную баню и раствор перемешивают при комнатной температуре в течение ночи. Реакционную смесь промывают насыщенным солевым раствором (3х50 мл), пропускают через фазоразделяющий бумажный фильтр и фильтрат выпаривают на роторном испарителе. Концентрат растворяют в дихлорметане (200 мл), обрабатывают активированным углем при комнатной температуре в течение часа при отсасывании фильтруют через фильтрующий материал. Фильтрат упаривают до объема 50 мл на роторном испарителе, разбавляют гексаном с получением непрозрачного раствора, обрабатывают 1 ч при 35оС и оставляют кристаллизоваться в течение ночи при комнатной температуре. Выпавший твердый продукт при отсасывании фильтруют и выделяют 31,15 г продукта, т.пл. 124-126оС. Фильтрат упаривают (2,35 г масла) и флэшхроматографируют через 300 г силикагеля 230-400 меш с использованием 1 л этилацетата, 500 мл 90/10 об/об этилацетат/метанол, 1 л 80/20 об/об ацетон/метанол в качестве элюирующего растворителя с получением 40х50 мл фракций. Из 18-22 фракций получают 1,32 г продукта. Получают продукт с общим весом 36,42 г (98,4% выход), т.пл. 124-126оС.
1Н-ЯМР (CDCl3) δ: 8,70 (gg, J 1,4; 4,9 Гц, 1Н, ArH); 8,18 (gg, J 1,4, 7,9 Гц, 1Н, ArH), 7,44 (gg, J 4,9, 7,9 Гц, 1Н, ArH), 6,16 (с, 1Н, пиримидин), 3,95 (с, 6Н, OСH3), 3,12 (с, 3Н, NCH3), 2,96 (c, 3H, NCH3).
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЛИ АММОНИЯ | 1992 |
|
RU2106346C1 |
| ПРОИЗВОДНЫЕ 3,5-ДИОКСО- 3,4,5,6- ТЕТРАГИДРООКСАЗИНОВ И СПОСОБ БОРЬБЫ С СОРНЯКАМИ | 1991 |
|
RU2013956C1 |
| НОВЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ФАРМАЦЕВТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ | 1996 |
|
RU2173316C2 |
| ИНГИБИТОРЫ ТРОМБИНА И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ | 1995 |
|
RU2172741C2 |
| ПРОИЗВОДНЫЕ РАПАМИЦИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2143434C1 |
| НОВЫЕ СПОСОБЫ ПОЛУЧЕНИЯ 2Н-ХРОМЕНА | 2006 |
|
RU2397980C2 |
| ПРОИЗВОДНЫЕ 1,3-ДИОКСОИНДЕНА, ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ АНТИВИРУСНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ИХ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2012 |
|
RU2566761C2 |
| АМИДЫ КОНДЕНСИРОВАННОГО ПИПЕРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ ИОННЫХ КАНАЛОВ | 2014 |
|
RU2741810C2 |
| ПРОИЗВОДНЫЕ ГИДРОКСАМОВОЙ КИСЛОТЫ И ИХ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 1989 |
|
RU2093508C1 |
| ФТОРСОДЕРЖАЩИЕ ЛИГАНДЫ ДЛЯ НАЦЕЛИВАНИЯ ПЕРИФЕРИЧЕСКИХ БЕНЗОДИАЗЕПИНОВЫХ РЕЦЕПТОРОВ | 2007 |
|
RU2468014C2 |

































Использование: в химии гетероциклических веществ, в частности в способе получения замещенных фталимидов или гетероциклических фталимидов. Сущность изобретения: продукт замещенные фталимиды или гетероциклические фталимиды общей ф-лы I. Условия реакции: синтез ведут реакцией соединения ф-лы II с соединением ф-лы III с получением соединения ф-лы IV, которое затем либо гидролизуют, либо обрабатывают амином или алкоголятом щелочного металла, либо этерифицируют, либо галогенируют, либо проводят раскрытие кольца в соединении ф-лы IV. Формулы I, II, III, IV (см.чертеж). 1 ил. 7 табл.
СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ ФТАЛИДОВ ИЛИ ГЕТЕРОЦИКЛИЧЕСКИХ ФТАЛИДОВ общей формулы
где кольцо А выбрано из группы, включающей остатки: фенил, пиридил, пятичленное гетероароматическое кольцо, включающее кислород, серу или азот в качестве гетероатома;
R цианогруппа, карбоксильная группа, которая может быть в виде свободной кислоты, или эфира, или соли, карбамоильная группа, или моно-, или дизамещенная карбамоильная группа, или кольцо
Y1, Y2 и Y3 присоединены к атомам углерода и являются независимо водородом, галогеном, гидроксилом, C1-C8-алкилом, C2-C8-алкенилом, C1-C8-алкокси, C2-C8-алкенилокси, C2-C8-алкинилокси, C1-C8-алкилсульфонилокси, каждый из которых, в свою очередь, может быть замещен 1 6 атомами галогена, а также коньюгированный C1-C8-алкоксил, C2-C8-ацил, фенил, C1-C8-алкоксил, фенилтио, каждый из которых может быть замещен одним или тремя атомами галогена;
Y1 и Y2 вместе взятые со смежными атомами углерода образуют группу -C(O)-O-CH2;
W1, W2, W3, W4 и W5 каждый независимо CH, CR3 или N;
Z мостик, состоящий из элементов, выбранных из группы: метилен, замещенный метилен, -C(O)-;
R1 и R3 каждый независимо водород, галоген, C1-C8-алкил, C1-C8-алкокси, C2-C8-алкенилокси, C2-C8-алкинилокси, каждый из которых может быть, в свою очередь, замещен 1 6 галогенатомами, 5- или 6-членный гетероцикло -C1-C8-алкокси, фенилокси или фенил -C1-C8-алкокси, каждый из которых может быть замещен 1 3 заместителями, выбранными из галогена или C1-C8-алкила;
R2 C1-C8-алкил, фенил -C1-C8-алкокси или фенил;
X и Y каждый независимо водород, гидроксил, галоген, циано, C1-C8-алкил, C1-C8-алкокси, C1-C8-алкоксикарбонилокси, C2-C8-ацилокси, карбамоилокси, C1-C8-алкилтио, фенилокси, фенил S, каждый из которых, в свою очередь, может быть замещен 1 3 атомами галогена или они вместе представляютO,S,NH,NOR12 или CR13R17, или X и R вместе могут образовать мостик, имеющий формулу -C(O)-O- или -C(O)-NR2-, где карбонил присоединен к А,
при условии, что, когда R карбоксил в свободном эфире или соли и X и Y вместе являются 0, то одно из колец А и В содержит гетероатом,
отличающийся тем, что:
a) когда X и R сочетаются с образованием мостиковой группы, как указано выше, и Y является водородом, циано или арилтио, осуществляют реакцию соединения общей формулы II
где кольцо A, Y1, Y2 и Y3 имеют указанные значения;
Y водород, циано или арилтио;
Z1 кислород, сера или NR2,где R2 имеет указанные значения,
с соединением общей формулы III
где W1, W2, W3, W4 и R1 имеют указанные значения;
R21 метилсульфонил или галоген,
для получения соответствующего соединения формулы Ip
b) обрабатывают соединение формулы Ip, где Y′ циано или арилсульфонил и Z1 кислород, а другие символы имеют указанные значения,
(I) путем гидролиза для получения соответствующего соединения формулы I, где R и X образуют мостик и Y гидроксил, или соединение формулы I, где X и Y вместе образуют 0;
(II) обрабатывают амином с получением соответствующего соединения формулы I, где R является, возможно, замещенной карбамоильной группой, а X и Y вместе образуют 0;
(III) соединением MOR22, где M щелочной металл, а R22 водород или C1-C8- алкил,
с получением соответствующего соединения, где R и X образуют мостик, а Y гидроксил или C1-C3-алкоксил, или
c) осуществляют гидролиз соединения формулы Ip, где Y водород, Z1 кислород и другие символы имеют указанные значения, для получения соединения формулы I, где R -карбоксильная группа, возможно, в виде соли, X водород и Y гидрокси, с последующим, в случае необходимости, переводом его в соль, или
d) раскрывают кольца в соединении формулы Ip, где Y гидроксил, Z1 кислород и другие символы имеют указанные значения, с получением соединения формулы I, где R карбоксильная группа, возможно, в виде соли, а X и Y вместе образуют 0;
e) этерифицируют соединение формулы I, где R карбоксильная группа, возможно, в виде соли, X и Y 0 другие символы имеют указанные значения, с получением соответствующего соединения формулы I, где R карбоксильная группа в виде эфира;
f) галогенируют соединение формулы Ip где Y гидроксил, Z1 имеет значения в части a), другие символы имеют указанные значения с получением соединения формулы I, где X и R вместе образуют мостиковую группу, а Y′ - галоген;
g) осуществляют реакцию соединения формулы Ip, где Z1 кислород, Y′ галоген, другие символы имеют указанные значения, с соединением RNH2 и HOR23, где R2 имеет указанные значения, а R23 C1-C8-алкил, C2-C8-ацил или арил, с получением соответствующего соединения, где Z1 NR2 и Y′ - C1-C8-алкокси, арилокси или C2-C8-ацилокси;
h) осуществляют окисление соединения формулы Ip, где Y водород, Y1 имеет значения в части a), другие символы имеют указанные значения, с получением соответствующего соединения, где Y гидроксил;
i) осуществляют взаимодействие соединения Ip, где Z1 кислород, Y′ водород, другие символы имеют указанные значения, с группой R7NH2, где R7 -C1-C6-алкил, с получением соединения формулы I, где R монозамещенный карбамоил, X водород, Y - гидроксил;
j) ацилируют соединение формулы Ip, где Z1 кислород, Y′ - гидроксил, другие символы имеют указанные значения, с получением соединения формулы I, где R и X образуют -C(O)-O-мостик и Y C2-C8-ацилокси;
k) осуществляют реакцию соединения формулы Ip, где Z1 кислород, Y′ галоген, другие символы имеют указанные значения с соединением R7R8NH, где R7 имеет значения в части i), R8= R7 с получением соединения I, где R карбамоил, дизамещенный низшим алкилом, а X и Y вместе представляют 0,
с последующим выделением целевого продукта.
| Европейский патент N 0249707, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-07-25—Публикация
1991-06-05—Подача